新化合物和腎細胞癌的治療的制作方法
本公開涉及腎細胞癌的治療領域。
背景技術:
1、透明細胞腎細胞癌(ccrcc)是腎細胞癌(rcc)最常見的組織學亞型,占所有rcc病例的70%[1]。手術(根治性或部分腎切除術)是具有局部腫瘤的患者的標準主要治療方法。具有腎切除術后復發或晚期腫瘤的患者的一線和二線靶向治療選擇包括酪氨酸激酶抑制劑(阿昔替尼(axitinib)、索拉非尼(sorafenib)、帕唑帕尼(pazopanib)和舒尼替尼(sunitinib)等)、mtor抑制劑(依維莫司(everolimus)和坦羅莫司(tesirolimus))以及針對vegf、pd-1或pd-l1的單克隆抗體(貝伐珠單抗(bevacizumab)、帕博利珠單抗(pembrolizumab)和阿維單抗(avelumab)等)。然而,據美國國家綜合癌癥網絡(nccn,版本:1.2022)報告,在不同臨床試驗中,基于這些藥物的單藥或聯合方案的應答率為6%至50%[2]。而且,這些藥物的平均疾病控制時間用于一線環境時僅為8-9個月,用于二線環境時為5-6個月[3]。因此,需要發現耐受性更好且更有效的藥物,以擴大用于ccrcc患者的單藥或聯合方案的選擇范圍。
技術實現思路
1、基于系統生物學方法的計算藥物重定位已成為鑒定潛在藥物-靶標相互作用和藥物-疾病相互作用的有力工具[4]。藥物重定位的優勢在于重定位藥物的藥理學和安全性已得到很好的表征,大大降低了傳統藥物開發的成本和時間,并降低了臨床階段的流失風險[5,6]。一般而言,目前的藥物重定位策略可分為基于藥物、基于疾病和基于譜[7]。通常,基于藥物和基于疾病的方法是通過比較藥物-藥物或疾病-疾病的相似性或應用現有的藥物治療知識來預測新的疾病-藥物關聯來進行的[8,9]。相比之下,基于譜的方法是通過分析與疾病和藥物相關的高通量多組學數據來進行的,其不依賴于對特定藥物或疾病的先驗知識,并且提高了發現新藥物-疾病對的能力[7]。
2、最近,多項研究已經采用了基于譜的重定位方法來鑒定對治療ccrcc有潛在價值的藥物。一種廣泛使用的方法是選擇對疾病特征基因有相反作用的藥物[10,11]。這種方法的理念是,如果藥物引起的基因表達擾動(藥物擾動特征)與腫瘤組織與正常組織相比的失調(疾病特異性特征)呈負相關,則該藥物對這種腫瘤類型具有治療價值。在應用上述方法的過程中,connectivitymap(cmap)[12]是最常用的藥物擾動基因表達數據源,其最近已更新并整合到lincs數據門戶[13]中。迄今為止,lincs數據門戶已包括與超過20,000種藥物、多達超過200個細胞系中的基因過表達和敲減相關的超過300萬個基因表達譜[13]。然而,據說以這種方式重新利用的藥物具有由癌基因和乘客基因混合而成的多種基因靶標,這限制了對藥物作用的關鍵靶標和機制的鑒定和驗證。
3、通過從靶標預測開始,然后將靶基因的現有抑制劑重新用于癌癥治療,已經避免了這個問題。在之前的研究中,通過基因組規模的代謝模型分析鑒定了對ccrcc腫瘤細胞生長至關重要的候選靶基因列表[14]。在這些必需基因中,通過對每個必需基因進行計算機毒性測試,篩選出在32種主要正常人體組織中的其抑制是沒有毒性的三個基因soat1、crls1和acacb,作為最終的可靶向基因。最后,soat1的一種眾所周知的抑制劑米托坦(mitotane)被重新利用,并驗證了其用于治療ccrcc的藥物療效。然而,這項研究的一個局限性是需要系統的藥物重定位方法來發現更多可能抑制soat1的潛在有效藥物。此外,候選靶基因列表需要擴展,并且這種擴展不應僅限于代謝重要性基因,其僅覆蓋人類基因組的約20-25%(如人類代謝模型[15]中所報道的),還應包括非代謝性基因。因此,應用所有可能的人類基因的基因共表達網絡(gcn)分析已用于鑒定關鍵基因、其鄰居和功能相關的生物學功能[5,16]。
4、在本公開的研究中,應用了涉及疾病-靶標預測和藥物-靶標預測的綜合策略。第一,提取了一組穩健的ccrcc特征基因,其表達與患者的生存結果顯著相關。功能富集分析表明,這些基因在細胞分裂、細胞周期、dna復制、血管生成、細胞遷移和細胞分化途徑中顯著富集,所有這些都是癌癥中眾所周知的標志[17]。第二,基于對ccrcc組織的轉錄組數據的gcn分析,鑒定出兩種顯著富集不利和有利特征的分子模塊。第三,提取出在模塊中表現出高中心性的四個靶基因,即bub1b、rrm2、asf1b和ccnb2。接下來,基于對來自lincs數據門戶的shrna擾動和藥物擾動轉錄組學數據的分析開發了一種藥物重定位方法,并重新利用了針對每個靶標的三種最有效的藥物。最后,在caki-1細胞中測試了藥物效果。在這些測試中,藥物tg-101209被證明是有效的。
5、接下來,本發明人意識到可以調整tg-101209的分子結構,以找到對ccrcc具有相似或更好效果的替代小分子。
6、因此,根據第一方面,提供了根據式(i)的化合物
7、
8、或其藥學上可接受的鹽或前藥,其中:
9、r1選自
10、
11、r2為
12、z為–h、–ome或–so2-nh2;
13、x為–h、–me、–nhc(o)–ar或–c(o)nh-ar,其中–ar為任選取代的芳基;并且
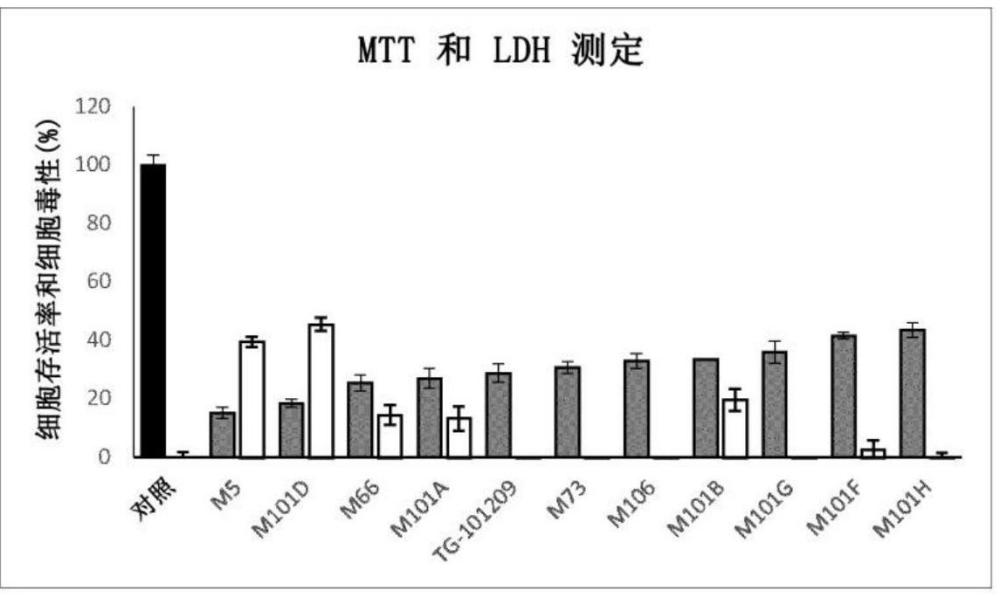
14、y為–h、–ome或前提是所述化合物不是tg-1012099。
15、根據式(i)的化合物對腎細胞癌細胞表現出細胞毒性并降低所處理細胞的細胞存活率。因此,本發明的化合物適用于治療腎細胞癌,諸如透明細胞腎細胞癌(ccrcc)
16、在一個實施方式中,y和z為–h,x為–c(o)nh-ar或–nhc(o)-ar,優選為–c(o)nh-ar,并且任選取代的芳基–ar具有一個或兩個環。任選取代的芳基–ar可以選自由任選取代的芐基、萘基、喹啉基、吲哚基和嘌呤基組成的組。
17、在一個實施方式中,–ar選自:
18、該實施方式包括實施例部分中的化合物m101a、m101b、m101d、m101f、m101g和m101h,并且使用該實施方式中的化合物處理與特別低的細胞存活率相關。
19、在一個實施方式中,–ar為該實施方式包括實施例部分中的化合物m101d,并且使用該實施方式中的化合物處理細胞與特別低的細胞存活率相關。
20、在一個實施方式中,x為–me,y為–h并且z為–so2nh2。該實施方式包括實施例部分中的化合物m66,并且使用該實施方式中的化合物處理細胞與特別低的細胞存活率和bub1b表達水平的降低相關。
21、在一個實施方式中,r2為優選地r2為該實施方式包括實施例部分中的化合物m5、m7、m79和m88,并且使用該實施方式的化合物處理細胞與特別低的細胞存活率和bub1b表達水平的降低相關。
22、在一個實施方式中,r1為在該實施方式中,z優選為–h或–so2-nh2和/或y優選為–h或該實施方式包括實施例部分中的化合物m5,并且使用該實施方式中的化合物處理細胞與特別低的細胞存活率和bub1b表達水平的降低相關。
23、在另一個實施方式中,r1為該實施方式包括實施例部分中的化合物m66、m79、m88、m101a、m101b、m101d、m101f、m101g和m101h,并且使用該實施方式的化合物處理細胞與顯著降低的細胞存活率相關。
24、在一個實施方式中,r1為該實施方式包括實施例部分中的化合物m7,并且使用該實施方式的化合物處理細胞與降低的細胞存活率相關。
25、在一個實施方式中,本發明不包括式(ii)或(iii)的化合物:
26、
27、用這些化合物處理的細胞表現出降低的細胞存活率。然而,其他化合物表現出更大的效果,因此更優選。
28、因此,當z和y均為-ome時,r1優選為
29、在第一方面的優選實施方式中,化合物為m5、m66、m101a、m101b或m101d或其藥學上可接受的鹽或前藥。m5、m66、m101a、m101b和m101d的結構在下文公開,例如在表1中。
30、在第一方面的特別優選實施方式中,化合物為m5或m101d或其藥學上可接受的鹽或前藥。
31、根據第二方面,提供了包括根據第一方面的化合物的藥物組合物。
32、根據第三方面,提供了包括化合物tg-101209的根據第一或第二方面的化合物或藥物組合物用于治療腎細胞癌諸如透明細胞腎細胞癌(ccrcc)的用途。ccrcc可以是i-iii期ccrcc,優選是i期或ii期ccrcc。
33、因此,化合物tg-101209被排除在第一和第二方面的范圍之外,但不被排除在第三方面的范圍之外。
34、在一個實施方式中,治療方法還包括給藥選自由酪氨酸激酶抑制劑(例如阿昔替尼、索拉非尼、帕唑帕尼和舒尼替尼)、mtor抑制劑(例如依維莫司和坦羅莫司)、抗vegf單克隆抗體(例如貝伐珠單抗)組成的組中的藥物。這些藥物與根據第一或第二方面的化合物或藥物組合物一起給藥可以對ccrcc的治療具有協同作用。
35、在另一實施方式中,治療方法還包括給藥:
36、i)帕比司他;和/或
37、ii)nvp-tae684或醉茄素-a。
38、該實施方式的組合預計具有協同作用(如下文進一步討論)。
- 還沒有人留言評論。精彩留言會獲得點贊!