一種雙模式靶向成像功能納米復合材料的制備和應用的制作方法
本發明屬于多功能納米生物醫藥材料領域,具體涉及一種具有核磁共振和熒光雙模式靶向成像和光熱轉換功能的納米復合材料的制備方法和應用。
背景技術:
具備多重模式結合、高效特異性主動靶向的生物探針能夠集成靶向識別、超靈敏檢測和高效治療于一體,為腫瘤的早期診斷和治療帶來了新的契機,具有重要的生物醫學應用價值。目前,核磁共振成像和光學成像是最具發展潛力的診斷方式。光學成像是目前發展起來的新興研究領域。其突出特點是非侵入性地對活體內參與生理和病理過程的分子事件進行可視化觀察,是目前公認的開展活體內分子事件研究的主流手段之一,在生命科學研究領域具有重大應用前景。但光學成像同時也具有分辨率低、背景干擾大、清晰度不高等缺點。另外一種成像模式核磁共振成像在影像的采集過程中可以自由選擇,它對于體內的部位幾乎都可以進行掃描,甚至可以做到只針對某些組織區域顯像,這個優勢對于癌細胞的早期發現和診療是有益的。更重要的是核磁共振成像具有高靈敏性、高分辨率和無電離輻射等優點,能夠彌補光學成像的不足,是目前臨床上精確監控組織病變的一種無創三維立體成像模式。若將二者進行有效地結合,將對癌癥的診斷和治療具有非常重要的意義。
超順磁性的過渡金屬氧化物是一種重要的核磁共振成像造影劑,在外磁場存在的情況下能夠表現極大的磁敏感性,通過縮短t2弛豫時間使得t2加權圖像變暗,表現出負增強效果,可有效提高mri成像的對比度。
目前,基于fe3o4納米顆粒與au組裝形成核殼納米結構主要依賴于種子介導法,在此過程中,帶有大量負電荷的金納米球通過靜電作用吸附于納米顆粒表面并生長為完整金殼。但由于靜電作用不穩定,被吸附的金納米球易脫落,導致金殼的制備過程重復性不好。因此提高復合納米材料的核磁共振造影效果、可控調節其近紅外吸收峰、增強特異性識別能力、提高分散性和可重復性等仍然是其在腫瘤診療應用中亟需解決的難題。
技術實現要素:
本發明的目的是提供一種新型的具有核磁共振和熒光雙模式靶向成像和光熱轉換功能的納米復合材料。
為實現上述目的,本發明采用技術方案為:
一種雙模式靶向成像和光熱轉換功能的納米復合材料,納米復合材料為核殼型結構;其中,內核為具有強磁敏感性的超順磁性fe3o4納米顆粒與摻雜熒光分子的sio2層組裝形成復合納米核,外殼為具有較強的光熱轉換能力的偶聯特異性配體的金納米粒子靶向探針。
所述具有較強的光熱轉換能力的偶聯特異性配體的金納米粒子靶向探針為能夠特異性識別腫瘤細胞的多肽配體。
所述具有較強的光熱轉換能力的金納米粒子偶聯特異性配體的探針為融合pviii蛋白。
一種雙模式靶向成像和光熱轉換功能的納米復合材料的制備方法,
1)復合納米粒子:將溶劑熱法合成的fe3o4納米顆粒分散于0.1m鹽酸中,超聲處理、離心,洗滌得沉淀,沉淀再溶于去離子水中,超聲分散;加入無水乙醇并混勻,隨后在攪拌條件下加入正硅酸乙酯,條件保持弱堿性,室溫下攪拌均勻,而后加入活化的熒光分子,繼續攪拌、經離心,洗滌,干燥,制得復合納米粒子fe3o4@rhb/sio2;
2)復合材料進行巰基化:將上述獲得fe3o4@rhb/sio2納米顆粒的溶液中逐滴加入3-巰丙基三甲氧基硅烷,室溫下攪拌混合均勻;
3)納米金連接:將納米金溶液與上述表面巰基功能化的fe3o4@rhb/sio2納米顆粒混勻,超聲振蕩,然后室溫靜置;利用磁鐵將偶聯有納米金的fe3o4@rhb/sio2納米顆粒分離,洗滌沉淀即為fe3o4@rhb/sio2-aunps,并將其重懸于水中,待用;
4)將碳酸鉀溶液與氯金酸溶液室溫攪拌混勻,混勻后與上述fe3o4@rhb/sio2-aunps納米球混勻,再次混勻后加入抗壞血酸溶液,振蕩產物經磁鐵分離,洗滌,洗滌后再次重復步驟4)的操作,產物記為fe3o4@rhb/sio2@au;
5)將采用蛋白活化劑和羧基端活化劑活化的融合pviii蛋白與上述合成的fe3o4@rhb/sio2@au納米球連接,即可得到fe3o4@rhb/sio2@au@fusion-pviii多功能納米復合材料。
所述經無水乙醇混勻后加入正硅酸乙酯使體系為弱堿性,室溫下攪拌6小時,攪拌后加入適量的3-氨丙基三乙氧基硅烷,繼續攪拌,而后加入濃度為1mm活化的熒光分子,繼續攪拌8小時,再次逐滴加入與3-氨丙基三乙氧基硅烷等量的正硅酸乙酯并攪拌6小時,經離心,洗滌,干燥,制得復合納米粒子fe3o4@rhb/sio2。
所述步驟4)經磁鐵分離后檢測其近紅外吸收光譜,經反復操作后檢測其近紅外吸收光譜范圍605-747nm。
一種雙模式靶向成像功能的納米復合材料的應用,所述納米復合材料fe3o4@rhb/sio2@au@fusion-pviii用于靶向熒光共聚焦成像。
一種雙模式靶向成像功能的納米復合材料的應用,所述納米復合材料fe3o4@rhb/sio2@au@fusion-pviii用于靶向核磁共振成像。
一種雙模式靶向成像功能的納米復合材料的應用,所述納米復合材料fe3o4@rhb/sio2@au@fusion-pviii在用于腫瘤細胞的光熱中的應用。
所述腫瘤細胞為結腸癌細胞。
本發明所具有的優點:本發明納米復合材料同時具有雙模式靶向成像與光熱功能,其具有典型的內核和雙外殼層的核殼結構;制備過程中采用溶劑熱法制備具有強磁敏感性的超順磁性fe3o4納米顆粒并與熒光分子組裝形成復合納米核;合成蔗糖穩定的單分散的金納米球,利用au-s鍵將其組裝于納米核表面并生長,構筑穩定且重復性高的金殼結構;所形成的納米核殼材料可同時作為核磁共振成像和熒光成像的造影劑。通過調節復合納米材料的吸收峰至近紅外區域,并通過酰胺鍵將復合材料與sw620細胞特異性配體融合pviii蛋白實現偶聯。本發明所制得的材料通過核磁共振和熒光雙模式具有可提高核磁共振造影效果、可控調節其近紅外吸收峰、增強特異性識別能力、提高分散性和可重復性等優點實現對腫瘤細胞的特異性檢測和高效的光熱治療。
附圖說明
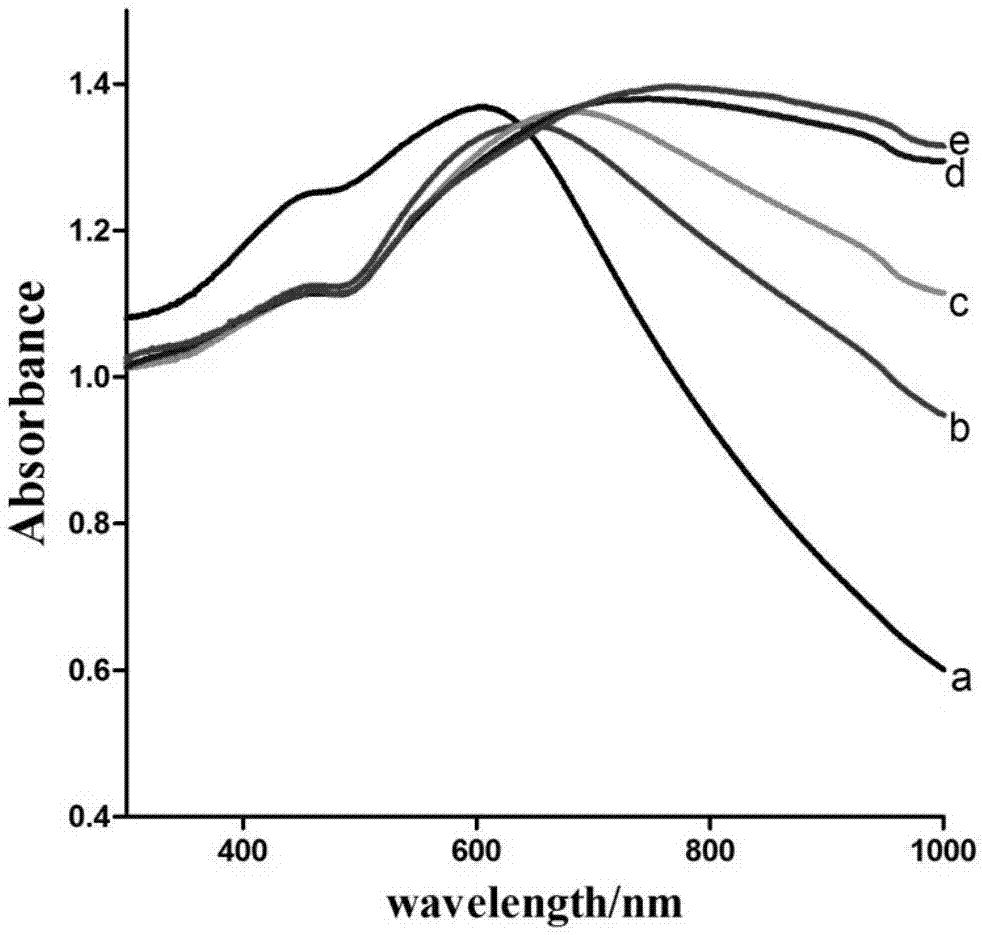
圖1為本發明實施例制得fe3o4@rhb/sio2@au納米顆粒的uv-vis-nir吸收光譜變化圖;
圖2為本發明實施例fe3o4@rhb/sio2@au納米顆粒的透射電鏡圖;
圖3為本發明實施例中所制得fe3o4、fe3o4@rhb/sio2和fe3o4@rhb/sio2@au納米顆粒的磁滯回線;
圖4為本發明實施例制得的不同濃度fe3o4@rhb/sio2@au@融fusion-pviii納米復合材料的mri圖像(a),t2弛豫效率與不同鐵濃度的關系(b)。
圖5為本發明實施例制得的fe3o4@rhb/sio2@au@fusion-pviii納米顆粒與sw620細胞、hek293t細胞和hepg2細胞孵育4h后的激光共聚焦圖片;
圖6為本發明實施例制得的fe3o4@rhb/sio2@au@fusion-pviii納米顆粒與sw620細胞、hepg2細胞和hek293t細胞孵育6h,采用功率為3w/cm2的808nm激光器照射不同時間細胞的存活率。
具體實施方式
下面將結合本發明實施例中的附圖,對本發明實施例中的技術方案進行清楚、完整的描述,顯然,所描述的實施例僅僅是本發明一部分實施例,而不是全部的實施例。基于本發明中的實施例,本領域普通技術人員在沒有做出創造性勞動前提下所獲得的所有其他實施例,都屬于本發明保護的范圍。
本發明采用溶劑熱法制備具有強磁敏感性的超順磁fe3o4納米顆粒并與熒光分子組裝形成復合納米核;將穩定的單分散金納米球,利用au-s鍵將其組裝于納米核表面并生長,構筑穩定且重復性高的金殼結構;所形成的納米核殼材料可同時作為核磁共振成像和熒光成像的造影劑。通過調節復合納米材料的吸收峰至近紅外區域,并通過酰胺鍵將復合材料與sw620細胞特異性配體融合pviii蛋白實現偶聯。本發明所制得的復合材料通過核磁共振和熒光雙模式成像功能實現了對腫瘤細胞的特異性檢測和高效的光熱現象。
實施例1
取20mg溶劑熱法合成的fe3o4納米顆粒,加入10ml濃度為0.1m的鹽酸,超聲處理10min,然后倒入50ml離心管中,9000rpm離心20min,除去上清,用去離子水洗滌沉淀三次,最終所得沉淀溶于4ml去離子水中,超聲分散。向含有fe3o4納米顆粒的水溶液中加入16ml無水乙醇并混勻,然后逐滴加入200μl濃氨水,攪拌5min,在攪拌條件下逐滴加入200μlteos,于室溫下攪拌6h,即可得到fe3o4@sio2納米顆粒。
吸取20μlaptes加入至溶液中,繼續攪拌反應12h,然后將20μl濃度為1mm活化的rhb熒光分子加入至溶液中,繼續攪拌8h,再次逐滴加入200μlteos并攪拌6h,然后將納米材料轉移至50ml離心管中,9000rpm離心20min,除去上清,沉淀用無水乙醇和去離子水洗滌多次,最終溶于水中,置于60℃真空干燥箱中干燥過夜,所得固體粉末表征后備用。
fe3o4@rhb/sio2納米顆粒表面巰基化:向上述所得fe3o4@rhb/sio2納米顆粒的溶液中按照mptms:teos=1:5的比例逐滴加入mptms,室溫攪拌24h。
將納米金球負載于fe3o4@rhb/sio2納米顆粒表面,并生長為金殼,最終得到fe3o4@rhb/sio2@au納米結構。取15ml金納米球溶液,與1ml表面功能化的fe3o4@rhb/sio2納米顆粒混勻,超聲10min,然后室溫靜置2h。利用磁鐵將偶聯有金納米球的fe3o4@rhb/sio2納米顆粒分離,并用水洗滌三次,去除多余的金納米球,沉淀重懸于1ml水中。配制8ml濃度為10mgml-1的k2co3溶液,與300μl濃度為10mmhaucl4溶液混勻,室溫攪拌30min,然后加入上述得到的fe3o4@rhb/sio2-aunps納米顆粒并混勻,向溶液中加入75μl濃度為0.1m的抗壞血酸,振蕩反應2h,所得產物經磁鐵分離洗滌,檢測其吸收光譜。多次重復此操作,至fe3o4@rhb/sio2@au納米顆粒的吸收峰移動至近紅外區,如圖1所示,顯示了在合成過程中,隨著表面金納米顆粒的生長,fe3o4@rhb/sio2@au的吸收峰逐漸紅移,當第一次以fe3o4@rhb/sio2-aunps表面附著的金納米顆粒為種子,在其表面還原haucl4時,其吸收峰紅移至605nm,四次重復此操作以后,吸收峰紅移至747nm。最終產物的電鏡表征如圖2所示,完整的au殼包裹于fe3o4@rhb/sio2納米顆粒表面形成了單一分散的fe3o4@rhb/sio2@au納米復合材料。x-射線能量色散譜分析結果顯示fe、si和au的同時存在,進一步證明我們已成功獲得fe3o4@rhb/sio2@au多層核殼納米結構。
活化已分離的sw620細胞特異性融合pviii蛋白。稱取0.5mg融合pviii蛋白至10ml離心管中并加入50μldh2o,逐漸滴加thf至溶液澄清,總體積約150μl。向溶液中加入二碳酸二叔丁酯(boc),使其終濃度為2mm,冰上振蕩20min,轉移至室溫振蕩3h,于4℃冰箱中靜置過夜。將50mm的edc和30mm的nhs混勻,然后取15μl加入至上述融合pviii蛋白溶液中,室溫避光靜置5h,使融合pviii蛋白的羧基端活化。
將活化的融合pviii蛋白與合成的fe3o4@rhb/sio2@au納米顆粒連接。向上述制備的1ml含有fe3o4@rhb/sio2@au納米顆粒溶液中加入30μl濃度為1mm的半胱氨酸,超聲混勻,然后避光攪拌5h。將已活化的pviii蛋白與半胱氨酸修飾的fe3o4@rhb/sio2@au納米顆粒混合,置于4℃冰箱中過夜反應。然后按照tfa:boc=5:1的比例向上述體系中加入0.175μltfa,冰浴條件下振蕩10min,轉移至室溫,繼續攪拌5h,即可得到fe3o4@rhb/sio2@au@fusion-pviii多功能納米復合材料。
圖3為所制得fe3o4、fe3o4@rhb/sio2和fe3o4@rhb/sio2@au納米顆粒的磁滯回線。在室溫條件下,測量所得fe3o4@rhb/sio2@au納米顆粒的磁飽和強度。與fe3o4和fe3o4@sio2納米顆粒相比,fe3o4@rhb/sio2@au納米顆粒的ms值顯著降低,減小至10.837emu/g,但依然能被外部磁鐵吸附并分離。對磁滯回線的局部放大,fe3o4@rhb/sio2@au納米顆粒的磁滯回線仍然經過原點,無矯頑力和剩磁力,是一種超順磁納米材料。因此,最終構筑的多功能核殼結構fe3o4@rhb/sio2@au仍然具有一定強度的ms,能被磁鐵吸附分離,具備超順磁性的特點,是臨床腫瘤核磁共振成像的理想造影劑。
圖4為不同濃度fe3o4@rhb/sio2@au@fusion-pviii納米復合材料的核磁共振圖像(a),t2弛豫效率與不同鐵濃度的關系(b)。fe3o4@rhb/sio2@au@fusion-pviii復合納米材料水溶液的圖像隨著材料濃度的增加而逐漸變暗,推測是由于納米材料有效縮短了其周圍水中氫質子的弛豫時間,表現出顯著的負增強效果。fe3o4@rhb/sio2@au@fusion-pviii復合納米材料的r2值高達176.2mm-1s-1(圖b),可作為一種理想的t2加權造影劑應用于腫瘤核磁共振檢測。
圖5為制得的fe3o4@rhb/sio2@au@fusion-pviii納米顆粒與sw620腫瘤細胞、hek293t細胞和hepg2細胞孵育4h后的激光共聚焦圖片。在550nm激光照射下,結腸腫瘤細胞sw620呈現紅色熒光,而對照組hek293t細胞和hepg2細胞未呈現熒光信號。因此,推測sw620細胞的熒光信號是由進入細胞的rhb分子在激發光下產生紅色熒光,而對照組細胞中不存在熒光分子,所以沒有出現熒光信號。由于熒光分子rhb包裹于sio2殼中,在實驗過程中不存在泄露進入細胞產生假陽性的情況,因此sw620細胞中的rhb熒光信號能夠準確說明fe3o4@rhb/sio2@au@fusion-pviii納米材料與靶標特異性結合并進入圖6為制得的fe3o4@rhb/sio2@au@fusion-pviii納米顆粒與sw620細胞、hepg2細胞和hek293t細胞孵育6h,采用功率為3w/cm2的808nm激光器照射不同時間細胞的存活率。由于細胞和細胞培養液中的組分對近紅外光無吸收,而fe3o4@rhb/sio2@au@fusion-pviii納米材料具有近紅外光吸收的特性,當808nm激光照射時,能夠有效地將吸收的光能通過電子的震動轉化為熱量,一定照射時間后,納米材料產生的過高熱能夠導致細胞死亡。據此,sw620細胞的死亡是由于其吸收fe3o4@rhb/sio2@au@fusion-pviii納米材料產生的過高熱引起,而對照細胞沒有吸收納米材料,對入射光無吸收且不能產生熱量,其生存狀態不受影響。這充分說明fe3o4@rhb/sio2@au@fusion-pviii納米復合材料能夠特異性識別并在3w/cm2的激光照射下殺傷腫瘤細胞,對腫瘤的靶向光熱治療具有重要價值。
由以上技術方案可知,本發明同時具有雙模式靶向成像與光熱功能的納米復合材料,所述的納米復合材料具有典型的內核和雙外殼層的核殼結構。其制備采用溶劑熱法制備具有強磁敏感性的超順磁性fe3o4納米顆粒并與熒光分子組裝形成復合納米核;將穩定的單分散金納米球,利用au-s鍵將其組裝于納米核表面并生長,構筑穩定且重復性高的金殼結構;所形成的納米核殼材料可同時作為核磁共振成像和熒光成像的造影劑。通過調節復合納米材料的吸收峰至近紅外區域,并通過酰胺鍵將復合材料與sw620細胞特異性配體融合pviii蛋白實現偶聯。本發明所制得的造影劑通過核磁共振和熒光雙模式成像功能實現了對腫瘤細胞的特異性檢測和高效的光熱治療。
上面結合附圖對本發明優選的具體實施方式和實施例作了詳細的說明,但是本發明并不限于上述實施方式和實施例,靶向探針也不限于特異性配體融合pviii蛋白,其可能能夠和待檢測的腫瘤細胞特異性結合的抗體、靶向多肽配體或適配體等,其他的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護范圍之內。
本領域技術人員在考慮說明書及實踐這里公開的發明后,將容易想到本發明的其它實施方案。本申請旨在涵蓋本發明的任何變型、用途或者適應性變化,這些變型、用途或者適應性變化遵循本發明的一般性原理并包括本發明未公開的本技術領域中的公知常識或慣用技術手段。說明書和實施例僅被視為示例性的,本發明的真正范圍和精神由權利要求指出。
- 還沒有人留言評論。精彩留言會獲得點贊!