攀登魚藤異黃酮在制備預防和/或治療宮頸癌藥物中的應用的制作方法
本發明屬于化合物應用技術領域,更具體地,涉及攀登魚藤異黃酮在制備預防和/或治療宮頸癌藥物中的應用。
背景技術:
宮頸癌是危害女性健康的主要惡性腫瘤之一,在女性腫瘤中的發病率僅次于乳腺癌,而現有的抗腫瘤藥物仍然存在毒性大、療效較低等弊端,因此開發一種療效好且毒副作用小的抗宮頸癌藥物具有非常重要的意義。
一直以來植物天然產物在開發新的治療惡性腫瘤藥物中一直占有重要的地位,攀登魚藤異黃酮(英文名稱為warangalone)為柘樹果實(fructusmacluraetricuspidatae)中分離得到的異黃酮類化合物,前期研究發現其具有較好的抗氧化活性,且對乳腺癌細胞mda-mb-231和mcf-7具有較好的抑制作用,但對抑制腫瘤細胞的分子機制并不清楚。且并不清楚其是否對其他腫瘤細胞存在較好的效果。
技術實現要素:
本發明提供了攀登魚藤異黃酮在制備預防和/或治療宮頸癌藥物中的應用。
為了實現上述目的,本發明采用如下技術方案:
攀登魚藤異黃酮在制備預防和/或治療宮頸癌藥物中的應用,所述攀登魚藤異黃酮的結構式如下:
優選地,所述藥物包括藥學上可接受的鹽或載體。
本發明針對warangalone選擇性地抑制宮頸癌細胞進行了相關的抑制機制研究,其可通過抑制腫瘤細胞的侵襲和遷移來抑制腫瘤的轉移能力,1μμ的warangalone的與陽性對照組順鉑(1μμ)的抑制效果相當。驗證了warangalone是通過線粒體途徑來誘導hela細胞凋亡。同時,ros的積累在warangalone誘導hela細胞凋亡通路中起著非常重要的作用,warangalone處理hela細胞后可能導致細胞內抗氧化劑或抗氧化酶系被氧化,使得ros不能被及時清除而大量積累,最終激活了線粒體凋亡通路和mapk信號通路。
與現有技術相比,本發明具有如下優點及有益效果:
本發明提供了攀登魚藤異黃酮在制備預防和/或治療宮頸癌藥物中的新應用,本發明提供的攀登魚藤異黃酮選擇性的抑制宮頸癌細胞,并且呈時間-劑量依賴性,成分安全可靠,在藥物開發方面具備較大的應用前景。
附圖說明
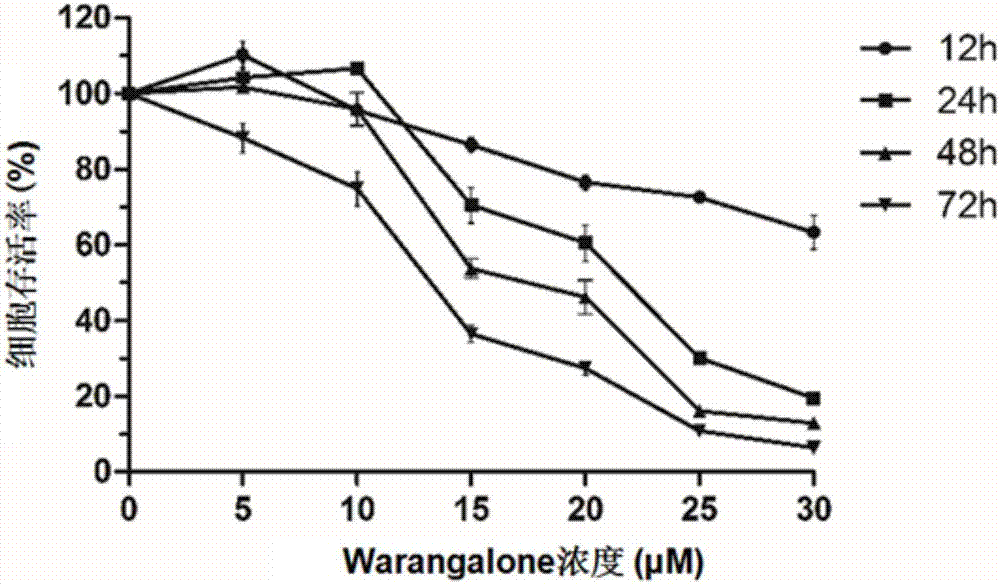
圖1為攀登魚藤異黃酮(warangalone)呈時間和劑量依賴性的抑制hela細胞的生長。
圖2為warangalone處理24h和48h后hela細胞的細胞形態改變(200×)。
圖3為hoechst33342染色觀察warangalone對hela細胞核形態的影響(200×)。
圖4為warangalone對hela細胞侵襲和遷移的抑制作用。
圖5為warangalone對hela細胞劃痕實驗結果。
圖6為流式細胞術檢測warangalone對hela細胞周期分布的影響。
圖7為annexinv-fitc/pi雙染檢測warangalone誘導hela細胞凋亡的作用。
圖8為流式細胞術檢測不同濃度warangalone處理hela細胞24h和48h后,對細胞線粒體膜電位的影響。
圖9為warangalone對hela細胞ros影響。
圖10為westernblot法檢測warangalone對bcl-2家族蛋白表達和胞漿細胞色素c的影響。
圖11為warangalone誘導hela細胞內caspases-3,caspase-8和caspase-9的活化。
圖12為不同濃度warangalone處理hela細胞48h后,westernbolting檢測細胞caspases-3,caspase-8,caspase-9和parp的表達水平。
圖13為warangalone對宮頸癌細胞內凋亡相關蛋白的影響。mapk信號通路中erk,akt去磷酸化和p38,jnk磷酸化的影響(a-c);p53的磷酸化(d)。
具體實施方式
以下結合具體實施例和附圖進一步說明本發明,其實施例在附圖中圖示并在后面加以說明,給出了部分詳細的實施方式和具體的操作過程。除非特別說明,本發明采用的試劑、方法和設備為本技術領域常規試劑、方法和設備。
實施例1warangalone體外抗腫瘤活性
細胞的半抑制濃度(ic50)是用于評估藥物抑制腫瘤增殖能力的常用方法之一。本發明選用了不同組織來源的人正常細胞和腫瘤細胞共8種細胞檢測warangalone的抗腫瘤能力,采用mtt法測定warangalone對細胞增殖的影響,藥物作用時間為72h,結果如表1所示:hela為人宮頸癌細胞,hepg2為人肝癌細胞,m321和mcf-7為人乳腺癌細胞,lo2人正常肝細胞,chem-5為正常腦膠質細胞。經warangalone處理后的腫瘤細胞的生長都受到不同程度的抑制,通過分析可以看出warangalone對宮頸癌、乳腺癌、肝癌子幾種不同腫瘤細胞的ic50范圍在13.3-29.6μμ之間,顯著低于正常肝細胞lo2(ic50=69.5+5.63μμ)和腦膠質細胞chem-5(76.9+5.64μμ)。其中hela的ic50值最小,為13.3+1.36μμ。結果表明warangalone選擇性的抑制腫瘤細胞,并且是選擇性的抑制人宮頸癌細胞。
表1warangalone對不同組織腫來源瘤細胞和正常細胞的增殖的抑制作用
實施例2warangalone對hela細胞增殖抑制作用時效
采用mtt法分別評估不同濃度warangalone(0、5、10、15、20、25、30μm)對hela細胞作用12h,24h,48h和72h后細胞生長情況。結果如圖1所示,warangalone對hela細胞的生長抑制作用呈劑量依賴性,作用12h,24h,48h和72h對hela細胞增殖抑制作用的ic50值分別為37.82±0.42μm、20.97±0.55μm、17.38±0.44μm、13.31±0.26μm,而warangalone對hela細胞作用48h對細胞引起的凋亡現象比較為明顯。
實施例3warangalone對hela細胞形態的改變
將對數期的hela鋪于6孔板內,細胞貼壁后加入不同濃度的藥物分別作用24h和48h后,倒置顯微鏡下觀察細胞的形態并拍照。如圖2所示,與空白對照組細胞相比較,隨著warangalone藥物濃度的增加,hela的細胞除了數量隨濃度的增加而減少外,形狀也隨濃度的增加而發生了明顯變化。低濃度10μm細胞的形狀變化并不明顯只是細胞數量有所減少;20μm時大多數細胞形態發生變化,由菱形逐漸變成梭形和圓形,貼壁能力下降;30μm時,細胞大多呈圓形,透光度增加,逐漸從壁上脫落。結果表明warangalone顯著性的抑制細胞的增殖,并改變細胞形態,且呈時間劑量依賴性。
實施例4warangalone對hela細胞核形態的影響
由于凋亡的細胞膜的通透性增加,故相比正常的細胞hoechst3342更容易進入。其次凋亡細胞染色結構發生變化dna與染料的結合能力較正常細胞要強更易被hoechst3342染色,因此凋亡的細胞被hoechst3342染色后細胞核呈現亮藍色。檢測結果如圖3所示,不同濃度的warangalone作用于hela細胞24h后對其進行hoechst3342染色,用熒光顯微鏡觀察hela細胞核形態的變化,結果顯示隨著藥物濃度的增加可觀察到細胞數量逐漸減少,細胞核碎裂、核解體及染色質固縮的現象越加明顯,并呈劑量依賴性。
實施例5warangalone對hela細胞侵襲和遷移能力的抑制作用
惡性腫瘤細胞的侵襲和遷移能力比正常細胞要更強是其重要的特征之一,高轉移的腫瘤細胞具有更強的細胞運動能力。因此尋找能夠抑制腫瘤細胞侵襲和遷移能力的藥物對腫瘤的治療具有重要的意義。為了探究warangalone對hela細胞侵襲和遷移能力是否有抑制作用,我們通過細胞劃痕實驗和transwell實驗來評估warangalone對hela細胞遷移能力和侵襲能力的影響。為了排除不是因為藥物作用使得細胞致死而導致遷移和侵襲能力下降,本實驗將warangalone作用濃度調為1μm、2μm、4μm,以1μm的順鉑作為陽性對照,藥物處理時間為24h。warangalone對hela細胞對細胞侵襲能力的影響如圖4-a所示,隨著藥物作用濃度增加,從transwell小室上面穿到下室的細胞數量逐漸減少,并呈劑量依賴性;1μm、2μm、4μm和陽性對照組處理后細胞侵襲抑制率分別為88.33%,49.48%,35.59%,86.76%如圖4-b所示。
劃痕實驗結果如圖5所示與空白相比隨著藥物作用濃度的增加細胞向劃痕區域遷移的能力逐漸減弱,在藥物作用濃度為2μm和4μm時對細胞的遷移的抑制作用與對照組相比具有顯著性差異,且藥物作用濃度為1μm時對細胞遷移的抑制作用與陽性對照組順鉑(1μm)相當;結果表明warangalone可顯著抑制hela細胞的侵襲和遷移。
實施例6warangalone對hela細胞周期的影響
哺乳動物的細胞周期可分為:g0/g1期(dna合成前期)、s期(dna合成期)、g2/m期(dna合成后期和分裂期)。而研究發現許多抗腫瘤藥物是通過周期阻滯來抑制腫瘤細胞的生長,為了驗證warangalone對hela細胞的抑制作用是否也與細胞周期的阻滯有關。我們采用了流式細胞術檢測warangalone對hela細胞周期的影響。本實驗檢測了不同藥物濃度(10μm、20μm、30μm)處理hela細胞48h后,對其周期分布的影響。結果如圖6-a所示,與對照組相比,隨著藥物濃度的增加,凋亡峰sub-g1也急劇增加,低濃度組為17.23%,中濃度組為36.32%,高濃度組為58.18%,統計學分析發現與對照組相比,均具有統計學意義(p<0.05)見圖6-b。而warangalone對g0/g1和g2/m影響不大,無統計學意義。綜上結果表明,warangalone對宮頸癌細胞的抑制作用主要通過細胞凋亡途徑而并非細胞周期阻滯作用。
實施例7流式細胞術分析warangalone對hela細胞凋亡的影響
熒光素fitc標記annexinv與pi聯用是常用于區分早凋與晚凋的凋亡檢測方法。本實驗通過流式細胞術檢測了不同濃度warangalone(10μm、20μm、30μm)處理hela細胞48h后對細胞凋亡的影響。檢測結果如圖7-a,與對照組相比較10μm,20μm和30μm的warangalone處理hela細胞48h后,凋亡率分別為6.63%,22.2%,31.5%。統計分析發現如圖7-b所示,中濃度和高濃度組與對照組相比具有顯著性差異。結果表明warangalone能夠誘導hela細胞凋亡,并且隨著濃度的增加呈劑量依賴性。
實施例8warangalone誘導hela細胞線粒體膜電位下降
細胞發生凋亡時往往伴隨著線粒體膜電位的下降,在凋亡刺激下,線粒體膜電位的耗散容易激活線粒體凋亡途徑發起凋亡級聯反應。而jc-1染色是檢測線粒體膜電位變化的常用方法。因此本實驗通過jc-1染色流式細胞術檢測了不同濃度warangalone(10μm、20μm、30μm)作用于hela細胞24h和48h后對hela細胞線粒體膜電位的變化的影響。實驗結果如圖8所示,藥物作用24h時對照組,低劑量組10μm,中劑量組20μm,高劑量組30μm對應的綠色熒光所占比例分別為0.50%,2.31%,12.99%,48.72%。藥物作用48h對應的綠色熒光所占比例分別為0.96%,3.80%,25.17%,79.71%。同對照組相比,隨著warangalone濃度的增加,綠色熒光所占的比例也逐漸增加,即線粒體膜電位的耗散增加。并且藥物處理48h對線粒體膜電位的耗散比24h藥明顯,說明呈一定的時間依賴性。結果表明warangalone處理細胞后破壞了線粒體的膜電位,并且呈劑量時間依賴性的降低了hela細胞的線粒體膜電位,由此說明warangalone誘導hela細胞凋亡的過程線粒體也參與到其中。
實施例9warangalone促進hela細胞內ros的產生
活性氧(ros)在細胞代謝過程中起著非常重要的作用,是許多疾病發生的原因之一。活性氧是體內有氧代謝的產物,主要包括o2-、no、h2o2等。研究表明ros的上調是黃酮類化合物誘導腫瘤細胞凋亡的原因之一,ros可以作為信號分子介導細胞凋亡是多種凋亡途徑的共同介質。為了探究warangalone是否能夠引起細胞內的ros水平的變化來介導細胞凋亡,我們采用dcfh-da熒光探針來檢測hela細胞中ros的水平。結果如圖9所示用不同濃度的warangalone處理hela細胞,選用5個時間點檢測,與對照組相比ros含量上升,處理組0到60min時ros水平逐漸上升,之后則逐漸趨于平緩。當ros含量最大時,即60min時間點不同劑量warangalone處理hela細胞后,ros水平隨藥物作用濃度增加而升高。結果表明warangalone作用于hela細胞后,會顯著提高細胞內ros水平。而過多的ros積聚會引起細胞損傷,如蛋白質的過氧化,體內酶的失活,dna的氧化損傷甚至導致細胞的凋亡。
實施例10warangalone通過調節bcl-2家族蛋白誘導hela細胞凋亡
根據jc-1線粒體膜電位的檢測結果發現warangalone處理hela細胞后線粒體膜電位隨warangalone的濃度呈劑量依賴性地降低,因此推測warangalone主要通過線粒體途徑來誘導hela細胞凋亡。而bcl-2家族在細胞凋亡的線粒體途徑調控中擔任著非常重要的角色,粒體膜電位的改變受bcl-2家族蛋白的表達的調控。bcl-2家族蛋白包括兩類:一類是促凋亡蛋白,如bad、bax、bid等另一類是抗凋亡蛋白,如bcl-2、bcl-xl等。bcl-2家族蛋白中的抗凋亡蛋白作用和促凋亡蛋白作用能夠互相制衡,一旦平衡破壞細胞將會通過線粒體介導的信號通路來啟動細胞凋亡。為了進一步闡明warangalone誘導細胞凋亡的機制,我們通過westernbloting檢測warangalone作用48h后,bcl-2家族各蛋白表達情況結果表明warangalone作用細胞后,促凋亡蛋白bad、bax的表達上調;抗凋亡蛋白bcl-2、bcl-xl的表達也下調,如圖10-a所示。同時我們也檢測細胞色素c的釋放,結果發現胞質中色素c的釋放量呈劑量依賴性增加,如圖10-b所示。以上結果表明warangalone通過調控bcl-2家族蛋白的表達來激活線粒體損傷,促進凋亡因子細胞色素c的釋放,進而誘導hela細胞的凋亡。
實施例11warangalone通過激活caspase家族蛋白表達誘導hela細胞凋亡
半胱氨酸天冬氨酸蛋白酶(cysteine-asparticproteases,caspases)是一類存在于細胞質中蛋白酶。多數情況下,細胞調亡的最終執行都要依賴caspases級聯反應的激活。caspase-8和caspase-9是細胞凋亡的起始者,他們分別介導死亡受體細胞凋亡信號通路和線粒體凋亡信號通路,而caspase-3是caspase家族蛋白中細胞凋亡最終執行者。為了驗證warangalone是否激活了caspase-3,caspase-8和caspase-9,我們采用熒光法檢測其活性,不同濃度的warangalone處理hela細胞warangalone后,caspase的活化情況如圖11所示,結果顯示caspase-3,caspase-8和caspase-9的活性與warangalone濃度呈劑量依賴性。濃度為10μμ的warangalone處理細胞后caspase-3,caspase-8,caspase-9活性無顯著變化,當處理濃度為20μμ和30μμ時caspase-3和caspase-9的活性程度與對照組相比顯著提高,但caspase-8只有在30μμ有顯著性提高。進一步表明了warangalone主要是通過線粒體介導的內源途徑來誘導hela細胞凋亡。
parp全稱聚腺苷酸二磷酸核糖轉移酶,是一種dna蛋白修復酶,是細胞凋亡核心成員caspase-3最主要的切割底物,在凋亡過程中發揮著重要的作用。warangalone處細胞hela細胞48h后,藥物處理組出現明顯的parp切割條帶(89kda),并且隨著warangalone濃度的增加parp的切割程度也逐漸增多,如圖12-a所示。結果表明warangalone誘導了細胞內parp進行切割,進而促使細胞凋亡。為了進一步佐證warangalone主要通過線粒體途徑來誘導細胞凋亡,我們進一步通過westernbloting檢測了caspase-3,caspase-8和caspase-9的表達量,結果顯示caspase-3和caspase-9的表達量呈下降趨勢,而caspase-8變化無顯著性差異;image統計分析,以β-actin蛋白表達灰度值為標準,計算出caspase-3蛋白表達與對照組的相對量如圖12-b所示。隨著warangalone濃度增加呈劑量依賴性地降低了caspase-3,caspase-9的表達量,又因加藥后caspase-8的表達量無顯著性變化,說明warangalone主要是通過線粒體介導的內源凋亡信號通路來誘導細胞凋亡。
實施例12warangalone誘導hela細胞p53的磷酸化,激活了mapk信號通路
細胞凋亡信號通路主要有死亡受體介導的外源凋亡途徑線粒體介導的內源凋亡途徑,但無論哪一種凋亡途徑都受到p53的調控,其活化與dna的氧化損傷密切相關。由前面westernbloting實驗結果發現bcl-2家族蛋白在warangalone作用后發生改變,而bcl-2家族蛋白的表達受p53的調控。又根據前面ros水平檢測的實驗中我們發現warangalone作用于hela細胞后能夠引起ros產生。研究表明ros的產生,能夠激活p53蛋白的磷酸化,而p53的激活能夠進一步激活下游的信號通路蛋白,包括線粒體家族蛋白以及死亡受體家族等。akt和erk已確認在細胞凋亡和藥物抵抗中起著重要的作用,erk能夠調控細胞的增殖分化和轉移等,通過激活抗凋亡蛋白和抑制caspase的激活來抑制細胞凋亡的發生,與erk相似akt通過抑制促凋亡蛋白如p53,bad等的表達來促進細胞凋亡。與erk和akt相反,mapk家族蛋白在外界刺激作用下,通過促進jnk,p38的磷酸化來促進細胞凋亡。
因此我們通過westernbloting檢測了p53,以及p53介導的mapk和akt信號通路相關蛋白的激活情況。結果如圖13所示,不同濃度warangalone處理hela細胞呈劑量依賴性上抑制了erk的磷酸化水平,同時能夠促進p38和p53的磷酸化,而總的erk和p38的表達量基本不變,但對akt和jnk的表達量無顯著影響。結果表明warangalone可能通過激活p53介導的mapk信號通路來誘導宮頸癌細胞hela細胞凋亡。
- 還沒有人留言評論。精彩留言會獲得點贊!