甲基蓮心堿在制備預防或治療急性呼吸窘迫綜合征藥物中的應用的制作方法
本發明涉及甲基蓮心堿抑制急性呼吸窘迫綜合征(ards)的發生發展從而預防或治療ards。本發明的具體機制涉及甲基蓮心堿通過抑制活性氧產生與釋放,減少因氧化損傷導致的血管內皮多糖包被的降解,進而降低血管通透性,以致于預防或治療ards。
背景技術:
急性呼吸窘迫綜合征(acuterespiratorydistresssyndrome,ards)是指由嚴重感染、創傷、休克、誤吸等多種非心源性致病因素導致,以進行性呼吸窘迫和難治性低氧血癥為臨床特征的急性呼吸衰竭綜合癥。ards發病急,發展迅速,臨床上至今尚缺乏有效遏制病情進展的藥物,因此ards預后差,死亡率高達41%,是嚴重危害人類健康的臨床常見呼吸危重癥之一。
ards尚無特效治療藥物,臨床主要以機械通氣支持治療為主。其主要借助呼吸機建立口與肺泡間的壓力差,可使因損傷而塌陷的肺泡重新復張,并通過調節吸入氧濃度有效改善缺氧癥狀,還可通過調節胸腔內壓對血流動力學產生影響,從而改善ards患者呼吸窘迫癥狀和頑固性低氧血癥。雖然其在ards的治療中發揮了重要作用,但也存在著繼發感染和呼吸機相關肺損傷的風險,因此開發ards有效治療藥物一直是人們關注的熱點和研究的難點。近年來研究表明,氧化應激在ards的發生發展中作用復雜。。進一步闡明ards中氧化損傷的機制,探尋有效抗氧化藥物,對開辟預防或治療ards的新途徑具有重要的理論指導意義。
甲基蓮心堿(neferine,nef)是從睡蓮科植物蓮成熟種子的綠色胚芽中提取分離的一種雙芐基異喹啉類生物堿(c38h44n2o6)。已有研究表明其具有抗氧化、抗纖維化、抗血小板聚集、抗心律失常、降血壓等廣泛的藥理作用。
目前尚未有甲基蓮心堿預防或治療急性呼吸窘迫綜合征方面的相關報道。
技術實現要素:
針對現有技術中的缺點,本發明的目的是提供通過甲基蓮心堿來預防或治療急性呼吸窘迫綜合征。
根據本發明的一個方面,本發明提供了甲基蓮心堿在制備預防或治療ards的藥物中的應用。
根據本發明的某些實施方式,所述急性呼吸窘迫綜合征是由肺外因素產生。
根據本發明的某些實施方式,所述肺外因素是膿毒癥、大面積燒傷、重癥急性胰腺炎、藥物中毒。
根據本發明的某些實施方式,所述肺外因素是lps刺激。
根據本發明的某些實施方式,所述甲基蓮心堿的給藥濃度是5-20mg/kg。
根據本發明的某些實施方式,所述甲基蓮心堿的給藥濃度是20mg/kg。
術語
急性呼吸窘迫綜合征(acuterespiratorydistresssyndrome,ards)是指非心源性的各種肺內和肺外因素所導致的急性缺氧性的呼吸衰竭。其主要的病理特征為,炎癥反應所致的肺泡上皮細胞及肺微血管內皮細胞損傷,肺毛細血管通透性增高,導致富含蛋白質的液體大量滲出到肺泡腔和肺間質,進而引起彌漫性肺水腫和透明膜形成;其主要的病理生理改變為肺容積減少、嚴重的通氣/血流比例失調、肺內分流增加和肺順應性降低;其臨床表現呼吸窘迫、頑固性低氧血癥、進行性的呼吸困難、呼吸衰竭。肺部影像學特點為:雙肺滲出樣改變。目前對于ards的治療是綜合治療,以呼吸支持治療為主,包括治療控制感染、合理液體管理、營養支持及心電監護支持治療,預防深靜脈血栓形成等多項輔助治療。
ards的發病因素包括直接因素(肺內因素)和間接因素(肺外因素)。直接因素主要有嚴重的肺炎(病毒性或細菌性)、胃內容物的吸入、吸入性肺損傷、肺挫傷等;間接因素主要有:膿毒癥、大面積燒傷、重癥急性胰腺炎、藥物中毒等。本專利從造模方式(脂多糖腹腔注射)上可以歸類為肺外因素(間接因素)。
內毒素是導致ards的重要因素之一,lps(lipopolysaccharide)是內毒素主要成分。lps(lipopolysaccharide,lps)是革蘭氏陰性桿菌細胞外膜成分,是病原菌主要的致病物質,進入機體后導致感染,引發ards,造成肺泡-毛細血管屏障損傷,毛細血管通透性增加、中性粒細胞浸潤和氧自由基釋放等病理生理學改變。本實驗運用lps刺激的huvecs細胞以及lps腹腔注射誘導的小鼠ards模型。
內皮細胞多糖包被(glycocalyx,gcx)為覆蓋于血管內皮細胞表面,一層由糖蛋白和蛋白聚糖為主體相互交聯形成帶負電荷的被膜結構,是保護血管內皮細胞的第一道屏障。gcx骨架結構主要包括核心蛋白和側鏈結構。核心蛋白主要有多配體聚糖(syndecan,sdc)組成。側鏈結構是氨基葡聚糖鏈(gags),硫酸乙酰肝素(hs)含量最多,占gags的50%以上,也是多糖包被的主要降解產物,其包含大量血漿蛋白的結合位點,并通過與核心蛋白的鏈接參與信號轉導。內皮細胞表面的多糖包被作為重要的血管屏障,具有維持血管內皮細胞結構和功能、調節毛細血管通透性、抗凝血、抗炎癥反應等作用。研究證明,感染性休克或手術后患者的血清中多糖包被標記物(多配體聚糖1(sdc-1),hs)濃度明顯升高。由肺毛細血管內皮細胞受損導致的血管通透性增加是ards的基本病理特點,因此,降低肺毛細血管多糖包被的降解或脫落成為治療ards的關鍵。氧化損傷在多糖包被降解中發揮著重要的作用。肺是含氧量最多的器官,也是最易受內源性和外源性ros損傷的器官。活性氧(ros)的大量產生可以引起細胞的氧化應激反應。ros可以直接降解多糖包被hsgags,此外完整的多糖包被可以結合抗氧化酶如黃嘌呤氧化酶、超氧化物歧化酶,以清除氧自由基。多糖包被完整性破壞后,ros直接損傷內皮細胞,中性粒等炎癥細胞粘附,大量炎癥因子釋放,導致內皮細胞功能障礙,血管通透性增高,ards病情加劇。
甲基蓮心堿是從睡蓮科植物成熟種子的綠色胚芽中提取的一類雙芐基異喹啉類的生物堿。研究表明其具有抗氧化、抗纖維化、抗心肌缺血、抗血小板聚集、抗心律失常、降血壓等廣泛的藥理作用。甲基蓮心堿抗氧化功能主要因為分子結構酚羥基上的氫易與氧自由基結合,可以有效清除細胞內氧自由基,同時減輕了細胞的氧化應激狀態。
肺濕重/肺干重是指是反映肺組織水腫的直接指標,也是反映肺組織損傷的敏感指標。主要測量方法為:動物麻醉處死后,用眼科解剖剪仔細游離出右肺下葉,置于天平中稱肺濕重(w)標號,然后將標好的肺組織置于60℃專用烤箱中烘干48小時(h)至恒重,再次稱重為肺干重(d)質量,肺組織的濕/干重比(wet/dryweightratio,w/d)=肺濕重/干重。w/d比值升高,表明肺水含量增加,肺水腫程度加劇,肺血管通透性升高。
肺組織氣血屏障通透性是指肺泡內的氧氣與肺毛細血管內的進行氣體交換的結構,其結構的完整性可以維持機體正常的通氣/血流比例。當損傷因素導致氣血屏障受損時,如肺泡及間質水腫,可導致通氣/血流比例失調,臨床表現為呼吸窘迫和頑固性的低氧血癥。
肺水腫及肺血管通透性是指各種因素導致的肺泡上皮細胞和肺微血管內皮細胞損傷,導致內皮細胞屏障功能障礙,引起肺血管通透性增高,富含蛋白質的液體滲出到肺泡和肺間質引起肺水腫。
活性氧(ros)是指一類由氧衍生出來的、化學性質較基態氧活潑的含氧物質統稱,包括氧自由基和一些非自由基的物質,其主要由線粒體產生。其過量積累可對細胞產生氧化損傷。
總抗氧化能力(t-aoc)是指機體在生理條件下,有清除產生過多的ros從而使細胞內ros保持一定水平的能力。
超氧化物歧化酶(sod)是指機體內能有效清除過氧化物的抗氧化酶,其能催化超氧化物陰離子生成過氧化氫與氧氣,其活性水平反映了機體清除氧自由基的能力。
丙二醛(mda)是指生物體脂質過氧化產物中的一種,mda的量反映了機體細胞細胞膜結構受氧自由基破壞程度。
脂質氧化是指機體受到損傷因素時,過量產生的活性氧作用于生物膜產生脂質過氧化損傷。
本申請所述藥物組合物可以為片劑、丸劑、膠囊劑、顆粒劑、粉劑、栓劑、散劑、膏劑、貼劑、注射液、溶液、混懸液、噴霧劑、洗劑、滴劑、擦劑。所述藥物組合物可制成干粉形式,并且在給藥前與無菌水或緩沖液混合以制成溶液形式。所述緩沖液的ph通常為3-11,優選5-9,更優選7-8。
本申請中術語“藥盒”或“試劑盒”可互換使用。本申請公開了包含治療有效量的所述治療劑或藥物組合物的藥盒。根據本申請的某些實施方式,所述藥盒還包含一種或多種其他的治療劑。根據本申請的某些實施方式,所述藥盒還包含使用說明書。
根據本申請的某些實施方式,所述藥盒還包含用于相應給藥方式的裝置,例如但不限于針頭。術語“給藥”、“給予”或“施予”是指將一定劑量的化合物或藥物組合物通過合適的給藥方式給予對象。
所述“給藥方式”包括但不限于口服給藥、靜脈內給藥、呼吸道內給藥、舌下給藥、局部給藥、肌肉內給藥、眼內給藥、透皮吸收、胃腸外給藥、腹膜內給藥、陰道給藥、頰部給藥、經直腸給藥等本領域已知的任何給藥方式。本領域技術人員應該了解對象的給藥方式取決于多個因素,所述因素包括疾病的位置、對象的年齡、疾病的嚴重程度、以及藥物組合物的成分等。
本申請所述化合物或藥物組合物可以在任意時間給藥。例如所述化合物或藥物組合物可以在對象疾病發作前、發作時或者發作后給藥,例如可以在疾病發作前或發作后的約1小時、約2小時、約4小時、約5小時、約8小時、約12小時、約24小時、約2天、約4天、約8天、約16天、約30天或1個月、約2個月、約4個月、約6個月給藥。
本申請所述化合物或藥物組合物可以一次給藥,也可以多次給藥。當多次給藥時,5可以以間隔任意時間的方式,例如后續劑量與前面劑量的間隔為約8周、約4周、約2周、約1周、約5天、約3天、約2天、約24小時、約12小時、約8小時、約6小時、約4小時、約3小時、約2小時、約1小時、約30分鐘或更少時間。
方法和用途
根據本發明的一個方面,本發明公開使用甲基蓮心堿來預防或治療急性呼吸窘迫綜合征的方法。
根據本發明的某些實施方式,所述急性呼吸窘迫綜合征是由肺外因素產生。
根據本發明的某些實施方式,所述肺外因素是膿毒癥、大面積燒傷、重癥急性胰腺炎、藥物中毒。
根據本發明的某些實施方式,所述肺外因素是lps刺激。
根據本發明的某些實施方式,所述甲基蓮心堿的給藥濃度是5-20mg/kg,例如5-18mg/kg、5-15mg/kg、5-13mg/kg、5-10mg/kg、5-8mg/kg、8-20mg/kg、8-18mg/kg、8-15mg/kg、8-13mg/kg、8-10mg/kg、10-20mg/kg、10-18mg/kg、10-15mg/kg、10-13mg/kg、13-20mg/kg、13-18mg/kg、13-15mg/kg、15-20mg/kg、15-18mg/kg、或18-20mg/kg。根據本發明的某些實施方式,所述甲基蓮心堿的給藥濃度是5mg/kg、6mg/kg、7mg/kg、8mg/kg、9mg/kg、10mg/kg、11mg/kg、12mg/kg、13mg/kg、14mg/kg、15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg、或20mg/kg。
根據本發明的某些實施方式,所述甲基蓮心堿給予細胞的濃度是5-20μm,例如5-18μm、5-15μm、5-13μm、5-10μm、5-8μm、8-20μm、8-18μm、8-15μm、8-13μm、8-10μm、10-20μm、10-18μm、10-15μm、10-13μm、13-20μm、13-18μm、13-15μm、15-20μm、15-18μm、或18-20μm。根據本發明的某些實施方式,所述甲基蓮心堿給予細胞的濃度是5μm、6μm、7μm、8μm、9μm、10μm、11μm、12μm、13μm、14μm、15μm、16μm、17μm、18μm、19μm、或20μm。
根據本發明的一個方面,本發明公開甲基蓮心堿在制備預防或治療急性呼吸窘迫綜合征藥物中的應用。
根據本發明的某些實施方式,所述急性呼吸窘迫綜合征是由肺外因素產生。
根據本發明的某些實施方式,所述肺外因素是膿毒癥、大面積燒傷、重癥急性胰腺炎、藥物中毒。
根據本發明的某些實施方式,所述肺外因素是lps刺激。
根據本發明的某些實施方式,所述甲基蓮心堿的給藥濃度是5-20mg/kg,例如5-18mg/kg、5-15mg/kg、5-13mg/kg、5-10mg/kg、5-8mg/kg、8-20mg/kg、8-18mg/kg、8-15mg/kg、8-13mg/kg、8-10mg/kg、10-20mg/kg、10-18mg/kg、10-15mg/kg、10-13mg/kg、13-20mg/kg、13-18mg/kg、13-15mg/kg、15-20mg/kg、15-18mg/kg、或18-20mg/kg。根據本發明的某些實施方式,所述甲基蓮心堿的給藥濃度是5mg/kg、6mg/kg、7mg/kg、8mg/kg、9mg/kg、10mg/kg、11mg/kg、12mg/kg、13mg/kg、14mg/kg、15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg、或20mg/kg。
根據本發明的某些實施方式,所述甲基蓮心堿給予細胞的濃度是5-20μm,例如5-18μm、5-15μm、5-13μm、5-10μm、5-8μm、8-20μm、8-18μm、8-15μm、8-13μm、8-10μm、10-20μm、10-18μm、10-15μm、10-13μm、13-20μm、13-18μm、13-15μm、15-20μm、15-18μm、或18-20μm。根據本發明的某些實施方式,所述甲基蓮心堿給予細胞的濃度是5μm、6μm、7μm、8μm、9μm、10μm、11μm、12μm、13μm、14μm、15μm、16μm、17μm、18μm、19μm、或20μm。
除非另外定義,本文使用的所有專業術語或專有詞匯具有本發明技術領域的普通技術人員通常所理解的含義。
在本申請中當“約”用于修飾數值時,是指所述數值可以上下浮動±10%、±9%、±8%、±7%、±6%、±5%、±4%、±3%、±2%或±1%的范圍內。
除非在本申請中另有說明或與上下文明顯矛盾,在描述本申請的上下文中(包括權利要求的上下文中)使用的術語“一種”、“一個”、“所述”、“該”以及“至少一個”和類似指代被解釋為覆蓋單數和復數。除非在本申請中另有說明或與上下文明顯矛盾,本申請中所使用的術語“包含”、“具有”、“包括”和“含有”被解釋為開放式術語(即“包括但不限于”)。除非在本申請中另有說明或與上下文明顯矛盾,本申請所述的所有方法可以根據本領域技術人員的理解,以任何合適的順序進行。
本申請中引用的所有專利、專利申請和參考文獻均通過引用的方式全文并入本申請,其并入程度就如同每一篇文獻單獨引用作為參考。如果本申請和本文提供的文獻之間存在沖突,應以本申請中的內容為準。
附圖說明
圖1顯示了甲基蓮心堿對lps(lipopolysaccharide,革蘭氏陰性桿菌細胞外膜中含有的主要致病物質)誘導的ards小鼠肺組織病理改變的he染色結果、肺水腫及肺血管通透性結果(#表示與正常對照組相比,#p<0.05;*表示與lps組相比,*p<0.05,下面的圖片相同);
圖2顯示了甲基蓮心堿對lps誘導的ards小鼠肺多糖包被sdc-1及hs表達的結果;
圖3顯示了甲基蓮心堿對lps誘導的ards小鼠肺組織中ros含量的改變的結果;
圖4顯示了甲基蓮心堿對lps誘導的ards小鼠肺組織中總抗氧化能力(t-aoc)超氧化物歧化酶(sod)、丙二醛(mda)含量改變的結果;
圖5顯示了甲基蓮心堿對lps刺激的huvecs細胞多糖包被sdc-1表達的結果;
圖6顯示了甲基蓮心堿對lps刺激的huvecs細胞多糖包被hs表達的結果;
圖7顯示了甲基蓮心堿對lps刺激的huvecs細胞中ros含量的改變的結果;
圖8顯示了甲基蓮心堿對lps刺激的huvecs細胞中t-aoc、sod及mda含量的改變的結果。
具體實施方式
本發明通過構建急性呼吸窘迫綜合征的動物和細胞損傷模型的基礎上,本發明通過he、伊文思藍(evanblue)染色、熒光探針、免疫熒光標記等驗證甲基蓮心堿能夠降低活性氧(ros)的產生與釋放、減少血管內皮多糖包被的降解,進而抑制急性呼吸窘迫綜合征的發生和發展,預防或治療ards。
實施例1:甲基蓮心堿對于肺組織病理改變、肺水腫及肺血管通透性的影響。
本實施例檢測甲基蓮心堿對于肺組織病理改變、肺水腫及肺血管通透性的影響,本實施例中使用由肺外因素lps誘導的ards小鼠損傷模型。
1.材料
c57bl/6小鼠,雄性,體重18-20g,清潔級,購自山東濟南朋悅實驗動物繁育有限公司(產品號:scxk(魯)20140007),適應性喂養3天(d),給藥期間自由飲水進食。甲基蓮心堿(neferine,nef)純度98%,購自上海立根生物技術制藥有限公司(產品號:z118105);脂多糖(lps)、伊文思藍(evansblue)購自sigma公司(產品號:l2880,e2129);總抗氧化能力(t-aoc)試劑盒、超氧化物歧化酶(sod)試劑盒、脂質氧化(mda)試劑盒,購自碧云天生物技術公司(產品號:s0121,s0101,s0131)。
2.方法
2.1ards小鼠動物模型建立與分組:
根據查閱文獻及預實驗結果篩選的優選的藥物濃度是5-20mg/kg,更優選20mg/kg。把c57bl/6小鼠60只,隨機分為4組,即正常對照組、lps(20mg/kg)組、lps+nef(20mg/kg)給藥組、nef(20mg/kg)組。首先,對于nef+lps組和nef組的小鼠,腹腔注射nef(20mg/kg)預處理1周。此期間正常對照組和lps組的小鼠給予相同劑量的生理鹽水。一周后,lps組、nef+lps組的小鼠腹腔注射20m/kg的lps,正常對照組、nef組的小鼠給予等量的生理鹽水。
2.2病理學觀察與相關實驗檢測:
各組實驗小鼠分別取8只于lps注射6小時(h)后處死,取肺組織。取左肺,稱肺濕重(w),60℃烘干48小時(h),再次稱重得肺干重(d),測肺組織濕干重比w/d值(wet/dryweightratio,w/d)=肺濕重/肺干重。
取右肺在4%多聚甲醛溶液中固定,然后使用病理學方法he染色。
剩余每組實驗小鼠,進行肺組織氣血屏障通透性檢測,經尾靜脈注射伊文思藍(evansblue)染液(20mg/kg),30分鐘(min)后開胸取肺臟約0.1g,剪碎肺組織浸泡在1ml甲酰胺溶液中(100mg/ml),置于37℃溫箱中溫育24小時(h)。待組織中的色素浸出后取出組織,12000g/分鐘(min)離心10分鐘(min)后取上清液,用分光光度計在波長620nm處進行比色,對照標準曲線計算出各組樣本伊文思藍的濃度。嚴格按照相應試劑盒說明書操作檢測各組實驗小鼠肺組織t-aoc、sod、mda的含量。
3.結果
如圖1a所示,正常對照組小鼠肺組織無明顯改變。與正常小鼠肺組織結構相比,lps組小鼠的肺間質增寬,間質及肺泡腔有出血、水腫、滲出、大量炎性細胞浸潤,肺損傷評分顯著升高141.2%。與lps組相比,nef+lps組小鼠的肺間質及肺泡出血、水腫,炎癥滲出較lps組減輕,肺損傷評分明顯降低39.0%。nef組與正常組的小鼠相比,肺組織結構無明顯改變。
如圖1b所示,與正常對照組相比,lps組小鼠的肺組織濕干重比(wet/dryweightratio,w/d)=肺濕重/肺干重)w/d值增加63.4%(#p<0.05);與lps組相比,nef+lps組小鼠的肺組織w/d降低20.5%(*p<0.05);nef與正常組相比,未見明顯改變。
如圖1c所示,與正常對照組相比,lps組小鼠肺組織伊文思藍含量升高106.3%(#p<0.05);與lps組相比,nef+lps組小鼠的肺組織伊文思藍含量降低29.0%(*p<0.05)。nef組與正常組相比,肺組織伊文思藍含量未見明顯改變。
實驗結果說明甲基蓮心堿可以改善lps誘導的小鼠肺組織結構病理改變及損傷,減輕小鼠肺水腫及血管通透性改變。
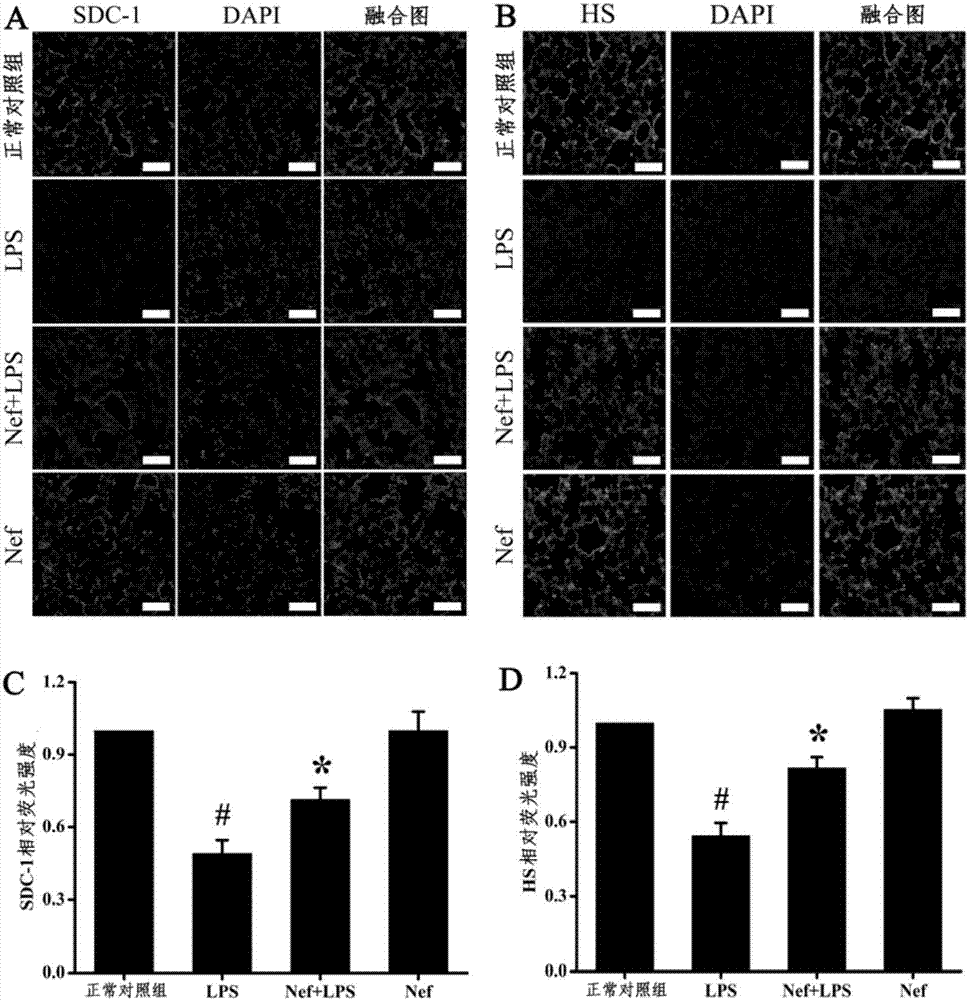
實施例2:甲基蓮心堿對肺多糖包被sdc-1及hs表達的影響。
本實施例檢測甲基蓮心堿對于肺多糖包被sdc-1及hs表達的影響,本實施例中使用由肺外因素lps誘導的ards小鼠損傷模型。
1.材料
c57bl/6小鼠,雄性,體重18g-20g,清潔級,購自山東濟南朋悅實驗動物繁育有限公司(產品號:scxk(魯)20140007),適應性喂養3天(d),給藥期間自由飲水進食。甲基蓮心堿(neferine,nef)純度98%,購自上海立根生物技術制藥有限公司(產品號:z118105);脂多糖(lps);syndecan-1抗體購自abcam公司(產品號:ab128936);血栓調節蛋白購自r&d公司(產品號:af3894);hs抗體購自swampscott公司(產品號:10e4020216);山羊血清封閉液、兔血清封閉液購自索萊寶公司(產品號:zli-9022,zli-9026);羅丹明標記山羊抗鼠二抗、羅丹明標記山羊抗兔二抗、fitc標記兔抗羊二抗購自北京中杉金橋生物科技有限公司(產品號:zf-0313,zf-0316,zf-0314)。
2.組織免疫熒光及相關實驗檢測:
各組實驗小鼠分別取6只于lps注射6小時(h)后,按5ml/kg給予腹腔注射4%水合氯醛,待小鼠進入麻醉狀態后(無疼痛反應等),將小鼠四肢外展固定于取材板上(麻繩固定),用預熱好的生理鹽水經左心室灌注,直至無血性液體流出,繼而用4%多聚甲醛固定液灌注,待小鼠出現四肢抽出現象,在等待一段時間即可。用鑷子輕輕固定剪取肺組織,將肺組織剪成0.5×1×1cm3大小,放入多聚甲醛固定液中,在4℃條件下固定48小時(h)。
待48小時(h)后,將固定好的肺組織進行梯度酒精脫水、石蠟包埋。石蠟切片經脫蠟、水化后,將切片放入盛有檸檬酸的染色盒內,置于微波爐中以百分之百火力加熱五分鐘至沸騰,后以百分之四十火力繼續加熱十五分鐘,以進行抗原修復,取出染色盒,靜置至室溫。然后用pbs沖洗5分鐘(min)×3次,將載玻片置于濕盒內,分別于各組織上滴加動物非免疫血清工作液封閉,室溫孵育60分鐘(分鐘(min))。60分鐘(min)后,分別滴加抗sdc-1、hs一抗50μl4℃過夜,pbs沖洗15分鐘(min)×3次,滴加相應的熒光標記的二抗,37℃避光孵育2小時,pbs沖洗15分鐘(min)×3次,除去pbs沖洗15分鐘(min)×3次,甩干后用動物非免疫血清封閉60分鐘。60分鐘后,每張切片滴加50μl血栓調節蛋白抗體,4℃過夜,pbs沖洗15分鐘(min)×3次。除去pbs液,每張切片滴加100μldapi染核溶液,37℃避光孵育15分鐘(min),pbs沖洗10分鐘(min)×3次,除去pbs液,切片稍干后用抗熒光淬滅封片劑封片,熒光顯微鏡觀察拍照。
3.結果
如圖2a和2c所示,小鼠肺組織毛細血管內皮細胞有sdc-1的表達,與正常對照組相比,lps組肺組織sdc-1的免疫熒光強度降低50.7%。與lps組相比,nef+lps組肺組織sdc-1熒光強度升高45%。nef組與正常對照組相比,肺組織sdc-1熒光強度未見明顯改變。
如圖2b和2d所示,小鼠肺組織毛細血管內皮細胞有hs的表達,與正常對照組相比,lps組肺組織hs的免疫熒光強度降低45.6%。與lps組相比,nef+lps組肺組織hs熒光強度升高50.1%。nef組與正常對照組相比,肺組織hs熒光強度未見明顯改變。
實驗結果說明甲基蓮心堿可以通過減少lps誘導的ards小鼠多糖包被sdc-1及hs的降解來保護多糖包被的完整性。
實施例3:甲基蓮心堿對肺組織中ros含量的影響。
本實施例檢測甲基蓮心堿對于肺組織中ros含量的影響,本實施例中使用lps誘導的ards小鼠損傷模型。
材料和方法同實施例1。
各組實驗小鼠分別取6只于lps注射6小時(h)后處死,于4℃條件下取小鼠肺組織,稱量60mg左右的小鼠肺組織,按1:5加入組織裂解液,經超聲勻漿后,13800g/20分鐘(min)離心,20分鐘(min)后,取200μl上清加入96孔板中,每孔加入10μl2,7-二氯熒光素二乙酸酯(dcfh-da),37℃孵育30分鐘(min)。在活性氧存在的條件下,dcfh-da可被氧化生成氧化型二氯熒光素(dcf)。通過熒光酶標儀在激發波長485nm,發射波長530nm進行組織檢測dcf熒光,從而測定ros水平。
如圖3所示:與正常對照組相比,lps組肺組織內ros水平明顯增高,熒光強度增加124.8%。與lps組比nef+lps組肺組織ros水平降低,熒光強度降低25.3%。nef組與正常對照組相比,ros熒光強度未見明顯改變。
實驗結果說明甲基蓮心堿可以降低lps誘導的ards小鼠肺組織內ros水平。
實施例4:甲基蓮心堿對肺組織中t-aoc、sod及mda含量的影響。
本實施例檢測甲基蓮心堿對于肺組織中t-aoc、sod及mda含量的影響,本實施例中使用lps誘導的ards小鼠損傷模型。
材料和方法同實施例1。
如圖4所示:與正常對照組相比,lps組小鼠肺組織t-aoc降低45.1%(圖4a)(#p<0.05)、sod含量降低45%(圖4b)(#p<0.05),而mda(圖4c)含量則有明顯的升高66.6%(#p<0.05)。而與lps組相比,nef+lps組小鼠的肺組織t-aoc升高45%(圖4a)(*p<0.05)、sod含量升高33.4%(圖4b)(*p<0.05),而mda含量降低22.3%(圖4c)(*p<0.05)。nef組與正常組相比,小鼠肺組織中t-aoc、sod及mda含量未見明顯改變(圖4)。
實驗結果說明甲基蓮心堿可以增強lps誘導的小鼠抗氧化能力和降低氧化損傷。
實施例5:甲基蓮心堿對細胞多糖包被sdc-1表達的影響。
本實施例檢測甲基蓮心堿對于細胞多糖包被sdc-1表達的影響,本實施例中使用lps刺激的huvecs細胞損傷模型。
1.材料
原代臍靜脈內皮細胞(huvecs)能代表人血管內皮細胞最主要的特點和性質,且來源相對容易、獲取細胞方便、對機體無影響,所以選用原代臍靜脈內皮細胞(huvecs)作為血管內皮細胞體外模型。原代臍靜脈內皮細胞(huvecs)和內皮細胞培養基購自allcell公司(產品號:huvec-001f);dcfh-da購自sigma公司(產品號:d6883);總抗氧化能力(t-aoc)試劑盒、超氧化物歧化酶(sod)試劑盒、脂質氧化(mda)試劑盒購自碧云天生物技術公司(產品號:s0121,s0101,s0131);syndecan-1抗體購自abcam公司(產品號:ab128936);血栓調節蛋白購自r&d公司(產品號:af3894);hs抗體購自swampscott公司(產品號:10e4020216);山羊血清封閉液、兔血清封閉液購自索萊寶公司(產品號:zli-9022,zli-9026);羅丹明標記山羊抗鼠二抗、羅丹明標記山羊抗兔二抗、fitc標記兔抗羊二抗購自北京中杉金橋生物科技有限公司(產品號:zf-0313,zf-0316,zf-0314)。
2.細胞培養方法
huvecs細胞在37℃、5%co2、飽和濕度的條件下培養在含有10%胎牛血清的dmem培養基中。細胞融合至80%-90%后,用25%胰酶消化傳代。將傳代至3-8代且處于對數生長期的細胞培養在無血清的培養基24小時(h)后用于實驗。mtt細胞毒性實驗顯示(圖5a):甲基蓮心堿在0μm-20μm濃度之間,對細胞無毒性作用,不影響細胞存活率,超過20μm細胞存活率下降,且與甲基蓮心堿的濃度成負相關性。細胞模型和動物模型用藥濃度相差比較大,不容易統一。選處于對數生長期的細胞,制成單個細胞懸液,接種于24孔板或蓋玻片上。
選處于對數生長期的細胞,制成單個細胞懸液,接種于蓋破片上,在70%-80%融合時,在無血清培養基中培養24h。設正常對照組、lps組、lps+nef低劑量組、lps+nef中劑量組、lps+nef高劑量組。lps+nef低劑量組、lps+nef中劑量組及lps+nef高劑量組分別給予nef(5μm、10μm、20μm)預處理1h,lps組、lps+nef低劑量組、lps+nef中劑量組及lps+nef高劑量組給予lps(1μg/ml)刺激6小時(h)。6小時(h)后,去除細胞培養液。各孔pbs沖洗5分鐘(min)×3次,加入4%多聚甲醛固定15分鐘(min),pbs沖洗5分鐘(min)×3次,血清封閉,(37℃,60分鐘(min)),滴加一抗,4℃過夜,pbs沖洗5分鐘(min)×3次,滴加二抗,37℃避光孵育60分鐘(min),pbs沖洗5分鐘(min)×3次,甘油封片,熒光顯微鏡觀察拍照。
如圖5b和5c所示,huvecs表面有sdc-1的表達,與正常對照組相比,lps組細胞sdc-1的免疫熒光強度降低70.7%。與lps組相比,lps+nef低劑量組(nef:5μm)細胞sdc-1的熒光強度升高26.8%,lps+nef中劑量組(nef:10μm)細胞sdc-1的熒光強度升高114.4%,lps+nef高劑量組(nef:20μm)細胞sdc-1的熒光強度升高188.7%。
實驗結果說明不同濃度(5μm、10μm、20μm)甲基蓮心堿均可以通過減少lps刺激的huvecs細胞多糖包被sdc-1的降解來保護多糖包被的完整性,且隨濃度增加,保護作用增加。
實施例6:甲基蓮心堿對細胞多糖包被hs表達的影響。
本實施例檢測甲基蓮心堿對于細胞多糖包被hs表達的影響,本實施例中使用lps刺激的huvecs細胞損傷模型。
材料和細胞培養方法同實施例5
如圖6a和6b所示,huvecs表面有hs的表達,與正常對照組相比,lps組細胞hs的免疫熒光強度降低55.3%。與lps組相比,lps+nef低劑量組(nef:5μm)細胞hs的熒光強度升高23.4%,lps+nef中劑量組(nef:10μm)細胞hs的熒光強度升高50.5%,lps+nef高劑量組(nef:20μm)細胞hs的熒光強度升高89.3%。
實驗結果說明不同濃度(5μm、10μm、20μm)甲基蓮心堿均可以通過減少lps刺激的huvecs細胞多糖包被hs的降解來保護多糖包被的完整性,且隨濃度增加,保護作用增加。
實施例7:甲基蓮心堿對ros含量的影響。
本實施例檢測甲基蓮心堿對于ros含量的影響,本實施例中使用lps刺激的huvecs細胞損傷模型。
材料和細胞培養方法同實施例5。
選處于對數生長期的細胞,制成單個細胞懸液,接種于蓋破片上,在70%-80%融合時,在無血清培養基中培養24h。設正常對照組、lps組、lps+nef低劑量組、lps+nef中劑量組及lps+nef高劑量組。lps+nef低劑量組、lps+nef中劑量組及lps+nef高劑量組分別給予nef(5μm,10μm,20μm)預處理1h,lps組、lps+nef低劑量組、lps+nef中劑量組及lps+nef高劑量組細胞給予lps(1μg/ml)刺激6小時(h)。6小時(h)后,去除細胞培養液,加入適當體積稀釋好的dcfh-da(10μm)。加入的體積以能充分蓋住細胞為宜,通常對于六孔板的一個孔加入稀釋好的dcfh-da不少于1ml。37℃細胞培養箱內孵育20分鐘(min)。用無血清細胞培養液洗滌細胞3次,以充分去除未進入細胞內的dcfh-da,置于熒光顯微鏡觀察。
如圖7所示,與正常對照組相比,lps組細胞內ros水平顯著增高,熒光強度增加228.9%。與lps組比lps+nef低劑量組(nef:5μm)、lps+nef中劑量組(nef:10μm)及lps+nef高劑量組(nef:20μm)細胞內ros水平明顯降低,熒光強度分別降低15.4%,34.4%,54.8%。
實驗結果說明不同濃度(5μm、10μm、20μm)甲基蓮心堿均可以降低lps刺激的huvecs細胞ros水平,且隨濃度增加,抑制作用增加。
實施例8:甲基蓮心堿對t-aoc、sod及mda含量的影響。
本實施例檢測甲基蓮心堿對于t-aoc、sod及mda含量的影響,本實施例中使用lps刺激的小鼠huvecs細胞損傷模型。
材料和細胞培養方法同實施例5。
選處于對數生長期的細胞,制成單個細胞懸液,接種于24孔板上,待細胞生長在70%-80%融合時,無血清培養基培養24小時(h)。設正常對照組、lps組、nef+lps組和nef組。nef+lps組與nef組的細胞給予nef(10μm)預處理1小時(h),lps組與nef+lps組的細胞給予lps(1μg/ml)刺激。6小時(h)后,收集細胞,嚴格按照相應試劑盒說明書操作檢測各實驗細胞組t-aoc、sod、mda含量。
如圖8所示,與正常對照組相比,lps組細胞t-aoc降低37.3%(圖8a)(#p<0.05)、sod含量(圖8b)降低49.7%(#p<0.05),而mda(圖8c)含量升高133.1%(#p<0.05)。而與lps組相比,nef+lps組細胞t-aoc升高28.8%(圖8a)(#p<0.05)、sod含量升高44.8%(圖8b)(*p<0.05),而mda含量降低33.6%(圖8c)(*p<0.05)。nef組與正常組相比,細胞中t-aoc、sod及mda含量未見明顯改變(圖8)。
實驗結果說明甲基蓮心堿可以增強huvecs細胞的抗氧化能力,降低lps刺激引起的氧化損傷。
本申請的上述結果說明甲基蓮心堿通過降低ros的產生、降低組織/細胞氧化損傷,對保護多糖包被的完整性發揮保護作用,進而抑制ards的發生和發展,預防或治療ards。
以上結合附圖示例性地說明了本申請的各實施例。本領域技術人員根據本說明書公開的內容可以很容易地想到,可以根據實際需要對各實施例進行適當調整和重新組合,而不會脫離本申請的精神。本申請的保護范圍以本申請的權利要求書為準。
- 還沒有人留言評論。精彩留言會獲得點贊!