一種軟骨組織工程修復支架及其制備方法與流程
本發明涉及一種軟骨組織工程修復支架及其制備方法。
背景技術:
軟骨組織工程是一種采用組織工程學方法構建軟骨組織的技術。軟骨組織工程的核心要素包括種子細胞、軟骨組織工程修復支架和生長因子。
軟骨組織工程修復支架能夠提供三維空間結構,有利于細胞的黏附、增殖,為細胞的生長提供良好的生長環境,通常將組織工程修復支架置于骨軟骨缺損區,用于缺損的填充修補,來促進軟骨組織和軟骨下骨的再生修復。常用的組織工程修復支架主要采用天然生物支架材料制備而成,其不僅能夠促進正常細胞外基質的生成及重塑,且在生物相容性、生物降解及成軟骨分化(即軟骨誘導能力)方面具有不可比擬的優勢。
生長因子可以調控軟骨細胞基質的合成、代謝以及軟骨形成。生長因子的緩釋是治療骨性關節炎中恢復關節軟骨功能的一個重要組成部分。在組織修復時必須考慮生物活性因子的類型,釋放的方法,時間和空間釋放所需達到的效果。而從促進軟骨修復的生長因子的研究現狀來看,多種生長因子共同釋放難以完全超越單一生長因子釋放的優勢在于需要改進生長因子在促軟骨再生過程中隨時間變化的表達。人們開始認識到,生長因子在空間和時間的精確調控緩釋方式應該可以引起更好的治療效果。
類似的利用乙酸-羥基乙酸共聚物(plga)微球不同共聚合物比例和微球直徑尺寸能夠達到多重突發釋放的方式已經在硫酸軟骨素治療骨性關節炎中應用。最近一項研究聯合類似聚丙烯腈預氧化纖維(opf)的復合材料,使用胰島素樣生長因子(insulin-likegrowthfactor,igf)中的igf-1和轉錄生長因子-β3(transfrominggrowthfactorβ3,tgf-β3在骨軟骨缺損部位聯合釋放進行組織修復,通過改變生長因子釋放動力學變化從而促進骨軟骨缺損區的修復。先前的研究已經證明軟骨細胞自身修復的能力,在損傷后的急性恢復其自身能夠增加內源性生長因子的表達。初始階段細胞內tgf-β1和igf-1增加表明自分泌和旁分泌的代謝的刺激,而后期通過持續增加tgf-β1的表達維持修復過程。這種釋放方式組合可以看作是一種軟骨修復控制下的生長因子釋放策略。
聚磷腈是一種醫用合成高分子材料,具有很好的生物相容性,可在大范圍內形成性能不同的共聚物藥物微球,可提高藥物的穩定性,實現藥物控釋或緩釋,具有很好的操作性,且無毒副作用。
技術實現要素:
本發明的目的在于提供一種可緩釋生長因子的軟骨組織工程修復支架及其制備方法。
第一方面,本發明提供了一種軟骨組織工程修復支架,包括:
多孔支架本體和附著在所述多孔支架上的包載有生長因子的聚磷腈微球。
優選地,所述多孔支架本體由生物天然材料制成。
更優選地,所述生物天然材料包括:蠶絲蛋白、纖維蛋白、膠原蛋白、明膠、瓊脂糖、藻酸鹽、透明質酸和殼聚糖中的至少一種。
優選地,所述多孔支架本體為脫鈣骨基質。
具體地,所述生長因子為轉錄生長因子-β、骨形態發生蛋白、胰島素樣生長因子、成纖維細胞生長因子、血小板源性生長因子和血管內皮生長因子中的至少一種。
優選地,所述生長因子為轉錄生長因子-β1和胰島素樣生長因子。
優選地,所述聚磷腈微球選自聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈]微球和/或聚[(甘氨酸乙酯)y(丙氨酸乙酯)(1-y)磷腈]微球,其中0.1≤x≤0.4,0.6≤y≤0.9。
優選地,所述包載有生長因子的聚磷腈微球為包載有轉錄生長因子-β1的聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈]微球和包載有胰島素樣生長因子的聚[(甘氨酸乙酯)y(丙氨酸乙酯)(1-y)磷腈]微球,其中0.1≤x≤0.4,0.6≤y≤0.9。
更優選地,所述包載有生長因子的聚磷腈微球為包載有轉錄生長因子-β1的聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]微球和包載有胰島素樣生長因子-1的聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]微球。
具體地,所述包載有生長因子的聚磷腈微球的制備方法為:
先將聚磷腈分散于二氯甲烷中;
之后向含有聚磷腈的二氯甲烷中加入油性表面活性劑,以及含有生長因子的水,形成初乳液,加入含有生長因子的水的體積小于二氯甲烷的體積;
然后對所述初乳液進行超聲處理;
再向超聲處理后的初乳液中加入穩定劑、水性表面活性劑以及水,攪拌處理,直至二氯甲烷揮發殆盡,得到含有包載有生長因子的聚磷腈微球的懸浮液;
最后對所述懸浮液反復進行洗滌和分離處理,之后冷凍干燥,得到包載有生長因子的聚磷腈微球。
第二方面,本發明提供了一種軟骨組織工程修復支架的制備方法,所述制備方法包括:
將所述包載有生長因子的聚磷腈微球和所述多孔支架本體置于磷酸緩沖液中預設時間,之后過濾處理,冷凍干燥,得到第一軟骨組織工程修復支架。
優選地,所述制備方法還包括:
向所述第一軟骨組織工程修復支架內注射含有包載有生長因子的聚磷腈微球的磷酸緩沖液,之后冷凍干燥,得到第二軟骨組織工程修復支架。
本發明實施例提供的技術方案的有益效果是:本發明實施例提供的軟骨組織工程修復支架中的多孔支架本體不但用于填充修補軟骨缺損區,還為包載有生長因子的聚磷腈微球提供三維空間,使包載有生長因子的聚磷腈微球滯留在軟骨缺損區,通過聚磷腈微球的降解,調控釋放其中的生長因子,改變生長因子釋放動力學變化來促進骨軟骨缺損區的修復。并且聚磷腈微球還具有生物相容性和降解無毒副作用。
附圖說明
圖1為實施例4制備的包載轉錄生長因子-β1的聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]微球的掃描電鏡照片;
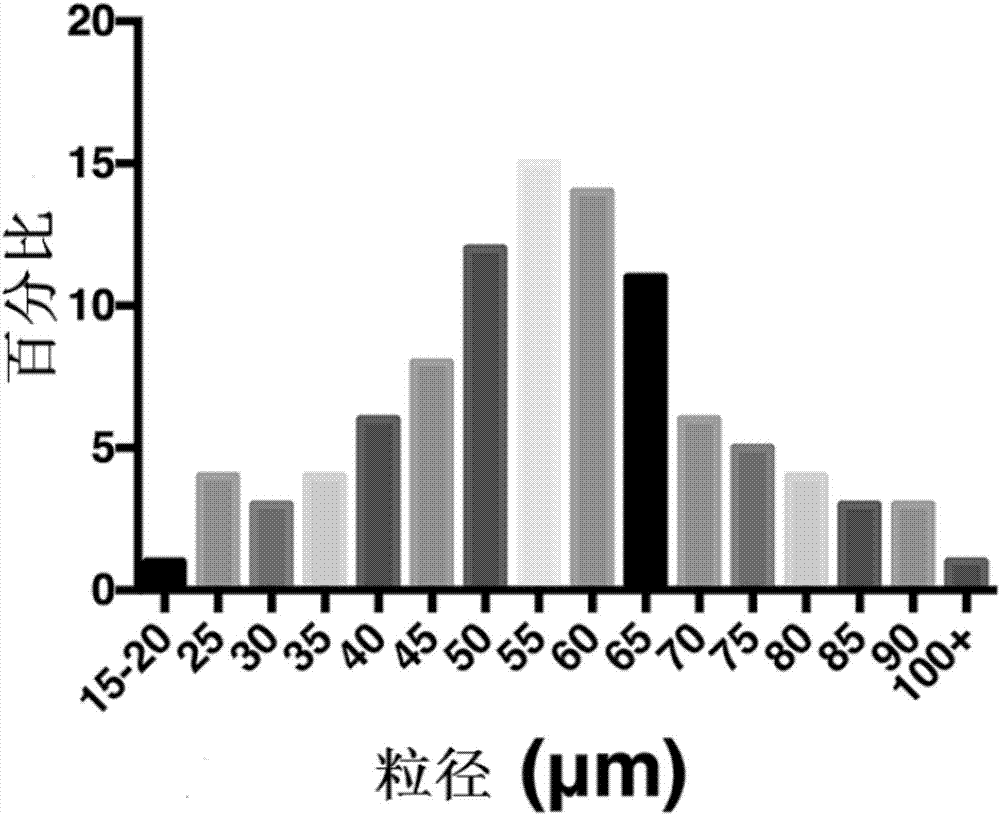
圖2為實施例4制備的包載轉錄生長因子-β1的聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]微球的粒徑直方圖;
圖3為實施例5制備的包載有胰島素樣生長因子-1的聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]微球的掃描電鏡照片;
圖4為實施例5制備的包載有胰島素樣生長因子-1的聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]微球的粒徑直方圖;
圖5為實施例4制備的tgf-β1+pagp70微球釋放tgf-β1的動力學曲線圖;
圖6為實施例5制備的igf-1+pagp30微球釋放igf-1的動力學曲線圖;
圖7為實施例4和實施5分別制備的tgf-β1+pagp70微球和igf-1+pagp30微球降解的掃描電鏡照片;
圖8為實施例7制備的pagp70微球與細胞活性關系圖;
圖9為實施例8制備的pagp30微球與細胞活性關系圖;
圖10為實施例7和實施例8分別制備的pagp70微球和pagp30微球與骨髓間充質干細胞的激光共聚焦顯微照片;
圖11為實施例11制備的tgf-β1+pagp70微球支架和igf-1+pagp30微球支架的掃描電鏡圖;
圖12為實施例11制備的四種支架與骨髓間充質干細胞共同培養的掃描電鏡圖;
圖13為實施例11制備的四種支架修復的新西蘭兔的軟骨缺損的照片;
圖14-1至圖14-3為實施例11制備的四種支架修復的新西蘭大白兔的軟骨缺損的組織切片圖;
圖14-4為圖14-1至圖14-3中新西蘭大白兔的軟骨缺損的虛線框中的組織切片的局部放大圖。
具體實施方式
為使本發明的技術方案和優點更加清楚,下面將結合附圖對本發明實施方式作進一步地詳細描述。
在本發明的第一方面,本發明實施例提供一種軟骨組織工程修復支架,包括:
多孔支架本體和附著在所述多孔支架上的包載有生長因子的聚磷腈微球。
本發明實施例提供的軟骨組織工程修復支架中的多孔支架本體不但用于填充修補軟骨缺損區,還為包載有生長因子的聚磷腈微球提供三維空間,使包載有生長因子的聚磷腈微球滯留在軟骨缺損區,通過聚磷腈微球的降解,調控釋放其中的生長因子,改變生長因子釋放動力學變化來促進骨軟骨缺損區的修復。并且聚磷腈微球還具有生物相容性和降解無毒副作用。
本發明實施例中的多孔支架本體由生物天然材料制成,由生物天然材料制成的多孔支架本體不但生物相容性好,而且降解產物無毒副作用。生物天然材料包括:蠶絲蛋白、纖維蛋白、膠原蛋白、明膠、瓊脂糖、藻酸鹽、透明質酸和殼聚糖中的至少一種,優選為蠶絲蛋白、纖維蛋白或膠原蛋白與明膠的混合制成的多孔支架本體,通過調節蠶絲蛋白、纖維蛋白或膠原蛋白與明膠的質量比,可以制作出不但機械強度高,而且降解速率與軟骨的再生速率相當的多孔支架本體。
本發明實施例中的多孔支架本體也可以為脫鈣骨基質。脫鈣骨基質脫除了免疫原性,具有很好的生物相容性,而且機械強度高,并且孔隙率高,可為包載有生長因子的聚磷腈微球提供更多的附著空間。
在本發明實施例中,生長因子優選為調節軟骨細胞基質的合成、代謝以及軟骨形成的生長因子,包括:轉錄生長因子-β、骨形態發生蛋白、胰島素樣生長因子、成纖維細胞生長因子、血小板源性生長因子和血管內皮生長因子中的至少一種。生長因子更優選為轉錄生長因子-β1和胰島素樣生長因子,其中胰島素樣生長因子包括:胰島素樣生長因子-1和胰島素樣生長因子-2,優選為胰島素樣生長因子-1。轉錄生長因子-β1和胰島素樣生長因子可以在軟骨修復的過程中,根據軟骨形成的不同階段,在時間上調控軟骨修復,并且可以根據軟骨形成的機制,調節轉錄生長因子-β1和胰島素樣生長因子的比例,通常二者的質量比可以為1:10-1:3,優選為1:5。
在本發明實施例中,所述聚磷腈微球選自聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈]微球和/或聚[(甘氨酸乙酯)y(丙氨酸乙酯)(1-y)磷腈]微球,其中0.1≤x≤0.4,0.6≤y≤0.9。聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈]微球相對于聚[(甘氨酸乙酯)y(丙氨酸乙酯)(1-y)磷腈]微球具有較強的疏水性,聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈]微球相對于聚[(甘氨酸乙酯)y(丙氨酸乙酯)(1-y)磷腈]微球在體內的降解速率慢,持續釋放生長因子的時間相對長,使得在體內包載在聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈]微球中的生長因子可以長期地發揮促進軟骨缺損修復的作用。
甘氨酸乙酯與丙氨酸乙酯共取代制備聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈],其中0.1≤x≤0.4的方法如下:
(1)通過六氯環三磷腈單體在無水無氧條件下,220-280℃開環聚合48-192小時,制備平均分子量為103-105da、聚合度為50~5000的線性聚二氯磷腈。將線性聚二氯磷腈溶于干燥四氫呋喃中得溶液a,其中-pncl2-單元的濃度為0.01-0.25毫摩爾/毫升。
(2)將丙氨酸乙酯鹽酸鹽溶于干燥四氫呋喃中,溶液濃度為0.01-0.25毫摩爾/毫升,向其中加入三乙胺,丙氨酸乙酯鹽酸鹽與三乙胺的摩爾比為1:2,回流6小時后減壓抽濾,得溶液b。
(3)將甘氨酸乙酯鹽酸鹽溶于干燥四氫呋喃中,溶液濃度為0.01-0.25毫摩爾/毫升,向其中加入三乙胺,甘氨酸乙酯鹽酸鹽與三乙胺的摩爾比為1:2,回流6小時后減壓抽濾,得溶液c。
(4)將步驟(2)準備的溶液b逐滴加入步驟(1)制備的溶液a,丙氨酸乙酯與-pncl2-單元的摩爾比為0.8:1-1.2:1,機械攪拌下,在35-60℃反應12-48hr,得反應混合物溶液d。
(5)將步驟(3)準備的溶液c逐滴加入步驟(4)制備的溶液d,甘氨酸乙酯與-pncl2-單元的摩爾比為0.3:1-0.7:1,機械攪拌下,在35-60℃反應12-48hr,得反應混合物溶液e。
(8)反應結束后,將反應混合物溶液e過濾,濾液經旋轉蒸發去除一部分四氫呋喃后得到粘稠狀液體,將此粘稠液體置于透析袋(截留分子量3500da)中,用四氫呋喃透析純化3天,每6-12小時更換一次溶劑。透析結束后,將透析袋內的溶液自然揮發、真空干燥即得聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈],其中0.1≤x≤0.4。
制備聚[(甘氨酸乙酯)y(丙氨酸乙酯)(1-y)磷腈],其中0.6≤y≤0.9的方法與上述聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈],其中0.1≤x≤0.4的區別僅在于,在步驟(4)中甘氨酸乙酯與-pncl2-單元的摩爾比為0.1:1-0.5:1,在步驟(5)中甘氨酸乙酯與-pncl2-單元的摩爾比為1:1-1.4:1。即可制備成聚[(甘氨酸乙酯)y(丙氨酸乙酯)(1-y)磷腈],其中0.6≤y≤0.9。
將聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈],其中0.1≤x≤0.4,聚[(甘氨酸乙酯)y(丙氨酸乙酯)(1-y)磷腈],其中0.6≤y≤0.9,分別制備成聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈]微球,其中0.1≤x≤0.4和聚[(甘氨酸乙酯)y(丙氨酸乙酯)(1-y)磷腈]微球,其中0.6≤y≤0.9的方法請參見實施例7和實施例8。
在本發明的實施例中,包載有生長因子的聚磷腈微球優選為包載有轉錄生長因子-β1的聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈]微球和包載有胰島素樣生長因子的聚[(甘氨酸乙酯)y(丙氨酸乙酯)(1-y)磷腈]微球,其中0.1≤x≤0.4,0.6≤y≤0.9。由于轉錄生長因子-β1可誘導充質干細胞,持續作用于軟骨修復過程,而胰島素樣生長因子可以促進軟骨細胞增殖、刺激細胞分泌細胞外基質及抑制細胞外基質降解酶,在軟骨修復的前期發揮著重要的作用。因此,將轉錄生長因子-β1包載在降解速率相對緩慢的聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈]微球,形成包載有轉錄生長因子-β1的聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈]微球,其中0.1≤x≤0.4,將胰島素樣生長因子-1包載在降解相對快速的聚[(甘氨酸乙酯)y(丙氨酸乙酯)(1-y)磷腈]微球中,形成包載有胰島素樣生長因子-1的聚[(甘氨酸乙酯)y(丙氨酸乙酯)(1-y)磷腈]微球,其中0.6≤y≤0.9,在時間和空間精確控制轉錄生長因子-β1和胰島素樣生長因子-1的釋放,以達到更好的修復軟骨缺損的效果。
進一步地,包載有生長因子的聚磷腈微球為包載有轉錄生長因子-β1的聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]微球和包載有胰島素樣生長因子的聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]微球。包載有轉錄生長因子-β1的聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]微球和包載有胰島素樣生長因子的聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]微球具有相對的疏水性和親水性,使二者在體內表現出不同的降解速率,這樣的降解速率差異更符合轉錄生長因子-β1和胰島素樣生長因子對軟骨的修復機制,從而更利于修復軟骨缺損。
本發明實施例中的包載有生長因子的聚磷腈微球,可以通過以下制備方法制得:
先將聚磷腈分散于二氯甲烷中;
之后向含有聚磷腈的二氯甲烷中加入油性表面活性劑,以及含有生長因子的水,形成初乳液,加入含有生長因子的水的體積小于二氯甲烷的體積;
然后對所述初乳液進行超聲處理;
再向超聲處理后的初乳液中加入穩定劑、水性表面活性劑以及水,攪拌處理,直至二氯甲烷揮發殆盡,得到含有包載有生長因子的聚磷腈微球的懸浮液;
最后對所述懸浮液反復進行洗滌和分離處理,之后冷凍干燥,得到包載有生長因子的聚磷腈微球。
從上述的包載有生長因子的聚磷腈微球的制備過程中可以看出,生長因子是在聚磷腈形成聚磷腈微球的過程中,同時包埋在聚磷腈微球中的,使聚磷腈微球作為生長因子的載體,在其降解的過程中,將生長因子緩慢釋放出來,促進軟骨缺損修復。
本發明實施例中的聚磷腈的分子式為:
其中,r1可以為氯、氨基酸酯,氨基酸酯,可以是甘氨酸、丙氨酸、纈氨酸、亮氨酸、異亮氨酸、蛋氨酸、苯丙氨酸、色氨酸、脯氨酸的甲酯、乙酯、丙酯、異丙酯和丁酯中的任意一種;
r2可以為氯、氨基酸酯,氨基酸酯,可以是甘氨酸、丙氨酸、纈氨酸、亮氨酸、異亮氨酸、蛋氨酸、苯丙氨酸、色氨酸、脯氨酸的甲酯、乙酯、丙酯、異丙酯和丁酯中的任意一種;
r1與r2可以相同也可以不同,r1與r2的摩爾比相加為1。
本發明實施例中所使用的生長因子為如前文所提及的生長因子,在此不作贅述。
下面對包載有生長因子的聚磷腈微球的制備過程進行解釋說明。如下:
聚磷腈與二氯甲烷的比例可以為2%-5%(w/v);
所使用的油性表面活性劑可以降低二氯甲烷的表面張力,油性表面活性劑具體可以為失水山梨醇單油酸酯溶液(俗稱司班80溶液);
加入含有生長因子的水,并且加入的體積小于二氯甲烷的體積,是為了使二氯甲烷包住水和其中的生長因子,含有生長因子的水團聚成一個個小球;
對初乳液進行超聲處理,超聲處理的目的是使形成的小球的粒徑比較均勻,超聲處理的功率可以為150-250w,超聲處理的時間可以為8-3min;
向超聲處理后的初乳液中加入穩定劑、水性表面活性劑以及水,降低水表面的張力,形成外水向,即水包住二氯甲烷,穩定劑可以為聚乙烯醇或明膠,水性表面活性劑可以為聚氧乙烯山梨糖醇酐單硬酸酯(俗稱吐溫60);
攪拌的速率可以為1000轉/min,待二氯甲烷揮發殆盡后可以停止攪拌,對所含有雜質的包載有生長因子的聚磷腈微球反復水洗,水洗次數可以為3至5次,將殘留在包載有生長因子的聚磷腈微球的試劑清除。
在本發明第二方面,本發明實施例還提供了一種軟骨組織工程修復支架的制備方法,所述制備方法包括:將所述包載有生長因子的聚磷腈微球和所述多孔支架本體置于磷酸緩沖液中預設時間,之后過濾處理,冷凍干燥,得到第一軟骨組織工程修復支架。
在本發明實施例中,磷酸緩沖液(pbs)的ph值可以為6.8-7.4。此處所提及的預設時間可以為5分鐘以上,使包載有生長因子的聚磷腈微球與多孔支架本體充分接觸,盡可能地使更多的包載有生長因子的聚磷腈微球附著在多孔支架本體的孔隙中。
為了使多孔支架本體上附著更多的包載有生長因子的聚磷腈微球,所述制備方法還包括:向所述第一軟骨組織工程修復支架內注射含有包載有生長因子的聚磷腈微球的磷酸緩沖液,之后冷凍干燥,得到第二軟骨組織工程修復支架。
在實施的過程中,可以利用注射器吸取含有包載有生長因子的聚磷腈微球的磷酸緩沖液注射到多孔支架本體的孔隙中,增加多孔支架本體對包載有生長因子的聚磷腈微球的負載量,更多的生長因子更有利于軟骨的形成。
實施例1
本發明實施例提供了一種甘氨酸乙酯與丙氨酸乙酯共取代聚膦腈的方法。該方法如下:
(1)通過六氯環三磷腈單體在無水無氧條件下,220-280℃開環聚合48-192小時,制備平均分子量為103-105da、聚合度為50~5000的線性聚二氯磷腈。將線性聚二氯磷腈溶于干燥四氫呋喃中得溶液a,其中-pncl2-單元的濃度為0.01-0.25毫摩爾/毫升。
(2)將丙氨酸乙酯鹽酸鹽溶于干燥四氫呋喃中,溶液濃度為0.01-0.25毫摩爾/毫升,向其中加入三乙胺,丙氨酸乙酯鹽酸鹽與三乙胺的摩爾比為1:2,回流6小時后減壓抽濾,得溶液b。
(3)將甘氨酸乙酯鹽酸鹽溶于干燥四氫呋喃中,溶液濃度為0.01-0.25毫摩爾/毫升,向其中加入三乙胺,甘氨酸乙酯鹽酸鹽與三乙胺的摩爾比為1:2,回流6小時后減壓抽濾,得溶液c。
(4)將步驟(2)準備的溶液b逐滴加入步驟(1)制備的溶液a,丙氨酸乙酯與-pncl2-單元的摩爾比為1:1,機械攪拌下,在35-60℃反應12-48hr,得反應混合物溶液d。
(5)將步驟(3)準備的溶液c逐滴加入步驟(4)制備的溶液d,甘氨酸乙酯與-pncl2-單元的摩爾比為0.5:1,機械攪拌下,在35-60℃反應12-48hr,得反應混合物溶液e。
(8)反應結束后,將反應混合物溶液e過濾,濾液經旋轉蒸發去除一部分溶劑后得到粘稠狀液體,將此粘稠液體置于透析袋(截留分子量3500da)中,用四氫呋喃透析純化3天,每6-12小時更換一次溶劑。透析結束后,將透析袋內的溶液自然揮發、真空干燥,即得聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]。
實施例2
與實施例1的區別僅在于,丙氨酸乙酯與-pncl2-單元的摩爾比為0.3:1,甘氨酸乙酯與-pncl2-單元的摩爾比為1.2:1,制得的產物為聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]。
實施例3
分別對實施例1和實施例2制得的聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]和聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]進行核磁共振(nuclearmagneticresonance,簡稱nmr)檢測。將聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]和聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]分別溶解于氘代氯仿(cdcl3)中,結果如表1所示:
表1磷元素和氫元素核磁共振檢測
其中,pagp70代表聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈],pagp30代表聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈];gly代表甘氨酸乙酯,ala代表丙氨酸乙酯。
實施例4
本發明實施例提供了一種雙乳液法制備包載有轉錄生長因子-β1的聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]微球的方法。方法如下:
稱取實施例1制得的聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]0.6g溶于20ml二氯甲烷中,磁力攪拌以保證溶解完全;
然后加入2ml質量分數為1%的司班80溶液、2ml含有40微克/毫升轉錄生長因子-β1的去離子水,配制成初乳液;
將配制好的初乳液進行超聲處理,超聲功率為200w,超聲時間為3min;
向超聲處理后的初乳液中加入200ml質量分數為1%的聚乙烯醇溶液和2ml10%吐溫60溶液,攪拌1000轉/分,待二氯甲烷揮發4h后,停止攪拌,先用去去離子水洗滌、過濾后再離心,如此反復操作5遍,直至將殘留在包載有轉錄生長因子-β1(tgf-β1)的聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]微球中的聚乙烯醇清除掉,之后冷凍干燥機中冷凍干燥36小時,得到如圖1所示的包載有轉錄生長因子-β1(tgf-β1)的聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]微球,記為tgf-β1+pagp70微球。
圖2為包載轉錄生長因子-β1(tgf-β1)的聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]微球的粒徑直方圖,由圖2可知,tgf-β1+pagp70微球的平均粒徑為54.22±19.19μm。
實施例5
本發明實施例提供了一種雙乳液法制備包載有胰島素樣生長因子-1的聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]微球的方法。方法如下:
稱取實施例2制得的聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]0.6g溶于20ml二氯甲烷中,磁力攪拌以保證溶解完全;
然后加入2ml質量分數為1%的司班80溶液、2ml含有200微克/毫升胰島素樣生長因子-1(igf-1)的去離子水,配制成初乳液;
將配制好的初乳液進行超聲處理,超聲功率為200w,超聲時間為3min;
向超聲處理后的初乳液中加入200ml質量分數為1%的聚乙烯醇溶液和2ml10%吐溫60溶液,攪拌1000轉/分,待二氯甲烷揮發4h后,停止攪拌,先用去去離子水洗滌、過濾后再離心,如此反復操作5遍,直至將殘留在包載有igf-1的聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]微球中的聚乙烯醇清除掉,冷凍干燥機中冷凍干燥36小時,得到如圖3所示的包載有igf-1的聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]微球,記為igf-1+pagp30微球。
圖4為包載有胰島素樣生長因子-1的聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]微球的粒徑直方圖,由圖4可知igf-1+pagp30微球的平均粒徑為34.11±18.82μm。
實施例6
分別對實施例4和實施例5制備的tgf-β1+pagp70微球和igf-1+pagp30微球進行降解實驗。
分別稱取5毫克tgf-β1+pagp70微球和igf-1+pagp30微球分別浸入1mlph值為7的磷酸緩沖溶液(pbs)中,并置于溫度為37℃,轉速為40rpm的搖床中。在預定的時間點(1,2,4,7,10,14,21,28,35和42天),通過離心分離分別采集上清液后,再補充pbs對兩種微球進行再懸浮。通過elisa檢測試劑盒分別測定上清液中tgf-β1和igf-i的含量,結果分別如圖5和圖6所示。同時,通過掃描電鏡監測兩種微球長達90天的降解形態,結果如圖7所示。
由圖5的結果可知,tgf-β1+pagp70微球釋放tgf-β1主要有兩個的階段,在第1天,tgf-β1+pagp70微球累積釋放tgf-β1占其所包載的tgf-β1總量的33.09%±7.24%,隨后緩慢持續釋放,在第42天,tgf-β1+pagp70微球累積釋放tgf-β1占其所包載的tgf-β1總量的82.63%±5.08%。
由圖6的結果可知,在第1天igf-1+pagp30微球累積釋放igf-1為61.74%±8.57%,在第28天,igf-1+pagp30微球累積釋放igf-1為98.24%±1.43%,也就是說,igf-1+pagp30微球包載的igf-1幾乎釋放完畢。說明igf-1+pagp30微球釋放igf-1快于tgf-β1+pagp70微球釋放tgf-β1。
由圖7的結果可知,tgf-β1+pagp70微球的外表面較光滑,有許多不規則的孔,在15天內的降解過程中,外形保持完整,在第30天形態發生變化,外表面出現較多的裂紋,孔徑也在變大;igf-1+pagp30微球相對于tgf-β1+pagp70微球具有粗糙的表面和更密集的孔,15天以后其表面粗糙度明顯增加,在第90天球形結構完全破裂,其降解速率明顯快于tgf-β1+pagp70微球。
綜合圖5、圖6和圖7的結果可知,生長因子的釋放動力學與上述微球的降解速率正相關。igf-1+pagp30微球具有較快降解速率,因此,igf-1在其降解前期表現出火山噴發般地釋放,而tgf-β1+pagp70微球相對于igf-1+pagp30微球具有疏水性,因而降解速率相對較慢,可以緩慢地釋放tgf-β1。這樣的釋放方式與軟骨修復過程中對tgf-β1和igf-1的需要相符合,可以更好地促進受損軟骨的修復。
通過tgf-β1+pagp70微球和igf-1+pagp30微球分別在制備過程中tgf-β1和igf-1的用量,以及在二者降解過程中tgf-β1和igf-1的釋放量,分別計算這兩種微球中tgf-β1和igf-1的加載量,結果為tgf-β1+pagp70微球中tgf-β1的加載量為90.34納克/毫克,igf-1+pagp30微球中igf的加載量為569.57納克/毫克。
實施例7
本發明實施例提供了一種雙乳液法制備聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]微球的方法。
實施例7與實施例4的區別僅在于實施例7中去離子水不含有轉錄生長因子-β1,從而制成了聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]微球,記為pagp70微球。
實施例8
本發明實施例提供了一種雙乳液法制備聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]微球。
實施例8與實施例5的區別僅在于實施例8中的去離子水不含有胰島素樣生長因子-1,從而制成了聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]微球,記為pagp30微球。
實施例9
測定實施例7制備的聚[(甘氨酸乙酯)0.3(丙氨酸乙酯)0.7磷腈]微球和實施例8制備的聚[(甘氨酸乙酯)0.7(丙氨酸乙酯)0.3磷腈]微球對細胞毒性和與骨髓間充質干細胞的的生物相容性。
骨髓間充質干細胞(bmscs)源自于六周大的spragueedawley(sd)大鼠,并經過兩次繼代培養的骨髓間充質干細胞。
繼代培養的具體操作為:
將骨髓間充質干細胞培養在α-dmem培養基含10%(v/v)血清和誘導分化的軟骨細胞分化培養基(rasmx-90041;賽業生物公司、森尼維耳、ca、美國)于37℃5%濃度的co2條件下孵育。
細胞活性檢測:
于96孔中每個孔接種5×103個bmscs,分為pagp70微球組和pagp30微球組,其中兩組中的各自微球的濃度梯度均為0.125、0.25、0.5、1.0和2.0mg/ml,并且分別在孵育第1天、第3天和第5天加入10μlcck-8(dojindo美國)和200μlα-dmem培養基,利用的酶標儀在450nm波長下測定吸光度,結果如圖8和圖9所示:采用cck-8法檢測細胞活性,隨著pagp70微球和pagp30微球用量增加,pagp70微球組和pagp30微球組的細胞存活率均略有下降,5天培養后這兩組的細胞存活率均在70%以上。此結果證明,本發明實施例中的聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈]微球和聚[(甘氨酸乙酯)y(丙氨酸乙酯)(1-y)磷腈]微球,其中0.1≤x≤0.4,0.6≤y≤0.9,不會增加bmscs細胞毒性反應,不會引起炎癥反應,2毫克/毫升以下濃度為安全濃度。
生物相容性檢測:
6×105個骨髓間充質干細胞(bmscs)分別與2毫克pagp70微球和pagp30微球接種在激光共聚焦小皿內單層共培養24h,與羅丹明-鬼筆環肽染色(160nm;細胞骨架的公司,丹佛、co、美國)1小時37℃、復染用hoechst33258(1:800;西格瑪,圣路易斯,穆村,美國),在激光共聚焦顯微鏡(sp2倒置顯微鏡;徠卡,曼海姆,德國)下觀察,結果如圖10所示:pagp70微球和pagp30微球的多孔的表面適合細胞粘附。也就是說,本發明實施例中的聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈]微球和聚[(甘氨酸乙酯)y(丙氨酸乙酯)(1-y)磷腈]微球,其中0.1≤x≤0.4,0.6≤y≤0.9生物相容性好。
實施例10
本發明實施例提供了一種脫鈣骨基質的制備方法,該制備方法如下:
將股骨上附著的肌肉、筋膜、脂肪等軟組織剔去,僅保留骨性成分。修整的股骨進行切割,選取骨骺端,利用生理鹽水沖洗殘留的骨髓3次。將沖洗后的骨骺切割成4×4×2cm3大小的骨塊,懸浸于脫脂液(甲醇∶氯仿=1:1v/v)內,進行脫脂處理48小時;
脫鈣液配制:用去離子水配制0.5m乙二胺四乙酸脫鈣液,控制其ph=8.3,脫鈣液保存及脫鈣過程均在4℃下用塑料容器盛載(避免玻璃容器);
生理鹽水沖洗脫脂后骨塊,浸泡于脫鈣液中,脫鈣液每日更換。脫鈣完全度檢測:每日換下的脫鈣液用原子吸收分光光度計檢測鈣離子濃度以監測脫鈣進程,當脫鈣液中的鈣(ca)螯合物濃度<0.5g/l,即為完全脫鈣,得到脫鈣骨基質。
實施例11
本發明實施例提供了一種軟骨組織工程修復支架的制備方法,該制備方法如下:
分別將磷酸緩沖液,含有2mg/ml的tgf-β1+pagp70微球的磷酸緩沖液、含有2mg/ml的igf-1+pagp30微球的磷酸緩沖液,以及含有1mg/ml的tgf-β1+pagp70微球和1mg/ml的igf-1+pagp30微球的磷酸緩沖液,其中磷酸緩沖液的ph值均為7.4,滴加到脫鈣骨基質上,并冷凍干燥,從而制備出脫鈣骨基質支架、tgf-β1+pagp70微球支架、igf-1+pagp30微球支架、以及tgf-β1+pagp70微球和igf-1+pagp30微球支架。tgf-β1+pagp70微球支架、igf-1+pagp30微球支架的掃描電鏡圖如圖11所示,表明包載有tgf-β1的聚[(甘氨酸乙酯)x(丙氨酸乙酯)(1-x)磷腈]微球,其中0.1≤x≤0.4可粘附在脫鈣骨基質上,包載有igf-1的聚[(甘氨酸乙酯)y(丙氨酸乙酯)(1-y)磷腈]微球,其中0.6≤y≤0.9可粘附在脫鈣骨基質上,軟骨組織工程修復支架制備成功。
對上述這四種支架在含有1×106個骨髓間充質干細胞(bmscs)的懸浮液培養三天后,添加鈣黃綠和乙二聚體試劑(invitrogen公司、美國)30分鐘后利用tcs-sp8共焦顯微鏡分別在488nm和568nm的激發光下觀察四種支架上細胞的整體分布情況,并從不同的層面得到的三維結構圖像。結果如圖12所示,其中,綠色熒光表明活細胞,而紅色熒光表明死細胞;每個區域的總體積為1740×1740×240μm3(x,y,z軸)。可見,脫鈣骨基質支架的綠色熒光最少,說明其上骨髓間充質干細胞粘附和存活的少,而tgf-β1+pagp70微球支架、igf-1+pagp30微球支架、以及tgf-β1+pagp70微球和igf-1+pagp30微球支架上的綠色熒光較多,說明這三種支架可有效地支持骨髓間充質干細胞的粘附和增殖。
實施例12
本發明實施例提供了對實施例11制備的四種支架進行動物體內關節軟骨缺損重建實驗。具體步驟如下:
36只新西蘭大白兔,體重2.5~3.0kg,隨機分為四組,即脫鈣骨基質支架組、tgf-β1+pagp70微球支架組、igf-1+pagp30微球支架組、以及tgf-β1+pagp70微球和igf-1+pagp30微球支架組。在兔膝關節內側髕旁行縱向切口切開關節囊,髕骨外翻后顯露膝關節。在兔股骨滑車溝區使用角膜環鉆制造軟骨缺損(直徑為4毫米,深度3毫米),利用微骨折技術釋放缺損區骨髓間充質干細胞后分別填充上述四種支架。分別在術后6周,12周和24周,對組織修復進行大體觀察,結果如圖13所示,術后6周時脫鈣骨基質支架組的軟骨缺損未有效填補,缺損仍很明顯。而在tgf-β1+pagp70微球支架組、igf-1+pagp30微球支架組、以及tgf-β1+pagp70微球和igf-1+pagp30微球支架組雖然軟骨缺損仍然存在,但其表面均覆蓋有白色半透明再生組織。隨著時間的推移,12周時脫鈣骨基質支架缺損區中心部仍存在,而tgf-β1+pagp70微球支架組、igf-1+pagp30微球支架組、以及tgf-β1+pagp70微球聯合igf-1+pagp30微球支架組修復的再生組織光滑并且與周圍正常軟骨有明顯的連接。第24周時,tgf-β1+pagp70微球支架組、igf-1+pagp30微球支架組、以及tgf-β1+pagp70微球和igf-1+pagp30微球支架組均有一個模糊的邊界,再生軟骨組織的表面類似于相鄰的正常軟骨,由此可以看出,tgf-β1+pagp70微球支架、igf-1+pagp30微球支架、以及tgf-β1+pagp70微球和igf-1+pagp30微球支架對受損軟骨的修復效果均優于脫鈣骨基質支架,并且tgf-β1+pagp70微球和igf-1+pagp30微球支架對受損軟骨的修復效果最好。
分別對術后6,12周和24周的軟骨缺損進行組織學評價。新西蘭大白兔的股骨遠端置于4%多聚甲醛溶液中固定48小時,再置于實施例10提及的脫鈣液中7天,通過脫水,石蠟包埋,制成切片,進行h&e染色、番紅-o染色和ii型膠原免疫組化染色,其結果分別如圖14-1至14-3所示。在術后6周,軟骨缺損組織修復如圖14-1所示,在脫鈣骨基質支架組軟骨缺損區的邊緣仍存在間隙,軟骨細胞外基質粘多糖(gag)紅染在番紅-o染色中并未發現新生組織,而在其他三組均可見新生組織填塞缺損區。經過12周的愈合,如圖14-2所示,h&e染色觀察軟骨下骨再生結構,其他三組明顯比脫鈣骨基質支架組新生骨組織多,并且微球支架組均有明顯的軟骨下骨橋連接,這在tgf-β1-pagp70微球組以及tgf-β1+pagp70微球和igf-1+pagp30微球支架組更為明顯,說明包載有生長因子的支架更有利于促進軟骨下骨新生骨組織修復,并且二型膠原免疫組化染色提示含有微球的支架組中新生軟骨組織中細胞外基質中二型膠原含量更高。如圖14-3所示在24周,脫鈣骨基質支架組的缺損區填充一層薄薄的纖維軟骨,并且新生軟骨表層多出現無軟骨細胞區域,tgf-β1-pagp70微球組以及tgf-β1+pagp70微球和igf-1+pagp30微球支架組中的缺損區的修復組織表現為均勻的番紅-o紅染新生軟骨,新生軟骨組織中gag含量明顯較脫鈣骨基質支架組的高。
圖14-4對番紅-o染色切片的再生修復組織邊緣進行高倍圖像采集(n代表缺損區邊緣的正常軟骨;r代表缺損區的新生軟骨組織),在第6周時,脫鈣骨基質支架組的正常軟骨與再生軟骨之間仍存在裂隙,而其他三組的再生軟骨和正常軟骨區整合度比脫鈣骨基質支架組高。在12周時,脫鈣骨基質支架組的新生軟骨組織和正常區軟骨組織仍然存在結構上的差異,番紅-o染色為綠染,而其他三組的再生骨組織可見清晰的軟骨細胞結構,并且細胞外基質染色為紅染,表明軟骨細胞外基質中粘多糖含量明顯增多,這對新生軟骨組織的抗壓縮能力及軟骨細胞微環境的建立均有明顯促進作用。最后在24周時其他三組新生軟骨組織和周圍正常軟骨組織結構更為相似,這其中tgf-β1+pagp70微球和tgf-β1+pagp70微球和igf-1+pagp30微球支架組表現出更佳的新生軟骨組織完整性,尤其是tgf-β1+pagp70微球和igf-1+pagp30微球支架組。
由上述實施例可知,本發明提供的軟骨組織工程修復支架能夠明顯促進骨軟骨缺損的修復速度和軟骨再生效果,能夠在一期手術治療中同時發揮生長因子時空緩釋刺激促進軟骨組織修復,可為組織工程提供新的思路,具有廣泛的臨床應用前景。
以上所述僅是為了便于本領域的技術人員理解本發明的技術方案,并不用以限制本發明。凡在本發明的精神和原則之內,所作的任何修改、等同替換、改進等,均應包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!