一種納米載藥系統(DOX?RGD?BSA@AuNCs)藥物傳遞和生物成像的制作方法
本發明涉及生物制藥技術領域,更具體的說是涉及一種納米載藥系統(dox-rgd-bsa@auncs)藥物傳遞和生物成像。
背景技術:
腫瘤,尤其是惡性腫瘤—癌癥是人類死亡的主要原因。為了提高腫瘤的診斷和治療效果,靶向腫瘤生物成像和藥物傳遞成為了重要的醫療手段。
近年來隨著納米技術的發展和廣泛應用,納米載藥系統成為當前國際藥學界的研究前沿和研究熱點。金納米簇(auncs)的粒徑大部分都小于2nm,因為納米簇的尺寸大小接近電子費米波長,使得狀態的連續能量強度分解成了離散的能級,導致了它獨特的光學和電化學特性。這種超小粒徑還賦予了它更多不同于傳統納米粒子和有機熒光染料的特性。金屬納米簇作為一種具有超小粒徑、低毒性、獨特光學和理化性質的納米材料,是理想的靶向腫瘤成像熒光納米材料。可通過透射電鏡(tem)以及微粒粒度及表面電位分析儀分別對納米載藥系統進行了形貌、粒徑與表面電位的表征。
谷胱甘肽是谷氨酸、半胱氨酸和甘氨酸組成的三肽,在人體中具有解毒和抗氧化的功能。在腫瘤部位,過多的氧化型谷胱甘肽(gssg)被谷胱甘肽還原酶轉換成具有還原型的谷胱甘肽(gsh),因此腫瘤細胞中的還原性的谷胱甘肽的濃度遠遠高于正常組織細胞還原型谷胱甘肽的濃度,研究表明:腫瘤細胞內的gsh含量約為2~10mm,是正常細胞內gsh含量的7倍,是細胞外gsh含量的100-1000倍。其中半胱氨酸上的巰基能夠與某些藥物、毒素等結合,因此谷胱甘肽能夠在生物轉化中把有機體內的有害物質排出體外。
為了能夠更有效地實現金納米簇的在體腫瘤診斷或治療,選擇一種合適的生物配體使得金納米簇能選擇性的傳遞至腫瘤細胞是很有必要的。腫瘤細胞或腫瘤細胞新生血管會特異性的高度表達出某些整合素受體,如整合素αvβ3,在正常細胞或組織的血管中含量就很少。rgd是由精氨酸、甘氨酸和天冬氨酸組成的三肽(arg-gly-asp),能夠特異性識別整合素αvβ3,有助于藥物與細胞靶向結合并進入細胞,抑制腫瘤細胞或腫瘤血管的生成。
目前大部分納米載藥系統的專利僅單方面涉及藥物傳遞或者腫瘤成像。例如中國發明專利“一種阿霉素共載藥系統、其制備方法及應用”公開了一種表面具有靶向配體的阿霉素載藥系統的制備方法;中國發明專利“一種rgd標記的熒光金納米簇的制備方法”公開了一種以rgd做靶向配體的熒光納米探針方法。而本發明制備的工藝還未見報道,尤其是一種具有靶向特異性的阿霉素金納米簇載藥系統。
因此,如何研制出一種既能高效靶向殺死腫瘤又對治療進行實時監控的載藥系統是本領域技術人員亟需解決的問題。
技術實現要素:
有鑒于此,本發明提供了一種納米載藥系統(dox-rgd-bsa@auncs)藥物傳遞和生物成像,不僅可以傳遞阿霉素化療藥物并將它們釋放在腫瘤區,使健康組織免于毒副作用,而且應用金納米簇載體的熒光特性,可以幫助醫生通過顯微鏡掃描看到腫瘤,能夠對治療進行實時監控。
為了突破納米載藥系統僅單方面涉及藥物傳遞或者生物成像的局限性,本發明提供如下技術方案:
一種納米載藥系統(dox-rgd-bsa@auncs)的藥物傳遞,其特征在于,包括如下步驟:
步驟1,金納米簇(auncs@bsa)的制備方法:
步驟1.1,量取質量分數為1%的氯金酸溶液1.7ml,加入3.3ml去離子水,得到5ml、10mm氯金酸溶液;
步驟1.2,稱取250mlbsa,溶解在5ml去離子水中,得到5ml、50mg/mlbsa溶液;
步驟1.3,稱取20mgnaoh,溶解在0.5ml去離子水中,得到1mnaoh溶液;
步驟1.4,將配制好的5ml(10mm)的氯金酸溶液加入到5ml(50mg/ml)的bsa溶液,控溫37℃,劇烈攪拌5min;
步驟1.5,將1mnaoh水溶液加入到上述混合溶液中,并且持續劇烈攪拌上述反應物,控溫37℃,持續時間12~24h;
步驟1.6,將得到的產物冷卻至室溫,裝進mwco100000透析袋中,透析外液用水,維持外界溫度4℃,透析12~24h,并用葡萄糖凝膠過柱,以除去多余的bsa,從而得到金納米簇;
步驟2,rgd-bsa@auncs的制備方法:
步驟2.1,取2ml金納米簇加入到8mlpbs緩沖溶液(ph=7.4,20mm)中,得到金納米簇溶液;
步驟2.2,取4ml金納米簇溶液,在其中加入15~30mg的edc,避光條件室溫下反應20min;
步驟2.3,加入15~20mg的nhs,在避光條件下劇烈攪拌1h,得到混合液;
步驟2.4,向上述混合液中加入c(rgd)fk溶液(100ul,10mg/ml),室溫下攪拌反應12~24h;
步驟2.5,反應后,將反應溶液裝進mwco100000透析袋中,透析外液用水,維持外界溫度4℃,透析12~24h,并且反應產物用截留量為10kda的超濾離心管中離心(3000xg,20min),去除過量反應物,得到的產物溶于2mlpbs緩沖溶液中,且放置在4℃的冰箱內部保存,得到rgd-bsa@auncs;
步驟3,dox-rgd-bsa@auncs的制備方法:
步驟3.1,將制得的rgd-bsa-auncs和1.5mg的spdp加入到含有1mmedta的pbs緩沖溶液中,室溫下反應4h,得到的反應產物裝進mwco100000透析袋中,透析外液用水,維持外界溫度4℃,透析12~24h,得到rgd-bsa@auncs;
步驟3.2,將鹽酸阿霉素(1.5mg,2.6×10-6mol)和2-亞氨基硫烷鹽酸鹽(0.36mg,0.36×10-6mol)的混合物加入到含有1mmedta的psb緩沖液中,室溫下反應4h,得到dox-sh(巰基dox修飾的鹽酸阿霉素);
步驟3.3,過量的dox-sh和rgd-bsa@auncs反應,得到dox-rgd-bsa@auncs溶液;
步驟3.4,將步驟3.3中的dox-rgd-bsa@auncs溶液加入到pbs緩沖溶液中,然后裝進mwco100000透析袋中,透析外液用水,維持外界溫度4℃,透析12~24h,得到dox-rgd-bsa@auncs;
步驟4,谷胱甘肽(gsh)的檢測:
步驟4.1,分別配制2mm、4mm、6mm、8mm、10mm的gsh;
步驟4.2,分別取步驟4.1中的gsh100ul,將其加入到納米載藥系統(dox-rgd-bsa@auncs)中,并加入pbs緩沖溶液使得反應體系的總體積為1ml,維持37℃反應4小時;
步驟4.3,將反應產物置于截留量為10kda的超濾離心管進行離心(3000xg,20min),并且將分離后的上、下溶液進行熒光檢測。
優選的,步驟1.5中,反應溶液的ph為12,并且37℃下反應24h。
優選的,步驟2.4中,c(rgd)fk溶液的濃度為10mg/ml,并且室溫下攪拌反應24h。
優選的,步驟3.2中,鹽酸阿霉素和2-亞氨基硫烷鹽酸鹽等摩爾反應4小時。
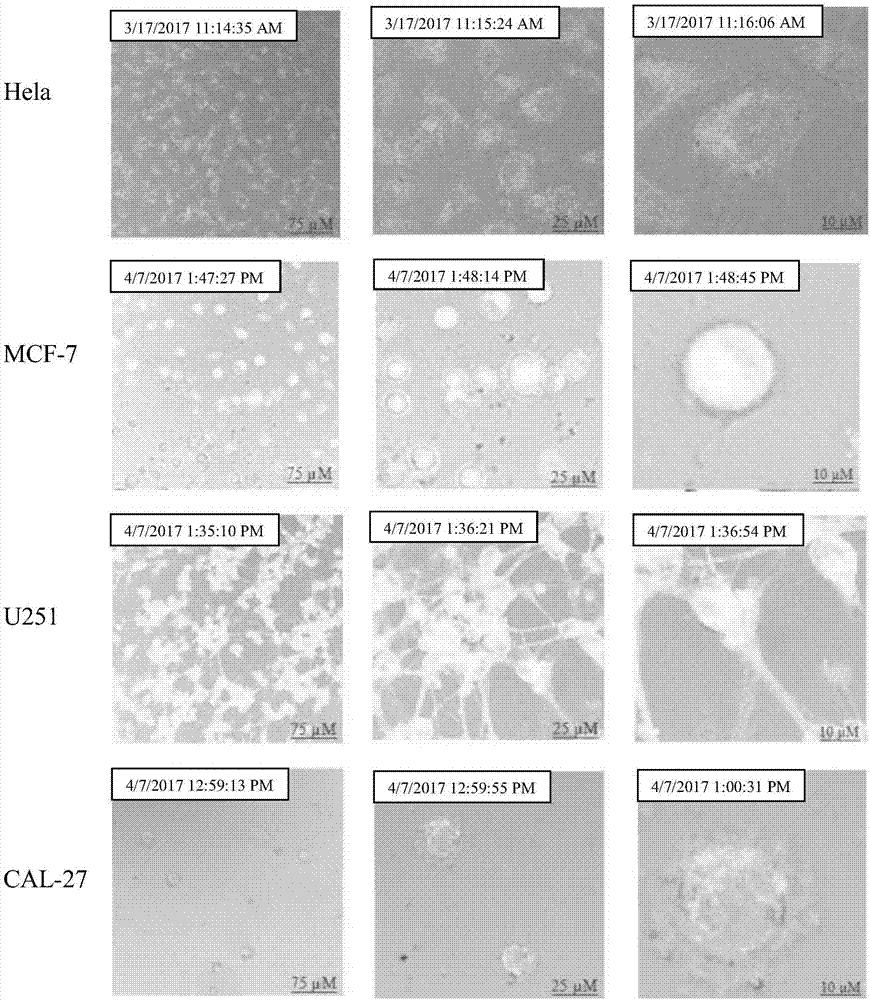
一種納米載藥系統(dox-rgd-bsa@auncs)的生物成像,其特征在于,包括如下步驟:在無菌環境下,將hela、mcf-7、u251、cal-27四種癌細胞細胞分別在培養基中生長,待細胞進入快速生長時期時,取0.5ml的dox-rgd-bsa@auncs溶液加入到細胞培養液中,孵化0、3、6小時在激光共聚焦顯微鏡觀察細胞形態,為了更好的觀察細胞成像以及細胞形態的變化,將培養皿在激光共聚焦顯微鏡下連續觀察6小時,每5分鐘拍一次照片。
優選的,在上述一種納米載藥系統(dox-rgd-bsa@auncs)的生物成像中,所述四種癌細胞加入dox-rgd-bsa@auncs溶液后,在激光共聚焦下觀察細胞形態。
本發明以牛血清蛋白(bsa)為還原劑合成的金納米簇(bsa@aunc)為載體,利用通過bsa氨基酸中的羧基和rgd的氨基通過酰胺化反應連接在一起,又利用雙管能團連接劑spdp將巰基化的dox的巰基與bsa的氨基進行交聯,制備出具有靶向特異性的納米載藥系統(dox-rgd-bsa@auncs)。進入細胞后,由于腫瘤細胞中含有大量的谷胱甘肽(gsh),能夠將連接阿霉素和納米簇的雙硫鍵剪切,從而成功地將藥物在腫瘤細胞中進行釋放。通過透射電鏡(tem)以及微粒粒度及表面電位分析儀分別對納米載藥系統進行了形貌、粒徑與表面電位的表征。以宮頸癌細胞(hela)、乳腺癌細胞(mcf-7)、口腔癌細胞(cal-27)和膠質瘤細胞(u251)為研究對象,通過激光共聚焦(clsm)及流式細胞儀對納米載藥系統進入細胞以及藥物治療的情況進行檢測,并且與正常細胞進行對比。
經由上述的技術方案可知,與現有技術相比,本發明公開提供了一種納米載藥系統(dox-rgd-bsa@auncs)的藥物傳遞和生物成像,一方面能在高效靶向殺死腫瘤的同時對治療進行實時監控;另一方面合成的以金納米簇(bsa@aunc)為載體的納米載藥系統(dox-rgd-bsa@auncs)不僅可以針對多種類型的腫瘤細胞發揮作用,能夠快速靶向識別癌細胞,而且通過谷胱甘肽(gsh)對連接阿霉素和納米簇的雙硫鍵的剪切作用將藥物釋放,能夠快速、準確的殺死癌細胞,達到治療的目的;并且在體內外呈現出良好的抗腫瘤作用,根據熒光成像的熒光分布情況和其熒光強度進行定性和定量分析,實現腫瘤早期診斷治療以及治療的實時監控。
附圖說明
為了更清楚地說明本發明實施例或現有技術中的技術方案,下面將對實施例或現有技術描述中所需要使用的附圖作簡單地介紹,顯而易見地,下面描述中的附圖僅僅是本發明的實施例,對于本領域普通技術人員來講,在不付出創造性勞動的前提下,還可以根據提供的附圖獲得其他的附圖。
圖1附圖為本發明的納米載藥系統的過程原理圖。
圖2附圖為本發明的納米載藥系統的紫外吸收圖譜及激發、發射光譜。
圖3附圖為本發明的gsh的熒光檢測(a圖中從低到高分別為濃度為0、1mm、2mm、4mm、6mm、8mm、10mm的商品化gsh與納米載藥系統室溫反應4小時后,經過超濾離心管離心后,取下清液測得的熒光光譜)。
圖4附圖為本發明的納米載藥系統的細胞成像。
圖5附圖為本發明的癌細胞(hela、mcf-7、u251、cal-27)的細胞成像。
具體實施方式
下面將結合本發明實施例中的附圖,對本發明實施例中的技術方案進行清楚、完整地描述,顯然,所描述的實施例僅僅是本發明一部分實施例,而不是全部的實施例。基于本發明中的實施例,本領域普通技術人員在沒有做出創造性勞動前提下所獲得的所有其他實施例,都屬于本發明保護的范圍。
本發明提供了一種納米載藥系統(dox-rgd-bsa@auncs)藥物傳遞和生物成像,能在高效靶向殺死腫瘤的同時對治療進行實時監控。
實施例1
金納米簇(auncs@bsa)的制備方法:
步驟1.1,量取質量分數為1%的氯金酸溶液1.7ml,加入3.3ml去離子水,得到5ml、10mm氯金酸溶液;
步驟1.2,稱取250mlbsa,溶解在5ml去離子水中,得到5ml、50mg/mlbsa溶液;
步驟1.3,稱取20mgnaoh,溶解在0.5ml去離子水中,得到1mnaoh溶液;
步驟1.4,將配制好的5ml(10mm)的氯金酸溶液加入到5ml(50mg/ml)的bsa溶液,控溫37℃,劇烈攪拌5min;
步驟1.5,將1mnaoh水溶液加入到上述混合溶液中,并且持續劇烈攪拌上述反應物,控溫37℃,持續時間24h;
步驟1.6,將得到的產物冷卻至室溫,裝進mwco100000透析袋中,透析外液用水,維持外界溫度4℃,透析12h,并用葡萄糖凝膠過柱,以除去多余的bsa,從而得到金納米簇。
實施例2
金納米簇(auncs@bsa)的制備方法:
步驟1.1,量取質量分數為1%的氯金酸溶液1.7ml,加入3.3ml去離子水,得到5ml、10mm氯金酸溶液;
步驟1.2,稱取250mlbsa,溶解在5ml去離子水中,得到5ml、50mg/mlbsa溶液;
步驟1.3,稱取20mgnaoh,溶解在0.5ml去離子水中,得到1mnaoh溶液;
步驟1.4,將配制好的5ml(10mm)的氯金酸溶液加入到5ml(50mg/ml)的bsa溶液,控溫37℃,劇烈攪拌5min;
步驟1.5,將1mnaoh水溶液加入到上述混合溶液中,并且持續劇烈攪拌上述反應物,控溫37℃,持續時間24h;
步驟1.6,將得到的產物冷卻至室溫,裝進mwco100000透析袋中,透析外液用水,維持外界溫度4℃,透析24h,并用葡萄糖凝膠過柱,以除去多余的bsa,從而得到金納米簇。
實施例3
rgd-bsa@auncs的制備方法:
步驟2.1,取2ml金納米簇加入到8mlpbs緩沖溶液(ph=7.4,20mm)中,得到金納米簇溶液;
步驟2.2,取4ml金納米簇溶液,在其中加入20mg的edc,避光條件室溫下反應20min;
步驟2.3,加入16mg的nhs,在避光條件下劇烈攪拌1h,得到混合液;
步驟2.4,向上述混合液中加入c(rgd)fk溶液(100ul,10mg/ml),室溫下攪拌反應24h;
步驟2.5,反應后,將反應溶液裝進mwco100000透析袋中,透析外液用水,維持外界溫度4℃,透析12h,并且反應產物用截留量為10kda的超濾離心管中離心(3000xg,20min),去除過量反應物,得到的產物溶于2mlpbs緩沖溶液中,且放置在4℃的冰箱內部保存,得到rgd-bsa@auncs。
實施例4
rgd-bsa@auncs的制備方法:
步驟2.1,取2ml金納米簇加入到8mlpbs緩沖溶液(ph=7.4,20mm)中,得到金納米簇溶液;
步驟2.2,取4ml金納米簇溶液,在其中加入15mg的edc,避光條件室溫下反應20min;
步驟2.3,加入15mg的nhs,在避光條件下劇烈攪拌1h,得到混合液;
步驟2.4,向上述混合液中加入c(rgd)fk溶液(100ul,10mg/ml),室溫下攪拌反應24h;
步驟2.5,反應后,將反應溶液裝進mwco100000透析袋中,透析外液用水,維持外界溫度4℃,透析24h,并且反應產物用截留量為10kda的超濾離心管中離心(3000xg,20min),去除過量反應物,得到的產物溶于2mlpbs緩沖溶液中,且放置在4℃的冰箱內部保存,得到rgd-bsa@auncs。
實施例5
dox-rgd-bsa@auncs的制備方法:
步驟3.1,將制得的rgd-bsa-auncs和1.5mg的spdp加入到含有1mmedta的pbs緩沖溶液中,室溫下反應4h,得到的反應產物裝進mwco100000透析袋中,透析外液用水,維持外界溫度4℃,透析12h,得到rgd-bsa@auncs;
步驟3.2,將鹽酸阿霉素(1.5mg,2.6×10-6mol)和2-亞氨基硫烷鹽酸鹽(0.36mg,0.36×10-6mol)的混合物加入到含有1mmedta的psb緩沖液中,室溫下反應4h,得到dox-sh(巰基dox修飾的鹽酸阿霉素);
步驟3.3,過量的dox-sh和rgd-bsa@auncs反應,得到dox-rgd-bsa@auncs溶液;
步驟3.4,將步驟3.3中的dox-rgd-bsa@auncs溶液加入到pbs緩沖溶液中,然后裝進mwco100000透析袋中,透析外液用水,維持外界溫度4℃,透析12h,得到dox-rgd-bsa@auncs。
實施例6
dox-rgd-bsa@auncs的制備方法:
步驟3.1,將制得的rgd-bsa-auncs和1.5mg的spdp加入到含有1mmedta的pbs緩沖溶液中,室溫下反應4h,得到的反應產物裝進mwco100000透析袋中,透析外液用水,維持外界溫度4℃,透析24h,得到rgd-bsa@auncs;
步驟3.2,將鹽酸阿霉素(1.5mg,2.6×10-6mol)和2-亞氨基硫烷鹽酸鹽(0.36mg,0.36×10-6mol)的混合物加入到含有1mmedta的psb緩沖液中,室溫下反應4h,得到dox-sh(巰基dox修飾的鹽酸阿霉素);
步驟3.3,過量的dox-sh和rgd-bsa@auncs反應,得到dox-rgd-bsa@auncs溶液;
步驟3.4,將步驟3.3中的dox-rgd-bsa@auncs溶液加入到pbs緩沖溶液中,然后裝進mwco100000透析袋中,透析外液用水,維持外界溫度4℃,透析24h,得到dox-rgd-bsa@auncs。
本說明書中各個實施例采用遞進的方式描述,每個實施例重點說明的都是與其他實施例的不同之處,各個實施例之間相同相似部分互相參見即可。對于實施例公開的裝置而言,由于其與實施例公開的方法相對應,所以描述的比較簡單,相關之處參見方法部分說明即可。
對所公開的實施例的上述說明,使本領域專業技術人員能夠實現或使用本發明。對這些實施例的多種修改對本領域的專業技術人員來說將是顯而易見的,本文中所定義的一般原理可以在不脫離本發明的精神或范圍的情況下,在其它實施例中實現。因此,本發明將不會被限制于本文所示的這些實施例,而是要符合與本文所公開的原理和新穎特點相一致的最寬的范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!