無載體共組裝腫瘤靶向抗癌納米藥物及其制備方法與應用與流程
本發明涉及生物醫藥技術領域,特別涉及無載體共組裝腫瘤靶向抗癌納米藥物及其制備方法與應用。
背景技術:
癌癥是嚴重威脅人類生命健康的疾病之一,腫瘤轉移則是癌癥患者死亡的最主要原因,資料表明,惡性腫瘤發生轉移的比例達60%-62.5%,因此控制腫瘤轉移是決定癌癥患者預后的關鍵因素。某種程度上說,防止腫瘤轉移即能控制腫瘤所致的死亡。腫瘤轉移過程牽涉到細胞脫落、浸潤、遷移運行、著床、新生血管生成等,理論上講,只要能夠阻止上述一個或多個過程,就能抑制腫瘤轉移。因此,找出抗腫瘤轉移的藥物刻不容緩。
核酸適配體(aptamer)是一類寡核苷酸片段,包括核糖核酸(rna)和單鏈脫氧核糖核酸(ssdna),可與不同的靶標分子高親和力特異性結合。它可作用于蛋白質、金屬離子、小分子化合物、細胞膜表面受體等靶標。較之抗體、多肽等較常見的靶向性配體,核酸適配體具有體積相對較小、免疫原性較低且易于體外篩選、性質穩定、易合成、易標記、分子量較小和目標分子廣泛等優勢。隨著研究不斷深入,以適配體靶向納米遞送系統在腫瘤治療中將會有廣闊的應用前景。
近幾年來,納米藥物載體在醫學領域的應用極為廣泛,尤其是在生物醫學領域,得到越來越多研究者的關注,納米藥物載體已經成為生物醫學領域的前沿和熱點問題,在醫藥衛生領域有著廣泛的應用和明尤其確的產業化前景。雖然納米藥物載體以其優異且獨特的性質在疾病診斷、治療和衛生保健方面發揮重要作用,但是能夠應用臨床的很少。當前的納米藥物載體雖在一定程度上提高了疏水性藥物的生物利用度,但是載體本身的生物相容性和細胞毒性不容忽視。最新的研究發現大多數人工合成的納米載體存在安全性問題,據報道一些納米載體在臨床試驗中引起休克、呼吸困難、低血壓等十分嚴重的不良癥狀,甚至有死亡的現象。納米載體在體內的代謝機制不明確,對細胞產生毒副作用將成為阻礙納米載藥體系向前發展和進一步應用于臨床的棘手問題。與傳統的納米載藥體系相比,無載體納米載藥體系解決了納米載體體系復雜、質控困難、作用機制不明確和代謝不清楚等問題。無載體納米載藥體系消除了引入載體對人體帶來的安全問題,同時減輕對人體額外代謝的負擔,更解決了載體納米粒制備過程中批次質量不可控的問題。
熊果酸(ursolicacid,ua)又名烏索酸(烏蘇酸),屬五環三萜類化合物。它在自然界分布很廣,如存在于杜鵑花科植物熊果的葉、果實中,玄參科植物毛泡桐的葉中,以及木樨科植物女貞的葉中。熊果酸具有廣泛的生物活性,包括抗癌、對肝損傷的保護、抗菌消炎和抗病毒等作用。近年來體內試驗證明發現:熊果酸的抗腫瘤作用廣泛,熊果酸不僅對多種致癌、促癌物有抵抗作用,而且能抑制多種惡性腫瘤細胞的生長,此外熊果酸可以明顯增強機體免疫功能,這說明熊果酸極有可能成為低毒有效的新型抗癌藥物。
阿霉素(doxorubicin,dox)是一種蒽環糖苷類的廣譜抗腫瘤藥物,阿霉素結構上既有脂溶性蒽環配基和水溶性柔紅糖胺,又有酸性酚羥基和堿性氨基,易通過細胞膜進入腫瘤細胞,具有很強的藥理活性。臨床上用于治療急性淋巴細胞白血病、急性粒細胞性白血病、霍奇金和非霍奇金淋巴瘤、乳腺癌、肺癌、卵巢癌、軟組織肉瘤、成骨肉瘤、橫紋肌肉瘤、腎母細胞瘤、神經母細胞瘤、膀胱瘤、甲狀腺瘤、絨毛膜上皮癌、前列腺癌、睪丸癌、胃癌、肝癌等。
技術實現要素:
本發明的目的在于提供一種無載體共組裝腫瘤靶向抗癌納米藥物及其制備方法與應用。本發明通過π-π堆積、疏水和靜電力形成的具有靶向抗癌活性的共組裝納米藥物,以解決現有技術中人工合成的載體納米體系復雜、質控困難、作用機制不明確和代謝不清楚等問題,以達到協同治療腫瘤的目的。
為實現上述目的,本發明采用的技術方案是:
無載體共組裝腫瘤靶向抗癌納米藥物,其是由雙抗癌納米藥物吸附具有腫瘤靶向功能的靶標而獲得,所述雙抗癌納米藥物為熊果酸與抗癌藥物共組裝而成。
所述靶標為核酸適配體、分子靶標、抗體或多肽。
所述核酸適配體為epcam、her2或muc1。
所述分子靶標為葉酸、乳糖酸或透明質酸。
與熊果酸共組裝的抗癌藥物包括但不限于鹽酸阿霉素、鹽酸厄洛替尼、甲苯磺酸索拉非尼、阿柔比星、阿柔比星b、伊達比星、吡柔比星、多西他賽、福美坦、埃博霉素、雷公藤內酯醇、米非司酮、喜樹堿、10-羥基喜樹堿、秋水仙堿、長春新堿、甲氨蝶呤、他莫西芬、替尼泊苷、順鉑和6-巰基嘌呤、鹽酸柔紅霉素、鹽酸表阿霉素、鹽酸佐柔比星或鹽酸米托蒽醌和5-氟尿嘧啶。
本發明將熊果酸與抗癌藥物共組裝得到雙抗癌納米藥物,雙抗癌納米藥物通過電荷間相互作用吸附熒光標記核酸適配體或分子靶標或抗體、多肽等,形成無載體共組裝腫瘤靶向抗癌納米藥物,該腫瘤靶向抗癌納米藥物同時兼具靶向性、成像和治療的功能,可作為抑制腫瘤轉移的藥物而應用,能夠達到很好的腫瘤治療效果。
本發明所述無載體共組裝腫瘤靶向抗癌納米藥物的制備方法,包括以下步驟:
1)將熊果酸溶于良性溶劑a中,得到溶液a,所述溶液a中的熊果酸濃度范圍為1000μm‐20000μμ,所述良性溶劑a為二氯甲烷、氯仿、乙醚、乙酸乙酯、乙酸甲酯、丙酮、正丙醇、甲醇、吡啶、乙酸、二甲基亞砜中的一種或多種;
2)將待與熊果酸共組裝的抗癌藥物溶于良性溶劑b中,得到溶液b,所述溶液b中的抗癌藥物濃度范圍為1000μm‐20000μm,所述良性溶劑b為待組裝抗癌藥物的良性溶劑;
3)a.當所述良性溶劑b為水:
在攪拌狀態下,將溶液a緩慢滴入溶液b中,攪拌一定的時間后得到溶液c1,溶液a與溶液b的體積為1:10‐1:100,溶液c1中熊果酸的濃度范圍為100μm‐2000μm;
b.當所述良性溶劑b為非水良性溶劑:
將溶液a和溶液b混合得到混合液,混合液中熊果酸與抗癌藥物的物質的量的濃度比為5:1-10:1,抗癌藥物的物質的量的濃度范圍為10μm-4000μm;然后在攪拌狀態下,將混合液緩慢滴入熊果酸的不良溶劑中,攪拌一定的時間后得到溶液c2,混合液與不良溶劑的體積為1:10-1:100,溶液c2中的熊果酸濃度范圍為100μm-2000μm;
所述不良溶劑為磷酸鹽緩沖液、水、生理鹽水、葡萄糖溶液中的一種或多種;
4)將上述得到的溶液c1或溶液c2攪拌0.5-2h后得到雙抗癌納米藥物;
5)將上述雙抗癌納米藥物中的有機溶劑吹干,之后滴加具有腫瘤靶向功能的靶標分子溶液,然后超聲10-60min,得到腫瘤靶向抗癌納米藥物。
進一步,與熊果酸組裝的抗癌藥物為阿霉素,靶標分子為aptamer,得到的腫瘤靶向抗癌納米藥物為ap/ud納米粒,所述ap/ud納米粒的制備方法包括以下步驟:
1)將熊果酸溶于良性溶劑a中,得到溶液a,所述溶液a中的熊果酸濃度范圍為1000μm‐20000μμ,所述良性溶劑a為二氯甲烷、氯仿、乙醚、乙酸乙酯、乙酸甲酯、丙酮、正丙醇、甲醇、吡啶、乙酸、二甲基亞砜中的一種或多種;
2)將鹽酸阿霉素溶于良性溶劑b中,得到溶液b,所述溶液b中的鹽酸阿霉素濃度范圍為1000μm‐20000μm,所述良性溶劑b為水、甲醇、吡啶、乙酸、二甲基亞砜中的一種或多種;
3)a.當所述良性溶劑b為水:
在攪拌狀態下,將溶液a緩慢滴入溶液b中,攪拌一定的時間后得到溶液c1,溶液a與溶液b的體積為1:10‐1:100,溶液c1中的熊果酸濃度范圍為100μm‐2000μm;
b.當所述良性溶劑b為甲醇、吡啶、乙酸、二甲基亞砜中的一種或多種:
將溶液a和溶液b混合得到混合液,混合液中熊果酸與鹽酸阿霉素的物質的量的濃度比為5:1-10:1,鹽酸阿霉素的物質的量的濃度范圍為10μm-4000μm;然后在攪拌狀態下,將混合液緩慢滴入不良溶劑中,攪拌一定的時間后得到溶液c2,混合液與不良溶劑的體積為1:10-1:100,溶液c2中的熊果酸濃度范圍為100μm-2000μm;
所述不良溶劑為磷酸鹽緩沖液、水、生理鹽水、葡萄糖溶液中的一種或多種;
4)將上述得到的溶液c1或溶液c2攪拌0.5-2h后得到雙抗癌納米藥物ud;
5)將上述雙抗癌納米藥物ud中的有機溶劑吹干,之后滴加aptamer溶液,然后超聲10-60min,得到ap/ud納米粒,即腫瘤靶向抗癌納米藥物。
本發明采用以上技術方案,用疏水性藥物熊果酸和廣譜抗腫瘤藥物如阿霉素(或其它抗癌藥物)共組裝形成無載體納米藥物(ua-dox,簡稱ud),并通過電荷間相互作用在其表面吸附具有腫瘤靶向功能的熒光標記核酸適配體或分子靶標或抗體、多肽等,獲得的腫瘤靶向抗癌納米藥物同時兼具靶向性、成像和治療的功能,從而達到協同的抗腫瘤作用,實現診療一體化,尤其在抗腫瘤轉移方面作用突出,更重要的是解決了傳統納米載體帶來的體系復雜和體內代謝不明確等問題。
所述的熊果酸的結構式如式ⅰ所示,阿霉素的結構式如式ⅱ所示:
本發明的優點在于:
1、本發明所制備的雙抗癌納米藥物中所用的熊果酸既具有良好的抗癌效果又具有抗轉移效果;
2、本發明所制備的無載體雙抗癌納米藥物中的熊果酸在水中可以通過溶劑交換法自組裝成為納米粒,并且可以和抗癌藥物阿霉素等共組裝形成新的納米粒,有效地解決了抗癌藥物熊果酸的水溶性和生物利用度的問題;
3、本發明的無載體雙抗癌納米藥物具備ph響應性;
4、本發明雙抗癌納米藥物表面電勢是正,可以對本發明的無載體雙抗癌納米藥物進行表面修飾,例如連上帶有負電荷的葉酸或核酸適配體,使無載體雙抗癌納米藥物具有靶向性和成像等功能,增加雙抗癌納米藥物對腫瘤細胞的殺傷力,并可實現診療一體化;
5、本發明所制備的無載體雙抗癌納米藥物制備過程簡單,方便,可以解決傳統納米載體在體內代謝不明確,體系復雜等問題,消除了人工合成載體帶來的臨床安全性問題,并能為以后新藥研發和制備提供新的思路。
附圖說明
圖1為實施例1中ua納米膠束粒徑圖;
圖2為實施例1中ua甲醇溶液與ua膠束溶液的對比成像圖;
圖3為實施例2中ud納米粒的粒徑圖;
圖4為實施例2中ud納米粒的電勢圖;
圖5為實施例2中ud溶液與實施例1中的ua納米膠束以及ua甲醇溶液的對比成像圖;
圖6為實施例3中fud納米粒的粒徑圖;
圖7為實施例4中ap/ud納米藥物的粒徑圖;
圖8為實施例5中ap/ud電泳圖;
圖9為實施例6中ap/ud對mcf-7腫瘤細胞的增殖抑制作用;
圖10為實施例7中ap/ud對mcf-7腫瘤細胞的抗遷移作用;
圖11為實施例8中ap/ud對mcf-7腫瘤細胞的抗侵襲作用;
圖12為實施例9中ap/ud對mcf-7腫瘤細胞的抗粘附作用;
圖13為實施例10中ud、ua納米膠束的丁達爾效應;
圖14為實施例11中ud的ph響應圖。
具體實施方式
下面結合具體實施方式對本發明所述的技術方案作進一步的說明,但是本發明不僅限于此。
實施例1
熊果酸納米膠束的制備方法
精確稱取ua粉末0.00456g,溶于1ml甲醇中,超聲溶解,配置成10mm的熊果酸甲醇溶液;取100μl上述溶液,在攪拌過程中逐滴滴加到含有2ml二次水中(注:滴加過程中高速攪拌,滴加時間為30s),此時ua在溶液中的濃度為500μm,然后攪拌8min,即得ua納米膠束。
本實施例制備的ua納米膠束平均粒徑98.32納米左右,粒徑圖如圖1所示。
本實施例制備的ua納米膠束溶液與ua甲醇溶液的對比成像圖如圖2所示。
實施例2
精確稱取ua粉末0.00456g,溶于1ml甲醇中,超聲溶解,配制成10mm的ua甲醇溶液;精確稱取鹽酸阿霉素粉末0.00579g,溶于1ml二次水中,超聲溶解,配制成10mm的鹽酸阿霉素水溶液;取200μlua甲醇溶液,逐滴滴加到含有2000μl含阿霉素水溶液的燒杯中(注:滴加過程中高速攪拌,滴加時間為30s,鹽酸阿霉素水溶液濃度為0.2μm),ua在溶液中的濃度為1000μm,攪拌8min后,高速攪拌2h后,吹干甲醇溶液,即得無載體雙抗癌納米藥物ud;
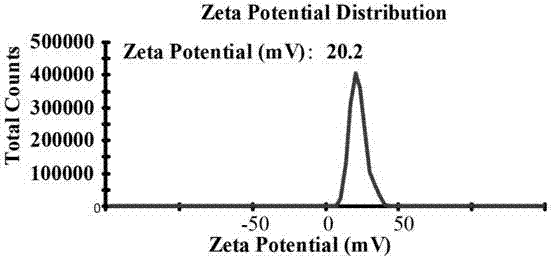
本實施例制備的無載體雙抗癌納米藥物ud的平均粒徑在207納米左右,粒徑圖如圖3所示。電勢在15.1mv左右,電勢如圖4所示。
本實施例制備的ud溶液與實施例1中的ua納米膠束以及ua甲醇溶液的對比成像圖如圖5所示。
實施例3
取實施例2制備的ud納米溶液,滴加20μl葉酸溶液(水懸液,10mm),然后超聲20min,混懸液消失,制備出具有葉酸靶向的fud納米粒。
本實施例制備的無載體雙抗癌納米藥物fud的平均粒徑在164納米左右,粒徑圖如圖6所示。
實施例4
在實施例2備的ud納米粒的基礎上,取100μl于ep管中,滴加10μl(her2適配體,10μm),超聲20min后,制備所得ap/ud納米粒,使用dls檢測粒徑大小。
本實施例制備的ap/ud納米藥物的粒徑118納米左右,其粒徑圖如圖7所示。
實施例5
實施例4制備所得ap/ud納米粒,用聚丙烯酰胺凝膠電泳檢測適配體是否成功吸附在ud納米粒表面。
如圖8所示,適配體成功地吸附在納米粒表面(1為阿霉素,2為適配體,3為ap/ud納米粒)。
實施例6
ud和ap/ud納米藥物的抗癌活性,通過細胞毒性來實現,采用標準mtt法測定ap/ud、ud、ua和dox及ua+dox對mcf-7細胞的增殖抑制活性,具體步驟為:
(1)取處于對數生長期狀態良好的mcf-7細胞,經胰蛋白酶消化后,計數并調整細胞密度為0.8×105個/ml,配成細胞懸液。于每孔100μl接種到96孔板中,周圍用nacl封板,置于37℃,5%co2培養箱中培養24h。
(2)去除舊的培養基,每孔加入100μl不同濃度梯度的含樣品的培養基,另設空白對照組,每組設置5個復孔,于培養箱中繼續孵育24h。
(3)移除培養基,于每孔中加入100μlmtt溶液(無血清、無酚紅的rmpi1640培養基:mtt母液=9:1,v:v),繼續孵育4h。
(4)取出96孔板終止培養,用移液槍輕輕吸去96孔板中的上清液,每孔加入dmso溶液100μl,振蕩搖勻10min,使藍紫色結晶全部溶解,用酶標儀于490nm波長處測定每孔的od值,使用graphpadprism5處理,實驗結果如圖9所示。
結果顯示,藥物的聯合使用有一定的協同效果,納米藥物組的細胞毒性顯著提高,在每組對應的濃度下都是ap/ud腫瘤靶向抗癌納米藥物組的抗腫瘤效果最好,和單藥相比有顯著性差異。
實施例7
ud和ap/ud納米藥物抗腫瘤細胞遷移活性,通過細胞劃痕來測定ap/ud、ud、ua和dox及ua+dox對mcf-7細胞的遷移抑制作用,具體步驟為:
(1).取對數生長期狀態良好的mcf-7細胞,經胰蛋白酶消化后,計數并調整細胞密度為8×105個/ml,配成細胞懸液。于每孔150μl接種到12孔板中,周圍用nacl封板,置于37℃,5%co2培養箱中培養24h。
(2).第二天用槍頭比著直尺,盡量垂至于孔板,槍頭要垂直,每個孔劃3天平行的直線。
(3).pbs洗細胞3次,去處劃下的細胞,加入無血清培養基
(4).按照相應的藥物濃度加入藥物(ua:1.25μm;dox:0.25μm;ua+dox,udnps和ap/udnps相應的濃度)。
(5).放入37℃5%co2培養箱,培養。24h取樣,拍照。
結果如圖10所示,ua和dox在該濃度下和空白組對比有一定的抗腫瘤細胞遷移效果,混合物的抗腫瘤細胞遷移和單藥沒有顯著性差異,納米組有顯著性提高了兩藥抗mcf-7細胞遷移效果,尤其是ap/udnps增加her2適配體靶向后,進一步提高了藥物抗腫瘤細胞遷移效果。
實施例8
為了驗證ap/ud納米粒的抗侵襲能力,利用traswell實驗驗證ap/ud納米粒對mcf-7的抗侵襲能力,具體步驟如下:
1、transwell法測定不同腫瘤細胞的侵襲能力,用1mg/ml的matrigel稀釋液包被transwell小室底部膜的上室面,4℃風干。棄小室中殘余液體,每孔加入50μl的1%bsa無血清培養液,于37℃放置1h。
2、取指數生長期的腫瘤細胞,消化離心,棄去上清液后用含0.1%bsa的無血清培養基重懸。調整細胞密度至1×106/ml,吸取200μl加入transwell上室,下室加入500μl含有20%fbs及含有納米藥物(ap/ud濃度含ua:1.25μm;dox:0.25μm)的培養基。
3、37℃培養24小時后,取出transwell小室用pbs洗2遍,用棉簽擦去基質膠和上室內的細胞,用95%預冷的甲醇溶液中固定20min,后用0.1%的結晶紫染色15min,棄去染色液,用pbs清洗2遍。室溫晾干后于正置顯微鏡進行觀察和拍照。隨機選取8個不同的視野細胞拍照并計數,實驗重復3次。
結果如圖11所示,ap/udnps增加her2適配體靶向后,對mcf-7細胞具有顯著的抗侵襲能力。
實施例9
為了驗證ap/ud納米粒的抗粘附能力,利用細胞粘附實驗驗證ap/ud納米粒對mcf-7的抗粘附能力,具體步驟如下:
細胞粘附實驗:將處于對數期的huvec細胞消化后接種于24孔板,待上述24孔板的內皮細胞長滿孔板時,用pbs清洗兩三次,然后加入含有內皮刺激因子il-1β,濃度為1ng/l的培養基,在37℃,5%co2的條件下孵育4h,以此激活內皮細胞。4h后取出孔板,用pbs清洗兩三次后,取對數生長期腫瘤細胞,熒光標記后制成4×105/ml-1單細胞懸液,并加入不同濃度藥物(ap/ud濃度含ua:1.25μm;dox:0.25μm)的rpm-1640培養液,每孔500μl。37℃、5%co2孵育2h后,pbs輕洗3遍,控干后加入無血清培養液500μl。然后在熒光顯微鏡下進行拍照。
結果如圖12所示,ap/udnps增加her2適配體靶向后,對mcf-7細胞具有顯著的抗粘附能力。
實施例10
將實施例1制備的ua納米膠束和實施例2制備的無載體共組裝雙抗癌納米藥物ud,分裝白色瓶中,然后用激光筆照射,觀察現象,結果如圖13所示。觀察到一束均一的光束,明顯的丁達爾現象。
實施例11
將實施例2制備的ud各取500μl三份于比色皿中,然后分別加入ph為5.0、6.5和7.4的pbs溶液1500μl,觀察現象。
如圖14所示,ph5.0出現明顯的渾濁,ph6.5出現少量析出,ph7.4的情況下納米藥物能夠均一的存在。
以上所述僅為本發明的舉例說明,對于本領域的技術人員而言,根據本發明的教導,在不脫離本發明的原理和精神的情況下凡依本發明申請專利范圍所做的均等變化、修改、替換和變型,皆應屬本發明的涵蓋范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!