一種提高DC疫苗抗肝癌效果的基因靶標、抑制劑和DC腫瘤疫苗的制作方法
本發明屬于基因治療和免疫治療領域,具體涉及一種提高dc疫苗抗肝癌效果的基因靶標、抑制劑和dc腫瘤疫苗。
背景技術:
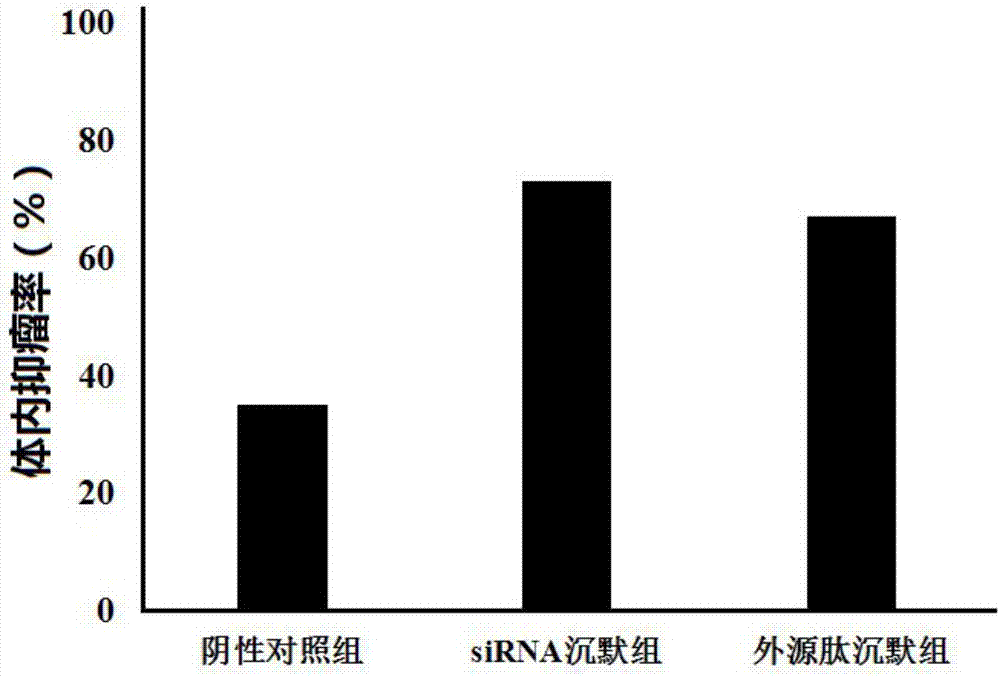
:肝細胞癌是全世界最常見的惡性腫瘤之一,每年約有60萬患者被診斷出患有肝細胞癌。目前,對于肝細胞癌的治療主要是手術切除、肝臟移植、放化療等,但僅有20%的患者能夠被治療。我國肝細胞癌年死亡率占腫瘤死亡率的第2位。肝細胞癌的病因及發病機制尚未確定,因此,尋找新的肝細胞癌的治療靶點和藥物是研究重點。基于dc的生物治療格外引人矚目。理論上說,dc是激發適應性免疫最有效的apc,將其在體外荷載腫瘤抗原后回輸,荷肽dc通過mhc/抗原肽-tcr的相互作用激活特異性t細胞,從而啟動抗瘤免疫應答,預防或者清除腫瘤。這種方法安全而少副作用,對微小和轉移病灶更有傳統手段無可比擬的高度靶向性。但實際運用時,僅僅荷肽的dc往往并不能激發足夠強大的抗瘤免疫應答,所以治療效果不如預期理想。這是由于為躲避宿主免疫系統攻擊,腫瘤發展出多種多樣的逃逸機制,在抗原提呈階段,就可能存在腫瘤抗原免疫原性低下、mhc分子表達減少、協同刺激分子缺如、分泌抑制性細胞因子等因素。因此,為提高疫苗的效能,就必須采取一定的方法來修飾、處理dc,增強其抗原提呈能力。技術實現要素:本發明目的在于提供一種提高dc疫苗抗肝癌效果的基因靶標、抑制劑和dc腫瘤疫苗。實現本發明上述目的技術方案如下:基因socs2作為靶標在制備dc肝癌疫苗方面的應用。基因socs2的抑制劑在制備dc肝癌疫苗方面的應用。優選地,所述抑制劑為抑制基因socs2表達的sirna或含抑制基因socs2表達的sirna序列的載體。優選地,所述抑制劑為seqidno.1所示的外源肽。優選地,所述外源肽n和/或c末端被化學修飾。優選地,所述外源肽的n末端被乙酰化修飾,c末端被酰胺化修飾。優選地,所述外源肽為游離形式或藥學上可以接受的成鹽形式,包括鹽酸鹽、硫酸鹽、磷酸鹽、磺酸鹽、乙酸鹽、檸檬酸鹽和酒石酸鹽。一種生物制品,含有上述抑制劑。上述生物制品在制備dc肝癌疫苗方面的應用。一種dc肝癌疫苗,其dc細胞的socs2基因低表達。本發明的突出優點:本發明證明,通過sirna抑制dc中socs2表達可以顯著提高dc疫苗的體內抑瘤效果,而本發明提供的外源肽為dc中socs2表達的有效抑制劑,具有與sirna相似的功能,可以顯著提高dc疫苗的體內抑瘤效果。使用socs2的表達抑制劑和本發明提供的外源肽可以用于制備更優抗肝癌效果的dc肝癌疫苗。附圖說明圖1為各組成熟dc中socs2mrna的相對表達量;圖2為各組成熟dc接種20天后對荷瘤裸鼠的體內抑瘤率(%)。具體實施方式下面就結合實施例具體介紹本發明的實質性內容,由于篇幅原因,實驗過程的描述無法做到非常詳細,凡是實驗中未詳細描述的部分均為本領域技術人員熟知的常規操作。一、實驗材料人肝細胞株瘤細胞株hhcc購于美國atcc,并有本公司保存。將hhcc細胞復蘇后接種于培養瓶中,加入含有10%fbs的rpmi-1640,貼壁細胞用0.25%的胰酶消化。取對數生長期的細胞進行實驗。balb/c小鼠購于南京君科生物工程有限公司。本發明外源肽通過本領域公知的標準多肽固相合成技術合成,采用芴甲氧羰基(fmoc)n端保護策略。按照樹脂固相合成的方法依次連接相應氨基酸,期間依次脫去fmoc-保護基團,然后切肽,獲得粗品,粗品經c18柱分離純化,hplc和ms檢測確證了本發明外源肽的結構,且純度均≥98%。其氨基酸序列如下(n末端→c末端),末端未經化學修飾:qedlmgpnqtdgepc(seqidno.1)二、實驗方法1、細胞培養和腫瘤裂解物的制備人肝細胞株瘤細胞株hhcc購于美國atcc,并由本公司保存。將hhcc細胞復蘇后接種于培養瓶中,加入含有10%fbs的rpmi-1640,貼壁細胞用0.25%的胰酶消化。取對數生長期的細胞進行實驗。balb/c小鼠購于南京君科生物工程有限公司。腫瘤裂解物的制備:將hhcc細胞接種于含有10%fbs的rpmi-1640的培養瓶中,待貼壁達到80%時,取貼壁細胞,用pbs洗滌重懸至3×107/ml,經-80℃/37℃反復凍融5次,超聲波裂解1次,離心收集上清即得腫瘤裂解物,冷凍干燥。2、bm-dc的培養參考garrigan等人方法:rpmi-1640沖洗小鼠長骨髓腔獲得骨髓細胞,tirs-nh4裂解去除紅細胞,用含10%fcs、20ng/mlrmgm-csf(r&d)的rpmi-1640完全培養基重懸至3×106細胞/ml,1ml/孔接種至24孔培養板,37℃、5%co2培養。每隔2-3d,輕輕吹打,3/4量換液以去除懸浮細胞,并補液至原體積。5~7d后,收集懸浮和松散貼壁的細胞即為未成熟的樹突狀細胞(idc)。3、外源肽和sirna沉默socs2基因表達sirna沉默組:收集培養第6天的idc,轉染有綠色熒光染料fam標記、針對socs2mrna的sirna(委托上海吉瑪設計合成),步驟如下:按每孔3μlfam-sirna、3μlgeneporter(genetherapysystems)、96μl無血清rpmi-1640混合,接種至12孔培養板,25℃孵育30min。隨后,用無血清rpmi-1640重懸idc至2×106細胞/ml,以1ml/孔加入孵育有轉染試劑的12孔培養板,37℃孵育4h;最后,每孔加入1ml含10%fcs、20ng/mlrmgm-csf的rpmi-1640完全培養基,37℃孵育8h。外源肽沉默組:收集培養第6天的idc,不轉染sirna,于12孔培養板中以含10%fcs、20ng/mlrmgm-csf的rpmi-1640完全培養基調整成與sirna沉默組終體積相同、細胞濃度相同的培養體系,但是培養基中含終濃度為10μm的外源肽,37℃孵育8h。陰性對照組:同外源肽沉默組,但是培養基中不含外源肽,37℃孵育8h。4、dc荷載腫瘤裂解物與lps刺激成熟未沉默和沉默socs2的idc用含腫瘤裂解物(200μg/ml))、lps(100ng/ml)的rpmi-1640完全培養基重懸至2×106細胞/ml,1ml/孔接種至24孔板,37℃孵育24h以成熟。其中,未沉默socs2者標記為nsi-dc,sirna沉默者標記為ssi-dc,外源肽沉默者標記為psi-dc。通過流式法檢測檢測cd11c、cd80、cd86的表達檢測dc純度和成熟度。5、rt-pcr檢測dc中socs2mrna表達用trizol法提取nsi-dc、ssi-dc、psi-dc的總rna。采用兩步法rt-pcr,參照takara公司amv反轉錄酶說明書進行反轉錄。cdna的pcr反應體系如下:2μl反轉錄產物,5μl的10×pcrbuffer(mg2+free),3μlmgcl2(25mmol/l),4μl的dntpmixture(2.5mmol/l),0.25μl的taq酶(5u/μl),上下引物各1μl(l20μmol/l),加滅菌蒸餾水調至50μl體系。選用小鼠gapdh作內參,引物序列如下:socs2上游引物:5’-agctcggtcagacaggatgg-3’(seqidno.2)socs2下游引物:5’-ttcgaagattagttggtccagc-3’(seqidno.3)gapdh上游引物:5’-atatggtacgcgaggtgagg-3’(seqidno.4)gapdh下游引物:5’-gtgattttagggacgctcca-3’(seqidno.5)pcr產物在1.5%瓊脂糖凝膠上電泳,gv染色后紫外線投射儀下觀察結果,經凝膠掃描成像系統拍照,用quantityone軟件半定量分析結果,即socs2mrna條帶的灰度值/gapdh條帶的灰度值,取平均值進行統計學分析。7、荷瘤動物的建模與治療balb/c小鼠于右背部皮下接種hhcc細胞1×106/只,接種2周后成瘤率100%,瘤徑約5mm。將成瘤裸鼠隨機分為4組:sirna沉默組、外源肽沉默組、陰性對照組和空白對照組,每組10只。從第15天開始,sirna沉默組、外源肽沉默組、陰性對照組每2天分別于皮下注射ssi-dc、psi-dc、nsi-dc的滅菌pbs懸液(1×106/50μl),空白對照組注射等量滅菌pbs,連續注射4次。為了充分促進機體免疫反應,每次注射dc或pbs后再腹腔注射lps,每只每次30μg/200μl。第25天開始(接種dc第10天),游標卡尺每2天測一次腫瘤體積。接種dc20天后,處死小鼠,剝離腫瘤塊,計算sirna沉默組、外源肽沉默組、陰性對照組相對于空白對照組的腫瘤抑制率(%),公式:腫瘤抑制率(%)=(空白對照組體積-sirna沉默組/外源肽沉默組/陰性對照組體積)/空白對照組體積×100%。8、數據處理數據分析采用spss20.0軟件進行,數據表示方法為均值±標準差,組間比較采用t檢驗,p<0.05認為有統計學差異。三、實驗結果1、各組dc純度和成熟度cd11c是小鼠髓系來源dc的特異性標志,各組dc的cd11c均呈陽性表達,且純度在80%以上。cd80、cd86是與dc抗原呈遞相關的標志分子,成熟前均低表達,但成熟后均顯著高表達,其中,成熟dc的cd80的純度均在80%以上,cd86的純度均在50%以上。結果表明,nsi-dc、ssi-dc、psi-dc均為成熟的dc細胞。2、各組成熟dc中socs2mrna表達與陰性對照組nsi-dc相比,sirna沉默組ssi-dc、外源肽沉默組psi-dc中的socs2mrna表達顯著下調(p<0.05),各組socs2mrna相對表達量見表1和圖1。表1各組成熟dc中socs2mrna的相對表達量組別socs2mrna相對表達量陰性對照組1.24sirna沉默組0.32外源肽沉默組0.393、各組成熟dc對荷瘤裸鼠的體內抑瘤率(%)與陰性對照組nsi-dc相比,sirna沉默組ssi-dc、外源肽沉默組psi-dc對荷瘤裸鼠的體內抑瘤率顯著升高,腫瘤生長緩慢,具有明顯的抑制作用。各組成熟dc接種20天后對荷瘤裸鼠的體內抑瘤率(%)見表2和圖2。表2各組成熟dc接種20天后對荷瘤裸鼠的體內抑瘤率(%)組別體內抑瘤率(%)陰性對照組35sirna沉默組73外源肽沉默組67實驗證明,通過sirna抑制dc中socs2表達可以顯著提高dc疫苗的體內抑瘤效果,而本發明提供的外源肽為dc中socs2表達的有效抑制劑,具有與sirna相似的功能,可以顯著提高dc疫苗的體內抑瘤效果。使用socs2的表達抑制劑和本發明提供的外源肽可以用于制備更優抗肝癌效果的dc肝癌疫苗。上述實施例是對本發明實質性內容的體現,用于更好地解釋本發明,但本領域技術人員應當知曉,不應將本發明的保護范圍局限于上述具體的實施例。sequencelisting<110>南京蓋斯夫醫藥科技有限公司<120>一種提高dc疫苗抗肝癌效果的基因靶標、抑制劑和dc腫瘤疫苗<130>1<160>5<170>patentinversion3.3<210>1<211>15<212>prt<213>人工序列<400>1glngluaspleumetglyproasnglnthraspglygluprocys151015<210>2<211>20<212>dna<213>人工序列<400>2agctcggtcagacaggatgg20<210>3<211>22<212>dna<213>人工序列<400>3ttcgaagattagttggtccagc22<210>4<211>20<212>dna<213>人工序列<400>4atatggtacgcgaggtgagg20<210>5<211>20<212>dna<213>人工序列<400>5gtgattttagggacgctcca20當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1