腫瘤靶向光熱響應可控釋放藥物納米傳輸載體的制備方法與流程
本發明屬于藥物載體制備的技術領域,具體涉及腫瘤靶向光熱響應可控釋放藥物納米傳輸載體的制備方法。
背景技術:
癌癥作為一種具有較高致死率的疾病,嚴重威脅著人類健康。化學藥物治療和放射療法的直接使用在殺死腫瘤細胞的同時,也對正常細胞和組織造成了不可逆的損傷。與傳統的化學療法相比,光動力學治療則借助光敏藥物將特定波長的光能轉化產生單線態氧,利用單線態氧殺死癌細胞,所以對腫瘤細胞具有較好的選擇性及較小的毒副作用。但多數光敏藥物的水溶性和分散性較差,因此,制備一種納米藥物的傳輸載體旨在將光敏藥物靶向傳輸進入腫瘤細胞,并在特定刺激條件下實現藥物可控釋放至關重要。同時借助材料的光熱性能還可進一步提高癌癥的治療效果,對癌癥多協同診療的發展具有重要意義。
在眾多的光敏藥物納米傳輸載體中,多孔二氧化硅材料的應用最為普遍。利用多孔二氧化硅的三維空腔結構和表面的功能基團可以物理吸附或共價連接光敏藥物,并將其傳輸進入腫瘤細胞。雖然硅質材料性質穩定,但只能作為單一載體使用,材料自身無法提供輔助功能以增強光動力治療效果。除此之外,膠束、有機聚合物納米粒子、納米脂質體和樹枝狀大分子也被大量用于光敏藥物的傳輸,以上納米載體雖然具有較好的生物相容性,豐富的功能基團也有利于材料的功能化修飾。但多數材料的合成步驟較為復雜,涉及大量有機溶劑的使用,成本高,耗時長。
此外,氧化石墨烯具有獨特的光熱性能,作為藥物傳輸載體也備受關注。然而,除繁瑣的共價方式連接外,氧化石墨烯只能裝載具有芳香環結構的疏水性光敏藥物,且無法有效避免藥物的提前泄漏和實現藥物在細胞內的精準可控釋放。相對單一的載藥模式和有限的表面功能化修飾嚴重制約了氧化石墨烯在光敏藥物傳輸及其在癌癥光動力治療中的應用。
因此,針對光敏藥物較差的水溶性以及不同類型納米載體開發中存在的不足,如何將光敏藥物靶向傳輸進入腫瘤細胞,在應激條件下實現藥物可控釋放,并借助材料的光熱性能以提高癌癥光動力治療效果是光敏藥物納米傳輸載體制備的巨大挑戰。
技術實現要素:
本發明的目的在于針對現有技術不足,提供了一種腫瘤靶向光熱響應可控釋放藥物納米傳輸載體的制備方法。所制得的腫瘤靶向光熱響應可控釋放藥物納米傳輸載體具有癌細胞靶向功能、可通過光熱響應控制藥物釋放、可用于傳輸各種不同藥物(疏水性藥物、親水性藥物和帶電荷藥物等)以及良好的光熱轉化性能,可增強癌癥的光動力治療效果。
為實現上述目的,本發明采用如下技術方案:
一種腫瘤靶向光熱響應可控釋放藥物納米傳輸載體的制備方法,借助聚多巴胺中鄰苯二酚基的強還原性,用多巴胺將氧化石墨烯還原為還原氧化石墨烯,賦予還原氧化石墨烯更好的光熱性能;利用協同組裝機理,將多孔二氧化硅組裝在還原氧化石墨烯兩側,形成三明治結構的納米復合材料,利用二氧化硅的三維孔洞空腔物理吸附裝載光敏藥物;通過靜電作用將透明質酸吸附于載藥平臺表面,防止藥物提前泄漏且實現對腫瘤細胞的靶向識別;具體包括以下步驟:
(1)還原氧化石墨烯-聚多巴胺(rgo-pda)的制備:用hummers法制備得到氧化石墨烯,取氧化石墨烯超聲分散于tris-hcl緩沖液中,離心,收集單層氧化石墨烯上清液;移取單層氧化石墨烯分散液于tris-hcl緩沖液中,水浴加熱至70℃,加入鹽酸多巴胺,持續加熱攪拌反應24h;反應結束后,將生成的還原氧化石墨烯-聚多巴胺(rgo-pda)納米片透析透析一周并在4℃下保存,備用;
(2)多巴胺還原氧化石墨烯@多孔二氧化硅(rgo-pda@ms)的制備:在磁力攪拌下,加入2.4mg步驟(1)合成的rgo-pda、1.2mmol十六烷基三甲基溴化銨(ctab)、0.15mmol氫氧化鈉(naoh)于150ml水中,分三次加入總計1.8ml四乙基原硅酸鹽(teos),室溫反應24h;之后,向反應液中加入67μl3-氨丙基三乙氧基硅烷(aptes),并繼續反應12h;反應結束后經離心、洗滌制得還原氧化石墨烯@多孔二氧化硅(rgo-pda@ms);
(3)藥物納米傳輸載體的制備:將步驟(2)制得的rgo-pda@ms與透明質酸(ha)按質量比1:2混合攪拌24h,使透明質酸通過靜電引力包裹于載體表面,再經離心、洗滌,制得所述腫瘤靶向光熱響應可控釋放藥物納米傳輸載體(rgo-pda@ms/ha),并分散于磷酸緩沖鹽溶液(pbs)中,備用。
步驟(1)中所述單層氧化石墨烯上清液的濃度為2mg/ml。
步驟(1)中所述tris-hcl緩沖液的濃度為10mm,ph為8.5。
步驟(1)中添加的鹽酸多巴胺與單層氧化石墨烯分散液的質量體積比為2:1。
步驟(2)中所述3-氨丙基三乙氧基硅烷的濃度為1m。
本發明的有益效果在于:
(1)本發明所制備的藥物納米傳輸載體,制備方法簡單,并突破了氧化石墨烯載藥的局限性,可用于裝載各種不同藥物(疏水性藥物、親水性藥物和帶電荷藥物等),具有良好的生物兼容性;
(2)具有癌細胞靶向和藥物光熱可控釋放功能:可將各種藥物靶向傳輸到cd-44過表達癌細胞,且可有效防止藥物泄漏,并通過808nm激光照射控制藥物在癌細胞內的釋放;
(3)本發明制備的藥物納米傳輸載體具有還原氧化石墨烯一樣的良好的光熱性能,可實現光熱增強型光動力治療,提高癌癥的光動力治療效果。
附圖說明
圖1多巴胺還原氧化石墨烯@多孔二氧化硅納米復合材料(rgo-pda@ms)的透射電鏡圖;
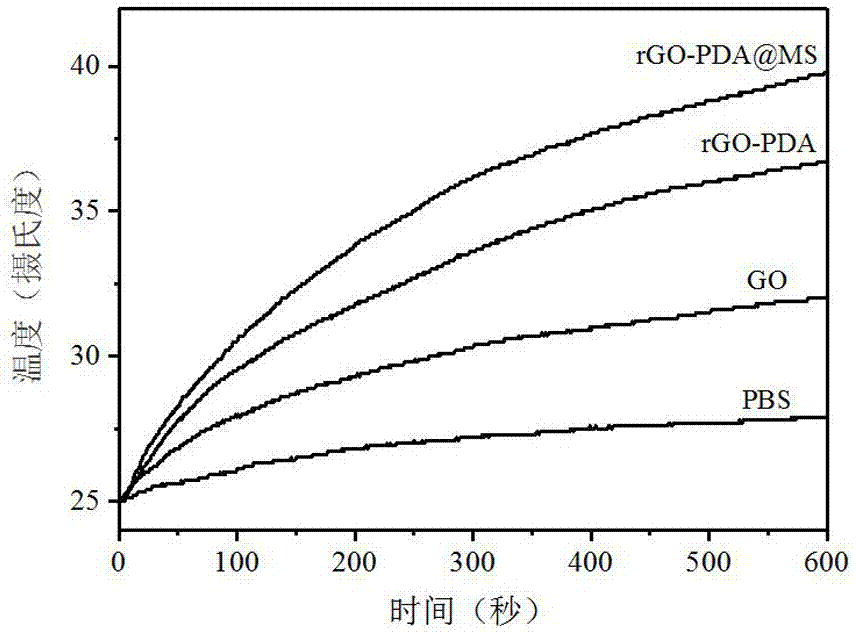
圖2rgo-pda@ms腫瘤靶向光熱響應可控釋放藥物納米傳輸載體在808nm1.5w激光照射下光熱升溫曲線;
圖3rgo-pda@ms/ce6/ha腫瘤靶向光熱響應可控釋放藥物納米傳輸載體的光熱響應藥物可控釋放曲線;
圖41.5μmrgo-pda@ms/ce6/ha分別與cd-44過表達癌細胞hct-116(靶向)、cd-44過表達癌細胞ht29(靶向)和正常細胞nih3t3(對照)細胞培養6h,經hoechst33342細胞核染色后的激光共聚焦細胞攝入圖;
圖5經2μmce6或rgo-pda@ms/ce6/ha處理的cd-44過表達癌細胞hct-116(靶向)、cd-44過表達癌細胞ht29(靶向)和正常細胞nih3t3(對照)細胞在不同條件下的細胞活力圖。
具體實施方式
以下結合具體實施例對本發明做進一步說明,但本發明不僅僅限于這些實施例。
實施例
將3g石墨粉與1.5g硝酸鈉(nano3)分散在70ml濃硫酸(h2so4)中,在冰水浴中快速攪拌,并緩慢加入9g高錳酸鉀(kmno4)。在35℃下攪拌30分鐘(min),加入300ml超純水稀釋,緩慢加入20ml的雙氧水(h2o2)。反應結束后,將溶液在10000rpm下離心,收集離心沉淀物獲得氧化石墨烯(go),并用10%鹽酸(hcl)和超純水交替清洗,置于14000da的透析袋,用超純水透析一周以去除雜質離子。最后將氧化石墨烯放入50℃真空干燥箱中干燥,備用。將上述制備的0.5g氧化石墨烯分散在100ml10mm的三羥甲基氨基甲烷(tris-hcl)緩沖溶液(ph8.5)中,超聲分散3h。將氧化石墨烯分散液高速(30000rpm)離心1h,收集單層氧化石墨烯(尺寸約為200nm)上清液(2mg/ml)。
移取上述氧化石墨烯分散液25ml于75ml10mm的tris-hcl(ph8.5)緩沖溶液中,水浴加熱至70℃,加入50mg鹽酸多巴胺,持續加熱攪拌反應24h。反應結束后,將生成的還原氧化石墨烯-聚多巴胺(rgo-pda,尺寸約為200nm)納米片置于14000da的透析袋,用超純水透析一周并在4℃下保存,備用。
在磁力攪拌下,加入2.4mg上述合成的還原氧化石墨烯-聚多巴胺(rgo-pda),1.2mmol十六烷基三甲基溴化銨(ctab),0.15mmol氫氧化鈉(naoh)于150ml水溶液中。分三次,間隔30min加入總計1.8ml四乙基原硅酸鹽(teos),室溫反應24h。之后,向反應液中加入67μl1m3-氨丙基三乙氧基硅烷(aptes),并繼續反應12h。反應結束后,將溶液以10000g離心30min,用甲醇、乙醇交替清洗5次,收集具備良好光熱性能的還原氧化石墨烯@多孔二氧化硅(rgo-pda@ms)(圖1、2)。
將rgo-pda@ms與透明質酸(ha)按質量比1:2混合攪拌24h,使ha通過靜電引力包裹于載體表面,防止藥物泄漏的同時,賦予載體靶向識別功能。將反應液在10000g離心力下離心,并用超純水洗滌去除多余的ha,制得所述腫瘤靶向光熱響應可控釋放藥物納米傳輸載體(rgo-pda@ms/ha),將rgo-pda@ms/ha分散于磷酸緩沖鹽溶液(pbs)中,備用。
應用例(在傳輸光敏藥物二氫卟吩e6(ce6)和cd-44過表達癌細胞光動力治療上的應用)
將本發明方法步驟(1)中已制備的rgo-pda@ms與藥物(ce6)水溶液按照質量比1:1混合,室溫攪拌12h將ce6裝載在rgo-pda@ms的多孔二氧化硅中(rgo-pda@ms/ce6)。在完成藥物裝載后,離心洗滌,去除多余的藥物。將裝載了光敏藥物ce6的rgo-pda@ms(rgo-pda@ms/ce6)與透明質酸(ha)按質量比1:2混合攪拌24h,使ha通過靜電引力包裹于載體表面(rgo-pda@ms/ce6/ha),防止藥物泄漏的同時,賦予載體靶向識別功能。將反應液在離心力10000g下離心,并用超純水洗滌去除多余的ha,完成ce6腫瘤靶向光熱響應藥物傳輸載體(rgo-pda@ms/ce6/ha)的構建,并將rgo-pda@ms/ce6/ha分散于磷酸緩沖鹽溶液(pbs,ph=7.4)中,4℃保存備用。
(2)將200μl上述rgo-pda@ms/ce6/ha載藥平臺(ce6,3μg/ml)通過皮下注射至小鼠腫瘤部位。注射后12h,腫瘤部位先用1w/cm2的808nm激光照射10min,再用0.05w/cm2的660nm激光照射5min,對腫瘤進行光熱增強光動力治療,跟蹤小鼠腫瘤大小與體重變化。從圖2可以看出,在波長為808nm,功率為1w/cm2的激光照射下,rgo-pda@ms的升溫速度明顯高于氧化石墨烯(go),說明我們所制備的納米藥物傳輸載體具有良好的光熱轉化能力,可增強癌癥的光動力治療效果。從圖3可看出,如果沒有用ha封閉(rgo-pda@ms/ce6),裝載在rgo-pda@ms中的ce6在細胞中短時間內幾乎全部釋放出來,產生泄露現象。經ha封閉后(rgo-pda@ms/ce6/ha),裝載在rgo-pda@ms/ce6/ha中的ce6在細胞中基本不泄露;而當用1w/cm2的808nm的激光照射10min時,裝載在rgo-pda@ms/ce6/ha中的ce6在細胞中部分釋放。圖3結果證明我們所研制的rgo-pda@ms/ha腫瘤靶向光熱響應藥物傳輸載體具有光熱響應特征,可用808nm的光照射控制藥物在細胞中的釋放。從圖4可知,用hoechst33343染色的三種細胞(靶向癌細胞hct-116、靶向癌細胞ht29和正常細胞nih3t3)均呈藍色熒光(左列),當3種細胞與rgo-pda@ms/ce6/ha作用后,靶向癌細胞hct-116和ht29明顯呈現出ce6的紅色熒光,而對照組的正常細胞nih3t3沒有呈現ce6的紅色熒光(中間列),說明rgo-pda@ms/ce6/ha可以靶向識別癌細胞hct-116和ht29并進入靶向癌細胞,而不會對正常細胞進行傷害。從圖5可知,相比于對照組(從左開始第1列,標有空白),在沒有照射情況下,結合有ce6(從左開始第2列)和rgo-pda@ms/ce6/ha(從左開始第4列)的三種細胞(靶向癌細胞hct-116、靶向癌細胞ht29和正常細胞nih3t3)仍然維持很高的存活率,說明我們的藥物傳輸載體(rgo-pda@ms/ce6/ha)具有優良的生物相容性。而在rgo-pda@ms/ce6/ha存在下,同時用波長為660nm的光(功率為0.05w/cm2)照射5分鐘情況下(從左開始第6列),靶向癌細胞hct-116和ht29的成活率降低至15%左右,而正常細胞nih3t3的成活率仍然維持在90%左右,說明我們的藥物傳輸載體(rgo-pda@ms/ce6/ha)可以特異識別癌細胞,并在660nm的光的作用下有效殺死癌細胞。在rgo-pda@ms/ce6/ha存在下,先用808nm的光(功率1w/cm2)照射10分鐘,接著再用660nm的光(功率為0.05w/cm2)照射5分鐘情況下(最右列),靶向癌細胞hct-116和ht29的成活率降低至5%左右,而正常細胞nih3t3的成活率仍然維持在85%左右,說明我們的藥物傳輸載體(rgo-pda@ms/ce6/ha)不但可以特異識別癌細胞,并在660nm的光的作用下有效殺死癌細胞,而且可以用808nm的光控制藥物ce6的釋放,并有效把光能轉化為熱能,增強了癌癥的光動力治療效果。
以上所述僅為本發明的較佳實施例,凡依本發明申請專利范圍所做的均等變化與修飾,皆應屬本發明的涵蓋范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!