Let?7c基因在制備治療阿爾茨海默病藥物中的應用的制作方法
本發明涉及生物醫學領域,具體涉及一種非編碼小分子rnalet-7c基因在制備治療阿爾茨海默病藥物中的應用。
背景技術:
阿爾茨海默病(alzheimerdisease,ad),又稱為老年性癡呆,是一種進行性神經系統退行性疾病,是癡呆中最常見的類型,臨床上主要表現為漸進性記憶減退、認知功能障礙以及其他神經精神癥狀和行為障礙。阿爾茨海默病具有兩個特征性的病理變化:β-淀粉樣蛋白(β-amyloidprotein,aβ)斑塊形成和神經原纖維纏結。aβ是機體的正常代謝產物,由β-淀粉樣前體蛋白(β-amyloidprecursorprotein,app)水解而來,在正常情況下它的產生和降解處于動態平衡,當某些原因導致app代謝異常時,aβ生成增多和(或)降解減少就會造成aβ大量沉積。app依次經過β-分泌酶和γ-分泌酶的切割后產生aβ。bace1,是體內主要的β-分泌酶,可以在β位點切割app,促進aβ生成。bace2與bace1同源,可以在θ位點切割app,從而減少aβ的產生。
此外,研究表明,app、早老蛋白-1(presenilin1)和早老蛋白-2(presenilin2)基因突變以及唐氏綜合征(downsyndrome,ds)都能夠誘發ad,其中ds病人高表達app、c99和aβ,是研究ad疾病的一個很好的模型。因此,本發明以唐氏綜合征細胞系(ds細胞系)對阿爾茨海默病進行相關的研究。
微小核糖核酸(microrna或mirnas)是一類普遍存在于真核生物中的長18-25bp長度的非編碼內源性小rna分子,它具有高度保守性不編碼蛋白質或多肽,而是通過與互補或部分互補的靶基因的mrna3’非編碼區相互作用,使mrna降解或誘發蛋白質翻譯抑制,從而抑制蛋白質合成。mirnas在調節細胞增殖、分化和發育等生物學過程、尤其在大腦的分化與發育中發揮關鍵作用。mirnas又可調節神經系統功能,例如,通過調節突觸的mrna從而調控突觸的可塑性。但有報道指出,mirnas對神經退行性疾病的發病進程有重要影響作用,特定mirna的錯誤調節和豐度的改變會導致ad的發生。但是ad的發病機制仍然不清楚。有研究表明,在ad早期進程中,調控bace1的mirna-107表達明顯下調,從而使bace1的mrna水平增加。有研究發現,在ad病人的海馬區域,mir-9,mir-124a,mir-125b,mir-128,mir-132以及mir-219的表達明顯改變。異常的mirna的表達與ad發病的機制,仍然是未知的。
let-7是第一個被確認的mirna,可調控線蟲發育,是目前研究最廣泛的mirna之一。let-7通過與靶基因序列不完全互補或完全互補,調控基因表達,當其與靶基因完全互補結合時,可直接降解靶基因mrna,當其與靶基因mrna的3’端非編碼發生不完全配對結合,則抑制靶基因的翻譯。let-7參與調控細胞生長分化、凋亡、免疫應答、腫瘤發生及轉移等多種生理病理過程。研究表明,let-7可通過抑制某些靶基因表達從而有效地抑制腫瘤轉移、增殖和促進腫瘤凋亡,對腫瘤的臨床診斷、治療及預后具有巨大的潛在價值。經檢索,目前未見有關let-7基因應用于阿爾茨海默病治療的相關報道。
公布號為cn104962657a的中國專利申請公開了yap1基因在阿爾茨海默病診治中的應用,該發明首次發現了yap1基因表達與阿爾茨海默病相關,并證明:與正常人群相比,阿爾茨海默病患者血液中的yap1基因表達顯著升高,且經過rna干擾實驗證明yap1能夠影響aβ介導的神經毒性作用,根據該發明的研究成果,可以研發能夠抑制yap1基因表達或者能夠抑制yap1基因表達產物功能的藥物,從而實現臨床上對于阿爾茨海默病的預防和治療。
技術實現要素:
本發明的目的在于提供一種非編碼小分子rnalet-7c基因的新用途,具體為非編碼小分子rnalet-7c基因在制備治療阿爾茨海默病藥物中的應用。
本發明所述的非編碼小分子rnalet-7c基因在制備治療阿爾茨海默病藥物中的應用,通過如下技術方案得到證實:
首先,本發明通過cdna基因芯片和半定量rt-pcr2種技術分析ds細胞和對照細胞中mirna的表達,其中,cdna基因芯片分析ds細胞中mirna的表達,結果顯示,let-7c、mir-99a、mir-155表達上調;pcr半定量結果顯示,let-7c在ds細胞的表達3倍于對照細胞。
此外,從ds細胞以及appsw/ps1ae9雙突變轉基因小鼠(ad小鼠,購自南京大學模式動物中心)的大腦中提取總rna,通過pcr半定量技術檢測let-7c基因表達水平,結果顯示,ds細胞中以及ad小鼠大腦中的let-7c表達均較正常細胞顯著提高,以上結果表明,非編碼小分子rnalet-7c基因在阿爾茨海默病的臨床診斷及預后判斷方面,具有重要的意義。
其次,本發明通過elisa雙抗體夾心法檢測app與c99分別與let-7c表達質粒共轉染hek293細胞和20e2細胞后aβ的表達水平,結果發現,共轉染let-7c表達質粒后的hek293細胞和20e2細胞,其aβ的表達量均顯著減少,表明let-7c可減少β-淀粉樣沉淀的產生。其中,所述的20e2細胞是穩定表達swedish突變型app蛋白(app695)的hek細胞系。
app的降解有兩種剪切方式,分別為淀粉樣剪切方式和非淀粉樣剪切方式。在淀粉樣剪切途徑中,bace1(β分泌酶)剪切app后產生分別一個sapp片段和一個c99片段,c99隨后被γ分泌酶剪切產生aβ和c末端ctf片段,從而促進aβ形成。在非淀粉樣剪切途徑中,app被α分泌酶剪切產生一個分泌型的app和c83,c83隨后被γ分泌酶剪切,從而抑制aβ產生。
為了進一步研究let-7c影響aβ產生的機制,本發明通過elisa雙抗體夾心法檢測let-7c轉染2eb2細胞后c99和c83/80的表達情況,所述的2eb2細胞是穩定表達appswedish突變型和bace1的細胞系。結果發現,在2eb2細胞中let-7c減少c99的表達并且增加c83/80的表達,表明let-7c可能通過影響app的非淀粉樣剪切途徑,抑制aβ產生。
另外,本發明用sirna干擾掉bace2后,檢測轉染let-7c表達質粒細胞中c99的表達的變化,結果發現,與對照組比較,用sirna干擾掉bace2后,let-7c不影響c99的表達,而采用非特異性陰性對照sirna進行處理后,檢測轉染let-7c表達質粒細胞中c99的表達的變化,結果發現,與對照組比較,let-7c可減少c99的表達。
同理,本發明用sirna干擾掉bace2后,檢測轉染let-7c表達質粒細胞中c83/80的表達的變化,結果發現,與對照組比較,用sirna干擾掉bace2后,let-7c不影響c83/80的表達,而采用非特異性陰性對照sirna進行處理后,檢測轉染let-7c表達質粒細胞中c83/80的表達的變化,結果發現,與對照組比較,let-7c可增加c83/80的表達,以上結果表明,let-7c可能通過影響bace2,降低c99的表達,增加c83/80的表達,從而減少β-淀粉樣沉淀的產生。
為了進一步研究let-7c對bace2活性和表達水平的影響,本發明從細胞中提取總rna并且分析bace2的啟動子區。結果發現,let-7c能夠明顯增加bace2的啟動子活性,并且bace2的表達明顯增加,但對bace23’非翻譯區并沒有明顯作用。和上述結果相一致,和對照相比,let-7c能夠上調bace2的mrna水平。同樣地,我們檢測了let-7c對bace1、app的影響作用,發現let-7c對bace1的3’非翻譯區、啟動子區域及app的啟動子區域沒有明顯作用。以上結果表明,let-7c可促進bace2的活性,并增加bace2的表達水平。
進一步地,為了研究let-7c與bace2啟動子區域的相互作用,本發明通過構建bace2啟動子區不同長度截短體雙熒光報告基因質粒,檢測過表達let-7c后不同截短體活性。結果發現,pb2p4的啟動子區-132到+304位置為let-7c作用位點所在區域。let-7c與bace2啟動子區域為不完全配對結合。
進一步地,由于mirna與靶基因結合需要ago蛋白家族的參與,為了驗證ago蛋白對let-7c與bace2啟動子區域結合的影響,本發明通過構建sh-ago1與sh-ago2質粒,沉默ago1、ago2蛋白表達。然后將sh-ago1、sh-ago2或let-7c分別與sh-ago1、sh-ago2共轉染入hek細胞,檢測bace2mrna水平,結果顯示,sh-ago1、sh-gao2過表達組的bace2mrna水平較低,而即使同時過表達let-7c,因為ago蛋白家族的缺失,bace2mrna水平依然比let-7c與空白對照共轉染組表達低。以上結果表明,ago蛋白家族的缺失會導致bace2mrna水平降低。
更進一步地,由于c99中含有bace2切割位點,為了驗證ago蛋白是否影響let-7c通過促進bace2活性從而降低c99水平,本發明將let-7c和c99分別與sh-ago1、sh-ago2共轉染入hek細胞,檢測標記c99的變化。結果發現,同時過表達let-7c、c99和sh-ago1或let-7c、c99和sh-ago2,標記c99的水平均比let-7c、c99與空白對照共轉染組高,表明ago蛋白家族的缺失,使bace2mrna水平降低,bace2表達降低,從而減少對c99的降解,使標記c99的水平增加。以上結果表明,let-7c與bace2啟動子區域結合進而影響bace2活性,let-7c通過影響bace2活性從而降低c99水平,抑制aβ形成,并且ago蛋白家族影響let-7c與bace2啟動子區域結合,ago蛋白家族的缺失會導致bace2mrna水平降低,從而減少對c99的降解,使標記c99的水平增加。
由上述試驗結果可知,let-7c可抑制aβ產生,而不可溶性aβ有毒性,可降低細胞的存活率。因此,我們檢測let-7c是否可通過抑制aβ產生從而影響細胞存活。結果發現,過表達let-7c,hek細胞存活率沒有改變,而sy5y細胞存活率則有微弱提高。kcnb1作為bace家族的已知底物,可被bace2切割,在過表達let-7c后,kcnb1含量減少,進一步證明let-7c可以增加bace2活性。以上結果表明,let-7c可抑制aβ產生,但對細胞存活率影響不大。
綜上所述,ds細胞中以及ad小鼠大腦中的let-7c表達均較正常細胞顯著提高,非編碼小分子rnalet-7c基因在阿爾茨海默病的臨床診斷及預后判斷方面,具有重要的意義。let-7c通過與bace2啟動子區域進行不完全配對結合,促進bace2活性,增加bace2表達水平,進而降低c99水平、增加c83/80水平,減少aβ的產生,抑制阿爾茨海默病的病理變化。let-7c可作為治療阿爾茨海默病的一個新靶點,可用于制備治療阿爾茨海默病的藥物而使用。
本發明所述的let-7c基因的核苷酸序列如seqidno:1所示,具體為:
gcauccggguugagguaguagguuguaugguuuagaguuacacccugggaguuaacuguacaaccuucuagcuuuccuuggagc。
進一步地,所述的治療阿爾茨海默病藥物包括有效劑量的let-7c基因及其藥學上可接受的載體或病毒載體。
更進一步地,所述的載體為殼聚糖、膽固醇、脂質體和納米顆粒中的一種或多種;所述的病毒載體為慢病毒載體、逆轉錄病毒載體或腺病毒載體中的一種或多種。
進一步地,所述的治療阿爾茨海默病藥物的劑型為任何適用于mirna藥物使用的劑型。
優選地,所述的治療阿爾茨海默病藥物的劑型為注射劑。
進一步地,所述的阿爾茨海默病包括由唐氏綜合征發展而成的阿爾茨海默病。
與現有技術相比,本發明具有以下有益效果:本發明提供了一種非編碼小分子rnalet-7c基因的新用途,具體為非編碼小分子rnalet-7c基因在制備治療阿爾茨海默病藥物中的應用。作為治療阿爾茨海默病的新藥物靶點,let-7c基因不僅對阿爾茨海默病的臨床診斷及預后判斷方面,具有重要的意義,對其進行細胞功能學研究的結果表明,let-7c基因可顯著減少aβ的產生,抑制阿爾茨海默病的病理變化,可用于制備治療阿爾茨海默病基因藥物和靶向藥物。
附圖說明
圖1為ds細胞系染色體核型分析結果圖。
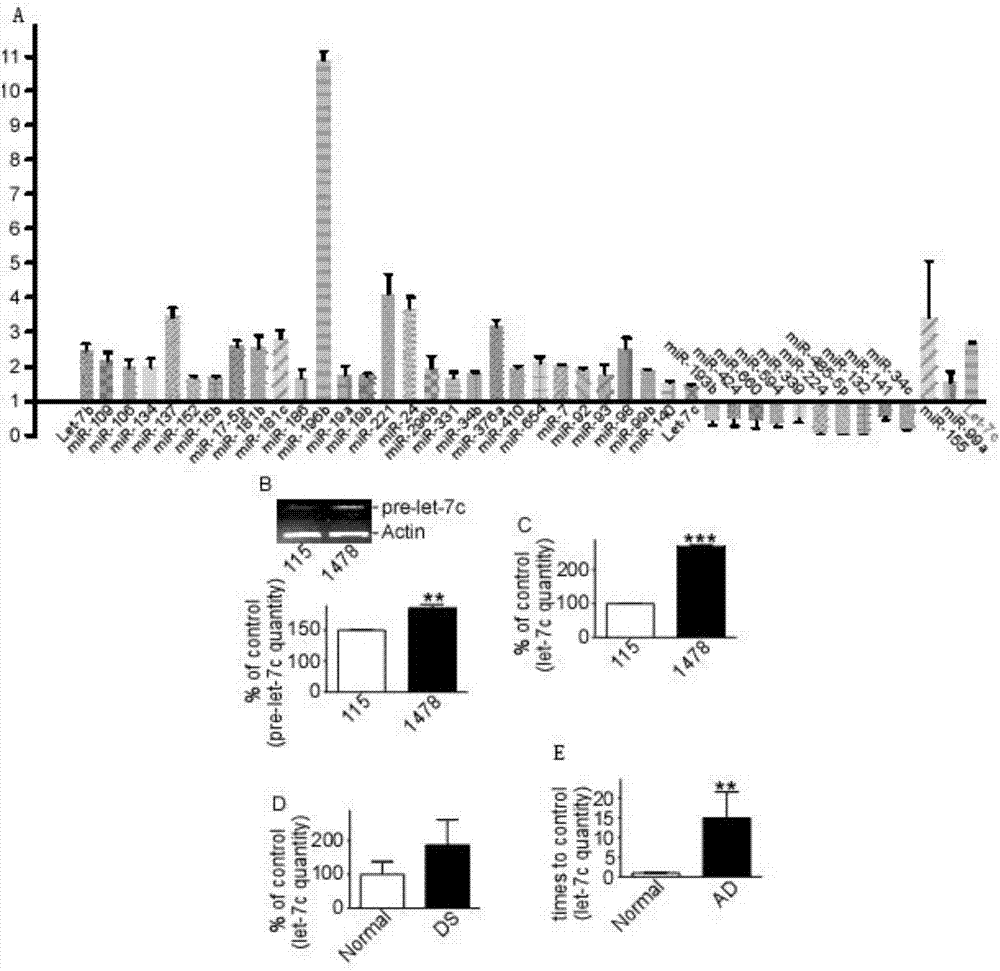
圖2為采用cdna基因芯片和半定量rt-pcr測定ds細胞系mirna的表達結果圖,其中a為采用cdna基因芯片分析ds細胞系mirna的表達結果圖,b和c為半定量rt-pcr測定ds細胞(1478)和對照細胞(115)中pre-let-7c和let-7c的含量,d和e為半定量rt-pcr測定ds細胞中和appsw/ps1ae9雙突變轉基因小鼠(ad小鼠)大腦中let-7c的含量。
圖3為采用雙夾心法elisa檢測hek細胞和20e2細胞中aβ的表達結果圖,其中,a為app與let-7c表達質粒共轉染hek293細胞后aβ表達結果圖,b為c99與let-7c表達質粒共轉染hek293細胞后aβ表達結果圖,c為let-7c表達質粒轉染20e2細胞后aβ表達結果圖。
圖4為采用雙夾心法elisa檢測let-7c轉染2eb2細胞后c99和c83/80的表達結果圖,其中,a為let-7c轉染2eb2細胞后c99和c83/80的表達結果圖,b為flagc99(熒光標記c99)和let-7c共轉染2eb2細胞后c99表達水平變化結果圖,c為用sirna干擾掉bace2后,檢測轉染let-7c表達質粒細胞中c99的表達變化結果圖,d為用sirna干擾掉bace2后,檢測轉染let-7c表達質粒細胞中c83/80的表達變化結果圖。
圖5為采用熒光素酶活性檢測技術測定let-7c對bace1和bace2的3’非翻譯區域活性、啟動子區域活性和app的啟動子區域活性的影響結果圖,其中,a為let-7c對bace23’非翻譯區域活性影響結果圖,b為let-7c對bace2啟動子區域活性影響結果圖,c為let-7c對bace2表達量影響結果圖,d為let-7c對bace2mrna水平影響結果圖,e-g分別為let-7c對bace1的3’非翻譯區、啟動子區域及app的啟動子區域活性影響結果圖。
圖6為let-7c與bace2啟動子區域相互作用結果圖,其中,a為構建bace2啟動子區域不同長度截短體雙熒光報告基因質粒,b為不同長度截短體雙熒光報告基因質粒對bace2啟動子區域活性影響結果圖,c為let-7c與bace2啟動子區域為不完全配對結合圖,d為構建sh-ago1與sh-ago2質粒,沉默ago1、ago2蛋白表達結果圖,e為sh-ago1、sh-ago2或let-7c分別與sh-ago1、sh-ago2共轉染入hek細胞后bace2mrna表達結果圖,f為let-7c和c99分別與sh-ago1、sh-ago2共轉染入hek細胞后c99表達結果圖。
圖7為采用mtt法檢測let-7c對hek細胞和sy5y細胞存活率影響結果圖,其中,a為let-7c對hek細胞存活率影響結果圖,b為let-7c對sy5y細胞存活率影響結果圖,c為let-7c對bace2活性及其底物kcnb1含量影響結果圖。
具體實施方式
以下通過具體實施方式進一步描述本發明,但本發明不僅僅限于以下實施例。
本發明中所用到的材料可通過市售得到或通過本領域的常規方法得到。如:阿爾茨海默病(ad)小鼠(appsw/ps1ae9)購買自南京大學模式動物中心;ds細胞系umb1478(47xx,+21),umb907(47xy,+21)和對照細胞系umb115(46xx),umb350(46xy)由馬里蘭大學惠贈,hek293購于atcc,2eb2為本實驗室在hek293基礎上構建的穩定表達app、bace1的細胞系,20e2為本實驗室在hek293基礎上構建的穩定表達app的細胞系,p-super表達載體購自oligoengine(catalog#vec-pbs-0002),tri-reat試劑購自sigma(t9424),tldahumanmirnapanel芯片購自thermo公司(4470187),轉染試劑lipofectamineplus購自invitrogen公司(11668019),雙熒光素酶檢測試劑購自promega公司(e1910)。
實施例1ds細胞系核型分析
使用秋水仙素(5ug/ml)處理ds細胞3小時后,收集細胞并用0.075%kcl處理細胞30分鐘(使細胞膨脹),然后用固定液(甲醇:冰醋酸,3:1)固定細胞,再將固定好的細胞滴到玻片上,用0.025%的胰酶處理1分鐘,最后用giemsa染色10分鐘,顯微鏡下進行核型分析,結果顯示,ds細胞系的染色體核型是47xx,+21(1478),見圖1。
實施例2采用cdna基因芯片和半定量rt-pcr測定ds細胞系mirna的表達
使用tri-reat試劑從ds細胞(umb1478)和對照細胞(umb115)中分離總rna。按照說明書,使用multiplexrthumanpool4,v1fortaqmanmiran,以上述rna樣品為模板,合成cdna。以上述cdna為模板,使用商品化的tldahumanmirnapanel芯片,檢測不同mirna的表達,結果顯示,let-7c、mir-99a、mir-155表達上調,見圖2a。
使用半定量rt-pcr技術,分別測定ds細胞(1478)和對照細胞(115)中pre-let-7c(let-7c前體)和let-7c的含量,此外,從ds細胞以及appsw/ps1ae9雙突變轉基因小鼠(ad小鼠)的大腦中提取總rna,通過半定量rt-pcr技術檢測let-7c基因表達水平。結果顯示:ds細胞(1478)中pre-let-7c和let-7c的含量較對照細胞(115)顯著增加,let-7c在ds細胞(1478)的表達3倍于對照細胞(115),見圖2b和c;此外,ds細胞中以及ad小鼠大腦中的let-7c表達均較正常細胞顯著提高,見圖2d和e。以上結果表明,非編碼小分子rnalet-7c基因在阿爾茨海默病的臨床診斷及預后判斷方面,具有重要的意義。
實施例3雙夾心法elisa檢測hek細胞和20e2細胞中aβ的表達量
采用常規方法培養hek細胞和20e2細胞。將mir-7c(let-7c),has-mir-99a(c99)的基因序列克隆到p-super表達載體中,構建mir-7c,mir-99a的表達質粒,其中has-mir-99a核苷酸序列如seqidno:2所示,具體為:
ccauuggcauaaacccguagauccgaucuuguggugaaguggaccgcacaagcucgcuucuaugggucugugucagugug。按照lipofectamineplus說明書將質粒轉染入細胞,具體為:將構建好的mir-7c表達質粒與app共轉染hek293細胞,將mir-7c,mir-99a的表達質粒共轉染hek293細胞,將mir-7c表達質粒單獨轉染20e2細胞,將質粒轉染入細胞培養48小時后,收集細胞進一步測定細胞中aβ的表達水平,具體為:收集細胞,用冰預冷的pbs洗2次,使用ripa裂解液(含蛋白酶抑制劑)超聲裂解細胞,離心,取上清。使用bio-raddcproteinassay定量蛋白。用12%的sds-page分離蛋白,轉膜,封閉,加入一抗孵育,清洗,加入二抗孵育,顯色,測定aβ的表達水平,其中aβ(1-40)elisakit購于invitrogen公司(99-0063)。
結果顯示:let-7c與app共轉染hek293細胞,可顯著減少aβ的表達量,見圖3a;let-7c和c99共轉染hek293細胞,可顯著減少aβ的表達量,見圖3b;let-7c單獨轉染20e2細胞,可顯著減少aβ的表達量,見圖3c;其中,所述的20e2細胞是穩定表達swedish突變型app蛋白(app695)的hek細胞系。以上結果表明,let-7c可減少β-淀粉樣沉淀的產生。
實施例4檢測let-7c轉染2eb2細胞后c99和c83/80的表達量
采用常規方法培養2eb2細胞,按照lipofectamineplus說明書將mir-7c表達質粒單獨轉染2eb2細胞,觀察c99和c83/80表達水平變化;將flagc99(熒光標記c99)和mir-7c表達質粒共轉染2eb2細胞,觀察觀察c99表達水平變化;使用sirna干擾掉bace2,觀察c99和mir-7c表達質粒共轉染2eb2細胞后c99表達水平變化;使用sirna干擾掉bace2,觀察c83/80和mir-7c表達質粒共轉染2eb2細胞后c83/80表達水平變化。具體為:將質粒轉染入細胞培養48小時后,收集細胞進一步測定細胞中c99和c83/80的表達水平,具體為:收集細胞,用冰預冷的pbs洗2次,使用ripa裂解液(含蛋白酶抑制劑)超聲裂解細胞,離心,取上清。使用bio-raddcproteinassay定量蛋白。用12%的sds-page分離蛋白,轉膜,封閉,加入一抗孵育,清洗,加入二抗孵育,顯色,測定c99和c83/80的表達水平,其中c99和c83/80抗體購自于abcam公司(nbp1-05103)。
結果顯示:let-7c轉染2eb2細胞后c99的表達減少,c83/80的表達增加,見圖4a;flagc99和let-7c共轉染2eb2細胞后c99的表達減少,見圖4b;使用sirna干擾掉bace2后,let-7c不影響c99的表達,而使用非特異性陰性對照sirna進行處理,let-7c可減少c99的表達,見圖4c;使用sirna干擾掉bace2后,let-7c不影響c83/80的表達,而使用非特異性陰性對照sirna進行處理后,let-7c可增加c83/80的表達,見圖4d。以上結果表明,let-7c可能通過影響app的非淀粉樣剪切途徑,減少c99的表達并且增加c83/80的表達,抑制aβ產生,并且let-7c可能通過影響bace2,減少c99的表達,增加c83/80的表達,從而減少β-淀粉樣沉淀的產生。
實施例5利用熒光素酶活性檢測技術測定let-7c對bace1和bace2的3’非翻譯區域活性、啟動子區域活性和app的啟動子區域活性的影響
采用常規方法培養hek293細胞,按照lipofectamineplus說明書將bace1和bace2的3’非翻譯區域基因/啟動子區域基因-熒光素酶報告基因載體以及app的啟動子區域基因-熒光素酶報告基因載體分別與let-7c共轉染hek293細胞,并使其在細胞內表達熒光素酶,采用雙熒光素酶檢測試劑測定細胞裂解液中熒光素酶的活性并用內參照載體的活性進行校準,最終活性比值反映bace1和bace2的3’非翻譯區域/啟動子區域活性和app的啟動子區域活性。同時測定將let-7c轉染hek293細胞后,bace2蛋白表達水平變化以及bace2mrna水平變化,其中bace2抗體購自abcam公司(貨號:ab5670)。
結果顯示,let-7c能夠明顯增加bace2的啟動子區域活性,見圖5b,增加bace2的表達,見圖5c和d,但對bace23’非翻譯區域活性并沒有明顯作用,見圖5a;let-7c對bace1的3’非翻譯區、啟動子區域活性及app的啟動子區域活性沒有明顯作用,見圖5e-g。以上結果表明,let-7c可促進bace2的活性,并增加bace2的表達水平。
實施例6bace2啟動子截短載體的構建與雙熒光素酶活性的檢測
為了研究let-7c與bace2啟動子區域的相互作用,本發明通過構建bace2啟動子區不同長度截短體雙熒光報告基因質粒,并將上述報告基因質粒轉染hek293細胞,采用雙熒光素酶活性檢測技術測定不同啟動子截短載體的啟動子活性。結果發現,pb2p4的啟動子區的活性最高,見圖6b;pb2p4的啟動子區-132到+304位置為let-7c作用位點所在區域,見圖6a;let-7c與bace2啟動子區域為不完全配對結合,見圖6c。
實施例7ago蛋白家族對let-7c與bace2啟動子區域結合的影響
由于mirna與靶基因結合需要ago蛋白家族的參與,為了驗證ago蛋白對let-7c與bace2啟動子區域結合的影響,本發明通過構建sh-ago1與sh-ago2質粒,沉默ago1、ago2蛋白表達,見圖6d。然后將sh-ago1、sh-ago2或let-7c分別與sh-ago1、sh-ago2共轉染入hek細胞,檢測bace2mrna水平,結果顯示,sh-ago1、sh-gao2過表達組的bace2mrna水平較低,而即使同時過表達let-7c,因為ago蛋白家族的缺失,bace2mrna水平依然比let-7c與空白對照共轉染組表達低,見圖6e。以上結果表明,ago蛋白家族的缺失會導致bace2mrna水平降低。
由于c99中含有bace2切割位點,為了驗證ago蛋白是否影響let-7c通過促進bace2活性從而降低c99水平,本發明將let-7c和c99分別與sh-ago1、sh-ago2共轉染入hek細胞,檢測標記c99的變化。結果發現,同時過表達let-7c、c99和sh-ago1或let-7c、c99和sh-ago2,標記c99的水平均比let-7c、c99與空白對照共轉染組高,表明ago蛋白家族的缺失,使bace2mrna水平降低,bace2表達降低,從而減少對c99的降解,使標記c99的水平增加,見圖6f。以上結果表明,let-7c與bace2啟動子區域結合進而影響bace2活性,let-7c通過影響bace2活性從而降低c99水平,抑制aβ形成,并且ago蛋白家族影響let-7c與bace2啟動子區域結合,ago蛋白家族的缺失會導致bace2mrna水平降低,從而減少對c99的降解,使標記c99的水平增加。
實施例8let-7c對hek細胞和sy5y細胞存活率影響
let-7c可抑制aβ產生,而不可溶性aβ有毒性,可降低細胞的存活率。因此,我們檢測let-7c是否可通過抑制aβ產生從而影響細胞存活。采用mtt比色法檢測過表達let-7c后hek細胞和sy5y細胞存活率變化。結果發現,過表達let-7c,hek細胞存活率沒有改變,而sy5y細胞存活率則有微弱提高,見圖7a和b。kcnb1作為bace家族的已知底物,可被bace2切割,在過表達let-7c后,kcnb1含量減少,見圖7c,進一步證明let-7c可以增加bace2活性。以上結果表明,let-7c可抑制aβ產生,但對細胞存活率影響不大。
以上僅是本發明的優選實施方式,應當指出的是,上述優選實施方式不應視為對本發明的限制,本發明的保護范圍應當以權利要求所限定的范圍為準。對于本技術領域的普通技術人員來說,在不脫離本發明的精神和范圍內,還可以做出若干改進和潤飾,這些改進和潤飾也應視為本發明的保護范圍。
sequencelisting
<110>山東大學齊魯醫院
<120>let-7c基因在制備治療阿爾茨海默病藥物中的應用
<130>1231
<160>2
<170>patentinversion3.3
<210>1
<211>84
<212>rna
<213>人工序列
<400>1
gcauccggguugagguaguagguuguaugguuuagaguuacacccugggaguuaacugua60
caaccuucuagcuuuccuuggagc84
<210>2
<211>80
<212>rna
<213>人工序列
<400>2
ccauuggcauaaacccguagauccgaucuuguggugaaguggaccgcacaagcucgcuuc60
uaugggucugugucagugug80
- 還沒有人留言評論。精彩留言會獲得點贊!
- 化藥/基因共轉運功能化碳納米管的制備方法及應用與流程
- 抗體基因的表達?分泌系統的制作方法與工藝
- 抗體捕獲蛋白及報告基因融合重組蛋白檢測抗體的方法與流程
- 治療性重組抗體、其編碼基因及應用的制作方法與工藝
- 一種制備高效合成泛酸基因工程菌的方法及其應用與流程
- MACF1基因及其表達產物在制備診斷和治療骨質疏松癥藥物中的應用的制作方法與工藝
- 野生型IDH2基因作為靶標在制備非小細胞肺癌治療藥物中的應用的制作方法與工藝
- FBN1基因在制備檢測先天性單純性晶狀體異位制品中的應用的制作方法與工藝
- TMEM104基因在制備治療椎間盤退行性疾病藥物中的應用的制作方法與工藝
- PSMG4基因在制備男性骨質疏松癥診斷產品中的用途的制造方法與工藝