2?(9?亞甲基蒽)氨基硫脲和TAT修飾的金納米載藥體系及應用的制作方法
本發明涉及生物醫藥領域,具體地說,涉及一種2-(9-亞甲基蒽)氨基硫脲和tat修飾的金納米載藥體系及應用。
背景技術:
由于獨特的物理化學性質,如局部表面等離子體共振,以及良好的生物相容性、簡便有效的表面修飾等特性,金納米顆粒受到了廣泛的關注,在生物傳感器、藥物輸送、腫瘤的靶向診斷與治療方面等領域都表現出巨大的應用潛力和前景。
rgrkkrrqrrr是來源于hiv-1tat蛋白的一個經典的細胞膜穿透肽,富含精氨酸(氨基),正電荷的高密度使其能夠與磷脂的頭基發生強烈的相互作用,從而能夠穿過細胞膜,因此廣泛被應用在納米載藥體系的構建。
由于腫瘤細胞多藥耐藥性的產生,化療藥物在臨床上的應用受到很大局限。藥物外排轉運蛋白如p-糖蛋白(p-glucoprotein,p-gp)的過度表達形成多藥耐藥的關鍵因素。p-gp結構由tmd1和tmd2(trans-membranedomain)兩個疏水性跨膜結構域和兩個核苷酸結合結構域nbd1和nbd2(nucleotide-bindingdomain)交叉排列組合。在結合atp之前,tmds可形成孔道,此孔道胞外端開口而胞內端封閉。在nbd(一個或兩個)結合atp后(此過程不耗能),tmds重排,形成一個胞內側開口胞外端封閉,側面有裂口的孔道。
技術實現要素:
本發明的目的是提供一種2-(9-亞甲基蒽)氨基硫脲和tat修飾的金納米載藥體系及其制備方法。
本發明的另一目的是提供上述金納米載藥體系在抗腫瘤藥物中的應用。
為了實現本發明目的,本發明分別構建了3.8nm和22.1nm兩種不同粒徑的金納米載藥體系,并修飾能夠提高細胞膜穿透力的多肽tat(cyrgrkkrrqrrr)和具有抗腫瘤活性的2-(9-亞甲基蒽)氨基硫脲。通過體外抗腫瘤活性評價表明,大粒徑載藥體系的耐藥指數更小,表明大粒徑納米顆粒更利于腫瘤耐藥性的治療,并且可以應用于細胞水平的拉曼成像。
所述小粒徑2-(9-亞甲基蒽)氨基硫脲和tat修飾的金納米載藥體系,其制備方法包括以下步驟:
⑴硼氫化鈉還原法制備檸檬酸根離子包被的金納米顆粒:在0.1~0.5mmhaucl4和0.1~0.5mm檸檬酸鈉混合水溶液200ml中,加入冰浴的0.1~0.2mnabh4水溶液5~10ml,室溫避光攪拌2~6h;
⑵tat修飾:將0.5~1mm多肽tat水溶液1ml加入到197ml步驟⑴制得的溶液中,室溫攪拌1~10min;
⑶2-(9-亞甲基蒽)氨基硫脲包覆:將0.1~0.3mg/ml2-(9-亞甲基蒽)氨基硫脲的dmso溶液12~16ml加入到步驟(2)制得的溶液中,室溫避光攪拌1.5~3h;靜置,水洗數次,離心,用標準曲線法進行定量,獲得的固體即為金納米載藥體系。
按照上述方法制備的金納米載藥體系呈球形,粒徑為3.8±0.7nm,消光吸收峰約為512nm。
所述大粒徑2-(9-亞甲基蒽)氨基硫脲和tat修飾的金納米載藥體系,其制備方法包括以下步驟:
⑴檸檬酸鈉還原法制備檸檬酸根離子包被的金納米顆粒:在0.1~0.5mmhaucl4水溶液192ml中,加入0.5~1.5%檸檬酸鈉水溶液6~12ml,攪拌,回流2~3h,備用;
⑵tat修飾:將0.05~0.15mm多肽tat水溶液40~50μl加入到步驟⑴制得的溶液中,室溫攪拌1~10min;
⑶2-(9-亞甲基蒽)氨基硫脲包覆:依次將0.01~0.1mg/ml2-(9-亞甲基蒽)氨基硫脲的dmso溶液9~12ml和0.2~0.5mg/ml2-(9-亞甲基蒽)氨基硫脲的dmso溶液1~6ml加入到步驟⑵制得的溶液中(分成兩個不同濃度添加,旨在獲得穩定的體系),室溫避光攪拌1.5~3h;靜置,水洗數次,離心,用標準曲線法進行定量,獲得的固體即為金納米載藥體系。
按照上述方法制備的金納米載藥體系呈球形,粒徑為22.1±3.6nm,消光吸收峰約為522nm。
本發明分別構建了兩種不同粒徑的2-(9-亞甲基蒽)氨基硫脲和tat修飾的金納米載藥體系,3.8nm的金納米球以硼氫化鈉為還原劑,檸檬酸鈉為穩定劑,22.1nm的金納米球以檸檬酸鈉同時為還原劑和穩定劑,并在兩種顆粒表面分別修飾修飾多肽tat和2-(9-亞甲基蒽)氨基硫脲。
用所述兩種不同大小的金納米顆粒100μg/ml培養hepg2細胞24小時后,細胞存活率在90%左右,證明兩種粒徑的金納米顆粒細胞毒性很小。可以通過提高細胞對藥物的攝取從而提高藥物的抗腫瘤效應。
所述不同粒徑的2-(9-亞甲基蒽)氨基硫脲和tat共同修飾的金納米載藥體系對于耐藥細胞抗腫瘤效應不同,受腫瘤細胞外排泵的影響,3.8nm的金納米載藥體系(ans–tat–aunps3.8nm)更容易被排出細胞,因此22.1nm的載藥體系(ans–tat–aunps22.1nm)的耐藥指數明顯低于3.8nm載藥體系。所述22.1nm金球對2-(9-亞甲基蒽)氨基硫脲的拉曼信號有明顯的增強效應,因此22.1nm的2-(9-亞甲基蒽)氨基硫脲和tat修飾的金納米體系(ans–tat–aunps22.1nm)可用于細胞水平拉曼成像。
本發明還提供由所述金納米載藥體系制備的抗腫瘤藥物或組合物。
本發明還提供所述金納米載藥體系在制備抗腫瘤藥物或組合物中的應用。
本發明所述腫瘤包括但不限于人乳腺癌細胞mcf-7、人乳腺癌耐藥細胞mcf-7/adr等多種腫瘤細胞。
本發明進一步提供所述金納米載藥體系(ans–tat–aunps22.1nm)在細胞拉曼成像中的應用。
本發明具有以下優點:
(一)合成的粒徑為3.8nm和22.1nm的金納米顆粒具有良好的生物相容性,在細胞活力試驗中已被證明細胞毒性很低。
(二)mtt細胞毒性實驗證明,該載藥體系的抗腫瘤活性相對于2-(9-亞甲基蒽)單體明顯提高。
(三)兩種粒徑的ans–tat–aunps載藥體系均可以降低mcf-7/adr耐藥細胞的耐藥指數,且ans–tat–aunps22.1nm治療組的耐藥指數低于ans–tat–aunps3.8nm治療組。
(四)22.1nm的金納米載藥體系對于2-(9-亞甲基蒽)氨基硫脲的拉曼信號有增強效果,并可用于細胞水平的拉曼成像。
附圖說明
圖1為本發明實施例1和2制備的ans–tat–aunps3.8nm(左)和ans–tat–aunps22.1n(右)納米金球的透射電鏡照片。
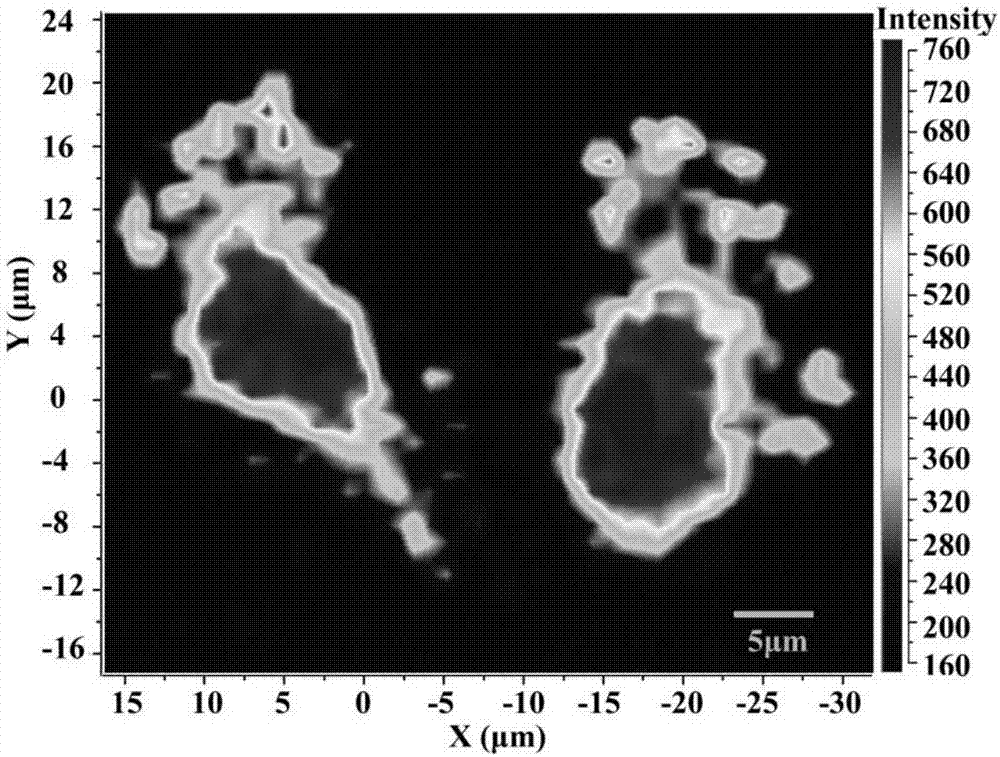
圖2為本發明實施例4中13.1μmans–tat–aunps22.1nm孵育mcf-7/adr細胞9h后在1250cm-1處的拉曼強度分布。激發條件632.8nm。
具體實施方式
以下實施例用于說明本發明,但不用來限制本發明的范圍。若未特別指明,實施例中所用的技術手段為本領域技術人員所熟知的常規手段,所用原料均為市售商品。
實施例1ans–tat–aunps3.8nm及其制備方法
本實施例中合成的粒徑為3.8nm的金納米載藥體系,制備方法包括以下步驟:
⑴硼氫化鈉還原法制備檸檬酸根離子包被的金納米顆粒:在0.25mmhaucl4和0.25mm檸檬酸鈉的混合水溶液200ml中,加入冰浴的0.1mnabh4水溶液6ml,室溫避光攪拌2h;
⑵tat修飾:將1mm多肽tat水溶液1ml加入到197ml步驟⑴制得的溶液中,室溫攪拌1min;
⑶2-(9-亞甲基蒽)氨基硫脲包覆:將0.2mg/ml2-(9-亞甲基蒽)氨基硫脲的dmso溶液15ml加入到步驟(2)制得的溶液中,室溫避光攪拌2h;靜置,水洗數次,離心,用標準曲線法進行定量,獲得的固體即為金納米載藥體系。
ans–tat–aunps3.8nm呈球形,粒徑約為3.8nm,消光吸收峰約為512nm。
實施例2ans–tat–aunps22.1n及其制備方法
本實施例中合成的粒徑為22.1nm的金納米載藥體系,制備方法包括以下步驟:
⑴檸檬酸鈉還原法制備檸檬酸根離子包被的金納米顆粒:在0.23mmhaucl4水溶液192ml中,加入1%檸檬酸鈉水溶液10ml,攪拌,回流2h,備用;
⑵tat修飾:將0.1mm多肽tat水溶液43.95μl加入到步驟⑴制得的溶液中,室溫攪拌1min;
⑶2-(9-亞甲基蒽)氨基硫脲包覆:依次將0.05mg/ml2-(9-亞甲基蒽)氨基硫脲的dmso溶液10ml和0.2mg/ml2-(9-亞甲基蒽)氨基硫脲的dmso溶液5ml,加入到步驟⑵制得的溶液中,室溫避光攪拌2h;靜置,水洗數次,離心,用標準曲線法進行定量,獲得的固體即為金納米載藥體系。
ans–tat–aunps22.1nm呈球形,粒徑約為22.1nm,消光吸收峰約為522nm。
實施例1和2制備的ans–tat–aunps3.8nm(左)和ans–tat–aunps22.1nm(右)納米金球的透射電鏡照片見圖1。
實施例3ans-tat-aunps耐藥指數測定
對不同粒徑的ans-tat-aunps的耐藥指數進行了測定,實驗方法采用了常規的mtt法。
1.樣品配制:將ans-tat-aunps溶解在dmso/水的混合溶液中,用培養基稀釋。
2.細胞株:mcf-7敏感細胞及mcf-7/adr耐藥細胞,以上細胞株均由本實驗室凍存和傳代。
3.培養液:rpmi1640+10%胎牛血清+雙抗(青霉素、鏈霉素各100u/ml)。
4.其他材料:全自動酶標儀,型號perkinelmerenspire2300multilabelplatereader,96孔板。
5.試驗方法:mtt法。在96孔板中每孔加入5×104/ml的細胞懸液100μl,置于37℃,5%co2的培養箱內。24小時后,將培養液吸出,換成含藥培養基。培養24后,每孔加5mg/mlmtt溶液20μl。作用4h后吸出液體,加入100μldmso,于搖床內15min,用酶標儀檢測570nm處od值。
6.結果表示:結果見表1。
6.1.ic50:獲得50%細胞增殖抑制的藥物濃度。每個實驗組進行3次獨立的實驗,每個濃度設6個復孔。
6.2.耐藥指數(dri)=ic50(mcf-7/adr)/ic50(mcf-7)
表1
實施例4ans–tat–aunps22.1nm的細胞拉曼成像
1.樣品配制:將ans-tat-aunps22.1nm溶解在dmso和水的混合溶液中,用培養基稀釋。
2.細胞株:mcf-7敏感細胞及mcf-7/adr耐藥細胞。
3.培養液:rpmi1640+10%胎牛血清+雙抗(青霉素、鏈霉素各100u/ml)。
4.其他材料:拉曼光譜儀,labramhrevolutionspectrometer,horiba,載玻片,蓋玻片,6孔板。
5.試驗方法:將蓋玻片置于6孔板中,每孔加入2×104/ml的細胞懸液2ml,置于37℃,5%co2的培養箱內。24小時后,將培養液吸出,換成含藥培養基。培養9小時后,棄去培養基,用pbs洗三遍。加入4%多聚甲醛室溫固定20min,用pbs洗三遍后,取出蓋玻片,固定在載玻片上,在632.8nm激光條件下進行測定。
6.數據采集:取1250cm-1處的拉曼強度進行細胞成像。
結果見圖2。可見,ans-tat-aunps22.1nm對2-(9-亞甲基蒽)氨基硫脲的拉曼信號有明顯的增強效應,因此ans-tat-aunps22.1nm可用于細胞水平拉曼成像。
雖然,上文中已經用一般性說明及具體實施方案對本發明作了詳盡的描述,但在本發明基礎上,可以對之做一些修改或改進,這對本領域技術人員而言是顯而易見的。因此,在不偏離本發明精神的基礎上所做的這些修改或改進,均屬于本發明要求保護的范圍。
序列表
<110>首都醫科大學
<120>2-(9-亞甲基蒽)氨基硫脲和tat修飾的金納米載藥體系及應用
<130>khp171111939.3tq
<160>1
<170>patentinversion3.3
<210>1
<211>13
<212>prt
<213>人工序列
<400>1
cystyrargglyarglyslysargargglnargargarg
1510
- 還沒有人留言評論。精彩留言會獲得點贊!