使用抗壞血酸穩定化放射性藥物組合物的制作方法
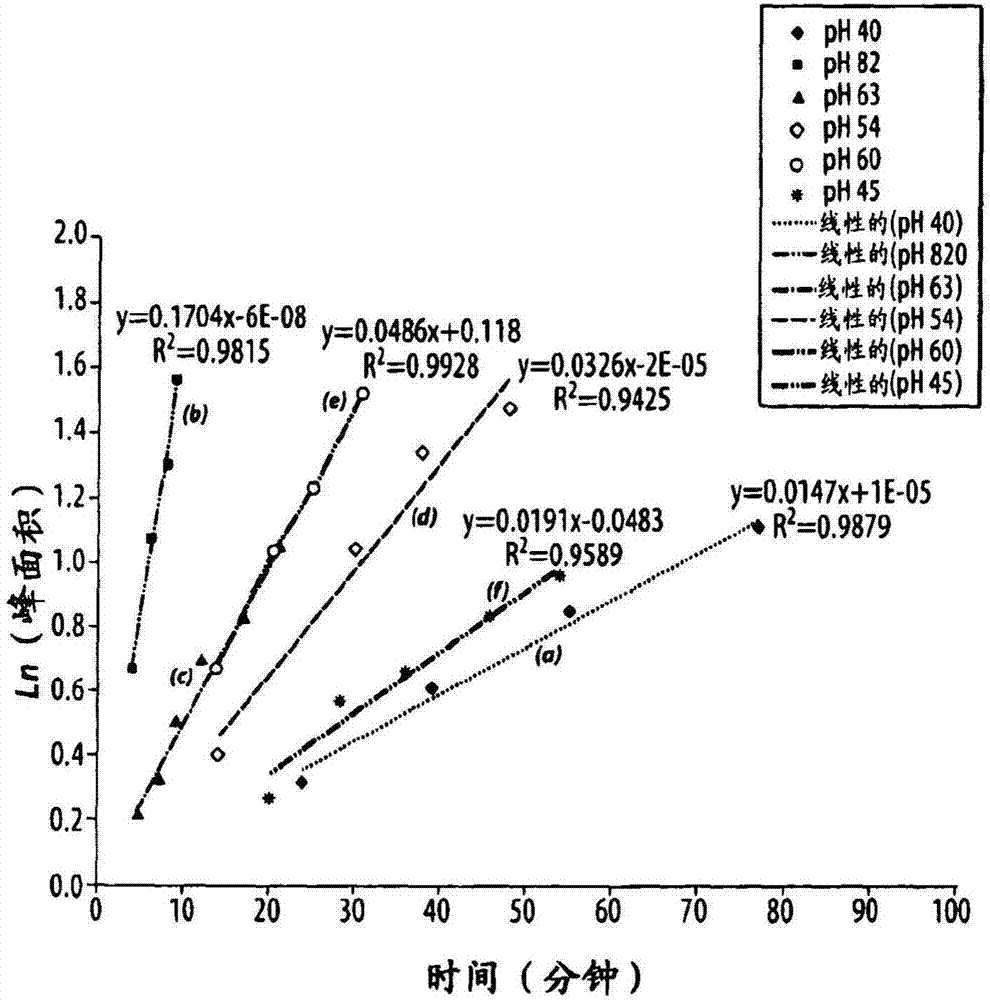
本申請是申請日為2010年4月15日,申請號為201080026254.0,發明名稱為“使用抗壞血酸穩定化放射性藥物組合物”的發明專利申請的分案申請。本發明涉及放射性藥物組合物的穩定化,和保護其免于輻射分解性的和傳播性的基團分解。具體地,本發明涉及抗氧化劑物質通過緩沖該組合物在放射性藥物制劑中的應用。此外,本發明涉及抗氧化劑抗壞血酸在緩沖的條件下在特定ph范圍內的下述應用:用于穩定化可用于醫學成像的放射性藥物組合物,并從而增加該組合物的儲存期,同時維持該組合物適合施用給人類和其它哺乳動物受試者。
背景技術:
:放射性藥物是含有放射性核素的藥物。放射性藥物常規地用于核醫學中,以用于診斷或治療各種疾病。它們通常是具有確定組成的小的有機或無機化合物。它們也可以是大分子,諸如未用放射性核素化學計量地標記的抗體或抗體片段。放射性藥物形成診斷和治療各種疾病的化學基礎。通過靜脈內注射放射性藥物,并使用γ照相機或pet照相機測定它的生物分布,可以得到體內診斷信息。放射性藥物的生物分布通常取決于放射性標記的化合物的物理性質和化學性質,且可以用于得到關于疾病的存在、進展和狀態的信息。放射性藥物通常可以分成2大類:其生物分布僅由它們的化學性質和物理性質決定的那些,和其最終的分布由它們的受體結合或其它生物學相互作用決定的那些。后一類經常被描述為靶物-特異性的。最近,已經將許多工作耗費在發現和開發用于診斷性成像的放射性藥物上,所述放射性藥物含有發射正電子的同位素。發射正電子的同位素包括82rb、124i、11c、13n和18f以及其它。這些同位素通過從原子核發射正電子而衰變。正電子是具有電子的等效質量、但是具有對應的正電荷的顆粒。在從原子核發射出以后,正電子移動,直到它遇到電子,且二者的反應導致質量的物理湮沒。以511kev的值,在相對方向釋放出能量,且由于所述湮沒不具有角動量,從湮沒點間隔大約180度發射出光子,這允許精確地確定發生所述分解所沿的線。該性質導致敏銳的靈敏度和分辨率,并允許極好的圖像重構和質量。碳、氮和氟同位素的一個優點是,它們可以摻入小的有機分子中,所述有機分子例如已知的或研究中的可以用于測定藥劑的生物分布以及診斷疾病的存在、不存在或范圍的藥物。通過具有本領域普通技術的有機化學家和放射化學家已知的多種方法,可以使它們方便地插入這些分子中。在調查研究中廣泛地使用11c-碘代甲烷(11ch3i)、甲基化醇或胺,以生成對應的醚或烷基胺。然后將這些化合物適當地滅菌,配制,并注射進受試者中。廣泛使用的許多pet放射性藥物的主要缺點是,與許多同位素有關的相對短的半衰期。銣-82、碳-11和氮-13分別具有1.27、20.3和9.97分鐘的半衰期。銣作為來自82sr-82rb發生器的氯化物鹽施用,且未經合成地修飾或處理。氮-13通常作為在回旋加速器中產生的氨(13nh3)施用,所述回旋加速器鄰近成像中心,適當地接近照相機。基于11c和13n二者的試劑已經用于顯像劑的放射性標記中。鑒于短的半衰期和在配制和施用藥物之前完成要求的反應和純化所需的時間,需要克服大量工程和邏輯挑戰,以允許使用化合物作為放射性藥物。相應地更長壽命的發射正電子的同位素可以摻入新的成像用的放射性示蹤劑中。這些包括前述的131i和18f,它們分別具有4.2天和107.9分鐘的半衰期。近來最普遍地使用18f,因為衰變完全是通過發射正電子,且具有有利的半衰期。近2小時允許合成地摻入分子中、純化并隨后從位于中央的放射性藥物進行分布,避免了對現場(on-site)回旋加速器或每月購買82sr-82rb發生器的需要/投資。在生產、配制、銷售和遞送藥劑的過程中,同位素通常以由每種具體同位素的物理學決定的零級速率衰變。但是,該衰變也可以通過輻射分解觸發藥劑的化學衰變。這可以通過自由基反應進行傳播,并嚴重降低組合物的質量。放射性藥物組合物在施用之前或在施用過程中的分解,可以急劇地降低靶向潛力,并增加治療性的放射性藥物組合物的毒性。因而,在某些情況下,重要的是,確保放射性核素連接在靶向部分上,并進一步確保靶向劑的特異性得到保持。輻射分解的原因是自由基(諸如羥基和超氧化物自由基)的形成(garrison,w.m.chem.rev.1987,87,381-398)。自由基對于有機分子是非常反應性的。這些自由基對有機分子的反應性,可以影響放射性藥物組合物的溶液穩定性。放射性藥物組合物的穩定化,是靶物-特異性的放射性藥物的開發中的一個重現挑戰,且經常采用自由基清除劑作為穩定劑,以使放射性標記的分子的輻射分解最小化。有些穩定劑是“清除自由基的抗氧化劑”,其可以容易地與羥基和超氧化物自由基反應。放射性藥物組合物的穩定劑可以有利地具有下述特征:當它用于人類施用時低毒性或基本上沒有毒性,對放射性標記的化合物向靶細胞或組織的遞送或受體結合具有低干擾或基本上沒有干擾,和/或使放射性藥物穩定合理的時間段(例如,在制備、銷售、儲存和運輸放射性藥物的過程中)的能力。諸如抗壞血酸等自由基清除劑已經用于穩定化99mtc(derosch等人,wo95/33757)和186/188re(anticancerres.1997,17,1783-1796)放射性藥物。美國專利5,393,512公開了抗壞血酸作為186re和131i-標記的抗體或抗體片段的穩定劑的應用。美國專利5,093,105和5,306,482公開了抗壞血酸作為99mtc放射性藥物的抗氧化劑的應用。為了在發生顯著的損害之前使用諸如抗壞血酸等抗氧化劑來終止衰變途徑,已經開發了幾種策略。抗壞血酸已經用于不同的藥物和放射性藥物組合物中。不同于其它的緩沖劑諸如琥珀酸和氨基羧化物,抗壞血酸不含有氨基或羧基。pct/us94/06276公開了穩定劑諸如抗壞血酸和抗壞血酸的水溶性的鹽和酯。美國專利no.6,066,309公開了抗壞血酸及其衍生物在穩定化放射性標記的蛋白和肽中的應用,以對抗放射性標記的氧化損失和自輻射分解。在某些情況下,在放射性標記(包括任何需要的溫育時間段)以后,但是在患者施用之前,加入抗壞血酸。另外,將抗壞血酸的衍生物定義為抗壞血酸的鹽、抗壞血酸的酯或它們的混合物。盡管已經公開了抗壞血酸/抗壞血酸鹽作為多種診斷性的和治療性的放射性藥物組合物的穩定劑的應用(參見,例如,deausch,e.a.等人/美國專利no.5,384,113/1995;vanderheyden,j.-l.,等人/美國專利no.5,393,512/1995;flanagan,r.j.和tartaglia,d./美國專利no.5,093,105/1992;tartaglia,d.和flanagan,r.j./美國專利no.5,306,482/1994;shochat,d.等人/美國專利no.5,961,955/1999;和zamora,p.o.和merek,m.j./美國專利no.6,066,309/2000),關于在特定ph范圍內使用抗壞血酸鹽來增強用于臨床應用的化合物的抗氧化作用,幾乎沒有公開或沒有公開。盡管已經在文獻中例證了諸如抗壞血酸等抗氧化劑的重要應用,幾乎沒有注意被放在抗氧化劑的狀態上,例如,當將它加入緩沖溶液中進行穩定性研究(在低ph,或對于適合注射的物質而言在更高的ph)時。可以選擇適合人類注射的物質,以具有高于4.0的ph,從而減少在注射部位處與強酸性溶液有關的局部化刺激和疼痛的風險。通常,注射用溶液已經用在6-8的ph范圍內的磷酸鹽(磷酸鹽緩沖鹽水(pbs))緩沖。但是,在處于典型的生物學ph范圍(6-8)的緩沖溶液中采用抗壞血酸/抗壞血酸鹽,經常會表現出更低的穩定化放射性藥物溶液的能力。相反,盡管以前的工作可能證實使用在低ph值(2-3)的抗壞血酸時放射性藥物制劑的穩定性,這樣的制劑通常不適用于動物模型或人類,這是由于上面指出的局部化反應。另外,以前的工作可能闡述了抗壞血酸在廣闊的酸性ph范圍是有用的,或根本沒有指定具體范圍。迄今為止,據信,當使用抗壞血酸用于放射性藥物的臨床應用時,幾乎不存在關于技術人員選擇ph的指導。因此,需要改進的組合物和方法。技術實現要素:本發明提供了抗壞血酸作為在一定ph范圍內的穩定劑的應用。在含水乙醇或水性緩沖液中配制藥劑和穩定劑,使得溶液優選地在約3.5-5.5的酸性ph范圍內,更優選地在約4-5范圍內,最優選地在約4-4.5范圍內。因而,在有些實施方案中,本發明提供了一種組合物,其包含一種或多種放射性藥物化合物以及包括抗壞血酸的穩定劑,其中所述組合物的ph是在約3.5-5.5范圍內。作為本發明組合物的一部分的放射性藥物化合物可以選自:魚藤酮、噠螨靈、喹螨醚、霸螨靈、吡螨胺、粉蝶霉素和2-取代的色酮類和它們的類似物。在有些實施方案中,所述放射性藥物化合物是至少一種選自下述的成員:噠螨靈和其類似物。在有些實施方案中,所述放射性藥物化合物是至少一種選自下述的成員:含有具有在5位取代的親脂側鏈的2-烷基-4-氯-2h-噠嗪-3-酮的化合物。在有些實施方案中,所述放射性藥物化合物是2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-芐氧基]-2h-噠嗪-3-酮。在有些實施方案中,所述放射性藥物化合物被放射性同位素標記,諸如選自11c、13n、18f、86br、124i、125i和131i的放射性同位素。在有些實施方案中,所述放射性同位素選自11c、13n和18f。在有些實施方案中,所述放射性同位素是18f。在前述實施方案中的任一個中,所述放射性藥物組合物包含約5至100mg/ml抗壞血酸,更優選約25至500mg/ml,更優選約50至200mg/ml。在有些實施方案中,存在大于約5mg、大于約10mg、大于約20mg、大于約30mg、大于約40mg、大于約50mg、大于約100mg或大于約200mg抗壞血酸/毫升。本發明也提供了一種用于制備在前述實施方案中的任一個中所述的組合物的方法,所述方法包括:將含有放射性藥物化合物的第一溶液加入在約3.5-5.5的ph范圍內、更優選在約4-5范圍內、甚至更優選在約4-4.5范圍內的含有抗壞血酸的第二溶液中,以形成包含放射性藥物化合物和抗壞血酸的第三溶液。在有些實施方案中,在將第一溶液加入第二溶液中之前,通過色譜法純化放射性藥物化合物。在有些實施方案中,在將第一溶液加入第二溶液中之前,沒有通過色譜法純化放射性藥物化合物。在有些實施方案中,所述方法另外包括下述步驟:在將第一溶液加入第二溶液中以后,并在將所述組合物用于患者之前,調節第三溶液的ph至約6-8。此外,作為本發明的一部分,存在這樣的方法,所述方法包括:給患者施用含有抗壞血酸的放射性藥物組合物,使得所述組合物具有在約3.5-5.5范圍內、更優選在約4-5范圍內、甚至更優選在約4-4.5范圍內的ph。本發明涉及這些以及在下文中描述的其它重要的目標。附圖說明圖1顯示了本發明的不同組合物的放射化學純度隨時間而變化的圖。圖2顯示了本發明的不同組合物在(a)4.0、(b)8.2、(c)6.3、(d)5.4、(e)6.0和(f)4.5的ph時放射化學雜質形成速率的圖。圖3顯示了包含在(a)20mg/ml(|p|>0.001)、(b)50mg/ml、(c)100mg/ml和(d)200mg/ml濃度的抗壞血酸的系列溶液的放射化學純度的圖。具體實施方式使用抗壞血酸作為緩沖劑,存在幾個優點。抗壞血酸已經被批準用于藥物和放射性藥物用途。抗壞血酸具有4.2的pka,且在ph3.0-5.0具有緩沖容量。在更高的濃度(>50mg/ml或0.25m),它也可以在5.5-6.0或更高的ph范圍具有足夠的緩沖容量。通常,它也被用作主要緩沖劑。本發明一般地涉及新穎的組合物(例如,放射性藥物組合物),和放射性藥物組合物中的抗氧化劑抗壞血酸在特定ph范圍的抗氧化能力和穩定化作用的意外的且急劇的增加。在該ph,大部分抗氧化劑被質子化,然而溶液的酸性不會大至造成受試者的嚴重反應。它特別適用于:在本文所述的條件下進行生產和儲存規程,并在施用給受試者的5、10或15分鐘內,調節至更高的ph。在有些實施方案中,提供了放射性示蹤劑(例如,18f-標記的放射性示蹤劑),其使用抗壞血酸作為穩定劑和/或作為臨床的pet顯像劑。本發明有利地提供了在特定ph范圍內的放射性藥物制劑,其利用抗壞血酸作為穩定劑。所述ph范圍會增加該組合物的穩定性和貯存期,同時使注射后的嚴重的局部化的部位反應最小化。另外,有些實施方案利用抗壞血酸作為放射性藥物組合物中的穩定劑,用于制備標記的分子、尤其是18f-標記的分子。在某些情況下,在制備、銷售和運輸放射性藥物組合物的過程中,抗壞血酸和它的類似物在特定ph范圍內可以用作穩定劑,尤其是對于用諸如18f等放射性同位素標記的那些化合物。選擇的放射性藥物組合物的ph位于抗氧化劑的主要pka或(在二堿性離子的情況下)次要pka處或附近。對于具有4.17的pk的抗壞血酸,可以選擇ph在約3.5-5.5、約4-5或4-4.5的范圍內。抗壞血酸通常用作本發明的放射性藥物組合物的穩定化組分。抗壞血酸被稱作維生素c,且已經被用作抗氧化劑來防止某些放射性藥物(wo95/33757;anticancerres.1997,17,1783-1796;美國專利5,093,105,和美國專利5,306,482)或放射性標記的肽(美國專利5,393,512;美國專利5,384,113和美國專利5,961,955)的輻射分解。本文使用的術語“抗壞血酸”包括抗壞血酸本身以及本領域普通技術人員已知的該酸的類似物和鹽。抗壞血酸是可容易地得到的gras(公認為安全的)物質,且可以以最終制劑的高達200mg/ml水平用于藥物組合物和用于生物學目的的其它制劑中。在基本上所有的加工步驟過程中以及施用給受試者時,以前的包含抗壞血酸的組合物通常處于在生物學ph范圍(例如,6-8)內的ph值,以減少與酸性溶液有關的刺激和疼痛的風險。但是,在生物學ph范圍內,抗壞血酸/抗壞血酸鹽在緩沖溶液中穩定化放射性藥物溶液的能力令人驚訝地降低。在本發明所公開的放射性藥物組合物中使用抗壞血酸或它的類似物的一些優點包括:(1)以高產率(>90%)制備放射性藥物組合物的能力,和(2)在維持放射性藥物的放射化學純度或rcp(>90%)的同時,儲存放射性藥物組合物幾小時或甚至幾天的能力。在某些情況下,可以將抗壞血酸鹽加入制劑中。在某些情況下,抗壞血酸可以以不帶電荷的形式使用,或者用于組合物中,其中在適當的ph,將更高百分比的抗壞血酸質子化。不受任何特定理論的約束,抗氧化劑的效能在某些情況下可能與抗氧化劑中的氫-氧鍵的非離子性質直接相關,在酸性水平(其中大部分抗氧化劑是質子化形式)具有增強的穩定性。在有些實施方案中,在沒有其它穩定劑化合物存在下,放射性藥物組合物可以包含抗壞血酸作為穩定劑。本發明預見到這樣的放射性藥物制劑:其含有一種或多種在下文中描述的心肌灌注顯像劑或放射性藥物化合物以及抗壞血酸,其在上文所述的ph范圍內。最近,已經公開了幾組新穎的心肌灌注顯像劑(casebier等人,美國2007036716a1;purohit&casebier,美國2006083681a1;radeke等人,美國2005244332a1;casebier等人,wo2005/079391a2),它們對于潛在的臨床診斷用途而言具有非常合乎需要的性質。這些藥劑經常被制備為放射性示蹤劑,且經常用放射性同位素(諸如放射性同位素18f)進行標記。在本發明中有用的一些放射性藥物化合物可以是線粒體復合物1(mc-1)的有效抑制劑,且具有潛在的臨床效用。這些化合物可以用放射性示蹤劑(在下文中描述的,諸如18f,作為實例)進行放射性標記,且因此,以防止輻射分解性的開始衰變的方式穩定化溶液可能是所需要的。幾類化合物可以用作在本發明的上下文中的放射性藥物化合物,如下面更完整地描述的。例如,天然產物魚藤酮是一種已知的商業殺蟲劑,且被廣泛地用于商業。主要的活性模式是通過mc-1的抑制。該化合物對于農作物應用而言是方便的,這是由于它的功效以及它在環境中快速分解為無危險產物。已知魚藤酮的幾種類似物會抑制mc-1,且一些已經被用于心肌灌注成像的非人模型中,諸如二氫氟代魚藤酮(dihydrofluorotenone,dhfr)。可以用于心肌灌注成像且其溶液可以用抗壞血酸穩定化的另一類化合物是下面顯示的一類色酮衍生物。這些化合物是在靈長類動物的心肌灌注中已經表現出良好效用的合成化合物,特別地,具體化合物如下所示。可以用于心肌灌注成像且其溶液可以用抗壞血酸穩定化的另一類化合物是稱作喹螨醚的喹唑啉衍生物。喹螨醚自身是mc-1的強抑制劑,且在商業上被用作殺蟲劑。喹螨醚和它的類似物的放射性標記的衍生物已經在靈長類動物和其它哺乳動物的心肌灌注成像中表現出良好效用。下面顯示了喹螨醚和它的類似物,以及對于心肌灌注成像而言特別優選的具體化合物。類似地,其它商業上有用的mc-1抑制劑的類似物可用于本發明中,諸如下面顯示的吡螨胺和其類似物。這些化合物的母體結構在商業上被用作殺蟲劑,但是它們的類似物可以被放射性地標記,以用作心肌灌注顯像劑。類似地,其它商業上有用的mc-1抑制劑的類似物可用于本發明中,諸如下面顯示的霸螨靈類似物。這些化合物的母體結構在商業上被用作殺蟲劑,但是它們的類似物可以被放射性地標記,以用作心肌灌注顯像劑。此外,下面顯示的天然產物粉蝶霉素的類似物可用作本發明一部分的化合物。粉蝶霉素是一類在取代(substation)和側鏈方面具有差異性的化合物,但是通常可以表征為2-烷基-4-羥基吡啶。通常,在粉蝶霉素中,3、5和6位也被烷基或烷氧基官能團取代。這些化合物和類似物的衍生物可以被放射性地標記,以用作心肌灌注顯像劑。另一類適用于本發明中的化合物是基于商業化合物噠螨靈。在某些情況下,所述化合物包含經由親脂側鏈連接至放射性同位素(諸如18f-氟化物)上的噠嗪酮雜環。這些化合物可以包含一系列有效的線粒體復合物1抑制劑。通過用基團x和y取代硫屬元素,保留了該能力,且側鏈(基團m、n和y)的容許量是廣闊的,具有最多10個鏈原子的支鏈和直鏈基團仍然會提供有效的活性。在有些實施方案中,所述化合物是2-烷基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-芐氧基]-2h-噠嗪-3-酮。例如,所述化合物可以是2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-芐氧基]-2h-噠嗪-3-酮。通過有機放射化學領域的技術人員和熟知用于生產諸如氟脫氧葡萄糖(18f-fdg)等放射性藥物(例如,目前唯一被批準用于人成像的18-f放射性示蹤劑)的技術的人員已知的方法,可以制備本文所述的化合物。在使用之前,可以純化化合物,并在這樣的用途中例證這樣的方法。其它方法是技術人員可容易地得到的。在某些情況下,放射性藥物化合物可以包括不對稱中心,即不對稱地取代的原子。可以以旋光的或外消旋的形式分離含有不對稱地取代的原子的化合物。本領域眾所周知如何制備旋光形式,包括諸如拆分外消旋形式或從旋光原料合成等方法。烯烴、c=n雙鍵等的許多幾何異構體也可以存在于本文所述的化合物中,且預見到將所有這樣的穩定的異構體用于本發明中。描述了本發明化合物的順式和反式幾何異構體,且可以分離為異構體的混合物,或分離的異構形式。是指結構的所有手性形式、非對映體形式、外消旋形式和所有幾何異構形式,除非特別指出具體的立體化學或異構形式。認為用于制備本發明化合物的所有方法和在其中制備的中間體可用于本發明中。如指出的,本文所述的放射性藥物化合物可以含有烷基取代基。如在本文中使用的,可以在本文中單獨使用或用作另一個基團的一部分的術語“烷基”和“烷”包括在正常鏈中含有1-20個碳、優選1-10個碳、更優選1-8個碳的直鏈和支鏈烴,諸如甲基、乙基、丙基、異丙基、丁基、叔丁基、異丁基、戊基、己基、異己基、庚基、4,4-二甲基戊基、辛基、2,2,4-三甲基戊基、壬基、癸基、十一基、月桂基、它們的各種支鏈異構體等,以及諸如包括1-4個取代基的基團,所述取代基例如鹵素(例如f、br、cl或i)或cf3、烷基、烷氧基、芳基、芳氧基、芳基(芳基)或二芳基、芳基烷基、芳基烷氧基、烯基、炔基、環烷基、環烯基、環烷基烷基、環烷基烷氧基、羥基、羥基烷基、酰基、烷酰基、雜芳基、雜芳氧基、環雜烷基、芳基雜芳基、芳基烷氧基羰基、雜芳基烷基、雜芳基烷氧基、芳氧基烷基、芳氧基芳基、烷基酰氨基、烷酰基氨基、芳基羰基氨基、硝基、氰基、硫醇、鹵代烷基、三鹵代烷基和/或烷硫基。如以前指出的,本文使用的放射性藥物化合物也包括其“類似物”。術語“類似物”意在包括與參照的結構或化合物在結構或原子連接性方面基本上類似的任意化合物。這些包括這樣的化合物:其中一個或多個單獨的原子已經被替換為不同的原子或不同的官能團。術語類似物暗示高度的同源性,但是也可以包括從這樣的結構智力地衍生出的化合物。因而,作為實例,噠螨靈的類似物可以作為含有具有在5位取代的親脂側鏈的2-烷基-4-氯-2h-噠嗪-3-酮的任意化合物。作為本發明一部分的放射性藥物化合物意在包括在本發明的化合物中出現的原子的所有同位素。同位素包括具有相同原子數、但是不同質量數的那些原子。作為一般的實例,但不限于此,氫的同位素包括氚和氘。碳的同位素包括c-13和c-14。當取代基的鍵顯示為連接環中的2個原子的交叉鍵時,則這樣的取代基可以鍵合到環上的任意原子上。當列出取代基、但是沒有指出這樣的取代基用于鍵合到給出通式的化合物的剩余部分上的原子時,則這樣的取代基可以經由該取代基中的任意原子進行鍵合。取代基和/或變量的組合是容許的,只要這樣的組合會產生穩定的化合物。上文所述的放射性藥物化合物被認為是藥學上可接受的。短語“藥學上可接受的”在本文中用于表示這樣的化合物、材料、組合物和/或劑型:其在合理的醫學判斷范圍內,適用于接觸人類和動物的組織,且沒有過度的毒性、刺激、變應性應答或其它問題或并發癥,與合理的收益/風險比相稱。上文所述的放射性藥物化合物也包括藥學上可接受的鹽。本文使用的“藥學上可接受的鹽”表示公開的化合物的衍生物,其中通過制備它們的酸或堿鹽而修飾母體化合物。藥學上可接受的鹽的實例包括、但不限于:諸如胺等堿性殘基的無機酸鹽或有機酸鹽;和諸如羧酸等酸性殘基的堿鹽或有機鹽。藥學上可接受的鹽包括常規的無毒的鹽,或從例如無毒的無機酸或有機酸形成的母體化合物的季銨鹽。例如,這樣的常規的無毒的鹽包括:從無機酸衍生出的鹽,所述無機酸諸如鹽酸、氫溴酸、硫酸、氨基磺酸、磷酸和硝酸;和從有機酸制備的鹽,所述有機酸諸如醋酸、丙酸、琥珀酸、羥乙酸、硬脂酸、乳酸、蘋果酸、酒石酸、檸檬酸、抗壞血酸、雙羥萘酸、馬來酸、羥基馬來酸、苯乙酸、谷氨酸、苯甲酸、水楊酸、對氨基苯磺酸、2-乙酰氧基苯甲酸、富馬酸、甲苯磺酸、甲磺酸、乙二磺酸、草酸和羥乙磺酸。通過常規化學方法,可以從含有堿性或酸性部分的母體放射性藥物合成出可用于本發明中的藥學上可接受的鹽。通常,這樣的鹽可以如下制備:在水或有機溶劑或二者的混合物中,使這些化合物的游離酸或堿形式與化學計量量的適當的堿或酸反應;通常,非水性介質如乙醚、乙酸乙酯、乙醇、異丙醇或乙腈是優選的。合適的鹽的列表可以參見:remington′spharmaceuticalsciences,第17版,mackpublishingcompany,easton,pa,1985,第1418頁,其公開內容通過引用并入本文。如以前所述,本文使用的放射性藥物化合物優選地是mc-1抑制劑。術語“mc-1抑制劑”表示具有抑制mc-1的能力的特定已知化合物和那些化合物的類似物。具體地,可以用合適的放射性同位素放射性地標記化合物,使得可以如下得到心肌組織的圖像:給患者施用所述化合物,隨后在合適的照相機中掃描患者,所述合適的照相機可以是pet、spect或平面的。這樣的抑制劑可以包括、但不限于:噠螨靈和它的類似物、喹螨醚和它的類似物、魚藤酮和它的類似物、魚藤素和它的類似物、和取代的色酮衍生物和它們的類似物,包括上面例證的那些。本發明的放射性藥物化合物優選地用合適的放射性同位素進行標記。術語“合適的放射性同位素”表示這樣的同位素:其可以共價地摻入分子中,而不會不利地影響生物學能力,且具有衰變參數諸如足夠長的半衰期和合適的顆粒/發射能量,使得可以得到良好的圖像。這樣的放射性同位素可以包括、但不限于:11c、13n、18f、86br、124i、125i和131i。在它們中,18f特別優選地用于本發明中。使用本領域技術人員可得到的材料和技術,實現放射性標記。例如,通過親電子氟化,在適當的條件下使用[18f-f]氟氣體,可以實現用氟進行的放射性標記,但是最優選地,通過[18f]-氟化物離子對適當離去基團的親核置換來實現。通過添加氪酸鹽(kryptate)來隔離鉀抗衡離子,使[18f]-氟化物離子具有更高的反應性。從本領域普通技術人員已知的那些中,可以選擇優選的離去基團,但是優選地是鹵素,包括碘化物、溴化物、氯化物和氟化物。最優選地,所述離去基團是烷基或芳基磺酸化的酯,特別是甲苯磺酸酯。在一組實施方案中,所述放射性藥物組合物包含2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-芐氧基]-2h-噠嗪-3-酮以及包括抗壞血酸在內的穩定劑,其中所述組合物的ph是在約4-4.5的范圍內,且所述放射性藥物組合物包含大于約50mg抗壞血酸/毫升。可以如下制備本發明的穩定化的放射性藥物制劑:將包含粗的(例如,未純化的)或純化的放射性藥物化合物的第一溶液(例如,水溶液或乙醇溶液)加入包含抗壞血酸的第二制備溶液中,以形成包含放射性藥物化合物和抗壞血酸的第三溶液。所述第一溶液可以是水溶液或醇溶液,諸如乙醇溶液。在某些情況下,在接觸第一溶液之前,通過加入酸性溶液(例如,鹽酸溶液)或堿性溶液(例如,氫氧化鈉水溶液),將所述第二溶液調節至希望的ph(例如,在3.5-5.5范圍內的ph)。本發明的方法可以包括額外的處理步驟。例如,在將第一溶液加入第二溶液中以后,可以將第三溶液調節至不同的ph,諸如在生物學范圍內的ph,即約6-8。在有些實施方案中,所述放射性藥物組合物包含大于約50mg抗壞血酸/毫升,且所述方法另外包括下述步驟:在將第一溶液加入第二溶液中以后,調節第三溶液的ph至約小于6。在一組實施方案中,所述方法包括:將包含2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-芐氧基]-2h-噠嗪-3-酮或其19f類似物的第一溶液加入包含抗壞血酸的第二溶液中,其中所述第二溶液具有在約4-4.5范圍內的ph,且包含大于約50mg抗壞血酸/毫升,以形成包含2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-芐氧基]-2h-噠嗪-3-酮和抗壞血酸的第三溶液。在有些實施方案中,所述方法可以包括一個或多個純化步驟,諸如通過色譜法純化。例如,所述方法可以包括通過色譜法純化放射性藥物化合物,即,在加入包含抗壞血酸的溶液之前。所述色譜法可以是反相色譜法、正相色譜法(regularphasechromatography)和/或離子交換色譜法。在有些實施方案中,所述正相色譜法可以包括使用氧化鋁或硅膠柱。在某些情況下,本發明的方法可以包括使用反相hplc柱。關于反相色譜法,使用包含水、乙腈、緩沖液(例如,醋酸銨緩沖液)、醇(例如,甲醇、乙醇)、酸(例如,甲酸)或其混合物的流動相,可以洗脫hplc柱。在某些情況下,所述hplc柱是反相柱,并使用包含醋酸銨緩沖液、乙腈、乙醇、甲酸或其混合物的流動相來洗脫柱。本發明的典型的放射性藥物組合物包含:含有不超過約0-10體積%乙醇的水溶液,和大于約5mg抗壞血酸/毫升。在某些情況下,所述水溶液含有大于約10mg、大于約20mg、大于約30mg、大于約40mg、大于約50mg、大于約100mg、或在某些情況下大于約200mg的抗壞血酸/毫升劑型。在有些實施方案中,所述水溶液還包括不超過約20mci的放射性藥物化合物(例如,約10-20mci)和不超過約5μg的冷的放射性示蹤劑的19f-類似物(例如,約1-5μg)/毫升劑型。通常,通過向溶液中加入na18f,開始輻射分解。本發明的有些方面涉及下述發現,即在開發根據本發明的放射性藥物組合物(用于廣泛的生產、分布和使用)的過程中,抗壞血酸表現出增強的穩定化在特定ph值的放射性藥物制劑的能力。經發現,在本文所述的ph值,放射性藥物制劑表現出明顯更高的對抗分解的穩定性。在更高的ph值,這些溶液的穩定性明顯不太有效。與含有抗壞血酸的溶液的ph的對比、經6小時時間段的穩定性和抗壞血酸的pka揭示,最有效的穩定作用是在穩定劑的氧化中心被質子化的范圍內。在某些情況下,抗壞血酸或它的類似物在本文所述的放射性藥物組合物中的應用,可以穩定化放射性藥物,使得在放射性藥物的基本上整個使用期限內可以維持高放射化學純度(例如,>90%、>95%、>97%)。例如,在高放射化學純度,可以維持包含18f的放射性藥物1小時或更久、2小時或更久、或在某些情況下,5小時或更久。本發明也包括將放射性藥物組合物施用給受試者的方法。在某些情況下,所述放射性藥物組合物含有抗壞血酸,且具有在約3.5-5.5范圍內的ph。在某些情況下,放射性藥物組合物含有大于約50mg抗壞血酸/毫升的量的抗壞血酸,且具有小于約6的ph。在一組實施方案中,本發明提供了給患者施用放射性藥物組合物的方法,所述放射性藥物組合物包含:2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-芐氧基]-2h-噠嗪-3-酮、大于約50mg抗壞血酸/毫升的量的抗壞血酸,其中所述放射性藥物組合物具有小于約6的ph。本文所述的本發明組合物可以以下述方式施用,作為實例:將導管或肝素固定線(heparinlockline)插入受試者的靜脈中,并用適當的鹽水和或肝素溶液沖洗。經由路厄粗頭旋口,將藥物施用進導管或肝素固定線中。患者原位在pet照相機中并可以立即開始成像,或者允許患者休息一段時間然后進入pet照相機中。或者,使用與本領域已知的那些類似的方法,在踏車或藥理學應激下,經由導管或肝素固定,以類似的方式施用給患者。下面的實施例采用本發明的不同實施方案,但是不應當解釋為限制其范圍:實施例使用itlc或更優選地hplc,通過放射性標記的化合物的放射化學純度(rcp),測量放射性藥物的完整性。使用hplc的優點是,在特定色譜條件下,可以將由輻射分解造成的放射性雜質與放射性藥物分離開。通過測定在代表性的時間點采取的樣品中的放射性標記的化合物的rcp的變化,可以證實本發明的放射性藥物組合物提高的時間穩定性。本發明的放射性藥物組合物可以有效地維持樣品的穩定性最多10小時。放射性藥物的最初rcp在很大程度上取決于放射性標記條件,諸如ph、加熱溫度和時間。在以高產率制備放射性藥物以后,通過放射性藥物在特定時間段內的rcp變化,測量放射性藥物組合物的穩定性。醋酸(超純的)、氫氧化銨(超純的)和龍膽酸購自aldrich或sigmachemicalco.,并以接收時的狀態使用。使用購自fisher的鹽酸和購自vwr的氫氧化鈉(1n溶液)進行ph調節。抗壞血酸(500mg/ml,美國藥典注射用溶液)購自myodermmedical,并根據需要用無菌注射用水(swfi)稀釋。[f-18]氟化鈉(na18f)購自siemensbiomarkersolutions,為儲存在聚合的柱支持物上的鹽。使用碳酸鉀(k2co3)和kryptofix[222]的溶液,將氟化物從柱洗脫進反應燒瓶或瓶中。可以使用下述的hplc分析方法。hplc方法1使用hp-1100hplc系統,該系統具有紫外/可見光檢測器(λ=220nm)、in-us放射-檢測器和zorbaxc18柱(4.6mmx250mm,孔徑)。流速是1ml/min,流動相從92%溶劑a(0.025m醋酸銨緩沖液,ph6.8)和8%溶劑b(乙腈)開始,在18min時達到90%溶劑a和8%溶劑b,然后在19至25min用40%溶劑a和60%溶劑b進行等度洗脫(isocraticwash)。hplc方法2使用hp-1100hplc系統,其具有紫外/可見光檢測器(λ=220nm)、in-us放射-檢測器和zorbaxc18柱(4.6mmx250mm,孔徑)。流速是1ml/min,流動相從92%溶劑a(0.025m醋酸銨緩沖液,ph6.8)和8%溶劑b(乙腈)開始,在18min時達到80%溶劑a和20%溶劑b,然后在19至25min用40%溶劑a和60%溶劑b進行等度洗脫。hplc方法3使用hp-1100hplc系統,其具有紫外/可見光檢測器(λ=220nm)、in-us放射-檢測器和zorbaxc18柱(4.6mmx250mm,孔徑)。流速是1ml/min,在25min內使用92%溶劑a(0.025m醋酸銨緩沖液,ph6.8)和8%溶劑b(乙腈)的等度流動相,隨后在26-30min使用40%溶劑a和60%溶劑b進行等度洗脫。hplc方法4使用hp-1100hplc系統,其具有eg&gbertholdradioflow檢測器和zorbaxc18柱(4.6mmx50mm,1.8μm粒度)。流速是1ml/min,在12min的運行時間內,使用50%乙腈/50%的0.1%甲酸水溶液的流動相。下面的實施例描述了18f-標記的心肌灌注成像放射性示蹤劑的制備和純化。使用下面的一般方法,以良好產率制備了噠螨靈、喹螨醚和色酮類似物,并配制成穩定的放射性藥物組合物。實施例1:制備用于ph穩定化研究的18f心肌灌注成像放射性示蹤劑的合成方法。將碳酸鉀(k2co3,美國藥典級,10mg)溶解于蒸餾水/去離子水(h2o,1ml)中,并在攪拌下加入4,7,13,16,21,24-六氧雜-1,10-二氮雜雙環[8.8.8]二十六烷(稱作kryptofixtm,k222)在無水乙腈(ch3cn,4ml)中的溶液中,使用得到的溶液的等分試樣(1ml)洗脫攜帶18f的樹脂柱。測定柱洗脫液的放射性內容物,并將洗脫液轉移至explorarn化學模塊(chemistrymodule)的反應器。該系統由使用gina-star軟件的計算機控制。將洗脫的復雜溶液濃縮至干燥(70-95℃),氬放出(argonbleed);部分真空(250-12毫巴)。這產生相對干燥的、高度活化的[18f]氟化物形式。然后將希望的放射性示蹤劑的對應甲苯磺酸酯溶解在100%乙腈中的溶液加入反應器中。將混合物在90℃加熱10分鐘。實施例2:18f心肌灌注成像放射性示蹤劑的純化和用于ph穩定化研究的藥劑的制備反應結束后,蒸發乙腈(55℃,氬放出;部分真空(250-15毫巴)),并將反應混合物懸浮于流動相(60%乙腈/40%50mm醋酸銨水溶液,1.3ml)中。將該混合物吸入樣品環中,注射上hplc柱(phenomenexsynergi4μhydro-rpc18,250x10mm)。通過在等度條件下的色譜法(60%乙腈/40%的50mm醋酸銨水溶液,5ml/min,36min運行時間),純化混合物。放射合成模塊(explorarn化學模塊)配有紫外(254nm)和geiger-mueller(gm)檢測器。將含有標記的放射性-示蹤劑的級分收集在瓶中。加入含有50mg/ml濃度的抗壞血酸的抗壞血酸溶液(10-15ml),使溶液穿過藥筒(預先用10ml乙醇、隨后用10ml抗壞血酸溶液調節)。18f放射性標記的示蹤劑吸附在柱上,拋棄水性洗脫液。用抗壞血酸溶液的另一份等分試樣(10ml)洗脫以去除任何額外的副產物和殘余的乙腈。然后用乙醇(≤0.5ml)洗脫放射性-示蹤劑,并加入裝有9.5ml抗壞血酸溶液的瓶中。實施例3:測定ph值對放射性示蹤劑制劑溶液的穩定化的影響配制了一系列在不同ph值的抗壞血酸溶液,每種溶液含有5μg/ml冷的放射性藥物化合物的19f-類似物2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-芐氧基]-2h-噠嗪-3-酮(例如,bms-747158-01(api))、乙醇/水(5/95)和50mg/ml抗壞血酸。通過根據需要加入鹽酸或氫氧化鈉的儲備水溶液,調節每種溶液的ph。溶液的列表如表1所示。通過將na18f加入含有冷的放射性藥物化合物的19f-類似物的溶液中,開始輻射分解,并通過放射化學純度的hplc分析方法,在(最少)6小時時間段內監測該溶液。使用具有梯度流動相的c18rp-hplc柱分析該溶液,并使用紫外和放射化學檢測器監測洗脫圖(elutionprofile)。結果如圖1所示。表1.在實施例3中使用的抗壞血酸溶液溶液批號pha0703274.0b0703285.8c0703304.0d0704034.0e0704044.5f0704184.6g0704244.6h0704254.6i0705016.5j0705022.4從圖1中的圖可以看出,得到的溶液在儲存以后的純度直接取決于最初緩沖的藥劑的ph。與具有相對更為酸性的值的溶液相比,在更高的ph值(更接近7-7.5的生理ph)的溶液具有明顯更低的儲存穩定性。這具體地通過分別具有5.8(溶液b)和6.5(溶液i)的溶液ph值的圖來例證。在圖1所示的圖上,分別存在這2個最低的圖。監測放射化學雜質的形成(隨著在4.0至8.2范圍內的溶液ph而變化)的其它研究如圖2所示。對于每種溶液,通過hplc監測放射化學純度的形成,并將與放射化學雜質相對應的色譜峰的面積繪制為時間的函數。與具有6.0或更大的ph的溶液相比,具有在3.5.-5.5的ph范圍的溶液表現出更大的穩定性,這證實了遠遠更慢的放射化學雜質形成速率。在圖2中顯示的結果進一步證實了在關鍵的酸性條件下提高的制劑穩定性的作用。在測試的ph范圍內,觀察到的放射化學雜質形成的第一階反應速率減小了超過10倍。實施例4:測定抗壞血酸濃度對放射性示蹤劑制劑溶液的穩定化的影響該實施例描述了抗壞血酸濃度對放射化學純度的影響。在該實施例中,監測在ph5.8的、具有200mg/ml(飽和水平)至20mg/ml的抗壞血酸濃度范圍的溶液中18f-標記的藥物產品(2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-芐氧基]-2h-噠嗪-3-酮)的放射化學純度(rcp)。顯示在圖3中的結果表明,在200至50mg/ml范圍內,rcp水平沒有顯著變化,但是在20mg/ml樣品中,觀察到雜質的增加(即,較低的rcp水平)。這些實施例意圖例證本發明的應用,絕不是限制在下面的權利要求書中闡述的本發明的目的、應用和效用。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1