一種肽修飾的多壁碳納米管載體及其制備方法和應用與流程
本發明涉及醫藥技術領域,具體地說,是一種肽修飾的多壁碳納米管載體及其制備方法和應用。
背景技術:
前列腺癌是嚴重威脅全球男性健康的常見惡性腫瘤之一。美國癌癥協會2016年最新數據表明,前列腺癌在預計新發人數上位居第一,預計死亡人數上排名第二(僅次于肺癌)。目前晚期、復發、轉移前列腺癌的治療面臨著很多問題,如何增加機體抗腫瘤的免疫效應已成為相關研究的熱點問題。
腫瘤是嚴重危害人類健康的重大疾病之一,尋找可行且高效的腫瘤治療方法,徹底攻克腫瘤是醫學界的重要研究課題。繼外科手術、放療、化療之后,腫瘤免疫治療成為第4類已被證明具有顯著臨床療效及優勢的抗腫瘤治療方法。它通過調動或激發機體自身的免疫功能,增強腫瘤周圍微環境中各種抗腫瘤能力,從而抑制和殺傷腫瘤細胞。機體免疫功能的改變對腫瘤的生物學行為有直接影響,例如可引起某些腫瘤自發緩解或消退的現象。另外,長期免疫治療可以阻止患者腫瘤的發病率增高等。抗pd1/pd-l1和抗ctla4抗體已被fda批準應用臨床,取得了較好的抗腫瘤效果。與手術切除、放療及化療這些傳統手段相比,腫瘤免疫治療的優勢主要有:1)利用生物細胞因子增強機體自身的免疫作用,以達到抗腫瘤作用,與放化療相比,毒副作用明顯降低;2)利用分子靶向藥物治療,目標明確,可選擇性、特異性地殺傷腫瘤細胞,而不影響正常細胞;3)通過主動免疫激發全身性的抗腫瘤效應,作用范圍廣泛,尤其適用于多發病灶或有廣泛轉移的惡性腫瘤;4)對不適合進行手術的中晚期腫瘤患者,可以明顯抑制其病情的發展,從而延長患者的生命;5)能夠清除手術后不能徹底清除的殘留病灶,防止復發和轉移,同時能夠修復放化療所導致的相關組織和臟器的損傷,恢復正常免疫功能。
富含未甲基化胞嘧啶-鳥嘌呤二核苷酸的dna(cpgdna)是一種可以刺激多種免疫細胞活化或增殖、具有強烈的免疫激活功能的核酸。早在1984年,tokunaga等人在牛分枝結核桿菌卡介苗(bcg)提取液中發現了一種具有刺激作用的短單鏈dna,可增強nk細胞的殺傷活。hemmi等人于2000年發表的研究工作表明,toll樣受體9(tolllikereceptor9,tlr9)是cpgdna發揮免疫激活性所必需的,可能是cpgdna的細胞內受體。tlr9屬于模式識別受體(patternrecognitionreceptor,prr)家族,存在于人類等哺乳動物的b淋巴細胞、樹突狀細胞(dendriticcells)、單核細胞和自然殺傷細胞(nks)等免疫細胞的內吞小體膜上。受到cpg刺激后,激活細胞內mapk和核因子-κb(nf-κb)等信號通路,促使細胞分泌各種細胞因子,包括白介素6(il-6)、白介素10(il-10)、白介素12(il-12)、i型干擾素(typeiifns)和腫瘤壞死因子α(tnf-α)等。這些細胞因子可引發b細胞分化為分泌抗體的漿細胞、激活自然殺傷細胞(nk)、促進cd8+細胞毒性t淋巴細胞應答等,從而完成一系列先天的或適應性的免疫應答過程。cpgodn發揮藥效的關鍵在于其能夠有效地被體內免疫細胞攝取并與受體tlr9發生相互作用。然而,與其他核酸類藥物一樣,未經修飾的cpgdna同樣面臨易被核酸酶降解、細胞攝取率低等問題,因此需要劑量重復給藥,這極大地限制了其在醫學領域的應用。近年來,在遞送cpgodn等寡核苷酸藥物的應用中,研究者將注意力集中在了非病毒類的納米材料載體上。
碳納米管作為一維納米碳材料,被認為是一種極有吸引力、應用前景廣泛的新型藥物載體。近年來,碳納米管也被嘗試用于輸送藥物分子等的載體。通過透射電鏡、共聚焦顯微鏡、熒光顯微鏡等,人們已經在細胞質和成纖維細胞中觀察到碳納米管。kam等研究了多種人體癌細胞與功能化碳納米管間相互作用,結果表明:功能化碳納米管不僅可進入人體非黏性癌細胞還可進入黏性癌細胞株(adherentcelllines,choand3t3)。碳納米管已有研究顯示可作為靶向超聲診斷納米載體,碳納米管子還可以和腫瘤細胞的微管蛋白結合,有效阻制腫瘤細胞增殖功效。但由于cnt的在水中的溶解性、分散性、和機體的生物相容性都很差,限制了在藥物載體方面的使用。通過對碳納米管和純化和表面羧基化修飾可增強其分散性和溶解性,減輕對機體的毒性。
細胞穿膜肽(cellpenetratingpeptides,cpps)是一類具有較強的細胞膜穿透能力的小分子短肽,可攜帶多種大分子進入細胞。這類肽很快用到藥物的靶向和導入的研究中,可以有效地將包括親水性蛋白質和多肽、核苷酸、小分子藥物、量子點和顯像劑等在內的多種貨物分子導入各種細胞中,開辟了藥物進入細胞的新介導途徑。其在基因治療方面因其高效傳遞基因物質的能力及低毒性,容易制備而在過去20多年中成為研究熱點。研究發現,多肽類載體中的精氨酸因其表面富集的正電荷可有效地吸附帶負電荷的基因物質而形成粒徑小,結構穩定的載體/基因復合物。組氨酸由于有咪唑基團,可有“質子海綿效應”,實現溶酶體的逃逸。從而可以構建一個以組氨酸和精氨酸組成的短肽,與羧基化多壁納米管通過酰胺鍵連接,精氨酸帶正電可以吸附帶負電的cpg。
基于上述理論,本課題構建了一種由3個精氨酸(arginine)、6個組氨酸(histidine)組成的短肽(hr)修飾的多壁碳納米管(multiwalledcarbonnanotubes)的納米載體mhr,可以增強碳納米管的水溶液中的溶解性、分散性,降低多壁碳納米管的生物機體毒性。穿膜短肽hr中的精氨酸帶正電,通過靜電吸附富含未甲基化胞嘧啶-鳥嘌呤二核苷酸的dna(cpgdna)等免疫激活劑,形成mhr-cpg納米免疫激活劑,保護cpg免受核酸酶的降解,增強其細胞攝取率,組氨酸的質子海綿效應可實現溶酶體逃逸。
目前尚無一種肽修飾的多壁碳納米管,并且能夠結合未甲基化胞嘧啶-鳥嘌呤二核苷酸的dna(cpgdna)等免疫激活劑激發機體的抗腫瘤免疫效應,為前列腺癌患者的治療開辟一個新的治療策略,同時也為碳納米管應用于藥物載體提供新的理論依據和思路。
技術實現要素:
本發明的目的在于提供一種可以增強碳納米管的水溶液中的溶解性、分散性,降低多壁碳納米管的生物機體毒性的肽修飾碳納米管載體。本發明的另一個目的是提供該肽修飾碳納米管載體的制備方法;本發明的第三目的是提供該多肽載體結合未甲基化胞嘧啶-鳥嘌呤二核苷酸的dna(cpgdna)等免疫激活劑在前列腺癌治療中的應用。
本發明所要解決的主要技術問題是:如何提高增強碳納米管的水溶液中的溶解性、分散性,降低多壁碳納米管的生物機體毒性,以及如何提高肽修飾碳納米管載體進入細胞的能力且可以實現溶酶體逃逸,同時保證材料具有生物可降解特性。
本發明設計了一種肽修飾的多壁碳納米管載體,由精氨酸、組氨酸組成的多肽hr,hr中精氨酸帶正電荷可與帶負電未甲基化胞嘧啶-鳥嘌呤二核苷酸的dna(cpgdna)等免疫激活劑結合并具有穿膜作用,其中組氨酸因其質子海綿效應而促進內涵體逃逸。
本發明的第一方面,提供一種肽修飾的多壁碳納米管載體,所述的多壁碳納米管是表面羧基化的多壁碳納米管;所述的肽修飾,是指多壁碳納米管上的羧基和組氨酸上的氨基通過酰胺鍵連接。是根據序列進行肽固相合成,再將羧基化的碳納米管上的羧基和組氨酸上的氨基通過酰胺鍵連接得到所述的肽修飾的多壁碳納米管載體。
所述的羧基化的多壁碳納米管,是將2g多壁碳納米管加入98%濃硫酸和98%濃硝酸混合溶液中(3:1,v/v,80ml),在超聲波水溶鍋(40khz,40℃)超聲8小時,然后磁力攪拌24小時,通過離心分離出羧基化的多壁碳納米管,并冷凍干燥以備使用。
所述的肽修飾的多壁碳納米管載體可通過將多壁碳納米管(mwcnt)和多肽hr按照一定的比例攪拌一定的時間而成。優選的,所述的多壁碳納米管(mwcnt)和多肽hr的質量比為1:30-1:20。更優選1:30。
所述的多肽的氨基酸序列如下所示:
hhhrrrrrr(seqidno:1);氨基酸之間以肽鍵相連,多肽可簡寫為h3r6,縮寫為hr。可通過固相合成法合成。
所述的肽修飾,是指羧基化的多壁碳納米管上的羧基和組氨酸上的氨基通過酰胺鍵連接。
所述的肽修飾的多壁碳納米管載體可以簡寫為:mhr,其中m為多壁碳納米管,h為組氨酸,r為精氨酸。
所述的肽修飾的多壁碳納米管載體的化學結構式如式(i)所示:
本發明的h組氨酸,r精氨酸組成9肽,氨基酸之間以肽鍵連接,英文縮寫為hr;在9肽的n端,碳納米管上的羧基與氨基以酰胺鍵連接,肽修飾的多壁碳納米管英文縮寫為mhr;與未甲基化胞嘧啶-鳥嘌呤二核苷酸的dna(cpgdna)等免疫激活劑結合后結合縮寫為mhr-cpg。
本發明的第二個方面,提供上述的肽修飾的多壁碳納米管載體的制備方法,所述的制備方法包括如下步驟:
(a)hhhrrrrrr多肽的合成:合成hr;
(b)肽修飾的多壁碳納米管載體制備:將步驟(a)合成的多肽hr與羧基化的多壁碳納米管(mwcnt),按質量比mwcnt/hr=1:30-1:20(優選1:30)攪拌反應24小時。
在本發明的一個優選實施例中,步驟(b)具體為:取30mgmwcnt加入到200mgedc和nhs200mg的蒸餾水溶液中,磁力攪拌反應3小時,將多壁碳納米管進行羧基化之后,按1:30的比例加入多肽hr反應,磁力攪拌24小時,然后離心去除未反應的多肽。
在本發明的一個優選實施例中,所述的步驟(b)中羧基化的多壁碳納米管,是將2g多壁碳納米管加入98%濃硫酸和98%濃硝酸混合溶液中(3:1,v/v,80ml),在超聲波水溶鍋(40khz,40℃)超聲8小時,然后磁力攪拌24小時,通過離心分離出羧基化的多壁碳納米管,并冷凍干燥以備使用。
優選的,步驟(b)反應后的溶液,2000rpm離心5min棄掉上清液,除去未反應肽。
優選的,步驟(b)所制得的樣品在-20℃保存。
為維持納米載體材料較高的活性,將制備的溶液冷凍干燥,并保存于-20℃,納米材料在復溶后可在4℃長期保存。
本發明的第三個方面,是提供了上述的肽修飾的多壁碳納米管載體在制備聯合免疫激活劑藥物中的應用。
優選的,所述的免疫激活劑,為未甲基化胞嘧啶-鳥嘌呤核苷酸的dna(cpgdna)。
所述的藥物中,肽修飾的多壁碳納米管載體中的精氨酸帶正電可以與帶負電免疫激活劑進行結合。
進一步地,本發明還提供了上述的肽修飾的多壁碳納米管載體在制備前列腺癌治療藥物中的應用。
進一步的,本發明還提供了上述的肽修飾的多壁碳納米管載體聯合未甲基化胞嘧啶-鳥嘌呤二核苷酸的dna(cpgdna)等免疫激活劑在制備前列腺癌治療藥物中的應用。
所述的應用具體為:
將此肽修飾的多壁碳納米管載體與cpgdna混合,制得mhr-cpg納米免疫激活劑。
所述的肽修飾的多壁碳納米管與cpgdna混合的n/p比為5:1-40:1(優選6:1),在此比例范圍內,所述納米載體材料能夠引導cpgdna進入細胞內。
本發明提供的納米載體適用于實驗所需的免疫激活。
本發明的優點在于:
本發明構建了一種由3個精氨酸(arginine)、6個組氨酸(histidine)組成的短肽(hr)修飾的多壁碳納米管(multiwalledcarbonnanotubes)的納米載體mhr,可以增強碳納米管的水溶液中的溶解性、分散性,降低多壁碳納米管的生物機體毒性。穿膜短肽hr中的精氨酸帶正電,通過靜電吸附富含未甲基化胞嘧啶-鳥嘌呤二核苷酸的dna(cpgdna)免疫激活劑,形成mhr-cpg納米免疫激活劑,保護cpg免受核酸酶的降解,增強其細胞攝取率,組氨酸的質子海綿效應可實現溶酶體逃逸。
本發明的納米載體可以利用mhr-cpg激發機體的抗腫瘤免疫效應,為前列腺癌患者的治療開辟一個新的治療策略,同時也為碳納米管應用于藥物載體提供新的理論依據和思路。
本發明的制備方法操作簡單,反應試劑和得到的產物無毒性,不會對環境產生污染,反應條件溫和,反應后得到的納米載體純化簡單,成分低廉,利于大規模推廣于研究和應用領域。
附圖說明
圖1.mhr的核磁共振氫譜圖;
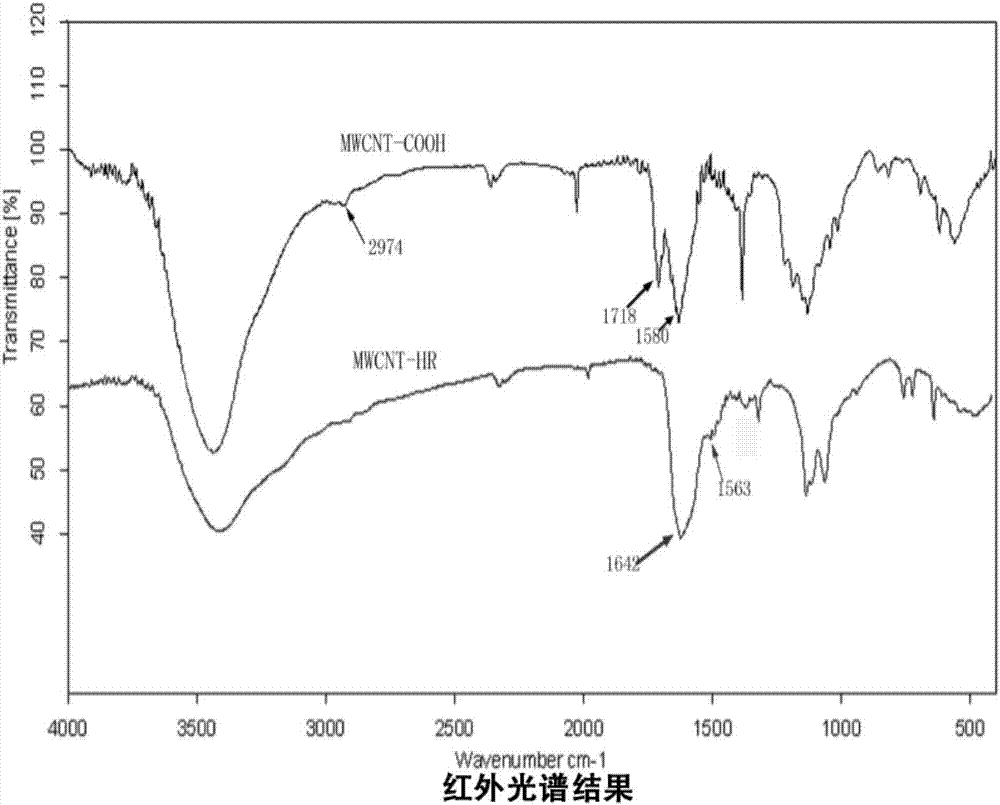
圖2.mhr紅外光譜圖;
圖3.其中a為羧基化的多壁碳納米管mwcnt-cooh,b為肽修飾的多壁碳納米管mhr透射電鏡圖;
圖4.mhr的zeta電位圖;
圖5.不同氮磷比mhr/pegfp體外轉染圖;
圖6.瓊脂糖凝膠電泳圖(考察mhr載基因的能力);
圖7.cpg、mhr-cpg的細胞攝取圖;
圖8.激光共聚焦結果圖;
圖9.mhr和mwcnt-cooh的細胞毒性考察;
圖10.免疫活性因子elisa考察。
具體實施方式
下面結合實施例對本發明提供的具體實施方式作詳細說明。
實施例1:hr的合成
9肽hr氨基酸序列:hishishisargargargargargarg(his,組氨酸;arg,精氨酸)(seqidno:1),hr,由上海吉爾生化有限公司采用多肽固相合成法合成并命名為hr,利用制備高效液相色譜純化合成的hr,使其純度達到95%以上。r為精氨酸,h為組氨酸,氨基酸之間以肽鍵連接形成9肽。
實施例2:肽修飾的多壁碳納米管載體mhr的制備
對多壁碳納米管表面進行羧基化修飾,再對表面羧基進行活化,根據hhhrrrrrr序列進行肽固相合成(按質量比mwcnt/hr,1:30),攪拌反應24小時,碳納米管上的羧基和組氨酸上的氨基能過酰胺鍵連接得到mhr,然后高速離心,對mhr測定電徑,再用透視電鏡對肽修飾的mhr進行形態考察,并利用核磁共振氫譜和紅外光譜鑒定所得聚合物的結構特征。核磁共振氫譜結果見圖1,紅外光譜結果見圖2,羧基化后的碳納米管和肽修飾多壁碳納米管的透射電鏡如圖3a和b(a為羧基化的多壁碳納米管,b為肽修飾多壁碳納米管),mhr的電位圖結果見圖4,電位+30mv左右。
實施例3:mhr/pegfp體外轉染效率考察
選取鼠巨噬細胞細胞株raw-264(購自中國科學院上海生物科學研究所細胞培養中心),加入不同氮磷比(5、10、20、40)的mhr負載egfp質粒,配置納米復合物渦旋10s后靜置30min,加入孔板中,培養4小時后,更換為新鮮培養基,繼續培養24小時。熒光顯微鏡觀察細胞轉染情況,如圖5所示。圖5顯示在n/p=10時mhr的轉染效率最佳。
實施例4:mhr載基因的能力的考察
配制不同n/p的mhr-cpg,進行瓊脂糖凝膠電泳,測定mhr的負載cpg的功效。瓊脂糖凝膠電泳結果見圖6,mhr在n/p=6時即可將cpg完全載上。
實施例5:cpg、mhr-cpg的細胞攝取情況
用mhr和標記fitc的cpg進行渦漩,靜止30min,選擇raw-264細胞,按照30w/孔分別接種于12孔板上,加入1ml含10%fbs(gibco公司,美國)的dmem培養基(gibco公司,美國)培養24小時,使細胞匯合度達70-80%,加入cpg、mhr-cpg復合物,無血清培基37℃培養4h,利用流失細胞儀、激光共聚焦考察其攝取。
流失細胞術結果見圖7(圖7a表示的是流失細胞術結果,圖7b結果是cpg-fitc陽性細胞數),可以看出mhr-cpg的攝取情況明顯多于單純的cpg。共聚焦結果見圖8,可見mhr可以成功的將fitc標記的cpg攜帶進入細胞。
實施例6:mhr和mwcnt-cooh的細胞毒性研究
將raw264細胞按照8×103/孔接種于96孔板中,培養24h,使細胞匯合度達到50%。吸去培養基,每孔加入100μl含不同濃度mhr和羧基化的多壁碳納米管mwcnt-cooh,繼續培養24、48h,cck-8法檢測細胞毒性,統計細胞存活率。結果見圖9,可以看出mhr在24h和48h對細胞幾乎沒有毒性,毒性明顯小于mwcnt-cooh。
實施例7:免疫活性因子elisa考察
給藥分組如下mhr-cpg、mhr、cpg、mhr-noncpg、lps、空白組對raw-264細胞培養24小時,收集培養基,離心收集上清,elisa方法測定細胞免疫因子(tnf-α、il-12)的濃度。結果見圖10。可以看出,mhr-cpg的免疫刺激活性和lps的免疫刺激活性相當,明顯高于單體cpg。
以上已對本發明創造的較佳實施例進行了具體說明,但本發明創造并不限于所述實施例,熟悉本領域的技術人員在不違背本發明創造精神的前提下還可做出種種的等同的變型或替換,這些等同的變型或替換均包含在本申請權利要求所限定的范圍內。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種高度石墨化碳納米線團材料及其制備方法
- 多壁碳納米管/ Ce<sup>3+</sup>摻雜TiO<sub>2</sub>納米纖維在對苯酚催化降解中的應用
- 一種石墨材料表面原位自生碳納米管的方法
- 一種碳納米管-石墨協同增強的電子煙導油繩制備方法
- 一種功能化多壁碳納米管共混超濾膜的制備方法
- 一種在膨脹石墨孔隙內生長納米碳管的方法
- 碳納米管/膨脹石墨組合填料及其制備方法和含有組合填料的導熱高分子材料及其制備方法
- 一種表面可控氧化的石墨化中間相碳微球負極材料及其制備方法
- 一種含改性氟化石墨纖維-碳納米管的pc-pet基led散熱材料及其制備方法
- 一種led用碳納米管-石墨填充改性的pa6/abs復合導熱塑料及其制備方法
- 一種摻雜多壁碳納米管的殼聚糖生物凝膠膜的制備工藝方法與流程
- 一種金屬摻雜的光熱碳納米材料及其制備方法和應用與流程
- 一種單質銅包覆多壁碳納米管/鋁基復合材料半固態坯料的制備方法與流程
- 一種基于多壁碳納米管修飾超濾膜深度處理飲用水中抗生素的方法與流程
- 基于分等級結構的Ce摻雜In2O3納米敏感材料的丙酮傳感器、制備方法及其應用與流程
- 一種生物基氮硫共摻雜碳納米片的制備方法與流程
- 一種多壁碳納米管增強傳熱密封材料及其制備方法與流程
- 金屬/碳納米管復合摻雜的磷酸錳鐵材料及其制備方法與流程
- 具有核殼結構的硫化鉬/多壁碳納米管雜化材料及其制備方法和應用與流程
- 碳納米管摻雜芬布芬分子印跡聚合物控緩釋材料的制備的制作方法與工藝