一種載布洛芬緩釋納米微球及其制備方法和應用與流程
本發明屬于醫藥技術領域,尤其涉及一種載布洛芬緩釋納米微球及其制備方法和應用。
背景技術:
內臟痛是臨床上常見的癥狀,常由機械性牽拉、痙攣、缺血和炎癥等刺激所致。內臟痛的主要特點為定位不準確,腹痛病人一般不能說出疼痛發生的具體位置,主要原因是由于內臟的痛覺感受器分布要比軀體的稀疏得多,同時內臟感覺的傳入途徑也比較分散。內臟痛另外一個特點是常常伴有牽涉痛,即內臟器官的炎癥疼痛常常有體表某一區域的疼痛。此外,內臟痛常引起不愉快的情緒活動,并伴有惡心、嘔吐以及呼吸活動等改變。目前,內臟痛的具體發病機制仍然不清,臨床上也沒有有效的治療手段。
目前,臨床上常用布洛芬、阿司匹林、保泰松、羅非昔布、塞來昔布等止痛藥來緩解內臟痛,其中,由于布洛芬的鎮痛效果遠比阿斯匹林、保泰松和撲熱息強,而倍受消費者青睞。但布洛芬的半衰期比較短,鎮痛效果不持久。
技術實現要素:
有鑒于此,本發明的目的在于提供一種載布洛芬緩釋納米微球及其制備方法和應用,本發明提供的載布洛芬緩釋納米微球具有良好的緩釋效果。
本發明提供了一種載布洛芬緩釋納米微球,包括載體和負載在載體上的布洛芬;
所述載體為聚乳酸-羥基乙酸共聚物。
優選的,所述聚乳酸-羥基乙酸共聚物的重均分子量為40000~75000。
優選的,所述乳酸-羥基乙酸共聚物中具有乳酸結構的重復單元與具有羥基乙酸結構的重復單元的摩爾比為(50~80):(50~20)。
優選的,所述布洛芬在緩釋納米微球中的含量為5~20wt%。
優選的,所述緩釋納米微球的粒徑為50~200nm。
本發明提供了一種上述技術方案所述載布洛芬緩釋納米微球的制備方法,包括以下步驟:
a)、將布洛芬、載體和有機溶劑混合,得到混合溶液;
b)、將所述混合溶液、乳化劑和水混合,得到乳狀液;
c)、所述乳狀液除去有機溶劑,得到載布洛芬緩釋納米微球。
優選的,所述有機溶劑包括二氯甲烷和/或氯仿;所述乳化劑包括聚乙烯醇和/或聚乙二醇。
本發明提供了一種治療內臟痛的載布洛芬緩釋制劑,包括上述技術方案所述的緩釋納米微球和藥學上可接受的輔料。
優選的,所述緩釋制劑為足底注射劑。
上述技術方案所述的載布洛芬緩釋納米微球在制備足底注射治療內臟痛藥物中的應用。
與現有技術相比,本發明提供了一種載布洛芬緩釋納米微球及其制備方法和應用。本發明提供的載布洛芬緩釋納米微球包括載體和負載在載體上的布洛芬;所述載體為聚乳酸-羥基乙酸共聚物。本發明提供的載布洛芬緩釋納米微球以聚乳酸-羥基乙酸共聚物作為載體,具有良好的緩釋效果。本發明還提供了一種治療內臟痛的載布洛芬緩釋制劑,所述緩釋制劑包括上述緩釋納米微球和藥學上可接受的輔料。本發明提供的緩釋制劑在治療內臟痛時具有持久的陣痛效果。在本發明提供的優選技術方案中,所述緩釋制劑為足底注射劑,本發明通過足底注射來治療內臟痛可以避免口服布洛芬制劑帶來的相關副作用。實驗結果表明,本發明提供的載布洛芬緩釋納米微球可以明顯緩解大鼠的內臟痛,并可以持續緩解疼痛達到3小時。
附圖說明
為了更清楚地說明本發明實施例或現有技術中的技術方案,下面將對實施例或現有技術描述中所需要使用的附圖作簡單地介紹,顯而易見地,下面描述中的附圖僅僅是本發明的實施例,對于本領域普通技術人員來講,在不付出創造性勞動的前提下,還可以根據提供的附圖獲得其他的附圖。
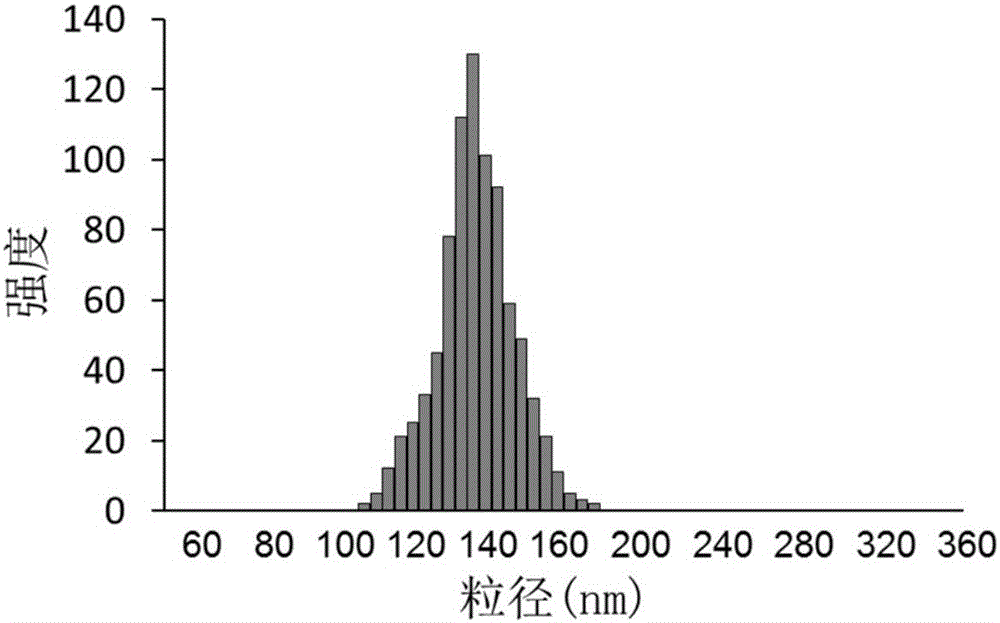
圖1是本發明實施例1提供的納米微球粒徑分布圖;
圖2是本發明實施例2提供的納米微球粒徑分布圖;
圖3是本發明實施例3提供的納米微球粒徑分布圖;
圖4是本發明實施例4提供的載布洛芬藥物納米微球的體外釋放曲線圖;
圖5是本發明實施例5提供的載布洛芬藥物納米微球的體外釋放曲線圖;
圖6是本發明實施例6提供的載布洛芬藥物納米微球的體外釋放曲線圖;
圖7是本發明實施例7提供的背根神經節中熒光的分布圖;
圖8是本發明實施例8提供的足底注射不同劑量的載布洛芬納米微球的生理鹽水注射劑緩解大鼠內臟痛的效果圖;
圖9是本發明實施例8提供的足底注射載布洛芬納米微球的生理鹽水注射劑緩解大鼠內臟痛的時程效果圖。
具體實施方式
下面對本發明實施例中的技術方案進行清楚、完整地描述,顯然,所描述的實施例僅僅是本發明一部分實施例,而不是全部的實施例。基于本發明中的實施例,本領域普通技術人員在沒有做出創造性勞動前提下所獲得的所有其他實施例,都屬于本發明保護的范圍。
本發明提供了一種載布洛芬緩釋納米微球,包括載體和負載在載體上的布洛芬;
所述載體為聚乳酸-羥基乙酸共聚物。
本發明提供的載布洛芬緩釋納米微球包括載體和負載在載體上的布洛芬。其中,所述布洛芬又稱為2-(-4-異丁基苯基)丙酸,CAS號為15687-27-1。
在本發明中,所述載體為聚乳酸-羥基乙酸共聚物(簡稱:PLGA),該共聚物為無規共聚物,由乳酸單體和羥基乙酸單體共聚而成,共聚物中包括無規排列的具有乳酸結構的重復單元和具有羥基乙酸結構的重復單元。在本發明提供的一個實施例中,所述聚乳酸-羥基乙酸共聚物的重均分子量(Mw)為40000~75000,具體可為45000、50000、55000、60000、65000或70000。在本發明提供的一個實施例中,所述乳酸-羥基乙酸共聚物中具有乳酸結構的重復單元與具有羥基乙酸結構的重復單元的摩爾比為(50~80):(50~20),優選為(65~70):(35~30)。
在本發明提供的一個實施例中,所述布洛芬在載布洛芬緩釋納米微球中的含量為5~20wt%,具體可為6wt%、7wt%、8wt%、9wt%、10wt%、11wt%、12wt%、13wt%、14wt%、15wt%、16wt%、17wt%、18wt%或19wt%。在本發明提供的一個實施例中,所述布洛芬在載布洛芬緩釋納米微球的粒徑為50~200nm,具體可為90~130nm。
本發明提供的載布洛芬緩釋納米微球以聚乳酸-羥基乙酸共聚物作為載體,具有良好的緩釋效果。實驗結果表明,本發明提供的載布洛芬緩釋納米微球可以明顯緩解大鼠的內臟痛,并可以持續緩解疼痛達到3小時。
本發明提供了一種上述技術方案所述載布洛芬緩釋納米微球的制備方法,包括以下步驟:
a)、將布洛芬、載體和有機溶劑混合,得到混合溶液;
b)、將所述混合溶液、乳化劑和水混合,得到乳狀液;
c)、所述乳狀液除去有機溶劑,得到載布洛芬緩釋納米微球。
在本發明提供的制備方法中,首先將布洛芬、載體和有機溶劑混合。其中,所述有機溶劑包括但不限于二氯甲烷和/或氯仿。在本發明中,所述布洛芬與載體的質量比優選為1:(5~20),更優選為1:(5~10),具體可選擇為1:8;所述載體和有機溶劑的質量體積比優選為(50~100)mg:(1~10)mL。在本發明中,所述布洛芬、載體和有機溶劑混合的溫度優選為室溫;本發明對混合的時間沒有特別限定,可是布洛芬和載體完全溶解在有機溶劑中即可;本發明對混合所用的設備沒有特別限定,優選本領域技術人員熟知的搖床。混合完畢后,得到混合溶液。
得到混合溶液后,將所述混合溶液、乳化劑和水混合。其中,所述乳化劑包括但不限于聚乙烯醇(簡稱:PVA)和/或聚乙二醇。在本發明中所述聚乙烯醇的重均分子量優選為9000~2000000,聚乙二醇的重均分子量優選為5000~2000000。在本發明中,所述乳化劑與所述混合溶液中載體的質量比優選為(500~1000):(50~100),具體可選擇為600:100、700:100、710:100、800:100或900:100;所述水與所述混合溶液中載體的體積質量比優選為(30~100)mL:(50~100)mg,具體可選擇為40mL:100mg、50mL:100mg、53mL:100mg、60mL:100mg、70mL:100mg、80mL:100mg或90mL:100mg。在本發明中,所述混合溶液、乳化劑和水的混合優選在超聲條件下進行;所述超聲的功率優選為200~500W,具體可為300W或400W;所述超聲的時間優選為1~10min,具體可為3min、4min、5min、6min、7min或8min。
在本發明提供的一個實施例中,所述混合溶液、乳化劑和水優選按照以下方式進行混合:先將乳化劑和水混合,得到乳化液;再將所述乳化液與所述混合溶液混合。其中,所述乳化液優選包括第一乳化液和第二乳化液;所述第一乳化液中乳化劑與水的質量體積比優選為(0.1~0.5)g:(1~10)mL,具體可為0.21g:3mL;所述第二乳化液中乳化劑與水的質量體積比優選為(0.1~1)g:(10~100)mL,具體可為0.5g:50mL。在本發明提供的一個包括第一乳化液和第二乳化液的實施例中,先將所述第二乳化液與混合溶液在超聲條件下混合,之后再將混合物與第一乳化液在超聲條件下混合。其中,第一次混合的時間優選為0.5~2min,具體可選擇為1min;第二次混合的時間優選為2~5min,具體可選擇為3min。
所述混合溶液、乳化劑和水混合完畢后,得到乳狀液。得到乳狀液后,將所述乳狀液中的有機溶劑除去。在本發明中,除有機溶劑的方式優選為對所述乳狀液進行攪拌,從而使乳狀液中的有機溶劑揮發。乳狀液中的有機溶劑除凈后,得到載布洛芬緩釋納米微球。在本發明中,優選對得到的載布洛芬緩釋納米微球進行水洗,從而提高緩釋納米微球的純凈度。
本發明提供的方法能夠制得粒徑均一、分散性好的載布洛芬緩釋納米微球,該緩釋納米微球具有良好的緩釋效果。實驗結果表明,本發明提供的載布洛芬緩釋納米微球可以明顯緩解大鼠的內臟痛,并可以持續緩解疼痛達到3小時。
本發明提供了一種治療內臟痛的載布洛芬緩釋制劑,包括上述技術方案所述的緩釋納米微球和藥學上可接受的輔料。
本發明提供的緩釋制劑包括所述緩釋納米微球和藥學上可接受的輔料。在本發明提供的一個實施例中,所述緩釋制劑為足底注射劑,所述足底注射劑包括所述緩釋納米微球和溶劑。在本發明提供的足底注射劑中,所述溶劑包括但不限于生理鹽水或可用于生物體注射的緩沖液,所述緩沖液可選擇磷酸鹽緩沖液;所述緩釋納米微球在足底注射劑中的濃度優選為1~100mg/mL,具體可選擇為1mg/mL、2mg/mL、3mg/mL、4mg/mL、5mg/mL、6mg/mL、7mg/mL、8mg/mL、9mg/mL、10mg/mL、11mg/mL、12mg/mL、13mg/mL、14mg/mL、15mg/mL、20mg/mL、25mg/mL、30mg/mL、35mg/mL、40mg/mL、45mg/mL、50mg/mL、55mg/mL、60mg/mL、65mg/mL、70mg/mL、75mg/mL、80mg/mL、85mg/mL、90mg/mL或95mg/mL。
本發明提供的緩釋制劑在治療內臟痛時具有持久的陣痛效果。在本發明提供的優選技術方案中,所述緩釋制劑為足底注射劑,本發明通過足底注射來治療內臟痛可以避免口服布洛芬制劑帶來的相關副作用。實驗結果表明,本發明提供的載布洛芬緩釋制劑可以明顯緩解大鼠的內臟痛,并可以持續緩解疼痛達到3小時。
本發明提供的上述技術方案具有如下優勢之一:
1)、本發明使用PLGA為制備納米粒子載體,PLGA是一種可降解的功能高分子有機化合物,無毒、具有良好的生物相容性、良好的成囊和成膜的性能,被廣泛應用于制藥、醫用工程材料和現代化工業領域。在美國PLGA通過FDA認證,被正式作為藥用輔料收錄進美國藥典。
2)、本發明載布洛芬藥物納米微球以PLGA作為載體,可以將藥物布洛芬以緩釋的方式釋放。PLGA作為載體,能夠有效延長藥物布洛芬的半衰期。我們的研究顯示載布洛芬藥物納米微球可以明顯緩解大鼠的內臟痛,并可以持續緩解疼痛達到3小時;
3)、本發明載布洛芬藥物納米微球可避免藥物布洛芬本身的高劑量,毒性導致的副作用;
4)、本發明載布洛芬藥物納米微球具有很好的生物相容性,無毒性,生物化學性質穩定;
5)、本發明制備方法制得的納米粒子粒徑較均一,分散性好。
6)、本發明獨特的給藥途徑—足底注射藥物,其方法簡單,易操作;
7)、本發明通過將載布洛芬藥物納米微球作為止痛藥劑注射足底來治療內臟痛,可避免長期口服布洛芬帶來的腎功能衰竭,消化不良等副作用。
為更清楚起見,下面通過以下實施例進行詳細說明。
實施例1
載布洛芬緩釋納米微球的制備
步驟1)
稱取100mg PLGA(lactide:glycolide=65:35(n:n),Mw=40000~75000)和15mg布洛芬,然后分別加入到1mL的二氯甲烷中,室溫于搖床上溶解混合,得到含PLGA和布洛芬的混合溶液;稱取0.5g,0.21gPVA(Mw=9000~2000000)分別加到50mL和3mL的雙蒸水中,制備1g/100mL和7g/100mL的PVA水溶液。
步驟2)
將步驟1)制取的PLGA和布洛芬的混合溶液與7g/100mL的PVA水溶液混合并用超聲破碎儀超聲1分鐘(功率300W)產生乳狀液,然后將乳狀液加入步驟1)制取的1g/100mL的PVA水溶液中繼續超聲3分鐘(功率300W),然后在攪拌器上持續攪拌24小時充分去除二氯甲烷,最后用雙蒸水洗滌兩次(13000rpm離心),最后重懸到2mL雙蒸水中,得到負載布洛芬的納米微球。
通過動態光散射測定上述納米微球的粒徑分布,結果如圖1所示,圖1是本發明實施例1提供的納米微球粒徑分布圖,通過圖1可以看出,納米微球的粒徑分布在92~185nm。
通過高效液相色譜測定上述納米微球的載藥量,結果為11wt%。
實施例2
載布洛芬緩釋納米微球的制備
步驟1)
稱取100mg PLGA(lactide:glycolide=65:35(n:n),Mw=40000~75000)和10mg布洛芬,然后分別加入到1mL的二氯甲烷中,室溫于搖床上溶解混合,得到含PLGA和布洛芬的混合溶液;稱取0.5g,0.21g PVA(Mw=9000~2000000)分別加到50mL和3mL的雙蒸水中,制備1g/100mL和7g/100mL的PVA水溶液。
步驟2)
將步驟1)制取的PLGA和布洛芬的混合溶液與7g/100mL的PVA水溶液混合并用超聲破碎儀超聲1分鐘(功率300W)產生乳狀液,然后將乳狀液加入步驟1)制取的1g/100mL的PVA水溶液中繼續超聲3分鐘(功率300W),然后在攪拌器上持續攪拌24小時充分去除二氯甲烷,最后用雙蒸水洗滌兩次(13000rpm離心),最后重懸到2mL雙蒸水中,得到負載布洛芬的納米微球。
通過動態光散射測定上述納米微球的粒徑分布,結果如圖2所示,圖2是本發明實施例2提供的納米微球粒徑分布圖,通過圖2可以看出,納米微球的粒徑分布在85~180nm。
通過高效液相色譜測定上述納米微球的載藥量,結果為8wt%。
實施例3
載布洛芬緩釋納米微球的制備
步驟1)
稱取100mg PLGA(lactide:glycolide=65:35(n:n),Mw=40000~75000)和20mg布洛芬,然后分別加入到1mL的二氯甲烷中,室溫于搖床上溶解混合,得到含PLGA和布洛芬的混合溶液;稱取0.5g,0.21gPVA(Mw=9000~2000000)分別加到50mL和3mL的雙蒸水中,制備1g/100mL和7g/100mL的PVA水溶液。
步驟2)
將步驟1)制取的PLGA和布洛芬的混合溶液與7g/100mL的PVA水溶液混合并用超聲破碎儀超聲1分鐘(功率300W)產生乳狀液,然后將乳狀液加入步驟1)制取的1g/100mL的PVA水溶液中繼續超聲3分鐘(功率300W),然后在攪拌器上持續攪拌24小時充分去除二氯甲烷,最后用雙蒸水洗滌兩次(13000rpm離心),最后重懸到2mL雙蒸水中,得到負載布洛芬的納米微球。
通過動態光散射測定上述納米微球的粒徑分布,結果如圖3所示,圖3是本發明實施例3提供的納米微球粒徑分布圖,通過圖3可以看出,納米微球的粒徑分布在90~185nm。
通過高效液相色譜測定上述納米微球的載藥量,結果為13wt%。
實施例4
緩釋納米微球的體外釋放曲線的檢測試驗
在37℃下,分別將100mg實施例1制備的載布洛芬緩釋納米微球和10mg布洛芬加入到10mL的磷酸鹽緩沖液中(0.01M,PH=7.4)透析,每隔2小時進行取樣,利用高效液相色譜(HPLC,C-18柱,流動相為甲醇:乙腈:磷酸二氫鈉溶液(0.02mol/L)=50:25:25,流動相用磷酸調節pH值至3.0±0.05,檢測波長為263nm,流速為1.0mL/min)測定布洛芬的濃度,并繪制布洛芬釋放曲線,如圖4所示,圖4是本發明實施例4提供的載布洛芬藥物納米微球的體外釋放曲線圖。通過圖4可以看出,相比于布洛芬,實施例1提供的載布洛芬納米微球具有良好的緩釋效果。
實施例5
緩釋納米微球的體外釋放曲線的檢測試驗
在37℃下,分別將100mg實施例2制備的載布洛芬緩釋納米微球和10mg布洛芬加入到10mL的磷酸鹽緩沖液中(0.01M,PH=7.4)透析,每隔2小時進行取樣,利用高效液相色譜(HPLC,C-18柱,流動相為甲醇:乙腈:磷酸二氫鈉溶液(0.02mol/L)=50:25:25,流動相用磷酸調節pH值至3.0±0.05,檢測波長為263nm,流速為1.0mL/min)測定布洛芬的濃度,并繪制布洛芬釋放曲線,如圖5所示,圖5是本發明實施例5提供的載布洛芬藥物納米微球的體外釋放曲線圖。通過圖5可以看出,相比于布洛芬,實施例2提供的載布洛芬納米微球具有良好的緩釋效果。
實施例6
緩釋納米微球的體外釋放曲線的檢測試驗
在37℃下,分別將100mg實施例3制備的載布洛芬緩釋納米微球和10mg布洛芬加入到10mL的磷酸鹽緩沖液中(0.01M,PH=7.4)透析,每隔2小時進行取樣,利用高效液相色譜(HPLC,C-18柱,流動相為甲醇:乙腈:磷酸二氫鈉溶液(0.02mol/L)=50:25:25,流動相用磷酸調節pH值至3.0±0.05,檢測波長為263nm,流速為1.0mL/min)測定布洛芬的濃度,并繪制布洛芬釋放曲線,如圖6所示,圖6是本發明實施例6提供的載布洛芬藥物納米微球的體外釋放曲線圖。通過圖6可以看出,相比于布洛芬,實施例3提供的載布洛芬納米微球具有良好的緩釋效果。
實施例7
雙熒光示蹤劑標記特異性支配足底和結腸的背根神經節(DRG)神經元
以正常的雄性大鼠(體重180g左右)作為實驗對象,首先用水合氯醛(360mg/kg)將大鼠麻醉,接著在無菌條件下將10μL熒光示蹤劑DiI(1,19-dioleyl-3,3,39,3-tetramethylindocarbocyanine methanesulfonate;Invitrogen,Carlsbad,CA)分5個點注射到結腸腸壁上(每個點2μL),同時將10μL的熒光金(FG)分5個點注射大鼠后足底(每個點2μL),注射完畢待大鼠蘇醒后于正常條件下(室溫24℃,濕度50-60%,通風良好,人工晝夜(12h/12h),自由攝食攝水)喂養一周,然后麻醉大鼠,灌流取DRGs,由于支配足底的背根神經節主要分布在腰段L2-6,而支配結腸的背根神經節主要分布在胸段T13,腰段L1和L2,所以取材主要取T13-L6DRGs。然后,行冰凍切片觀察熒光在背根神經節中的分布情況。觀察結果如圖7所示,圖7是本發明實施例7提供的背根神經節中熒光的分布圖,圖7中,T13、L1、L2、L6表示不同背根神經節的編號,左欄為FG熒光的分布情況,中間欄為DiI熒光的分布情況,右欄為FG熒光和DiI熒光的疊加圖。通過圖7可知,在T13、L1、L2、L6均存在雙色熒光標記的神經元,說明同時支配足底和結腸的神經元主要分布在T13、L1、L2、L6的背根神經節中。也就是說,支配內臟的神經纖維與支配足底的神經纖維可由背根神經節中同一個神經元發出,即在背根神經節中有些神經元可以同時支配內臟和足底。所以,可通過將藥物注射足底,來降低同時支配內臟和足底的神經元興奮性,達到治療內臟痛的目的。
實施例8
鞘內注射載布洛芬緩釋納米微球的生理鹽水注射劑緩解大鼠內臟痛試驗
給予出生第10天SD大鼠足底注射完全弗氏佐劑CFA,可以誘發成年大鼠的AWR(腹壁撤回反射)評分顯著升高,即表現為內臟痛覺過敏,且這種作用可以從第6周持續到第12周。
選取模型成功大鼠,后爪足底注射不同劑量的載布洛芬緩釋納米微球的生理鹽水注射劑,檢測其緩解內臟痛敏效果。檢測成年大鼠內臟痛反應主要通過腹壁撤回反射(Abdominalwithdrawalreflex,AWR)評分來測量痛閾。首先將大鼠用乙醚適度麻醉,迅速將涂有石蠟油的乳膠擴張氣囊小心地插入大鼠的結直腸,插入長度約8cm。用膠帶把大鼠尾巴固定在木板上,固定好后讓大鼠清醒并適應30分鐘,以待測試。用水銀檢壓計分別給以不同壓力充氣。結直腸擴張(CRD)可引起大鼠腹部肌肉的收縮,這稱為內臟收縮反應(Visceral Motor Responses,VMR)。通過CRD擴張結直腸進行腹部撤回反射AWR評分方法檢測內臟痛覺的反應性,CRD:用臺式血壓計將氣球快速加壓至恒壓:20、40、60、80mmHg,2min一次,一次停留20s。
用AWR評分方法檢測大鼠結腸痛閾:0,沒有可察覺的異常表現;1,頭部輕微僵直而身體沒有明顯異常;2,側腹部收縮;3,下腹壁抬離桌面;4,下腹部拱起。根據大鼠在不同壓力擴張情況下的反應給予相應的分數,相同壓力下分值越高說明大鼠對疼痛越敏感。
將不同計量的實施例1制備的載布洛芬緩釋納米微球加入到生理鹽水中,分別獲得布洛芬含量為0.14mg/0.1mL、0.4mg/0.1mL、1.2mg/0.1mL的載布洛芬緩釋納米微球的生理鹽水注射劑。分別足底注射1.2mg布洛芬,以及0.1mL上述載布洛芬緩釋納米微球的生理鹽水注射劑,注射后進行結直腸擴張(20、40、60、80mmHg)刺激,用AWR評分方法觀察大鼠的內臟痛反應變化和時程效應。結果如圖8和圖9所示,圖8是本發明實施例8提供的足底注射不同劑量的載布洛芬納米微球的生理鹽水注射劑緩解大鼠內臟痛的效果圖,圖9是本發明實施例8提供的足底注射載布洛芬納米微球的生理鹽水注射劑緩解大鼠內臟痛的時程效果圖。可見,注射0.1mL布洛芬含量1.2mg/0.1mL的載布洛芬緩釋納米微球的生理鹽水注射劑可以明顯翻轉大鼠的內臟痛,并可以持續緩解疼痛達到3小時。
以上所述僅是本發明的優選實施方式,應當指出,對于本技術領域的普通技術人員來說,在不脫離本發明原理的前提下,還可以做出若干改進和潤飾,這些改進和潤飾也應視為本發明的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!