合成空心球的方法與流程
本申請是申請日為2009年3月13日、申請號為200980109808.0、名稱為″合成空心球的方法″的發明專利申請的分案申請。
本發明涉及合成具有聚合物殼的空心球(hollowspheres)的方法。此外,本發明涉及空心球和這些球在超聲成像或超聲藥物遞送中的用途。
背景技術:
超聲作為診斷成像技術用于臨床裝置中。其相對便宜且更加重要的是,不采用電離輻射。在超聲成像中,聲波經換能器(transducer)傳輸至生物組織中。取決于涉及的組織和流體的聲學性質,聲波可被完全或部分地反射或吸收。反射的聲波通過接收換能器檢測,并被進一步處理以形成被研究的組織的圖像。通過組織的聲學性質的相對差異,確定圖像對比度。盡管超聲技術在進步,但是主要器官如肝、脾、腎、前列腺和脈管系統中惡性腫瘤和疾病的成像和檢測仍然存在技術挑戰。
為了優化能夠在超聲成像中獲得的圖像質量,已經開發了造影劑(contrastagents)。現有的超聲造影劑被設計為是聲學活性的,并且包括例如采用類脂、聚合物或蛋白質殼穩定的氣體填充的微泡的組成。固體、液體和氣體的聲學性質,特別是聲阻抗是不同的。這些聲阻抗和可壓縮性方面的明顯變化導致在固體、液體和氣體之間的界面處更加強烈的聲波反射,導致超聲圖像強度的升高。氣體填充的超聲造影劑通過壓縮和膨脹還對超聲波起反應,導致產生可選擇性檢測的特定共振頻率。此外,在造影劑可破裂而釋放可檢測的氣體,和在造影劑中包含藥物,局部釋放治療劑的情況下,造影劑能夠采用超聲脈沖活化。其它遞送模式包括通過新釋放的氣泡的相互作用改變周圍的組織,和暫時提高血管壁對從造影劑單獨結合或給予的藥物的滲透性。
中空的以聚合物為殼的試劑可由乳化過程合成,其中形成油填充的聚合物包覆的膠囊(capsule),然后采用冷凍干燥法除去核。這類合成路線的一個例子公開于le等的文章(ieee,proceedingsoftheannualnortheastbioengineeringconferenceissue,2003年3月22-23日,315-316頁)中,其公開了通過調節乳液聚合物微膠囊制備方法合成納米膠囊。為制備油填充的膠囊,將油或其它疏水性添加劑添加至聚合物溶液中,該聚合物溶液是在該聚合物的僅與水輕度混溶的良溶劑如二氯甲烷中。然后將該溶液在包含穩定劑的水相中乳化。將所述良溶劑在加工期間除去。結果,乳液滴中聚合物的溶解性將下降,并隨后從富含油的相中相分離,從而形成包含油的聚合物殼的膠囊。為通過乳化法生產中空核,將包封的疏水性添加劑或油通過冷凍干燥除去。通常將穩定劑如聚乙烯醇(pva)添加至水相中,以控制粒度和防止聚集。穩定劑的添加通常必須過量,從而需要后續純化和/或洗滌步驟,導致降低的工藝產率。
技術實現要素:
本發明的一個目的在于改進用于具有聲學性質的空心球合成的已知方法,以實現快速且方便的制備。
根據本發明,該目的通過包含以下步驟的方法實現:
提供包含以下的溶液:
-具有疏水性嵌段和親水性嵌段的第一聚合物(1),
-不與水混溶的第二聚合物(2),
-疏水性化合物,
-水混溶性有機溶劑,
將所述溶液與水溶液混合
除去水混溶性有機溶劑
冷凍干燥以除去疏水性化合物。
空心球的直接沉淀通過將聚合物溶液與水溶液混合來引發。所述有機溶劑將立即均勻分布于水相中,導致疏水性化合物填充的聚合物球的形成。將形成所述球的殼的聚合物上親水性嵌段的引入在不使用添加劑的情況下促進了穩定化。這種親水性嵌段的一個例子為大親水性基團例如聚乙二醇(peg)。
由于不存在必須要除去的穩定劑如pva和自動獲得所述球的peg化的(pegylated)外表面,所以根據本發明的方法與常規乳化過程相比更加快速和更加方便。相對于不具有這些嵌段的顆粒,該peg化的表面還導致了增加的顆粒循環時間。
根據另一個實施方案,所述親水性有機溶劑選自丙酮、四氫呋喃、二甲基亞砜、二甲基甲酰胺、乙腈、二醇醚和二甲基乙酰胺或其組合。這些溶劑是本發明方法中所用聚合物的良溶劑,是水混溶性的。所述溶劑從所述混合物中的除去可通過蒸發便利地進行促進。
在一個優選實施方案中,第一聚合物(1)包括選自聚交酯、聚己內酯、聚氰基丙烯酸酯和前述之一的共聚物、聚乙交酯的共聚物或它們的任意組合的組。更優選地,所述聚合物具有小于10000,優選為1000-6000的嵌段長度。當空心球用于人和醫療用途如超聲成像中時,生物可降解性是期望的。
根據一個優選實施方案,第二聚合物(2)包括烷基或氟化端基或它們的組合。在聚合物上烷基和/或含氟基團的引入導致空心球內產生疏水性,保證了憎水性能。這將在含水生物環境中穩定所述球。穩定的聲學活性球可通過對于約1000-10000,更優選1000-5000的聚合物分子量使用具有8-14個碳原子的烷基得到。
可以設想采用聚合物的不同組合以及聚合物的不同改性水平。具有親水性嵌段的聚合物可與疏水改性的聚合物組合。
根據本發明方法的另一個實施方案為步驟(a)的溶液還包括冷凍干燥后得以保留的疏水性化合物如油,和藥學或診斷化合物。這種疏水性化合物的優選例子為具有至少16個碳原子的烷烴、類脂類、石蠟或油中的至少一種,更優選十六烷。這種添加促進了除氣體外還包含溶解或細分散于保留的疏水性化合物中的藥物的可生物降解空心球的形成。可通過采用超聲脈沖來局部釋放溶解于保留在可生物降解空心球內的化合物中的藥物。
本發明的另一個實施方案為根據包括以下步驟的方法合成的具有聚合物殼的空心球:
提供包含以下的溶液:
-具有親水性嵌段和疏水性嵌段的第一聚合物(1),
-不與水混溶的第二聚合物(2),
-疏水性化合物,
-水混溶性有機溶劑,
將所述溶液與水溶液混合
除去水混溶性有機溶劑
冷凍干燥以除去疏水性化合物。
這種空心球優選能夠在施加診斷或治療超聲時破裂。
所述空心球的核與殼之間的比例由溶液中聚合物與疏水性化合物之間的關系決定。優選地,該比例為2∶1-1∶5w/w,更優選為1∶1-1∶4w/w。
優選地,具有親水性嵌段的第一聚合物(1)與不與水混溶的第二聚合物(2)之間的比例在2∶1-1∶12w/w范圍,更優選1∶3-1∶10w/w。應理解的是,添加具有疏水性或親水性性能的額外聚合物,或添加同時具有親水性和疏水性性能的一種聚合物落在本發明的范圍內。
根據本發明該實施方案的空心球當施加超聲脈沖時能夠破裂。該行為導致了在超聲脈沖對準的區域中能夠與超聲相互作用的游離氣泡的形成,增強了藥物遞送的超聲引導。以類似的方式,還可以在相同區域中釋放藥學或診斷化合物。這開啟了控制遞送的量和位置的可能。此外,新形成的氣泡易于吸收入射的超聲能量,然后作為次級聲源再發射,增加局部超聲能量吸收。進而,局部升高的超聲能量沉積可增加局部組織免疫反應的刺激和增強聲孔效應(sono-poration),并從而增強藥物攝取。此外,局部超聲能量吸收可通過包封的氣體的量(即可冷凍干燥的化合物的量)和聲學脈沖的活化振幅進行控制。對應于特定尺寸氣泡的獨特聲學信號的出現允許識別活化釋放以及理想地允許一定的釋放藥物濃度置信度。
所述空心球優選具有50-400nm的尺寸,以通過避免身體中的主要清除機制或抑制其速率來增加循環時間。
在本發明的另一個實施方案中,氣態內容物(gaseouscontent)至少部分地被氣體前體替代。根據該實施方案,所述球包含至少一種可相轉變的疏水性化合物例如液態全氟化碳,如全氟己烷、全氟戊烷、全氟庚烷、全氟辛烷和全氟辛基溴化物。與氣體填充的空心球相比,氣體形成僅通過施加超聲進行誘導。
在另一個實施方案中,所述空心球的殼包括靶向部分。通過將靶向部分或前靶向部分偶聯至所述球,促進了所述球的選擇性靶向。靶向部分的例子包括但不限于抗體或抗體片段、生物素/抗生蛋白鏈菌素連接體和化學正交偶合部分(chemicalorthogonalcouplingmoieties)如用于staudinger反應的膦和疊氮基團。
在另一個實施方案中,所述空心球包括藥物活性化合物,從而所述球可起到藥物載體的作用。特別地,所述藥物活性化合物可選自抗體、蛋白質、sirna、shrna和pdna。
在根據本發明的另一個實施方案中,所述空心球包括選自pet、spect或mri試劑的成像劑(imagingagent)。通過將空心球的超聲特性與額外的成像部分結合,有助于監視例如聚合物殼的降解途徑或局部藥物遞送。
本發明的特定和優選方面在所附的獨立和從屬權利要求中給出。從屬權利要求的特征可與獨立權利要求以及與其它從屬權利要求的特征適宜地組合,并不僅為權利要求中明確描述的那樣。
本發明的這些和其它方面參考在下文中描述的實施方案將變得顯而易見并且將參考在下文中描述的實施方案進行闡述。
附圖說明
圖1:聚合物的示意性表示
圖2:根據本發明合成的球的活化
具體實施方式
應該進一步指出,在表格和實施例中使用的產品名和供應商名可能涉及商標權,并且不意在以普通方式使用,而僅用于限定由指定供應商供應的具體產品。
本發明將參考以下非限制性實施例、優選實施方式和非限制性圖表進行描述。
根據本發明的方法提供用于生產聲學活性空心球的快速和有效合成途徑。
聲學活性是指這些顆粒可在施加1mhz超聲(高于至多1mpa的閾值)時破裂。
球表示具有球形或近似球形形狀的顆粒或部分,包括但不限于卵形和/或部分壓縮的球。
根據本發明空心是指至少部分地采用氣體填充,或至少部分地采用氣體前體填充。
根據本發明的方法
基于現有技術,聲學活性空心球可通過采用乳化技術生產。乳化依賴于不與水混溶或僅在非常有限的程度上與水混溶的溶劑,例如鹵化溶劑如二氯甲烷。通常,需要添加劑以控制形成的顆粒的尺寸和防止在冷凍干燥期間顆粒聚集。這些方法通常導致尺寸在微米范圍的空心球。
在本發明中,我們改進了合成具有聲學性質的空心球的已知方法以實現快速且方便的制備,特別適于亞微米空心球的制備。以下詳細描述可在本發明合成方法中辨認的步驟。
步驟(a)
在根據本發明方法的步驟(a)中,提供溶液,其包含具有親水性嵌段的第一聚合物(1)、不與水混溶的第二聚合物(2)、疏水性化合物如烷烴或油和水混溶性有機溶劑。
所述聚合物或聚合物的組合用于形成空心球的殼。用于本發明方法的聚合物可包含不同構件(elements),如圖1中示意性顯示的那樣。
本發明方法中使用的聚合物優選包含主要決定剛性(如結晶或玻璃態)殼的機械性質的合成或生物聚合物嵌段。這些嵌段可以是聚合物1和2這兩者的一部分,并且在很大程度上有助于所述球的穩定性。符合這些要求的典型可生物降解聚合物為l或dl形式的聚丙交酯(pla)或其共聚物、聚交酯、聚己內酯、聚氰基丙烯酸酯和上述之一的共聚物、聚乙交酯的共聚物,或它們的任意組合。這個或這些構件形成在中空顆粒的殼形成中占主導地位的聚合物的主鏈并在圖1中由嵌段(a)示意性表示。相對低分子量的聚合物在殼中具有較少纏結,并且因此在施加超聲時更易于導致殼破裂。
可使用具有不同改性情況的聚合物的混合物,在圖1中示出3個實例。根據本發明,所述混合物中存在具有親水性嵌段的聚合物。該優選大體積的(bulky)親水性基團(由嵌段b示意性地表示)將位于由本發明方法形成的球的外側。這種基團的使用穩定了所述球,并促進了直接沉淀。這類基團的一個例子為聚乙二醇。
第二聚合物包括疏水性部分。這種部分的例子為烷基基團或氟化基團。這些基團在圖1中由嵌段c示意性地表示。不期望被任何理論束縛,據信在所述制備方法中,這些基團將朝向膠囊的核一側取向,提供疏水性內部。通過采用這些疏水性嵌段,由于憎水性能,增強了所述空心球在生物環境中的穩定性。
具有親水性嵌段的聚合物和疏水改性的聚合物的組合的使用在根據本發明的方法中是優選的。還可預期使用同時包含親水性基團和疏水性部分的聚合物,如圖1中下格所示。
空心球的核與殼之間的比例由溶液中聚合物與疏水性化合物之間的關系決定。優選地,該比例為2∶1-1∶5w/w,更優選1∶1-1∶4w/w。
優選地,具有親水性嵌段的第一聚合物(1)和不與水混溶的第二聚合物(2)之比在2∶1-1∶12w/w范圍,更優選1∶3-1∶10w/w。本領域技術人員理解,添加具有疏水性或親水性性質的額外聚合物,或添加一種同時具有親水性和疏水性性質的聚合物落在本發明的范圍內。
不同于采用幾乎不與水溶液混合的溶劑生產乳液,我們采用與水完全混合的親水性有機溶劑。根據本發明水混溶性是指在水中在所有濃度的完全混溶性。這類溶劑的例子為丙酮、四氫呋喃、二甲基亞砜、二甲基甲酰胺、乙腈、二醇醚和二甲基乙酰胺。二醇醚包括二甲醚、三甘醇二甲醚和乙二醇二甲醚。由于這些溶劑也是聚合物的良溶劑,所以通過將所述溶液與水混合除去親水性溶劑導致聚合物在疏水性溶劑液滴上的直接沉淀。
所述疏水性化合物被包括以作為成殼聚合物的不良溶劑。這類物質的選擇應使得其能夠采用冷凍干燥除去。因此,待除去的化合物應能夠變為固體,并在冷凍干燥條件下具有適當的蒸氣壓,從而可將其除去。優選地,該疏水性化合物為烷烴或油。環辛烷和環癸烷是適宜的例子,因為它們可采用冷凍干燥完全除去,從而所述球適于進一步處理。
步驟(b)
為制備與水的混合物,優選將所述溶液通過另一種形式的攪動/剪切力攪拌或混合。任選地包括進一步的混合處理。用于獲得這樣的混合物的適宜設備例如選自膠體磨、均化器、超聲破碎器(sonicaters)。任選地,在這種處理前或后將該混合物加壓通過玻璃過濾器。若需要,這種處理可重復多次。不期望被任何理論束縛,據信所述親水性溶劑將立刻與水相混合,從而乳液內相中殼組合物的濃度升高到超過溶解性閾值,和在此時所述殼組合物將立即沉淀。
這種沉淀導致在包含所述疏水性溶劑的乳液內相(液滴)的表面處形成聚合物殼。據信一旦親水性溶劑汽化,就產生殼組合物,其覆蓋包含非溶劑和可能已在所述方法的較早階段添加的任選的其它成分的核。
步驟(c)
在根據本發明方法的步驟(c)中,將親水性溶劑從水相除去,例如在減壓下。另一種除去親水性溶劑的適宜方法為提高溫度,例如將溫度提高至25-35℃的溫度,或簡單地通過攪拌該混合物給定量的時間。
步驟(d)
通過采用具有親水性嵌段的聚合物,不再需要添加穩定劑,導致步驟(d)的樣品可被直接冷凍干燥,無需采用任何純化步驟。通過冷凍干燥,除去了構成所述球的核的疏水性化合物,形成氣體填充的或氣體部分填充的球形顆粒。另外,優選聚合物的該非溶劑升華而非蒸發。所以,優選熔點不遠小于0℃的非溶劑。也可考慮可在冷凍干燥過程中除去的其它非溶劑,其中據信,優選但并不總是絕對必要的是所述非溶劑在冷凍干燥過程中為固體。例如,可使用具有8-14個碳水化合物部分的烷烴或環烷烴。
迄今為止,尚不存在尺寸低于微米范圍,特別是50-400nm的超聲造影劑的有效合成路徑。這已經妨礙了對超聲對中空納米膠囊的影響的理解。對于游離氣泡,如果尺寸降至100或200nm,則共振頻率增加到超過用于成像的范圍。以聚合物為殼的試劑不僅共振,而且由超聲誘導的殼破壞導致的氣體逸出可表現出非常不同的頻率相關性。由于它們的高laplace壓力和發生ostwald熟化現象,以類脂為殼的納米尺寸的試劑并不非常穩定。這導致小球的損失和大球的生長。
應該注意的是,在循環中來自納米球的背景信號的缺失在一些藥物遞送方案中可能是有利的,其中對于檢測,僅經活化的納米球(氣體已經從聚合物殼釋放的那些)是所希望的。
超聲造影劑被研究用于很多新應用如分子成像、藥物遞送及它們的組合。對于這些應用,需要約數小時的長循環時間以在感興趣的區域得到有效的累積,這是用于其它模式的經靶向的造影劑(mri試劑)和藥物遞送載體的情況。增加的循環時間可通過將試劑的尺寸降至遠低于1um實現。根據本發明的方法促進了這些具有低于微米范圍的尺寸,優選50-400nm的穩定空心球的合成。此外,立體親水性嵌段如peg通過降低所述球經res的攝取增加了循環時間。
可制備具有與所述球直接結合的藥物或造影劑的藥物遞送載體。這些藥物或造影劑可結合于殼中,作為藥物承載顆粒如脂質體附著于殼上,或包封于核中(在殼內)。如果藥物結合于核中,則一個優選的選擇是使它們溶解在不能被冷凍干燥的溶劑中。這類溶劑的例子為例如十六烷或類脂類例如甘油三酯如三辛酸甘油酯。將要包含在這樣的體系中的藥物優選為疏水性藥物,紫杉醇是常見的例子。對于親水性藥物,將包含親水性藥物的脂質體附著于外殼上的選擇是最優選的。
另一種可行途徑是使冷凍干燥的納米球再懸浮,然后在小瓶內或通過并置給予技術(連接至相同的靜脈或動脈入口的不同注射泵)與期望的藥物或生物制劑組合。該“鄰近”遞送技術利用血管壁和局部細胞滲透性的提高來聯合給予藥物或生物制劑。
在結合藥物后,納米泡的特定靶向同樣是可行的。這可例如通過生物素抗生蛋白鏈菌素偶合劑促進。可合成生物素化的pla-peo,可向其添加抗生蛋白鏈菌素,然后連接生物素化的抗體或其片段。直接偶合也是可行的,例如采用硫酯。其它靶向試劑是可行的,但不限于抗體片段或化學正交反應對,例如膦和疊氮基團,以促進staudinger連接或反應。
本發明包括通過納米沉淀方法由在非鹵化有機溶劑中的聚合物溶液不添加穩定劑方便地形成氣體填充的球的方法,形成疏水性溶劑填充的以聚合物為殼的膠囊。該方法直接繼之以采用冷凍干燥過程除去疏水性溶劑。
應理解,盡管對于本發明方法和空心球在這里已經討論了優選實施方式、具體混合物和材料,但是在不脫離本發明的范圍和精神的情況下,可實施形式和細節的各種改變、改進或組合。
實施例
合成
將平均分子量為2000-5000的疏水改性的plla(l-聚丙交酯)的丙酮溶液與分子量比為5000∶700的plla和peo的嵌段共聚物或分子量比為1800∶2000的plla和peo(聚氧化乙烯)的嵌段共聚物混合。將環癸烷添加至該溶液中,并將該溶液與水充分混合并施壓通過1μm過濾器。通過在減壓下在旋轉燒瓶中蒸發除去丙酮。添加作為冷凍干燥添加劑的聚乙二醇,并如別處所述實施冷凍干燥。動態光散射測量顯示冷凍干燥后200nm的流體動力學直徑。在離心時觀察到納米泡上浮至管上部,差示掃描量熱法表明已經除去了環癸烷。由于顆粒上浮至上部,這表明它們的密度低于1g/cm3,并且由于聚合物的密度為約1.25g/cm3,所以這表明氣體與所述結構相關聯。
表格顯示了已經制備的許多組合物,包括冷凍干燥前和后通過動態光散射測量的平均泡尺寸,包括多分散指數,所有這些組合物在再懸浮后都顯示出漂浮的顆粒,表明包含氣體:
超聲測量
采用在32周期脈沖長度使用的1.0mhz空穴換能器(panametricesv392)建立聚焦聲場。采用被動聲波檢測器檢查經活化的微膠囊的行為。所述被動檢測器由具有5mhz中心頻率的寬帶聚焦換能器(直徑3.8cm,焦距5.1cm)(panametricsv307)和寬帶低噪聲信號放大器(40db)構成。使用3.0mhz的高通濾波器(ttehb5-3m-65b)和10.7mhz的低通濾波器(minicircuitsblp-10.7),來除去來自空穴換能器的直接傳輸的衍射誘導的1.0mhz聲學信號。使用數字示波器(modellt374l,lecroy,chestnutridge,ny)采用20mhz取樣頻率數字化經放大的散射信號。
使用時間調制器(fourchanneldigitaldelay/pulsegenerator;standfordresearchsystemsdg535)在2.0hz的prf(脈沖重復頻率)同步聲波檢測器與活化超聲脈沖。活化換能器水平安裝在矩形測試室(20.2×20.2×9.6cm3)的側壁上,而聲波檢測器垂直放置,并與空穴換能器成直角共焦排列。由于發射和接收換能器均為聚焦換能器,所以檢測器僅對在所述兩個換能器的小共焦區域內的球非常敏感。采用所述被動技術,微膠囊的活化閾值和活化后振動[=游離(逸出)氣體泡的振動]或活化誘導的破壞可通過辨別收到的聲學信號的波形和通過經由信號譜分析諧波和噪音產生來研究。采用labview通過自動計數收到的被散射的信號,測量對于1.0mhz猝發聲列(toneburst)的每100個聲波作用微膠囊的活化事件計數(或相對活化率)。
對于聲學活化測量,將包含1±0.1mg納米泡的各樣品瓶采用5ml空氣飽和的去離子水復原。將10μl量的該懸浮液注入用空氣飽和的水填充的3.4l槽中,使之靜置整夜,以最小化微小氣泡的存在。在采用1mhz、32周期超聲猝發聲列的聲波作用產生納米泡的聲學活化的同時,根據來自經活化的納米泡的散射信號的3-8mhz之間的高諧波含量,檢測各聲學事件。
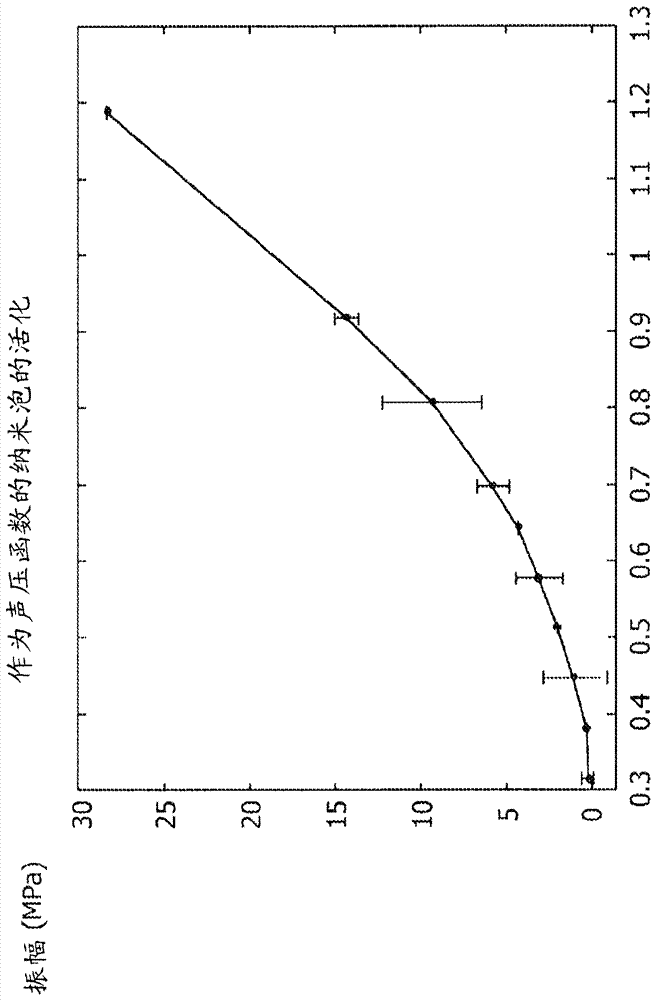
圖2給出了樣品mpeg(2000)pla(1800)/pla-pfo的活化曲線的例子,具有1∶3的聚合物/環癸烷比例,以及1∶9的peg化對疏水改性pla。將聲學事件計數作為在1mhz的以mpa為單位的負聲壓振幅(或機械指數)的函數做圖,其它組合物表現出類似的性質(將在再次測量它們中的一些后添加)。負聲壓振幅是納米泡解體和隨后氣體從破裂的納米泡釋放(所謂“活化”)的直接原因。另外,在具有p4-2探針的hdi-5000超聲掃描器上觀察到這些納米泡的強烈活化(作為當在1.2的mi暴露于超聲脈沖時的明亮閃光)。
體內實驗
常規超聲造影劑的循環時間通常低于30分鐘。為顯示通過本發明方法合成的球的延長的循環,實施以下實驗。形成加載有熒光染料尼羅紅的球,采用環辛烷與十六烷的1∶1混合物形成核,通過冷凍干燥從其除去環辛烷級分。將樣品在鹽水中復原,并將100μl眼球后注入采用異氟烷麻醉的c57bl/6小鼠中。注射后4和7小時,采集血液樣品并殺死動物。取肝、肺、脾、腎和心臟并稱重。添加tritonx100(250μl,在水中3%),然后添加750μl水。將所述器官用超聲破碎器(sonicatorheatsystemsw375細胞粉碎器)粉碎,冷凍干燥并采用異丙醇提取尼羅紅。離心后,測量熒光(激發570nm,檢測630nm,截止590nm)。由這些值和樣品(器官或血液)重量,確定尼羅紅的相對量。
測定4和7小時后的分布,各五只小鼠,顯示主要存在于肝臟和血液中。7小時后肝臟與血液之比更高,表明發生緩慢的肝臟累積,然而,即使在7小時后,在循環中仍然存在顯著部分。
- 還沒有人留言評論。精彩留言會獲得點贊!