用于治療目的的抗體?脲酶綴合物的制作方法
相關申請的交叉引用
本申請要求于2015年1月23日提交的美國臨時申請第62/107,210號的權益。該申請通過引用并入本文。
序列表
即時申請包含已經以ascii格式電子提交的序列表,其全部內容通過引用并入本文。所述ascii副本于2016年1月14日創建,命名為105013-1610_sl.txt,大小為11,000字節。
本公開提供具有治療效用的抗體-脲酶綴合物。更具體地,本公開涉及具有綴合至脲酶的一種或多種抗體的治療性綴合物、組合物、其用途及其制備。
背景技術:
脲酶是催化尿素水解成二氧化碳和氨的酶。具體地,脲酶催化尿素水解產生氨和氨基甲酸酯,隨后通過自發水解使產生的氨基甲酸酯降解以產生另外的氨和碳酸。在這方面,脲酶活性傾向于增加其產生氨(其是具有一般毒性的堿性分子)的局部環境的ph值。
在癌癥治療中使用抗體靶向腫瘤相關抗原的觀念已經有一段時間了(herlyn等人,(1980)cancerresearch40,717)。然而,關于脲酶,有毒成分是通過尿素的酶降解產生的堿性環境,并且使用高親和力抗體片段。
發明概述
本技術涉及抗體-脲酶綴合物。本技術提供包含適于靜脈內注射的藥學上可接受的水溶液和基本上不含脲酶、不含非綴合抗體和/或不含非水性hplc溶劑的抗體-脲酶綴合物的藥物組合物。
在一些方面,綴合物具有每個脲酶部分3個、4個、5個、6個、7個、8個、9個、10個、11個或12個抗體部分的綴合比。在一些方面,綴合物具有每個脲酶部分約6個或更多個抗體部分的綴合比。在一些方面,綴合物具有每個脲酶部分6個、7個、8個、9個、10個、11個或12個抗體部分的綴合比。在一些方面,綴合物具有每個脲酶部分8個、9個、10個、11個或12個抗體部分的綴合比。在一些方面,綴合物具有每個脲酶部分約6個或更多個抗體部分的平均綴合比。在一些方面,綴合物具有每個脲酶部分約8-11個抗體部分的平均綴合比。在一些方面,脲酶是洋刀豆(jackbean)脲酶。
在一些方面,抗體是人源化抗體或非人抗體。在一些方面,抗體的分子量為從約5kda至約200kda。在一些方面,抗體的分子量為從約5kda至約50kda。在一些方面,抗體是單結構域抗體。在一些方面,單結構域抗體具有不超過110個氨基酸殘基、或約90個至130個氨基酸殘基的大小。在一些方面,單結構域抗體的分子量為從約10kda至約50kda。在一些方面,單結構域抗體的分子量為從約12kda至約15kda。在一些方面,抗體對腫瘤細胞的抗原具有特異性。在一些方面,抗體對由非小細胞肺癌表達的腫瘤抗原具有特異性。在某一些方面,抗體對ceacam6具有特異性。
在一些方面,抗體對ceacam6具有高于約1×10-6m的kd值的的結合親和力。在一些方面,綴合物對ceacam6具有不大于約1×10-8m的kd值的結合親和力。在一些方面,綴合物對ceacam6具有不大于約1×10-10m的kd值的結合親和力。在一些方面,綴合物對ceacam6具有不大于約5nm的ic50值的合親和力。在一些方面,ic50值為約3nm至約5nm。在一些方面,ic50值為約3.22nm。在一些方面,綴合物以約10μg/ml至約30μg/ml的ic50值與ceacam6結合。在一些方面,綴合物以約20μg/ml的ic50值與ceacam6結合。
在一些方面,抗體包含含有seqidno:1的氨基酸序列的多肽。在一些方面,抗體包含含有對seqidno:1的氨基酸序列的至少一個修改的多肽。
本技術提供了治療有需要對象中癌癥的方法,其包括向對象施用治療有效量的本文提供的組合物,從而治療對象中的癌癥。
在一些方面,癌癥是非小細胞肺癌、乳腺癌、胰腺癌、卵巢癌、肺癌、結腸癌或其組合中的一種或多種。在一些方面,癌癥是非小細胞肺癌。在一些方面,對象是人。
本技術提供了制備包含基本上不含脲酶的抗體-脲酶綴合物的組合物的方法,該方法包括在具有約6.0-7.0(如約6.5)的ph值的水性緩沖液中組合活化的抗體和脲酶,將ph值調節至8.0-9.0(如約8.3)以形成抗體-脲酶綴合物,并純化抗體-脲酶綴合物,其中該方法不包括色譜純化步驟,諸如常用的蛋白純化色譜法,包括尺寸排阻色譜法(sec)、離子交換色譜法、親和色譜法、固定化金屬親和色譜法、免疫親和色譜法、液固吸附色譜法、疏水相互作用色譜法(hic)、反相色譜法(rpc)和高效液相色譜法等。在一些方面,通過超透析過濾法純化抗體-脲酶綴合物。
在一些方面,抗體-脲酶綴合物具有每個脲酶部分8-11個抗體部分的綴合比。在一些方面,具有約6.5的ph值的緩沖液是乙酸鈉緩沖液。在一些方面,通過包括添加硼酸鈉溶液的方法將ph值調節至約8.3。
本技術提供增加對腫瘤抗原的抗體結合親和力的方法,其包括將多個抗體分子與脲酶分子綴合以形成抗體-脲酶綴合物,其中所述綴合物對腫瘤抗原具有比非綴合抗體高至少約100倍的結合親和力。
在一些方面,抗體是人源化抗體或非人抗體。在一些方面,抗體是單結構域抗體。在一些方面,腫瘤抗原由非小細胞肺癌表達。在一些方面,抗體對ceacam6具有特異性。
本技術還提供了試劑盒,其包含本文提供的組合物和使用該組合物的說明書。
下面進一步描述本公開的這些方面和其它方面。
附圖說明
圖1a-b描述了在癌細胞系中l-dos47的示例性結合和細胞毒性研究。(a)l-dos47與以下五種癌細胞系的直接結合:bxpc-3、capan-1、zr-75-30、ls174t和mda-mb231。結合信號由與20mm尿素一起孵育時產生的氨的量表示。在bxpc-3細胞(●)、capan-1細胞
圖2a-b描述了l-dos47抗體、dos47抗體和afaikl2抗體與bxpc-3細胞的示例性直接和競爭性結合。(a)釕標記的l-dos47抗體、afaikl2抗體和非綴合的dos47與bxpc-3細胞的結合。電化學發光分析提供了l-dos47抗體和afaikl2抗體與bxpc-3細胞結合的直接測量。用afaikl2抗體(▲)觀察到弱結合信號,而由于抗體綴合物上存在多個afaikl2抗體的親合力,l-dos47顯示出更強的結合信號(●)。用陰性對照dos47(◇)沒有觀察到結合。(b)l-dos47-標簽與bxpc-3細胞的結合,與l-dos47抗體、afaikl2抗體或dos47競爭。可以通過測試制品的ic50(導致結合降低50%所需競爭者的量),來比較l-dos47抗體和afaikl2抗體兩者的表觀結合親和力。l-dos47抗體(●)和afaikl2抗體(▲)的ic50分別估計為2μg/ml和20μg/ml(或3.22nm和1.55μm),表明l-dos47的結合親和力約為afaikl2抗體的500倍。用陰性對照dos47(◇)沒有觀察到抑制作用。結果表示代表性實驗的平均值(n=3)。
圖3a-c描述了示例性的ceacam6基因的過表達和敲低。(a)l-dos47與ceacam6轉染的h23細胞的結合。通過facs細胞分選與增加量的選擇抗生素一起富集轉染的細胞系群(▲)。與天然h23細胞(○)和a549細胞(△)相比,結合分布圖表明ceacam6在轉染細胞中的表達水平低于在a549細胞中的水平。(b)在ceacam6轉染的h23細胞上l-dos47的細胞毒性試驗。與bxpc-3細胞(●)、a549細胞(△)和天然h23細胞(○)相比,在h23細胞(▲)中的ceacam6過表達大大提高了其對l-dos47細胞毒性的敏感性。有趣地是,盡管在(a)中觀察到較弱的l-dos47結合,但轉染的h23細胞比a549細胞和bxpc-3細胞兩者對l-dos47細胞毒性都更敏感。(c)l-dos47與具有敲低的ceacam6基因的bxpc-3細胞的結合。在天然(●)bxpc-3細胞和對照(hush-tr3▲)bxpc-3細胞中觀察到良好的結合信號。然而,由于ceacam6基因被shrna(hush#6
圖4描述了具有l-dos47的人結腸癌和肺腺癌的免疫組織化學染色。陽性染色顯示為深色。
圖5描述了afaikl2抗體的氨基酸序列(seqidno:1)。
圖6示例了通過兩步反應合成l-dos47綴合產物。步驟1是使用siab活化抗體,步驟2涉及活化的抗體與脲酶的綴合以形成生物綴合物l-dos47。
圖7描繪了空白制劑、afaikl2、高純度脲酶(hpu)和綴合物l-dos47的示例性尺寸排阻色譜圖。每個成分的二聚體的非常小的峰,出現在各自單體峰的前面。空白制劑含有10mm組氨酸、1%蔗糖、0.2mmedta,ph值6.8。
圖8描繪了空白制劑(a)、l-dos47(b)、摻有2.4%hp脲酶(hpu)的l-dos47(c)、摻有4.8%hp脲酶(hpu)的l-dos47(d)和摻有7.2%hp脲酶(hpu)的l-dos47(e)的示例性離子交換色譜圖。空白制劑含有10mm組氨酸、1%(w/v)蔗糖、0.2mmedta,ph6.8。
圖9描繪了experionsds窗口的示例性快照。圖塊1:泳道2和泳道4的電泳圖疊加。圖塊2:泳道l,分子量(mw)梯;泳道1、2、7和8:使用經過額外iec凈化的活化afaikl2產生的l-dos47;泳道3-6:使用未經過額外iec凈化的afaikl2產生的l-dos47;泳道9和泳道10:hpu。在圖塊1中,x軸上圖塊1中的數字2-14是泳道1的電泳圖的峰數;3*表示內部mw標準的最低分子量標記峰,14*表示內部mw標準的最高mw標記峰。
圖10描繪了l-dos47(圖9的泳道2)的示例性電泳圖,顯示了與0-4個抗體分子連接的脲酶亞基的離散峰。x軸上的數字1-11是峰數;3*表示內部mw標準的最低分子量標記峰,11*表示內部mw標準的最高mw標記峰。
圖11描述了綴合比對l-dos47結合活性的示例性影響。以不同抗體綴合比(從1.8至12)制備l-dos47。測定l-dos47樣品與固定的ceacam6-a分子的直接結合。
圖12描述了afaikl2、脲酶和l-dos47的示例性免疫印跡。左圖:l-dos47、脲酶和afaikl2的凝膠電泳(考馬斯藍染色)。中間圖:用抗afaikl2抗體探測的afaikl2、脲酶和l-dos47(標準負載和5x過載)的蛋白質印跡。右圖:用抗脲酶抗體探測的afaikl2、脲酶和l-dos47(標準負載和5x過載)的蛋白質印跡。插入框:l-dos47的放大。
圖13描繪了afaikl2-cys-fl的胰蛋白酶消化物在420nm處的示例性rp-hplc色譜圖。在相應的hplc峰標出鑒定的綴合肽及其肽質量。
圖14描述了l-dos47與癌細胞系bxpc-3、a549和mcf7的示例性直接結合。結合信號用與20mm尿素一起孵育時產生的氨的量表示。在bxpc-3(·)中觀察到升高的l-dos47結合,而在a549細胞(▲)中觀察到中等結合,并且在mcf7細胞
圖15描繪了在加入20mm尿素時l-dos47誘導的對bxpc-3細胞和a549細胞的細胞毒性的實例。在mcf7細胞
發明詳述
應當理解,本公開不限于所描述的具體方面或具體實施方案,因此當然可以變化。還應當理解,本文使用的術語僅用于描述具體方面或具體實施方案的目的,并不旨在限定,因為本公開的范圍將僅由所附權利要求限定。
僅為了讀者的方便,將本公開的詳細描述被分成各個節,并且可以將在任何節中發現的公開與另一節中的公開相結合。除非另有定義,本文使用的所有技術和科學術語具有與本公開所屬領域的普通技術人員通常理解的相同的含義。
定義
必須指出,如本文和所附權利要求中所使用的,除非上下文另有明確規定,單數形式“一個/一種(a/an)”和“所述(the)”包括復數指示物。因此,例如,提及“化合物”包括多種化合物。
如本文所用,術語“約”用在數字指定(例如溫度、時間、數量、濃度以及包括范圍在內的其它值)之前時表示近似值,其可以變化規定值的(+)或(-)10%、5%或1%。
如本文所用,術語“給藥/施用(admnistration)”可以按一次劑量、連續或間歇地或通過幾個亞劑量在總體上提供單次劑量來起作用。可以在整個治療過程中進行給藥。確定最有效的給藥手段和劑量的方法是本領域技術人員已知的,并且將隨著用于治療的組合物、治療目的、被治療的靶細胞和被治療的對象而變化。可以通過治療醫師所選擇的劑量水平和模式,進行單次給藥或多次給藥。合適的劑量制劑和施用藥劑的方法是本領域已知的。還可以確定給藥途徑,并且確定最有效的給藥途徑的方法是本領域技術人員已知的,并且將隨著用于治療的組合物、治療目的、治療對象的健康狀況或疾病階段以及靶細胞或靶組織而變化。給藥途徑的非限制性實例包括:口服給藥、陰道給藥、鼻腔給藥、注射、局部施用、舌下給藥、肺部給藥和通過栓劑給藥。
如本文所用,術語“親和力”是指受體及其配體之間(例如抗體與其抗原之間)的結合強度。術語“kd”或“解離常數”是指抗體與抗原之間的親和力,即抗體與特定抗原結合的程度如何。術語“ic50”或“半數最大抑制濃度”表示導致測試制品結合降低50%所需競爭者的量。
如本文所用,術語“氨基酸”是指l-氨基酸或d-氨基酸或其混合物,包括天然氨基酸和合成氨基酸等,只要由多肽保留了期望的功能性質即可。當用在肽序列開始時,nh2是指存在于多肽的氨基末端(或n末端)的游離氨基。當用在肽序列的末端時,cooh是指存在于多肽的羧基末端(或c末端)的游離羧基。氨基酸殘基的標準多肽縮寫如下:a(ala或丙氨酸);c(cys或半胱氨酸);d(asp或天冬氨酸);e(glu或谷氨酸);f(phe或苯丙氨酸);g(gly或glycine);h(his或組氨酸);i(iie或異亮氨酸);k(lys或賴氨酸);l(leu或亮氨酸);m(met或甲硫氨酸);n(asn或天冬氨酰);p(pro或脯氨酸);q(gln或谷氨酰胺);r(arg或精氨酸);s(ser或絲氨酸);t(thr或蘇氨酸);v(val或纈氨酸);w(trp或色氨酸);x(xaa或未知或其他);y(tyr或酪氨酸);z(glx/gln/glu或谷氨酸/谷氨酰胺);和dpr(2,3-二氨基丙酸)。在本文中由化學式表示的所有氨基酸殘基序列,具有在氨基末端至羧基末端的常規方向上從左至右的取向。在氨基酸殘基序列的開始或末端的破折號,表示與一個或多個氨基酸殘基的另一序列的肽鍵,或與氨基末端基團(如nh2)或乙酰基或羧基末端基團(如cooh)的共價鍵。
如本文所用,術語“包含(comprising/comprises)”旨在表示組合物和方法包括所列舉的要素,但不排除其它要素。用于定義組合物和方法時,“基本上由…組成”意味著排除對于所述目的的組合具有任何本質意義的其他要素。因此,基本上由本文定義的要素組成的組合物或過程,將不排除不會實質上影響本公開的基本特征和新穎特征的其它材料或步驟。“由…組成”的意思是排除超過微量元素的其他成分和實質性方法步驟。由這些轉換術語中的每一個定義的實施方案在本公開的范圍內。
如本文所用,術語“活性劑”、“藥物”和“藥理學活性劑”在本文中可互換使用,是指當施用于對象時誘導期望的藥理作用的化學材料或化合物,并且旨在包括治療劑,其包括放射性核素、藥物、抗癌劑、毒素等。示例性活性劑是抗體脲酶綴合物。
如本文所用,術語“抗體”是指對抗原具有結合親和力的肽、多肽或蛋白。典型的抗體結構單元包含四聚體。每個四聚體由兩個相同的多肽鏈對組成,每對具有一條“輕”鏈和一條“重”鏈。每條鏈的n末端限定了主要負責抗原識別的約100-110個或更多個氨基酸的可變區。術語“可變輕鏈”(vl)和“可變重鏈”(vh)分別指這些輕鏈和重鏈。抗體以完整的免疫球蛋白或以其片段如f(ab)’2或fab'單體存在,f(ab)’2是fab的二聚體其本身是通過二硫鍵與vh-ch1連接的輕鏈,fab'單體其可以由鉸鏈區二硫鍵的斷裂產生。fab'單體基本上是具有部分鉸鏈區的fab(參見fundamentalimmunology,w.e.paul,ed.,ravenpress,n.y.(1993),關于其他抗體片段的更詳細的描述)。可以通過用例如化學方法或通過利用重組dna方法從頭合成的各種肽酶,消化完整的抗體來產生抗體片段。因此,本文所用的術語“抗體”還包括通過修飾抗體產生的或通過使用重組dna方法從頭合成產生的抗體片段。抗體包括單鏈抗體,其包括單鏈fv(sfv)抗體,其中vh和vl連接在一起(直接或通過肽連接子)以形成連續多肽。
如本文所用,術語“單結構域抗體”(sdab或“vhh”)是指單重鏈可變結構域的抗體類型,并且在一些方面可以在天然缺乏輕鏈的駱駝科(camelid)哺乳動物中發現。在一些方面,單結構域抗體可以衍生自vh區、vhh區或vl區。在一些方面,單結構域抗體是人源的。在一些方面,人單結構域抗體包含wo2006/099747和wo2009/079793以及wo2012/100343中公開的重鏈序列或輕鏈序列,它們的全部內容通過引用并入本文。在一方面,人單結構域抗體包含在wo2012/100343中討論的框架區內具有二硫鍵的重鏈序列或輕鏈序列。
如本文所用,術語“抗體片段”還包括通過結合特異性抗原以形成復合物而像抗體一樣起作用的任何合成或基因工程改造的蛋白。
如本文所用,術語“綴合物”是指共價連接以形成較大構建體的兩個或更多個分子。在一方面,通過直接鍵合連接兩個分子,其中脲酶上的反應性官能團與抗體上的互補反應性官能團結合,例如賴氨酸的氨基官能團與天冬氨酸或谷氨酸的羧基官能團結合。應當理解,這種反應可能需要常規的羧基修飾以使其更具反應性。另一方面,通過連接子部分連接兩個分子。
如本文所用,本文所用的術語“蛋白”、“多肽”或“肽”可互換使用。蛋白具有由其亞基序列表示的一級結構,并且可以具有二級螺旋結構或褶狀結構,以及整體三維結構。雖然“蛋白”通常是指相對較大的多肽(例如含有100個或更多個氨基酸),而“肽”指較小的多肽相同,但所述術語在本文中可互換使用。也就是說,術語“蛋白”可以指較大的多肽以及較小的肽,反之亦然。
如本文所用,術語“靶向部分”是指結合所定義的細胞群或選擇的細胞類型的分子。靶向部分可以結合存在于靶細胞或細胞群體上或內的受體、寡核苷酸、酶底物、抗原決定簇或其它結合位點。示例性靶向部分是抗體。能夠識別表達的抗原的抗體片段和小肽序列,也是考慮的靶向部分。
如本文所用,本文所用的術語“治療(treat/treating/treatment)”包括緩解、減輕或改善疾病或病況或其一種或多種癥狀,預防其他癥狀,改善或預防癥狀的潛在代謝原因,抑制疾病或病況(例如阻止或抑制疾病或病況的發展,減輕疾病或病況,導致疾病或病況消退,減輕由疾病或病況引起的狀況,或抑制疾病或病況的癥狀),并且旨在包括預防。這些術語還包括減輕疾病或病況,例如導致臨床癥狀的消退。術語還包括實現治療益處和/或預防益處。治療益處是指根除或改善正在治療的潛在病癥。此外,通過消除或改善與潛在病癥相關的一種或多種生理學癥狀來實現治療益處,使得在個體中觀察到改善,盡管個體仍然受潛在病癥的折磨。
術語“對象”、“個體”和“患者”在本文中可互換使用,以指代治療的任何目標。本技術還提供了在原位或其正常位置或部位治療腫瘤細胞(例如乳腺腫瘤或前列腺腫瘤的腫瘤細胞)的方法。這些原位腫瘤可以位于各種宿主內或上,例如,人宿主、犬宿主、貓宿主、馬宿主、牛宿主、豬宿主等。任何其中發現腫瘤或腫瘤細胞的宿主都可以被治療并且符合本技術。因此,對象包括脊椎動物,優選哺乳動物,更優選人。
如本文所用,術語“基本上不含”顆粒將完全缺乏顆粒,或者幾乎完全缺乏顆粒而使得其效果將與完全缺乏顆粒相同。換句話說,“基本上不含”某成分或要素的組合物可能仍然實際上含有這樣的物品,只要其沒有可測量的效果即可。除非另有說明,術語“基本上”是指大于約90%、大于約95%、大于約96%、大于約97%、大于約98%或大于約99%。在一些實施方案中,包含抗體-脲酶綴合物的組合物基本上不含非綴合脲酶,意味著組合物含有大于約90%的抗體-脲酶綴合物、大于約95%的抗體-脲酶綴合物、大于約96%的抗體-脲酶綴合物、大于約97%的抗體-脲酶綴合物、大于約98%的抗體-脲酶綴合物或大于約99%的抗體-脲酶綴合物。換句話說,組合物含有小于約0.1%的非綴合脲酶、小于約0.5%的非綴合脲酶、小于約1%的非綴合脲酶、小于約2%的非綴合脲酶、小于約3%的非綴合脲酶、小于約4%非綴合脲酶、小于約5%的非綴合脲酶,或小于約10%的非綴合脲酶。術語“非綴合脲酶”是指不與抗體綴合的脲酶。
如本文所用,術語“脲酶”是指具有天然存在或通過例如重組核酸技術和/或化學合成獲得的尿素酰胺水解酶(e.c.3.5.1.5)的酶活性的酶。脲酶還包括融合蛋白,其包含整個脲酶、其亞基或其片段,和/或具有保留了該多肽的尿素酰胺水解酶活性的氨基酸取代、缺失或添加的脲酶。
如本文所用,術語“dos47”是指純化的脲酶。
抗體-脲酶綴合物
本技術涉及抗體-脲酶綴合物。本技術提供包含適于靜脈內注射的藥學上可接受的水溶液和基本上不含脲酶、不含非綴合抗體和不含非水性hplc溶劑的抗體-脲酶綴合物的藥物組合物。非水性hplc溶劑包括通常用于制備型hplc或hplc純化的有機溶劑,諸如甲醇、乙腈、三氟乙酸等。在一些方面,抗體-脲酶綴合物基本上不含來自磷酸鹽緩沖液的磷酸鹽。在一些方面,將含有10mm磷酸鹽、50mmnacl,ph值7.0的磷酸鹽緩沖液用于sec純化。在一些方面,在制造產生抗體-脲酶綴合物中不進行hplc純化。
在一些方面,綴合物具有每個脲酶部分約3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個或20個抗體部分的綴合比。在一些方面,綴合物具有每個脲酶部分約6個、7個、8個、9個、10個、11個或12個抗體部分的綴合比。在一些方面,綴合物具有每個脲酶部分約8個、9個、10個、11個或12個抗體部分的綴合比。在一些方面,綴合物具有每個脲酶部分約6個或更多個抗體部分的平均綴合比。在一些方面,綴合物具有每個脲酶部分約8個、9個、10個或11個抗體部分的平均綴合比。
在一些方面,連接是共價鍵或直接鍵合,其中脲酶上的反應性官能團與抗體上的互補反應性官能團結合,諸如例如賴氨酸的氨基(nh2)官能團與例如天冬氨酸或谷氨酸的羧基(cooh)官能團或半胱氨酸的巰基(sh)結合。應當理解,這種反應可能需要常規的羧基修飾以使其更具反應性。
反應性官能團可以是相同的,諸如草酸、琥珀酸等,或者可以是正交官能團,諸如氨基(其在綴合后變成nh)和羧基(其在綴合后變成co或coo)。可選地,抗體和/或脲酶可以被衍生化以暴露或附加另外的反應性官能團。衍生化可以涉及連接許多連接子分子中的任何一種,如可從piercechemicalcompany,rockfordill獲得的那些連接子分子。
如本文所用的“連接子”是用于將靶向部分連接到活性劑(諸如將抗體連接到脲酶)的分子。連接子能夠與靶向部分和活性劑都形成共價鍵。合適的連接子是本領域技術人員公知的,包括但不限于:直鏈碳連接子或支鏈碳連接子、雜環碳連接子、或肽連接子。當靶向部分和活性劑分子是多肽時,連接子可以通過其側基與組成氨基酸連接(例如通過二硫鍵連接到半胱氨酸)。在一優選的方面,連接子將連接到末端氨基酸的α碳氨基和羧基。在一些方面,連接是通過具有兩個或更多個官能團的連接子(如羧基或氨基)進行的,以允許其與脲酶和抗體反應。連接子是本領域公知的,并且通常包含1-20個原子,其包括碳、氮、氫、氧、硫等。
可以使用具有與脲酶上基團反應的一個官能團和與抗體反應的另一基團的雙功能連接子,以形成期望的免疫綴合物。可選地,衍生化可以涉及靶向部分的化學處理,例如用高碘酸鹽處理的糖蛋白抗體的糖部分的二醇斷裂,以產生游離醛基。抗體上的游離醛基可以與試劑上的游離胺基團或肼基團反應,以將試劑與其結合。(參見第4,671,958號的美國專利號)。在多肽(如抗體或抗體片段)上產生游離巰基的步驟也是已知的(參見第4,659,839號的美國專利)。
其它連接子分子及其用途包括描述于以下文獻中的那些:例如歐洲專利申請第188,256號;美國專利第4,671,958號、第4,659,839號、第4,414,148號、第4,699,784號、第4,680,338號、第4,569,789號和第4,589,071號,以及borlinghaus等人(1987)(cancerres.47:4071-4075)。
在一些方面,當綴合分子已經達到其靶位點時,在靶位點處或其附近的連接是可切割的,并且脲酶從靶向部分釋放。可以通過酶活性或在靶細胞內或靶標位點附近綴合物經受的條件來促進對連接的切割,以從靶向部分釋放脲酶。在一些方面,可以使用在腫瘤部位存在的條件(例如當暴露于腫瘤相關酶或酸性ph時)下可切割的連接子。
可切割的連接子包括描述于以下文獻中的那些:例如美國專利第4,618,492號、第4,542,225號和第4,625,014號。從這些連接子釋放活性劑的機理,包括例如光不穩定鍵的照射和酸催化的水解。例如美國專利第4,671,958號包括對包含通過患者補體系統的蛋白水解酶在體內的靶位點處切割的連接子的免疫綴合物的描述。在一些方面,合適的連接子是氨基酸殘基或由兩個或更多個氨基酸組成的肽間隔子。
在一些方面,合適的連接子是r1-l-r2,其中r1和r2是相同的官能團或不同的官能團,其中一個與抗體連接,另一個與脲酶連接。r1和r2可以獨立地選自但不限于:-nh-、-co-、-coo-、-o-、-s-、nhnh-、-n=n-、=n-nh-等。l可以是直鏈烴鏈或支鏈烴鏈(如烷基鏈),其中一個或多個碳任選地被氧、氮、酰胺、硫、亞砜、砜、環烷基、雜環烷基、芳基、雜芳基等替代。在一些方面,連接子可以是氨基酸殘基或肽。在一些情況下,連接子可以在靶位點處或接近靶位點處由于酶或改變ph值而被切割。適于制備綴合物的某些連接子和步驟描述于以下文獻:美國專利第4,414,148號、第4,545,985號、第4,569,789號、第4,671,958號、第4,659,839號、第4,680,338號、第4699,784號、第4,894,443號和第6,521,431號。在某些方面,連接子是
其中
在一些方面中,連接子是使用具有下式的連接劑的殘基:
其中x是溴或碘,l是如本文所述的連接子。
在一些方面,交聯劑是sbap(琥珀酰亞胺基3-[溴乙酰氨基]丙酸酯)或sia(n-琥珀酰亞胺基碘乙酸酯),在與siab類似的條件下(例如,不需要hplc色譜法純化和可以僅需要超透析過濾),其可以用于綴合。在一些方面,在siab的連接臂長度
另外,其他成分(如但不限于諸如抗癌劑的治療劑)也可用于與抗體結合以進一步增強治療效果。
脲酶
大量的研究已經提供了關于來自多種進化上不同的細菌、植物、真菌和病毒的脲酶的遺傳學的詳細信息(mobley,h.l.t.等人(1995)microbiol.rev.59:451-480;eurj.biochem.,175,151-165(1988);labigne,a.(1990)internationalpublicationno.wo90/04030;clayton,c.l.等人(1990)nucleicacidres.18,362以及美國專利第6,248,330號和第5,298,399號,其各自通過引用并入本文)。特別令人感興趣的是在植物中發現的脲酶(sirko,a和brodzik,r.(2000)actabiochimpol47(4):1189-95)。一個示例性的植物脲酶是洋刀豆脲酶。可以在公共數據庫(例如,entrez(ncbi.nlm.nih.gov/entrez))中鑒定其他有用的脲酶序列。
在一些方面,脲酶是洋刀豆脲酶。洋刀豆脲酶氨基酸序列具有如下所示的seqidno.2的氨基酸序列:
mklspreveklglhnagylaqkrlargvrlnyteavaliasqimeyardgektvaqlmclgqhllgrrqvlpavphllnavqveatfpdgtklvtvhdpisrengelqealfgsllpvpsldkfaetkednripgeilcedecltlnigrkavilkvtskgdrpiqvgshyhfievnpyltfdrrkaygmrlniaagtavrfepgdcksvtlvsiegnkvirggnaiadgpvnetnleaamhavrskgfgheeekdasegftkedpncpfntfihrkeyankygpttgdkirlgdtnllaeiekdyalygdecvfgggkvirdgmgqscghppaisldtvitnaviidytgiikadigikdgliasigkagnpdimngvfsnmiiganteviageglivtagaidchvhyicpqlvyeaissgittlvgggtgpaagtrattctpsptqmrlmlqstddlplnfgftgkgssskpdelheiikagamglklhedwgstpaaidncltiaehhdiqinihtdtlneagfvehsiaafkgrtihtyhsegaggghapdiikvcgiknvlpsstnptrpltsntidehldmlmvchhldreipedlafahsrirkktiaaedvlndigaisiissdsqamgrvgevisrtwqtadkmkaqtgplkcdssdndnfrirryiakytinpaiangfsqyvgsvevgkladlvmwkpsffgtkpemvikggmvawadigdpnasiptpepvkmrpmygtlgkaggalsiafvskaaldqrvnvlyglnkrveavsnvrkltkldmklndalpeitvdpesytvkadgkllcvseattvplsrnyflf(seqidno.2)
可以在公共數據庫(例如,entrez(http://www.ncbi.nlm.nih.gov/entrez/))中鑒定有用脲酶序列。此外,可以利用用于擴增來自各種生物體的脲酶的引物,其描述于baker,k.m.和collier,j.l.(http://www.science.smith.edu/departments/biology/lkatz/nemeb_webpage/abstracts.html),或使用codehop(共識-簡并雜合寡核苷酸引物),其描述于rose等人(1998)nucl.acidsres.26:1628。脲酶可以將底物尿素轉化成氨和氨基甲酸酯。這種酶活性可以提高ph值,使環境更堿性。癌細胞周圍的環境是典型酸性的(webb,s.d.等人(2001)novartisfoundsymp240:169-81)。因此,通過以這種方式提高細胞外環境的ph值,抑制癌細胞的生長。因此,在本技術的某些方面,添加抗體-脲酶綴合物導致間質液的ph值提高約0.1個ph單位,例如,0.1-0.5個ph單位以上。
本技術的脲酶包括脲酶的天然存在形式及其功能活性變體。預期了兩種一般類型的氨基酸序列變體。氨基酸序列變體是那些在特定氨基酸具有不破壞脲酶活性的一個或多個取代的氨基酸序列變體。這些變體包括沉默變體和與天然蛋白基本上同源且功能上等同的保守修飾的變體。當其氨基酸序列的至少約80%,更優選至少約90%,甚至更優選至少約95%,甚至更優選98%和最優選至少約99%與天然蛋白的氨基酸序列相同時,天然蛋白的變體是與天然蛋白“基本上同源的”。變體可以是僅僅1個或高達10個或更多個氨基酸的不同。
第二類變體包括是分離的脲酶活性片段的脲酶的大小變體。可以通過例如片段化脲酶,通過化學改性,通過蛋白水解酶消化,或通過它們的組合形成大小變體。此外,可以使用基因工程技術以及從氨基酸殘基直接合成多肽的方法來產生大小變體。
所謂“功能等同”是指變體序列限定了產生具有與天然脲酶基本上相同的生物活性的蛋白的鏈。本技術也包括包含大量序列變化的這種功能上等同的變體。因此,天然脲酶蛋白的功能等同變體將具有足夠的生物學活性以用于治療。在本領域中有可用于確定功能等同的方法。可以使用專門設計用于測量天然脲酶蛋白的活性試驗來測量生物活性。此外,可以測試針對生物活性的天然蛋白產生的抗體結合到功能等同變體的能力,其中有效結合指示具有類似于天然蛋白構象的蛋白。
本技術的脲酶蛋白序列(包括保守取代序列),可以作為更大的多肽序列的部分存在,諸如發生在加入用于純化蛋白的一個或多個結構域(例如,聚his片段、flag標簽片段等),其中附加的功能性結構域對蛋白的脲酶蛋白部分的活性有很少的影響或沒有影響,或其中可通過后合成處理步驟(如通過用蛋白酶處理)除去附加的結構域。
添加不改變本技術的核酸分子的編碼活性的一個或多個核酸或序列(如添加非功能性序列)是基本核酸分子的保守變化,而添加不改變本技術的多肽活性的一個或多個氨基酸殘基是基本多肽的保守變化。這兩種類型的添加都是本技術的特點。本領域的普通技術人員將認識到,公開的核酸構建體的許多保守變化產生功能相同構建體。
可以使用各種測定序列關系的方法,包括手工比對和計算機輔助序列比對和分析。這后一種方法是本技術的優選方法,由于通過計算機輔助方法提供了增加的吞吐量。各種用于進行序列比對的計算機程序是可用的,或可以通過技術人員來制備。
如上所述,本技術中使用的核酸序列和多肽序列(及其片段)不需要與本技術的脲酶多肽或脲酶核酸分子(或其片段)或相關分子的相應序列是相同的,但可以是基本上相同的(或基本上類似)。例如,所述多肽可以經歷各種變化,諸如一個或多個氨基酸或核酸的插入、缺失和取代,無論保守或非保守的,包括其中例如,這樣的變化可能在其用途(例如,在其治療應用或給藥應用)中提供一定的優勢。
靶向部分
預期了將靶向部分作為本技術的化學實體,并且與確定的、選擇的細胞類型或靶細胞群(如癌細胞)結合。在這方面有用的靶向部分包括抗體和抗體片段、肽和激素。對應于已知細胞表面受體的蛋白(包括低密度脂蛋白、轉鐵蛋白和胰島素)、纖維蛋白溶解酶、血小板結合蛋白(如膜聯蛋白)和生物反應調節劑(包括白細胞介素、干擾素、促紅細胞生成素和集落刺激因子)也是預期的靶向部分。可以將與靶細胞核酸的一部分互補的寡核苷酸(例如,反義寡核苷酸)用作本技術的靶向部分。靶向部分也可以是與靶細胞表面結合的寡核苷酸。保留與確定的靶細胞群結合的能力的上面列出的靶向部分的類似物,也可以用作靶向部分。
前述的靶向部分的功能等同物也可以用作本技術的靶向部分。示例性靶向部分功能等同物是設計以模仿用于靶向部分靶細胞結合的適當構象和/或取向的有機化學構建體。另一靶向部分功能等同物是展現靶向部分的結合親和力的短多肽。
在一些方面,本公開的靶向部分是抗體、肽、寡核苷酸等,其與靶細胞表面上的抗原反應。可以使用商購或在文獻中描述的多克隆抗體和單克隆抗體。抗體可以是完整抗體或其片段。可以根據常規技術(如雜交瘤合成、重組dna技術和蛋白合成)制備單克隆抗體和片段。有用的單克隆抗體和片段可以來自任何物種(包括人)或可以形成為采用來自多于一種物種的序列的嵌合蛋白。
在一些方面中,靶向部分是人源化抗體或非人抗體。在一些方面中,靶向部分是單結構域抗體。在一些方面,單結構域抗體(sdab)或“vhh”是指能夠在駱駝科哺乳動物中發現的抗體類型的單重鏈可變區結構域,所述抗體類型天然沒有輕鏈。在一些方面,單結構域抗體可以來源于vh區、vhh區或vl區。在一些方面,單結構域抗體是源自人類的。在一些方面中,人單結構域抗體包含重鏈序列或輕鏈序列,其公開在wo2006/099747和wo2009/079793以及wo2012/100343中,通過引用將其全部并入本文。在一方面,人單結構域抗體包含具有如在wo2012/100343中所討論的框架區內的二硫鍵的重鏈序列或輕鏈序列。
在一些方面,靶向部分(例如抗體)對由癌、白血病、淋巴瘤和肉瘤表達的腫瘤抗原具有特異性。癌可能是肛門癌、膽道癌、膀胱癌、乳腺癌、結腸癌、直腸癌、肺癌、口咽癌、下咽部癌、食道癌、胃癌、胰腺癌、肝癌、腎癌、膽囊癌和膽管癌、小腸癌、尿道癌、卵巢癌、結腸癌、非小細胞肺癌、生殖道癌、內分泌腺癌、甲狀腺癌和皮膚癌。在一些方面,靶向部分(例如抗體)對由如下腫瘤表達的腫瘤抗原具有特異性:類癌瘤、胃腸道間質瘤、頭頸部腫瘤、原發性腫瘤、血管瘤、黑素瘤、惡性間皮瘤、多發性骨髓瘤和腦腫瘤、神經腫瘤、眼腫瘤和腦膜腫瘤。在一些方面,靶向部分(例如抗體)對由癌、乳腺癌、胰腺癌、卵巢癌、肺癌和結腸癌表達的腫瘤抗原具有特異性。在一些方面,靶向部分(例如抗體)對由非小細胞肺癌表達的腫瘤抗原具有特異性。
在一些方面,抗體對由非小細胞肺癌表達的腫瘤抗原具有特異性。在一些方面,由非小細胞肺癌表達的腫瘤抗原是ceacam6(癌胚抗原相關細胞粘附分子6),并且抗體對ceacam6具有特異性。ceacam6,也被稱為非特異性交叉反應抗原(nca)或cd66c,是被充分表征的癌癥抗原(11,12)。它與其他人癌胚抗原(如ceacam1、ceacam7和ceacam8)具有高的序列同源性。它是糖基磷酸肌醇(gpi)-連接的細胞表面蛋白,但是沒有已知的細胞質結構域。在乳腺癌組織、胰腺癌組織、卵巢癌組織、肺癌組織和結腸癌組織中,ceacam6的表達是顯著升高的。其增加的表達涉及腫瘤細胞的侵襲性行為和轉移行為(13)。在一些方面,抗體對ceacam6具有高于約1×10-6m的kd值的結合親和力。在一些方面,綴合物對ceacam6具有不大于約1×10-8m、1×10-9m、1×10-10m或1×10-20m的kd值的結合親和力。在一些方面,抗體是識別肺腺癌細胞上的ceacam6的單結構域駱駝科抗體片段(afaikl2,seqidno.1)。在一些方面,抗體包含含有如圖5所示的seqidno:1的氨基酸序列的多肽。在一些方面,抗體包含含有對seqidno:1的氨基酸序列至少一個修改的多肽。在一些方面,抗體包含含有與seqidno:1的氨基酸序列具有至少80%、85%、90%、95%、98%和99%的序列同源性的多肽。
在一些方面,ceacam6抗體是抗-ceacam6抗體(9a6):購自santacruzbiotech的sc-59899。ceacam6抗體(9a6)是以200μg/ml提供的小鼠單克隆igg1,其是針對人源的ceacam6表達腫瘤細胞系產生的。推薦用于檢測人源的ceacam6。
在一些方面,ceacam6抗體是購自abcam的抗-ceacam6抗體(ab56234)。抗-ceacam6抗體(ab56234)是ceacam6的兔多克隆抗體。它是針對對應于人ceacam6的內部序列217-266位氨基酸的合成肽(iqnpasanrsdpvtlnvlygpdgptispskanyrpgenlnlschaasnpp(seqidno:3))中的區域產生的。
在一些方面,ceacam6抗體是購自novusbiologicals的抗-ceacam-6/cd66c的抗體,其是針對ceacam6的兔多克隆抗體,并且經過蛋白質印跡和免疫組織化學-p來驗證。它是針對指向人ceacam6(np_002474)的中間區域的合成肽(eiqnpasanrsd(seqidno:4))產生的。
在一些方面,ceacam6抗體是購自origene的抗-ceacam6抗體epr4403,其是針對ceacam6(克隆epr4403)的兔單克隆抗體。它是針對對應于人ceacam6中的殘基的合成肽產生的。它對小鼠ceacam6、大鼠ceacam6和人ceacam6具有反應性。
在一些方面,綴合物對ceacam6具有不大于約10nm的ic50值的結合親和力。在一些方面,綴合物對ceacam6具有不大于約5nm的ic50值的結合親和力。在一些方面,綴合物對ceacam6具有不大于約4nm的ic50值的結合親和力。在一些方面,ic50值約為3.22nm。在一些方面,綴合物以約10-30μg/ml的ic50值與ceacam6結合。在一些方面,綴合物以約20μg/ml的ic50值與ceacam6結合。可以根據本文所述的方法或本領域已知的方法,測定抗體或綴合物與靶抗原的結合親和力。在一些方面,本技術描述了該抗-ceacam6-脲酶綴合物(l-dos47)。在一些方面,本技術描述了抗體-脲酶綴合物,例如,afaikl2-脲酶。通過針對非小細胞肺腺癌a549進行淘選,將來源于美洲駝重鏈抗體所有組成成分的噬菌體庫,用于確定單結構域抗體(sdab)。將sdab指定為afai。為了綴合的目的優化了afai的基因序列,并重命名為afaikl2。在一些方面,在大腸桿菌(e.coli)bl21(de3)pt7-7系統中克隆和表達afaikl2抗體。
人源化靶向部分能夠降低宿主受體中抗體或多肽的免疫反應性,以允許增加半衰期和減少不良免疫反應。可以通過例如將編碼小鼠fv區的核苷酸序列或其互補決定區與編碼人恒定結構域區和fc區的核苷酸序列進行遺傳重組,將小鼠單克隆抗體人源化。也可以將小鼠殘基保留在人可變區框架結構域內以確保適當的靶位點結合特性。用于將各種活性劑遞送至癌細胞的基因工程抗體綜述于bodey,b.(2001)expertopinbiol.ther.1(4):603-17。
在一些方面,靶向部分是與靶細胞表面上的受體反應的配體。因此,靶向部分可以包括但不限于:對細胞結合成分具有親和力的激素,包含被細胞結合成分識別的碳水化合物部分的任何分子,以及與細胞結合成分結合的藥物或小分子。短語“結合成分”包括受體和受體分子。優選地,結合成分是細胞表面結合成分。在一方面,靶向部分是與靶位點結合的天然存在的蛋白(如胰島素)。包括白細胞介素和諸如粒細胞/巨噬細胞集落刺激因子(gm-csf)和腫瘤壞死因子(tnf)的因子的細胞因子,也是已知的與表達其高水平受體的特異性細胞結合的特異性靶向部分(terlikowski,sj(2002)toxicology174(3):143-152)。
為了降低暴露于非靶細胞或非靶組織的脲酶或其它活性劑,可以篩選靶向部分以鑒定顯示最小非靶反應性的那些靶向部分,同時保持靶特異性和反應性。通過減少非靶暴露(和不利的非靶定位和/或毒性),可以施用增加劑量的脲酶或其它活性劑。這允許施用最高可能濃度的脲酶或其它治療劑以最大限度地暴露靶細胞,同時保持低于不可接受的非靶細胞毒性的閾值。
在一些方面,使用兩種或更多種活性劑-靶向部分綴合物,其中每種綴合物包括不同的靶向部分,例如不同的抗體種類。每種所用的靶向部分結合到可以與相同或不同靶位點相關聯的不同靶位點區域。每種施用的綴合物的活性劑成分可以相同或不同。參見例如美國專利第4,867,962號和第5,976,535號,其各自通過引用并入本文。在一些方面,由于每種靶向部分(例如抗體種類)識別不同的靶位點區域(即表位),因此改善了活性劑綴合到靶位點的靶位點的增加。這種可選的靶位點區域方法為活性劑提供了更多潛在的靶位點結合點。因此,例如通過表位飽和和/或空間位阻可以避免實際或有效的靶位點飽和。因此,可以實現活性劑(例如脲酶)的遞增積累。可選地,或聯合地,可以使用另外的脲酶特異性基因產物作為活性劑,例如用于在靶位點生產催化活性全酶。示例性的脲酶脫輔酶包括由細菌ureabc基因編碼的γ亞基、β亞基和α亞基(burne,r.a.和chen,y.m.(2000)microbesandinfection2:533-542)。
可以分析針對特定靶位點的單克隆抗體的交叉反應性模式,以鑒定用于治療應用的具有非重疊交叉反應性的一組兩種或更多種靶特異性單克隆抗體。短語“交叉反應性的非重疊模式”,表示由一種抗體種類結合的非靶組織與由另一抗體種類結合的非靶組織顯著不同。交叉反應性的模式對于成比例地減少用于治療應用的活性劑的暴露所需的程度是不同的。優選較少的抗體對(或更大的一組抗體)重疊。
可以通過多種方法篩選抗體。可以使用免疫組織化學分析來確定與靶組織的反應性和與非靶組織的交叉反應性。可以通過將組織暴露于抗體來鑒定抗體種類要結合的組織;洗滌組織以除去任何未結合的抗體;并檢測結合的抗體的存在。體外組織化學方法是本領域已知的。參見例如sanchez-islas,e.和leon-olea,m.(2001)nitricoxide5(4):302-16。
當靶向部分相對較短時,可以使用標準化學肽合成技術合成。對于多肽化學合成方法的一方面,預期了其中將序列的c末端氨基酸連接到不溶性支持體上并隨后順序添加序列中的剩余氨基酸的固相合成。固相合成技術描述于barany和merrifield,solid-phasepeptidesynthesis;pp.3-284inthepeptides:analysis,synthesis,biology.vol.2:specialmethodsinpeptidesynthesis,parta.,merrifield等人,j.am.chem.soc.,85:2149-2156(1963)和stewart等人,solidphasepeptidesynthesis,第2版。piercechem.co.,rockford,iii.(1984)。
可以通過任何合適的方法制備編碼抗體或脲酶的dna,包括例如克隆和限制合適的序列或通過如下方法的直接化學合成:諸如narang等人(1979)meth.enzymol.68:90-99的磷酸三酯法;brown等人meth.enzymol.68:109-151的磷酸二酯法;beaucage等人(1981)tetra.lett.,22:1859-1862的二乙基亞磷酰胺法(1981)和美國專利第4,458,066號的固體支持法。
化學合成產生單鏈寡核苷酸。這可以通過與互補序列雜交或通過使用單鏈作為模板與dna聚合酶聚合而轉化成雙鏈dna。本領域技術人員將認識到,雖然dna的化學合成限于約100個堿基的序列,但是通過連接較短的序列可以獲得更長的序列。
可選地,可以克隆子序列,并使用合適的限制酶切割適當的子序列。然后可以將片段連接以產生期望的dna序列。
制備抗體-脲酶綴合物的方法
本技術提供了制備包含抗體-脲酶綴合物且基本上不含非綴合脲酶(如基于抗體-脲酶綴合物重量不超過約5%、4%、3%、2%或1%的脲酶)的組合物的方法,該方法包括:(1)在溶劑中組合活化的抗體和脲酶,且在所述溶劑中活化抗體和脲酶基本上不反應(如不超過每小時10%、5%或1%的反應)形成反應混合物,其中活性抗體和脲酶在溶劑中的分布是均勻的,和(2)改變(1)的混合物的性質,使得活化的抗體容易與脲酶反應形成抗體-脲酶綴合物。在一些方面,(1)的混合物的性質是ph值。在一些方面,改變(1)混合物的性質包括將ph值增加到活化抗體容易與脲酶反應以形成抗體-脲酶綴合物的值。在一些方面,在(2)中活化的抗體容易(例如至少90%或至少95%的活化抗體)與脲酶以如下速度反應:在改變混合物的性質約6小時、約5小時、約4小時、約3小時、約2小時或約1小時后,混合物基本上不含非綴合脲酶。
在一些方面,所述方法包括在具有約6.0-7.0(如約6.5)的ph值的酸性水性緩沖液中組合活化的抗體和脲酶,將ph值調節至約8.0-9.0(如約8.3)的堿性ph值以形成抗體-脲酶綴合物,并通過超透析過濾法純化抗體-脲酶綴合物,其中該方法不包括色譜純化步驟。在一些方面,所述水性緩沖液具有約5-8的ph值。在一些方面,將活化的抗體和脲酶在酸性水性緩沖液中組合。在一些方面,活化的抗體和脲酶的比率為從約3至約12。在一些方面,抗體-脲酶綴合物具有每個脲酶部分6-15個抗體部分的綴合比。在一些方面,抗體-脲酶綴合物具有每個脲酶部分8-11個抗體部分的綴合比。在一些方面,ph調節劑是緩沖劑或緩沖溶液。在一些方面,ph調節劑包含以下的一種或多種:鹽酸、硫酸、硝酸、硼酸、碳酸、重碳酸、葡糖酸、氫氧化鈉、氫氧化鉀、氨水、檸檬酸、單乙醇胺、乳酸、乙酸、琥珀酸、富馬酸、馬來酸、磷酸、甲磺酸、蘋果酸、丙酸、三氟乙酸、其鹽或其組合。在一些方面,緩沖劑包含以下的一種或多種:甘氨酸、乙酸、檸檬酸、硼酸、鄰苯二甲酸、磷酸、琥珀酸、乳酸、酒石酸、碳酸、鹽酸、氫氧化鈉、其鹽或其組合。在一些方面,緩沖溶液包括以下的一種或多種:甘氨酸鹽酸鹽緩沖液、乙酸鹽緩沖液、檸檬酸鹽緩沖液、乳酸鹽緩沖液、磷酸鹽緩沖液、檸檬酸-磷酸鹽緩沖液、磷酸鹽-乙酸鹽-硼酸鹽緩沖液、鄰苯二甲酸鹽緩沖液或其組合。在一些方面,緩沖液不是磷酸鹽緩沖液。在一些方面,酸性緩沖液是乙酸鈉緩沖液。在一些方面,通過包括加入水性堿溶液如硼酸鈉溶液(例如0.1-5m,或1m)的方法,將ph值調節至堿性ph值。不希望受理論的束縛,乙酸鈉緩沖液具有低的緩沖能力,適用于通過ph8.5,1m硼酸鹽緩沖液,將ph值調節至8.3。在一些方面,使用tris-hcl緩沖液(例如1mtris-hcl)將混合物調節至ph值8-9(例如8.3)。
在一些方面,將反應時間和抗體/脲酶比保持為常數。在一些方面,反應混合物中抗體/脲酶的摩爾比為:約25、或約21、或約1.8-12的抗體/脲酶。在一些方面,將抗體/脲酶摩爾比從4調整到25。在一些方面,抗體/脲酶摩爾比至少為6。
在一些方面,在純化(如超透析過濾)之后,混合物中存在不超過1%或2%的未反應的抗體。在一些方面,可以使用其它非hplc純化方法。例如,可以將乙醇結晶/分級分離用于具有較低產率的純化。在一些方面,抗體的分子量不超過50kda,諸如約10-20kda或約13kda,并且所述純化為超透析過濾。在一些方面,所述方法提供抗體-脲酶綴合物,其產率為總蛋白重量的至少約60%,總蛋白重量的約70%,總蛋白重量的約80%,或總蛋白重量的至少90%。總蛋白是指脲酶和afaikl2抗體的組合量(重量)。在一些方面,在純化前,不超過10%-20%(占總蛋白重量)的非綴合抗體殘留在反應混合物中。
本技術提供了包含在酸性水性溶劑(如上所述)中的活化的抗體和脲酶且基本上不含(如基于脲酶重量不超過約5%、4%、3%、2%或1%的抗體-脲酶綴合物)抗體-脲酶綴合物的穩定組合物。本技術還提供了包含在水性溶劑中的抗體-脲酶綴合物且基本上不含(如基于抗體-脲酶綴合物重量不超過約5%、4%、3%、2%或1%的脲酶)非綴合脲酶的組合物,其中所述水性溶劑具有約8-9如8.3(如上所述)的ph值。在一些方面,包含抗體-脲酶綴合物的組合物還包含占總抗體(活化的抗體和未反應的抗體)的不超過約40%至60%的非綴合抗體。在一些方面,包含抗體-脲酶綴合物的組合物還包含占總蛋白的不超過約10%至20%的非綴合抗體。
由于脲酶導致體內氨的釋放,氨具有一般毒性并且本身不能靶向腫瘤,所以非綴合脲酶的存在增加了脲酶在正常組織中的存在并對正常組織產生毒性的風險。然而,由于脲酶的大小和其他性質,抗體與脲酶的綴合不會導致足夠的大小或其他差異,從而允許通過色譜純化方法將抗體-脲酶綴合物從非綴合的脲酶中容易地分離出來,特別是以大規模方式。
本技術令人驚奇地提供脲酶與抗體的基本完全綴合,使得不進行任何色譜純化所得產物基本上不含非綴合的脲酶。通過基本上不含脲酶,通過全身給藥,本文所述的組合物將組合物中基本上所有脲酶部分遞送至靶位點。將脲酶靶向遞送至靶位點減少或消除了由脲酶產生的氨的一般毒性,并減少需要施用的脲酶的量以產生治療效果。本技術特別適用于大規模制備(如至少約1g、10g、100g或1kg)用于臨床用途,特別是用于治療轉移性腫瘤(其通過局部施用脲酶難于或無法實施治療)的基本上不含用脲酶的抗體-脲酶綴合物。
本技術還提供了增加對腫瘤抗原的抗體結合親和力的方法,其包括將多個抗體分子與脲酶分子綴合以形成抗體-脲酶綴合物,其中所述綴合物具有比非綴合的抗體高至少約100倍(如約200倍、約300倍、約400倍和約500倍)的與腫瘤抗原的結合親和力。在一些方面,競爭性結合試驗顯示,由于增加的親合力,抗體-脲酶綴合物的結合親和力比天然單結構域抗體的結和親和力強約100倍、約200倍、約300倍、約400倍和約500倍。在一些方面,綴合物具有每個脲酶部分3個、4個、5個、6個、7個、8個、9個、10個、11個或12個抗體部分的綴合比。在一些方面,綴合物具有每個脲酶部分約6個或更多個抗體部分的綴合比。在一些方面,綴合物具有每個脲酶部分6個、7個、8個、9個、10個、11個或12個抗體部分的綴合比。在一些方面,綴合物具有每個脲酶部分8個、9個、10個或11個抗體部分的綴合比。在一些方面,綴合物具有每個脲酶部分約8個、9個、10個或11個抗體部分的平均綴合比。在一些方面,脲酶是洋刀豆脲酶。在一些方面,抗體是人源化抗體或非人抗體。在一些方面,抗體是單結構域抗體。在一些方面,腫瘤抗原由非小細胞肺癌表達。在一些方面,抗體對ceacam6具有特異性。在一些方面,抗體對ceacam6具有高于約1×10-6m的kd值的結合親和力。在一些方面,綴合物以不大于約1×10-8m的kd值與ceacam6結合。在一些方面,綴合物以不大于約1×10-10m的kd值與ceacam6結合。在一些方面,綴合物以不大于約5nm的ic50值與ceacam6結合。在一些方面,ic50值為約3.22nm。在一些方面,綴合物以約20μg/ml的ic50值與ceacam6結合。也稱為非特異性交叉反應抗原(nca)或cd66c的ceacam6,是被充分表征的癌癥抗原。它與其他人癌胚抗原(如ceacam1、ceacam7和ceacam8)具有高的序列同源性。它是糖基磷酸肌醇(gpi)連接的細胞表面蛋白,但沒有已知的細胞質結構域。在乳腺癌組織、胰腺癌組織、卵巢癌組織、肺癌組織和結腸癌組織中,ceacam6的表達是顯著升高的。
組合物制劑
本技術的組合物包含基本上不含脲酶且任選地不含非水性hplc溶劑的抗體-脲酶綴合物。在一些方面,組合物是藥學上可接受的組合物。組合物還可以包含生物相容的藥物載體、佐劑或媒介物。在一些方面,組合物為固體形式。在一些方面,組合物是包含約0.1-10mg/ml、約0.5-5mg/ml、約1-5mg/ml、或約1.5-2.0mg/ml綴合物的水溶液。在一些方面,水溶液還包含賦形劑,諸如組氨酸、蔗糖和edta中的一種或多種。在一些方面,水溶液包含約1-20mm(如10mm)組氨酸,約0.1-5w/v%(如1w/v%)蔗糖、約0.1-0.5mm(如0.2mmedta)。在一些方面,水溶液具有約6.5-7(如約6.8)的ph值。在一些方面,水溶液不含有磷酸鹽。在一些方面,組合物是通過水溶液的凍干獲得的固體形式。在一些方面,固體形式不含磷酸鹽。
組合物還可以包括與賦形劑或其它藥學上可接受的載體混合的其它核苷酸序列、多肽、藥物或激素。除藥物組合物以外的組合物,任選地包含液體,即水或基于水的液體。
要添加到藥物組合物中的藥學上可接受的賦形劑,也是本領域技術人員熟知且易于獲得的那些。賦形劑的選擇將部分地由用于施用產品的具體方法來確定。因此,存在用于本技術背景下的各種合適的制劑。
用于藥物組合物的制劑和給藥的技術,可參見remington'spharmaceuticalsciences,第19版,williams&wilkins,1995,并且是本領域技術人員所熟知的。賦形劑的選擇將部分地由根據本技術用于施用產品的具體方法來確定。因此,存在用于本技術背景下的各種合適的制劑。以下方法和賦形劑僅僅是示例性的,絕不是限制性的。
可以使用任何常規方法(例如混合、溶解、成粒、研磨、乳化、包封、包埋、熔融紡絲、噴霧干燥或凍干過程)制造本技術的藥物組合物。然而,根據給藥途徑和所需劑量,本領域技術人員將確定最佳藥物制劑。這種制劑可影響施用藥劑的物理狀態、穩定性、體內釋放速率和體內清除速率。
將藥物組合物配制成含有合適的藥學上可接受的載體,并且可以任選地包含促進將活性化合物加工成藥學上可使用的制劑的賦形劑和助劑。給藥形式通常將決定載體的性質。例如,用于腸胃外給藥的制劑可以包含水溶性形式的活性化合物水溶液。適合腸胃外給藥的載體可以選自鹽水、緩沖鹽水、葡萄糖、水和其他生理上相容的溶液。用于胃腸外給藥的優選載體是生理上相容的緩沖液,諸如hank溶液、ringer溶液或生理緩沖鹽水。對于組織給藥或細胞給藥,在制劑中使用適合于要透過的特定屏障的滲透劑。這種滲透劑在本領域中通常是已知的。對于包含蛋白的制劑,制劑可以包括穩定材料,諸如多元醇(例如蔗糖)和/或表面活性劑(例如非離子表面活性劑)等。
可選地,用于腸胃外使用的制劑可以包含作為合適的油性注射懸浮液制備的活性化合物的懸浮液。合適的親脂性溶劑或媒介物包括脂肪油(如芝麻油)和合成脂肪酸酯(如油酸乙酯或甘油三酯)或脂質體。含水注射懸浮液可含有增加懸浮液粘度的物質,如羧甲基纖維素鈉、山梨糖醇或葡聚糖。任選地,懸浮液還可含有合適的穩定劑或增加化合物溶解度的試劑以允許制備高度濃縮的溶液。還可以使用乳化劑(例如水包油分散體和油包水分散體),任選地通過乳化劑或分散劑(表面活性材料;表面活性劑)來穩定。如上所述的含有活性劑的脂質體也可以用于腸胃外給藥。
可選地,可以使用本領域熟知的藥學上可接受的載體配制包含適于口服給藥劑量的試劑的藥物組合物。配制用于口服給藥的制劑可以是片劑、丸劑、膠囊、扁囊劑、錠劑、液體、凝膠、糖漿、漿液、懸浮液或粉劑的形式。為了說明,可以通過將活性化合物與固體賦形劑組合獲得口服用的藥物制劑,任選地研磨所得混合物,并且如果需要加入合適的助劑之后,加工顆粒混合物以獲得片劑。口服制劑可以使用類似于腸胃外使用的所述的那些類型的液體載體,例如緩沖水溶液、懸浮液等。
這些制劑可以含有一種或多種賦形劑,其包括但不限于:a)稀釋劑,如糖,包括乳糖、葡萄糖、蔗糖、甘露醇或山梨醇;b)粘合劑,如硅酸鋁鎂和來自玉米、小麥、水稻、馬鈴薯的淀粉等;c)纖維素材料(如甲基纖維素、羥丙基甲基纖維素和羧甲基纖維素鈉)、聚乙烯吡咯烷酮、樹膠(如阿拉伯樹膠和黃蓍膠)和蛋白(如明膠和膠原蛋白);d)崩解劑或增溶劑,如交聯聚乙烯吡咯烷酮、淀粉、瓊脂、海藻酸或其鹽(如海藻酸鈉);或泡騰組合物;e)潤滑劑,如二氧化硅、滑石粉、硬脂酸或其鎂鹽或鈣鹽,以及聚乙二醇;f)香味劑和甜味劑;g)著色劑或色素,例如用于鑒定產品或表征活性劑的量(劑量);和h)其他成分,如防腐劑、穩定劑、溶脹劑、乳化劑、溶液促進劑,用于調節滲透壓的鹽和緩沖劑。
所述藥物組合物可以作為活性劑的鹽來提供,該鹽可以由許多酸形成,包括但不限于:鹽酸、硫酸、乙酸、乳酸、酒石酸、蘋果酸、琥珀酸等。鹽傾向于更易溶于水性溶劑或其它質子溶劑,它們是相應的游離堿形式。
綴合物本身的特性和綴合物制劑,可以影響所施用的綴合物的物理狀態、穩定性、體內釋放速率和體內清除速率。通過臨床前的體外和體內研究,可以收集這些藥代動力學信息和藥效學信息,稍后可以在臨床試驗過程中在人體中證實這些信息。可以從許多來源獲得基于體內動物數據來進行人類臨床試驗的指導,包括例如http://www.clinicaltrials.gov。因此,對于本技術方法中使用的任何化合物,可以首先從生物化學測定和/或基于細胞的測定來估計哺乳動物(特別是人)中的治療有效劑量。然后,可以在動物模型中配制劑量,以實現能調節綴合物活性的期望的循環濃度范圍。隨著人類研究的進行,有關各種疾病和病況的合適劑量水平和治療時間的進一步信息將會出現。
可以通過在細胞培養物或實驗動物中的標準藥物程序,來確定所述綴合物的毒性和治療功效,例如用于確定ld50(50%群體的致死劑量)和ed50(50%群體的治療有效的劑量)。
其他活性劑
在本技術的組合物中也可以包括其他活性劑。可以在細胞與第一活性劑接觸之前、同時或之后,在組合物中利用其他活性劑如抗腫瘤劑(針對增殖細胞的活性劑)。例如,在脲酶已經靶向腫瘤細胞之后,其可以具有調節或調控腫瘤外部環境的能力,例如通過ph值變化。有利于堿性環境的活性劑(如抗腫瘤劑)則更為有效。
在某些方面,預期了將能夠通過脲酶酶促處理的底物用作活性劑。在一些方面,活性劑是脲酶可以用來形成銨離子的底物(例如尿素)。
示例性的抗腫瘤劑包括細胞因子和其它部分,如白細胞介素(例如il-2、il-4、il-6、il-12等)、轉化生長因子-β、淋巴毒素、腫瘤壞死因子、干擾素(例如γ-干擾素)、集落刺激因子(例如gm-csf、m-csf等)、血管通透性因子、凝集素炎癥反應啟動子(選擇素)(如l-選擇素、e-選擇素、p-選擇素)和蛋白質部分(如c1q受體蛋白和nk受體蛋白)。其他合適的抗腫瘤劑包括,抑制血管生成并因此抑制轉移的化合物。這些試劑的實例包括:魚精蛋白甲羥孕酮、戊聚糖多硫酸鹽(pentosanpolysulphate)、蘇拉明、紫杉酚、沙利度胺、血管抑素、干擾素-α、金屬蛋白酶抑制劑、血小板因子4、生長激素抑制素、凝血酶敏感蛋白(thromobospondin)。可用于本技術的活性劑的其它代表性實例和非限制性實例包括:長春新堿、長春花堿、長春地辛、白消安、苯丁酸氮芥(chiorambucil)、螺鉑、順鉑、卡鉑、甲氨蝶呤、阿霉素、絲裂霉素、博來霉素、阿糖胞苷、阿糖腺苷、巰嘌呤、米托坦、甲基芐肼、更生霉素(放線菌素d)、柔紅霉素、鹽酸阿霉素、紫杉酚、普卡霉素、氨魯米特、雌氮芥、氟他胺、亮丙瑞林、醋酸甲地孕酮、他莫昔芬、睪內酯、曲洛司坦、安吖啶(m-amsa)、天冬酰胺酶(左旋天冬酰胺酶)、依托泊苷、血液制品(如血卟啉)或上述的衍生物。活性劑的其它實例包括遺傳物質,如天然或合成來源的核酸、rna和dna,包括重組rna和dna。編碼某些蛋白的dna可用于治療許多不同類型的疾病。例如,可以提供腫瘤壞死因子基因或白細胞介素-2基因來治療晚期癌癥;可以提供胸苷激酶基因來治療卵巢癌或腦腫瘤;并且可以提供白細胞介素-2基因來治療神經母細胞瘤;惡性黑素瘤或腎癌。預期了用于本技術的其他活性劑,其描述于第6,261,537號美國專利,其全部內容通過引用并入本文。抗腫瘤劑和用于檢測這些藥劑的篩選,綜述于monga,m.和sausville,e.a.(2002)leukemia16(4):520-6。
在一些方面,活性劑是弱堿性抗腫瘤化合物,其療效被實質瘤中較高的細胞內/較低的細胞外ph梯度降低。示例性弱堿性抗腫瘤化合物包括:阿霉素、柔紅霉素、米托蒽醌、表柔比星、絲裂霉素、博來霉素、長春花生物堿(如長春花堿和長春新堿)、烷化劑(如環磷酰胺和鹽酸氮芥)以及抗腫瘤嘌呤衍生物和嘧啶衍生物。
在一些方面,組合物包括脲酶,并且基本上缺少任何細胞因子(例如,腫瘤壞死因子和/或干擾素)。在這方面,脲酶單獨或與除細胞因子以外的活性劑組合小分子抗腫瘤劑,對抑制癌細胞生長是有效的。因此,在這方面,組合物可以或可以不與所治療的對象中存在的內源性細胞因子或天然細胞因子一致地起作用,但所施用的組合物不含有另外的外源性細胞因子。
在一些方面,所述其他活性劑不是培美曲塞和/或卡鉑。在一些方面,所述其他活性劑不是葉酸抗代謝物和/或鉑劑。
遞送和給藥方法
可以通過本領域已知的多種方法,將抗體-脲酶綴合物組合物遞送至癌細胞。在治療應用中,將組合物以足以抑制癌細胞生長的量施用于具有癌細胞的患者。可以通過多種途徑給藥,包括但不限于腸胃外、腸內、經上皮、經粘膜、透皮和/或手術,將藥物組合物暴露于癌細胞。
腸胃外給藥方式包括通過如下方式施用組合物的那些:例如靜脈內施用、動脈內施用、腹膜內施用、髓內施用、肌肉內施用、關節內施用、鞘內施用和心室內注射施用、皮下施用、性腺內施用(intragonadal)或瘤內針刺彈丸注射施用,或使用適當的泵技術的延長的連續施用、脈動施用或計劃灌注施用或微灌注施用。腸內給藥方式包括口服給藥(包括口腔和舌下)和直腸給藥。經上皮給藥方式包括例如經粘膜給藥和透皮給藥。經粘膜給藥包括例如腸內給藥以及經鼻、吸入和深肺給藥、陰道給藥和直腸給藥。透皮給藥包括被動或主動的透皮或經皮方式,包括例如貼劑方式和離子電滲裝置方式,以及局部敷用糊劑、藥膏或軟膏方式。外科手術技術包括植入藥性持久(儲庫)組合物、滲透泵等。
可以根據對象所需要和耐受的劑量和頻率,施用單次給藥或多次給藥的活性劑。無論如何,組合物應提供足夠量的活性劑,以有效治療對象。
在一些方面,本技術預期了使用諸如脂質體和/或納米膠囊的囊泡作為化學實體,用于將包含抗體-脲酶綴合物的藥物組合物遞送至癌細胞。這種制劑對于引入本文公開的多肽、藥物和/或抗體的藥學上可接受的制劑可能是優選的。脂質體的形成和使用通常是本領域技術人員已知的。(參見例如backer,m.v.等人,(2002)bioconjugchem13(3):462-7)。在優選的方面,所公開的組合物可以包埋在脂質體中。
納米膠囊通常可以以穩定和可再生的方式捕獲化合物(whelan,j.(2001)drugdiscovtoday6(23):1183-84)。為了避免由于細胞內聚合物超載引起的副作用,可以使用能夠在體內降解的聚合物來設計這樣的超微顆粒(大小約為0.1μm)。預期將滿足這些要求的生物可降解的聚氰基丙烯酸異丁酯納米顆粒用于本技術中,并且這樣的顆粒可以容易地制備,如描述于例如lambert,g.等人(2001)intjpharm214(1-2):13-6。制備含有生物活性物質的聚烷基-氰基-丙烯酸酯納米顆粒的方法及其用途,描述于第4,329,332號、第4,489,055號和第4,913,908號美國專利。納米膠囊可以從諸如capsulution,inc.(www.capsulution.com)等來源商購。
包含用于遞送組合物的納米膠囊的藥物組合物,描述于第5,500,224號、第5,620,708號和第6,514,481號美國專利。第5,500,224號美國專利描述了納米膠囊的膠態懸浮液形式的藥物組合物,其包含基本上由含有溶解有表面活性劑的油組成的油相和懸浮在其中的具有小于500納米直徑的多個納米膠囊。第5,620,708號美國專利描述了組合物和用于施用藥物和其它活性劑的方法。組合物包含附著于特異性結合存在于哺乳動物腸上皮細胞表面上的靶分子的結合部分的活性劑載體顆粒。所述結合部分以足以引發顆粒活性劑載體的內吞作用或吞噬作用的結合親和力或親合力結合靶分子,使得載體被腸上皮細胞吸收。然后,活性劑將從載體釋放到宿主的體循環。以這種方式,可以避免腸道中降解敏感性藥物(如多肽)的降解,同時增加從腸道吸收蛋白和多肽。可選地,本技術預期了在靶細胞周圍的環境中釋放活性劑。例如,在一方面,抗體-脲酶綴合物在靶向部分結合到靶細胞后從納米膠囊中釋放,使得脲酶被釋放到靶細胞(例如腫瘤細胞)周圍的微環境中。第6,379,683號和第6,303,150號美國專利描述了制備納米膠囊的方法及其用途,并且通過引用并入本文。
將使用的藥物組合物以有效量施用于對象。通常,有效量是有效(1)減少尋求治療的疾病的癥狀的量;或(2)誘導與治療尋求治療的疾病相關的藥理學變化的量。對于癌癥,有效量可以包括如下有效的量:減少腫瘤的大小;減緩腫瘤的生長;預防或抑制轉移;或者增加受影響對象的預期壽命。接觸包括向細胞中加入包含靶向部分和以所選擇電荷和與第二、相反電荷的卷曲形成肽相互作用以形成穩定的α-螺旋卷曲螺旋異源二聚體的能力為特征的第一卷曲形成肽的綴合物。隨后,向細胞中加入脂質體。脂質體包含外表面和內部隔室;位于脂質體內部隔室的活性劑(例如脲酶);和多個第二肽,其中每個第二肽被連接到脂質體的外表面。
在一些方面,接觸包括將脂質體添加到細胞中,其中脂質體具有包埋形式的活性劑(例如抗體-脲酶綴合物),并且脂質體的外表面包括有效且特異性結合靶表面的細胞靶向部分,以及有效地屏蔽靶向部分以免于與靶表面相互作用的親水性聚合物覆蓋層。親水聚合物覆蓋層可以由通過可釋放的鍵與脂質體中的表面脂質成分共價連接的聚合物鏈組成。在一些方面,將釋放劑以能有效引起所添加的脂質體中大部分鍵的釋放的量加入到腫瘤細胞中,從而將靶向部分暴露于靶表面。可釋放的鍵可以是可還原的化學鍵如二硫鍵、酯鍵和肽鍵。
在一些方面,本文預期了針對哺乳動物對象的基于脂質體的療法。該方法包括對對象全身施用(例如靜脈內施用)具有表面結合的靶向部分和親水性聚合物覆蓋層的脂質體。由可釋放地連接的聚合物鏈組成的親水性聚合物覆蓋層,有效地屏蔽靶向部分以免于與其靶標的相互作用。使所施用的脂質體全身循環,直到實現期望的脂質體生物分布。向對象施用有效地引起大部分(例如,大于所施用脂質體中可釋放鍵的約50%,優選大于約70%,更優選大于約90%)裂解的量的釋放劑。當釋放親水性聚合物鏈以與其靶標相互作用時,所述靶向部分被暴露。
在一些方面,脂質體用于治療實體瘤。脂質體包括抗體-脲酶綴合物,以及任選地,包埋形式的其他活性劑(例如抗腫瘤藥物),并且通過有效且特異性結合腫瘤特異性抗原的靶向部分而靶向腫瘤區域。在一示例性方法中,通過在脂質體中包括vegf配體,使脂質體靶向腫瘤的血管內皮細胞,用于選擇性附著到在增殖性腫瘤內皮細胞上表達的flk-1,2受體(niederman,tm等人(2002)procnatlacedsci99(10):7009-14)。
在一些方面,脂質體具有在約30-400nm的尺寸。已經顯示在該大小范圍內的脂質體能夠通過存在于腫瘤脈管系統的內皮細胞襯里層中的“間隙”進入腫瘤(maruyama,k等人(1999)advdrugdelivrev40(1-2):89-102)。
在施用(例如靜脈內施用)脂質體之后,并且在經過足夠的時間以使脂質體分布在對象中并結合腫瘤之后,向對象施用釋放劑以從脂質體中釋放親水性表面覆蓋層。釋放表面覆蓋層對于暴露靶向部分以允許脂質體與靶細胞結合是有效的。在一方面,親水性表面覆蓋層通過ph敏感性鍵附著到脂質體上。脂質體與腫瘤結合后釋放該鍵。
上述任何方面中的脂質體,可以任選地包括一種或多種包埋的抗腫瘤藥物或顯像劑或二者。可以加入脂質體并使其分散,然后可以施用釋放劑以釋放親水性表面覆蓋層,以暴露附著的靶向部分并開始結合。可以如第6,043,094號美國專利號中所述制備和施用脂質體,其通過引用并入本文。
在本技術中可以使用其他遞送劑,諸如第6,180,114號美國專利中所述的小單層囊泡(suv),其全部內容通過引用并入本文。
本領域技術人員應當理解,存在不是嚴重血管化的或者被緊密連接所連接的細胞和/或主動轉運機制保護的一些區域,其減少或阻止了存在于血流中的大分子的進入。因此,例如,全身施用治療劑以治療神經膠質瘤或其他腦癌,可能受到抵抗大腦分子進入蛛網膜下腔空間的血腦屏障的制約。在這些類型的腫瘤中,治療組合物可優選直接施用于腫瘤部位。因此,例如,可以通過將治療組合物直接施用(例如通過彈丸注射、微注射或手術植入導管)于腫瘤部位來治療腦腫瘤。
劑量
對于本技術的方法,可以使用調節劑量時間和順序的任何有效的給藥方案。人對象的示例性劑量水平,將取決于給藥方式、腫瘤的程度(大小和分布)、患者個體大小以及癌癥對脲酶治療的應答性。
當將抗體-脲酶綴合物組合物施用于(例如直接注射)腫瘤中時,示例性劑量為約0.1至1,00010μg/kg體重(如約0.2至5μg/kg,或約0.5至2μg/kg)。可以通過常規的圖像引導技術(例如熒光透視)來引導注射針的安放,使得醫生可以相對于靶組織觀察針的位置。這種引導工具可以包括超聲、熒光透視、ct或mri。
在一些方面,可以在施用抗體-脲酶綴合物進入腫瘤期間或之后,通過用能夠檢測對象癌組織區域中ph值變化的工具監測腫瘤組織,來監測施用劑量的抗體-脲酶綴合物的有效性或分布。這樣的工具可以包括可以直接插入腫瘤的ph探針或可視化工具(如磁共振成像(mri)、計算機斷層掃描(ct)或熒光透視)。可以在沒有額外的成像劑情況下進行mri問診,這僅僅是基于作為ph值函數的組織的磁性能差異。ct或熒光透視成像可能需要額外的ph敏感成像劑,其不透明度受組織培養基的ph值影響。這些試劑是本領域技術人員公知的。
在施用任何抗體-脲酶綴合物之前,可以通過相對于周圍正常組織的其較低ph值來顯現腫瘤組織。因此,正常組織可以具有約7.2的正常ph值,而腫瘤組織可以為低0.1個至0.4個或更高的ph值單位。也就是說,在注射任何抗體-脲酶綴合物之前,可以通過其較低的ph值來明確腫瘤組織的程度。在施用脲酶后,具有脲酶的腫瘤區域的ph值將開始上升,并且可以通過將所得圖像與較早的給藥前圖像進行比較來鑒定。
通過以這種方式問診組織,可以監測ph值的變化程度和組織受影響的程度。基于這種問診,醫生可以向該部位施用其他組合物,和/或可以在腫瘤部位內的另外區域施用組合物。可以重復該過程直到在實體腫瘤的整個區域達到期望的ph變化程度,例如0.2至0.4個ph值單位。
可以以合適的間隔重復(例如每周一次或每周兩次)給藥如通過直接注射,直到觀察到期望的,優選腫瘤塊基本上消退或完全消退。如上所述,可以通過在處理過程中顯現處理組織的ph值的變化來監測治療效果。因此,在每次額外的注射之前,可以顯現組織的ph值以確定目前存在的腫瘤程度,此后可以使用組織的ph值變化來監測對組織施用新劑量的抗體-脲酶組合物。
當通過非直接注射的方法腸胃外施用抗體-脲酶組合物時,抗體-脲酶組合物的示例性劑量為100-100,000個國際單位/kg脲酶活性/kg對象體重。如本文所述,該方法中的抗體-脲酶組合物包括用于將脲酶靶向癌癥細胞(例如實體瘤位點)的抗體,或用于在腫瘤部位選擇性地螯合尿素酶的抗體(例如以脂質體形式)。
對組織ph值變化敏感的成像技術,可用于監測給藥劑量的有效性。由于這種靶向可能需要幾個小時或更長時間,所以該方法可以包括如上所述在注射抗體-脲酶組合物之前和給藥后數小時(例如12-24小時),監測腫瘤ph值以確認腫瘤部位已被充分地給藥,如通過腫瘤區域ph值的升高所證實。根據這種問診結果,該方法可以確定額外的劑量,直到觀察到期望的ph值升高,例如0.2-0.4個ph值單位。一旦確立了該劑量,可以定期(例如每周一次或兩次)對患者進行類似劑量的脲酶組合物的治療,直到達到腫瘤大小或狀況的改變。
考慮到改變藥物作用的各種因素(如藥劑的比活性,疾病狀態的嚴重性,患者的應答性,患者的年齡、狀況、體重、性別和飲食,任何感染的嚴重程度等),由主治醫師鑒于良好的醫學實踐來確定最終劑量方案。可以考慮的其他因素包括:給藥的時間和頻率、藥物組合、反應敏感性和對治療的耐受/應答。由本領域從業人員,尤其是根據所公開的劑量信息和測定方法,以及在臨床試驗中觀察到的藥代動力學數據,常規地進行適用于治療的涉及本文提及的任何制劑的劑量的進一步改進。可以通過使用已建立的用于確定體液中的試劑或其它樣品的濃度的測定方法以及劑量應答數據來確定合適的劑量。
給藥的頻率將取決于藥劑的藥代動力學參數和給藥途徑。調整劑量和給藥以提供足夠水平的活性劑或維持期望的效果。因此,可以根據需要以單劑量、多個離散劑量、持續輸注、緩釋儲庫或其組合來施用藥物組合物,以維持期望的藥劑最低水平。
可以每天一次或每天超過一次(例如每天兩次、三次或四次)施用短效藥物組合物(即,短半衰期)。可以每3-4天、每周或每兩周一次施用長效藥物組合物。將泵(例如皮下泵、腹膜內泵或硬膜下泵)用于連續輸注。
可以制備在藥學上可接受的載體中包含綴合物的組合物,置于合適的容器中,并標記用于治療指定的病況。標簽上指示的病況可以包括但不限于治療各種癌癥類型。也涵蓋如下所述的試劑盒,其中試劑盒包含藥物組合物的劑型和包含使用該組合物治療醫學病況的說明的包裝說明書。
通常,將綴合物組合物以有效量施用于對象。通常,有效量是有效(1)減少尋求治療的疾病的癥狀的量;或(2)誘導與治療尋求治療的疾病相關的藥理學變化的量。對于癌癥,有效量可以包括如下有效的量:減少腫瘤的大小;減緩腫瘤的生長;預防或抑制轉移;或增加受影響對象的預期壽命。
治療方法
本技術提供了治療對象的癌癥的方法,其包括向對象施用治療有效量的本文提供的組合物,從而治療對象的癌癥。適合通過本文的方法治療的癌癥通常包括:癌、白血病、淋巴瘤和肉瘤。癌可以是肛門癌、膽道癌、膀胱癌、乳腺癌、結腸癌、直腸癌、肺癌、口咽癌、下咽部癌、食道癌、胃癌、胰腺癌、肝癌、腎癌、膽囊癌和膽管癌、小腸癌、尿道癌、卵巢癌、結腸癌、非小細胞肺癌、生殖道癌、內分泌腺癌、甲狀腺癌和皮膚癌。其他適合的癌癥包括:類癌瘤、胃腸道間質瘤、頭頸部腫瘤、原發性腫瘤、血管瘤、黑素瘤、惡性間皮瘤、多發性骨髓瘤和腦腫瘤、神經腫瘤、眼腫瘤和腦膜腫瘤。
在一些方面,待治療的癌癥形成實體腫瘤,諸如癌、肉瘤、黑素瘤和淋巴瘤。在一些方面,癌癥是以下中的一種或多種:非小細胞肺癌、乳腺癌、胰腺癌、卵巢癌、肺癌、結腸癌或其組合。在一些方面,癌癥是非小細胞肺癌。在一些方面,對象是人。
可以通過本領域熟知的方法來估計治療有效劑量。癌癥動物模型,如具有小鼠腫瘤的免疫能力小鼠,或具有人腫瘤異種移植物的免疫受損小鼠(例如,裸鼠),在本領域中是眾所周知的,并且被廣泛地描述于以引用并入本文的許多參考文獻中。這些信息與在大鼠、狗和/或非人靈長類動物中的安全性研究結合使用,以確定在人類中安全和潛在有用的初始劑量。用于估計生物體內劑量的其他信息,可來自臨床試驗報告的實際人癌癥研究。
在一些方面,癌癥治療方法旨在包括治愈以及改善癌癥的至少一種癌癥癥狀。如果患者被治愈了癌癥,癌癥進入緩解期,生存期以統計學顯著的方式延長,腫瘤進展時間以統計學顯著的方式增長,基于為每種類型的淋巴細胞惡性腫瘤或造血惡性腫瘤建立的規范標準,淋巴細胞腫瘤負荷或造血腫瘤負荷減少,或者實體瘤負荷已經按照如實體瘤應答評估標準定義的減少,則治療了癌癥患者(recist1.0或recist1.1,therasse等人,jnatl.cancerinst.92(3):205-216,2000和eisenhauer等人,eur.j.cancer45:228-247,2009)。如本文所用,“緩解期”是指先前證明患有癌癥的患者中不存在生長中的癌細胞。因此,緩解期的癌癥患者,或者治愈了其癌癥,或者其癌癥是存在的但不容易檢測的。因此,當腫瘤不能增大或轉移時,癌癥可能是在緩解期。如本文所用的完全緩解期,是通過診斷方法(如成像,諸如x射線、mri、ct和pet,或血液活檢或骨髓活檢)所示的疾病不存在。當癌癥患者進入緩解期時,其后可能會復發,其中癌癥再次出現。
在一些方面,所述治療不與培美曲塞和/或卡鉑聯合。在一些方面,所述治療不與葉酸抗代謝物化合物和/或鉑劑聯合。
試劑盒
在一些方面,本技術提供使用本文所述方法抑制腫瘤細胞生長的試劑盒。試劑盒包括含有一種或多種活性劑的容器。試劑盒可以另外包括用于實施本技術方法的本文所述的任何其它成分。
試劑盒可以任選地包括含有公開用于抑制腫瘤細胞生長的活性劑的用法說明的(即,方案)的說明材料。因此,一方面,試劑盒包括含有活性劑,優選脲酶的藥物組合物,以及教導向對象施用該組合物以治療對象中癌癥的說明材料。在一方面,說明材料教導向對象施用如下量的脲酶組合物,其量取決于腫瘤的大小,并且當通過直接注射施用組合物進入腫瘤時,每mm3腫瘤0.1至100個國際單位的脲酶活性,當經腸胃外施用組合物于對象而不是通過直接注射進入腫瘤中時,其量為100-100,000個國際單位/kg國際單位脲酶活性/kg對象體重。
在另一方面,說明材料教導了以有效減少或逆轉實體瘤中較高的細胞內/較低的細胞外ph值梯度的脲酶量,向還在接受其有效性被實體瘤中較高的細胞內/較低的細胞外ph值梯度降低的弱堿性抗腫瘤化合物的對象施用脲酶組合物。
可選地,說明材料教導了在可有效定位對象的實體瘤中的脲酶的條件下,向含有或懷疑含有實體瘤的對象施用脲酶組合物,用能夠檢測對象組織中細胞外ph值的變化的診斷工具問診對象,以及鑒定在所述給藥后顯示細胞外ph值升高的對象內的組織區域。
雖然說明材料通常包括書面材料或印刷材料,但是它們不限于此。本技術涵蓋了任何能夠存儲這些說明并將其傳遞給最終用戶的介質。這樣的介質包括但不限于:電子存儲介質(例如,磁盤、磁帶、盒帶、芯片),光學介質(例如,cdrom)等。這樣的介質可以包括提供這種說明材料的因特網站點的地址。
實施例
給出以下實施例是為了說明本公開的各個方面。它們并不意圖以任何方式限制本公開。本領域技術人員將理解,本公開很好地適用于實現目標并獲得所提及的目的和優點,以及本文中固有的任何目標、目的和優點。本發明的實施例(以及本文所述的方法)目前代表優選方面。它們是示例性的,并不意圖限制本公開的范圍。本領域技術人員將想到包含在由權利要求的范圍限定的本公開的精神內的變化和其它用途。
實施例1.l-dos47:靶向表達ceacam6的腫瘤的抗體-脲酶綴合物
相對于正常組織,腫瘤的微環境通常是酸性的。響應于由異常脈管系統的局部缺氧導致無氧糖酵解而引起的乳酸積累,似乎是直接原因(1,2)。然而,即使在氧的存在下,癌細胞繼續無氧代謝葡萄糖(3)。這表明轉變的代謝表型和所產生的酸性環境可能賦予癌細胞生長優勢(4)。
已經表明,將尿素轉變成氨并提高溶液ph值的洋刀豆脲酶,對癌細胞是細胞毒性的(8)。在負載人乳腺癌和肺癌的異種移植物的小鼠中,向腫瘤內注射酶也顯著延遲了腫瘤生長(8)。然而,在臨床環境中,腫瘤內遞送癌癥治療劑是一個困難的實踐。在患有晚期和顯著轉移性疾病的患者中,瘤內注射不是可行的選擇。更實際的方法是通過靜脈內注射來遞送酶。然而,脲酶缺乏靶向結構域,并且酶的全身遞送可能導致脫靶毒性。使用特異性靶向腫瘤的抗體-酶綴合物將脲酶遞送至癌癥部位。所述綴合物中使用的該抗體能特異性識別在非小細胞肺癌患者中的ceacam6。
選擇識別肺腺癌細胞(17)上的ceacam6的單結構域駱駝科抗體片段(afaikl2,seqidno.1),用于與洋刀豆脲酶(dos47)綴合以產生癌癥治療劑。本技術描述了對這種抗ceacam6-脲酶綴合物(l-dos47)進行的一些相關臨床前研究(目前處在人類i期臨床研究中)。
將洋刀豆脲酶的抗腫瘤活性與抗-ceacam6單結構域抗體的特異性,以抗體-脲酶偶聯物(l-dos47)的形式組合。l-dos47特異性結合表達ceacam6的癌細胞系,并發揮有效的細胞毒作用。競爭性結合試驗顯示,由于增加的親合力,l-dos47的結合親和力比天然單結構域抗體強約500倍。l-dos47的細胞毒性取決于原位尿素的可用性和靶細胞對氨毒性的敏感性。通過沉默ceacam6基因來保護bxpc-3細胞免受l-dos47的影響,而ceacam6過表達致使轉染的h23細胞對l-dos47細胞毒性敏感。人正常組織和癌組織的免疫化學染色顯示,l-dos47優先結合肺腺癌,以及結合結腸腺癌和胰腺腺癌,具有陽性但較弱的染色。小鼠肺腺癌a549細胞的轉移研究也表明,l-dos47在10μg/ml濃度下可有效減少肺中癌細胞計數。
材料。洋刀豆(canavaliaensiformis)脲酶得自biovectrainc.(pei,加拿大),并通過酸沉淀、醇分級分離和離子交換色譜法進一步純化。通過sds-page、hplc和質譜法測定,酶的純度>97%。脲酶的一個單位定義為在25℃和ph值7.6下產生1μmol/分鐘的氨。
來自美洲駝的重鏈抗體庫的噬菌體文庫,用于通過對非小細胞肺腺癌a549進行淘選來鑒定單結構域抗體(sdab)。sdab被指定為afai(17)。優化afai的基因序列用于綴合目的,并重命名為afaikl2。然后將afaikl2抗體在大腸桿菌bl21(de3)pt7-7系統中克隆并表達。使用離子交換色譜法從包涵體中純化該抗體。使用異雙功能交聯劑n-琥珀酰亞胺基(4-碘乙酰基)氨基-苯甲酸酯(siab),進行抗體與脲酶的綴合。首先通過伯胺基團用siab連接子的nhs酯部分活化afaikl2抗體。活化的抗體通過交聯劑的碘乙酰基結合脲酶,以釋放存在于酶上的巰基。通過以2:1的質量比將高純度脲酶和活化的抗體混合,來控制靶向綴合比(1:6至1:10,脲酶與抗體比)。通過超透析過濾純化抗體-脲酶綴合物。
尿素、胰蛋白酶(組織培養級)、吩嗪硫酸乙酯(pes)、硝普化鈉、次氯酸鈉溶液、苯酚、nacl、kh2po4、mgso4、nahco3和戊二醛,購自sigmachemicalco.(st.louis,mo)。3-(4,5-二甲基噻唑-2-基)-5-(3-羧基甲氧基苯基)-2-(4-磺苯基)-2h-四唑(mts)和胰蛋白酶(用于肽片段化和質譜分析),購自promegacorp.(madison,wi)。過氧化氫(30%)、siab、kcl、d-葡萄糖、hcl、na2hpo4和nah2po4,購自fisherscientific(ottawa,on)。牛血清白蛋白v部分(bsa)購自roche(indianapolis,in)。氯化銨(0.100m)購自riccachemical(arlington,tx)。抗-afaikl2-過氧化物酶綴合物,由rocklandimmunochemicals(gilbertsville,pa)生產。細胞培養基(rpmi)、胎牛血清和抗生素,獲自lifetechnologies(burlington,on)。雌性crtac:ncr-foxn1nu裸鼠,由taconic(hudson,ny)提供。實驗中使用的改性krebsringer緩沖液(krb)含有nacl(98.3mm)、kcl(4.73mm)、kh2po4(1.19mm)、mgso4(1.19mm)、d-葡萄糖(11.7mm)、na2hpo4(11.1mm)和nah2po4(2.77mm),ph值7.2。
靛酚測定
使用改良的靛酚測定法(18),測定脲酶酶反應產生的氨的量。簡言之,通過將165mg苯酚和132mgnaoh顆粒溶解在10ml水中,然后加入66μl硝普化鈉溶液(10mg/ml),新鮮制備溶液a。通過向5ml水中加入40μl次氯酸鈉制備溶液b。將來自全細胞結合試驗(見下文)的樣品溶液(每次30μl)轉移到含有50μl/孔的5nnaoh:h2o(3.3:46.7)和20μl/孔水的新的96孔板中。加入溶液a(50μl/孔)和溶液b(50μl/孔),然后將平板轉移到酶標儀上,在37℃顯色30分鐘。在630nm處測量od值。使用氯化氨作為標準品(0至150μm),從校準曲線計算在孔中產生的氨的量。
l-dos47的全細胞結合測定
通過在96孔培養板中接種100μl/孔的腫瘤細胞(4×104個細胞/孔),并在37℃孵育過夜,來制備細胞單層。從平板上去除培養基,并在室溫(rt)下用100μl/孔的0.05%戊二醛(在磷酸鹽緩沖鹽水,pbs中)將細胞單層固定10分鐘。然后用pbs洗滌平板,加入120μl/孔的甘氨酸溶液(50mm),并在37℃下孵育20分鐘。孵育后,將平板用120μl/孔的1%bsa/pbs在37℃封閉30分鐘。然后,將平板用緩沖液a(pbs中0.05%bsa)洗滌3次,加入80μl/孔的稀釋的l-dos47溶液或dos47溶液,并在37℃下孵育1.5小時。通過尿素方法或抗體方法產生結合信號:(1)用尿素方法,將平板用緩沖液a洗滌4次,加入80μl/孔的20mm尿素(在ph值7.6的0.1m磷酸鹽緩沖液中制備),并在37℃下孵育30分鐘。孵育后,加入40μl/孔的1nhcl以停止反應。使用靛酚測定法測定每個孔中產生的氨的量。(2)對于抗體方法,在封閉步驟前,首先用100μl/孔的0.3%過氧化氫猝滅內源性過氧化物酶30分鐘。在用試驗物質孵育后,用pbs洗滌平板,并在含有0.05%tween-20和0.1%奶粉的緩沖液a中,制備稀釋的抗-afaikl2-過氧化物酶抗體綴合物(1:8,000)。將平板用緩沖液a洗滌3次,向平板中加入100μl/孔的抗體-過氧化物酶綴合物。在37℃下孵育1小時后,將平板用緩沖液a洗滌3次。在含有0.03%h2o2的檸檬酸鈉緩沖液中,制備1mm的過氧化物酶底物,加入100μl/孔的底物溶液,并在室溫下孵育30分鐘。將平板轉移至酶標儀,在405nm下測量od值。
l-dos47的細胞毒性測定
通過在96孔培養板中接種100μl/孔的腫瘤細胞(4×104個細胞/孔),并在37℃孵育過夜,來制備細胞單層。從每個孔中去除培養基,加入80μl/孔的l-dos47或dos47,并在37℃下進一步孵育2小時。孵育后,將平板用緩沖液a洗滌3次。然后將100μl/孔的krb中的尿素(20mm)加入到平板中,將其在37℃下孵育過夜。去除培養基,用100μl/孔普通培養基代替。使用mts細胞活力測定法測定細胞活力,其中制備mts/pes溶液混合物(20:1體積/體積;mts,2mg/ml;pes,1mg/ml),并將20μl/孔的混合物加入到平板中。然后將平板在37℃下孵育1-2小時,并在630nm處測量od值,參考490nm處的od值。
基于細胞的電化學發光(ecl)結合測定
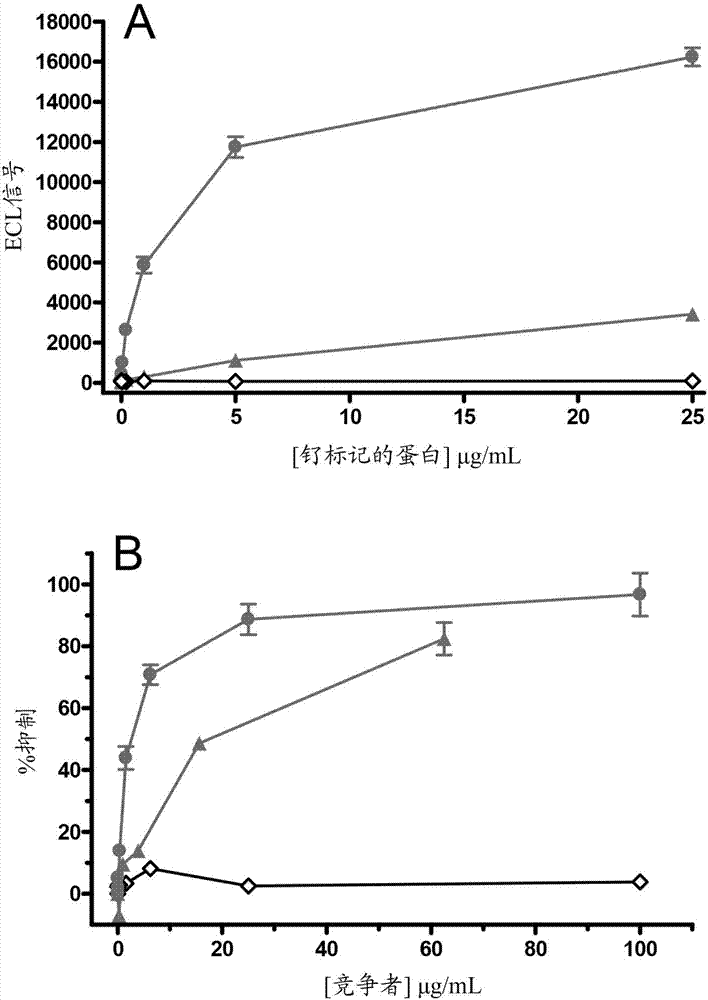
根據制造商的說明書,用釕-nhs-酯(sulfo-tag,mesoscalediscoverymsd;rockville,md)標記l-dos47、afaikl2抗體和dos47。這些釕標記的蛋白允許直接測量l-dos47和afaikl2與靶抗原的結合。對于直接結合測定,在96孔sectorpr高結合板(msd)上,制備bxpc-3細胞單層。固定和封閉后,加入各種量的l-dos47標簽或afaikl2標簽。將平板在37℃下孵育1.5小時。孵育后,將板洗滌兩次,并用讀取緩沖液(readbuffer)(msd)填充。然后立即使用sectorpr-100讀取器(msd)讀取ecl信號。對于競爭性結合測定,使用l-dos47或afaikl2抗體來抑制l-dos47標簽與bxpc-3細胞的結合。使用1μg/ml的l-dos47標簽結合bxpc-3細胞。使用各種濃度的競爭者(l-dos47或afaikl2)來競爭標記的l-dos47的結合。孵育后,將平板洗滌兩次,并用讀取緩沖液填充。然后立即使用sectorpr-100讀取器讀取平板。
bxpc-3細胞中的ceacam6基因敲低
為了證實ceacam6是由l-dos47識別的特異性抗原,使用來自origene(rockville,md)的hush-29發夾表達克隆,使陽性細胞系bxpc-3的ceacam6基因沉默。這些質粒轉錄短發夾rna(shrna)序列,其通過rna干擾阻斷靶基因轉錄。用hush質粒轉染bxpc-3細胞,并且使用嘌呤霉素來選擇出穩定轉染的細胞。從轉染hush6(aaggcgaaagagtggatggcaacagtcta(seqidno:5))、hush7(aagaagcaaccggacagttccatgtatac(seqidno:6))和對照質粒hush-trs,獲得不同的克隆。通過抗生素選擇來獲得兩種陽性穩定細胞系(hush#6和hush#7)和對照(hush-trs)。然后使用全細胞結合測定法,將這些克隆用于檢查與l-dos47的結合。用l-dos47孵育后,將平板用緩沖液a洗滌3次,加入80μl/孔的20mm尿素(在ph值7.6的0.1m磷酸鹽緩沖液中制備)。將平板在37℃下孵育30分鐘。通過加入40μl/孔的1nhcl終止酶促反應。使用靛酚測定法測定產生的氨的量。
將ceacam6基因轉染到h23細胞
將含有g418選擇標記的哺乳動物表達載體克隆,其具有pmp-gfp基因(質膜蛋白-綠色熒光蛋白)和ceacam6基因。使用cellfectin試劑(lifetechnologies),將表達載體轉染到h23細胞中。簡言之,將在2ml完全rpmi培養基(含有10%胎牛血清和50u/ml青霉素和50μg/ml鏈霉素)中的2×106個細胞/孔的h23細胞,接種在6孔培養板中并在37℃下孵育過夜。將cellfectin試劑(10μl)和dna(1-2μl)分別稀釋于100μl無血清rpmi培養基中。然后將兩種稀釋溶液合并,輕輕混合,并在室溫下孵育30分鐘。將平板用1.5ml無血清rpmi培養基洗滌兩次。將合并的溶液稀釋于0.8ml無血清rpmi培養基中,輕輕混合,并加入到細胞中。將細胞于37℃在co2培養箱中孵育過夜。第二天,用2ml完全rpmi培養基代替該培養基。轉染的細胞共表達了來自與ceacam6相同的mrna的gfp。通過在含有400μg/mlg418抗生素的培養基中孵育來選擇轉染的細胞。將細胞直接分選或用cy5.5標記的l-dos47孵育后分選,其表明ceacam6的表面表達。
l-dos47對人腫瘤組織的免疫化學染色
篩選代表42個癌組織和正常組織的總共400個組織樣品(axelwellmann,universityhospitalaachen,rwthaachengermany)。首先將載玻片在62℃的烘箱中以垂直取向孵育1小時以除去石蠟。然后,將載玻片在二甲苯代替物中脫蠟5×4分鐘。將載玻片在100%、95%和75%乙醇中水合2x3分鐘每次,然后浸入自來水中5分鐘。用0.3%h2o2淬滅內源性過氧化物酶30分鐘。使用vectastaineliteabc試劑盒(vectorlabs,burlington,on),檢測載玻片上的l-dos47結合。簡言之,在pbs中洗滌3×5分鐘后,將載玻片在封閉血清中于4℃孵育過夜。然后將載玻片在l-dos47溶液(在緩沖液a中為20μg/ml)中于37℃中孵育1.5小時。用pbs洗滌后,將載玻片用小鼠抗-脲酶抗體(sigma,1:1500)在37℃孵育1小時。用pbs洗滌后,將載玻片用生物素化的二抗溶液(vectorlabs)孵育30分鐘。用pbs洗滌后,將載玻片與vectastaineliteabc試劑一起孵育30分鐘。用pbs洗滌后,將載玻片在新鮮的dab(3,3-二氨基聯苯胺)過氧化物酶底物溶液混合物(vectorlabs)中,在室溫下孵育2分鐘。通過在自來水中洗滌5分鐘來停止反應。然后將載玻片在meyer蘇木精中復染10sec。將載玻片在75%、80%、95%和100%乙醇中脫水。在二甲苯中清洗后,用clarion安裝介質安裝載玻片。
a549轉移研究
接種a549腫瘤細胞(5×106),并在低結合培養板中生長。一旦獲得足夠的數量,收獲細胞并以5×106個細胞/ml的濃度重懸于培養基中。然后將細胞以1ml/孔置于6-孔的低結合組織培養板中。然后將終濃度為10μg/ml或15μg/ml的l-dos47(1ml)加入每個孔中。用10μg/ml的v21-dos47綴合物(靶向血管內皮生長因子(vegf)受體的抗體-脲酶綴合物)處理同種型對照。將細胞在37℃下孵育4小時。孵育后,將細胞離心并用無菌pbs洗滌3次,并在無菌pbs中重懸至1×107個細胞/ml。然后每只小鼠接受1×106個處理的細胞的單次接種。本研究由4組雌性crtac:ncr-foxn1nu小鼠(未處理、同種型和l-dos47(10μg/ml和15μg/ml))組成。通過尾靜脈進行靜脈內接種a549腫瘤細胞,總共40只小鼠(每組10只)。
每組5只動物在第22天(3周)安樂死,而剩余動物保持到第71天(10周)。處死后,用墨汁(calvertlabs;olyphant,pa)氣管內注射動物;然后切除肺,隨后在fekete溶液(calvertlabs)中固定。通過在解剖顯微鏡下計數每個肺中的轉移性腫瘤(病灶)的數目,來確定測試物品對腫瘤轉移的影響。拍攝來自各組的代表性肺。
l-dos47結合各種癌細胞系
在5種腫瘤細胞系-bxpc-3、capan-1、zr-75-30、ls174t和mda-mb231之間,觀察到l-dos47的不同結合分布圖(圖1a)。結果顯示,l-dos47與兩種胰腺細胞系(bxpc-3和capan-1)和乳腺細胞系(zr-75-30)結合良好,表明ceacam6抗原在細胞表面表達。在結腸細胞系ls174t中也觀察到中等結合,但在乳腺細胞系mda-mb231(陰性對照)中沒有發現結合。當與脲酶綴合時,afaikl2抗體提供了針對表達ceacam6細胞的特異性靶向。這通過在dos47處理的細胞中沒有結合信號得以證實(數據未顯示)。
l-dos47的細胞毒性
圖1b顯示,bxpc-3和zr-75-30都對l-dos47細胞毒性敏感。在用小于1μg/ml的l-dos47處理的這兩種細胞系中,觀察到細胞存活的快速下降。在capan-1細胞和ls174t細胞中,觀察到中等作用。l-dos47對陰性對照細胞系mda-mb231沒有任何作用。來自更多細胞系的結合和細胞毒性的結果列表顯示在表1中。l-dos47細胞毒性直接取決于l-dos47對相應細胞系的結合活性。a549和capan-1的較弱的細胞毒性應答,是由于這兩種細胞系對氨毒性的較高耐受性(數據未顯示)。另一方面,h23細胞對氨高度敏感(數據未顯示)。盡管在細胞表面沒有ceacam6抗原,h23細胞仍然顯示出對l-dos47的一些弱的細胞毒性應答,這可能是由于在孔中存在非特異性結合的l-dos47。
表1.從l-dos47對9種人腫瘤細胞系的各種結合和細胞毒性研究獲得的結果總結
其中:+,陽性(+的數表示活性強度);-,陰性
來自四種人組織的五種細胞系(bxpc-3、capan-1、zr-75-30、ls174t和a549),顯示出如表1中所示的強l-dos47結合和對l-dos47細胞毒性的良好敏感性(a549除外)。l-dos47的細胞毒性作用或多或少依賴于與癌細胞的相對結合強度。圖中的結果表示代表性實驗的平均值(n=3)。所有值的標準偏差(sd)小于10%。
l-dos47與bxpc-3細胞的直接和競爭性結合
基于細胞的電化學發光結合測定,允許直接檢測結合到腫瘤細胞的釕標記的抗體綴合物。在圖2a中,發現釕標記的l-dos47和afaikl2抗體都結合bxpc-3細胞,而釕標記的dos47作為陰性對照。因為l-dos47中呈現較高的抗體親合力(6-10個抗體),l-dos47顯示出比afaikl2抗體高得多的結合親和力。使用l-dos47和afaikl2抗體作為競爭者來抑制釕標記的l-dos47與bxpc-3細胞的結合,進一步證實了結果(圖2b)。l-dos47和afaikl2抗體均抑制釕標記的l-dos47與bxpc-3的結合,并且如預期的那樣,l-dos47表現出更好的結合親和力,并因此比afaikl2抗體更強地抑制釕標記的l-dos47與bxpc-3的結合。可以通過測試物品的ic50(導致結合降低50%所需競爭者的量)來比較l-dos47和afaikl2抗體的表觀結合親和力。估計l-dos47和afaikl2抗體的ic50分別為2μg/ml和20μg/ml;或對于l-dos47為3.22nm(對于1個脲酶比6個抗體的綴合比,mw=622k)和對于afaikl2為1.55μm(mw=12.9k)。結果表明,l-dos47的結合親和力為afaikl2抗體的結合親和力的約500倍。
在h23細胞中過表達轉染的ceacam6基因
用ceacam6基因轉染后,鑒定出陽性克隆h23-cc6#7。通過用l-dos47-cy5.5重新分選h23-cc6#7克隆,獲得具有更接近于a549細胞的ceacam6水平的克隆。用更高量的g418抗生素(800μg/ml)進一步孵育克隆,有助于選擇具有較高水平的ceacam6表達的克隆。盡管h23-cc6#7比a549細胞和bxpc-3細胞在細胞表面上表達較少的ceacam6,但由于其對氨的毒性的高度易感性(數據未顯示),該ceacam6轉染的克隆比bxpc-3細胞對l-dos47細胞毒性更敏感(圖3b)。
bxpc-3細胞中的ceacam6基因敲低
與天然bxpc-3細胞和對照克隆(hush-tr3)相比,l-dos47與兩個ceacam6敲低克隆(hush#6和hush#7)的結合顯著降低(圖3c)。實驗清楚地表明,ceacam6在細胞表面的存在對于l-dos47結合是重要的。沉默該基因確實顯著降低了l-dos47的結合。
l-dos47對人腫瘤組織的免疫化學染色
正常組織和癌組織篩選表明,l-dos47幾乎唯一地識別腺癌亞型(表2)。在篩選的400多個組織樣品中,其代表由各種癌組織和匹配的正常組織組成的42組,肺腺癌組織顯示相當大的染色,有超過80%的細胞被識別。相應的年齡匹配的正常肺組織是陰性,其少數活化肺細胞中有病灶暗示。顯示一些陽性但弱染色的其他組織是結腸腺癌和胰腺腺癌。圖4顯示用l-dos47進行結腸腺癌和肺腺癌免疫化學染色。
表2.篩選l-dos47結合的人正常組織和癌組織
用l-dos47進行的人結腸腺癌和肺腺癌免疫組織化學染色如圖4所示。
a549轉移研究
在3周時,接受用10μg/ml和15μg/mll-dos47處理的a549細胞的小鼠顯示出降低的肺腫瘤計數,與未處理的對照組相比展示顯著的降低(p<0.05)(表3)。然而,在10周時,沒有觀察到腫瘤細胞計數的平均數量的顯著降低。盡管不具有統計學意義,但用10μg/mll-dos47治療,與未治療的對照組相比,治療后3周和10周顯示平均腫瘤細胞數量一致下降(表3)。有趣地是,同種型對照(v21-dos47)也影響并減少了肺中的腫瘤計數的數量。總之,在治療后3周,用10μg/ml的l-dos47處理的a549細胞減少了肺腫瘤的平均數,但是這種作用是短暫的,因為在治療后10周沒有觀察到平均腫瘤數目的顯著降低。
表3.在a549轉移研究中計數的肺腫瘤的平均數
#平均值±sem;當與未處理的對照組相比時,*p<0.05。
如表3所示,在體外用l-dos47或同種型對照(v21-dos47)處理a549人肺腺癌細胞。在37℃下孵育4小時后,將細胞用pbs洗滌3次,并以1×107個細胞/ml重懸于pbs中。然后每只小鼠接受1×106個處理的細胞的單次接種。每組5只動物在注射后3周和10周安樂死。通過在解剖顯微鏡下計數每個肺中的轉移性腫瘤的數量,來確定測試物品對腫瘤轉移的影響。將l-dos47治療組的轉移性腫瘤生長,與未經治療的對照組進行非配對t檢驗比較。用l-dos47共注射治療后3周,顯著減少腫瘤計數的數量。
證明了,基于由脲酶介導的氨產生和局部ph值升高,使用脲酶作為潛在癌癥治療劑(8)。然而,相對于正常細胞所述酶對腫瘤細胞的選擇性缺乏,已經限制了其作為癌癥治療劑的應用。抗體-藥物綴合物(adc)的應用,或更具體地,該技術的抗體導向酶前藥治療(adept)的應用,可以規避這種限制。在該實施例中,通過將ceacam6特異性美洲鴕單結構域抗體(afaikl2)與脲酶(dos47)綴合,來制備抗體-脲酶綴合物(l-dos47)的特殊形式。綴合的afaikl2抗體提供了特異性,因此提高了脲酶對表達ceacam6的腫瘤的療效。通過體外結合研究來評估l-dos47對在細胞表面表達ceacam6的癌細胞的特異性(圖1和圖2)。這些研究結果表明,l-dos47結合表達ceacam6的細胞系(bxpc-3、capan-1、zr-75-30和ls174t),但不結合不表達的細胞系(mda-mb231)。此外,通過ceacam6在癌細胞中的敲低和過表達實驗,證實了ceacam6的功能作用(圖3)。通過將ceacam6編碼的質粒轉染到h23細胞中,ceacam6被過表達,而在bxpc-3細胞中通過小發夾rna介導的ceacam6缺失來進行基因敲低。結合研究顯示,l-dos47以高親和力結合天然bxpc-3細胞,但不結合具有ceacam6基因敲低的bxpc-3細胞(圖3c)。相比之下,ceacam6在h23細胞中的過表達使得該細胞對l-dos47結合和細胞毒性敏感(圖3a和圖3b)。這些結果表明,l-dos47與ceacam6抗原的特異性結合對于抗體綴合物誘導腫瘤細胞毒性是重要的。相對于單獨抗體,將抗體與脲酶綴合的另一個好處是親合力的總體增加。ecl結合分析顯示,具有6-10個抗體比1個脲酶的摩爾綴合比的l-dos47與bxpc-3細胞的結合,超過單一抗體與bxpc-3細胞的結合500倍(圖2b)。進一步的結合研究表明,對于l-dos47結合ceacam6,大于6:1的抗體比酶的綴合比是最佳的(數據未顯示)。
通過體外研究和體內研究調查了作用機制。脲酶是l-dos47的活性成分,以前的研究已經證明在體外脲酶對人類腫瘤細胞具有細胞毒性(8)。對裸鼠的a549(肺)腫瘤和mcf-7(乳腺)腫瘤進行脲酶瘤內給藥,顯著抑制了腫瘤生長(8)。然而,脲酶或l-dos47的細胞毒性也依賴于腫瘤細胞系對氨的敏感性。例如,在圖1a中,l-dos47與bxpc-3、zr-75-30和capan-1的結合大致相同,但與其他兩種細胞系相比,capan-1顯示出中等的細胞毒性應答(圖1b)。與bxpc-3和zr-75-30相比,capan-1對氨細胞毒性作用較不敏感(數據未顯示)。類似地,人肺腺癌h23細胞對氨的存在敏感;與bxpc-3細胞(數據未顯示)和a549細胞(圖3a)相比,盡管在細胞表面上呈現較少的ceacam6抗原,但一旦用ceacam6基因轉染,該細胞系變得對l-dos47細胞毒性敏感(圖3b)。總之,對于l-dos47對腫瘤發揮細胞毒作用,在細胞表面表達ceacam6和對氨的敏感性是兩個重要的要求。
人癌癥組織的免疫組織化學篩選顯示,l-dos47對肺腺癌、結腸腺癌和胰腺癌是特異性的(表2),但不針對相應的正常組織。脲酶表面的多重抗體的綴合,大大增強了對ceacam6抗原的特異性(圖1a和圖2),并且降低了該酶的非特異性結合性質(數據未顯示)。體內研究進一步證實了l-dos47對腫瘤異種移植物的療效。在對裸小鼠腫瘤異種移植物的l-dos47的靜脈內注射給藥中(數據未顯示)和a549肺腺癌轉移研究中,觀察到腫瘤生長抑制(表3)。在用10μg/ml或15μg/mll-dos47注射后3周的處理的a549細胞中,觀察到肺部病灶的顯著減少(表3)。然而,10周后沒有發現顯著性差異,這可能是由于來自動物對l-dos47的清除。同種型對照(v21-dos47,抗vegfr2-dos47綴合物)也引起一定程度的肺部病灶的減少,盡管事實是a549細胞在正常條件下不表達vegfr2。ohwada等人(19)報道,在暴露于50mmhcl后的a549細胞中誘導了vegfr功能。可以通過外源vegf給藥來恢復受損的a549細胞的抑制增殖,而加入中和性的抗-vegfr1抗體和抗-vegfr2抗體則重新抑制細胞增殖。然而,vegf抗體和抗-vegfr抗體都對對照細胞沒有影響。不希望被理論束縛,在這種轉移研究中,可能在細胞制備過程中誘導a549細胞中的vegfr2功能。這解釋了為什么在同種型對照組中觀察到細胞計數減少。來自體外研究和體內研究的結果表明,抗體綴合至脲酶使得該抗體綴合物能夠以良好的選擇性和療效特異性靶向表達ceacam6的腫瘤,這為l-dos47的臨床開發提供了概念證明。
實例2.在復發性或轉移性非鱗狀nsclc(非小細胞肺癌)中的l-dos47劑量升高研究
這項研究的主要目的是,評估在具有第iv階段(tnmm1a和m1b)復發性或轉移性非鱗狀非小細胞肺癌的患者中,與培美曲塞/卡鉑的標準雙效治療聯合的l-dos47劑量范圍的安全性、耐受性以及有效性。
主要療效判定指標如下。不良事件患者的數量,作為與培美曲塞/卡鉑聯合治療的l-dos47安全性和耐受性的度量,是隨訪12周的參與者。這被指定為安全性問題。ae報告期從第1周期的第1天開始,直至最后的研究訪問。次要療效判定指標如下。根據recist1.1接受聯合治療的患者的客觀反應率最長為12周,并且未被指定為安全性問題。在已經完成了至少2個周期的研究治療并且具有至少1次治療后疾病評估的患者中,將根據1.1版本的recist評估客觀腫瘤反應。接受持續臨床受益的患者數量隨訪達12周,并未被指定為安全性問題。定義為與l-dos47+培美曲塞/卡鉑聯合治療后,達到完全應答、部分應答和穩定疾病的患者百分比。與培美曲塞/卡鉑聯合治療給藥后,l-dos47的最大觀察血漿濃度(cmax)長達12周,并未被指定為安全性問題。將從收集自用l-dos47給藥的所有患者的血漿樣品中確定l-dos47的藥代動力學參數。與培美曲塞/卡鉑聯合治療給藥后,出現l-dos47的最大觀察血漿濃度(tmax)的時間長達12周,并未被指定為安全性問題。將從收集自用l-dos47給藥的所有患者的血漿樣品中,確定l-dos47的藥代動力學參數。與培美曲塞/卡鉑聯合治療給藥后,l-dos47的濃度-時間曲線下面積(auc)長達12周,未被指定為安全性問題。將從收集自用l-dos47給藥的所有患者的血漿樣品中確定l-dos47的藥代動力學參數。與培美曲塞/卡鉑聯合治療給藥后,l-dos47的終末消除半衰期長達12周,并未被指定為安全性問題。將從收集自用l-dos47給藥的所有患者的血漿樣品中確定l-dos47的藥代動力學參數。與培美曲塞/卡鉑聯合治療,用l-dos47給藥的患者的抗l-dos47抗體的存在長達12周,并被指定為安全性問題。從用l-dos47給藥的所有患者中收集和分析血清樣品。
將進行涉及培美曲塞和卡鉑+l-dos47的實驗。患者將被招募到l-dos47升高劑量的群組中,每個群組最少3名患者,最多6名患者。l-dos47的起始劑量為0.59μg/kg;可評估的進一步可能的劑量水平為0.78μg/kg、1.04μg/kg、1.38μg/kg和1.84μg/kg。分別與l-dos47聯合施用的培美曲塞[500mg/m2]和卡鉑[auc6]的護理劑量標準,將在群組間保持不變。治療周期為21天,患者在周期的第1天、第8天和15天接受l-dos47治療,并且在每個治療周期的第1天接受培美曲塞/卡鉑。計劃患者將接受4個周期l-dos47+培美曲塞/卡鉑的聯合治療。根據研究者的意見,只要有臨床益處并且耐受性良好,在4個周期聯合治療后疾病沒有發展的和沒有經歷不可接受的毒性的患者,將有機會繼續接受l-dos47治療直到疾病進展。根據研究者的意見,由于培美曲塞/卡鉑毒性而無法完成4個周期l-dos47+培美曲塞/卡鉑聯合治療的患者,只要有臨床益處并且耐受性良好,將有機會在停用培美曲塞/卡鉑后繼續接受l-dos47治療直到疾病進展。
實施例3.用于治療非小細胞肺癌的免疫綴合物l-dos47的i期/ii期非盲、非隨機劑量升高研究
本研究的主要目的是,評價當作為單一療法給予時,非鱗狀非小細胞肺癌患者的l-dos47劑量范圍的安全性、耐受性和有效性。
主要療效判定指標如下。藥物相關不良事件的發生率和嚴重程度,作為l-dos47的安全性和耐受性的度量長達12周,并被指定為安全性問題。在從第1周期第1天開始,直到最后研究訪問的ae報告期間評估這些結果。
主次療效判定指標如下。在輸注后的第一個2小時期間的l-dos47相關毒性,是在輸注后的第一個2小時期間,并被指定為安全性問題。通過ae和sae的發生率和嚴重程度以及生命體征的變化來評估這些結果。所有報告的不良事件和嚴重不良事件的發生率和嚴重程度均在時間框架之下,即參與者將被隨訪12周和30天的隨訪期。這些結果被指定為安全性問題,并從第1周期第1天開始,直到最后研究訪問的ae報告期間被評估。其他安全參數(臨床實驗室評估、生命體征、體重、氧氣需求和12導聯心電圖)從基線的變化在直到12周的時間框架內,并被指定為安全性問題。安全參數包括臨床實驗室評估、生命體征、重量、氧需求量和12導聯心電圖。抗l-dos47抗體隨時間推移評估長達12周,并被指定為安全性問題。從用l-dos47給藥的所有患者中收集和分析血清樣品。
其他療效判定指標如下。在每個劑量水平下,l-dos47的最大觀察血漿濃度(cmax)在直到12周的時間框架內,并未被指定為安全性問題。將從收集自用l-dos47給藥的所有患者的血漿樣品中確定l-dos47的藥代動力學參數。在每個劑量水平下,出現l-dos47的最大觀察血漿濃度(tmax)的時間長達12周,并未被指定為安全性問題。將從收集自用l-dos47給藥的所有患者的血漿樣品中確定l-dos47的藥代動力學參數。在每個劑量水平下,測量l-dos47的濃度-時間曲線下面積(auc)長達12周,并未指定為安全性問題。將從收集自用l-dos47給藥的所有患者的血漿樣品中確定l-dos47的藥代動力學參數。在每個劑量水平下,l-dos47的終點消除半衰期在直到12周的時間框架內,并未被指定為安全性問題。將從收集自用l-dos47給藥的所有患者的血漿樣品中確定l-dos47的藥代動力學參數。患者將被招募到l-dos47升級劑量的群組中,每個群組最少3名患者,最多6名患者。l-dos47的起始劑量為0.12μg/kg;進一步可能的劑量水平包括0.21μg/kg、0.33μg/kg、0.46μg/kg、0.59μg/kg、0.78μg/kg、1.04μg/kg、1.38μg/kg、1.84μg/kg、2.45μg/kg、3.26μg/kg和4.33μg/kg。治療周期為21天,患者在第1周期的第1天和第8天接受l-dos47治療。
患者將被招募到群組中,每群組最少三名患者,最多六名患者。在隨后的患者可以進行遞增之前,給定劑量水平的所有患者必須完成第1周期(3周的周期)。在安全性和可用的藥代動力學(pk)數據已由試驗指導委員會(tsc)審查后,將進行劑量遞增至下一劑量水平的決定。遞增l-dos47將持續,直到達到最大耐受劑量(mtd)。在第一階段確定l-dos47的mtd后,最多可以招募20名患者(從i期開始)來評估l-dos47的初步療效(即使用1.1標準版本(疾病進展和生存)的實體腫瘤反應評估標準的應答率[recist]);監測將包括每兩個周期的放射學評估。也將進一步評估l-dos47的安全性和耐受性。將收集l-dos47的藥代動力學信息以及關于其活性的相關觀察結果。
對于所有患者,使用l-dos47的治療將持續,直到患者經歷疾病進展、不可接受的毒性,患者撤回同意或已經完成了四個治療周期,并且不希望繼續進行額外的周期,以先發生者為準。四個周期后,根據研究者的意見,只要有持續的臨床益處并且耐受性好,患者可能會持續接受l-dos47。
實施例4:制備和表征用于治療非小細胞肺癌(nsclc)的駱駝科單結構域抗體-脲酶綴合物
最常用的癌癥化療藥物的有效性,受到其狹窄的治療指標和對腫瘤細胞缺乏選擇性作用的限制。抗體定向酶前藥治療(adept)通過將抗體-酶綴合物遞送到腫瘤位點來改善選擇性,其中抗體-酶綴合物在腫瘤位點與腫瘤相關抗原結合,而剩余的未結合的綴合物從血流中消除[20]。一旦抗體-酶綴合物積累,前藥被施用并且在腫瘤部位通過抗體-酶綴合物的酶部分轉化為其活性細胞毒性形式,從而實現選擇性腫瘤細胞死亡。由于adept概念是由bagshawe于1987年引入的[20-22],研究人員已經應用了這一概念的變化來開發更有效和更具有特效的抗癌藥物[22-24]。開發了不同代的半乳糖苷前藥和抗體-半乳糖苷酶綴合物,以減少全身毒性,同時增加活化藥物的細胞毒性[25]。改造人嘌呤核苷磷酸化酶的突變形式,以增強基于腺苷的前藥作為底物的特異性[26]。此外,已經開發了不同類型的免疫酶輸注蛋白,以改善酶活性和抗體親合力[27-29]。
描述了l-dos47的制備和表征,其是具有每個天然脲酶分子約10個抗體的綴合比的單結構域重組抗體與洋刀豆脲酶的化學綴合物。l-dos47免疫綴合物使用在腫瘤組織中天然豐富的尿素作為產生氨的前藥。afaikl2抗體與靶腫瘤細胞上的腫瘤相關抗原ceacam6[33]的選擇性結合導致尿素酶的積累,從而導致細胞外尿素的水解以產生細胞毒性的氨,并產生不利于癌細胞的堿性環境[34]。由于綴合物的復雜性和大小,其可以具有高達680kda的分子量,因此開發了綴合物化學、反應和分離程序以應對大規模生產中的挑戰。由于脲酶具有選擇抗體的多個潛在的綴合位點,所以使用experionsds微通道凝膠電泳系統來表征l-dos47對藥物效力至關重要的綴合比[31,32]。通過尺寸排阻色譜法測定l-dos47綴合物純度。通過質譜肽圖譜和蛋白質印跡來表征l-dos47的化學特性。由于在單結構域抗體的cdr3區域上攜帶伯胺(k32),所以通過rp-hplc和maldi質譜法測定抗體側的綴合位點的分布。還通過esi質譜法表征抗體側和脲酶側的綴合位點。通過elisa評估綴合比對l-dos47結合ceacam6的親和力的影響。進行體外研究,以確認l-dos47結合及其在表達ceacam6的癌細胞系中引起細胞毒性的能力。
開發和表征作為用于表達ceacam6的腫瘤的治療劑的免疫綴合物(l-dos47)。在大腸桿菌bl21(de3)pt7-7系統中表達靶向ceacam6的單結構域抗體afaikl2。從洋刀豆磨粉中提取和純化高純度脲酶(hpu)。使用n-琥珀酰亞胺基[4-碘乙酰基]氨基苯甲酸酯(siab)作為交聯劑來活化afaikl2,然后將其與脲酶綴合。通過改變ph值來控制活化反應和綴合反應。在這些條件下,材料比率實現每個脲酶分子8-11個抗體的綴合比,殘留的游離脲酶含量幾乎可以忽略不計(<2%),可以僅使用超濾去除未反應的抗體和水解的交聯劑制備高純度(>95%)的l-dos47綴合物。通過包括sec、iec、蛋白質印跡、elisa和lc-mse肽圖譜的一組分析技術來表征l-dos47。隨著抗體-脲酶綴合比的增加,觀察到更高的結合信號。然而,在高于每脲酶6個抗體的綴合比下,效果較不明顯。通過在三種細胞系(bxpc-3、a549和mcf7)中篩選,證實l-dos47的特異性和細胞毒性。發現bxpc-3(表達ceacam6的細胞系)對l-dos47最為敏感。正在研究l-dos47作為在人i期臨床研究中用于非小細胞肺癌(nsclc)的潛在治療劑。
制備高純度尿素酶的中間體尿素酶(以下稱為粗制尿素酶或dos47),采購自biovectrainc.(charlottetown,pecanada)。在用于綴合前,純化粗制脲酶以去除洋刀豆基質蛋白污染物(如刀豆球蛋白和伴刀豆球蛋白a)。將粗制脲酶溶解在高純度水中,并用10mm乙酸、0.2mmedta(乙酸鹽-edta緩沖液)將ph值調至5.15,然后使用硅藻土503的漿液在真空下過濾。將濾餅用10mm乙酸鈉、1mmedta、ph值5.15的緩沖液洗滌,并在真空下干燥。將含脲酶的濾液冷卻至0-4℃,并通過加入冷凍乙醇分級分離至終濃度為25%(v/v)。將混合物攪拌15分鐘,然后使用洗滌的硅藻土503在真空下過濾。將濾餅用含有25%(v/v)乙醇的乙酸鹽-edta緩沖液洗滌,然后在真空下干燥。
將濾餅重新懸浮于乙酸鹽-edta緩沖液中,并將該漿液在真空下通過硅藻土過濾以收集濾液。所得濾餅用乙酸鹽-edta緩沖液洗滌,并在真空下干燥。將洗滌濾液和初始濾液通過0.65μm小皿過濾。使用兩個sartoriussartocon100000damwco聚醚砜膜,將該乙醇分級分離的脲酶濾液濃縮至~2x,隨后緩沖液更換為乙酸鹽-edta緩沖液。
將咪唑和tcep(三羥甲基氨基甲烷(2-羧乙基)磷化氫鹽酸鹽),分別以20mm和1mm的終濃度加入到該培養基純度脲酶中,并將ph值調節至6.5。將蛋白溶液加載到用20mm咪唑、1mmtcep、ph值6.5的緩沖液(咪唑-tcep緩沖液)預平衡的deae-sepharosefastflow柱上。所有步驟以500ml/min的流速進行。該柱用咪唑-tcep緩沖液洗滌,然后用含有80mmnacl的咪唑-tcep緩沖液洗滌,以去除未結合的雜質。用含有180mmnacl的咪唑-tcep緩沖液洗脫脲酶。合并a280>0.1和sec的純度≥90-97%的級分。
使用兩個sartorioussartocon100000damwcopesu膜,將合并的級分濃縮至濃度為6-8mg/ml的目標蛋白,然后對含有10mm乙酸鈉、1mmedta、ph值6.5的乙酸鹽-edta緩沖液進行滲濾。該步驟的產率通常>起始活性的55%。表達和純化afaikl2藥物中間體,afaikl2抗體的氨基酸序列如圖5(seqidno.1)所示。
在大腸桿菌bl21(de3)pt7-7系統中表達抗體基因。將一個小瓶的主細胞庫,通過三個接種步驟無菌地接種到補充有50mg/l卡那霉素、1g/l葡萄糖、0.02g/lmgso4和0.01%biospumex消泡劑的350lluriahiveg(20g/l)試劑的500l發酵罐中。控制該過程以將溶解氧維持在>20%,溫度在37℃±2℃,背壓在5-20psi之間,ph值在7.0±0.2,od600在0.5-40之間和葡萄糖濃度在1-3g/l之間。一旦培養物達到7-10的od600,通過加入iptg至終濃度為1mm來誘導抗體表達,并允許持續6-8小時。通過離心收集細胞,洗滌并裂解以釋放包涵體,然后重懸于10倍體積的ph值6.8的50mm咪唑中。將細胞懸浮液分批均質,并將勻漿首先通過75微米不銹鋼衛生篩,然后通過最小壓力為10,000psi的微射流機總共三次,同時保持溫度低于10℃。將細胞裂解物離心,將不溶物質合并,并且在均化作用下將沉淀重新懸浮于10倍體積的含有5mmdtt的1%tritonx-100中。通過離心收集洗滌的沉淀。重復該洗滌,然后用含有5mmdtt的ph值4.0的25mm乙酸鈉洗滌二次,以除去殘留的tritonx-100,并將沉淀緩沖至ph值4。
將含有洗滌的包涵體的沉淀,重新懸浮于8m尿素、25mmdtt、125mm乙酸鈉,ph值4.0的緩沖液中,然后用ross均質器和架空混合器交替溶解,直至視覺外觀無進一步變化,然后單獨用架空混合器總共混合3小時。將溶解的包涵體離心,將澄清的上清液以550ml/min加載到sp-sepharosexl柱上,該柱用在ph值4.0的125mm乙酸鈉中的8m尿素(sp平衡緩沖液)預平衡。加載澄清的上清液后,用平衡緩沖液洗滌柱,直到洗脫液a280降低到0.05以下,然后用在有50mmnacl的ph值4.0的乙酸鈉中的8m尿素緩沖液洗滌,直到洗脫液a280降低到0.05以下。將泵速降低到275ml/min,并將3cv的含有25mm乙酸鈉、180mmnacl、ph值4.0的8m尿素緩沖液施加到柱上,以洗脫afaikl2。合并a280>0.4和a280/a260比例>1.5的級分,并分析其純度和蛋白含量。該步驟的百分產率通常為35%-45%。用sp平衡緩沖液將合并的物料稀釋至≤2.5g/l,用ph值8.0的2mtris-cl將ph值調節至8.0,加入dtt至2.5mm,并將調節池混合60分鐘以完全還原變性蛋白。然后將變性蛋白溶液在ph值8.5的含有25mmtris-cl的重折疊緩沖液中稀釋至小于0.1mg/ml的最終蛋白濃度。重新折疊在2-8℃進行,并通過ellman測定和c18反相hplc進行跟蹤,直到游離巰基的水平<0.75μm,并且僅檢測到完全氧化的蛋白。
將重折疊的蛋白溶液加載到用ph值6.8的25mm咪唑預平衡的q-sepharosexl柱上,并用平衡緩沖液洗滌柱直到a280<0.05,然后用含有50mmnacl的ph值6.8的25mm咪唑洗滌,直至a280<0.01。然后用含有150mmnacl的ph值6.8的25mm咪唑洗脫蛋白,收集級分直到a280≤0.3。合并級分以產生不低于97%純度和產率不低于45%的目標池。然后使用具有hydrosart再生纖維素5000mwco柱的uf/df系統,將池濃縮至3-5g/l,隨后與ph值7.0的10mm磷酸鹽緩沖液進行緩沖液交換并凍干。
綴合化學
分兩步進行綴合(圖6)。在第一步中,通過與siab的nhs酯部分反應來活化afaikl2上的伯胺基團。在第二步中,通過siab的碘乙酰胺末端將活化的afaik2與尿素酶上的巰基偶聯。如圖6所示,l-dos47綴合產物的合成是兩步反應。步驟1是使用siab活化抗體,步驟2涉及活化的抗體與脲酶的綴合,以形成生物綴合物l-dos47。
afaikl2抗體的活化。將凍干的afaikl2(25g)溶于注射用水(wfi)中。將siab(2.00g)溶于無水dmf中,并且以三等份加入到afaikl2溶液中,每次加入后攪拌60分鐘。在最終加入siab1小時后,通過加入超過原始添加量的siab的10×摩爾過量的甘氨酸,來終止任何剩余的未反應的nhs基團。為了除去水解的和甘氨酸猝滅的siab,使用sartorioussartocon5000damwco將反應溶液濃縮至10mg/ml的afaikl2,隨后緩沖液更換為ph值6.5的10mm乙酸鈉、1mmedta的緩沖液。
活化的抗體與脲酶的綴合。將高純度脲酶(50g)與活化的afaikl2在ph值6.5的10mm乙酸鈉、1mmedta緩沖液中混合。然后通過加入ph值8.5的1m硼酸鈉使ph值達到8.3,其允許活化的抗體上的碘乙酰基與脲酶上可用的半胱氨酸殘基反應。使反應在攪拌下進行90分鐘。然后通過加入超過原始添加量的siab的10×摩爾過量的半胱氨酸來終止未反應的碘乙酰基,并將該溶液混合60分鐘。為了除去未綴合的afaikl2,使用100000damwcosartorioussartocon,將l-dos47濃縮至6mg/ml的目標,然后緩沖液交換為ph值6.8的10mml-組氨酸、2.2mmedta的緩沖液。加入蔗糖至1%w/v的終濃度,并用ph值6.8的10mml-組氨酸、2.2mmedta緩沖液將l-dos47稀釋至為1.8g/l的目標濃度。
用于純度評估的尺寸排阻色譜法(sec)。使用有empower2軟件的具有996pad的waters2695hplc系統進行數據采集和處理。在210-400±4nm處記錄色譜圖,提取280nm的信號進行處理。在superose6100/300gl柱(ge)上進行分離。在10mm磷酸鹽、50mmnacl、0.2mmedta,ph值7.2的緩沖液中洗脫蛋白。在注射100μl純樣品后,以0.5ml/min的恒流進行分離。柱在室溫下運行,而樣品溫度控制在5±2℃。
用于殘留脲酶的離子交換色譜法(iec)。使用具有996pad和empower軟件的waters2695hplc系統。在210-400nm±4nm處采集色譜圖,提取280nm處的信號進行處理。將柱(mono-q5/50gl,ge)在室溫下運行,同時將樣品溫度控制在5±2℃。洗脫緩沖液含有50mm乙酸鹽、0.025%聚山梨酯80(超純hx2,nofcorporation,tokyo),有(緩沖液b)或無(緩沖液a)0.70mnacl,ph值5.5。在注射樣品之前,將柱用15%緩沖液b和85%緩沖液a以1ml/min流速(6cv)平衡6分鐘。洗滌周期(15%緩沖液b,以1.0ml/min進行6分鐘)后,用15-60%緩沖液b的梯度在20分鐘內以0.5ml/min流速洗脫蛋白。用100%緩沖液b以1.0ml/min清洗6分鐘后,在下一次樣品注入之前,將該柱用15%緩沖液b重新平衡。將800μl純的l-dos47樣品摻有hp脲酶參照標準品達到最終百分比為0-8%w/w,并且注入50μl/樣品。使用標準加法作為校準方法,將峰高用于計算殘留脲酶含量。
將experionsds微通道凝膠電泳用于測定綴合比。使用bioradexperion自動電泳系統和bioradsds凝膠電泳試劑盒(pro260試劑盒),分析l-dos47綴合比。將樣品用tris-hcl緩沖液(10mm,0.2mmedta,ph值7.0)稀釋至0.5mg/ml的目標蛋白濃度,然后將4μl稀釋的樣品或分子量梯子與2μl樣品緩沖液混合并短暫離心。將樣品在70℃加熱10分鐘,然后在用凝膠染色溶液引發該系統和通道之后,將樣品加載到微通道芯片上。experion軟件自動記錄電泳圖。
通過sds-page凝膠電泳來分離用于鑒定表征l-dos47測試樣品和afaikl2/hpu對照的蛋白質印跡,然后使用invitrogeniblot系統轉移到硝酸纖維素膜上。由平行運行的凝膠制成重復的印跡。需要使用兔抗-afaikl2igg一抗(rockland)的檢測和使用與堿性磷酸酶(ap)(sigma)綴合的山羊抗兔igg的二次檢測一起確認afaikl2的身份。需要使用兔抗脲酶igg一抗(rockland)的檢測和使用與ap(sigma)綴合的山羊抗兔igg的二次檢測一起確認脲酶的身份。對于使用抗afaikl2igg的檢測,將l-dos47樣品在含有0.1mg/mlbsa的1×tbs中稀釋至0.002mg/ml,然后與蛋白凝膠上樣緩沖液1:1混合,加熱至70℃持續10分鐘,每泳道加載0.01μg的l-dos47。對于使用抗-脲酶igg的檢測,將l-dos47樣品在含有0.1mg/mlbsa的1×tbs中稀釋至0.02mg/ml,然后與蛋白凝膠上樣緩沖液1:1混合,加熱至70℃持續10分鐘,每泳道加載0.1μg的l-dos47。用含有nbt/bcip的ap緩沖液進行蛋白質印跡的最終顯影。
具有不同綴合比的l-dos47的elisa
為了研究綴合比對l-dos47與其靶向抗原ceacam6結合的親和力的影響,通過調節綴合過程中的afaikl2/hpu摩爾比,在實驗室規模下產生具有不同綴合比的l-dos47綴合物。通過sds-experion測定所得綴合物的綴合比,并使用總蛋白試劑盒(sigma,tp0200)通過microlowry測定蛋白濃度。用100μl/孔的ceacam6-a(ceacam6全抗原的結構域a)(pbs中為2.5μg/ml)包被微量滴定板,并在室溫下孵育6小時。將平板用緩沖液a(pbs中的0.05%bsa)洗滌兩次,用150μl/孔的3%bsa/pbs于4℃封閉過夜,然后用緩沖液a洗滌兩次。所有后續步驟在室溫下進行,伴有輕輕搖動。加入l-dos47(100μl/孔)并孵育2小時,將平板用緩沖液a洗滌3次,然后加入100μl/孔的抗-脲酶igg(1:12000,rockland)并孵育1小時。用緩沖液a洗滌三次后,加入100μl/孔的山羊抗-兔igg-ap(1:6000,sigma)并孵育1小時。用緩沖液a洗滌三次后,加入100μl/孔的ap底物溶液,并孵育25分鐘。在405nm處測定吸光度。
確定afaikl2抗體上的活化位點
為了制備熒光素標記的半胱氨酸(cys-fl),將半胱氨酸過量與nhs-酯熒光素(pierce)在1m硼酸鹽(ph值8.0)中于室溫下反應60分鐘。通過rp-hplc用c8柱分離反應溶液。通過maldi質譜法鑒定cys-fl峰級分,并根據其在493nm和ph值7下的消光系數通過光譜法確定其濃度。將峰級分等分試樣凍干,并在-20℃的黑暗中儲存。首先用siab交聯劑在實驗室規模活化afaikl2抗體,并通過內部制備的g25脫鹽柱除去水解的siab。使活化的抗體與熒光素標記的半胱氨酸(cys-fl)在ph值8.3的100mm硼酸緩沖液中于室溫下反應90分鐘。通過g25脫鹽柱將反應溶液與30mm碳酸氫銨緩沖液交換,將得到的afaikl2-cys-fl在含有20%乙腈的30mm碳酸氫銨中稀釋至0.5-0.8mg/ml。加入胰蛋白酶(promega)達到20:1的最終蛋白與胰蛋白酶的比例,并在37℃進行消化36小時。通過加入0.1mtcep將胰蛋白酶消化物還原至2mm的終濃度,然后通過反相hplc分離(具有zobax300sb-c18柱(5μm,4.6x150mm)的agilent1100系統,在55分鐘內從0至45%的乙腈的梯度、0.025%tfa),并在420nm處記錄吸收。因為afaikl2上的siab活化的賴氨酸與熒光素標記的半胱氨酸連接,所以不可能被胰蛋白酶接近,并且應該產生肽(xnkxm)-cys-fl。收集含有熒光素修飾肽的峰級分,并應用反射模式(micromasstof2e)的maldi-質譜。使用相應肽的hplc峰面積來計算每個活化位點的分布百分比。
通過esi質譜法進行綴合肽的肽作圖和鑒定。使用watersxevog2qtof質譜儀和具有beh300c18柱(1.7μm,2.1x150mm)的acquineuplc系統h級。將每個l-dos47樣品(1.5-2.0mg/ml,50.0μl)與0.063±0.003g胍-hcl混合。該鹽完全溶解后,加入1.50μl的0.7mdtt并將溶液在60℃下孵育30分鐘。加入10.0μl的0.20m碘乙酰胺(iaa),并用飽和的tris-base溶液將ph值調至8.0-8.5。將樣品在37℃下孵育60分鐘。將50.0μl每個烷基化樣品與15.0μl的0.1mcacl2和80.0μl的tris緩沖液(50mmtris-hcl,ph值8.0)混合,然后加入3.00μl的0.5mg/ml胰蛋白酶溶液。在37℃進行胰蛋白酶消化20-24小時。經胰蛋白酶消化后,將50.0μl消化物與0.50μl純甲酸混合,以用于lc-ms分析。將柱溫度設定為60℃,并將溶劑a(在水中的0.075%v/v甲酸)和溶劑b(在乙腈中的0.075%甲酸)用于uplc分離。以0.15ml/min的流速,在80分鐘內從0至55%溶劑b的梯度進行uplc。
由masslynxv4.1軟件控制lc-ms分析。在50-2000da的m/z范圍內以分辨率模式進行lc-msetic(總離子計數)數據采集,掃描速率為0.3/s,毛細管電壓為3.0kv,樣品錐電壓為25v,提取錐電壓為4.0kv。隨著碰撞能量從20v增加至40v,進行高能碰撞誘導的碎片tic數據采集。離子源溫度設定在100℃,去溶劑化溫度設定在300℃。去溶劑氣流量為600l/小時。用100fmole/μlglu-fibb以3.0μl/分鐘的流速獲得實時鎖定質量tic原始數據集(掃描/20s)。
在分辨率為20000的肽圖模式下,用biopharmalynx(v1.2)處理質譜原始數據。應用785.8426da的鎖定質量,進行實時點對點質量校準。低能ms離子強度閾值設定在3000個計數,而mse高能離子強度閾值設定為300個計數。將ms數據集和mse數據集的質量匹配公差設置為15ppm。將afaikl2氨基酸序列和脲酶氨基酸序列輸入到肽匹配/鑒定的序列文庫中。將可變修飾劑(包括脫酰胺n、脫酰胺琥珀酰亞胺n、氧化m、氧化2xm、+k、+na和氨基甲酰甲基c(用于烷基化半胱氨酸)的固定修飾劑)用于肽圖分析。為了鑒定afaikl2側的綴合肽,將脲酶的含半胱氨酸肽加上交聯劑siab(c9h7o2n,161.0477da)的連接部分作為可變修飾劑產生,并被包含在可變修飾劑庫中。在這種情況下,包括氨基甲酰甲基c作為可變修飾劑。為了鑒定脲酶側的綴合肽,將afaikl2的賴氨酸中間肽xnkxm加上siab的連接部分作為可變修飾劑產生,并被包含在可變修飾劑庫中。
l-dos47的全細胞結合測定
通過在96孔培養板中接種100μl/孔的mcf-7細胞、bxpc-3細胞和a549細胞(4×104細胞/孔)并在37℃孵育過夜來制備細胞單層。然后從平板中去除培養基,并在室溫(rt)下用100μl/孔的在pbs中的0.05%戊二醛將細胞單層固定10分鐘。然后用pbs洗滌平板,并加入120μl/孔的50mm甘氨酸。在37℃下孵育20分鐘后,將平板用120μl/孔的1%bsa/pbs在37℃封閉30分鐘。然后將平板用緩沖液a(pbs中0.05%bsa)洗滌3次,加入80μl/孔的稀釋的l-dos47或dos47,并在37℃下孵育1.5小時。將平板用緩沖液a洗滌4次,加入在ph值7.6、0.1mpbs中的80μl/孔的20mm尿素,并在37℃下孵育30分鐘。孵育后,加入40μl/孔的1nhcl以停止反應。使用改進的靛酚測定法測定每個孔中產生的氨的量。簡言之,通過將165mg苯酚和132mgnaoh溶解在10ml水中,然后加入66μl硝普鈉溶液(10mg/ml)制備新鮮的溶液a。通過向5ml水中加入40μl次氯酸鈉制備溶液b。將來自全細胞結合測定的樣品溶液(每個30μl),轉移到含有50μl/孔的5nnaoh:h2o(3.3:46.7)和20μl/孔水的新的96孔板中。加入溶液a(50μl/孔)和溶液b(50μl/孔),然后將平板轉移到酶標儀上,在37℃顯色30分鐘。在630nm處測量od值。使用0至150mm氯化銨作為標準品,從校準曲線計算在所述孔中產生的氨的量。
l-dos47的細胞毒性測定。通過在96孔培養板中接種100μl/孔的mcf-7細胞、bxpc-3細胞和a549細胞(4×104個細胞/孔)并在37℃下孵育過夜來制備細胞單層。然后從平板中去除培養基,加入80μl/孔的稀釋的l-dos47或dos47,并在37℃下進一步孵育2小時。孵育后,將平板用kr-ii緩沖液/0.05%bsa洗滌3次,并加入100μl/孔的20mm尿素溶液。將平板在37℃下孵育過夜,然后去除培養基并用100μl/孔普通培養基替換。使用mts細胞活力測定法測定細胞活力,其中制備21:1v/v的mts/pes(mts:2mg/ml;pes:1mg/ml)的溶液,并將20μl/孔的混合物加入平板中。然后將平板在37℃下孵育1小時,并在6300nm處測量od值,參考490nm處的od值。
洋刀豆脲酶是由六個相同的約91kda的亞基組成的六聚酶,每個亞基具有15個游離的半胱氨酸殘基。afaikl2抗體含有7個伯胺和一個二硫鍵。抗體上的伯胺和脲酶上的半胱氨酸殘基是通過異雙功能交聯劑進行化學綴合的基礎。然而,綴合物的分子大小和兩種蛋白的性質在綴合產物的大規模制備、純化和表征方面造成了挑戰。用作腸胃外藥物時,該免疫綴合物在生理ph附近的水性介質中必須是可溶的和穩定的;因此,重組抗體的等電點(pi)需要仔細的序列設計,因為脲酶是從植物來源提取的并且其pi(觀察到的pi為4.8-5.1)不能被改變。優化以確保反應均勻性并去除殘留反應物和副產物對綴合化學至關重要。雖然幾種交聯劑[24,30]被廣泛用于蛋白綴合并且在開發過程中進行篩選,但是由于兩個交聯反應最適ph值的差異,選擇n-琥珀酰亞胺基[4-碘乙酰基]氨基苯甲酸酯(siab)用于l-dos47綴合物制備。在制備過程中,在ph值7.0時用交聯劑活化抗體,然后緩沖交換至ph值6.5并與脲酶混合。然后通過將反應介質的ph值升高至8.3,將抗體與脲酶連接。因為連接活化的afaikl2與脲酶的反應速率在ph值6.5時非常低,通過在ph值6.5下預混合來確保大反應容器中的材料均勻性。因此,殘留游離脲酶的分布和脲酶-(ab)x的亞種類僅由概率和物質摩爾比決定。在8-11抗體/脲酶的綴合比下,殘留脲酶含量理論上可以忽略,并且可以使用超濾法純化l-dos47綴合物以除去未反應的抗體和水解的交聯劑。l-dos47綴合物、游離afaikl2和游離脲酶的大小排阻色譜圖,如圖7所示。
l-dos47綴合物在~24.6分鐘時洗脫,二聚體(可能通過二硫鍵連接或被以兩個siab活化的afaikl2分子連接)在20.5分鐘時作為小的未分離峰洗脫,并且聚合物在空白時間(~15分鐘)作為痕量峰值洗脫。在~40分鐘的痕量峰代表緩沖液成分。l-dos47綴合峰寬度稍大于但是與游離尿素酶的峰寬相當,表現出均勻分布的綴合反應。游離抗體在37分鐘時洗脫。抗體峰前面的小的未分離峰代表非共價二聚體。通常在制備批次中觀察到高純度的抗體(>95%),其高分子量物質種類包括不超過5%的二聚體。hpu通常在~26.9分鐘時洗脫主峰,在24分鐘時洗脫小二聚體峰和在15分鐘時洗脫痕量聚合物峰。將粗制脲酶純化為hpu產生~97%的單體,而二聚體和聚合物的總和不超過3%。通常僅使用超濾進行簡單純化即可達到95%以上的l-dos47純度。因為sec在天然條件下運行,它可以確定由于蛋白四級結構的降解和解離而導致的有效分子量的變化;因此,該方法也用作l-dos47的穩定性指示試驗。使用離子交換色譜法評估l-dos47中殘留游離脲酶的存在(圖8)。
殘留游離脲酶在15.33分鐘時洗脫,這非常接近摻入的脲酶峰(15.42分鐘)。hpu峰從大型l-dos47峰(1.48的rs)得到很好的分離。如圖8的插圖所示,測定殘留脲酶含量的標準添加方法(摻有2.4%、4.8%和7.2%w/whpu的l-dos47),顯示出良好的線性(0.9995的r2)。該樣品計算的殘留脲酶含量為0.72%,并且殘留脲酶在迄今為止的所有制備批次中都沒有超過2%,證明在這些條件下殘留脲酶實際上可以忽略不計,并且制備過程不需要額外的步驟以從非綴合的脲酶中分離l-dos47綴合物。
在l-dos47制備期間,六個單體脲酶亞單位中的每一個可以與0個、1個、2個、3個或4個afaikl2分子綴合;因此,在變性條件下,l-dos47的sds-experion產生從~90-155kda的多個離散峰/帶的圖案。另外,在抗體活化反應期間,可以用每個抗體分子(afaikl2-(siab)2)的兩個siab隨機活化一小部分抗體,這導致這些抗體分子中的每一個與脲酶的兩個亞單位綴合。因此,單抗體雙亞基會產生范圍從200-260kda較小的第二組未良好分離的峰/條帶。
在圖9中,圖塊2描繪了虛擬凝膠圖像,圖塊1包含了泳道1和4的電泳圖的疊加。泳道1-2和7-8中的l-dos47實驗室規模樣品是用在第二綴合反應之前通過離子交換色譜法純化的活化的afaikl2制備的。因為去除了afaikl2-(siab)2種類,所得到的綴合物缺少相互交聯的亞基,并且僅觀察到一組峰/帶。在第3-6泳道的l-dos47樣品中,afaikl2在活化步驟后無需另外純化而直接用于綴合,因此存在小的第二組峰/帶。泳道9和10用hpu樣品過載。
峰面積(圖9,圖塊1)和帶強度(圖9,圖塊2)取決于與相應數量的抗體分子連接的脲酶亞基的相對豐度。峰面積在基線校正后通過軟件積分,并且l-dos47綴合比(cr)計算如下(參見圖10,來自圖9的凝膠的泳道2的示意圖):
cr=6*(pk1*0+pk2*1+pk3*2+pk4*3+pk5*4)/(pk1+pk2+pk3+pk4+pk5)
其中pki(i=1-5)是與i-1抗體分子連接的脲酶亞單位的峰面積。
因為在大規模制備l-dos47期間,活化的抗體不進行離子交換色譜純化,所以在這些樣品的電泳圖中出現第二組未良好分離的峰。然而,因為活化位點分布由概率和抗體與siab的摩爾比確定,兩組峰預期具有相似的強度模式。因為條帶未良好分離并與260kda分子量標記物重疊,因此第二組峰不用于計算綴合比。雖然afaikl2-(siab)2種類理論上可以通過連接到來自不同天然脲酶分子的兩個亞基來產生二聚體綴合物或多聚體綴合物,但在l-dos47樣品尺寸排阻色譜圖中觀察到的組合的二聚體和多聚體峰面積的最小水平(小于3%)(圖7)表明,大多數afaikl2-(siab)2種類有助于單個天然脲酶分子的亞基間連接以產生單體l-dos47,而不是分子間連接以產生二聚體綴合物和多聚體綴合物。此外,sec色譜圖中這些二聚體峰和多聚體峰的存在可以在邏輯上歸因于二硫鍵,因為類似的峰也出現在hp脲酶的尺寸排阻色譜圖中。因此,電泳圖中的第二組峰不用作質量控制的參數。
l-dos47的綴合比對于其對ceacam6(抗體所靶向的腫瘤抗原)的親和力至關重要。通過調節afaikl2/hp脲酶摩爾比來產生具有不同綴合比(每個脲酶1.8至12個afaik)的l-dos47,以評估綴合比對結合親和力的影響。發現l-dos47對固定化ceacam6-a的結合親和力,與綴合到脲酶的抗體數量直接成正比(圖11)。綴合的抗體越多,觀察到結合信號越高。然而,綴合比為6以上時效果較差。
通過雙重蛋白質印跡分析l-dos47(圖12),證實了通過sds-experion看到的條帶圖案。插圖框顯示了主要印跡的加框區域的放大,其中脲酶和綴合物(n1-n4分別對應于具有1至4個綴合的afaikl2的脲酶)被標記。當用抗脲酶抗體探測時,91kda脲酶帶是最強烈可見的,并且較高分子量帶(對應于更高度綴合的種類)的強度降低。相比之下,當用抗afaikl2抗體探測時,91kda條帶幾乎不可見,接下來的兩個較高分子量條帶是最強烈的(n1和n2)。這是由于它們是綴合物中的優勢帶的事實。通過抗-afaikl2和抗-脲酶抗體兩者可以顯現l-dos47的能力,證明了綴合物中兩個種類都存在,抗體的特異性通過以下事實證實:抗-afaikl2抗體不與脲酶結合,抗-脲酶抗體不與afaikl2結合。
因為l-dos47是afaikl2和脲酶的化學綴合物,所以應該從綴合物的胰蛋白酶消化物中檢測來自抗體和脲酶的胰蛋白酶肽以及兩種蛋白的共價交聯的肽。進行esilc-mse肽作圖以表征該綴合物。如相關內容所示,來自afaikl2的肽出現在l-dos47譜中,但不在hp脲酶譜中。從l-dos47的胰蛋白酶消化物中,afaikl2的氨基酸序列和脲酶氨基酸序列的肽覆蓋率為100%,典型質量誤差小于6ppm,并且通過具有小于±15ppm質量誤差的其高能ms/msb/y碎片離子確認每種肽。
為了鑒定afaikl2的活化位點并確定每個綴合位點的分布,使用siab活化afaikl2,然后綴合到熒光素標記的半胱氨酸(cys-fl)上。在胰蛋白酶消化所得afaikl2-cys-fl后,通過rp-hplc色譜進行分離,收集峰級分用于maldi-ms,以鑒定cys-fl連接的抗體胰蛋白酶肽。因為只有siab活化的位點可以連接到cys-熒光素,其中0.025%tfa中的最大吸收波長為420nm,所以在420nm處應該僅檢測到活化的肽峰。例如,如果afaikl2的賴氨酸#32被siab活化,則應該連接到cys-fl,并且在胰蛋白酶消化期間將會漏掉該胰蛋白酶消化位點;因此,應該觀察到分子量為2768.113da的峰,其代表cys-fl連接的賴氨酸中間肽(lscaahdpifdk32nlmgwg)-cys-fl(seqidno:7),表示為l2k32-cys-fl。afaikl2-cys-fl的胰蛋白酶消化物的rp-hplc色譜圖,如圖13所示。
具有檢測到的質量值的鑒定的綴合肽,也在圖13中的相應hplc峰處標記。根據抗體的氨基酸序列,來自六個賴氨酸殘基的伯胺和n-末端胺在理論上可用用于活化反應。然而,實際上只有四個被活化了。這最有可能是由于抗體的三級結構暴露了表面上的那些四個伯胺,同時將其他伯胺埋在天然結構內部。根據其峰面積和圖13中所有確定的hplc峰面積的總和,計算每個活化位點的分布(表4)。
表4.afaikl2上每個活化位點的hplc峰面積和分布百分比
如表4所示,對于交聯劑,抗體的最活躍位點是l2k76,其次是l2m1,然后是l2k44。l2k32對于抗體結合是必不可少的,也是最不活躍的位點,但仍占總反應性的~18%。對于l-dos47,交聯劑活化的afaikl2與暴露于脲酶四級結構表面的半胱氨酸殘基共價連接。因此,應該從l-dos47的胰蛋白酶消化物的肽譜中檢測共價交聯的肽。
為了鑒定那些共價交聯的肽,通過biopharmalynx處理來自l-dos47樣品的胰蛋白酶消化物的esilc-mse原始數據,但用含有用于脲酶側的所有15個半胱氨酸殘基的一組用戶創建的修飾劑的可變修飾劑庫進行搜索。根據表4中的活化分布,這些用戶創建的修飾劑是三種賴氨酸中間肽加上siab的連接部分(c9h5o2n,159.0320da)(表示為l2k76、l2k44和l2k32),以及n-末端甲硫氨酸加上連接(表示為l2m1)。結果(相關內容的細節)證明,在每個脲酶亞基的15個半胱氨酸殘基中,僅6個是基本上綴合的。最容易獲得的半胱氨酸是uc824,其次是uc663、uc59、uc207、uc329和uc268。脲酶活性必不可少的半胱氨酸殘基cys592是基本上不綴合的。四個交聯劑活化的afaikl2位點對脲酶側的六個半胱氨酸殘基中每一個的相對可用性也是不同的。例如,uc329只能接近l2m1。這些基本的綴合位點也通過其ms/ms片段譜確認。作為實例,通過將綴合肽l2k32uc663作為用來自afaikl2側的(lscaahdpifdknlmgwgr(seqidno:8))-連接-(2346.0674da)作為修飾劑來修飾的脲酶肽(seqidno:9)cdssdndnfr進行搜索,以2.1ppm的質量匹配誤差鑒定綴合肽l2k32uc663,其序列為(lscaahdpifdknlmgwgr(seqidno:8)-連接-(cdssdndnfr(seqidno:9),并且具有3517.4873的肽質量。通過將肽作為用來自脲酶側的連接-(cdssdndnfr(seqidno:9))(1330.4520da)作為修飾劑來修飾的afaikl2肽lscaahdpifdknlmgwgr(seqidno:8)進行搜索,以2.1ppm的質量匹配誤差還鑒定了同樣的肽。通過將綴合肽作為用來自afaikl2側的修飾劑來修飾的脲酶肽進行搜索,繪制了具有來自脲酶側的9個b/y片段離子的該綴合肽的高能量碰撞誘導的ms/ms光譜。通過將肽作為具有用來自脲酶側的修飾劑的afaikl2肽進行搜索,還繪制了從afaikl2側具有14個b/y離子的同樣的光譜。
在bxpc-3細胞系、a549細胞系和mcf7細胞系中,觀察到不同的l-dos47結合分布圖(圖14)。結果顯示,l-dos47與胰腺細胞系bxpc-3結合良好,表明在細胞表面表達了ceacam6抗原。在肺細胞系a549中觀察到中等結合,但在乳腺細胞系mcf7中沒有發現結合。當與脲酶(dos47)綴合時,afaikl2抗體提供了針對表達ceacam6的細胞的特異性靶向。這是通過用非綴合的dos47對照處理的三種細胞系中沒有結合信號證實的。
bxpc-3細胞對l-dos47細胞毒性非常敏感(圖15),如用小于1μg/ml的l-dos47處理細胞時,觀察到的細胞存活的快速下降所示。在a549細胞中觀察到中度細胞毒性,而在mcf7中沒有觀察到作用,與結合研究的結果一致。此外,陰性對照dos47對任何細胞系都沒有細胞毒性作用。
在其大規模制備中成功應用了開發用于l-dos47免疫綴合物的綴合和純化的方法。使用已建立的綴合化學和反應條件,通過將交聯劑活化的抗體與hp脲酶中間體預混合,然后調節ph值以活化綴合反應,實現了良好的均勻性。在每個脲酶分子8-11個抗體的綴合比下,殘留的脲酶含量幾乎可以忽略不計,并且可以僅使用超濾法純化l-dos47綴合物以除去未反應的抗體和水解的交聯劑,并且避免了從最終免疫綴合物分離殘留脲酶的挑戰步驟。該方法產生高純度的l-dos47產物(>95%),游離脲酶低于2%。通過elisa評估l-dos47對固定化ceacam6-a的結合親和力,與綴合脲酶的抗體數目直接成正比,并且當綴合比大于6時結合親和力達到平衡。對所有大規模批量,綴合比具有每個脲酶分子9至11個抗體的范圍,證明在這些條件下已經實現最佳綴合。雙抗體蛋白質印跡分析證實了該綴合物的化學特性。esilc-mse肽圖譜分析獲得了來自l-dos47免疫綴合物的抗體和脲酶的100%序列回收率。通過相應肽的ms/msb/y片段圖譜證實了包括afaikl2和脲酶的c末端序列和n末端序列的具有多于3個氨基酸殘基的肽序列。通過l-dos47樣品的esilc-mse肽圖譜分析,鑒定了有效綴合位點(afaikl2側4個,脲酶側6個)。通過來自抗體側和脲酶側的相關肽的ms/msb/y片段圖譜,證實了這些交聯肽。
通過與抗體綴合的l-dos47的對應物相對的dos47不存在結合活性和細胞毒活性,闡明了l-dos47對表達ceacam6的兩種細胞系bxpc-3和a549的特異性。在測試的三種細胞系中,bxpc-3顯示出最強的結合信號,而a549僅顯示中度結合。bxpc-3的結合信號約為a549的結合信號的5倍。該結果與細胞毒性測定中觀察到的結果一致。l-dos47誘導了對bxpc-3明顯高于對a549的細胞殺傷作用。由于缺乏l-dos47結合,在mcf-7中沒有觀察到細胞毒性應答。正在研究l-dos47作為用于非小細胞肺癌人類i期臨床研究中的潛在治療劑。
應當理解,雖然已經結合上述方面描述了本公開,但是前述描述和實施例旨在說明而不是限制本公開的范圍。在本公開的范圍內的其他方面、優點和修改對于本公開所屬領域的技術人員將是顯而易見的。
本公開的范圍不應受所描述的具體方面的限制,這些具體方面旨在作為本公開的各個方面的單一說明,并且在功能上等同的任何組合物或方法都在本公開的范圍內。對于本領域技術人員顯而易見的是,在不脫離本公開的精神或范圍的情況下,可以在本公開的方法和組合中進行各種修改和變化。因此,本公開旨在覆蓋該公開的修改和變化,只要它們在所附權利要求及其等同物的范圍內。
在本說明書中提及的所有出版物和專利申請通過引用并入本文,其程度如同每個單獨的出版物或專利申請被具體和單獨地指明通過引用并入。
參考文獻
1.stubbsm,mcsheehypmj,griffithsjr,etal.causesandconsequencesoftumoracidityandimplicationsfortreatment.molmedtoday2000;6:15-9.
2.raghunandn,gilliesrj.phandchemotherapy.in:goodeja,chadwickdj,eds.thetumormicroenvironment:causesandconsequencesofhypoxiaandacidity.chichester:johnwiley&sonsltd.2001;199-211.
3.schornackpa,gilliesrj.contributionsofcellmetabolismandh+diffusiontotheacidicphoftumors.neoplasia2003;5:135-45.
4.helmlingerg,sckella,dellianm,etal.acidproductioninglycolysis-impairedtumorsprovidesnewinsightsintotumormetabolism.clincancerres2002;8:1284-91.
5.izumih,torigoet,ishiguchih,etal.cellularphregulators:potentiallypromisingmoleculartargetsforcancerchemotherapy2003;29:541-9.
6.robeyif,baggettbk,kirkpatricknd,etal.bicarbonateincreasestumorphandinhibitsspontaneousmetastases.cancerres2009;69:2260-8.
7.mahoneybp,raghunandn,baggettb,etal.tumoracidity,iontrappingandchemotherapeuticsi.acidphaffectsthedistributionofchemotherapeuticagentsinvitro.biochempharmacol2003;66:1207-18.
8.wongwy,delucaci,tianb,etal.urease-inducedalkalinizationofextracellularphanditsantitumoractivityinhumanbreastandlungcancers.jexptheroncol2005;5:93-9.
9.teicherba,charirvj.antibodyconjugatetherapeutics:challengesandpotential.clincancerres2011;17:6389-97.
10.xug,mcleodhl.strategiesforenzyme/prodrugcancertherapy.clincancerres2001;7:3314-24.
11.kuespertk1,pilss,hauckcr.ceacams:theirroleinphysiologyandpathophysiology.curropincellbiol2006;18:565-71.
12.pavlopouloua,scorilasa.acomprehensivephylogeneticandstructuralanalysisofthecarcinoembryonicantigen(cea)genefamily.genomebiolevol2014;6:1314–26.
13.blumenthalrd,hansenhj,goldenbergdm.inhibitionofadhesion,invasion,andmetastasisbyantibodiestargetingceacam6(nca-90)andceacam5(carcinoembryonicantigen).cancerres2005;65:8809-17.
14.baraltn,murady,nguyentd,etal.isolationoffunctionalsingledomainantibodybywholecellimmunization:implicationsforcancertreatment.jimmunolmethods2011;371:70-80.
15.stricklandla,rossj,williamss,etal.preclinicalevaluationofcarcinoembryoniccelladhesionmolecule(ceacam)6aspotentialtherapytargetforpancreaticadenocarcinoma.jpathol2009;218:380-390.
16.duxburyms,matrose,itoh,etal.systemicsirna-mediatedgenesilencing:anewapproachtotargetedtherapyofcancer.annalsofsurgery2004;240:667-76.
17.zhangj,liq,nguyentd,etal.apentavalentsingle-domainantibodyapproachtotumorantigendiscoveryandthedevelopmentofnovelproteomicsreagents.jmolbiol2004;341:161-9.
18.weatherburnmw.phenol-hypochloritereactionfordeterminationofammonia.analchem1967;39:971-4.
19.ohwadaa,yoshiokay,iwabuchik,etal.vegfregulatestheproliferationofacid-exposedalveolarliningepithelialcells.thorax2003;58:328-32.
20.napier,m.p.etal.,(2000)antibody-directedenzymeprodrugtherapy:efficacyandmechanismofactionincolorectalcarcinoma1.clinicalcancerresearch6,765-772.
21.bagshawe,k.d.(1987)antibodydirectedenzymesreviveanti-cancerprodrugsconcept.br.j.cancer56,531–532.
22.bagshawek.d.(2006)antibody-directedenzymeprodrugtherapy(adept)ofcancer.expertrevanticancerther6,1421–1431.
23.tietze,l.f.andfeuerstein,t.(2003)enzymeandproton-activatedprodrugsforaselectivecancertherapy.curr.pharm.des.9,2155–2175.
24.denny,w.a.(2004)tumor-activatedprodrugs-anewapproachtocancertherapy.cancerinvest.22,604–619.
25.pasquettom.v.,vecchia,l.,covini,d.,digilio,r.,andscotti,c.,(2011)targeteddrugdeliveryusingimmunoconjugates:principlesandapplicationsjournalofimmunother34,611–628.
26.tietze,l.f.,andkrewer,b.(2009)antibody-directedenzymeprodrugtherapy:apromisingapproachforaselectivetreatmentofcancerbasedonprodrugsandmonoclonalantibodies.chembioldrugdes74,205–211.
27.afshar,s.,asai.t.,andmorrison,s.l.(2009)humanizedadeptcomprisedofanengineeredhumanpurinenucleosidephosphorylaseandatumortargetingpeptidefortreatmentofcancer.molcancerther2009,81-9.
28.afshar,s.,olafsen,t.,wua.m.,andmorrison,s.l.,(2009)characterizationofanengineeredhumanpurinenucleosidephosphorylasefusedtoananti-her2/neusinglechainfvforuseinadept.jexpclincancerres28:147.
29.aldersonr.a.,toki,b.e.,roberge,m.,geng,w.,basler,j.,chin,r.,liu,a.,ueda,r.,hodges,d.,escandon,e.,chen,t.,kanavarioti,t.,babé,l.,senter,p.d.,fox,j.a.,schellenberger,v.,(2006)characterizationofacc49-basedsingle-chainfragment-
30.http://www.piercenet.com/method/crosslinking-applications
31.kim,j.h.,kim,y-w.,kim,i-w.,park,d.c.,kim,y.w.,lee,k-h.,jang,c.k.,ahn,w.s.,(2013)identificationofcandidatebiomarkersusingtheexperiontmautomatedelectrophoresissysteminserumsamplesfromovariancancerpatients.internationaljournalofoncology42940,1257-1262.
32.chan,o.t.m.,andherold,d.a.,(2009)chipelectrophoresisasamethodforquantifyingtotalalbuminincerebrospinalfluid.journaloftheassociationforlaboratoryautomation14,6-11.
33.zhang,j.,li,q.,nguyen,t.d.,tremblay,t-l.,stone,e.,to,r.,kelly,j.,andmackenzie,c.r.,(2004)apentavalentsingle-domainantibodyapproachtotumorantigendiscoveryandthedevelopmentofnovelproteomicsreagents.jmolbiol41161-1699.
34.wong,w.y.,deluca,c.i.,tian,b.,wilson,i.,molund,s.,warriar,n.,govindan,m.v.,sega,ld.,andchao,h.,(2005)urease-inducedalkalinizationofextracellularphanditsantitumoractivityinhumanbreastandlungcancers.jexptheroncol5,93-9.
序列表
<110>赫利克斯生物藥品公司
<120>用于治療目的的抗體-脲酶綴合物
<130>105013-1610
<140>
<141>
<150>62/107,210
<151>2015-01-23
<160>9
<170>patentinversion3.5
<210>1
<211>122
<212>prt
<213>人工序列
<220>
<223>人工序列描述:合成多肽
<400>1
metaspvalglnleuglnalaserglyglyglyvalvalglnprogly
151015
glyserleuargleusercysalaalahisaspproilepheasplys
202530
asnleumetglytrpglyargglnalaproglylysglnargglutyr
354045
valalathrileserglyserglyglythrasntyralaserserval
505560
gluglyargphethrileserargaspasnalalyslysthrvaltyr
65707580
leuglnmetasnaspleulysprogluaspthralavaltyrtyrcys
859095
asnseralaphealailetrpglyglnglythrglnvalthrvalser
100105110
serglyglyglyglugluaspaspglylys
115120
<210>2
<211>840
<212>prt
<213>洋刀豆(canavaliaensiformis)
<400>2
metlysleuserproarggluvalglulysleuglyleuhisasnala
151015
glytyrleualaglnlysargleualaargglyvalargleuasntyr
202530
thrglualavalalaleuilealaserglnilemetglutyralaarg
354045
aspglyglulysthrvalalaglnleumetcysleuglyglnhisleu
505560
leuglyargargglnvalleuproalavalprohisleuleuasnala
65707580
valglnvalglualathrpheproaspglythrlysleuvalthrval
859095
hisaspproileserarggluasnglygluleuglnglualaleuphe
100105110
glyserleuleuprovalproserleuasplysphealagluthrlys
115120125
gluaspasnargileproglygluileleucysgluaspglucysleu
130135140
thrleuasnileglyarglysalavalileleulysvalthrserlys
145150155160
glyaspargproileglnvalglyserhistyrhispheilegluval
165170175
asnprotyrleuthrpheaspargarglysalatyrglymetargleu
180185190
asnilealaalaglythralavalargphegluproglyaspcyslys
195200205
servalthrleuvalserilegluglyasnlysvalileargglygly
210215220
asnalailealaaspglyprovalasngluthrasnleuglualaala
225230235240
methisalavalargserlysglypheglyhisglugluglulysasp
245250255
alasergluglyphethrlysgluaspproasncyspropheasnthr
260265270
pheilehisarglysglutyralaasnlystyrglyprothrthrgly
275280285
asplysileargleuglyaspthrasnleuleualagluileglulys
290295300
asptyralaleutyrglyaspglucysvalpheglyglyglylysval
305310315320
ileargaspglymetglyglnsercysglyhisproproalaileser
325330335
leuaspthrvalilethrasnalavalileileasptyrthrglyile
340345350
ilelysalaaspileglyilelysaspglyleuilealaserilegly
355360365
lysalaglyasnproaspilemetasnglyvalpheserasnmetile
370375380
ileglyalaasnthrgluvalilealaglygluglyleuilevalthr
385390395400
alaglyalaileaspcyshisvalhistyrilecysproglnleuval
405410415
tyrglualaileserserglyilethrthrleuvalglyglyglythr
420425430
glyproalaalaglythrargalathrthrcysthrproserprothr
435440445
glnmetargleumetleuglnserthraspaspleuproleuasnphe
450455460
glyphethrglylysglyserserserlysproaspgluleuhisglu
465470475480
ileilelysalaglyalametglyleulysleuhisgluasptrpgly
485490495
serthrproalaalaileaspasncysleuthrilealagluhishis
500505510
aspileglnileasnilehisthraspthrleuasnglualaglyphe
515520525
valgluhisserilealaalaphelysglyargthrilehisthrtyr
530535540
hissergluglyalaglyglyglyhisalaproaspileilelysval
545550555560
cysglyilelysasnvalleuproserserthrasnprothrargpro
565570575
leuthrserasnthrileaspgluhisleuaspmetleumetvalcys
580585590
hishisleuasparggluileprogluaspleualaphealahisser
595600605
argilearglyslysthrilealaalagluaspvalleuasnaspile
610615620
glyalaileserileileserseraspserglnalametglyargval
625630635640
glygluvalileserargthrtrpglnthralaasplysmetlysala
645650655
glnthrglyproleulyscysaspserseraspasnaspasnphearg
660665670
ileargargtyrilealalystyrthrileasnproalailealaasn
675680685
glypheserglntyrvalglyservalgluvalglylysleualaasp
690695700
leuvalmettrplysproserphepheglythrlysproglumetval
705710715720
ilelysglyglymetvalalatrpalaaspileglyaspproasnala
725730735
serileprothrprogluprovallysmetargpromettyrglythr
740745750
leuglylysalaglyglyalaleuserilealaphevalserlysala
755760765
alaleuaspglnargvalasnvalleutyrglyleuasnlysargval
770775780
glualavalserasnvalarglysleuthrlysleuaspmetlysleu
785790795800
asnaspalaleuprogluilethrvalaspproglusertyrthrval
805810815
lysalaaspglylysleuleucysvalserglualathrthrvalpro
820825830
leuserargasntyrpheleuphe
835840
<210>3
<211>50
<212>prt
<213>人工序列
<220>
<223>人工序列描述:合成多肽
<400>3
ileglnasnproalaseralaasnargseraspprovalthrleuasn
151015
valleutyrglyproaspglyprothrileserproserlysalaasn
202530
tyrargproglygluasnleuasnleusercyshisalaalaserasn
354045
propro
50
<210>4
<211>12
<212>prt
<213>人工序列
<220>
<223>人工序列描述:合成多肽
<400>4
gluileglnasnproalaseralaasnargserasp
1510
<210>5
<211>29
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成寡核苷酸
<400>5
aaggcgaaagagtggatggcaacagtcta29
<210>6
<211>29
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成寡核苷酸
<400>6
aagaagcaaccggacagttccatgtatac29
<210>7
<211>19
<212>prt
<213>人工序列
<220>
<223>人工序列描述:合成多肽
<400>7
leusercysalaalahisaspproilepheasplysasnleumetgly
151015
trpglycys
<210>8
<211>19
<212>prt
<213>人工序列
<220>
<223>人工序列描述:合成多肽
<400>8
leusercysalaalahisaspproilepheasplysasnleumetgly
151015
trpglyarg
<210>9
<211>10
<212>prt
<213>人工序列
<220>
<223>人工序列描述:合成多肽
<400>9
cysaspserseraspasnaspasnphearg
1510
- 還沒有人留言評論。精彩留言會獲得點贊!