廣藿香醇在制備防治潰瘍性結腸炎的藥物中的應用的制作方法
本發明涉及含有機有效成分的醫藥配制品,具體涉及含羥基化合物的藥物,該藥物可用于治療潰瘍性結腸炎。
背景技術:
潰瘍性結腸炎(ulcerative colitis,UC)是一種病因及發病機制均不明確的慢性結腸炎癥。該病病程冗長,病變范圍廣泛,病變部位主要位于結腸的粘膜層,以潰瘍為主,多累及直腸和乙狀結腸,有時遍及整個結腸。潰瘍性結腸炎具有急性暴發型病死率高、慢性持續型癌變率高、易反復發作等特點,臨床表現為:腹痛、持續性腹瀉及血便、發熱、腹脹等癥狀,嚴重影響著人們的生活質量,且目前無特效藥物,故被世界衛生組織列為現代難治病之一。本病在歐美國家發病率較高,大概為0.04%-0.1%。在國內未見精確的統計報告數據,但近年來呈明顯增加的趨勢。目前主要采用傳統的治療藥物有以下5種:氨基水楊酸類(如柳氮磺胺吡啶)、皮質類固醇、免疫抑制劑(如硫唑嘌呤)、生物制劑(如TNF-α,即英夫利昔)以及益生菌。但還是存在療效不理想,甚至導致嚴重副作用的問題。氨基水楊酸類可導致嚴重過敏和高熱,糖皮質激素可導致水牛背及骨質疏松,硫唑嘌呤會導致嚴重肝損傷,英夫利昔可能引起大出血和感染。因此,尋找對潰瘍性結腸炎具有良好治療作用的中藥,探明其作用機制,對于發現潰瘍性結腸炎的新型治療藥物具有重要意義。
廣藿香醇又名百秋李醇,虎尾草醇,是一種三環倍半萜類化合物,其化學名為[1R(1α,4β,4Aα,6β)]-八氫-4,8A,9,9-四甲基-1,6-亞甲基萘-1(2H)-醇,分子式為C15H26O,分子量為222.37,結構式如下結構式I所示,外觀為六角偏方四分面像晶體,不溶于水,可溶于乙醇和乙醚和常用有機溶劑。廣藿香醇在抗流感毒性、抗炎、抗真菌,并在神經保護、胃腸道保護、免疫調節上發揮了重要作用。
公開號為CN 104306362 A的發明專利申請公開了廣藿香醇在制備防治胃腸動力障礙性疾病的藥物中的應用,該應用公開了廣藿香醇“既能抑制小鼠胃底平滑肌收縮,又能小鼠胃底抑制平滑肌的舒張”。由胃腸動力的概念可知,胃腸動力障礙是指胃腸部肌肉的收縮蠕動力不足,只是某種原因所產生的結果。現代醫學研究結果顯示,很多因素都可引起胃腸動力不足,如,胃腸疾病,甚至精神情緒變化和生活習慣都可引起胃腸動力足,因此即使是胃腸疾病引起的,服用含廣藿香醇的藥物后使胃腸動力恢復正常,也不能說明治愈了所引發的疾病,因為胃腸動力只能作為治療某種胃腸疾病的一個評價指標,而且還不是主要的指標。比如,潰瘍性結腸炎是否治愈的關鍵是結腸黏膜層和層黏膜下的炎癥是否消失,結腸黏膜上的潰瘍面是否縮小或治愈。可見,上述專利申請未公開廣藿香醇具有防治潰瘍性結腸炎的生物活性。
技術實現要素:
本發明所要解決的技術問題是提供廣藿香醇的新用途,即在制藥中的新用途。
上述新用途具體是,廣藿香醇在制備防治潰瘍性結腸炎的藥物中的應用。
上述應用中所述的藥物由廣藿香醇和醫學上可接受的輔料組成。所述藥物可以是常見的口服制劑,如口服液、片劑、膠囊,滴丸、顆粒劑或栓劑。
本發明的研究結果顯示,廣藿香醇具有防治潰瘍性結腸炎的作用,其機制與其降低反映結腸炎癥程度的髓過氧化物酶(MPO)活力,促進緊密蛋白(TJs)和黏蛋白的表達,從而保護腸上皮黏膜屏障有關。廣藿香醇的這種作用可以用于制備防治潰瘍性結腸炎的藥物,特別是以腹痛、持續性腹瀉及血便、發熱、腹脹為主要臨床表現的潰瘍性結腸炎。
此外,與現有的治療潰瘍性結腸炎的藥物相比,廣藿香醇保護腸道粘膜的機制有所不同。因此,本發明為潰瘍性結腸炎提供了一種新的藥物選擇。另外,根據前期急性毒性實驗結果顯示,廣藿香醇沒有給藥毒性和遺傳毒性,安全性很高,因此,從安全角度廣藿香醇的每日施用劑量不受嚴格的限制,應用時可根據實際情況進行調整,保證了廣藿香醇的廣泛應用,具有很好的推廣應用前景。
附圖說明
圖1為廣藿香醇對DSS誘導潰瘍性結腸炎小鼠體重和DAI評分的影響(n=10)的結果圖,其中,A圖為體重變化趨勢的曲線圖;B圖為DAI評分的條形圖,圖中,##為與Control組比較P<0.01,**為與DSS組比較P<0.01
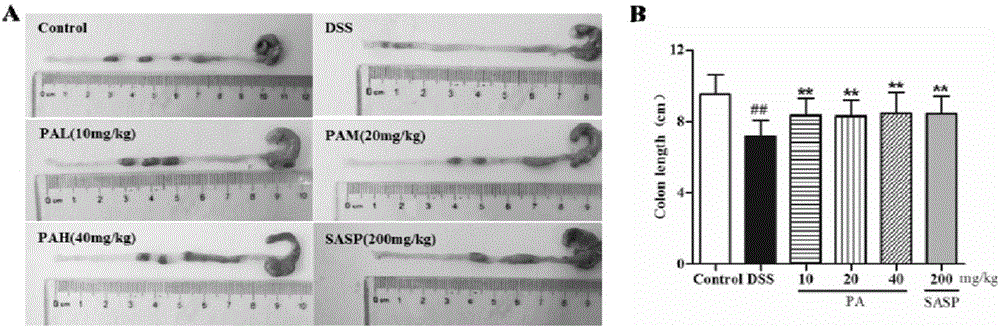
圖2廣藿香醇對DSS誘導潰瘍性結腸炎小鼠結腸變化的影響(n=10)的結果圖,其中,A圖為小鼠結腸宏觀變化的病理顯微照片;B圖為小鼠結腸組織長度差異的條形圖,圖中,##為與Control組比較P<0.01,**為與DSS組比較P<0.01。
圖3廣藿香醇對DSS誘導潰瘍性結腸炎小鼠HE染色結腸組織和組織學病理損傷評分(n=10)的結果圖,其中A圖為HE染色結腸組織的顯微照片,B圖為組織學病理損傷評分的條形圖,圖中,##為與Control組比較P<0.01,**為與DSS組比較P<0.01。
圖4廣藿香醇對DSS誘導潰瘍性結腸炎小鼠結腸組織中髓過氧化酶(MPO)活力的影響(n=10)的條形圖,圖中,##為與Control組比較P<0.01,**為與DSS組比較P<0.01。
圖5廣藿香醇對DSS誘導潰瘍性結腸炎小鼠結腸組織中因子變化(n=10)的條形圖,其中,A圖為TNF-α(A),B圖為IFN-γ(B),C圖為IL-1β(C),D圖為IL-6(D),E圖為IL-12(E),IL-17(F),F圖為IL-4(G),G圖為IL-10(H);A圖~G圖中,##為與Control組比較P<0.01,**為與DSS組比較P<0.01。
圖6廣藿香醇對DSS誘導潰瘍性結腸炎小鼠結腸組織中粘蛋白表達的影響(n=10)結果圖,其中,A圖為mucin-1(A),B圖為mucin-2(B);A圖和B圖中,##為與Control組比較P<0.01,*為與DSS組比較P<0.05,**為與DSS組比較P<0.01。
圖7廣藿香醇對DSS誘導潰瘍性結腸炎小鼠結腸結構相關緊密連接蛋白表達的影響(n=10)結果圖,其中,左邊為小鼠結腸結構相關緊密蛋白表達的western blot圖,右邊為各緊密蛋白表達情況的條形圖;右邊的條形圖中,a為claudin,b為occludin,c為ZO-1,d為ZO-2,a~d圖中,##為與Control組比較P<0.01,*為與DSS組比較P<0.05,**為與DSS組比較P<0.01。
圖8廣藿香醇對DSS誘導潰瘍性結腸炎小鼠結腸組織凋亡相關蛋白表達的影響(n=10)結果圖,其中,左邊為小鼠結腸組織凋亡相關蛋白表達的western blot圖,右邊為各凋亡相關蛋白表達情況的條形圖;右邊的條形圖中,##為與Control組比較P<0.01,*為與DSS組比較P<0.05,**為與DSS組比較P<0.01。
具體實施方式
一、效果實驗例
1.實驗材料
1.1實驗動物及藥品
SPF級Balb/C小鼠,雄性,22-24g,購于廣州中醫藥大學實驗動物中心(合格證編號:44005800002727)。實驗動物分籠飼養,適應性飼養7天,實驗期間自由飲水和進食。飼養環境溫度為22±2℃,相對濕度為60%,每天12小時光照和12小時黑夜循環。
1.2供試藥品
來源:廣藿香醇購買自廣州菲博生物科技有限公司經色譜檢驗鑒定,其純度大于98%;
配制:正常組(Control)和模型組(葡聚糖硫酸鈉,DSS),稱取2.4g吐溫-80,溶于120mL蒸餾水中;PA低、中、高劑量組(10mg/kg,20mg/kg,40mg/kg),分別對應稱0.06g,0.12g,0.24g PA,先與其5倍量的Tween-80完全融合,再溶于60mL蒸餾水中,混勻;陽性對照藥柳氮磺吡啶(SASP)組(200mg/kg),稱取1.2g SASP溶于60mL含1.2g吐溫-80的蒸餾水即可;上述藥物配制后,4℃冰箱保存備用。
2實驗方法
2.1動物分組及模型建立
實驗開始前取各小鼠,稱重,按體重隨機分組:正常組(Control),模型組(DSS),廣藿香醇低、中、高劑量組(PAL、PAM、PAH,對應劑量為10,20,40mg/kg),柳氮磺胺吡啶組(SASP,200mg/kg),每組20只小鼠。分組后,標號,再稱量各小鼠體重,記錄并計算相應給藥體積(0.1mL/10g)。蒸餾水配制3%DSS水溶液,供與除正常組(給予蒸餾水)之外的各組小鼠自由飲用7天以誘導急性潰瘍性結腸炎模型。模型建立的同時,各組小鼠給予相應的藥物進行治療,其中Control組,DSS組給予治療藥物的相應溶劑(2%Tween-80水溶液),每日一次,持續給藥7天。
2.2疾病活動指數(Disease activity index,DAI)評分
實驗過程中,每天記錄小鼠體重、活動狀況、糞便性狀、便血情況。DAI評分按以下標準進行,體重變化評分:體重未變化,記為0分;體重下降1-5%,記為1分;5-10%,記為2分;10-20%,記為3分;體重變化大于20%,記為4分。大便性狀評分:正常,0分;糞便較軟,1分;糞便濕軟2分;半稀便,3分;稀便,4分。便潛血評分:無血便,0分;便血檢測陽性,2分;明顯血便,4分。評分后計算3部分評分并求得平均值。DAI評分的范圍為0分(健康狀態)-4分(嚴重結腸炎)。此外,實驗第8天,剖取結腸后,立即觀察結腸有無水腫、粘連、潰瘍、壞死等。
2.3結腸取材及結腸組織病理學觀察、組織損傷評分
實驗結束后用頸脫臼法全部處死,并馬上剖取結腸組織,測量結腸長度并拍照比較。每組隨機取6只小鼠結腸等分為2份,一份放入4%多聚甲醛中固定,用于H&E染色,一份放入EP管中,用于后續Western Block測定;另每組隨機6只小鼠結腸,一部分放入EP管中保存于液氮,取材結束后置于-80℃冰箱中保存,用于后續MPO活性測定,一部分加入Trizol,用于PCR測定相應基因表達;剩余小鼠結腸(7-8只)收取用于Elisa測定。收好材后,放入-80℃冰箱保存,以使用于后繼實驗。
參照文獻進行結腸炎癥和損傷程度組織學病理評分(Histological score):
a.炎癥程度—0分:無炎癥;1分:淺顯炎癥;2分:輕微潰瘍;3分:明顯潰瘍;
b.隱窩損傷程度—0分:形態正常;1分:少量隱窩變形;2分:中等水平隱窩變形;3分:高水平隱窩變形;4分:明顯的隱窩缺失;
c.炎癥浸潤面積—0分:無炎癥細胞浸潤;1分:10%視野呈低水平炎癥細胞浸潤;2分:10-25%視野呈中等水平炎癥細胞浸潤;3分:25-50%視野呈高水平炎癥細胞浸潤;4分:明顯炎癥細胞浸潤;
d.腸壁炎癥深度—0分:無炎癥;1分:炎癥限于黏膜層;2分:炎癥逐步深入黏膜下層:3分:炎癥深入固有層。總分為0分(正常)—14分(嚴重腸炎)不等。
2.4結腸組織中MPO及炎癥因子的測定
2.4.1勻漿液制備
于冰上稱取結腸組織,置于4mL EP管中,冰上剪碎,立即加入9倍量的組織勻漿液,于4℃,3500rpm離心15min,取上清,分裝,用于后續勻漿蛋白測定(Thermo公司BCA蛋白分析試劑盒說明書)及ELISA測定結腸勻漿中TNF-α,IFN-γ、IL-4、IL-10、IL-12、IL-6、IL-17、IL-1β的變化。
2.4.2 MPO測定
參照試劑盒說明書,制備組織勻漿液,準確稱定組織重量,以試劑盒配備的試劑二為勻漿介質,按重量體積比為1:19加入勻漿介質制備成5%的組織勻漿,無需離心。嚴格按照試劑盒說明書操作,最后用紫外分光光度計在460nm處,1cm光徑,雙蒸水調零,測定各管的吸光度值。按以下公式計算MPO活力(U/g組織濕重)=(測定管OD值-對照管OD值)/11.3*取樣量(g)
2.4.3 Elisa測定炎癥因子
Step1,按說明書所示,用包被液配制捕捉抗體(Capture antibody)隨后于96孔板內加入100μL/well的抗體,4℃孵育過夜;
Step2,棄除孔內液體,并用洗液(大于250μL/wel)清洗3次,每次清洗保持洗液在板孔中浸潤1min,且最后一次洗滌時,將板倒扣于濾紙,吸去孔內多余的液體;
Step3,用去離子水稀釋5x測定原液至1x,于板內加入200μL 1x測定原液,封閉96孔板,室溫孵育1hour;
Step4,參照step2,洗板至少1次;
Step5,稀釋標準品與加樣,首先,按照說明書要求配置最高濃度的標準品,隨后,依次2倍稀釋標準品(配足8個點),再按要求在相應的孔內加入100μL/well的標準品或者樣品,室溫孵育2hour;
Step6,參照step2,洗板3-5次;
Step7,按說明書要求以測定試劑(Assay diluent)配制檢測抗體(Detection antibody),并且孔內加入100μL/well Detection antibody,室溫孵育1hour;
Step8,參照step2,洗板3-5次;
Step9,每孔加入100μL的HRP標記的辣根過氧化物酶(Avidin-HRP),室溫,避光孵育30min;
Step10,參照step2,洗板5-7次;
Step11,每孔加入100μL的底物溶液(TMB Solution),蓋住板,室溫,避光孵育15min;
Step12,每孔加入50μL的終止液(1M H3PO4),于酶標儀測定450nm和570nm處的吸光度值。
最后,以標準品OD450nm-OD570nm所得值OD值為橫坐標,對應的標準品濃度為縱坐標,繪制標準曲線并建立對應方程,再計算各樣品的因子水平。
2.5 Q-PCR檢測相關基因mRNA表達
2.5.1 RNA提取
勻質:液氮研磨結腸組織樣本,加入500μL含4%β-巰基乙醇的CTAB提取液,65℃水浴30min;加入等體積的氯仿/異戊醇(24:1),混勻后10000g離心10min;加入等體積的異丙醇,-20℃放置1h,10000g離心10min,棄上清。
相分離:加入1000μL Trizol重懸沉淀,然后加入200μL氯仿,用手劇烈振蕩15秒,室溫靜置5min;4℃下,10000g離心3min,溶液分為三層,RNA溶解在水相中,吸取500μL轉移水相至另一個新的RNA-free EP管;
沉淀RNA:加入等體積500μL體積異丙醇,渦旋充分混勻。4℃下,12000g離心10min,離心后,管底出現RNA沉淀,去上清;
RNA洗滌:加入1mL 75%乙醇,用手輕輕顛倒,12000g離心5min,去上清;室溫晾干或真空干燥,加入60μL DEPC水溶解沉淀。
2.5.2去基因組
使用RNA-free的DNA I,按以下體系配置反應液[60μL RNA,20μL DNA I,20μL 10x buffer,100μL H2O(RNA free)],37℃消化30min,65℃滅活10min。隨后,加入等體積的苯酚,上下顛倒混勻后10000rpm,離心5min,取上清;加入等體積的氯仿,上下顛倒混勻后10000rpm,離心10min,取上清;加入等體積異丙醇,輕柔地充分混勻,-20℃靜置15min;4℃下,10000g離心10min,收集RNA沉淀,去上清;用75%乙醇洗滌兩次,置于超凈臺中風干;加入10μL DEPC水溶解沉淀。
2.5.3純度檢測
取2μLRNA樣品60倍稀釋,在微量分光光度計k2800(北京凱奧)上測定OD值,OD260nm/OD280nm的比值大于1.8,說明制備的RNA較純,無蛋白質污染。
2.5.4逆轉錄
在PCR管中加入模板RNA、引物混合物,總量12μL。具體如下表:
表2加樣指南
70℃保溫10min,然后迅速在冰上冷卻2min,離心;
再者,在該PCR管中加入下列試劑,
表3加樣方案
將上述20μL反應溶液42℃保溫60min;72℃保溫15min反轉錄;-20℃保存備用。
2.5.5檢測
首先,針對以下目的基因,設計相應的引物。
表4引物序列
再按以下反應體系:cDNA稀釋3倍
表5反應體系
使用ViiA7software,95℃30Seconds;95℃30Seconds,60℃34Seconds(收集熒光信號);35個循環,并測定達到熒光閾值使的最小循環次數(Ct)。完成后進行融解曲線分析:溫度60℃-95℃,每分鐘讀1次。以GAPDH為內參基因,計算相對表達量2-ΔΔCt,其中ΔΔCt=(Ct目的基因-Ct GAPDH)處理組-(Ct目的基因-Ct GAPDH)正常組。
2.5免疫印跡分析
樣本處理:取結腸組織30mg加入1mL RIPA[強裂解液,主要成分為50mMTris(pH 7.4),150mMNaCl,1%TritonX-100,1%sodium deoxycholate,0.1%SDS,以及10mMNaF,5mM EDTA,1mM Na3VO4,用前按1:100的比例加入蛋白酶體抑制劑(1片溶于1ml)]。將組織剪成細小碎片,電動勻漿器勻漿處理。冰上孵育30分鐘,使組織充分裂解。14000rpm離心10分鐘,吸取上清分裝保存,并測定蛋白濃度,測定蛋白濃度使用BCA法。將100μL BCA Reagent與2μL Cu2+Reagent混合均勻后加入5μL所提取的蛋白質,室溫放置過夜,使用分光亮度計測量A540定量。利用標準曲線計算出各樣品濃度。根據所測蛋白濃度,將樣品用裂解液稀釋到相同濃度,并后室溫放置準備點樣。電泳時總上樣量為10μg總蛋白。
上樣檢測:取煮沸后的樣品。用微量加樣器把變性后的蛋白樣品滴加到凝膠孔內,開啟電泳電源,濃縮膠電壓是100v,電泳時間為30分鐘,待樣品溴酚藍跑成一條直線的時候,換電泳的電壓至120V,電泳時間為1小時。電泳溴酚藍到達膠的底端處附近即可停止電泳。參照分子量Marker將膠取下,浸入轉膜液備用。PVDF膜預先浸泡甲醇數秒。隨后,采用的半干轉法進行轉膜操作。將跑完電泳的膠按海綿-濾紙-膠-PVDF膜-濾紙-海綿的順序轉入轉膜夾內,膜靠正極側,膠靠負極側。取出配好的轉膜緩沖液,按照150mA,90min條件在低溫下轉膜。轉膜結束后,將膜取出,放入1xTBST配的濃度為5%的脫脂奶粉里面,常溫搖床孵育封閉1小時。封閉結束后,用TBST洗膜,5分鐘每次,洗膜3次。分別加入一抗(Claudin-1,ZO-1,ZO-2,occludin,Bcl-2,Bax),4℃孵育過夜,一抗稀釋比例1:1000且用TBST含5%的BSA做為稀釋液。搖床振蕩孵育。內參抗體GAPDH(Cell Signaling Technology)1:1000稀釋。1h反應。一抗孵育結束后,TBST洗膜3次,每次間隔10分鐘,加入HRP標記的二抗,博士德公司1:5000稀釋,常溫孵育1h,振蕩孵育,孵育結束后用TBST洗膜3次,每次間隔10分鐘,再用TBS洗2次,每次間隔5min。用ECL發光液(MILLIPORE)1mL。孵育膜2分鐘,將膜拿至暗房進行孵育反應。加入膠片柯達感光膠片,壓片2分鐘,顯影3分鐘,定影10分鐘。條帶分析,使用Image J軟件分析目的條帶灰度值,比較各組蛋白表達差異。
2.6統計學分析
各數據以均數±標準差(x±SD)表示,應用Graphpad Prism 5軟件制圖,SPSS17.0軟件進行統計學分析,各組間差異比較,采用單因素方差分析(One-Way ANOVA),方差齊時,組間兩兩多重比較采用LSD法;方差不齊時,組間兩兩多重比較采Dunnett’sT3法,以P<0.05為標準,表示有顯著性差異。此外與Control組比較,#P<0.05,##P<0.01;與DSS組比較,*P<0.05,**P<0.01。
3實驗結果
3.1廣藿香醇對潰瘍性結腸炎模型小鼠一般癥狀的影響
研究證實DSS誘導的小鼠腸炎模型與人類潰瘍性結腸炎的臨床特征相似,如體重減輕、腹瀉、便血等。本文研究發現,正常小鼠體重保持上升趨勢;而造模后,小鼠前4天體重增長穩定,第5天后,DSS組小鼠體重明顯下降且呈持續下降狀態;給藥各組體重呈增長趨勢,其中PA(10mg/kg)組小鼠體重增長明顯,PA(20,40mg/kg)組及SASP組體重增長趨勢相似。各組體重變化如圖1-A所示。
同時,在造模期間發現,DSS組小鼠便血情況嚴重,而給藥后明顯緩解血便的癥狀。上述觀察到的現象,結合小鼠體重變化及排便癥狀進行疾病活動指數評分,得出結果如圖4所示,DSS組小鼠較Control組DAI評分明顯要高(P<0.01),而給藥后,PA(40mg/kg)組和SASP組DAI評分明顯降低(均有顯著性差異,P<0.01)。DAI評分如圖1-B所示。
此外,如圖2所示,造模后,小鼠結腸顯著縮短(與Control組相比,P<0.01);而給藥治療后情況有所恢復,且給藥各組小鼠結腸長度均較DSS組顯著增長。綜上,可知PA,尤其是40mg/kg,可改善DSS誘導的IBD模型小鼠的宏觀表現,具有抗潰瘍性結腸炎的作用。
3.2廣藿香醇對潰瘍性結腸炎模型小鼠結腸組織結構的保護作用
由結腸組織病理切片H&E染色結果(圖3)可見,Control組小鼠結腸組織結構完整,黏膜層、黏膜下層、肌肉層、外膜4層結構層次清晰,黏膜上層杯狀細胞排列整齊,形態完整;黏膜下層無水腫,未見炎性細胞浸潤;腸外膜無損傷,間皮細胞排列整齊。
DSS組腸壁結構完整性被破壞,黏膜上層細胞壞死脫落,杯狀細胞排列紊亂且明顯減少;固有層中腸腺扭曲甚至消失;黏膜及下層發現明顯的炎性細胞浸潤,肌層細胞排列錯亂。其組織病理學評分(Histological score,HS),顯著高于Control組(P<0.01)。
藥物治療后,PA各劑量組較DSS組情況有所好轉,黏膜上皮脫落減少;固有層腺窩排列均相對整齊,此外黏膜層及下層炎癥細胞減少;肌層及漿膜較完整,且PA修復腸組織的能力呈劑量依賴性。此外,經SASP治療后,結腸組織結構完整,各層結構清晰可見,炎癥細胞少量浸潤于黏膜上層,肌層和外膜細胞排列有序,無損傷。再者,給藥各組病理學評分較DSS組明顯降低,且有統計學差異(P<0.01)。結合病理結構變化和病理學評分差異結果可知PA和SASP能有效改善DSS所致的結腸組織損傷,以進一步緩解潰瘍性結腸炎發病。
3.3廣藿香醇對潰瘍性結腸炎模型小鼠結腸組織中MPO及各細胞因子的影響
本發明研究結果如圖4所示,DSS-treated小鼠結腸MPO活性顯著增加,而PA和SASP治療7天后,MPO活性顯著降低(P<0.01vs.DSS組)。與組織學結果一樣,表明PA和SASP均可通過抗炎作用而體現抗潰瘍性結腸炎活性。
如圖5A-D所示,DSS組小鼠結腸組織中促炎因子(TNF-α、IFN-γ、IL-1β、IL-6)均顯著升高(P<0.01vs.Control)。PA各劑量治療后,上述4種細胞因子濃度顯著下降(P<0.01vs.DSS),且PA高劑量組(40mg/kg)效果最強。與此同時,造模小鼠給予SASP治療后,較DSS小鼠而言,TNF-α和IL-1β濃度顯著下降(P<0.01);而IFN-γ、IL-6等因子只有下降趨勢,無顯著性差異。此外,如圖5E-F所示,DSS誘導的模型小鼠促炎因子(IL-12和IL-17)濃度較Control組上升,并且PA的3個劑量治療組均降低了模型小鼠結腸組織中IL-12和IL-17濃度,但是上述結果均無統計學差異,再者,SASP對上述兩種因子濃度幾乎無影響。如圖5G-H所示,DSS組IL-4和IL-10的表達水平明顯高于Control組。而PA和SASP治療后,IL-4和IL-10水平較DSS組顯著下降(P<0.01)。上述結果表明DSS誘導的潰瘍性結腸炎模型小鼠結腸出現明顯的炎癥癥狀,而PA能有效減輕炎癥癥狀,且效果較SASP更好,表明其具有抗潰瘍性結腸炎的作用。
3.4廣藿香醇對潰瘍性結腸炎模型小鼠結腸組織腸屏障功能的保護作用
研究表明,腸上皮細胞分泌的粘蛋白(Mucin,主要包括mucin-1和mucin-2)組成了腸上皮黏液層,對腸道具有潤滑以及保護其免受微生物侵害的作用。粘蛋白的表達異常意味著腸組織受損,進而影響腸道的屏障功能。如圖6所示,潰瘍性結腸炎模型小鼠腸組織中粘蛋白mucin-1和mucin-2表達水平較Control組小鼠顯著下降;而給藥治療后,PA三個劑量和SASP均能顯著增加mucin-1的表達,PA低、高劑量(10,40mg/kg)相對中劑量(20mg/kg)和SASP可顯著提高mucin-2的表達水平。表明造模后,小鼠腸組織黏液層明顯受損,而經藥物治療后減輕了損傷程度,可見藥物通過修復小鼠腸組織體現抗潰瘍性結腸炎作用。
如圖7所示,本發明免疫印跡法檢測發現研究發現,DSS組小鼠腸組織中緊密連接蛋白ZO-1、ZO-2,Occludin和Claudin-1蛋白表達水平下降(P<0.01vs.Control),揭示緊密連接結構破壞;而廣藿香醇則能上調上述4種蛋白,提示具有保護腸黏膜作用,且調節作用優于SASP。由圖7A-B所示,只有PAH(40mg/kg)能夠顯著提升occludin和claudin-1蛋白的表達水平(P<0.05vs.DSS);由圖7C-D可知,廣藿香醇可呈劑量依賴性地顯著提升緊密連接蛋白ZO-1和ZO-2的表達(P<0.01vs.DSS);總結上述結果可知,廣藿香醇(尤其是高劑量組)可通過上調腸黏膜結構相關的緊密連接蛋白保護腸黏膜免受傷害,進而體現抗潰瘍性結腸炎作用。
同時,研究發現DSS組導致結腸組織中凋亡蛋白Bax表達增多,抗凋亡蛋白Bcl-2表達下降,表明小鼠腸黏膜細胞凋亡,一定程度上影響腸屏障功能。而陽性藥SASP和廣藿香醇PA預處理緩解了DSS引起的腸上皮屏障功能損害,表現為腸組織細胞抗凋亡蛋白表達增多,腸凋亡蛋白的表達減少。其中由圖8可知,PA治療后,呈劑量依賴性,顯著降低抗凋亡蛋白Bcl-2的表達;高劑量(40mg/kg)顯著升高凋亡蛋白Bax的表達。表明PA一定程度上可以減少腸粘膜細胞的凋亡,進而修復腸屏障。
最后,總的來說,廣藿香醇可能通過抑制結腸黏膜細胞凋亡,保護腸黏膜完整性從而減輕結腸炎癥,體現出抗潰瘍性結腸炎活性。
本發明的優點是:(1)本發明發現中藥單體廣藿香醇有顯著的抗潰瘍性結腸炎的活性,其特征是廣藿香醇灌胃給藥后明顯改善模型小鼠體重變化,增加結腸長度,降低疾病活動指數(DAI),明顯改變結腸炎癥水平,減少反映結腸炎癥程度的MPO活力,同時通過促進緊密蛋白和黏蛋白的表達保護腸上皮黏膜屏障,并且調節相關凋亡蛋白的表達,開拓了廣藿香醇在治療炎癥性腸病上新的應用領域。(2)本發明的中藥單體廣藿香醇來源于我國常見的傳統中藥材廣藿香,臨床上常用于胃腸道疾病的治療,安全無毒,本發明中廣藿香醇可較好改善結腸炎癥狀,可用于制備治潰瘍性結腸炎的藥物。(3)本發明基于潰瘍性結腸炎維持腸黏膜屏障結構和功能的完整性,以及減輕腸道炎癥這兩個角度展開,闡明廣藿香的藥效物質基礎,為潰瘍性結腸炎的治療提供新的選擇。(4)本發明的中藥單體廣藿香醇,可制成口服液,膠囊,片劑,顆粒劑,栓劑等。
二、藥物的制備例
例1(片劑)
取廣藿香醇400g,加入乳糖480g、淀粉754g混合均勻,用7%的淀粉漿350g作為粘合劑,濕法制粒,烘干,加入硬脂酸鎂16g混勻,壓制成每片含廣藿香醇40mg的片劑10000片,每片凈重0.2g。口服,用于治療潰瘍性結腸炎。癥見:腹痛、持續性腹瀉及血便、發熱、腹脹等。
例2(膠囊劑)
取廣藿香醇400g,加入乳糖980g、淀粉1254g混合均勻,用7%的淀粉漿350g作為粘合劑,濕法制粒,烘干,加入硬脂酸鎂16g混勻,填充至1號膠囊制成10000粒,每粒膠囊內含廣藿香醇40mg,每粒凈重0.3g。口服,用于治療潰瘍性結腸炎。癥見:腹痛、持續性腹瀉及血便、發熱、腹脹等。
例3(滴丸)
取廣藿香醇300g,加入適量PEG4000作為基質,適量液體石蠟為冷卻劑;滴制法制成含有每丸含廣藿香醇6mg的滴丸,每丸凈重30mg。口服,用于治療潰瘍性結腸炎。癥見:腹痛、持續性腹瀉及血便、發熱、腹脹等。
例4(顆粒劑)
取100g廣藿香醇,加入適量蔗糖粉,混合均勻,逐漸加入乙醇和水,制成顆粒,進行分裝。規格為每包含廣藿香醇40mg的顆粒劑,每包凈重7g。開水沖服,口服,用于治療潰瘍性結腸炎。癥見:腹痛、腹脹。
例5(口服液)
稱取100g廣藿香醇,加入增溶劑普羅莎姆,和一定比例的乙醇,充分攪勻;然后加入適宜附加劑(如矯味劑、抑菌劑、抗氧化劑、著色劑),溶解均勻,濾過澄清,將內容物裝入安瓿或易拉蓋瓶中,滅菌。規格為每瓶含廣藿香醇40mg的口服液,每瓶凈含量10mL。口服,用于治療潰瘍性結腸炎。癥見:腹痛、持續性腹瀉及血便、發熱、腹脹等。
例6(栓劑)
取廣藿香醇100g,加入可可豆脂等輔料,配制成含廣藿香醇30mg的栓劑。直腸給藥,用于治療潰瘍性結腸炎。癥見:腹痛、持續性腹瀉及血便、發熱、腹脹等。
- 還沒有人留言評論。精彩留言會獲得點贊!