一種奧沙利鉑和伊立替康共載載藥脂肪乳及其制備方法與流程
本發明涉及脂肪乳制劑技術領域,尤其涉及一種奧沙利鉑和伊立替康共載載藥脂肪乳及其制備方法。
背景技術:
結直腸癌發病率在各種腫瘤疾病中位列第三位,傳統化學治療藥物仍是目前臨床結直腸癌治療中不可或缺的手段。由于癌癥的異質性和基因復雜性,單一化療藥往往治療效果有限且易產生多藥耐藥,因此常需采用聯合用藥或多重治療的方式。其中,奧沙利鉑與伊立替康的聯用方案在美國NCCN(National Comprehensive Cancer Network,美國國家癌癥綜合網絡)公布的《結腸癌臨床治療指南》中,推薦用于治療首次化療失敗后進展性的轉移性結直腸癌。奧沙利鉑是繼順鉑、卡鉑之后的第三代鉑類抗癌藥,鉑原子可與DNA形成Pt-DNA結合物,導致DNA修復和復制受阻,從而誘導細胞凋亡。伊立替康是喜樹堿類細胞毒性藥物,其作用于DNA拓撲異構酶I,抑制DNA重排并導致DNA鏈斷裂,從而誘導細胞凋亡。兩種藥物聯用時,能夠以不同作用機制同時作用于細胞DNA,從而產生協同治療效果。
同傳統化療藥物一樣,奧沙利鉑和伊立替康均存在一系列的缺點,如:低的藥物耐受,非特異性,多藥耐藥,非期望的藥代動力學和生物分布,在殺死腫瘤細胞時對正常組織也會造成嚴重損害,而二者的聯合使用則會進一步加劇對機體的毒副作用。另外,在奧沙利鉑與伊立替康聯合治療結直腸癌中,臨床上的傳統方法只是簡單的將兩種藥物聯合使用,但不能控制藥物在體內的釋放;由于每種藥物的藥代動力學不同,而不同藥物比例對疾病的治療可能起到協同、相加甚至是拮抗作用,必然會產生治療的不確定性,影響治療效果。
納米載體遞送抗腫瘤藥物能夠有效提高抗腫瘤效果,降低毒副作用等。目前已有多種載藥納米粒上市或進入臨床試驗階段。其中,脂肪乳作為藥物遞送載體,具有靶向、高效和低毒等優點,具有廣闊的應用前景。脂肪乳,也稱作脂質納米乳或脂質微球,是一種均勻的水包油體系。早在上世紀90年代即有多種產品上市,如前列腺素、氟比洛芬等。但目前并沒有報道以奧沙利鉑和伊立替康為治療藥物的共載脂肪乳。
技術實現要素:
針對上述現有技術,本發明提供了一種奧沙利鉑和伊立替康共載脂肪乳,采用脂肪乳共載奧沙利鉑和伊立替康的形式,能夠控制兩種藥物的同步釋放、實現兩種藥物的共遞送,從而提高結直腸癌的治療效果。本發明還提供了該脂肪乳的制備方法。
本發明是通過以下技術方案實現的:
一種奧沙利鉑和伊立替康共載脂肪乳,包括以下組分:治療藥物、注射用油、磷脂、普朗尼克F68、穩定劑、甘油和水,所述治療藥物為奧沙利鉑和伊立替康類藥物,奧沙利鉑與伊立替康類藥物質量比為1:1-5;其中,奧沙利鉑濃度0.5-2mg/ml,伊立替康類藥物濃度0.5-10mg/ml,注射用油質量分數為5-20%,磷脂質量分數0.5-2.5%,普朗尼克F68質量分數0.1-2%,穩定劑質量分數0.01-0.5%,甘油質量分數0.1-2.5%,剩余為水。
本領域技術人員知曉,藥物的作用是受藥物組分及其各組分含量影響的,經過試驗可得,含有上述各配比量原料的奧沙利鉑和伊立替康共載脂肪乳,物理性質穩定,并且兩種藥物具有優異的協同作用。若是不合適的原料配比量,共載脂肪乳物理性質不穩定,兩種藥物不能發揮最優的協同效果。
優選的,所述伊立替康類藥物可以是伊立替康、其活性代謝物7-乙基-10-羥基喜樹堿(SN-38),以及伊立替康與酸所成的鹽中的一種或多種。所述的伊立替康與酸所成的鹽可選用鹽酸伊立替康。
所述的奧沙利鉑和伊立替康共載脂肪乳中,奧沙利鉑和伊立替康類藥物首先與磷脂形成藥物脂質復合物,再進行負載。包括兩種方法:一是奧沙利鉑與伊立替康類藥物分別與磷脂制備奧沙利鉑-脂質復合物、伊立替康-脂質復合物;二是奧沙利鉑與伊立替康類藥物同時與磷脂制備得到奧沙利鉑/伊立替康-脂質復合物。其中,優選的,奧沙利鉑與形成的奧沙利鉑-脂質復合物中磷脂的質量比1:5-1:30,伊立替康類藥物與形成的伊立替康-脂質復合物中磷脂的質量比1:2-1:10。
疏水性的伊立替康類藥物不經制備藥物脂質復合物而直接進行負載,在工藝上也是可以實現的。
所述注射用油為長鏈油酯或中鏈甘油三酯(MCT),以及兩者任意比例的混合物。其中,長鏈油酯可以是大豆油、花生油、麻油、蓖麻油等。優選的,所述注射用油為中鏈甘油三酯(MCT)。
所述磷脂可以是天然磷脂如:大豆磷脂、蛋黃磷脂、氫化大豆磷脂等;也可以是合成磷脂如:二油酰磷脂酰膽堿(DOPC)、二棕櫚酰磷脂酰膽堿(DPPC)、磷脂酰絲氨酸(DOPS)、二油酰基磷脂酰乙醇胺(DOPE)、二棕櫚酰磷脂酰甘油酯(DPPG)、(2,3-二油酰基-丙基)-三甲胺(DOTAP)等。
為了控制所形成的水包油顆粒在適宜的粒徑范圍,本發明優先選擇普朗尼克F68作為水相中的乳化劑。另外,普朗尼克F68被批準可用于靜脈注射,具有較高的安全性。
所述穩定劑為油酸、膽酸、脫氧膽酸、甘氨膽酸的一種或任幾種的混合物,也可以是所述酸的金屬鈉鹽形式。優選的,所述穩定劑為油酸。
所述的甘油即可作為助乳化劑,控制粒徑大小、提高制劑穩定性;又可以作為一種等滲調節劑,調節體系的滲透壓。
所述的奧沙利鉑和伊立替康共載脂肪乳,其平均粒徑在100-200nm之間,粒徑分布范圍窄。
所述的奧沙利鉑和伊立替康共載脂肪乳的制備方法,包括如下步驟:
(1)首先制備奧沙利鉑、伊立替康或奧沙利鉑和伊立替康混合的藥物脂質復合物或奧沙利鉑-脂質復合物:分別將奧沙利鉑、伊立替康類藥物與磷脂混合,或者將奧沙利鉑、伊立替康類藥物同時與磷脂混合,或者只將奧沙利鉑與磷脂混合,然后加入合適的有機溶劑溶解并反應設定時間,抽真空除去有機溶劑,得到均勻藥物脂質膜,即藥物磷脂復合物;
(2)藥物脂質復合物使用有機溶劑復溶后,與注射用油、穩定劑混合,或者加入伊立替康類藥物、注射用油和穩定劑混合(此時適用于步驟(1)中只將奧沙利鉑與磷脂混合),并抽真空除去有機溶劑,得到油相;
(3)普郎尼克F68、甘油用水溶解,得到水相;
(4)將油相與水相預熱后,在高速剪切下混合,得到初乳;所得初乳通過高壓乳勻機控制粒徑,即得到共載脂肪乳,并經過濾除菌后冷藏保存。
以上步驟只要不影響制備,可互換。
步驟(1)中,本發明使用藥物脂質復合物技術制備奧沙利鉑和伊立替康共載脂肪乳,藥物脂質復合物是利用藥物和磷脂分子之間弱的作用力形成較為穩定的化合物或絡合物。由于藥物脂質復合物能夠改善藥物的油水分配系數,從而提高藥物在制劑中的包封效果。此外,在共遞送不同藥物時,藥物脂質復合物能夠減小不同藥物之間的疏水差異,因此能夠協調不同藥物的釋放行為,從而更好地控制不同藥物的同步釋放,從而保證不同藥物的優化治療比例。
奧沙利鉑及伊立替康類藥物可以分別與磷脂反應制備奧沙利鉑-脂質復合物、伊立替康-脂質復合物,也可同時與磷脂反應制備奧沙利鉑/伊立替康-脂質復合物;奧沙利鉑與形成的奧沙利鉑-脂質復合物中磷脂的質量比1:5-1:30,伊立替康類藥物與形成的伊立替康-脂質復合物中磷脂的質量比1:2-1:10;有機溶劑可以是甲醇、二氯甲烷、氯仿、乙醚的一種或幾種混合,反應溫度20-60℃。
步驟(2)中,復溶有機溶劑優選二氯甲烷、氯仿、乙醚的一種或兩種混合,注射用油在最終處方中所占比例為5-20%(w/v);穩定劑所占比例為0.01-0.5%(w/v)。
步驟(3)中,普郎尼克F68在最終處方中所占比例為0.1-2%,甘油比例為0.1-2.5%。優選的,普郎尼克F68在最終處方中所占比例為0.5-1%;甘油比例為2-2.25%。
步驟(4)中,水相與油相預熱溫度在40-80℃,混合時剪切速率為3000-10000r/min,高壓乳勻條件為5-10Mpa、循環10-20次。經過試驗驗證,以上條件可以得到良好的物理穩定性的共載載藥脂肪乳。
上述技術方案具有如下有益效果:
本發明中的奧沙利鉑和伊立替康共載載藥脂肪乳,具有良好的物理穩定性、生物兼容性和生物可降解性,由于脂肪乳將藥物包封在內油相中,能夠有效避免藥物的泄露,因此可實現完全負載,從而精確控制兩種藥物的比例。此外,奧沙利鉑和伊立替康共載載藥脂肪乳能夠延緩兩種藥物在體內的釋放,且可利用EPR效應增加在腫瘤組織的聚集,因此可以提高其抗腫瘤效果。
更重要的是,使用藥物脂質復合物技術制備的共載脂肪乳取得了意想不到的效果,能夠協調兩種藥物在體內的同步釋放,確保兩種藥物在到達腫瘤部位仍保持優化的劑量比,從而實現最佳協同效果,這比現有技術中的兩種藥物的協同效果都要突出。
本發明采用的脂肪乳制備方法,工藝穩定,簡單可行,易于工業化生產。
所選用乳化劑磷脂和普郎尼克F68均為批準可用于靜脈注射的輔料,具有良好的安全性。
附圖說明
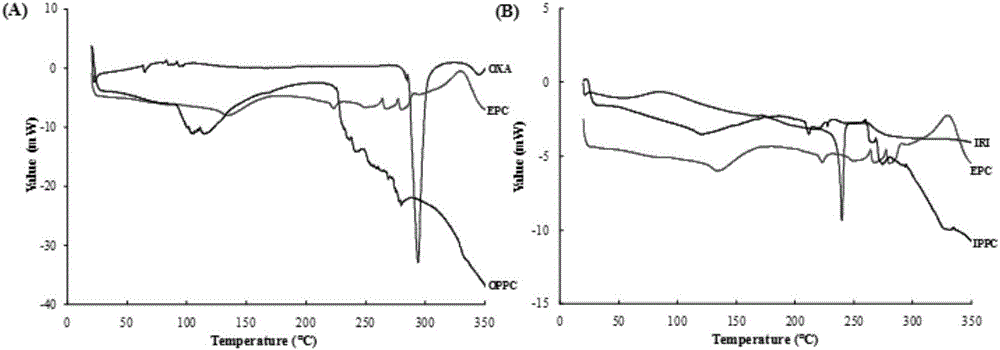
圖1為本發明制備的藥物脂質復合物的差示掃描量熱(DSC)表征結果。OXA表示奧沙利鉑,IRI表示伊立替康,EPC表示蛋黃卵磷脂,OPPC表示奧沙利鉑-磷脂復合物,IPPC表示伊立替康-磷脂復合物。
圖2為本發明制備的共載脂肪乳的透射電鏡照片。
圖3為本發明制備的共載脂肪乳的粒徑分布圖。
圖4為本發明制備的共載脂肪乳的電位分布圖。
圖5為本發明制備的共載脂質體的體外釋放情況。
圖6為本發明制備的共載脂質體的3個月穩定性情況。
具體實施方式
下面結合實施例對本發明進一步說明。
實施例1:奧沙利鉑與伊立替康分別制備藥物脂質復合物。
一種奧沙利鉑與伊立替康共載脂肪乳,取奧沙利鉑20mg與蛋黃磷脂300mg溶解于甲醇/二氯甲烷20ml(體積比9:1),伊立替康50mg與蛋黃磷脂200mg溶解于二氯甲烷5ml,反應一定時間后,二者分別抽真空得到奧沙利鉑-脂質復合物、伊立替康-脂質復合物;兩種藥物脂質復合物用二氯甲烷4ml復溶,加入MCT 2g、油酸50mg,抽真空后得到油相。將普郎尼克F68 200mg、甘油800mg溶解于水中,得到水相。油相和水相分別60℃預熱后,在剪切速率6000r/min下混合,得到初乳,并加水定容至終體積40ml;隨后在8Mpa下高壓乳勻循環15次,得到共載脂肪乳。
奧沙利鉑和伊立替康濃度分別為0.5mg/ml、1.25mg/ml;MCT所占比例為5%;磷脂和普郎尼克F68比例分別為1.25%、0.5%;油酸和甘油的比例分別為0.125%、2%。測定其平均粒徑為126.9nm,如圖3所示。圖1A分別為奧沙利鉑(OXA)、蛋黃卵磷脂(EPC)以及奧沙利鉑-藥物脂質復合物(OPPC)的DSC曲線,OPPC表現出與OXA及EPC均不同的吸熱放熱峰,表明OPPC的形成;圖1B同樣表明伊立替康-藥物脂質復合物(IPPC)的形成。圖2為所制備共載脂肪乳的透射電鏡圖片,可看到脂肪乳粒子形態圓整,呈較好的球形。圖4所示共載脂肪乳zeta電位在-20mV左右,該電位下粒子之間具有一定的排斥力,能夠有效避免納米粒團聚,有利于制劑的穩定。圖5所示為共載脂肪乳中兩種藥物的釋放,一方面兩種藥物具有相似的釋放速率,表明在釋放過程中兩種藥物能夠保持穩定的藥物比例,從而保證二者的協同增效作用;另一方面兩種藥物在脂肪乳中均表現出顯著的緩釋效果,可以延長藥物的作用時間。圖6所示共載脂肪乳冷藏儲存下放置三個月后,外觀、粒徑均無明顯變化,表明該制劑具有較高的物理穩定性。
實施例2:奧沙利鉑與伊立替康同時制備藥物脂質復合物。
一種奧沙利鉑與伊立替康共載脂肪乳,取奧沙利鉑20mg、伊立替康50mg與大豆磷脂500mg溶解于甲醇/二氯甲烷20ml(體積比9:1),反應一定時間后,抽真空得到奧沙利鉑/伊立替康-脂質復合物;將藥物脂質復合物用二氯甲烷4ml復溶,加入MCT 4g、油酸50mg,抽真空后得到油相。將普郎尼克F68 200mg、甘油900mg溶解于水中,得到水相。油相和水相分別60℃預熱后,在剪切速率8000r/min下混合,得到初乳,并加水定容至終體積40ml;隨后在10Mpa下高壓乳勻循環15次,得到共載脂肪乳。
奧沙利鉑和伊立替康濃度分別為0.5mg/ml、1.25mg/ml;MCT所占比例為10%;磷脂和普郎尼克F68比例分別為1.25%、0.5%;油酸和甘油的比例分別為0.125%、2.25%。測定其平均粒徑為160.2nm。
實施例3:奧沙利鉑制備藥物脂質復合物、伊立替康直接進行負載。
一種奧沙利鉑與伊立替康共載脂肪乳,取奧沙利鉑20mg與氫化大豆磷脂300mg溶解于甲醇/氯仿20ml(體積比9:1),反應一定時間后,抽真空得到奧沙利鉑-脂質復合物。將藥物脂質復合物用氯仿4ml復溶,并加入伊立替康50mg、MCT 2g、膽酸50mg,抽真空后得到油相。將普郎尼克F68 300mg、甘油800mg溶解于水中,得到水相。油相和水相分別50℃預熱后,在剪切速率10000r/min下混合,得到初乳,并加水定容至終體積40ml;隨后在10Mpa下高壓乳勻循環10次,得到共載脂肪乳。
奧沙利鉑和伊立替康濃度分別為0.5mg/ml、1.25mg/ml;MCT所占比例為5%;磷脂和普郎尼克F68比例分別為1.25%、0.75%;膽酸和甘油的比例分別為0.125%、2%。測定其平均粒徑為140.4nm。
實施例4:增加藥物及乳化劑用量。
一種奧沙利鉑與伊立替康共載脂肪乳,取奧沙利鉑60mg、伊立替康120mg與蛋黃磷脂1000mg溶解于甲醇/氯仿60ml(體積比5:1),反應一定時間后,抽真空得到奧沙利鉑/伊立替康-脂質復合物(為了區分,單獨形成的復合物寫為:奧沙利鉑-藥物脂質復合物、伊立替康-藥物脂質復合物;而混合后形成的復合物寫為:奧沙利鉑/伊立替康-藥物脂質復合物);將藥物脂質復合物用二氯甲烷10ml復溶,加入MCT 4g、油酸100mg,抽真空后得到油相。將普郎尼克F68 600mg、甘油800mg溶解于水中,得到水相。油相和水相分別60℃預熱后,在剪切速率10000r/min下混合,得到初乳,并加水定容至終體積40ml;隨后在10Mpa下高壓乳勻循環20次,得到共載脂肪乳。
奧沙利鉑和伊立替康濃度分別為1.5mg/ml、3mg/ml;MCT所占比例為10%;磷脂和普郎尼克F68比例分別為2.5%、1.5%;油酸和甘油的比例分別為0.25%、2%。測定其平均粒徑為163.5nm。
實施例5:改變注射用油的種類。
一種奧沙利鉑與伊立替康共載脂肪乳,取奧沙利鉑40mg與蛋黃磷脂200mg溶解于甲醇/二氯甲烷40ml(體積比8.5:1.5),伊立替康50mg與蛋黃磷脂400mg溶解于甲醇/二氯甲烷5ml(2:3),反應一定時間后,二者分別抽真空得到奧沙利鉑-脂質復合物、伊立替康-脂質復合物;兩種藥物脂質復合物用二氯甲烷5ml復溶,加入注射用大豆油4g及花生油2g,油酸160mg,抽真空后得到油相。將普郎尼克F68 300mg溶解于水中,得到水相。油相和水相分別70℃預熱后,在剪切速率5000r/min下混合,得到初乳,并加水定容至終體積40ml;隨后在8Mpa下高壓乳勻循環15次,得到共載脂肪乳。
奧沙利鉑和伊立替康濃度分別為1mg/ml、1.25mg/ml;注射用油所占的總比例為15%;磷脂和普郎尼克F68比例分別為1.5%、0.75%;油酸比例為0.4%。測定其平均粒徑為197.8nm。
實施例6:改變穩定劑種類。
一種奧沙利鉑與伊立替康共載脂肪乳,取奧沙利鉑40mg與蛋黃磷脂200mg溶解于甲醇/二氯甲烷40ml(體積比8.5:1.5),伊立替康50mg與蛋黃磷脂200mg溶解于甲醇/二氯甲烷5ml(2:3),反應一定時間后,二者分別抽真空得到奧沙利鉑-脂質復合物、伊立替康-脂質復合物;兩種藥物脂質復合物用二氯甲烷5ml復溶,加入MCT 4g、脫氧膽酸40mg,抽真空后得到油相。將普郎尼克F68 300mg溶解于水中,得到水相。油相和水相分別70℃預熱后,在剪切速率5000r/min下混合,得到初乳,并加水定容至終體積40ml;隨后在8Mpa下高壓乳勻循環15次,得到共載脂肪乳。
奧沙利鉑和伊立替康濃度分別為1mg/ml、1.25mg/ml;MCT所占比例為10%;磷脂和普郎尼克F68比例分別為1%、0.75%;脫氧膽酸比例為0.2%。測定其平均粒徑為167.8nm。
對比例1不采用藥物脂質復合物
制備油相:取蛋黃磷脂500mg、MCT 2g、油酸50mg混合,抽真空后得到油相;將奧沙利鉑20mg、伊立替康50mg加入油相中,藥物無法溶解,油相呈渾濁。
后續制備脂肪乳操作無法進行。
結論:奧沙利鉑及伊立替康直接在油相溶解不可行。而藥物磷脂復合物能夠改善藥物的親疏水性,從而實現藥物在油相均一穩定的存在。也表明形成藥物磷脂復合物能夠大大提高制劑的穩定性。
對比例2改變注射用油及穩定劑含量比例
一種奧沙利鉑與伊立替康共載脂肪乳,取奧沙利鉑20mg與蛋黃磷脂300mg溶解于甲醇/二氯甲烷20ml(體積比9:1),伊立替康50mg與蛋黃磷脂200mg溶解于二氯甲烷5ml,反應一定時間后,二者分別抽真空得到奧沙利鉑-脂質復合物、伊立替康-脂質復合物;兩種藥物脂質復合物用二氯甲烷4ml復溶,加入MCT 12g,但不加入穩定劑油酸,抽真空后得到油相。將普郎尼克F68 200mg、甘油800mg溶解于水中,得到水相。油相和水相分別60℃預熱后,在剪切速率6000r/min下混合,得到初乳,并加水定容至終體積40ml;隨后在8Mpa下高壓乳勻循環15次,得到共載脂肪乳。
結論:MCT占處方最終比例為30%,所得脂肪乳表面有油滴,放置過夜后分層,已破乳。表明注射用油含量應在合適范圍,以保證乳化劑能夠將油相和水相完全乳化。而穩定劑的存在,能夠增加藥物與油相的親和力,從而改善制劑的穩定性。
對比例3水相中不加乳化劑普郎尼克F68。
一種奧沙利鉑與伊立替康共載脂肪乳,取奧沙利鉑20mg與蛋黃磷脂300mg溶解于甲醇/二氯甲烷/乙醚20ml(體積比8.5:1:0.5),伊立替康50mg與蛋黃磷脂200mg溶解于甲醇/二氯甲烷5ml(1:1),反應一定時間后,二者分別抽真空得到奧沙利鉑-脂質復合物、伊立替康-脂質復合物;兩種藥物脂質復合物用二氯甲烷4ml復溶,加入MCT 2g、油酸鈉25mg,抽真空后得到油相。將甘油800mg溶解于水中,得到水相。油相和水相分別60℃預熱后,在剪切速率6000r/min下混合,得到初乳,并加水定容至終體積40ml;隨后在10Mpa下高壓乳勻循環20次,得到共載脂肪乳。
結論:不使用普郎尼克F68也可得到均一的脂肪乳,但粒徑均勻度較差,有大顆粒存在。測定其平均粒徑為180.1nm、多分散系數(PDI)為0.354。制劑冷藏放置7天后出現破乳,穩定性大大降低。說明普郎尼克F68的存在能夠改善制劑的穩定性。
上述實施例為本發明較佳的實施方式,但本發明的實施方式并不受上述實施例的限制,其他的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!