一種多功能納米藥物載體及其形成的載藥膠束及載藥膠束制備方法與流程
本發明屬于生物醫藥和納米醫學技術領域,具體涉及一種長循環和靶向協同的多功能抗腫瘤靶向納米藥物載體及其形成的載藥膠束及載藥膠束制備方法。
背景技術:
納米藥物載體在輸送藥物過程中面臨諸多的障礙,靶向腫瘤的藥物輸送是一個體內五步串聯的過程:1)在血液循環系統中保留較長時間(血液屏障),以實現2)腫瘤組織中的高效富集(EPR效應),3)在腫瘤組織滲透到各個部分以到達所有腫瘤細胞,4)能夠快速進入腫瘤細胞,并5)在胞內將藥物快速釋放。然而,對于多功能的納米藥物載體,每一新的功能勢必增加了體系的復雜性并帶來新的問題,并且不同特定功能之間往往會產生一定的矛盾。例如,一些藥物載體表面修飾親水性較好的聚合物以避免網狀內皮系統的快速清除,獲得較好的長循環性能并提高腫瘤部位的富集量。但是,研究表明,這些載體不易被腫瘤細胞內吞,降低腫瘤治療效果。與此同時,一些具有良好應用前景的靶向藥物載體具有良好的腫瘤細胞內吞能力,然而長循環及腫瘤部位的高效富集難以實現,此外,對于一些表面修飾了靶向基團如c(RGDfK)的納米粒子,c(RGDfK)直接暴露在納米粒子表面,易與血液中的調理素相互作用,使得納米粒子在調理素作用下,促使其被網狀內皮系統快速清除,并可能會引起免疫反應,大大降低了抗腫瘤療效。
目前解決長循環和細胞內吞的研究主要集中表面聚乙二醇(PEG)可脫離的納米載體。這種納米藥物載體在血液循環過程中,在PEG的屏蔽作用下,載體材料可以在一定程度上避免體內網狀內皮系統的快速清除,提高了血液循環時間。同時,在EPR效應發揮作用后,載體材料進入腫瘤組織,在腫瘤組織微環境如弱酸性、過度表達的酶類等響應性刺激下,PEG響應性脫除,從而發生電荷轉變或暴露出的靶向于腫瘤細胞的靶向基團,提高細胞內吞能力。盡管如此,目前大部分的PEG脫殼研究仍然處于細胞水平,體內的驗證還沒有實現。同時,脫殼過程及脫殼機理較為復雜,適用范圍較窄。因此,為解決長循環和細胞內吞的矛盾,需要發展新型具有協同作用的納米藥物載體系統,提高抗腫瘤治療效果。
技術實現要素:
本發明的目的是為了克服現有技術的不足,提供一種多功能納米藥物載體,該藥物載體保留了表面PEG修飾及表面結構所帶來的長循環性能,同時可有效提高腫瘤細胞攝取能力,有效提高抗腫瘤治療效果。
本發明的另一目的在于提供所述多功能納米藥物載體的制備方法。
本發明的上述目的通過如下技術方案予以實現:
一種多功能納米藥物載體,由粒徑為30~200 nm且均勻分布的復合膠束組成;
所述復合膠束由雙親性嵌段共聚物A和雙親性嵌段共聚物B通過在水溶液中自組裝形成,
所述雙親性嵌段共聚物A為聚乙二醇-b-聚環己內酯,即PEG-b-PCL1,其親水端為聚乙二醇PEG、疏水端為聚環己內酯PCL1;
所述雙親性嵌段共聚物B為聚環己內酯-b-聚β氨酯-c(RGDfK),即PCL2-b-PAE-c(RGDfK),其中c(RGDfK)為短鏈環肽,所述短鏈環肽的氨基酸序列為cyclo(Arg-Gly-Asp-d-Phe-Lys),其親水端為PAE-c(RGDfK)、疏水端為聚環己內酯PCL2;
所述PCL1、PCL2的分子量為2~10kDa,且其差值<5kDa;
所述復合膠束在pH 為7.4水溶液中為核-殼結構,其中核為疏水端PCL,殼層為PEG和PAE-c(RGDfK)的復合殼層。
優選地,所述復合膠束的粒徑約為100nm。
一種載藥膠束,所述載藥膠束中由藥物成分和載體構成,所述載體為所述多功能納米藥物載體。
優選地,所述藥物成分與載體的質量比為1:1。
優選地,所述多功能納米藥物載體中,雙親性嵌段共聚物A與雙親性嵌段共聚物B的質量為1:1。
優選地,所述多功能納米藥物載體的分子量為12~14kDa。
優選地,所述藥物成分為阿霉素。
所述載藥膠束的制備方法,包括如下步驟:
S1.制備雙親性嵌段共聚物A PEG-b-PCL1;
S2.制備雙親性嵌段共聚物B PCL2-b-PAE-c(RGDfK);
S3.將雙親性嵌段共聚物A與雙親性嵌段共聚物B分別溶解于溶劑中,制成溶液C、溶液D;將藥物成分制成溶液E;
S4.將溶液C、溶液D與溶液E混合,形成混合溶液;控制混合溶液pH為4以下,除去溶液中的溶劑,再調節混合溶液pH為7.4,并進行透析,截留需要的分子量,得到所述載藥膠束。
優選地,S3.中,所述溶劑為氯仿。
優選地,S4.中除去溶液中的溶劑的方法為在常溫下揮發和/或室溫下真空去除。
與現有技術相比,本發明具有以下有益技術效果:
本發明制備的納米藥物載體,表面結構可通過改變不同嵌段共聚物比例靈活調控;靶向基團針對腫瘤細胞具有特異性靶向作用;載藥系統具有響應性釋放能力,在酸性條件下釋放相對較快,而在正常組織環境中釋放較慢;載藥體系生物相容性較好,并具有生物可降解性;制備工藝簡單、易于操作。因此尤其構成的載藥膠束保留了表面PEG修飾及表面結構所帶來的長循環性能,同時可有效提高腫瘤細胞攝取能力,有效提高抗腫瘤治療效果。
附圖說明
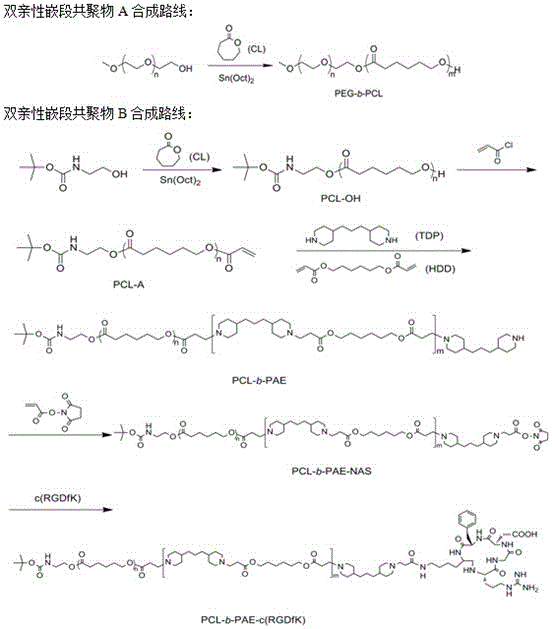
圖1為本發明所述雙親性嵌段共聚物A、雙親性嵌段共聚物B的合成路線圖。
具體實施方式
下面結合具體實施例和對比例對本發明做進一步的詳細說明,但本發明并不限于下述實施例。
實施例中,所用的原料均為市售商品。實施例中,所述的百分含量為重量百分含量。
實施例1
一種載藥膠束,由藥物成分阿霉素,及多功能納米藥物載體構成。
所述多功能納米藥物載體,由粒徑為100 nm且均勻分布的復合膠束組成;
所述復合膠束由雙親性嵌段共聚物A和雙親性嵌段共聚物B通過在水溶液中自組裝形成,
所述雙親性嵌段共聚物A為聚乙二醇-b-聚環己內酯,即PEG-b-PCL1,其親水端為聚乙二醇PEG、疏水端為聚環己內酯PCL1;
所述雙親性嵌段共聚物B為聚環己內酯-b-聚β氨酯-c(RGDfK),即PCL2-b-PAE-c(RGDfK),其中c(RGDfK)為短鏈環肽,所述短鏈環肽的氨基酸序列為cyclo(Arg-Gly-Asp-d-Phe-Lys),其親水端為PAE-c(RGDfK)、疏水端為聚環己內酯PCL2;所述復合膠束在pH 為7.4水溶液中為核-殼結構,其中核為疏水端PCL,殼層為PEG和PAE-c(RGDfK)的復合殼層。
上述載藥膠束通過如下方法制成:
1)聚乙二醇-b-聚環己內酯(PEG2k-b-PCL1)的合成
以端羥基聚乙二醇(CH3O-PEG45-OH)為引發劑,以辛酸亞錫[Sn(Oct)2]為催化劑,以ε-己內酯(ε-CL)為單體,開環聚合制備,具體方法是:將干燥處理過的端羥基聚乙二醇2.0 g和減蒸處理過的ε-CL 5.0 g溶于重蒸過的20 mL無水甲苯中,加入50 μL Sn(Oct)2,依次進行液氮冷凍、抽真空、通氮氣、解凍,重復三次,110℃油浴中反應12 h,反應后旋蒸除去甲苯,加入20 mL二氯甲烷溶解粘稠物后,在200 mL冰乙醚中沉淀,抽濾洗滌后,將固體產物置于真空烘箱中干燥,即可得到白色固體聚乙二醇-b-聚環己內酯(PEG2k-b-PCL);
2)聚環己內酯-b-聚β氨酯-c(RGDfK)[ PCL-b-PAE-c(RGDfK)]的合成
利用開環聚合和邁克爾加成反應通過連續反應制備,具體方法是:將叔丁氧羰基氨基乙醇(BOC-NH-C2H4OH)0.1 g和減蒸過的ε-己內酯(ε-CL)3.5 g置于茄型瓶中,加入10 m重蒸過的甲苯溶解,加入50 μL辛酸亞錫[Sn(Oct)2],依次進行液氮冷凍、抽真空、通氮氣、解凍,重復三次,然后在110℃油浴中反應12 h,反應后旋蒸除去甲苯,加入5 mL二氯甲烷溶解粘稠物后,在50mL冰乙醚中沉淀,抽濾洗滌后,將固體產物置于真空烘箱中干燥,得到PCL的均聚物PCL-OH;
將上述2.5 g PCL-OH、0.25 g三乙胺(TEA)和5 mL重蒸后的二氯甲烷混合均勻得到混合液a,將圓底燒瓶置于冰水浴中,然后將0.18 g丙烯酰氯溶解于0.18 g重蒸后的二氯甲烷中,混合均勻得到混合液b,加入到恒壓滴液漏中,將混合液b在氬氣氛圍下逐滴緩慢滴入到圓底燒瓶混合液a中,混合液a與混合液b的質量比7:10,滴加完畢后封閉反應體系,緩慢升至室溫,在氬氣氛圍下反應12 h后,萃取反應液,用飽和碳酸鈉溶液、0.1 mol/L的鹽酸溶液和純水分別洗滌至少三次,取有機相,用無水硫酸鎂干燥8~10 h,抽濾,旋蒸濃縮后在冰乙醚中沉淀,靜置8-10 h后抽濾,用無水乙醚洗滌后,將固體置于真空烘箱中干燥,即可制得端基碳碳雙鍵功能化的PCL-A;
將上述PCL-A 0.5 g、 己烷-1,6-二醇-二丙烯酸酯(HDD)0.68 g和4,4′-三亞甲基-二哌啶(TDP)0.69 g混合后,加入10 mL氯仿溶解,55℃油浴中反應,72 h后,在反應液中加入0.305 g N-丙烯酰氧琥珀酰亞胺(NAS),繼續反應12 h,封端并終止反應,即可得到黃色固體PCL-b-PAE-NAS;
將80 mg上述PCL-b-PAE-NAS和16 mg短鏈環肽[c(RGDfK)]混合后,加入5 mL體積比為3:2的DMF和氯仿的混合溶劑,然后加入200 μL三乙胺(TEA),30℃下攪拌反應8~10h,反應液旋蒸除去氯仿,在超純水中透析,透析袋截留分子量為12-14k Da,每天換水四次,透析三天后,冷凍干燥,即可制得聚環己內酯-b-聚β氨酯-c(RGDfK)[ PCL-b-PAE-c(RGDfK)];
3)室溫下分別將步驟1)和2)中所得到的兩種嵌段共聚物PCL-b-PAE-c(RGDfK)和PEG-b-PCL分別溶解在有機溶劑氯仿中,得到兩種聚合物溶液,這兩種溶液的濃度均為2 mg/mL;另外將阿霉素鹽酸鹽加入到氯仿中,再加入三乙胺中和阿霉素鹽酸鹽中的鹽酸,制得濃度為2 mg/mL的阿霉素溶液;
4)將步驟3)中制備得到的兩種聚合物溶液和阿霉素溶液按照體積比為1:1:1均勻混合,得到混合溶液;
5)將上述混合溶液在超聲攪拌下逐滴加入到pH 為4.0、濃度為10-4 mol/L的鹽酸中,滴加完全后,在35℃下劇烈攪拌揮發至有機溶劑基本揮發完全,然后在室溫下旋蒸至完全除去未揮發干凈的有機溶劑,加入濃度為0.1 mol/L的氫氧化鈉溶液調節pH至7.4,在超純水中透析,所用透析袋截留分子量為12~14 kDa,透析兩天后,經超濾離心濃縮,即可制得所述載藥膠束(RMSM-DOX)。
實驗分析:
1)RMSM-DOX的體外阿霉素釋放
分別取1 mL載藥膠束RMSM-DOX溶液于透析袋(透析袋截留分子量:12~14 kDa)中,置于3 mL的緩沖溶液中,在三種不同pH(pH 7.4,6.5和5.0)37 ℃電磁攪拌下,每隔一段時間取出1 mL緩沖溶液用熒光分光光度計測定其波長在592 nm處的熒光強度,并加入1 mL新的緩沖溶液,保證透析袋外溶液體積不變,利用阿霉素在水中的標準曲線來計算阿霉素的累積釋放量。
2)多功能抗腫瘤納米載藥膠束的細胞毒性實驗
采用MTT法,以HepG2細胞為研究對象評價載藥膠束的細胞毒性。將HepG2細胞以每孔4000個分別接種到96孔板中。加入500 μL RPMI1640的細胞培養液,在5% CO2,在37 °C下分別孵育24 h。之后每孔加入不同濃度(0.001, 0.01, 0.1, 0.5, 1, 5, 10和50 μg/mL)的自由阿霉素藥物組(free DOX)和載藥膠束組(RMSM-DOX)。分別在兩個pH(7.4和6.5)下繼續培養2 h,之后棄去培養液,加入500 μL新鮮的培養基,繼續培養24 h,之后每孔加入25 μL 5 mg/mL的MTT溶液,4 h后棄去培養液,每孔加入150 μL DMSO,室溫孵育15~20 min,振蕩培養板,用酶聯檢測儀在570 mm波長檢測光吸收值,計算細胞相對增殖百分率,并根據結果估測半抑制率IC50。
3)多功能抗腫瘤納米載藥膠束的細胞攝取實驗
將HepG2細胞以每孔105個接種到96孔板中,每孔均加入500 μL RPMI-1640培養基,培養24 h后,棄去原培養基并加入500 μL新鮮培養基,其中分別含10 μg/mL阿霉素的自由阿霉素藥物組(free DOX)和載藥膠束組(RMSM-DOX)。分別在兩個pH(7.4和6.5)下繼續培養2 h,之后棄去培養液,并用500 μL PBS緩沖溶液洗滌三次。在倒置熒光顯微鏡(DMI6000B, Leica, Wetzlar, Germany)下觀察不同膠束的細胞攝取情況。研究結果顯示,自由阿霉素藥物組在pH 7.4和6.5下,細胞中阿霉素的熒光強度均較弱且變化不大。載藥膠束組在pH 7.4時,阿霉素熒光強度較弱,而在pH 6.5時熒光強度大大增加,并高于自由阿霉素藥物組。
4)多功能抗腫瘤納米載藥膠束的抗腫瘤藥效研究
將HepG2細胞以4×105的量移植到BALB/c裸鼠的腹部。培養4-5周,當荷瘤小鼠的腫瘤體積在200 mm3后,將小鼠隨機分為三組,分別為生理鹽水組(Saline)、自由阿霉素藥物組(free DOX)和載藥膠束組(RMSM-DOX),每組十只。DOX劑量為5 mg/kg小鼠體重。五組小鼠分別通過尾靜脈注射六次,每兩天一次。在第一次注射后三十天內檢測小鼠腫瘤的體積和重量。
檢測:
取1 mL RMSM-DOX冷凍干燥,將冷凍干燥產物溶于1 mL二甲基甲酰胺(DMF)中,熒光光譜測定DOX的熒光強度,利用DOX在DMF中的標準曲線,計算DOX含量,通過所測結果得到熒光強度(F)與阿霉素濃度(c)的關系式為F=-183.1+438.8c。
藥物負載率(DLC)和包封率(DLE)的計算公式如下:
DLC(wt%)=(載藥量/載藥膠束總質量)×100%;
DLE(%)=(載藥量/初始投藥量)×100%。
通過測定計算載藥膠束組的DLC(wt%)為9.9%,DLE(%)為21.9%。
- 還沒有人留言評論。精彩留言會獲得點贊!