共載化療藥物和核酸的腫瘤靶向納米粒子及制備方法與流程
本發明屬于納米藥物領域,具體地涉及一種共載化療藥物和核酸的腫瘤靶向納米粒子及制備方法。
背景技術:
惡性腫瘤的發病率、死亡率呈現逐年增加的趨勢,嚴重威脅著人類的健康。近年來,隨著肝外科技術、麻醉技術以及圍手術期處理水平的不斷進步,手術治療成為治療惡性腫瘤的首選。然而,臨床絕大多數的患者在確診時已經失去了手術的機會。化療也是治療惡性腫瘤的常見策略之一,但是由于腫瘤具有異質性,單一的化療往往不能取得理想的療效,且患者易對化療產生耐受。
上個世紀60年代末,美國科學家Michael Blaese首次在醫學界提出了基因治療的概念。腫瘤的發生發展過程中涉及多種基因的表達和功能異常,而這些基因異常與細胞的生長、分化和死亡等密切相關。基因/藥物聯合治療能夠針對腫瘤細胞內的不同靶點發揮治療作用,從而發揮協同治療作用,提高藥物療效;與單一治療方法相比,聯合治療方法可以減少藥物劑量,從而降低毒副作用;此外,基因/藥物聯合治療還能夠有效地降低腫瘤耐藥的發生。
然而,在實際應用中,聯合治療仍然面臨著巨大的挑戰,主要包括:如何保證核酸藥物在體內不降解,如何解決化療藥物的溶解性問題,以及如何將二者同時靶向輸送至腫瘤部位并實現有效釋放。因此,設計一種簡單有效的共輸送體系是聯合治療成功的關鍵。
聚賴氨酸是一種陽離子多肽,其結構中的伯氨基通過質子化作用而使其帶正電荷,通過靜電作用可與表面帶磷酸基的核酸復合形成納米粒子。低分子量的賴氨酸(<3000)可質子化伯氨基數量少,較難與核酸形成穩定的復合物,而高分子的聚賴氨酸雖然可以提高轉染效率,但卻有著細胞毒性大的缺點。因此,有必要對其進行結構改造、表面修飾等方法來提高其性能。
天然材料β-環糊精(β-Cyclodextrin,β-CD),具有良好的生物相容性及可降解性等優勢,其可以通過“主-客體”相互作用包合多種疏水性小分子,提高藥物溶解性,增加藥物穩定性。然而,單一的β-CD并不能與疏水性藥物實現自組裝。將β-環糊精引入聚合物的結構中使其具備特殊的結構與性質,是一種優良的藥物載體材料。因此,將β-環糊精與聚賴氨酸有效的結合,不僅有效降低了聚賴氨酸的毒性,可以實現藥物和核酸的共載。
目前,尚未有用透明質酸與共載化療藥物和核酸制成腫瘤靶向納米粒子的報道。
技術實現要素:
本發明目的是克服現有技術的不足,提供一種制備簡捷、省時節能的共載化療藥物和核酸的腫瘤靶向納米粒子。
本發明的第二個目的是提供共載化療藥物和核酸的腫瘤靶向納米粒子的制備方法。
本發明的第三個目的是提供共載化療藥物和核酸的腫瘤靶向納米粒子的用途。
本發明的技術方案概述如下:
一種共載化療藥物和核酸的腫瘤靶向納米粒子的制備方法,包括如下步驟:
(1)將6-醛基化β-環糊精、聚-L-賴氨酸氫溴酸鹽溶于pH=4.4的醋酸鹽緩沖溶液中,室溫攪拌1-2h,加入氰基硼氫化鈉,室溫繼續攪拌48~72h;加氫氧化鈉水溶液使體系呈中性,在半透膜截留分子量為7000Da的條件下超純水透析2d、透析液冷凍干燥獲得聚賴氨酸接枝β-環糊精衍生物;所述聚賴氨酸接枝β-環糊精衍生物簡稱PLCD;
所述聚-L-賴氨酸氫溴酸鹽粘均分子量為15000~30000Da;
以賴氨酸結構單元計的聚-L-賴氨酸氫溴酸鹽、6-醛基化β-環糊精和氰基硼氫化鈉的摩爾比為1:(0.5~2):4;
(2)按質量比為1:(0.3~0.5)的比例,將PLCD與疏水性化療藥物溶解于二甲基亞砜中,室溫攪拌8~12h,在半透膜截留分子量為8000~14000Da的條件下純水透析24h、冷凍干燥,得到載化療藥物的納米粒子;
(3)將載化療藥物的納米粒子與核酸分別溶于DEPC水中,調節兩種溶液的濃度使載化療藥物的納米粒子與核酸的N/P摩爾比為30~50:1,將二者等體積混合,渦旋震蕩20~30s,經室溫靜置孵育30~60min,得共載化療藥物和核酸的納米粒子;
(4)將共載化療藥物和核酸的納米粒子滴加于質量濃度為0.75~1.0mg/mL的透明質酸水溶液中,在200-400rpm的條件下,攪拌5-10min,得共載化療藥物和核酸的腫瘤靶向納米粒子;透明質酸與共載化療藥物和核酸的納米粒子的質量比為(3~4):6。
疏水性化療藥物優選阿霉素、喜樹堿或紫杉醇,也可以用其它的疏水性化療藥物。
核酸優選為質粒DNA、小干擾RNA、microRNA或無功能核苷酸序列,也可以使用其它的核酸。
質粒DNA優選質粒pEGFP-C1,也可以選其它的質粒。
小干擾RNA為c-myc siRNA,所述c-myc siRNA核苷酸序列如SEQ ID NO.1所示。
microRNA為miR-122,所述miR-122核苷酸序列如SEQ ID NO.2所示。
無功能核苷酸序列為Control RNA或異硫氰酸熒光素標記的RNA,即FAM-RNA;所述Control RNA的核苷酸序列如SEQ ID NO.3所示;所述FAM-RNA的核苷酸序列如SEQ ID NO.4所示。
透明質酸分子量為20000~40000Da。
上述方法制備的共載化療藥物和核酸的腫瘤靶向納米粒子。
上述共載化療藥物和核酸的腫瘤靶向納米粒子在制備抗肝癌或抗乳腺癌藥物中的應用。
本發明的優點:
本發明制備工藝簡單,易于操作,省時節能,且所用載體材料生物安全性高,具有良好生物相容性、可生物降解性、無毒性,無免疫原性。
本發明的共載化療藥物和核酸的腫瘤靶向納米粒子具有典型的核-殼結構,粒徑為150~200nm,可以有效地將化療藥物和核酸同時攜帶進入高表達CD44分子的細胞,抑制細胞增殖,并具有顯著的體內外腫瘤靶向性。
附圖說明
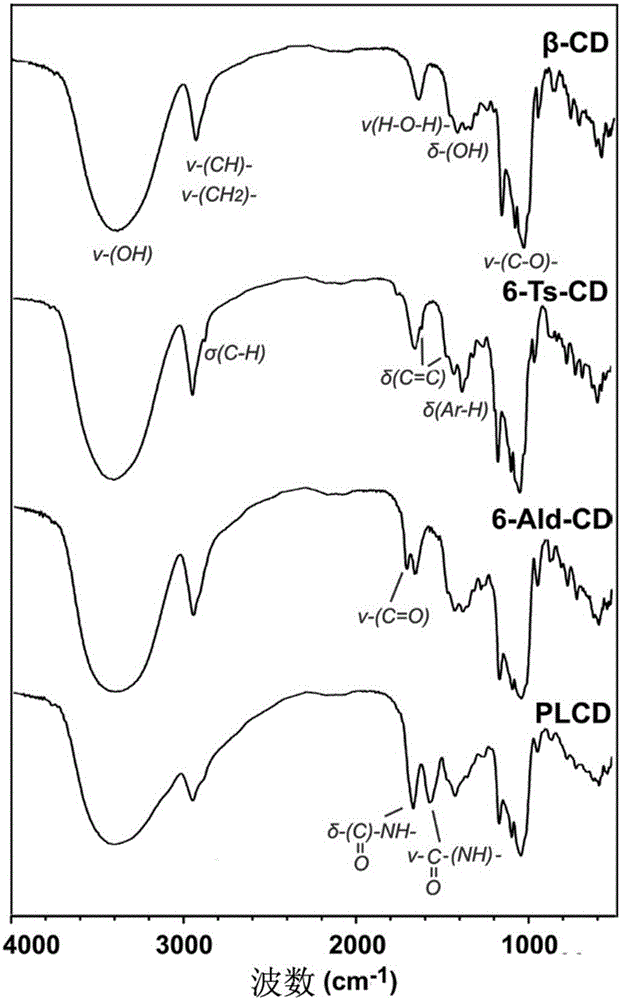
圖1,實施例1中β-環糊精(β-CD)、6-單-(對-甲苯磺酰基)-β-環糊精(6-Ts-CD)、6-醛基化β-環糊精(6-Ald-CD)、聚賴氨酸接枝β-環糊精衍生物(PLCD)的紅外光譜圖;
圖2,實施例1中的β-CD、6-Ts-CD、6-Ald-CD、PLCD的核磁氫譜圖;
圖3,實施例1中不同氮磷比時載藥體系PLCD/DOX壓縮寡聚RNA的瓊脂糖電泳結果;
圖4,實施例1中氮磷比為30:1時共載藥物和基因的納米復合物(PDR)的電子顯微鏡照片(a)和粒徑分布圖(b);
圖5,實施例1中不同質量比時透明質酸(HA)包裹PDR納米復合物后的瓊脂糖電泳結果;
圖6,實施例1中不同質量比時HA包裹PDR納米復合物后的粒徑和Zeta電位分析;
圖7,實施例1中HA與PDR質量比為3:6時的共載藥物和基因的腫瘤靶向納米復合物(HPDR)的透射電子顯微鏡照片(a)及粒徑分布圖(b);
圖8,實施例2中PDR及HPDR在不同pH值介質中阿霉素的體外釋放曲線。
圖9,實施例3中PDR及HPDR分別處理肝癌細胞MHCC-97H后的激光共聚焦顯微鏡照片。
圖10,實施例4中PDR及HPDR分別處理肝癌細胞MHCC-97H的細胞毒性比較。
圖11,實施例5中PDR及HPDR在裸鼠體內的組織分布圖。
具體實施方式
下面結合具體實施例對本發明作進一步的說明,本發明的實施例是為了使本領域的技術人員能夠更好地理解本發明,但并不對本發明作任何限制。
質粒pEGFP-C1(市售)。
6-單-(對-甲苯磺酰基)-β-環糊精(6-Ts-CD)的合成
將180gβ-環糊精(β-CD)混懸于1.5L蒸餾水中,使用恒壓滴液漏斗向混懸液中緩慢滴加60mL NaOH溶液(8.2M)。滴加完待溶液澄清后,將反應體系置于冰水浴中。另將45.4g對甲苯磺酰氯溶于135mL乙腈,逐滴加入至上述反應體系。將體系置于23℃水浴中,攪拌反應2h后,離心收集生成的沉淀,上清液用HCl調節pH至6左右,置于4℃冰箱中過夜,離心收集析出的沉淀。兩次沉淀合并,在水中重結晶兩次,真空干燥得到白色粉末6-單-(對-甲苯磺酰基)-β-環糊精(6-Ts-CD)(產率為12.9%)
6-醛基化-β-環糊精(6-Ald-CD)的合成
取4g上述制備的6-Ts-CD溶于40mL干燥的DMSO中,加入16mL三乙胺,反應體系在氮氣保護下逐漸升高溫度至135℃,繼續攪拌反應5h,而后將反應產物傾入丙酮中,離心收集沉淀,經反復洗滌真空干燥即得6-Ald-CD(產率為69%)。
通過紅外光譜儀和核磁共振波譜儀對β-CD、6-Ts-CD、6-Ald-CD進行化學結構表征,紅外譜圖見圖1,核磁共振氫譜圖見圖2。
實施例1
(1)聚賴氨酸接枝β-環糊精衍生物(PLCD)的合成
將282mg(0.25mmol)6-Ald-CD、57mg(其中賴氨酸結構單元為0.25mmol)聚-L-賴氨酸氫溴酸鹽溶于5mL pH 4.4的醋酸鹽緩沖溶液(0.2M)中,室溫攪拌反應1h,加入62.8mg(1mmol)氰基硼氫化鈉,室溫繼續攪拌72h,加2M的NaOH水溶液使體系調節至中性,而后將反應體系轉移至透析袋中(截留分子量為7000Da),超純水中透析2d,透析液經冷凍干燥,所得白色絮狀產物即為聚賴氨酸接枝β-環糊精衍生物(PLCD),其中β-CD的取代度為12.9%。
所述聚-L-賴氨酸氫溴酸鹽粘均分子量為15000~30000Da;
通過紅外光譜儀和核磁共振波譜儀對PLCD進行化學結構表征,紅外譜圖見圖1,核磁共振氫譜圖見圖2。
(2)載阿霉素的納米粒子的制備與表征
精密稱取10mg PLCD及3.2mg鹽酸阿霉素(含阿霉素3mg)溶于1mL二甲基亞砜中,加入2.2μL三乙胺使鹽酸阿霉素脫鹽,室溫攪拌8h,將體系轉移至透析袋中(截留分子量為8000~14000Da),經純水透析24h,透析液經冷凍干燥,所得暗紅色絮狀產物即得載阿霉素的納米粒子(PLCD/DOX);采用動態光散射檢測PLCD/DOX的粒徑為199.1nm,Zeta電位為40.5mV;采用紫外光譜法于480nm處檢測DOX的載藥量為11.0%。
(3)載阿霉素和Control RNA的納米粒子的制備與表征
將Control RNA用DEPC水配制成0.1mg/mL,同時,PLCD/DOX用DEPC水溶解,分別配制成0.1mg/mL、0.2mg/mL、0.5mg/mL、1.0mg/mL、2.0mg/mL、3.0mg/mL、4.0mg/mL及5.0mg/mL的溶液,然后取50μL各種濃度的PLCD/DOX溶液加入等體積的Control RNA溶液中,使得各個體系中PLCD/DOX與Control RNA的N/P摩爾比為1:1、2:1、5:1、10:1、20:1、30:1、40:1及50:1,渦旋震蕩30s,室溫靜置孵育30min,即得共載阿霉素和Control RNA的復合物(PLCD/DOX)/RNA。
采用瓊脂糖凝膠電泳法考察PLCD/DOX對Control RNA的復合能力,當N/P比大于等于30:1時,RNA的遷移可以完全被抑制,結果見圖3。
N/P比為30:1時制備的(PLCD/DOX)/RNA簡稱為PDR。
采用透射電子顯微鏡(TEM)觀察PDR納米粒子呈規則球形,結構致密;采用動態光散射法檢測PDR納米粒子的粒徑為168.9nm,Zeta電位為38.7mV;TEM照片與粒徑分布圖見圖4。
(4)共載阿霉素和Control RNA的腫瘤靶向納米粒子的制備與表征
將透明質酸(HA)溶于DEPC水中,分別稀釋成0.25mg/mL,0.50mg/mL,0.75mg/mL及1.0mg/mL的水溶液,然后將100μL PDR溶液(1.505mg/mL)逐滴加入等體積的HA溶液中,使各個體系中的HA與PDR的質量比分別為1:6,2:6,3:6,4:6;200rpm攪拌5min,得共載阿霉素和Control RNA的腫瘤靶向納米粒子HA/(PLCD/DOX)/RNA;
采用瓊脂糖凝膠電泳法考察個HA修飾PDR后對RNA復合情況的影響,結果見圖5,實驗結果表明修飾HA后不會影響PDR對RNA的復合;采用動態光散射法表征不同HA/PDR質量比制備的納米復合物的粒徑及zeta電位變化,當HA/PDR的質量比增加至3:6時,納米粒子的粒徑為195.6nm,zeta電位由正電轉變為負電,為-22.7mV,變化趨勢如圖6;
HA與PDR的質量比為3:6時制備的HA/(PLCD/DOX)/RNA簡稱HPDR。
采用TEM觀察HPDR的形態呈規則球形,并具有典型的“核-殼”結構;TEM照片及粒徑分布見圖7。
實施例2
體外藥物釋放實驗
將實施例1制備的PDR和HPDR各取三份,每份1mL,轉移至透析袋中(截留分子量為8000~14000Da),分別置于10mL pH 5.0、6.5及7.4的PBS溶液中,37℃避光振蕩(100rpm),于不同的時間點(見圖8)取出1.5mL介質用于測試,并補充等體積的新鮮透析介質;采用紫外分光光度儀檢測DOX的釋放量(檢測波長為480nm)。按照以下公式計算藥物累積釋放率:DOX累積釋放率=(DOX釋放量/投入DOX總量)×100%。DOX釋放曲線見圖8,呈現緩慢釋藥的特性,并具有顯著的pH敏感性。
實施例3
細胞攝取研究
以FAM-RNA替代實施例1中的Control RNA,其它同實施例1,制備的PDR和HPDR分別命名為PDRFAM和HPDRFAM。
采用肝癌細胞系MHCC-97H考查PDRFAM和HPDRFAM進入細胞的能力及定位;上述細胞在37℃,5%CO2培養箱中培養,培養基為含10%FBS的高糖DMEM培養基;待細胞生長處于對數生長期,消化細胞按照5×104細胞/孔的密度接種于預先鋪好激光共聚焦專用玻璃片的12孔板中,培養24h后,加入無血清培養基稀釋的游離DOX,FAM-RNA,PDRFAM和HPDRFAM,使體系中DOX終濃度為3.3μg/mL,FAM-RNA終濃度為1.0μg/mL;孵育4h后,細胞經4%多聚甲醛固定,DAPI染細胞核,取出玻璃片,于激光共聚焦顯微鏡下觀察細胞內熒光情況,結果見圖9。PDRFAM和HPDRFAM均能同時攜載DOX和FMA-DNA進入細胞,且經HPDRFAM處理的細胞內熒光明顯增強,說明HPDRFAM較PDRFAM具有明顯的腫瘤靶向性。
實施例4
細胞毒性研究
采用肝癌細胞系MHCC-97H研究實施例1中的PDR和HPDR對細胞的殺傷作用。上述細胞在37℃,5%CO2培養箱中培養,培養基為含10%FBS的高糖DMEM培養基。待細胞生長處于對數生長期,消化細胞按照4×104細胞/孔的密度接種于96孔板中,培養24h后,加入不同濃度的PDR和HPDR。孵育48h后,加入CCK-8測定于450nm處測定吸光度。按照以下公式計算細胞存活率:細胞存活率=(實驗孔吸光度-空白孔吸光度)/(對照孔吸光度-空白孔吸光度)×100%,結果見圖10。結果表明:PDR和HPDR對肝癌細胞的殺傷作用呈現濃度依賴性,且HPDR具有更強的細胞殺傷作用。
實施例5
小鼠體內組織分布考察
以近紅外熒光探針Cy5.5對實施例1制備的PDR和HPDR進行標記,方法如下:
步驟(1)、(2)同實施例1步驟(1)、(2)
(3)Control RNA用DEPC水配制成0.1mg/mL,PLCD/DOX用DEPC水溶解,配制成3.0mg/mL的溶液,Cy5.5溶于二甲基亞砜中,使其終濃度為5mg/mL,取6.0μL Cy5.5的二甲基亞砜溶液加入200μL PLCD/DOX的水溶液中,室溫攪拌4h,然后將其加入200μL的Control RNA液中,使體系中PLCD/DOX與Control RNA的N/P摩爾比為30:1,渦旋震蕩30s,室溫靜置30min,得Cy5.5標記的PDR,命名為PDRCy5.5。
(4)將透明質酸(HA)溶于DEPC水中,稀釋成0.75mg/mL,然后將200μL PDRCy5.5溶液(1.505mg/mL)逐滴加入等體積的HA溶液中,使體系中的HA與PDRCy5.5的質量比為3:6;200rpm攪拌5min,得Cy5.5標記的HPDR,命名為HPDRCy5.5。
MHCC-97H裸鼠肝癌皮下移植瘤模型:對數生長期的MHCC-97H細胞經胰酶消化離心后,用無血清DMEM培養基重懸,并調整細胞濃度至5×107個/mL。然后用注射器吸取200μL上述細胞懸液接種于裸鼠皮下,裸鼠經飼養3~4周后,即形成MHCC-97H荷瘤裸鼠用于以下實驗。
將荷瘤裸鼠分為3組,經尾靜脈分別注射生理鹽水、PDRCy5.5和HPDRCy5.5,然后利用活體成像分別于2h,8h,24h觀察Cy5.5在裸鼠體內各組織臟器中的分布,成像照片見圖11。結果表明:PDRCy5.5和HPDRCy5.5在8h開始滯留于肝臟,給藥24h后PDRCy5.5主要富集于肝臟和腫瘤,而HPDRCy5.5主要富集于腫瘤部位,說明HPDR具有更強的腫瘤靶向性。
實施例6
一種共載化療藥物和核酸的腫瘤靶向納米粒子的制備方法,包括如下步驟:
(1)將6-醛基化β-環糊精、聚-L-賴氨酸氫溴酸鹽溶于pH=4.4的醋酸鹽緩沖溶液中,室溫攪拌2h,加入氰基硼氫化鈉,室溫繼續攪拌48h;加氫氧化鈉水溶液使體系呈中性,在半透膜截留分子量為7000Da的條件下超純水透析2d、透析液冷凍干燥獲得聚賴氨酸接枝β-環糊精衍生物;所述聚賴氨酸接枝β-環糊精衍生物簡稱PLCD;
所述聚-L-賴氨酸氫溴酸鹽粘均分子量為15000~30000Da;
以賴氨酸結構單元計的聚-L-賴氨酸氫溴酸鹽、6-醛基化β-環糊精和氰基硼氫化鈉的摩爾比為1:0.5:4;
(2)按質量比為1:0.4的比例,將PLCD與喜樹堿溶解于二甲基亞砜中,室溫攪拌10h,在半透膜截留分子量為8000~14000Da的條件下純水透析24h、冷凍干燥,得到載喜樹堿的納米粒子;
(3)將載喜樹堿的納米粒子與pEGFP-C1分別溶于DEPC水中,調節兩種溶液的濃度使載喜樹堿的納米粒子與pEGFP-C1的N/P摩爾比為30:1,將二者等體積混合,渦旋震蕩20s,經室溫靜置孵育60min,得共載喜樹堿和pEGFP-C1的納米粒子;
(4)將共載喜樹堿與pEGFP-C1的納米粒子滴加于質量濃度為1.0mg/mL的透明質酸水溶液中,在300rpm的條件下,攪拌10min,得共載喜樹堿與pEGFP-C1的腫瘤靶向納米粒子;透明質酸與共載喜樹堿與pEGFP-C1的納米粒子的質量比為3:6。
實施例7
一種共載化療藥物和核酸的腫瘤靶向納米粒子的制備方法,包括如下步驟:
(1)將6-醛基化β-環糊精、聚-L-賴氨酸氫溴酸鹽溶于pH=4.4的醋酸鹽緩沖溶液中,室溫攪拌1.5h,加入氰基硼氫化鈉,室溫繼續攪拌60h;加氫氧化鈉水溶液使體系呈中性,在半透膜截留分子量為7000Da的條件下超純水透析2d、透析液冷凍干燥獲得聚賴氨酸接枝β-環糊精衍生物;所述聚賴氨酸接枝β-環糊精衍生物簡稱PLCD;
所述聚-L-賴氨酸氫溴酸鹽粘均分子量為15000~30000Da;
以賴氨酸結構單元計的聚-L-賴氨酸氫溴酸鹽、6-醛基化β-環糊精和氰基硼氫化鈉的摩爾比為1:2:4;
(2)按質量比為1:0.5的比例,將PLCD與紫杉醇溶解于二甲基亞砜中,室溫攪拌12h,在半透膜截留分子量為8000~14000Da的條件下純水透析24h、冷凍干燥,得到載紫杉醇的納米粒子;
(3)將載紫杉醇的納米粒子與c-myc siRNA分別溶于DEPC水中,調節兩種溶液的濃度使載紫杉醇的納米粒子與c-myc siRNA的N/P摩爾比為50:1,將二者等體積混合,渦旋震蕩30s,經室溫靜置孵育30min,得共載紫杉醇和c-myc siRNA的納米粒子;
(4)將共載紫杉醇和c-myc siRNA的納米粒子滴加于質量濃度為0.75mg/mL的透明質酸水溶液中,在400rpm的條件下,攪拌8min,得共載紫杉醇和c-myc siRNA的納米粒子的腫瘤靶向納米粒子;透明質酸與共載紫杉醇和c-myc siRNA的納米粒子的質量比為4:6。
用miR-122或異硫氰酸熒光素標記的RNA替代本實施例的c-myc siRNA,其它同本實施例,制備出相應的HPDR。
實驗證明,實施例6和實施例7制備的HPDR分別采用TEM觀察形態呈規則球形,并具有典型的“核-殼”結構;粒徑分布與實施例1的HPDR相似。
體外藥物釋放實驗證明,實施例6和實施例7制備的HPDR呈現緩慢釋藥的特性,并具有顯著的pH敏感性。
細胞攝取實驗證明,實施例6和實施例7HPDRFAM具有明顯的腫瘤靶向性。
細胞毒性實驗證明,實施例6和實施例7HPDR具有強的細胞殺傷作用。
SEQ ID NO.1(5’-AACGUUAGCUUCACCAACAUU-3’)
SEQ ID NO.2(5'-UGGAGUGUGACAAUGGUGUUUG-3')
SEQ ID NO.3(5’-AATTCTCCGAACGTGTCACGT-3’)
SEQ ID NO.4(5’-FAM-AATTCTCCGAACGTGTCACGT-3’)。
SEQUENCE LISTING
<110> 天津市腫瘤醫院
<120> 共載化療藥物和核酸的腫瘤靶向納米粒子及制備方法
<130>
<160> 4
<170> PatentIn version 3.3
<210> 1
<211> 21
<212> RNA
<213> 人工合成
<400> 1
aacguuagcu ucaccaacau u 21
<210> 2
<211> 22
<212> RNA
<213> 人工合成
<400> 2
uggaguguga caaugguguu ug 22
<210> 3
<211> 21
<212> DNA
<213> 人工合成
<400> 3
aattctccga acgtgtcacg t 21
<210> 4
<211> 21
<212> DNA
<213> 人工合成
<400> 4
aattctccga acgtgtcacg t 21
- 還沒有人留言評論。精彩留言會獲得點贊!