PKA抑制劑H?89的新應用的制作方法
本發明涉及一種PKA抑制劑H-89的新用途,屬于生物醫藥
技術領域:
。
背景技術:
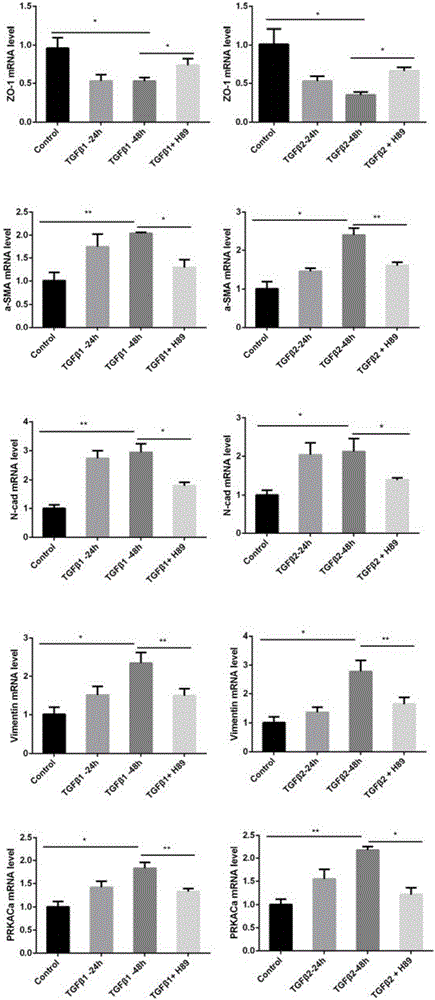
:增生性玻璃體視網膜病變(PVR)是指孔源性視網膜脫離后玻璃體腔內和視網膜表面的膜增生和收縮的病變,這些增生的膜可以牽拉和重新打開已經修復的裂孔,造成新的裂孔并且扭曲和遮擋黃斑,同時PVR也是最常見的導致視網膜脫離手術失敗的原因,據報道其發生率為5.1%~11.7%,在最終失敗的視網膜脫離手術中,75%的病因都歸因于PVR,因此其也是致盲的主要原因。文獻報道僅有11~25%的PVR患者經治療后視力能夠達到0.2以上。但是迄今為止對PVR的發病機制的研究仍不明確,臨床上沒有可用的有效治療藥物,仍主要通過玻璃體切除手術治療,但手術較為復雜,且手術也不能徹底解決問題,術后容易復發,往往經過多次手術,患者的視功能仍逐漸下降甚至喪失,而且手術費用也很昂貴,給患者及家屬帶來沉重的心理負擔及經濟損失,因而深入研究PVR的發病機制,探尋安全有效的靶向藥物治療方法,來輔助視網膜脫離手術的成功,對于PVR的治療具有重要的臨床意義和社會價值。在增生性玻璃體視網膜病變的發病機制中,上皮-間質化(EMT)被認為是最重要的機制之一。EMT是指上皮細胞通過特定程序逐步轉化成為具有間質表型細胞的生物學過程,如失去典型的上皮樣形態,而轉變為纖維樣形態,并失去細胞之間的緊密連接,上皮細胞標記物如ZO-1,E-cad等表達下降,而間質細胞標記物如a-SMA,FN,Vimentin等表達增加,細胞的增生、遷移能力增強,在多種纖維化疾病中有著重要的作用。RPE細胞在多種細胞因子的作用下發生EMT是PVR的重要病理過程。目前關于PVR的EMT相關機制的研究最多的是TGFβ信號通路,被認為是最主要的PVR發病的纖維化因子,在PVR患者的玻璃體、視網膜下液以及增殖膜中都高表達。TGFβ信號通路包括經典的Smad信號通路和非經典信號通路。在經典的TGFβ-Smad信號通路中,TGFβ與I型受體結合,再直接磷酸化Smad2和Smad3,然后再與Smad4結合并轉運到細胞核中去發揮它們的作用。而非經典的TGFβ信號通路主要包括絲裂原活化蛋白激酶(MAPK)、細胞外信號調節激酶1/2(ERK1/2)和磷脂酰肌醇-3激酶(PI3-K)/蛋白激酶B(PKB或者AKT)/哺乳動物雷帕霉素靶蛋白(mTOR),其中MAPK非經典通路包含p38MAPK,c-JNK和p42/44ERK。目前為止,在PVR的機制研究中,還沒有涉及到關于蛋白激酶A(PKA)信號通路以及TGFβ和PKA信號通路相互關系的研究。PKA是一個在細胞中廣泛存在的依賴于cAMP的絲-蘇氨酸激酶,PKA包含兩個調節亞基和兩個激活亞基,當細胞內c-AMP濃度升高時,cAMP與調節亞基結合,改變調節亞基構象,使調節亞基和激活亞基解離,釋放出激活亞基。活化的PKA激活亞基可使細胞內某些蛋白的絲氨酸或蘇氨酸殘基磷酸化,于是改變這些蛋白的活性,進一步影響到相關基因的表達,如一部分激活亞基可以轉運到核內激活轉錄因子c-AMP反應元件結合蛋白(CREB)。PKA信號通路與細胞循環、存活、增殖、分化以及凋亡等多種生命活動相關。而目前在PVR的機制研究當中,除了TGFβ信號通路,還有肝細胞生長因子(HGF)、血小板生長因子(PDGF)、成纖維細胞生長因子(FGF)、骨形態蛋白(BMPs)以及結締組織生長因子(CTGF)等信號通路,但是還沒有有關PKA信號通路的研究,同時也沒有TGFβ和PKA信號通路相互關系的研究。技術實現要素:本發明的目的就是為了探討PVR的機制,尤其是TGFβ和PKA信號通路之間的關系,而進一步闡明PVR的機制,并提供一種PVR治療的有效藥物PKA抑制劑H-89。本發明的目的可以通過以下技術方案來實現:本發明發現在體外TGFβ誘導的EMT細胞模型以及體內SD大鼠PVR模型中,PKA抑制劑H-89都能夠有效地抑制PVR。在體外模型中,我們利用10ng/ml的TGFβ在ARPE19細胞中誘導EMT,用5-20uM的H-89處理EMT的細胞,可以降低EMT相關基因a-SMA、Fibronectin等的表達,而升高上皮相關基因ZO-1等的表達,同時還能保護EMT引起的緊密連接的破壞及組織細胞骨架的重構。在體內試驗中,我們利用玻璃體腔注射8ul的ARPE19細胞(2.4*106)的血小板富集血漿(PRP)懸液的方法成功誘導PVR模型,再通過玻璃體腔注射H-89(終濃度5-50uM)進行治療,與生理鹽水對照組相比,發現H-89能夠保護由于PVR造成的SD大鼠的ERG下降以及視網膜結構的破壞。本發明的第一方面,提供了在體外的細胞模型中,PKA抑制劑H-89能夠抑制ARPE19細胞發生EMT過程模擬的PVR過程。具體而言,PKA抑制劑H-89能夠在體外從mRNA、蛋白以及基因定位等方面保護TGFβ引起的EMT相關基因的改變。本發明的第二方面,提供了在體內的SD大鼠PVR模型中,PKA抑制劑H-89能夠抑制PVR的癥狀,并延緩其進展。具體而言,所述的PKA抑制劑H-89作為TGFβ誘導的人視網膜上皮細胞增值和遷移的抑制劑。在ARPE19細胞聯合血小板富集血漿玻璃體腔注射誘導的PVR模型中,PKA抑制劑H-89的應用能夠保護PVR引起的SD大鼠的視網膜電圖b波波幅的下降。所述的PKA抑制劑H-89作為眼球結構改變抑制劑和前膜形成促進劑的應用。在ARPE19細胞聯合血小板富集血漿玻璃體腔注射誘導的PVR模型中,PKA抑制劑H-89的應用能夠還能夠保護眼球結構的改變如前膜的形成等。所述的PKA抑制劑H-89作為間質細胞標記物抑制劑的應用。在ARPE19細胞聯合血小板富集血漿玻璃體腔注射誘導的PVR模型中,H-89的應用能夠降低EMT標記物a-SMA的表達。本發明的第三方面,揭示了在PVR的發病過程中,TGFβ與PKA信號通路的關系,發現在PVR的過程中,TGFβ能夠激活PKA信號通路。表現為在體外細胞模型中,TGFβ1能夠劑量依賴和時間依賴的增加PKA的活性。本發明的第四方面,提供了PKA抑制劑H-89作為PVR治療藥物與PVR抑制劑的依據,提供了一種通過玻璃體腔注射H-89進行PVR治療的手段。具體而言,PKA抑制劑H-89作為預防和/或治療增生性玻璃體視網膜病變藥物的應用。以及PKA抑制劑H-89作為輔助視網膜脫離手術藥物的應用,PKA抑制劑H-89以玻璃體腔注射劑的形式使用。本發明的第五方面,提供了一種預防和/或治療增生性玻璃體視網膜病變的藥物,主要成分為PKA抑制劑H-89。并提供了一種輔助視網膜脫離手術的藥物,主要成分為PKA抑制劑H-89。本發明首次發現了PKA抑制劑H-89在體外以及體內的PVR模型中對PVR的抑制作用,H-89能夠保護由于PVR發病過程中如EMT等引起的EMT相關的基因表達水平改變以及緊密連接的破壞等,并同時說明了在PVR的發病過程中,TGFβ和PKA信號通路的關系,TGFβ能夠激活PKA信號通路,而PKA抑制劑H-89對PVR的抑制作用可能會通過抑制EMT來實現的。這些結果首次表明在PVR發病過程中,PKA信號通路的作用,以及PKA抑制劑H-89可以作為PVR治療的藥物。與現有技術相比,本發明具有以下優點:1、目前PVR的治療仍以玻璃體切除手術為主,但是手術費用昂貴,且需要反復手術;而PKA抑制劑H-89為小分子化合物價格便宜,容易獲得;2、PVR的藥物治療目前主要有糖皮質激素及非甾體類消炎藥和抑制細胞增生的藥物等,但是目前前者的應用證據還不是很充分,而后者能夠廣譜抑制細胞增殖,會帶來嚴重的潛在的風險。而H-89能夠在體內體外均有效抑制PVR,同時通過玻璃體腔注射進行眼局部用藥,可以避免全身用藥帶來的潛在風險。附圖說明圖1A:H-89在mRNA水平減輕TGFβ1和TGFβ2引起的基因改變。圖1B和1C:H-89在蛋白水平減輕TGFβ1引起的基因改變。圖1D:H-89保護TGFβ1引起的EMT相關蛋白的定位改變以及表達量改變。圖2A和2C:H-89在劃痕實驗中抑制TGFβ1引起的細胞增殖和遷移。圖2B和2D:在Transwell遷移實驗中,H-89抑制TGFβ1引起的細胞遷移。圖3A和3B:H-89治療能夠挽回PVR體內造模引起的SD大鼠視網膜電圖的b波波幅的下降。圖4:眼球冰凍切片免疫熒光圖顯示H-89能夠保護PVR造模引起的前膜形成,并降低EMT標記物a-SMA的表達量。圖5:眼球冰凍切片免疫熒光圖顯示H-89能夠保護PVR造模引起的前膜形成,并降低EMT標記物FN1的表達量。圖6A和6C:TGFβ1能夠激活PKA通路,TGFβ1對PKA活性的增加是劑量依賴的。圖6B和6D:TGFβ1能夠激活PKA通路,TGFβ1對PKA活性的增加是時間依賴的。具體實施方式下面結合附圖和具體實施例對本發明進行詳細說明。以下實施例中,ARPE19細胞購自ATCC,培養基為DMEM:F12培養基含10%血清和1%P/S。培養環境是37℃、5%CO2和95%空氣。TGFβ1、TGFβ2購買自R&D公司。H-89購自Selleck公司,使用濃度為5-50uM。反轉錄試劑盒是PrimeScriptTMRTMasterMix(購自Takara公司),PCR試劑盒是SuperRealPreMixPlus(SYBRGreen)(購自天根公司)。所用引物由蘇州金維智公司合成。Transwell小室,8uM孔徑(購自康寧公司)。PKA活性測定試劑盒購自Promega公司。實施例1PKA抑制劑H-89在體外細胞模型中抑制EMTARPE19細胞EMT誘導:ARPE19細胞匯合度約為40-50%時,進行血清剝奪饑餓過夜處理,然后用10ng/ml的TGFβ1或者TGFβ2處理相應的時間,有或者無H-89干預。EMT誘導之后,細胞形態由典型的上皮樣轉變為成纖維形態,同時失去緊密連接,且細胞增殖也加快。實施例2EMT誘導及H-89處理后q-PCR檢測mRNA變化水平:將正常對照、TGFβ誘導細胞以及H-89處理的TGFβ誘導細胞用1mlTrizol收集在1.5ml管中,進行抽提總RNA。經過逆轉錄和實時定量PCR分析,采用半定量的方法計算。主要步驟如下:1.向Trizol收集的樣品中,加入五分之一200ul體積的氯仿,劇烈混勻后,以12000rpm的轉速4℃離心10分鐘。2.離心后,將上清轉移到新的離心管中,注意不要取到中間的蛋白層,加入等體積的異丙醇。3.12000rpm的轉速4℃離心10分鐘,棄去上清,將沉淀用75%的乙醇洗1-2次。4.將沉淀室溫干燥后,用適量的20ulDEPC水溶解。5.Nanodrop定量,并計算反轉錄所需的體積。6.RNA反轉錄:(1)20ul的體系,1000ng的RNA,取4ul的Takara的逆轉錄試劑supermix,再加ddH2O補到20ul.(2)反轉錄程序:37℃15分鐘,85℃5秒,然后可于-20℃冰箱保存備用。7.定量PCR(1)將RNA反轉錄后得到的cDNA10倍稀釋作為為模板,設計引物如表1。表1q-PCR中所用到的引物序列表Gapdh-ForwardAGGTCGGTGTGAACGGATTTGGapdh-ReverseTGTAGACCATGTAGTTGAGGTCAZO-1-ForwardATTGTCGTCGCATGTAGATCCZO-1-RevrseGGGTTCATAGGTCAGATTAGGCa-SMA-ForwardAATGCAGAAGGAGATCACGGa-SMA-ReverseTCCTGTTTGCTGATCCACATCN-Cad-ForwardCCCAAGACAAAGAGACCCAGN-Cad-ReverseGCCACTGTGCTTACTGAATTGFN1-ForwardGAGCTGCACATGTCTTGGGAACFN1-ReverseGGAGCAAATGGCACCGAGATAVimentin-ForwardCGTGAATACCAAGACCTGCTCVimentin-ReverseGGAAAAGTTTGGAAGAGGCAG(2)利用天根公司的SYBRGreen實時熒光定量PCR檢測試劑盒,q-PCR的體系為20ul,2ul的cDNA模板,1ul的引物,10ul的2XPCRMix,7ul的ddH2O,檢測目的基因的表達量。PCR擴增條件如下:94℃變性10分鐘,進入循環(95℃5sec,60℃60sec),一共40個循環,并收集溶解曲線。(3)數據分析,采用2-△△Ct法進行處理,以Gapdh做為內參。實驗結果如圖1A所示,通過圖可以看出,經TGFβ1和TGFβ2處理后,緊密連接蛋白ZO-1表達下降,而EMT相關基因a-SMA,N-cad,Vimentin以及PKA的激活亞基PRKACa的mRNA水平的表達量明顯上升,而H-89處理能夠抑制TGFβ引起的這些基因mRNA表達的改變。實施例3EMT誘導及H-89處理后WesternBlot檢測蛋白變化水平1、蛋白的提取:將細胞接種在6cm的細胞培養皿中,經相應的處理后,加150μl含有ProteaseInhibitorCocktail的RIPA裂解液,用細胞刮收集細胞到新的EP管中,放冰上孵育30分鐘,10000rpm,4℃離心15分鐘,輕輕吸出上清至干凈的離心管中,-80℃保存備用。2、蛋白濃度的測定:蛋白定量采用BCA定量法,具體方法如下:配制標準蛋白溶液2μg/μl,-20℃保存備用;根據標準品和樣品的數目配制工作液,試劑A和試劑B按50:1的體積比充分混勻,現配現用;工作液總體積=(標準品個數+待測樣品個數)×(2個復孔數)×(200μl工作液)。將標準品按0μl、1μl、2μl、4μl、8μl、16μl的體積加到酶標孔中,每孔加入200μl的BCA工作液,制作標準曲線;待測樣品每孔加入2μl,再加入200μl的BCA工作液,37℃孵育30分鐘;用多功能酶標儀測定560nm處的吸光度值。3、蛋白樣品的準備:根據準備上樣的蛋白量和蛋白濃度,加入5×loadingbuffer,混合后于100℃加熱10分鐘,使其充分的變性,4℃,12000rpm,離心2分鐘,除去沉淀,-80℃貯存備用。4、SDS-PAGE電泳:分離膠的制備:10%的分離膠(10ml)配制方法如下:30%聚丙烯酰胺3.3ml,ddH2O2.7ml,1MTris(PH8.8)3.8ml,10%SDS0.1ml,10%過硫酸銨0.1ml,TEMED0.004ml;灌膠前加APS和TEMED,加完后充分混勻,迅速灌膠。用移液槍將配制好的分離膠溶液緩慢加入到裝配好的玻璃板中,分離膠溶液高度約為6cm,給濃縮膠留出1.5cm高的位置,加好后在凝膠頂部緩緩加入無水乙醇促進膠凝,使凝膠表面呈一條直線;放置1小時左右直到凝膠完全凝固,當無水乙醇和凝膠之間有一條折線時說明凝膠已經凝固,倒掉膠上的無水乙醇,用濾紙吸干。制備5%的濃縮膠(4ml)方法如下:30%聚丙烯酰胺0.67ml,ddH2O2.7ml,1MTris(PH6.8)0.5ml,10%SDS0.04ml,10%過硫酸銨0.04ml,TEMED0.004ml;灌膠前加APS和TEMED,加完后充分混勻,迅速灌膠。用移液槍將配制好的濃縮膠溶液緩慢加入分離膠的上層,直至玻璃板的邊緣,然后小心插入梳子,注意不要產生氣泡,放置約1小時左右凝膠,凝膠之后拔出梳子,準備電泳。將準備好的蛋白樣品和蛋白標記分子加入到加樣孔中,防止氣泡產生,使用Bio-Rad電泳儀,槽內加滿電泳液以后即可開始電泳,電泳條件為:80V電壓,30分鐘,換120V電壓,1小時30分鐘左右。電泳至溴酚藍剛好跑出分離膠底部停止。5、轉膜:SDS-PAGE凝膠電泳結束以后,將玻璃板撬開后小心分離出凝膠,切去濃縮膠的部分,保留分離膠,浸泡于去離子水中;剪取與凝膠大小相似的PVDF膜放入無水甲醇中浸泡2分鐘;將切好的凝膠、濾紙以及事先用無水甲醇浸泡過的PVDF膜放入轉膜平衡液中平衡10分鐘;采用Bio-Rad的轉膜系統,以夾三明治的方式,從黑面到白面的順序依次為:黑面(負極)-海綿墊-濾紙-凝膠-PVDF膜-濾紙-海綿-白面(正極),濾紙、凝膠和PVDF膜要對齊,徹底清除內部氣泡,然后放入裝滿轉膜液的轉膜儀中,轉膜條件為300毫安,2小時;轉膜槽置于冰浴中。轉膜結束后可以參考蛋白Marker轉上PVDF膜作為轉膜成功的標志,也可將膜用1×麗春紅染液染色,然后用水沖洗掉沒染上的染液就可看到膜上的蛋白。6、免疫雜交反應:用1×PBST洗掉麗春紅,配置5%的BSA閉液,室溫封閉1小時。加入用PBST稀釋的一抗,4度過夜;1×PBST洗膜3次,每次10。加入PBST稀釋的HRP標記的二抗,室溫1小時。1×PBST洗膜3次,每次10。ECL化學發光采集結果,以Gapdh作為對照內參。7、數據統計分析:用ImageJ軟件western條帶的灰度分析,然后與對應的Gapdh進行相比,然后再利用GraphpadPrism軟件進行統計分析及作圖。實驗結果如圖1B及圖1C所示,1B為條帶圖,1C為對條帶進行灰度分析后的統計結果,由圖可知經TGFβ1處理后,緊密連接蛋白ZO-1表達下降,而EMT相關基因a-SMA,N-cad,Vimentin,Fibronectin及PRKACa的表達量明顯上升,而H-89處理能夠挽救TGFβ引起的這些基因蛋白水平表達的改變。實施例4EMT誘導及H-89處理后免疫熒光檢測蛋白定位及表達情況1、細胞處理:將細胞接種于預置在培養皿中的玻片上,經相應的處理之后,取出玻片;2、固定:用4%多聚甲醛固定10分鐘,PBS洗3次,每次5分鐘;3、透膜:0.1%tritonX-100透膜10分鐘,PBS洗3次,每次5分鐘;4、封閉:5%馬血清室溫封閉1小時;5、一抗:加5%馬血清室稀釋的一抗,置于濕盒內防止干燥,4℃孵育過夜;6、二抗:PBS洗3次,每次5分鐘;加5%馬血清室稀釋的熒光素酶標記的與一抗同種屬來源的二抗,置于濕盒內,避光37℃孵育1,PBS洗3次,每次5分鐘;7、染核:用0.5μg/mlDAPI染細胞核3分鐘,PBS洗3次,每次5分鐘;8、封片:用熒光封片劑封片。9、拍照:用激光共聚焦顯微鏡,在油鏡,600倍放大進行拍照。實驗結果如圖1D中的免疫熒光圖所示,經TGFβ1處理后,ARPE19細胞之間的緊密連接被破壞,如緊密連接蛋白ZO-1的染色所示;細胞骨架F-actin重構變得紊亂,而H-89處理后,細胞之間的緊密連接重新出現,細胞骨架的重構引起的F-actin的紊亂也有所減輕。與EMT有關的蛋白a-SMA、Fibronectin和Vimentin以及PKA的激活亞基PRKACa經TGFβ1處理后表達量均上升,而H-89處理之后,這些蛋白的表達上升都被抑制。實施例5EMT誘導及H-89處理后劃痕實驗檢測細胞遷移能力1、細胞處理:將細胞接種在96孔板中,做相應的處理之后(如實施例1中所述);2、劃痕:用10uL移液槍槍頭在細胞上呈“一”字劃痕,然后用PBS清洗3次洗掉浮起的細胞。加入對應處理的培養基繼續進行培養。3、拍照:在顯微鏡下分別在劃痕0小時,24小時和48小時的時間點進行拍照。4、數據分析:用ImageJ軟件進行劃痕寬度的測量,獲得寬度數據,然后再利用GraphpadPrism軟件進行統計分析及作圖數據如圖2A和圖2C所示,2A為不同時間點劃痕的圖像,而2C為經ImageJ軟件統計分析后的結果,由圖我們可以看出經TGFβ1處理后,ARPE19細胞的增殖遷移能力明顯增強,48小時后劃痕已經完全看不見,而H-89處理之后,細胞的增殖遷移能力下降特別明顯,說明H-89能夠有效地抑制ARPE19細胞的增殖遷移。實施例6EMT誘導及H-89處理后Transwell實驗檢測細胞遷移能力1.接種:8.0uM的Transwell小室至于24孔板當中,將用實施例1中不同處理的細胞接種于Transwell上室,上室加100ul的1%血清的含有對應處理因子的培養基,下室加600ul的10%血清的培養基;2.細胞遷移:將細胞置于37度,5%二氧化碳的培養箱中培養24小時,讓細胞遷移;3.細胞染色:用棉簽輕輕拭去上室未遷移的細胞,然后用甲醇固定半個小時,小室適當風干,再用伊紅染色半個小時;4.拍照計數:20倍顯微鏡下隨即六個視野觀察細胞,記數。數據如圖2B及2D所示,2B為伊紅染色后的遷移細胞(圖中亮色的部分),2D為細胞計數后的統計結果,由圖可知,經TGFβ1處理后,ARPE19細胞遷移過Transwell小室膜的細胞數量明顯增加,而H-89處理能夠降低約三分之一的遷移細胞數目,說明H-89能夠有效地抑制ARPE19細胞的遷移。實施例7玻璃體腔注射PVR造模1、大鼠準備:6-8W的SD大鼠購自斯萊克公司,飼養在同濟大學動物中心。160~180g重,隨機分為三組,PBS對照組,模型組(ARPE19+PRP),治療組(ARPE19+PRP+H-89)。2、細胞準備:取體外培養的ARPE19細胞,P10-P15之間,調節細胞濃度使得每只眼的細胞數量為2.4*106,分到兩個EP管中分別為模型組合治療組,置于冰上備用。3、血小板富集血漿(PRP)的制備:將大鼠固定于鼠籠內,鼠尾暴露于籠外。穿刺前用酒精棉球擦拭鼠尾,將5號頭皮針和1ml注射器相連接,用肝素鈉稀釋液沖洗針頭和注射器;右手持針,左手拇指在上、示指在下捏住鼠尾,將鼠尾略彎曲以使進針處血管和針頭方向平行,針頭平行于鼠尾刺破表皮后繼續進針3-5mm,針頭進入尾靜脈見回血,左手捏住鼠尾,右手推拉1ml注射器活塞,制造負壓進行取血;取血結束后,應用脫脂棉球按壓針眼部位30s,確定止血后放開大鼠。將取得的血轉移到含3.8%枸櫞酸鈉的采血管內,低溫離心,1000g,1min,其上清液為PRP。4、ARPE19+PRP懸液制備:按照已經計算好的細胞量和注射量,分別用PRP重懸ARPE19細胞,模型組為ARPE19+PRP,治療組為ARPE19+PRP+H-89;使得H-89的終濃度為5-50uM。5、玻璃體腔注射:注射前大鼠腹腔注射2%戊巴比妥鈉(1mL/400g體重)進行麻醉,1×速眠新(0.1ml/200g)進行肌肉松弛,然后給予一滴0.5%托吡卡胺散瞳(WuxiShanheGroup,Jiangsu,China),一滴0.4%鹽酸奧布卡因表面麻醉(EisaiCoLtd,Tokyo,Japan)。在體視顯微鏡下,先用1ml注射器自角膜緣后垂直進針扎一小孔,然后再用注射針由該孔向玻璃體腔內注入相應液體。每只眼的注射體積為8ul。實施例8SD大鼠視網膜電圖ERG采集1.儀器:APS全自動視覺電生理檢查儀(APS-2000)購于重慶康華科技有限公司。暗適應:做視覺電生理功能檢查前一天,把SD大鼠轉移到暗房,進行暗適應。第二天開始做。2.大鼠的準備:向大鼠腹腔注射2%戊巴比妥鈉(1mL/500g體重)進行麻醉,1×速眠新(0.1ml/200g)進行肌肉松弛,然后給予一滴0.5%托吡卡胺散瞳(WuxiShanheGroup,Jiangsu,China),一滴0.4%鹽酸奧布卡因表面麻醉(EisaiCoLtd,Tokyo,Japan),每只眼睛各涂一點導電膏。插電極:地線接大鼠尾巴上,負極接大鼠兩耳朵之間,正極接兩眼睛角膜上,注意不要觸到眼瞼和鞏膜上。3.數據采集:打開軟件“視覺電生理圖”,點“FERG”,再點1,2通道,一個為左眼通道,另一個為右眼通道,點“設置”,刺激次數為2次,刺激頻率為0.05Hz;依次點擊刺激強度(1)―0.0006325(cd*s/m)、(5)―0.006325(cd*s/m)、(9)―0.06325(cd*s/m),每次強度至少間隔2min。點“示波”,待波的基線平穩時,點擊“采集”,等聽到“嘀”的一聲后,采集完畢,點擊“保存”。再點擊“設置”,修改文檔號和刺激強度,依次類推。等所有強度做完后,換下一只大鼠。所有大鼠做完后,打開“文件”,進行標定,雙擊曲線,曲線變為白色,點擊“標定”。標定完a波后,按空格鍵,標定b波。所有標定完畢,點擊“打印”,保存為.PDF格式。點擊左下角按鈕,退出軟件,關閉電腦,關閉放大器。數據如圖3所示,其中3A為ERG的b波波形圖,3B為b波波幅的統計圖,由圖可知,經注射誘導后模型組與PBS對照組相比,b波波幅明顯下降,而治療組與模型組相比,經H-89處理后,b波波幅有所回升,說明H-89能夠對PVR造成的ERGb波波幅的下降有保護作用。實施例9眼球冰凍切片的制備1.眼球準備:PVR造模后的SD大鼠在不同時間點收取眼球樣本,SD大鼠脫臼處死后,仔細摘除眼球,注意保留視神經;2.固定:置于4%多聚甲醛固定過夜;3.解剖:在解剖顯微鏡下沿角鞏膜緣上緣解剖眼球,小心去除角膜,虹膜和晶狀體,形成完整的視杯,注意操作輕柔防治造成視網膜脫離;4.脫水:用30%的蔗糖過夜脫水;5.包埋:用組織包埋液OCT包埋4℃平衡過夜;6.液氮速凍:將眼球用液氮快速冷凍,冷凍之前使得眼球的位置盡量垂直居中。-80℃保存冰凍樣品。7.切片:用冰切機按8μm的厚度進行連續切片,取過視神經乳頭的切片。將切片放在-80℃保存,使用前吹干。實施例10視網膜冰凍切片免疫熒光1.切片準備:取實施例9中所得的眼球冰凍切片樣品進行免疫熒光染色檢測。2.烤片:50℃烤片半小時。3.固定:4%PFA固定10分鐘,再用PBS清洗三次,每次5分鐘。4.透膜:用0.25%Triton-X100透膜15min,PBS洗3次,每次5min。5.封閉:5%馬血清室溫封閉1小時;6.一抗:加5%馬血清稀釋的相應一抗,置于濕盒內防止干燥,4℃孵育過夜。7.二抗:PBS洗3次,每次5min;加5%馬血清稀釋的熒光素酶標記的與一抗同種屬來源的二抗,置于濕盒內,避光37℃孵育1小時。8.DAPI染核:PBS洗3次,每次5min;用0.5μg/mlDAPI染細胞核1min,PBS洗3次,每次5min。9.封片:用熒光封片劑封片。10.拍照觀察:在顯微鏡下拍照觀察。如圖4和圖5所示,為冰凍眼球切片免疫熒光圖片,圖4和圖5分別為EMT相關基因a-SMA和FN1的表達情況,由圖我們可以看出在PBS對照組完全沒有a-SMA以及FN1的表達,在模型組,不僅有前膜形成,而且a-SMA和FN1的表達明顯升高,而在H-89治療組,a-SMA和FN1的表達量明顯下降,尤其是FN1,幾乎沒有表達了。這進一步說明H-89對ARPE19聯合PRP注射引起的前膜形成以及EMT過程有抑制作用,從而證明了H-89對PVR的治療作用。實施例11ARPE19細胞中PKA活性的測定1.細胞用TGFβ1進行不同濃度以及不同時間段的相應處理。2.收樣:消化細胞,用預冷的PKAExtractionbuffer重懸細胞,并用超聲打碎細胞。3.PKA活性檢測:(1)溶液配制:按照商家提供的說明書用PKAdilutionbuffer稀釋所需的c-AMP-dependentProteinKinaseCatalyticSubunit至2ug/ml。并按一下體系混合各溶液,均在冰上操作。實驗組陽性對照陰性對照5XPKAReactionbuffer5ul5ul5ulA1Peptide5ul5ul5ul5XPKAActivatorsolution5ul5ul5ulPeptideProtectionsolution1ul1ul1ulSample1-10ul●5ulPKAcatalyticSubunit0ulddH2OTo25ulTo25ulTo25ul其中樣品和CatalyticSubunit單獨加,將上述其他溶液混好后之后,從冰上拿開,并30℃水域1分鐘,然后分別添加樣品和CatalyticSubunit,室溫孵育30分鐘。(2)熱阻止:用沸水浴或者95℃10分鐘熱阻止后,樣品可保存在4-20℃的黑暗處,直到跑膠前。(3)跑膠:用50mM的Tristan-HCL(PH8.0)配制0.8%的瓊脂糖膠。上樣前,向樣品中加1ul的80%的甘油,確保樣品仍在管中。上樣后,100伏,15-20分鐘或者直到肉眼可見條帶分離清楚為止。4.PKA活性定量:(1)割膠:跑膠后立即割膠,使得膠塊溶解后的體積大約為250ul左右,轉移到1.5毫升EP管中,95℃溶膠,不足的用ddH2O補充至250ul.(2)96孔板轉移:準備一個干凈的96孔板,取125ul的已經溶解的熱膠、75ul的膠溶解液以及50ul的冰醋酸至1個1.5毫升的EP管中快速震蕩后取250ul轉移到96孔板的一個孔當中去,以此加完所有樣品。(3)酶標儀讀數:570nm波長處讀數,以陰性對照孔為空白對照。結果如圖6所示,其中6A、6C為跑膠后的條帶圖,6B、6D為統計圖,由圖可以看出TGFβ1可以激活PKA通路,增加PKA活性,并且該過程還是劑量依賴和時間依賴的。這進一步揭示了在體外PVR模型EMT的過程中PKA通路被激活,從而為H-89能夠抑制EMT,對PVR有治療作用提供了依據。上述的對實施例的描述是為便于該
技術領域:
的普通技術人員能理解和使用發明。熟悉本領域技術的人員顯然可以容易地對這些實施例做出各種修改,并把在此說明的一般原理應用到其他實施例中而不必經過創造性的勞動。因此,本發明不限于上述實施例,本領域技術人員根據本發明的揭示,不脫離本發明范疇所做出的改進和修改都應該在本發明的保護范圍之內。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1