透明質酸鈉/β?磷酸三鈣多孔復合材料的制備方法與流程
本發明涉及組織工程技術領域,具體涉及一種透明質酸鈉/β-磷酸三鈣多孔復合材料的制備方法。
背景技術:
組織工程作為一種替代傳統治療各類骨損傷及器官修復的方法,近年來得到了研究者的重視和不斷發展。組織工程的核心內容為:建立細胞和生物材料的三維空間復合體,即具有生命力的活體組織,用來對病損組織進行形態、結構和功能的重建并達到永久性替代的目的。組織工程三維支架材料也成為組織工程研究的熱點之一。
天然高分子材料由于具有與組織類似的基質成分以及優異的生物相容性、生物可降解性能,因而使其成為組織工程中應用較早的支架材料。透明質酸是一種由D-葡萄糖酸醛和N-乙酰胺基葡聚糖重復二糖單元組成的線性陰離子多糖,具有極佳的生物相容性、降解性和非免疫原性,在細胞遷移、黏附、增殖、分化等方面發揮著重要作用,已廣泛應用于美容填充、傷口敷料、關節潤滑、藥物靶向遞送等方面,更是組織工程良好的支架材料。然而透明質酸存在水溶性高、對自由基及透明質酸酶敏感、容易發生降解、吸收迅速、體內保留時間短,在水體系中缺乏力學強度等問題。
為了解決上述問題,對透明質酸進行改性以提高其抗降解性和力學強度顯得十分重要。透明質酸鈉(HA)分子鏈上的改性位點包括羧基、羥基及乙酰胺基基團等,可利用透明質酸鈉分子內或者分子間的自交聯反應在不引入其它基團的前提下實現對其改性,提高天然高分子材料的抗降解性能和生物穩定性。β-磷酸三鈣(β-TCP)成分與骨組織相似,具有良好的生物相容性、容易降解吸收、具有骨傳導性并且無毒副作用,被視為優良的骨替代材料,且其與天然高分子材料如明膠、殼聚糖的復合能夠顯著的提高復合支架的機械強度和細胞粘附性能。然而β-磷酸三鈣本身脆性大、難于成型、易于潰散,這些缺陷限制了其在承重部位的使用。目前透明質酸鈉與β-磷酸三鈣的復合主要是以復合水凝膠的形式出現,對三維多孔支架的研究不多。
技術實現要素:
本發明的目的在于克服目前透明質酸鈉、β-磷酸三鈣應用在組織工程材料領域所存在的上述問題,提供一種透明質酸鈉/β-磷酸三鈣多孔復合材料的制備方法,采用該方法制備得到的三維多孔支架材料具有良好的生物相容性、可降解性、力學性能,并且制備過程簡單。為實現上述目的,本發明的技術方案如下:
透明質酸鈉/β-磷酸三鈣多孔復合材料的制備方法,包括以下步驟:(a)將透明質酸鈉溶解在純水中,配制成透明質酸鈉溶液;(b)將β-磷酸三鈣粉末溶解在純水中,配制成β-磷酸三鈣懸液;(c)將β-磷酸三鈣懸液與透明質酸鈉溶液按照一定比例混合,攪拌均勻得混合溶液;(d)將混合溶液注入模具中靜置除氣泡,接著經冷凍成型、干燥得到多孔復合支架;(e)將多孔復合支架置于交聯溶液中,接著洗滌、再次冷凍干燥,最后得到透明質酸鈉/β-磷酸三鈣多孔復合支架。
上述方案中,所述透明質酸鈉溶液的濃度為1.25-3.75%(w/v)。
優選的,所述透明質酸鈉分子量在100萬道爾頓以上。
上述方案中,所述β-磷酸三鈣懸液的濃度為4.3-35%(w/v)。
優選的,所述β-磷酸三鈣粉末通過固相反應法制得,其粒徑分布在2-5μm之間,所得β-磷酸三鈣懸液需在100W功率下超聲震蕩20min。
上述方案中,β-磷酸三鈣懸液與透明質酸鈉溶液混合時的體積比為1:4,采用將β-磷酸三鈣懸液逐滴加入到透明質酸鈉溶液中的方式進行混合。
上述方案中,混合溶液注入模具后在4℃下靜置1h去除氣泡,冷凍成型溫度為-20℃或-50℃或-80℃,冷凍干燥溫度為-50℃,冷凍干燥的真空度為20Pa,冷凍干燥時間為48h。
上述方案中,所述交聯溶液中所含交聯劑為2-氯-1-甲基碘代吡啶,溶劑為體積比80:20的無水乙醇-超純水混合液。
上述方案中,交聯溶液中交聯劑與透明質酸鈉中羧基的摩爾比為0.2-1.25:1。
上述方案中,所述洗滌包括先用體積分數為80%的乙醇溶液洗滌三次,再用超純水洗滌三次。
與現有技術相比,本發明具有以下有益效果:(1)利用異相交聯法對透明質酸鈉/β-磷酸三鈣復合支架進行交聯,通過活化透明質酸鈉鏈上的羧基,實現透明質酸鈉分子內或分子間的交聯反應,在不引入其他基團的情況下,實現透明質酸鈉的自身交聯,提高支架的抗降解性能。(2)制作工藝簡單可控,在使用較少交聯劑的情況下即可實現透明質酸鈉的交聯,且在交聯過程中不會破壞支架的宏觀形貌和微觀結構,因此可預先設計所需的支架形狀。(3)通過改變β-磷酸三鈣的用量,可以調節支架的機械強度和抗水解能力。(4)通過本發明方法,可充分利用天然高分子和生物陶瓷材料自身的優點,將兩者有機的結合在一起,制備出用于組織工程的生物支架材料。
附圖說明
圖1為本發明所使用的原料β-磷酸三鈣粉末的掃描電鏡圖;
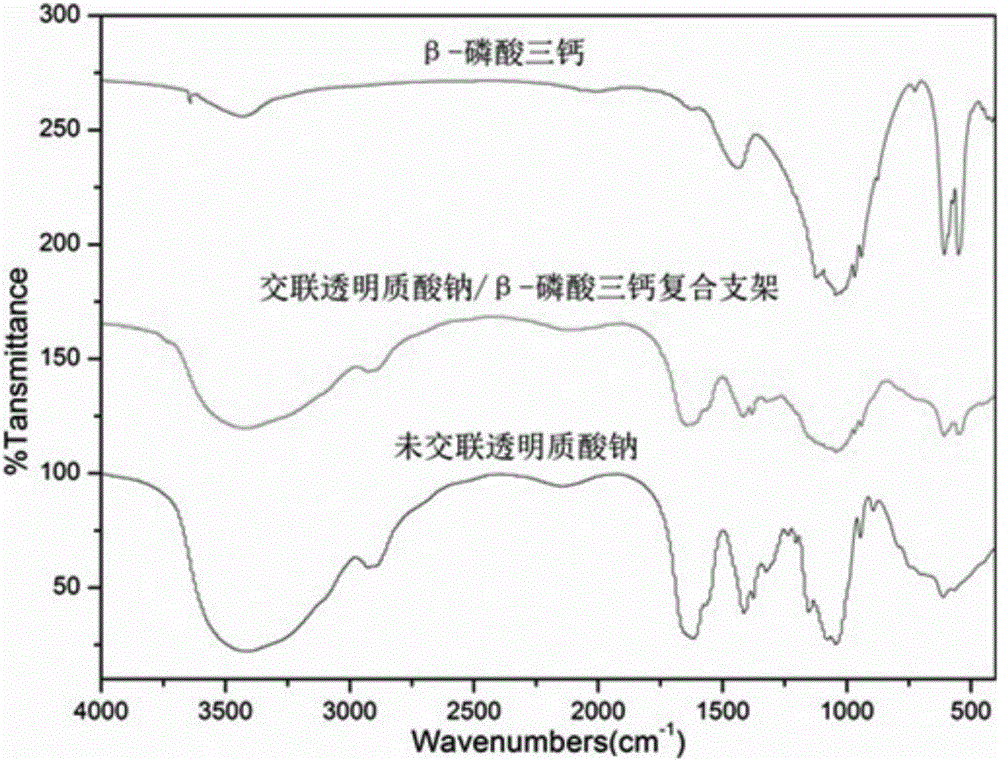
圖2為本發明實施例1中β-磷酸三鈣、交聯透明質酸鈉/β-磷酸三鈣多孔復合支架以及未交聯透明質酸鈉的紅外光譜圖;
圖3為本發明實施例1中β-磷酸三鈣、交聯透明質酸鈉/β-磷酸三鈣多孔復合支架的XRD圖;
圖4為本發明實施例1中交聯透明質酸鈉/β-磷酸三鈣多孔復合支架的掃描電鏡圖。
圖5為本發明實施例1-3及對比例1制備的多孔支架材料抗壓強度對比圖。
具體實施方式
為使本領域普通技術人員充分理解本發明的技術方案和有益效果,以下結合具體實施例及附圖進行進一步詳細說明。本領域普通技術人員應當明白,以下實施例僅用于說明本發明,并不對其構成任何限定。
一種透明質酸鈉/β-磷酸三鈣多孔復合材料的制備方法,包括以下步驟:(a)將分子量在100萬道爾頓以上的透明質酸鈉溶解在純水中,配制成濃度為1.25-3.75%(w/v)的透明質酸鈉溶液;(b)將粒徑分布在2-5μm之間的β-磷酸三鈣粉末(固相反應法制得)溶解在純水中,100W功率下超聲震蕩20min,配制成濃度為4.3-35%(w/v)的β-磷酸三鈣懸液;(c)將β-磷酸三鈣懸液與透明質酸鈉溶液按照1:4的體積比進行混合,攪拌均勻得混合溶液;(d)將混合溶液注入模具中,在4℃下靜置1h去除氣泡,接著在-20℃或-50℃或-80℃冷凍成型,然后在-50℃、20Pa的真空度下干燥48h得到多孔復合支架;(e)將多孔復合支架置于2-氯-1-甲基碘代吡啶的乙醇溶液(乙醇與純水體積比80:20)中交聯,接著用體積分數為80%的乙醇溶液洗滌三次,再用超純水洗滌三次,再次冷凍干燥,最后得到透明質酸鈉/β-磷酸三鈣多孔復合支架。交聯時交聯劑2-氯-1-甲基碘代吡啶與透明質酸鈉中羧基的摩爾比為0.2-1.25:1。
本發明原料之一透明質酸鈉的分子量在100萬道爾頓以上。另一原料β-磷酸三鈣粉末通過固相反應法制得,其微觀結構如圖1所示,從圖1可得其粒徑分布在2-5μm之間。交聯劑2-氯-1-甲基碘代吡啶(CMPI)為普通市售。
實施例1
取0.3g透明質酸鈉粉末溶解在8mL超純水中,室溫條件下攪拌至透明質酸鈉完全溶解,形成濃度為3.75%(w/v)的透明質酸鈉溶液。將0.3gβ-磷酸三鈣加入到2mL超純水中形成濃度為15%(w/v)的懸液,將懸液超聲(功率100W)震蕩20min,接著將其逐滴加入到透明質酸鈉溶液中,攪拌均勻。將所得均勻混合溶液注入到24孔板模具中,4℃下靜置1h去除氣泡,接著在-20℃下冷凍24h成型。之后利用真空冷凍干燥機對樣品進行干燥,冷凍干燥溫度為-50℃,真空度為20Pa,冷凍干燥時間為48h,得到未交聯的透明質酸鈉/β-磷酸三鈣多孔復合支架。將未交聯的復合多孔支架浸沒在交聯溶液中24h進行交聯。交聯完成后將樣品用體積分數為80%的乙醇溶液洗滌三遍,再用超純水洗滌三遍,最后再次冷凍干燥得到交聯后的透明質酸鈉/β-磷酸三鈣多孔復合支架。此處所用交聯溶液為含10mM的2-氯-1-甲基碘代吡啶溶質(CMPI與透明質酸鈉中羧基的摩爾比為0.4:1),溶劑為體積比80:20的乙醇/水混合溶液。
分別對實施例1中的原料β-磷酸三鈣、產物交聯透明質酸鈉/β-磷酸三鈣多孔復合支架以及原料未交聯透明質酸鈉進行了紅外分析,對原料β-磷酸三鈣和產物交聯透明質酸鈉/β-磷酸三鈣多孔復合支架進行了XRD測試,對產物交聯透明質酸鈉/β-磷酸三鈣多孔復合支架進行了掃描電鏡分析,結果分別如圖2-4所示。圖2顯示,交聯后透明質酸鈉位于1620cm-1的羧基峰消失,位于1420cm-1處的羥基峰減弱,并在1655cm-1處形成一個新峰,說明羥基和羧基之間發生了酯化反應,交聯反應實現了。從圖3可知該交聯方法并不影響β-磷酸三鈣的結晶度;從圖4可得知β-磷酸三鈣顆粒均勻的分布在透明質酸鈉基體上,復合支架的孔徑在140μm左右,氣孔率為91.82%。
實施例2
取0.3g透明質酸鈉粉末溶解在8mL超純水中,室溫條件下攪拌至透明質酸鈉完全溶解,形成濃度為3.75%(w/v)的透明質酸鈉溶液。將0.7gβ-磷酸三鈣加入到2mL超純水中,形成濃度為35%(w/v)的懸液,將懸液超聲(功率100W)震蕩20min,然后將其逐滴加入到透明質酸鈉溶液中,攪拌均勻。將所得均勻混合溶液注入到24孔板模具中,4℃下靜置1h去除氣泡,接著在-20℃下冷凍24h成型。之后利用真空冷凍干燥機對樣品進行干燥,冷凍干燥溫度為-50℃,真空度為20Pa,冷凍干燥時間為48h,得到未交聯的透明質酸鈉/β-磷酸三鈣多孔復合支架。將未交聯的復合多孔支架浸沒在交聯溶液中24h進行交聯。交聯完成后將樣品用體積分數為80%的乙醇溶液洗滌三遍,再用超純水洗滌三遍,最后再次冷凍干燥得到交聯后的透明質酸鈉/β-磷酸三鈣多孔復合支架。此處所用交聯溶液為含10mM的2-氯-1-甲基碘代吡啶溶質(CMPI與透明質酸鈉中羧基的摩爾比為0.4:1),溶劑為體積比80:20的乙醇/水混合溶液。
實施例3
取0.3g透明質酸鈉粉末溶解在8mL超純水中,室溫條件下攪拌至透明質酸鈉完全溶解,形成濃度為3.75%(w/v)的透明質酸鈉溶液。將0.1268gβ-磷酸三鈣加入到2mL超純水中,形成濃度為6.34%(w/v)的懸液,將懸液超聲(功率100W)震蕩20min,然后將其逐滴加入到透明質酸鈉溶液中,攪拌均勻。將所得均勻混合溶液注入到24孔板模具中,4℃下靜置1h去除氣泡,接著在-20℃下冷凍24h成型。之后利用真空冷凍干燥機對樣品進行干燥,冷凍干燥溫度為-50℃,真空度為20Pa,冷凍干燥時間為48h,得到未交聯的透明質酸鈉/β-磷酸三鈣多孔復合支架。將未交聯的復合多孔支架浸沒在交聯溶液中24h進行交聯。交聯完成后將樣品用體積分數為80%的乙醇溶液洗滌三遍,再用超純水洗滌三遍,最后再次冷凍干燥得到交聯后的透明質酸鈉/β-磷酸三鈣多孔復合支架。此處所用交聯溶液為含10mM的2-氯-1-甲基碘代吡啶溶質(CMPI與透明質酸鈉中羧基的摩爾比為0.4:1),溶劑為體積比80:20的乙醇/水混合溶液。
對比例1
取0.3g透明質酸鈉粉末溶解在10mL超純水中,室溫條件下攪拌至透明質酸鈉完全溶解,形成濃度為3%(w/v)的透明質酸鈉溶液。將所得透明質酸鈉溶液注入到24孔板模具中,4℃下靜置1h去除氣泡,接著在-20℃下冷凍24h成型。之后利用真空冷凍干燥機對樣品進行干燥,冷凍干燥溫度為-50℃,真空度為20Pa,冷凍干燥時間為48h,得到未交聯的透明質酸鈉多孔支架。將未交聯的多孔支架浸沒在交聯溶液中24h進行交聯。交聯完成后將樣品用體積分數為80%的乙醇溶液洗滌三遍,再用超純水洗滌三遍,最后再次冷凍干燥得到交聯后的透明質酸鈉多孔支架。此處所用交聯溶液為含10mM的2-氯-1-甲基碘代吡啶溶質(CMPI與透明質酸鈉中羧基的摩爾比為0.4:1),溶劑為體積比80:20的乙醇/水混合溶液。
為充分了解不同β-磷酸三鈣用量對支架強度的影響,我們對本發明實施例1-3及對比例1制備的多孔支架進行了抗壓強度測試。測試用儀器為抗壓強度試驗機,轉頭速度為1mm/min,將試樣壓縮至其原有高度的50%,得到抗壓強度值。每組樣品測試五個,取平均值,結果如圖5所示。圖5表明在透明質酸鈉濃度相同的情況下,隨著β-磷酸三鈣含量的增多,多孔支架的抗壓強度不斷提高。
實施例5
取0.1g透明質酸鈉粉末溶解在8mL超純水中,室溫條件下攪拌至透明質酸鈉完全溶解,形成濃度為1.25%(w/v)的透明質酸鈉溶液。將0.086gβ-磷酸三鈣加入到2mL超純水中形成濃度為4.3%(w/v)的懸液,將懸液超聲(功率100W)震蕩20min,接著將其逐滴加入到透明質酸鈉溶液中,攪拌均勻。將所得均勻混合溶液注入到24孔板模具中,4℃下靜置1h去除氣泡,接著在-50℃下冷凍24h成型。之后利用真空冷凍干燥機對樣品進行干燥,冷凍干燥溫度為-50℃,真空度為20Pa,冷凍干燥時間為48h,得到未交聯的透明質酸鈉/β-磷酸三鈣多孔復合支架。將未交聯的復合多孔支架浸沒在交聯溶液中24h進行交聯。交聯完成后將樣品用體積分數為80%的乙醇溶液洗滌三遍,再用超純水洗滌三遍,最后再次冷凍干燥得到交聯后的透明質酸鈉/β-磷酸三鈣多孔復合支架。此處所用交聯溶液為含5mM的2-氯-1-甲基碘代吡啶溶質(CMPI與透明質酸鈉中羧基的摩爾比為0.2:1),溶劑為體積比80:20的乙醇/水混合溶液。
實施例6
取0.2g透明質酸鈉粉末溶解在8mL超純水中,室溫條件下攪拌至透明質酸鈉完全溶解,形成濃度為2.5%(w/v)的透明質酸鈉溶液。將0.7gβ-磷酸三鈣加入到2mL超純水中形成濃度為35%(w/v)的懸液,將懸液超聲(功率100W)震蕩20min,接著將其逐滴加入到透明質酸鈉溶液中,攪拌均勻。將所得均勻混合溶液注入到24孔板模具中,4℃下靜置1h去除氣泡,接著在-80℃下冷凍24h成型。之后利用真空冷凍干燥機對樣品進行干燥,冷凍干燥溫度為-50℃,真空度為20Pa,冷凍干燥時間為48h,得到未交聯的透明質酸鈉/β-磷酸三鈣多孔復合支架。將未交聯的復合多孔支架浸沒在交聯溶液中24h進行交聯。交聯完成后將樣品用體積分數為80%的乙醇溶液洗滌三遍,再用超純水洗滌三遍,最后再次冷凍干燥得到交聯后的透明質酸鈉/β-磷酸三鈣多孔復合支架。此處所用交聯溶液為含30mM的2-氯-1-甲基碘代吡啶溶質(CMPI與透明質酸鈉中羧基的摩爾比為1.25:1),溶劑為體積比80:20的乙醇/水混合溶液。
- 還沒有人留言評論。精彩留言會獲得點贊!