闊葉豐花草三萜化合物的制備方法及其在制備糖苷酶抑制劑藥物中的應用與流程
技術領域
本發明屬于天然藥物化學領域,具體涉及六種三萜類化合物即mesembryanthemoidigenic acid(1)、29-hydroxyhederagenin(2)、3β,6β-dihydroxy-olean-12-ene-28-oic acid(3)、scutellaric acid(4)、arjunic acid(5)、3β,6β,23-trihydroxy-olean-12-en-28-oic acid(6)或其可藥用的鹽在制備糖苷酶抑制劑或藥物中的應用,以及它們的制備方法。
發明背景
糖尿病為臨床上常見的內分泌代謝失調性疾病,其與心血管疾病和癌癥等逐年高發具有重要的相關性,是人類健康重要的殺手。目前,在全球范圍內糖尿病的發病率正在提高,在我國更是有超過1億人的患病率,并呈現逐年增加的趨勢。糖尿病正給我國人民健康和國民經濟造成越來越重大的損失。
糖尿病西醫分為Ⅰ型糖尿病(或稱胰島素依賴性,DM1)和Ⅱ型糖尿病(或稱非胰島素依賴性,DM2),其中Ⅱ型糖尿病發病與患病率均遠高于Ⅰ型糖尿病,因而危害更大。競爭性α-糖苷酶抑制劑具有推遲糖類物質消化吸收、控制飯后血糖急劇升高、進而使血糖濃度在一天內變化波動幅度減小等功能,是可開發用于治療Ⅱ型糖尿病的潛在藥物。目前已開發上市正臨床試用作治療Ⅱ型糖尿病的重要α-糖苷酶抑制劑包括一線用藥acarbose(阿卡波糖)、voglibose、miglitol和emigliate等。
六種三萜化合物mesembryanthemoidigenic acid(1)、29-hydroxyhederagenin(2)、3β,6β-dihydroxy-olean-12-ene-28-oic acid(3)、scutellaric acid(4)、arjunic acid(5)、3β,6β,23-trihydroxy-olean-12-en-28-oic acid(6)分別曾自其他植物中分離獲得(具體見文獻:Magina et al.,Quim Nova,2012,35:1184-1188;Huu et al.,J Chem,2007,45:363-367;Kuo et al.,Chem Pharm Bull,1988,36:3619-3622;Ponouet al.,Chem Biodivers,2011,8:1301-1309;Lavaud et al.,Phytochemistry,2001,57:469-478;Khan et al.,J Nat Prod,1993,56:2163-2165),它們的化學結構式如下式(Ⅰ)所示,到目前還未見這些化合物具有糖苷酶抑制劑活性的報道,以及未見其自闊葉豐花草(Spermacoce latifolia)植物中分離獲得的報道。
技術實現要素:
本發明的第一個目的是提供化合物mesembryanthemoidigenic acid(1)、29-hydroxyhedera genin(2)、3β,6β-dihydroxy-olean-12-ene-28-oic acid(3)、scutellaric acid(4)、arjunic acid(5)、3β,6β,23-trihydroxy-olean-12-en-28-oic acid(6)或它們的可藥用鹽,在制備α-糖苷酶抑制劑藥物中的應用。
經體外藥理實驗證實,本發明提供的化合物mesembryanthemoidigenic acid(1)、29-hydroxyhederagenin(2)、3β,6β-dihydroxy-olean-12-ene-28-oic acid(3)、scutellaric acid(4)、arjunic acid(5)或3β,6β,23-trihydroxy-olean-12-en-28-oic acid(6)均具有強效抑制α-葡萄糖苷酶的活性,它們抑制α-葡萄糖苷酶的活性均顯著強于糖尿病一線用藥阿卡波糖,因此可發展制備用于預防和治療α-糖苷酶引起或有關的生理改變或疾病的潛在藥物候選分子。其中,與α-糖苷酶引起或有關的生理改變或疾病包括但不限于Ⅱ型糖尿病。
本發明所述的六種化合物的可藥用的鹽,其在人消化道中于胃酸等生理條件下可轉化為以上式(Ⅰ)所示的對應三萜化合物分子,其實質性抑制α-葡萄糖苷酶的活性成分與以上所示的六種三萜化合物分子相同,因而屬于本發明的嚴格保護范圍。
本發明的以上所述的六種三萜化合物分子或其可藥用的鹽可與藥學上常用輔料或載體結合,制備得到具有以上所述六種化合物分子之任意一種或多種抑制α-糖苷酶活性的可用于預防和治療Ⅱ型糖尿病的藥物或藥物組合物。該藥物或藥物組合物可采用可濕性粉劑、片劑、顆粒劑、膠囊、口服液、滴丸等劑型,還可采用制藥界公知的控釋或緩釋劑型或納米制劑。
以本發明所述的以上六種三萜化合物分子中的一種或多種為有效成分的包括闊葉豐花草等植物的提取物在制備α-糖苷酶抑制劑藥物中的應用,因其是以本發明所述的六種化合物分子中的一種或多種為實質性有效成分,因而屬于本發明的嚴格保護范圍范疇。
本發明的第二個目的是提供化合物mesembryanthemoidigenic acid(1)、29-hydroxyhederagenin(2)、3β,6β-dihydroxy-olean-12-ene-28-oic acid(3)、scutellaric acid(4)、arjunic acid(5)、3β,6β,23-trihydroxy-olean-12-en-28-oic acid(6)的制備方法,其特征在于,所述的化合物mesembryanthemoidigenic acid(1)、29-hydroxyhederagenin(2)、3β,6β-dihydroxy-olean-12-ene-28-oic acid(3)、scutellaric acid(4)、arjunic acid(5)、3β,6β,23-trihydroxy-olean-12-en-28-oic acid(6)是從闊葉豐花草(Spermacoce latifolia Aubl.K.Schum.)植株中分離得到的。
優選,具體步驟為:
將干燥的闊葉豐花草全株粉碎后用乙醇或乙醇水溶液提取,提取液經濃縮后得到浸膏,浸膏加水混懸,依次用石油醚和乙酸乙酯萃取,濃縮后分別得到石油醚萃取部分和乙酸乙酯萃取部分;石油醚萃取部分經正相硅膠柱層析,以石油醚/丙酮從體積比100:0-0-100梯度洗脫,收集石油醚-丙酮體積比10:1洗脫的餾分E6,餾分E6經MCI柱除去色素,用甲醇洗脫得到甲醇洗脫部分E6-1,E6-1依次通過反相中壓柱層析,甲醇/水體積比從30:70-100:0梯度洗脫、Sephadex LH-20凝膠柱,以甲醇洗脫,和正相硅膠層析,以氯仿/甲醇體積比100:1洗脫,得到化合物1;
乙酸乙酯萃取部分經正相硅膠柱層析,以氯仿/甲醇從體積比100:1-0:100梯度洗脫,收集氯仿/甲醇體積比25:1洗脫的餾分F5,F5經反相中壓柱層析,甲醇/水從體積比30:70-100:0,梯度洗脫,收集甲醇/水體積比80:20洗脫的餾分F5-4和甲醇/水體積比90:10洗脫的餾分F5-5;餾分F5-4經Sephadex LH-20凝膠柱以甲醇洗脫,再經正相硅膠層析柱分離純化,以氯仿/甲醇體積比50:1洗脫,得到化合物3,4,5和6;餾分F5-5經Sephadex LH-20凝膠柱以甲醇洗脫,得到化合物2。
本發明的第三個目的是提供闊葉豐花草在制備化合物mesembryanthemoidigenic acid(1)、29-hydroxyhederagenin(2)、3β,6β-dihydroxy-olean-12-ene-28-oic acid(3)、scutellaric acid(4)、arjunic acid(5)或3β,6β,23-trihydroxy-olean-12-en-28-oic acid(6)中的應用。
本發明的六種具強效抑制α-糖苷酶活性的化合物為安全性高并在環境中能快速自然降解無殘留的天然化合物,它們可自闊葉豐花草等植物材料中分離獲得,植物材料來源豐富,制備過程易于操作。所述的六種化合物的單體均較穩定、易存放,它們的α-糖苷酶抑制活性顯著強于或相當于臨床用藥阿卡波糖,極可能進一步發展為有效、安全的預防和治療Ⅱ型糖尿病的α-糖苷酶抑制劑類藥物,具有較好前景。
附圖說明:
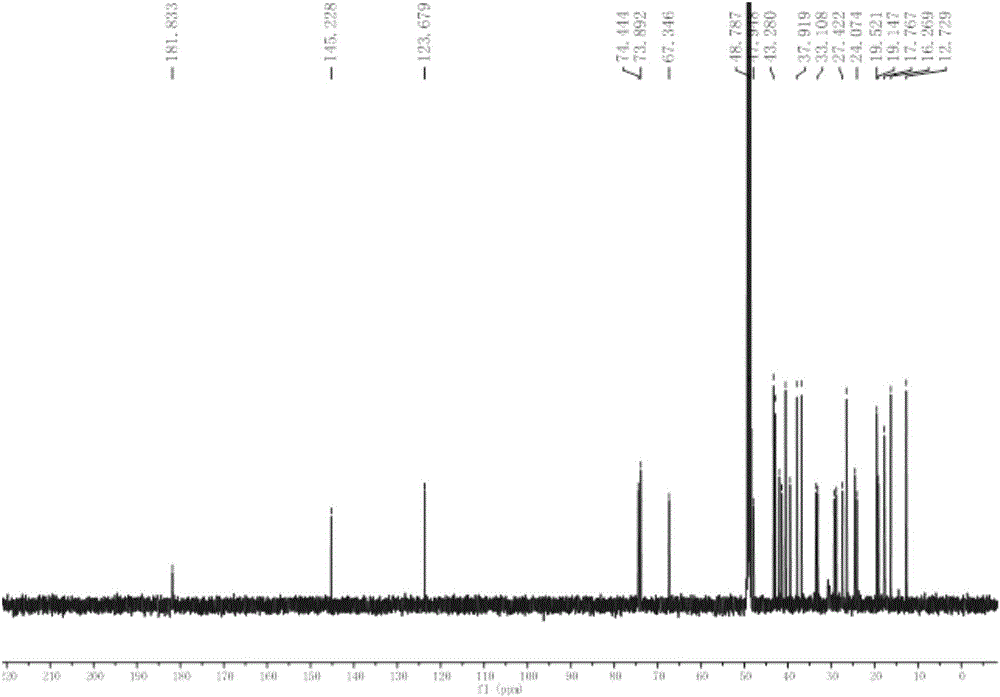
圖1是化合物mesembryanthemoidigenic acid(1)的13C NMR圖譜。
圖2是化合物29-hydroxyhederagenin(2)的13C NMR圖譜。
圖3是化合物3β,6β-dihydroxy-olean-12-ene-28-oic acid(3)的13C NMR圖譜。
圖4是化合物scutellaric acid(4)的13C NMR圖譜。
圖5是化合物arjunic acid(5)的1H NMR圖譜。
圖6是化合物3β,6β,23-trihydroxy-olean-12-en-28-oic acid(6)的13C NMR圖譜。
具體實施方式:
以下實施例是對本發明的進一步說明,而不是對本發明的限制,根據本發明的實質對本發明進行的簡單改進都屬于本發明要求保護的范圍。
實施例1:闊葉豐花草植物中六種三萜化合物的制備
1.1植物來源與鑒定
闊葉豐花草(Spermacoce latifolia Aubl.K.Schum.)植物全株于2012年09月采自廣東省廣州市華南植物園,經中國科學院華南植物園邢福武研究員鑒定。
1.2提取與分離
干燥的闊葉豐花草全株(5.0Kg)粉碎后于室溫用體積分數95%的乙醇水溶液提取,提取液合并后減壓濃縮得無醇浸膏。浸膏加水混懸,依次用石油醚和乙酸乙酯萃取各4次;減壓濃縮后得到石油醚萃取部分(330g)和乙酸乙酯萃取部分(202g)。所獲石油醚萃取部分(330g)經正相硅膠柱層析(200-300目,1000×105mm i.d.),以石油醚-丙酮(100:0-0:100,v/v,each 3.0L)梯度洗脫,經TLC薄層層析檢測合并主點相同的流分,共得到9個組分(E1-E9)。E6(5.0g)【石油醚-丙酮(10:1,v/v)洗脫的餾分】經MCI柱【200×40mm i.d.】除去色素,用甲醇洗脫得到甲醇洗脫部分E6-1。E6-1(3.0g)依次通過反相中壓柱層析分離純化,甲醇/水(30:70-100:0,v/v,each 1.0L)為流動相梯度洗脫、Sephadex LH-20凝膠柱(1550×13.4mm i.d.)以甲醇洗脫和正相硅膠層析柱(200-300目,400×30mm i.d)分離純化,以氯仿-甲醇(100:1,v/v)恒定梯度洗脫,得到化合物1(3.4mg)。乙酸乙酯萃取部分(202g)經正相硅膠柱層析(200-300目,1000×105mm i.d.),以氯仿-甲醇(100:1-0:100,v/v,each 3.0L)梯度洗脫,經TLC薄層層析檢測合并主點相同的流分,得到F1-F9共9個組分。F5(3.3g)【氯仿-甲醇(25:1,v/v)洗脫的餾分】繼續經反相中壓柱層析分離純化,甲醇/水(30:70-100:0,v/v,each 1.0L)為流動相梯度洗脫,TLC薄層檢測合并主點相同的流分,得到6個亞組分(F5-1-F5-6)。F5-4(2.5g)【甲醇/水(80:20,v/v)洗脫的餾分】經Sephadex LH-20凝膠柱以甲醇洗脫,再經正相硅膠層析柱(200-300目,400×30mm i.d.)分離純化,以氯仿-甲醇(50:1,v/v)恒定梯度洗脫,得到化合物3(5.6mg),4(3.6mg),5(5.0mg)和6(4.0mg)。F5-5(1.0g)【甲醇/水(90:10,v/v)洗脫的餾分】經Sephadex LH-20凝膠柱以甲醇洗脫,得到化合物2(4.2mg)。
1.3化合物的結構鑒定
所獲化合物1為白色粉末,ESI-MS m/z 495[M+Na]+,471[M-H]–對應該化合物的分子式C30H48O4;其13C NMR圖譜如圖1所示,1H-NMR(500MHz,CD3OD):δ5.25(1H,t,J=3.5Hz,H-12),3.19(2H,s,H-29),3.15(1H,dd,J=11.4,4.7Hz,H-3),2.88(1H,dd,J=13.0,4.7Hz,H-18),1.17(3H,s),0.97(3H,s),0.94(3H,s),0.93(3H,s),0.82(3H,s),0.78(3H,s);13C-NMR(125MHz,CD3OD):δ38.5(CH2,C-1),27.6(CH2,C-2),79.7(CH,C-3),38.9(C,C-4),56.7(CH,C-5),18.3(CH2,C-6),32.9(CH2,C-7),39.8(C,C-8),46.5(CH,C-9),36.8(C,C-10),23.2(CH2,C-11),123.7(CH,C-12),145.2(C,C-13),42.7(C,C-14),28.7(CH2,C-15),24.0(CH2,C-16),47.6(C,C-17),40.6(CH,C-18),40.3(CH2,C-19),35.5(C,C-20),29.6(CH2,C-21),38.0(CH2,C-22),28.3(CH3,C-23),16.3(CH3,C-24),15.9(CH3,C-25),17.7(CH3,C-26),25.4(CH3,C-27),181.9(C,C-28),74.4(CH2,C-29),19.5(CH3,C-30)。根據以上波譜數據綜合分析,解析出該化合物1的化學結構為mesembryanthemoidigenic acid,其結構式如式(Ⅰ)中的1所示。
所獲化合物2為白色粉末,ESI-MS m/z 511[M+Na]+,487[M-H]–,對應該化合物分子式C30H48O5;其13C NMR圖譜如圖2所示,1H-NMR(500MHz,CD3OD):δ5.26(1H,t,J=3.5Hz,H-12),3.60(1H,dd,J=11.9,4.2Hz,H-3),3.53,3.33,(each 1H,d,J=11.0Hz,H-23),3.19(2H,s,H-29),2.88(1H,dd,J=13.9,4.3Hz,H-18),1.19(3H,s),0.98(3H,s),0.93(3H,s),0.82(3H,s),0.70(3H,s);13C-NMR(125MHz,CD3OD):δ38.2(CH2,C-1),26.1(CH2,C-2),75.3(CH,C-3),40.6(C,C-4),49.5(CH,C-5),18.7(CH2,C-6),32.6(CH2,C-7),39.7(C,C-8),47.4(CH,C-9),36.7(C,C-10),22.8(CH2,C-11),122.8(CH,C-12),144.5(C,C-13),41.4(C,C-14),27.7(CH2,C-15),23.2(CH2,C-16),47.7(C,C-17),40.7(CH,C-18),40.7(CH2,C-19),35.6(C,C-20),28.8(CH2,C-21),32.1(CH2,C-22),68.3(CH2,C-23),11.6(CH3,C-24),15.3(CH3,C-25),16.8(CH3,C-26),25.4(CH3,C-27),182.7(C,C-28),73.4(CH2,C-29),18.8(CH3,C-30)。根據以上波譜數據綜合分析,解析出該化合物2的化學結構為29-hydroxyhederagenin,其結構式如式(Ⅰ)中的2所示。
所獲化合物3為白色粉末,ESI-MS m/z 495[M+Na]+,471[M-H]–,對應該化合物分子式C30H48O4;其13C NMR圖譜如圖3所示,1H-NMR(500MHz,CD3OD):δ5.30(1H,t,J=3.6Hz,H-12),4.51(1H,br s,H-6),3.10(1H,dd,J=11.6,4.1Hz,H-3),2.89(1H,dd,J=13.7,4.2Hz,H-18),1.32(3H,s),1.18(3H,s),1.15(3H,s),1.11(3H,s),1.06(3H,s),0.96(3H,s),0.93(3H,s);13C-NMR(125MHz,CD3OD):δ42.0(CH2,C-1),28.1(CH2,C-2),80.1(CH,C-3),40.1(C,C-4),57.1(CH,C-5),68.7(CH,C-6),41.6(CH2,C-7),40.7(C,C-8),49.4(CH,C-9),37.7(C,C-10),24.5(CH2,C-11),123.9(CH,C-12),144.5(C,C-13),43.4(C,C-14),28.7(CH2,C-15),24.0(CH2,C-16),47.7(C,C-17),40.6(CH,C-18),47.3(CH2,C-19),30.5(C,C-20),33.6(CH2,C-21),32.0(CH2,C-22),28.3(CH3,C-23),17.6(CH3,C-24),17.3(CH3,C-25),18.8(CH3,C-26),26.4(CH3,C-27),181.9(C,C-28),23.9(CH3,C-29),31.8(CH3,C-30)。根據以上波譜數據綜合分析,解析出該化合物3的化學結構為3β,6β-dihydroxy-olean-12-ene-28-oic acid,其結構式如式(Ⅰ)中的3所示。
所獲化合物4為白色粉末,ESI-MS m/z 495[M+Na]+,471[M-H]–,對應該化合物分子式C30H48O4;其13C NMR圖譜如圖4所示,1H-NMR(500MHz,CD3OD):δ5.26(1H,t,J=3.6Hz,H-12),3.63(1H,m,H-3),3.70,3.44,(each 1H,d,J=11.0Hz,H-23),2.87(1H,dd,J=13.8,4.2Hz,H-18),1.15(3H,s),1.10(3H,s),1.06(3H,s),0.93(3H,s),0.87(3H,s),0.72(3H,s);13C-NMR(125MHz,CD3OD):δ33.2(CH2,C-1),26.1(CH2,C-2),73.9(CH,C-3),40.6(C,C-4),43.5(CH,C-5),18.7(CH2,C-6),33.6(CH2,C-7),39.7(C,C-8),49.4(CH,C-9),37.7(C,C-10),23.5(CH2,C-11),122.8(CH,C-12),144.5(C,C-13),42.4(C,C-14),28.7(CH2,C-15),24.0(CH2,C-16),47.7(C,C-17),42.1(CH,C-18),46.3(CH2,C-19),31.5(C,C-20),34.2(CH2,C-21),33.1(CH2,C-22),68.3(CH2,C-23),18.6(CH3,C-24),15.3(CH3,C-25),17.8(CH3,C-26),26.4(CH3,C-27),181.7(C,C-28),23.9(CH3,C-29),33.8(CH3,C-30)。根據以上波譜數據綜合分析,解析出該化合物4的化學結構為scutellaric acid,其結構式如式(Ⅰ)中的4所示。
所獲化合物5為白色粉末,ESI-MS m/z 511[M+Na]+,487[M-H]–,對應該化合物分子式C30H48O5;其1H NMR圖譜如圖5所示,1H-NMR(500MHz,CD3OD):δ5.31(1H,t,J=3.6Hz,H-12),3.62(1H,m,H-2),3.24(1H,d,J=3.7Hz,H-19),3.05(1H,d,J=3.7Hz,H-18),2.90(1H,d,J=9.6Hz,H-3),1.31(3H,s),1.03(3H,s),1.00(3H,s),0.96(3H,s),0.93(3H,s),0.84(3H,s),0.76(3H,s);13C-NMR(125MHz,CD3OD):δ48.2(CH2,C-1),69.6(CH,C-2),84.9(CH,C-3),40.6(C,C-4),57.0(CH,C-5),19.7(CH2,C-6),34.0(CH2,C-7),40.9(C,C-8),49.4(CH,C-9),39.7(C,C-10),25.1(CH2,C-11),124.8(CH,C-12),144.9(C,C-13),42.7(C,C-14),29.7(CH2,C-15),28.6(CH2,C-16),46.7(C,C-17),45.1(CH,C-18),82.3(CH,C-19),36.2(C,C-20),29.5(CH2,C-21),34.1(CH2,C-22),29.3(CH3,C-23),17.5(CH3,C-24),17.1(CH3,C-25),17.8(CH3,C-26),25.4(CH3,C-27),181.7(C,C-28),25.2(CH3,C-29),28.8(CH3,C-30)。根據以上波譜數據綜合分析,解析出該化合物5的化學結構為arjunic acid,其結構式如式(Ⅰ)中的5所示。
所獲化合物6為白色粉末,ESI-MS m/z 511[M+Na]+,487[M-H]–,對應該化合物分子式C30H48O5;其13C NMR圖譜如圖6所示,1H-NMR(500MHz,CD3OD):δ5.29(1H,t,J=3.6Hz,H-12),4.39(1H,br s,H-6),3.56(1H,m,H-3),3.60,3.47,(each 1H,d,J=11.0Hz,H-23),2.87(1H,dd,J=13.7,3.9Hz,H-18),1.33(3H,s),1.14(3H,s),1.10(3H,s),1.06(3H,s),0.96(3H,s),0.91(3H,s);13C-NMR(125MHz,CD3OD):δ41.2(CH2,C-1),28.1(CH2,C-2),73.5(CH,C-3),44.0(C,C-4),49.5(CH,C-5),68.6(CH,C-6),41.0(CH2,C-7),39.3(C,C-8),48.7(CH,C-9),36.9(C,C-10),23.7(CH2,C-11),122.8(CH,C-12),144.5(C,C-13),42.4(C,C-14),28.7(CH2,C-15),24.0(CH2,C-16),46.7(C,C-17),42.1(CH,C-18),46.3(CH2,C-19),31.0(C,C-20),34.2(CH2,C-21),33.1(CH2,C-22),66.7(CH2,C-23),14.6(CH3,C-24),17.5(CH3,C-25),18.8(CH3,C-26),26.4(CH3,C-27),181.9(C,C-28),23.7(CH3,C-29),33.2(CH3,C-30)。根據以上波譜數據綜合分析,解析出該化合物6的化學結構為3β,6β,23-trihydroxy-olean-12-en-28-oic acid,其結構式如式(Ⅰ)中的6所示。
實施例2:所述六種三萜化合物的α-糖苷酶抑制活性檢測
2.1儀器與試劑
實驗儀器:酶標儀Genois microplate reader(Tecan GENios,Swizerland)。
試劑樣品:α-葡萄糖苷酶購自Sigma Chemical Co.(Sigma-Aldrich,St.Louis,USA);阿卡波糖(Acarbose)購自Tokyo Chemical Industry Co.,Ltd.(Japan);4-硝基酚-α-D-葡萄糖吡喃苷(PNPG)購自Tokyo Chemical Industry Co.,Ltd.(Japan);六種三萜化合物mesembryanth emoidigenic acid(化合物1)、29-hydroxyhederagenin(化合物2)、3β,6β-dihydroxy-olean-12-en e-28-oic acid(化合物3)、scutellaric acid(化合物4)、arjunic acid(化合物5)、3β,6β,23-tr ihydroxy-olean-12-en-28-oic acid(化合物6)由以上實驗例1的方法制備,也可以按照文獻Ma gina et al.,Quim Nova,2012,35:1184-1188;Huu et al.,J Chem,2007,45:363-367;Ku o et al.,Chem Pharm Bull,1988,36:3619-3622;Ponouet al.,Chem Biodivers,2011,8:13 01-1309;Lavaud et al.,Phytochemistry,2001,57:469-478;Khan et al.,J Nat Prod,1993,56:2163-2165中的方法制備得到。
2.2測試方法:
a)配制藥物溶液:將待測化合物和阿卡波糖分別由二甲基亞砜(DMSO)配制10mg/ml的溶液,并配制67mmol/L的磷酸緩沖液(超純水配制),PNPG底物溶液(5mM,磷酸緩沖液配制)和0.2M的NaCO3溶液(磷酸緩沖液配制)。
b)采用比色法,通過96孔板就待測化合物對α-葡萄糖苷酶的半數抑制濃度進行測定。首先將20μl的α-葡萄糖苷酶(0.8U)加入樣品孔,然后將樣品溶液用磷酸緩沖液按比例稀釋,每孔加入樣品溶液120μl,使測試樣品(包含待測化合物和阿卡波糖)的最終濃度為:500μg/mL,250μg/mL,125μg/mL,62.5μg/mL,31.25μg/mL,15.625μg/mL,最后再加入反應底物4-硝基酚-α-D-吡喃葡萄糖苷20μl(5mM)。37℃水浴反應15min后,每個樣品孔中加入80μl的Na2CO3(0.2M)終止反應,在405nm波長處比色測定。相同體積的磷酸緩沖液代替酶溶液。化合物抑制率由樣品OD值對于空白和對照OD值計算,計算公式如下:抑制率(%)=(ODcontrol–ODneg)-(ODtest–ODtestcontrol)/(ODcontrol–ODneg)×100%。其中所測試六種化合物分別對α-葡萄糖苷酶的半數抑制濃度(IC50)由劑量效應曲線得到。
2.3實驗數據參見表1:
表1.六種三萜化合物的a-葡萄糖苷酶抑制活性
2.4實驗結論:
a-葡萄糖苷酶是a-糖苷酶抑制劑類Ⅱ型糖尿病治療藥物篩選的指標性測試酶。本實驗結果表明,本發明提供的化合物mesembryanthemoidigenic acid(化合物1)、29-hydroxyhederagenin(化合物2)、3β,6β-dihydroxy-olean-12-ene-28-oic acid(化合物3)、scutellaric acid(化合物4)、arjunic acid(化合物5)和3β,6β,23-trihydroxy-olean-12-en-28-oic acid(化合物6)均具有顯著強于糖尿病一線用藥阿卡波糖抑制α-葡萄糖苷酶的活性,因此可發展制備用于預防和治療α-糖苷酶引起或有關的生理改變或疾病的潛在藥物候選分子,具有較強的應用開發潛質,可望能進一步發展成為新的預防和治療Ⅱ型糖尿病的用藥,應用潛質廣泛。
- 還沒有人留言評論。精彩留言會獲得點贊!