一種載有核酸適配體?阿霉素結合物的溫敏原位凝膠瘤內注射制劑及其制備方法與流程
本發明涉一種載有核酸適配體-阿霉素結合物的的溫敏原位凝膠瘤內注射制劑及其制備方法,屬于藥物制劑領域。
背景技術:
腫瘤生物學標志物是指在腫瘤細胞中過量表達,而在正常細胞中不表達或表達量小于腫瘤細胞的生化分子。利用腫瘤生物學標志物的這一特點,將其作為靶標分子,篩選出能與其特異性結合的靶向分子,并將其與抗腫瘤藥物結合或修飾在載體的表面,從而實現腫瘤細胞的靶向攝取,達到診斷與治療的目的。其中,核酸適配體(aptamer)能夠以較高親和力與其相應靶標進行特異性結合的單鏈DNA或RNA。其大多是通過指數富集的配體系統進化技術從寡核苷酸序列庫中隨機篩選得到的能夠和靶物質高特異性結合的寡核苷酸序列,與傳統大分子靶向分子如抗體的作用類似,但同時又具有許多傳統的抗體無法比擬的優點:特異性及親和性高;穩定性好,不易降解,可長期保存,常溫下運輸;分子質量小,無免疫原性;適配體分子較小,易于透過細胞膜;易于合成,經修飾后可與藥物分子結合,從而提要藥物分子的靶向性。適配體作為一種極有前景的、可望取代抗體的藥物,在腫瘤治療領域引起廣泛研究。作為一種極有前景的、可望取代抗體大分子的靶向分子,適配體在腫瘤治療領域引起廣泛研究。然而,核酸適配體注射入生物體內后,因其不可避免地易被生物體內大量的核酸酶降解,導致核酸適配體的體內應用具有一定的局限性。
黏蛋白1(Mucin 1,MUC1)是一種I型跨膜蛋白,在乳腺癌細胞、卵巢癌細胞等多種癌細胞中過量表達,而在相應的癌旁組織中不表達,是一種新型的腫瘤標志物。通過指數富集的配體系統進化技術篩選出的與黏蛋白1具有高親和力高特異性的一段核酸適配體序列為5’-GCAGTTGATCCTTTGGATACCCTGG-3’。本發明擬將末端修飾后MUC1黏蛋白適配體與抗腫瘤藥物DOX相結合,形成MUC1黏蛋白核酸適配體-DOX結合物,從而提高DOX的靶向性和特異性,減少DOX對正常細胞的毒副作用。同時考慮到MUC1適配體在體內的穩定性差,無法直接通過靜脈注射給藥而實現良好的靶向治療效果,故本發明擬將得到的MUC1黏蛋白核酸適配體-DOX結合物通過物理包埋的方式載入凝膠的三維網狀結構中,并將其注射埋植在腫瘤部位,以防止體循環中的核酸酶的降解,同時可實現MUC1黏蛋白核酸適配體-DOX結合物的緩慢釋放。
原位凝膠又稱在體凝膠,是指將其以溶液狀態給藥后,當接觸到用藥部位機體的生理條件或受到其他環境因素的影響后即發生相轉變形成半固體凝膠狀態的制劑。原位凝膠具有緩慢釋放藥物,避免藥物的首過效應,提高藥物生物利用度,降低藥物毒副作用等優點。目前研究較多的是殼聚糖/β-甘油磷酸鈉溫敏原位凝膠系統,故本研究通過物理包埋法將MUC1黏蛋白核酸適配體-阿霉素結合物裝載入由殼聚糖及β-甘油磷酸鈉所構成凝膠三維網狀結構中,其特征在于在室溫下為液態可用于瘤內注射,且進入體內后在體溫下可迅速實現膠凝化而形成藥物儲庫,緩慢釋放出核酸適配體-阿霉素結合物,并進一步通過腫瘤細胞表面高表達的核酸適配體受體的特異性識別,而實現阿霉素在腫瘤細胞內的靶向攝取而發揮抗腫瘤療效。
技術實現要素:
本發明的目的是為臨床提供一種實用方便、穩定可靠的治療腫瘤的載有MUC1黏蛋白核酸適配體-DOX結合物的溫敏原位凝膠及其制備方法,旨在克服傳統DOX制劑在腫瘤治療方面所存在的不足。
為實現以上目的,本發明提供以下技術方案:
本發明將5’端有巰基修飾的MUC1黏蛋白適配體與DOX修飾物DOXO-EMCH在冰浴條件下反應24h,得到MUC1黏蛋白核酸適配體-DOX結合物。
本發明提供的載有MUC1黏蛋白核酸適配體-DOX結合物的溫敏原位水凝膠瘤內注射制劑,其中殼聚糖溶液為的殼聚糖冰醋酸水溶液,用量為10.0~15.0mg/mL,殼聚糖分子量為10萬,脫乙酰度≥90.0%,粘度為45mPa·s。
本發明提供的載有MUC1黏蛋白核酸適配體-DOX結合物的溫敏原位水凝膠瘤內注射制劑,其中β-甘油磷酸鈉的用量為100~200mg/mL。
本發明提供的載有MUC1黏蛋白核酸適配體-DOX結合物的溫敏原位水凝膠瘤內注射制劑,其制備方法主要包括以下幾個步驟:
(1)稱取一定量的DOXO-EMCH,溶解于二甲基亞砜(Dimethyl sulfoxide,DMSO)中,配置成一定濃度的DOXO-EMCH溶液。
(2)將5’端有巰基修飾的MUC1黏蛋白適配體,溶解于pH 7.4PBS水溶液中,配置成一定濃度的MUC1黏蛋白適配體水溶液。
(3)將一定量的DOXO-EMCH溶液與MUC1黏蛋白適配體水溶液混合,冰浴條件下反應24h,反應液過交聯葡聚糖凝膠柱(Sephadex G-25)除去未反應的DOXO-EMCH,而后冷凍干燥制得核酸適配體-阿霉素干燥粉末。
(4)稱取一定量的殼聚糖,溶解于冰醋酸溶液中,配制成一定濃度的殼聚糖的冰醋酸水溶液,4℃儲存備用。
(5)稱取一定量的β-甘油磷酸鈉溶于去純化水中,配制成一定濃度的β-甘油磷酸鈉水溶液。
(6)在冰浴條件下,向殼聚糖溶液中逐滴加入β-甘油磷酸鈉溶液,繼續攪拌使其混合均勻,制得空白溫敏原位凝膠制劑。
(7)稱取一定量的核酸適配體-阿霉素粉末,在冰浴攪拌下加入到空白溫敏原位凝膠制劑中,繼續攪拌使其混合均勻,即得本發明制劑。
本發明涉及的載有MUC1黏蛋白核酸適配體-DOX結合物的溫敏原位凝膠瘤內注射制劑在室溫下為液體,注射到腫瘤部位后,在生理溫度下可迅速膠凝形成半固體凝膠,作為藥物貯庫緩慢釋放藥物,一方面殼聚糖溫敏原位凝膠三維網狀結構可以保護核酸適配體不被生物體內的核酸酶降解,并達到緩慢釋藥的目的,另一方面核酸適配體可幫助DOX進行精準的腫瘤細胞靶向及攝取從而達到了增加DOX對腫瘤細胞的殺傷力,同時降低對正常細胞的毒副作用,減小藥物用量的目的。本發明有望作為一種新型的瘤內注射給藥系統,通過緩慢釋藥達到治療目的,操作方便,降低藥物毒性,解決傳統靜脈及埋植給藥方法上的不足。
附圖說明
附圖1:具體實施例1所得的MUC1黏蛋白核酸適配體-DOX結合物的質譜圖。
附圖2:具體實施例1所得的載有MUC1黏蛋白核酸適配體-DOX結合物的溫敏原位凝膠瘤內注射制劑的體外膠凝圖。
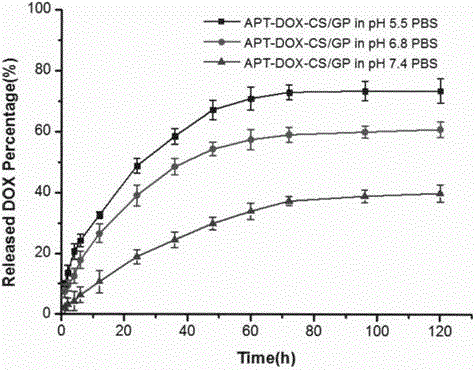
附圖3:具體實施例2所得載有MUC1黏蛋白核酸適配體-DOX結合物的溫敏原位凝膠瘤內注射制劑的體外藥物釋放曲線,其中APT-DOX-CS/GP代表載有MUC1黏蛋白核酸適配體-DOX結合物的殼聚糖/β-甘油磷酸鈉溫敏原位凝膠制劑。
附圖4:具體實施例1所制備MUC1黏蛋白核酸適配體-DOX結合物和市售DOX溶液對人乳腺癌細胞MCF-7的細胞毒性評價實驗結果。
具體實施方式
下面結合具體實施例對本發明作進一步解釋和說明,應當理解,所給出的實施例只是舉例說明性的,其不以任何方式對本發明的范圍構成任何限制。
具體實施例1
稱取一定量的DOXO-EMCH,溶解于DMSO中,配置成一定濃度的DOXO-EMCH溶液。將5’端有巰基修飾的MUC1黏蛋白適配體,溶解于pH 7.4PBS水溶液中,配置成一定濃度的MUC1黏蛋白適配體水溶液。將一定量的DOXO-EMCH溶液與MUC1適配體水溶液混合,冰浴條件下反應24h,反應液過交聯葡聚糖凝膠柱(Sephadex G-25)除去未反應的DOXO-EMCH,而后冷凍干燥制得核酸適配體-阿霉素結合物干燥粉末。質譜圖見附圖1.
殼聚糖(0.04g)溶解于2mL的冰醋酸溶液(0.1M)中,在冰浴攪拌條件下,逐滴加入β-甘油磷酸鈉溶液,繼續攪拌使其混合均勻,繼續在冰浴條件下,加入核酸適配體-阿霉素結合物粉末,繼續攪拌使其溶解,即得載有阿霉素結合物的溫敏原位凝膠制劑。該制劑在室溫時為液體狀態,通針性良好,37℃水浴條件下3min可膠凝。體外膠凝試驗見附圖2。
具體實施例2
對本發明具體實施例1所得的溫敏原位凝膠進行體外釋藥行為試驗,釋放曲線如附圖3所示。
精密量取1mL載藥溫敏原位凝膠,加入到10mL具塞試管中,37±1℃水浴條件下放置1h,待充分膠凝后,加入10mL pH 7.4的磷酸鹽緩沖液,置于37±1℃,100rpm搖床中振蕩。于固定的取樣時間點取出全部釋放介質,并補充相同體積的釋放介質。經0.45μm濾膜過濾,取續濾液進樣,在485nm波長下測定DOX含量,計算累計釋藥率。
具體實施例3
以市售DOX溶液為對照,進行體外細胞毒性試驗,考察實施例1所得MUC1黏蛋白核酸適配體-DOX結合物的細胞毒性。
將人乳腺癌MCF-7細胞以密度為4×103細胞/孔接種于96孔板中,培養24h。此后,細胞用含有樣品(阿霉素溶液和實施例1所得MUC1黏蛋白核酸適配體-阿霉素結合物溶液,相同的最終阿霉素濃度為0.5μM)的新鮮培養基(pH 7.4)處理2h(37℃)。細胞孵育4h后用新鮮PBS沖洗3次,將藥物溶液替換成新鮮空白培養基繼續培養46h。每孔加入20μL 5mg/mL MTT溶液,培養4h后棄去培養基,用新鮮PBS溶液小心清洗兩遍后,每孔加入150μL DMSO溶液。用酶標儀在570nm條件下測定吸光度,以加入空白培養基的細胞作為對照組,計算細胞存活率。
實驗結果如附圖4所示:核酸適配體-阿霉素結合物組的細胞存活率比市售阿霉素組的細胞存活率低,圖中*表明p<0.05,兩組制劑的細胞存活率有顯著性差異。說明本發明所得的核酸適配體-阿霉素結合物,可以提高對MCF-7細胞的毒性,促進藥物的跨細胞膜轉運,增加藥物在腫瘤內的累計而提高藥效。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種舌癌細胞的核酸適配體及試劑盒的制造方法與工藝
- 金黃色葡萄球菌腸毒素C2的核酸適配體C203及其篩選方法和應用與制造工藝
- 胰島素核酸適體INS5及其制備方法與制造工藝
- 一種高親和力興奮劑核酸適體EPO4及其制備方法與制造工藝
- 一種鄰苯二甲酸酯類增塑劑單鏈DNA核酸適配體及其篩選與表征方法及電化學傳感器與制造工藝
- 基于高特異性核酸適體熒光探針INS1胰島素試劑盒及其檢測方法與制造工藝
- 運用核酸適配體與溶菌酶特異性識別并形成G四鏈體進行熒光顯現潛指紋的方法與制造工藝
- 基于快速識別核酸適體熒光探針INS2胰島素試劑盒及其檢測方法與制造工藝
- 一種用于檢測沙門氏菌的增敏型核酸適配體試紙條及其制備方法
- 一組特異性結合結核分枝桿菌的核酸適配體及其應用
- 一種舌癌細胞的核酸適配體及試劑盒的制造方法與工藝
- 金黃色葡萄球菌腸毒素C2的核酸適配體C203及其篩選方法和應用與制造工藝
- 胰島素核酸適體INS5及其制備方法與制造工藝
- 一種高親和力興奮劑核酸適體EPO4及其制備方法與制造工藝
- 一種鄰苯二甲酸酯類增塑劑單鏈DNA核酸適配體及其篩選與表征方法及電化學傳感器與制造工藝
- 基于高特異性核酸適體熒光探針INS1胰島素試劑盒及其檢測方法與制造工藝
- 運用核酸適配體與溶菌酶特異性識別并形成G四鏈體進行熒光顯現潛指紋的方法與制造工藝
- 基于快速識別核酸適體熒光探針INS2胰島素試劑盒及其檢測方法與制造工藝
- 一種用于檢測沙門氏菌的增敏型核酸適配體試紙條及其制備方法
- 幾種識別滅草松的核酸適配體序列及其衍生物的制作方法