一種基于3D生物打印修復人關節軟骨的方法與流程
本發明涉及組織工程技術領域,特別涉及一種基于3D生物打印修復人關節軟骨的方法。
背景技術:
骨關節炎、衰老以及關節損傷等原因導致的軟骨缺損是關節痛和慢性殘疾的主要原因之一。由于缺乏血管、神經和淋巴,成熟軟骨不能自愈。目前最常用于晚期軟骨退化的治療方法是關節置換術,但是該手術本身操作復雜,常引起周圍組織感染,并且手術費用也非常昂貴。盡管基于細胞移植的組織工程療法在二十多年前已被引進,但目前軟骨組織工程策略還不能制造出和天然軟骨一樣的組織,包括層次結構、細胞外基質和機械性能。另外,幾乎所有的膝蓋軟骨修復方法都有一個步驟:將損傷部位周圍的健康軟骨組織移除,以產生一定形狀的人工缺損,便于后期的治療和移植。該步驟實際上對現存的軟骨造成了額外的壞死并最終導致了軟骨退化和組織移植失敗。
基于組織工程的直接軟骨修復方法非常具有吸引力,因為該方法是直接對缺損部位進行修復,而不會導致周圍健康組織額外的損傷。理想的移植組織需要和天然軟骨很好的整合并對不同大小和厚度的損傷部位進行修復。因此,需要開發新的技術,使工程化組織能夠與損傷部位不同的形狀和性質相匹配。
噴墨打印是非接觸式打印技術,在基底上通過微墨滴的形式復制數模信息。打印前加熱產生熱量,進而氣化墨水產生氣泡,由此產生的壓力使墨滴以不同體積(10-150 pL)噴射。在打印過程中,盡管每個噴嘴處的加熱元件使局部溫度上升到300℃并持續幾微秒,但哺乳動物細胞只被加熱2微秒,溫度超過外界環境4-10℃,90%的細胞任能夠保持活力。隨著高通量數控技術的發展和對細胞、生長因子和生物材料支架的高精度定位,目前已經有研究組用生物打印的方法成功制造出了具有生物功能的人類微血管。
生物材料支架的產生通常是將粘性較小的生物墨水噴射到粘性較大的生物紙上。研究表明,由聚乙二醇(PEG)大分子單體合成的水凝膠可以保持軟骨細胞的活力并促進細胞外基質的沉積,如蛋白聚糖和II型膠原。PEG水凝膠的壓縮模量與人軟骨的壓縮模量相仿,和天然組織具有生物相容性,不會引發強免疫排斥。另外,PEG是水溶性的,粘度低,可以通過光交聯方法進行修飾。因此,在生物打印中,PEG可以作為生物支架材料用于自發聚合。
技術實現要素:
本發明要解決的技術問題是提供一種基于3D生物打印修復人關節軟骨的方法,該方法可以按照軟骨部位缺損形狀、大小以及性質快速而準確的制造相應的組織,最終用于修復人軟骨缺損。
為解決上述技術問題,本發明的技術方案為:一種基于3D生物打印修復人關節軟骨的方法,其創新點在于:包括以下步驟:
a)PEG與甲基丙烯酰氯過夜反應制備PEGDMA并純化;
b)采用全骨髓貼壁法分離人間充質干細胞;
c)將生長狀態良好的人間充質干細胞傳代并調整密度,待細胞貼壁后更換誘導培養基培養;
d)清洗新鮮牛股骨,在骨軟骨栓塞的中心位置用無菌活體穿孔器做出全層軟骨缺損,將骨軟骨栓塞置于DMEM中培養成3D生物紙;
e)將純化的PEGDMA溶解,加入光引發劑2959,將步驟c)誘導所得軟骨細胞重懸在過濾除菌的PEGDMA溶液中制成生物墨水;
f)將生物打印機消毒滅菌后加入生物墨水,按照設計的形狀和大小在3D生物紙上層層打印出3D軟骨,將3D軟骨置于誘導培養基中培養。
進一步的,步驟a)中采用3kDa的PEG與甲基丙烯酰氯在氮氣條件下過夜反應,再通過乙醚析出和過夜凍干的方法進行純化,使合成的PEGDMA大分子單體純度大于95%。
進一步的,步驟b)中分離人間充質干細胞包括在無菌條件下取健康成人骨髓液,用PBS漂洗并計數,將處理后的細胞培養在含20%(v/v)胎牛血清和1%(v/v)青霉素-鏈霉素-慶大霉素的α-MEM基礎培養基中,置于37℃、5%(v/v)CO2的細胞培養箱培養,48小時后換液,之后每隔3天換液。
進一步的,步驟c)中人間充質干細胞密度調整至5×103個/cm2,所述誘導培養基含1×胰島素-轉鐵蛋白-硒-丙酮酸鈉,0.1mmol/L抗壞血酸磷酸鹽, 1.25mg/mL 人血清白蛋白, 10-7mol/L地塞米松, 1%(v/v)青霉素-鏈霉素-慶大霉素, 10 ng/mL TGF-b1,將所述誘導培養基置于37℃、5%(v/v)CO2的細胞培養箱,每3天更換一次誘導培養基,培養2-6周。
進一步的,步驟d)中無菌活體穿孔器直徑為4mm,缺損的深度為2-5mm,所述DMEM含有10%(v/v)小牛血清和1%(v/v)青霉素-鏈霉素-慶大霉素,培養溫度37℃,將DMEM置于5%(v/v)CO2的細胞培養箱。
進一步的,步驟e)中PEGDMA溶解在PBS或去離子水中,濃度為10 %(w/v)和20 %(w/v) ,光引發劑2959的加入量為0.05 %(w/v),所述生物墨水中每毫升溶液含5×106個細胞。
進一步的,步驟f)中生物打印機用紫外照射滅菌,打印筆用70%(v/v)乙醇消毒,打印時將UV強度為4.5 mW/cm2的長波紫外燈置于打印平臺上方25cm處,打印筆中加滿步驟e)制得的生物墨水并用鋁箔覆蓋以防止紫外照射,打印出的出3D軟骨在誘導培養基中分別培養2、4、6周,每3天更換一次培養基。
本發明的優點在于:1)可以按照組織受損部位的大小和形狀制造出合適的軟骨移植物;2)可以準確的控制單個細胞和生物材料支架的位置;3)對細胞損傷小有利于維持軟骨表型;4)采用熱噴墨打印機和自發光聚合反應將組織工程制造的時間大大縮短。本發明操作簡單快速且準確,細胞毒性小,非常有希望成為臨床軟骨修復的方法。
附圖說明
圖1為本發明一種基于3D生物打印修復人關節軟骨的方法的過程示意圖。
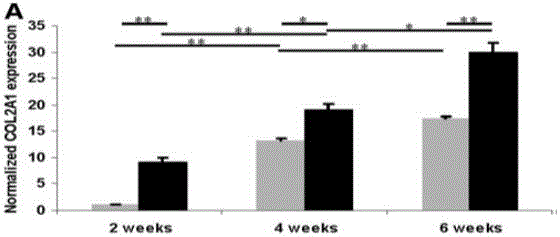
圖2為本發明生物打印關節軟骨的COL2A1基因表達水平柱狀圖。
圖3為本發明生物打印關節軟骨的ACAN基因表達水平柱狀圖。
圖4為本發明生物打印關節軟骨的COL1A1基因表達水平柱狀圖。
具體實施方式
如圖1所示,本發明公開了一種基于3D生物打印修復人關節軟骨的方法,包括以下步驟:
PEGDMA的制備
將3kDa的PEG(聚乙二醇)溶解在四氫呋喃中,在氮氣條件下使PEG與甲基丙烯酰氯過夜反應。通過乙醚析出和過夜凍干的方法純化合成的PEGDMA(聚乙二醇二甲基丙烯酸酯)大分子單體,采用質子核磁共振法檢測,確保合成的PEGDMA大分子單體純度大于95%。
人間充質干細胞分離
無菌條件下取健康成人骨髓液,加入等體積PBS,用吸管吹打分散細胞。室溫下取300g骨髓PBS混合液離心5min,收集細胞。用PBS重懸細胞,進行計數。室溫下取300g骨髓PBS混合液離心5min,收集細胞,用含20%(v/v)胎牛血清和1%(v/v) PSG(青霉素-鏈霉素-慶大霉素)的α-MEM基礎培養基重懸細胞,將細胞以1.6×105個/cm2的密度接種于培養瓶中,置于37℃、5%(v/v)CO2的細胞培養箱培養,48小時后換液,之后每隔3天換液。體外擴增到第二代后,將干細胞傳代,調整密度至5×103個/cm2,培養24小時使細胞貼壁。將基礎培養基更換為誘導培養基DMEM,置于37℃、5%(v/v)CO2的細胞培養箱培養,每3天更換一次誘導培養基,培養2-6周。所述誘導培養基DMEM含1×胰島素-轉鐵蛋白-硒-丙酮酸鈉 (ITS-A ),0.1mmol/L抗壞血酸磷酸鹽, 1.25mg/mL 人血清白蛋白, 10-7mol/L地塞米松, 1%(v/v) 青霉素-鏈霉素-慶大霉素, 10 ng/mL TGF-b1。
3D生物紙和生物墨水的制備
取新鮮牛股骨,無菌條件下用直徑8mm的不銹鋼鉆洞,骨軟骨栓塞用含抗生素的DMEM清洗3次。在骨軟骨栓塞的中心位置用直徑4mm的無菌活體穿孔器做出全層軟骨缺損,缺損的深度約2-5mm,具體取決于軟骨的厚度。將通過上述方法制備的骨軟骨栓塞培養在含有10%(v/v)小牛血清和1%(v/v)PSG(青霉素-鏈霉素-慶大霉素)的DMEM中,在37℃、5%(v/v)CO2的細胞培養箱中培養成3D生物紙。將前述制得的純化PEGDMA溶解在PBS或去離子水中,使溶液終濃度為10%(w/v)和20 %(w/v)。向溶液中加入0.05%(w/v)光引發劑2959。將誘導所得軟骨細胞重懸在過濾除菌的PEGDMA溶液中,每毫升溶液含5×106個細胞。
3D生物打印
將生物打印機用紫外照射滅菌,將含有50個噴墨倉的打印筆用70%(v/v)乙醇消毒。打印時將長波紫外燈置于打印平臺上方25cm處,UV強度為4.5 mW/cm2。打印筆中加滿前述制得的生物墨水,用鋁箔覆蓋打印筆以防止紫外照射。用Adobe Photoshop設計軟骨缺損的大小和形狀,用打印機層層打印,制造出3D軟骨,并將其在誘導培養基中分別培養2、4、6周,培養基每3天更換一次。
為更清楚的了解和表征PEGDMA及3D軟骨性能,我們對其進行了相應的性能測試功能鑒定。
(1)PEGDMA機械性能測試
測試前,將制備的PEGDMA無細胞水凝膠在37℃的DMEM中放置48小時,用雙軸控制器測量水凝膠的厚度。采用步進式壓縮的方式,用測試速度為0.1mm/s的應變荷載將水凝膠壓縮至最大壓縮張力的20%。每個荷載循環后,都對軟骨進行DMEM溶液平衡。壓縮模量根據壓力-張力曲線的斜率計算。結果表明所打印的軟骨組織機械強度達到或優于天然軟骨的生物力學特性。
(2)PEGDMA溶脹系數測定
取一定量的PEGDMA水凝膠在37℃的DMEM中放置48小時后稱重,得到溶脹后質量Ws;將PEGDMA水凝膠凍干,稱重得到干重Wd。平衡溶脹比Q= Ws /Wd,水含量M=(Ws -Wd)/ Ws。結果表明所打印的關節軟骨組織和天然組織非常相似。
(3)3D生物打印軟骨相關基因表達水平
用液氮速凍制備的3D軟骨物并將其粉末化,提取上述樣品的RNA逆轉錄得cDNA,用實時定量PCR的方法檢測軟骨相關基因(COL1A1,COL2A1,ACAN,GAPDH做為內參)表達情況,如圖2、圖3、圖4所示,分別為COL2A1,ACAN,COL1A1的表達情況。結果表明打印軟骨的基因表達水平達到天然軟骨的要求。
(4)3D生物打印軟骨生化分析
將分別培養2周、4周、6周的3D軟骨凍干48小時,分別向軟骨樣品中加入1ml木瓜蛋白酶溶液(含125 mg/mLIII型木瓜蛋白酶,10mM L-半胱氨酸,100mM磷酸鹽緩沖液和10mM EDTA,pH 6.4),在60℃下處理16小時。之后向溶液中加入1ml胃蛋白酶溶液(濃度100 mg/mL,胃蛋白酶溶解于0.05M醋酸),將溶液置于4℃處理6天。用CyQUANT Cell Proliferation Assay試劑盒測定DNA含量,用ELISA試劑盒測定I型和II型膠原含量。結果表明打印軟骨的蛋白生產水平優異。
(5)3D生物打印軟骨組織學分析
將制備的3D軟骨用10%福爾馬林溶液固定過夜,然后將其轉移到70%(v/v)的乙醇溶液中,接著用石蠟包埋經過上述步驟處理的3D軟骨。包埋后制作成6μm厚的石蠟切片并用蕃紅O/固綠染色,觀察水凝膠分泌的蛋白聚糖。結果表明打印軟骨的蛋白聚糖生成水平達到天然軟骨水平。
(6)天然軟骨的界面破壞應力測試
將PEG水凝膠打印到3D生物打印紙上,分別在誘導培養基中培養2、4、6周的時候收集樣品。小心的將3D生物打印紙和移植物的軟骨部分與軟骨下骨分離,所得軟骨樣本置于專門的可以支持外環部分的小室中。采用由SMAC音圈電機驅動的活塞(直徑稍小于3.5mm)推軟骨樣本中心,速度為0.1mm/s,在1kHz的時候測量軸向力并記錄。中心部分的厚度用游標卡尺測定,界面破壞應力是實驗中測得最大力和中心側邊區域之比。結果表明天然軟骨和打印軟骨的相互結合力隨著培養時間的增長而增強。
以上顯示和描述了本發明的基本原理和主要特征。本行業的技術人員應該了解,本發明不受上述實施例的限制,上述實施例和說明書中描述的只是說明本發明的原理,在不脫離本發明精神和范圍的前提下,本發明還會有各種變化和改進,這些變化和改進都落入要求保護的本發明范圍內。本發明要求保護范圍由所附的權利要求書及其等效物界定。
- 還沒有人留言評論。精彩留言會獲得點贊!