干擾素調節因子6及其抑制劑在治療血管損傷后再狹窄中的功能和應用的制作方法
本發明屬于基因的功能與應用領域,特別涉及一種干擾素調節因子6(interferon regulatory factor-6,IRF6)作為藥物靶標在篩選治療血管損傷后再狹窄的藥物中的應用。
背景技術:
隨著人類社會經濟的飛速發展、人民生活水平的提高以及人口老齡化進程的加快,心血管疾病的發病率逐年升高,已成為嚴重危害全球性公眾健康的重大疾病之一,目前對這類疾病尚無根治辦法。血管外科的治療手段包括球囊擴張、支架置入及動脈旁路等方式,但是血管重建后再狹窄極大地影響了治療效果。有關血管再狹窄的研究已進行了多年,但是迄今為止還沒有明確。已有研究表明,在損傷形成的過程中,新生內膜及中膜組織過度增生以及同時伴隨的細胞外基質形成,是造成血管重建后再狹窄的主要病理基礎。血管平滑肌細胞(vascular smooth muscle cells,VSMCs)的兩種不同的表型狀態,即分化/收縮型和去分化/合成型的轉化在新生內膜形成過程中扮演著重要的角色。其由收縮型向合成型轉化時,增殖、遷移能力增強并分泌、合成大量的細胞外基質,從而形成新生內膜,進而導致嚴重的血管增生性疾病的發生。因此,尋找新的血管再狹窄的干預靶點具有重要的理論意義。
哺乳動物體內,干擾素調節因子家族(IRFs)是由9個家族成員組成(IRF1-IRF9),目前的研究公認其為免疫和細胞存活的主要調節因子[1-3]。與其他IRF成員不同之處,IRF6的功能研究都集中在表皮發育和分化的調節作用,而其對免疫細胞的影響仍然未知[4]。有2個主要IRF6缺陷小鼠模型得到發現:其中一個為在翼狀胬肉綜合征病人身上發現的,敲除最常見的IRF6蛋白突變(R84C)[5],另一個是功能完全缺失的等位基因[4]。IRF6功能無論是部分或完全缺失都能導致肢體和皮膚發育嚴重缺陷以及在濾泡間上皮角質細胞妥協的增殖與分化[4,5]。除了翼狀胬肉綜合征,IRF6的突變也已與另一常染色體顯性遺傳疾病,范德伍茲綜合征相關,其特征是唇裂,指畸形,皮膚皺褶,和生殖器異常[6]。在這些綜合征里,DeltaNp63亞型p63和正性激活IRF6表達的IRF6增強劑之間的相互作用已經建立,導致了p63水平的負調節和隨后抑制角質細胞的增殖[7]。
參考文獻
1.Tamura,T.,Yanai,H.,Savitsky,D.&Taniguchi,T.The IRF family transcription factors in immunity and oncogenesis.Annu.Rev.Immunol.26,535–584(2008).
2.Ikushima,H.,Negishi,H.&Taniguchi,T.The IRF family transcription factors at the interface of innate and adaptive immune responses.Cold Spring Harb.Symp.Quant.Biol.78,105–116(2013).
3.Yanai,H.,Negishi,H.&Taniguchi,T.The IRF family of transcription factors:inception,impact and implications in oncogenesis.Oncoimmunology 1,1376–1386(2012).
4.Ingraham CR,Kinoshita A,Kondo S,Yang B,Sajan S,Trout KJ,Malik MI,Dunnwald M,Goudy SL,Lovett M,Murray JC,Schutte BC(2006)Abnormal skin,limb and craniofacial morphogenesis in mice deficient for interferon regulatory factor 6(Irf6).Nat Genet 38:1335-1340doi:10.1038/ng1903
5.Richardson RJ,Dixon J,Malhotra S,Hardman MJ,Knowles L,Boot-Handford RP,Shore P,Whitmarsh A,Dixon MJ(2006)Irf6is a key determinant of the keratinocyte proliferation-differentiation switch.Nat Genet 38:1329-1334doi:10.1038/ng1894
6.Kondo S,Schutte BC,Richardson RJ,Bjork BC,Knight AS,Watanabe Y,Howard E,de Lima RL,Daack-Hirsch S,Sander A,McDonald-McGinn DM,Zackai EH,Lammer EJ,Aylsworth AS,Ardinger HH,Lidral AC,Pober BR,Moreno L,Arcos-Burgos M,Valencia C,Houdayer C,Bahuau M,Moretti-Ferreira D,Richieri-Costa A,Dixon MJ,Murray JC(2002)Mutations in IRF6cause Van der Woude and popliteal pterygium syndromes.Nat Genet 32:285-289doi:10.1038/ng985
7.Moretti F,Marinari B,Lo Iacono N,Botti E,Giunta A,Spallone G,Garaffo G,Vernersson-Lindahl E,Merlo G,Mills AA,Ballaro C,Alema S,Chimenti S,Guerrini L,Costanzo A(2010)A regulatory feedback loop involving p63and IRF6links the pathogenesis of 2genetically different human ectodermal dysplasias.J Clin Invest 120:1570-1577doi:10.1172/JCI40267
技術實現要素:
為解決上述現有技術的缺陷和不足,本發明的目的在于確定IRF6的表達和血管損傷后再狹窄的相互關系,提供一種IRF6作為藥物靶標在篩選防治血管損傷后再狹窄的藥物中的應用,進而提供一種IRF6的抑制劑在制備防治血管損傷后再狹窄的藥物中的應用。
本發明的目的通過下述技術方案實現:
本發明以野生型C57BL/6小鼠與IRF6基因敲除小鼠(IRF6-KO小鼠)為實驗對象,通過頸動脈導絲損傷模型誘導獲得小鼠血管損傷模型(vascular injury,VI),進行了血管損傷模型(VI)小鼠內膜新生測定、血管壁細胞增殖水平的檢測和平滑肌細胞表型的檢測和研究,結果表明:與野生型C56BL/6小鼠對比,IRF6基因敲除小鼠表現出內膜新生及細胞增殖明顯小于WT小鼠;IRF6基因敲除可以抑制細胞增殖核抗原(Proliferating Cell Nuclear Antigen,PCNA)和細胞周期蛋白(Cyclin D1)的表達,可抑制平滑肌細胞的增殖和內膜增生;IRF6基因敲除可以促進平滑肌細胞分化特異性抗原(smoothelin)、平滑肌肌動蛋白(Smooth Muscle Actin,SMA)和平滑肌22α(smooth muscle 22alpha,SM22α)的表達,可抑制平滑肌細胞由收縮型向合成型的表型轉換,從而抑制內膜增生。上述結果表明IRF6基因敲除會抑制血管損傷后再狹窄的發生,IRF6能夠促進血管損傷后再狹窄的形成,為研究預防、緩解和/或治療血管損傷后再狹窄的新靶點和新策略提供了理論依據和臨床基礎。
因此,IRF6基因可作為藥物靶點,構建IRF6基因過表達的體外細胞模型或動物模型,用于篩選預防、緩解和/或治療血管損傷后再狹窄的藥物;IRF6基因也可作為基因治療中的靶基因,設計并制備預防、緩解和/或治療血管損傷后再狹窄的目的。例如以IRF6為靶基因,設計可干擾IRF6表達的雙鏈siRNA,通過化學方法合成以后,注射入人體通過RNA干擾的方法使IRF6基因沉默來治療血管損傷后再狹窄;還可以設計并構建IRF6的突變體,注射后進入細胞,競爭IRF6原形的作用底物,從而抑制IRF6的功能,起到治療目的;此外,還可以以IRF6為靶點設計小分子化合物抑制劑,利用IRF6基因過表達的體外模型或動物模型,通過篩選,發現其中能夠特異性抑制IRF6的分子,從而為血管損傷后再狹窄的治療提供新的治療性分子。
針對IRF6的上述功能,提供IRF6作為藥物靶標在篩選治療血管損傷后再狹窄的藥物中的應用。
針對IRF6的上述功能,提供IRF6的抑制劑在制備血管損傷后再狹窄的藥物中的應用。
一種保護血管功能的藥物,包含IRF6的抑制劑。
一種治療血管損傷后再狹窄的藥物,包含IRF6的抑制劑。
一種預防、緩解和/或治療血管損傷后再狹窄的動脈支架,其包被有IRF6的抑制劑。
所述的IRF6的抑制劑優選為IRF6基因的siRNA、IRF6基因的RNA干擾載體,IRF6的抗體及其他能夠抑制IRF6表達的抑制劑。
在本發明中,所述血管損傷主要是動脈血管損傷。
在本發明中,所述血管損傷是指動脈粥樣硬化引起的血管損傷,或者在治療動脈粥樣硬化時引起的血管損傷,例如通過球囊擴張或放入支架引起的血管損傷,或者移植后動脈病或肺動脈高壓引起的血管損傷。
在本發明中,所述動脈粥樣硬化既包括動脈粥樣硬化較早期階段的血管狹窄期,也包括動脈粥樣硬化嚴重時的血管梗塞期。
在本發明中,所述動脈支架是指用于支撐人體內因病變而狹窄、閉塞的血管,恢復血液流通的管狀器件,采用金屬或高分子材料加工制成,可長期或暫時留于人體血管內。在管腔球囊擴張成形的基礎上,在病變段置入支架以達到支撐狹窄閉塞段血管、減少血管彈性回縮及再塑形、保持管腔血流通暢的目的,既包括外周動脈支架,也包括冠狀動脈支架。
在本發明中,所述再狹窄是指在局部血管發生損傷時,所作出的導致血管管腔再狹窄的普遍性生物學反應。這里主要指醫源性損傷引起的血管再狹窄,損傷過程主要由動脈重塑和內皮增生組成。
本發明相對于現有技術具有如下的優點及效果:
(1)本發明發現IRF6的新功能,即IRF6具有惡化血管損傷后再狹窄的作用。
(2)基于IRF6在惡化血管損傷后再狹窄中的功能,其為研制預防、緩解和/或治療血管損傷后再狹窄的藥物提供靶標。
(3)IRF6的抑制劑可用于制備預防、緩解和/或治療血管損傷后再狹窄的藥物。
(4)IRF6的抑制劑可用于制備預防、緩解和/或治療血管損傷后再狹窄的動脈支架。
附圖說明
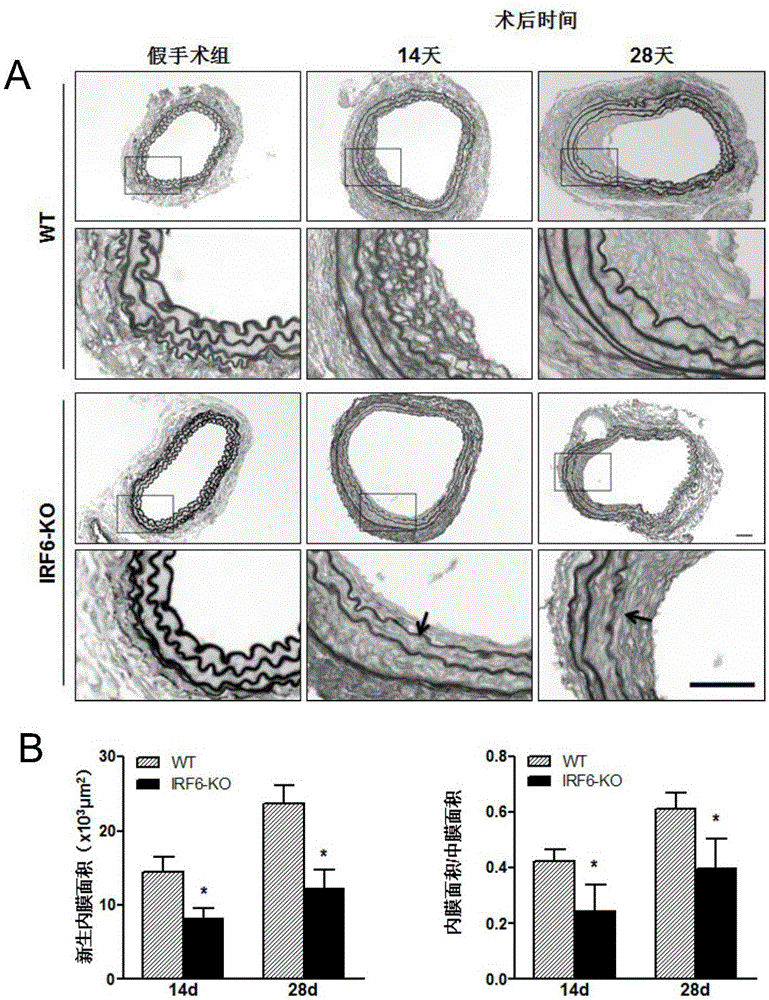
圖1是WT和IRF6-KO小鼠術后14、28天的EVG染色及內膜面積結果統計柱狀圖;
其中,A:EVG染色圖,B:內膜面積統計柱狀圖(*:p<0.05vs WT VI組)。
圖2是WT和IRF6-KO小鼠術后14、28天血管壁細胞增殖水平標志物PCNA、CyclinD1表達的免疫熒光染色及結果統計柱狀圖;
其中,A:免疫熒光染色,B:結果統計柱狀圖(*:p<0.05vs WT VI組)。
圖3是WT和IRF6-KO小鼠術后14、28天平滑肌細胞表型轉換標志物smoothelin、SMA、SM22α表達的免疫熒光染色及結果統計柱狀圖;
其中,A:免疫熒光染色,B:柱狀圖(*:p<0.05vs WT VI組)。
具體實施方式
通過以下詳細說明結合附圖可以進一步理解本發明的特點和優點。所提供的實施例僅是對本發明方法的說明,而不以任何方式限制本發明揭示的其余內容。
實驗用動物及飼養
實驗動物:選用8-10周齡、體重在24-27g,雄性,C57BL/6小鼠(WT小鼠,購自北京華阜康生物科技有限公司),IRF6基因敲除小鼠(IRF6-KO,購自美國The Jackson Laboratory公司,貨號:016902)。
飼養環境:所有實驗小鼠均飼養在武漢大學SPF級實驗動物中心。SPF級小鼠飼料購自北京華阜康生物科技有限公司,飼養條件:室溫在22-24℃之間,濕度在40-70%之間,明暗交替照明時間為12h,自由飲水攝食。
【實施例1】小鼠血管損傷模型(VI)獲得
1.實驗動物分組:使用8-10周齡,體重24-27g的WT和IRF6-KO小鼠,共分為2組:WT血管損傷組,IRF6-KO血管損傷組,每組各20只小鼠。分別在手術后14天和28天處死小鼠,取損傷節段血管進行分析。
2.小鼠血管損傷模型操作流程:
1)用電子天平于動態模式下準確稱取小鼠體重(g),用雙蒸水準確配置3%戊巴比妥鈉溶液,輕輕搖動使其充分溶解,采用80mg/kg體重劑量,計算所需戊巴比妥鈉溶液體積后用1mL注射器準確抽取相應體積溶液,行腹腔注射麻醉小鼠,待小鼠充分麻醉倒(約3min)后,8%硫化鈉頸部脫毛。
2)分離頸內和頸外動脈。
3)在頸內動脈和頸外動脈分叉處用8-0線結扎頸外動脈,同時用血管夾(WPI,501784-G)暫時性阻斷頸內動脈及頸總動脈供血。
4)用顯微剪(WPI,501839)在頸外動脈結扎線的上方橫向剪一個小口。經此血管切口插入直徑0.015英寸的導絲(No.C-SF-15-15,Cook,Bloomington,Indiana),旋轉導絲進退5-6次。
5)在切口進心端結扎頸外動脈,松開頸內及頸總動脈置留的血管夾,剪斷線頭,清理術野,縫合頸部切口。
【實施例2】血管損傷模型(VI)小鼠內膜新生測定
1.小鼠取材
1)麻醉小鼠,剪破心臟放血。
2)從頸動脈近分叉處剪下頸動脈,取0.5-0.6cm長,保留頸外動脈線結。
3)將頸動脈放入PBS中,用顯微鑷輕柔排干管腔內的殘血。
4)將血管放入裝有1mL 4%多聚甲醛的1.5mL EP管中固定。
2.病理學檢測
2.1制備石蠟標本切片
由實驗室專業病理工作人員制備石蠟標本切片,主要操作程序包括:4%多聚甲醛中隔夜固定后,將血管用濾紙小心包好,放入包埋框→流水沖洗→脫水→透明→浸蠟→包埋→切片(3μm)→攤片→晾干或烘烤后備用。
2.2EVG染色
主要步驟為:55℃烘烤30min→二甲苯5min,3次→100%酒精3min,2次→95%酒精3min,1次→70%酒精3min,1次→雙蒸水1min→高錳酸鉀溶液5min(珠海貝索,BA-4083B)→水洗1min→草酸溶液5min(珠海貝索,BA-4083B)→水洗1min→95%酒精分化2-3秒→Elastin染液(珠海貝索,BA-4083B)8-24小時→95%酒精迅速分化1s→流水沖洗10min→雙蒸水1min→Van Gieson染液(珠海貝索,BA-4083B)1min→95%酒精迅速分化2-3s→100%酒精2min,2次→二甲苯2min,3次→趁二甲苯未干立即封片→通風櫥內吹干,顯微鏡拍照。
以血管內彈力纖維和外彈力纖維為界,內彈力板以內為血管內膜,外彈力板以外為血管外膜,內外彈力板之間為血管中膜。用Image-Pro Plus 6.0軟件分別圈各血管管腔面積。
內膜面積大小的計算參照公式如下:
新生內膜面積=內彈力板面積-管腔面積;
中膜面積=外彈力板面積-內彈力板面積。
小鼠EVG染色后的血管內膜新生的結果如圖1。正常的血管壁結構完整,排列整齊,血管內膜為單層內皮細胞,結構完整,中膜平滑肌細胞排列整齊。通過HE染色觀察到,血管損傷組(VI組)血管壁結構不完整,血管內皮細胞缺失,新生內膜增生明顯,并伴有大量炎癥細胞浸潤;IRF6-KO組在術后14、28天新生內膜面積明顯比WT小鼠要減小。同樣,內膜面積/中膜面積的比值在VI術后IRF6-KO組要低于WT組。這說明IRF6基因的缺失可以抑制血管損傷后引起的內膜新生。
【實施例3】血管壁細胞增殖水平的檢測
免疫熒光染色檢測細胞增殖核抗原(Proliferating Cell Nuclear Antigen,PCNA)、細胞周期蛋白(Cyclin D1)的表達。所需一抗信息:PCNA(#2586;1:100;mouse;Cell Signaling Technology),cyclin D1(#2978;1:25;rabbit;Cell Signaling Technology);所需二抗信息:Alexa Fluor 568-conjugated goat anti-rabbit IgG(A11011;Invitrogen,Carlsbad,CA),Alexa Fluor 568-conjugated goat anti-mouse IgG(A11004;Invitrogen,Carlsbad,150d,CA)。
主要步驟為:
1)烤片:將石蠟切片置于55℃烤箱中60min以上。
2)脫蠟:二甲苯8min×3。
3)水合:100%乙醇5min×2;95%乙醇5min;70%乙醇5min;ddH2O浸洗5min×2。
4)檸檬酸鹽組織抗原修復(高壓修復):取一定量的pH6.0檸檬酸鹽抗原修復工作液(購自福州邁新生物科技有限公司,貨號MVS-0100)于修復盒中,修復工作液的量必須能足夠浸沒整張切片,將修復盒放入已加入適量自來水的高壓鍋中,大火加熱至沸騰,將脫蠟水合后的組織切片置于耐高溫染色架上,再將染色架緩慢放入修復盒中,蓋上鍋蓋,扣上壓力閥,繼續加熱至噴氣,開始計時5min后,壓力鍋斷開電源,去閥開蓋,取出修復盒;室溫放置20min自然冷卻后取出切片。
5)ddH2O漂洗5min×2次,PBS漂洗5min×2次。
6)組化筆劃圈,滴加10%驢血清(GTX27481,GeneTex)封閉,于濕盒中37℃封閉60min。
7)棄封閉液,滴加適當比例稀釋的一抗,4℃孵育過夜,37℃復溫30min,棄去一抗,PBS洗8min×4次。
8)滴加二抗,于濕盒中37℃孵育60min,棄去二抗,PBS浸洗5min×4次。
9)SlowFade Gold antifade reagent with DAPI(S36939,Invitrogen)封片。
10)熒光鏡下觀察,拍照。若需保存,于暗濕盒中4℃保存。
熒光統計方法:PCNA免疫熒光染色統計采用IPP軟件計數,PCNA陽性細胞百分比=PCNA陽性細胞個數/(內膜+中膜)的總DAPI個數*100%;CyclinD1免疫熒光染色統計采用IPP軟件直接測陽性吸光度。
免疫熒光法觀察平滑肌細胞增殖標志物PCNA、CyclinD1在WT和IRF6-KO小鼠血管損傷后的表達變化,結果見圖2。PCNA、CyclinD1在血管組織中有表達,IRF6-KO小鼠在術后14、28天PCNA的陽性細胞個數及CyclinD1的熒光強度均要降低于同組的WT小鼠,表明IRF6基因敲除可以抑制PCNA、CyclinD1的表達,可抑制平滑肌細胞的增殖和血管內膜新生。
【實施例4】平滑肌細胞表型的檢測
免疫熒光染色檢測平滑肌細胞分化標志物:平滑肌細胞分化特異性抗原(smoothelin)、平滑肌肌動蛋白(Smooth Muscle Actin,SMA)、平滑肌22α(smooth muscle 22alpha,SM22α)的表達。所需一抗信息:SMA(ab5694;1:100;rabbit;Abcam)and SM22α(ab14106;1:100;rabbit;Abcam);所需二抗信息:Alexa Fluor 488-conjugated goat anti-rabbit IgG(A11008;Invitrogen,Carlsbad,CA)。
主要步驟參照實施例3。
熒光統計方法:采用IPP軟件直接測陽性吸光度。
在正常生理狀態下,血管平滑肌細胞處于靜止狀態,主要表現為收縮型;血管損傷后,血管平滑肌細胞由中膜向內膜遷移,平滑肌細胞的增殖凋亡失平衡,表型由收縮型向合成型轉變,血管壁不適重塑,從而引起內膜增生。免疫熒光觀察smoothelin、SMA、SM22α在WT和IRF6-KO小鼠血管損傷后的表達變化,結果見圖3。smoothelin、SMA、SM22α在血管組織中有表達,IRF6-KO小鼠在術后14、28天smoothelin、SMA、SM22α的熒光強度均要高于同組的WT小鼠,表明IRF6基因敲除可以促進smoothelin、SMA、SM22α的表達,可抑制平滑肌細胞由收縮型向合成型的表型轉換,從而抑制內膜增生。
以上實施例結果顯示,野生型小鼠和IRF6-KO小鼠在血管損傷模型(VI)的誘導下均發生血管損傷后再狹窄。IRF6基因敲除小鼠的內膜新生、細胞增殖水平以及平滑肌細胞表型轉換均比野生型小鼠不明顯。這些結果表明,IRF6可以加重血管損傷誘導的平滑肌細胞的增殖、表型轉化和血管新生內膜形成。
上述實施例為本發明較佳的實施方式,但本發明的實施方式并不受上述實施例的限制,其他的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 干擾素調節因子8(irf8)在腦卒中疾病中的應用的制作方法
- 通過抑制干擾素相關發育調節因子1(ifrd1)的天然反義轉錄物而治療ifrd1相關疾病的制作方法
- 通過抑制干擾素調節因子8(irf8)的天然反義轉錄物而治療irf8相關疾病的制作方法
- 干擾素調節因子4基因在治療動脈粥樣硬化中的應用的制作方法
- 干擾素調節因子1基因在治療動脈粥樣硬化中的應用的制作方法
- 重組人干擾素調節因子4結合蛋白表達體系及制備方法與應用的制作方法
- 干擾素調節因子9(irf9)及其抑制劑在冠狀動脈粥樣硬化性心臟病中的應用的制作方法
- 分析活檢樣品中干擾素調節因子-1特異性核糖核酸以診斷癌癥,癌變前狀態的方法
- 在致瘤性診斷中的干擾素調節因子1和2的制作方法
- 一種新的多肽——干擾素調節因子10.34和編碼這種多肽的多核苷酸的制作方法
- 腎外髓質鉀通道的抑制劑的制作方法與工藝
- 一種抑制植物細胞組織在培養中褐化的方法與流程
- 干擾素調節因子5及其抑制劑在腦卒中疾病中的應用的制作方法與工藝
- 干擾素調節因子6(IRF6)及其抑制劑在治療心肌肥厚中的應用的制作方法與工藝
- 人喉組織中水通道的表達定位方法與流程
- 補體因子H抑制劑及與之相關的用途的制作方法與工藝
- 干擾素調節因子5(IRF5)及其抑制劑在治療心肌肥厚中的應用的制作方法與工藝
- 作為因子XIA抑制劑的環狀P1連接體的制作方法與工藝
- 作為補體因子B抑制劑用于治療眼科疾病的2?(1H?吲哚?4?基甲基)?3H?咪唑并[4,5?B]吡啶?6?甲腈衍生物的制作方法與工藝
- 能夠結合組織因子途徑抑制劑(1?161)上的兩個表位的抗體的制作方法與工藝
- 干擾素調節因子5(IRF5)及其抑制劑在治療心肌肥厚中的應用的制作方法與工藝
- 作為因子XIA抑制劑的環狀P1連接體的制作方法與工藝
- 能夠結合組織因子途徑抑制劑(1?161)上的兩個表位的抗體的制作方法與工藝
- 針對組織因子途徑抑制劑(TFPI)的優化的單克隆抗體的制作方法與工藝
- 一種作為自分泌運動因子抑制劑的咔唑類化合物及其制備方法和應用與流程
- 外周血單核細胞活化抑制劑在制備治療急性肝衰竭的藥物中的用途的制造方法與工藝
- 對NEDD8活化酶(NAE)抑制劑的反應的生物標記的制造方法與工藝
- 一種肺癌調節因子SRSF5及其抑制劑與應用的制造方法與工藝
- 自分泌運動因子抑制劑的制造方法與工藝
- 一種BCL?2抑制劑Venetoclax的合成方法與流程