用HIFU治療子宮肌瘤或其它組織的辦公室用系統的制作方法
相關申請的交叉引用
本申請要求于2010年4月2日提交的、申請號為12/753,813的美國專利申請的優先權,該申請是于2009年10月5日提交的、申請號為12/573,840的美國專利的接續部分,后者根據法規35u.s.c.§119(e)要求于2008年10月3日提交的、申請號為61/102,804的美國臨時申請的權益;上述這些申請的全部內容以引用方式并入本申請。
本文的技術涉及用于對內部人體組織進行治療的方法和裝置,尤其涉及用高強度聚焦超聲(highintensityfocusedultrasound,hifu)對內部人體組織的治療。
背景技術:
當前有許多用于治療內部人體組織的技術。例如,可使用例如外科手術、放射和化療等多種技術來治療內部惡性和非惡性腫瘤。每一種技術都有其優點和缺點。一種用于治療內部人體組織的有前景的非侵入性技術是高強度聚焦超聲(highintensityfocusedultrasound,hifu)。通過hifu,將高強度超聲能量聚焦在理想治療區。該能量同時通過熱機制和機械機制來導致組織的破壞。
使用hifu其中一個缺點是治療給定組織區所需的時間。當前的hifu程序可能需要長達3小時的時間來治療單個腫瘤,這歸因于醫生和患者對這些程序的低接受性。另外,徹底燒蝕一大片組織所需的能量導致大量熱從燒蝕區向外傳導,這可能增大對周圍的健康組織造成熱損傷的風險。
鑒于上述問題,需求一種以能夠縮短治療時間、同時提高安全性和有效性、便于使用且降低了所需的總能量的方式來治療內部人體組織。
技術實現要素:
為解決上述問題,本文的技術涉及一種用于治療子宮肌瘤或其它組織的系統,所述其它組織足夠緊湊,以便能夠在內科進行處理。該系統使用來自可包括高強度聚焦超聲(highintensityfocusedultrasound,hifu)的能量源的能量來治療組織。這類能量源還可包括射頻、輻射、微波、冷凍療法、激光等。盡管如此,優選方式還是hifu,因為hifu具有無需穿刺或切開便能非侵入地聚焦在人體深處組織的獨特性能。
在一個實施例中,通過燒蝕多個相鄰的基本治療區、以形成用于治療整個目標組織區的“積木”(buildingblocks)來治療理想目標組織區。通過使hifu換能器的焦域聚集以燒蝕比焦域本身大、但比整個理想治療區小的子區域而生成每個基本治療區。通過在施加治療能量時使hifu換能器的焦域重復聚集在基本治療區的周界上而生成每個基本治療區。可不使用溫度數據或反饋控制而將來自hifu換能器的治療信號施加在組織上,即便有氣泡存在;這樣,治療時間顯著地縮短了。
在一個實施例中,機械或電動轉向裝置使hifu波束的焦域圍繞基本治療區的周界聚集,直到對該周界所包圍的組織進行了燒蝕。在一個實施例中,基本治療區的中央區域不直接燒蝕,而是通過周界燒蝕時產生的熱傳導進行治療。
在一個實施例中,本文的技術包括用于將治療能量投送至焦域的hifu換能器,以及計算機控制的波束轉向器,用于在施加治療能量時使焦域重復地置于基本治療區的周界上。
在一個實施例中,生成了一種基本治療區模式,以形成圍繞治療區的燒蝕組織殼體(類似于包圍著蛋的蛋殼的幾何形狀)。在hifu療法中使用這種殼體燒蝕類型來治療理想組織區,具有兩個主要作用:(1)在一個實施例中,燒蝕殼體中斷了向治療區內部的供血,導致殼體內未治療的組織在原處缺血性壞死。通過這種方式,盡管僅用hifu對外部邊界進行了直接治療,然而對區域中央造成的缺血性損傷會隨時間推移而破壞整個區域。(2)在另一實施例中,由模式殼體構成的基本治療區這樣一種方式沉積:盡管僅用hifu能量直接燒蝕了外部邊界,然而,朝向區域內部的熱傳導使內部組織即刻被熱破壞了。由于殼體燒灼形成的是比用hifu能量直接燒灼的區域更大的有效組織治療區,因此,殼體燒蝕所具有的這些優點顯著地提高了hufu療法的效率。利用殼體燒蝕的優點中的一兩個便可提高給定hifu步驟的產出效果。
在另一實施例中,生成了多個用于填充或部分填充治療目標區的基本治療區。利用這項技術,與僅燒蝕外部邊界的情形相比,治療區內有更大比例的組織通過暴露于燒蝕能量中而直接壞死。
在另一實施例中,hifu治療裝置使hifu換能器的焦域沿某一路徑移動,以環繞或包圍組織區。hifu換能器焦域移動的模式生成了一串直徑各異的燒蝕組織環狀體,這些環狀體堆疊起來以環繞或包圍組織區。在另一實施例中,移動焦域以生成用于包圍治療區的燒蝕組織螺旋狀殼體。
為最大程度縮短治療時間并降低對操作人員的技能要求,在一個實施例中使用了計算機控制機構來自動移動hifu焦域并施加hifu能量,以這種方式生成理想基本治療區和/或理想幾何形狀的殼體,同時用戶僅需簡單地保持治療儀靜止即可。
本部分內容選擇性地簡要介紹了一些概念,在以下說明書具體實施方式部分將對這些概念作進一步敘述。本部分內容并不旨在辨識所主張的主體的關鍵特征,也不旨在幫助確定所主張的主體的范圍。
附圖說明
通過以下結合附圖的詳細描述,前述的本技術的各方面及其有點將更清晰地展現,其中:
圖1a展示了對應于本文技術一個實施例的由燒蝕殼體包圍的內部組織區;
圖1b為燒蝕殼體內部和外部的組織的詳細視圖;
圖2展示了要治療的子宮肌瘤的超聲圖像;
圖3a和3b展示了根據本文技術一個實施例生成的圓柱形基本治療區;
圖3c展示了安全性及治療范圍與所hifu信號的施加功率之間的關系;
圖3d展示了根據本文技術一個實施例生成的基本治療區的側視圖和俯視圖,以及該實施例產生的完全填充的燒蝕區;
圖3e展示了根據本公開技術另一實施例生成的更小的基本治療區的側視圖和俯視圖,以及該實施例產生的完全填充的燒蝕區;
圖3f展示了根據本公開技術另一實施例生成的更大的基本治療區的側視圖和俯視圖,以及該實施例產生的部分填充的燒蝕區;
圖3g展示了通過使hifu焦域沿著組織區單次掃過的方式施加能量而生成的不均勻的治療組織輪廓;
圖3h展示了通過使hifu焦域沿著組織區多次掃過的方式施加能量而生成的更均勻的治療組織輪廓;
圖3i展示了通過使焦域來回聚集在全部理想治療區周界的一部分上而生成的弧形或弓形基本治療區;
圖3j和3k展示了對應于本文技術一個實施例的、用于從多個基本治療區生成圍繞組織區的燒蝕殼體的技術;
圖4a和4b展示了對應于本公開技術另一實施例的、用于生成圍繞組織區的燒蝕殼體的第二種技術;
圖4c展示了對應于本公開技術另一實施例的、用于生成圍繞組織區的燒蝕殼體的第三種技術;
圖4d展示了用于生成圍繞子宮肌瘤的燒蝕殼體的技術,所述燒蝕殼體與至少一部分相鄰子宮內膜重疊,以進一步減輕月經過多癥狀;
圖5展示了對應于本文技術一個實施例的hifu治療設備;
圖6展示了對應于本公開技術一個實施例的、用于改變hifu換能器的焦域的位置和朝向的機構;
圖6a和6b展示了如何使用圖6所示的機構來改變焦域的角度朝向;
圖6c和6d展示了用于改變焦域深度和位置的另一機構;
圖7展示了對應于本文技術一個實施例的、使用hifu治療組織的系統;
圖8a和8b展示了兩種不同的hifu信號波形;
圖9展示了治療波形中的多個可調節參數;
圖10展示了根據本文技術另一方面所計算的保留的基本能量(fundamentalenergyretained,fer)曲線;
圖11展示了根據本文技術另一方面所計算的、圍繞hifu換能器焦域的組織中的hifu信號估算衰減值與所施加功率變化之間的關系曲線;
圖12展示了根據本文技術另一方面所計算的一組曲線,分別表示投送至焦域的總功率、保留在hifu治療信號基頻的功率、以及轉換為諧振的功率;
圖13為對應于本文技術一個實施例的、用于計算有多少治療信號基頻能量轉換為基頻諧振能量的方法的流程圖;
圖14為用于估算hifu發射器焦域的hifu信號的衰減與輸入功率變化之間關系的方法的流程圖。
具體實施方式
如上所述,本文的技術涉及一種用于治療內部人體組織、例如子宮肌瘤、良性或惡性腫瘤或類似物的方法。盡管以下說明針對的是本技術在治療子宮肌瘤中的應用,然而本領域技術人員應當理解,該技術可用于治療任意內部人體組織區域。在一個實施例中,通過在組織上生成一個或多個基本治療區的模式來治療理想治療區。盡管本文的技術描述了這些基本治療區的可能具有的幾種集合形狀,然而每一類基本區都具有共同特征:所述基本區由燒蝕組織區構成,所述燒蝕組織區比hifu焦域區要大,這是由于焦域以預定方式圍繞或沿著基本區作受控運動。本文所稱的聲焦域通常定義為從聲波形的空間最大值處測得的聲波形的-6db等壓線所包圍的區域。本領域技術人員將理解,該-6db等壓線的大小也稱為半高寬(full-widthhalf-maximum),或fwhm尺寸。本文的實施例中應用的一個典型焦域為卵形,其fwhm尺寸為:沿著波束軸具有約10mm的長度,垂直于波束軸具有約2mm的寬度。
對應于本文技術的一個實施例,要治療的理想組織區暴露于以殼狀模式燒蝕組織的能量中,所述能量完全或部分地圍繞組織區,但僅直接燒蝕外部邊界。由所述殼體包圍的組織仍留在體內,因非直接燒蝕的效應而在原處壞死。引起原處壞死的這些其它效應可包括以下組合:
1.缺血性壞死,由部分或全部將所封裝區域與其供血隔斷引起;
2.直接熱壞死,由生成燒蝕殼體過程中向內的熱傳導引起;和/或
3.由正常愈合過程引起的繼發性損傷引起(發炎、細胞凋亡等)。
位于治療區的燒蝕殼體內的壞死組織隨后經正常人體機制而再吸收和/或愈合。
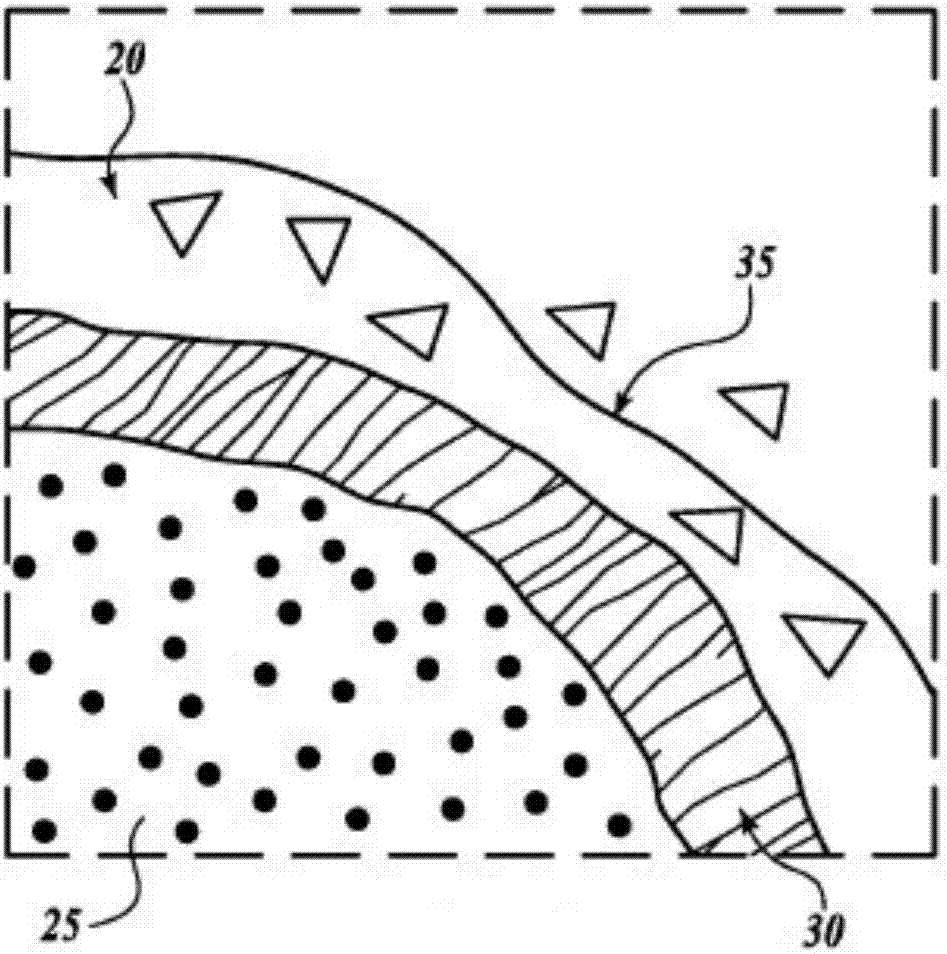
圖1a展示了要治療的組織區,例如子宮肌瘤20。子宮肌瘤可具有不規則形狀,但常為球形或橢圓形。肌瘤20包括一個或多個向肌瘤20供血的血管22。為治療肌瘤20,在肌瘤20邊緣內部以一種將殼體內肌瘤組織與向其供血的血管22相隔斷、并將血液從肌瘤20中移出的方式形成了立體的燒蝕殼體30。通過用燒蝕殼體30切斷內部組織的供血,可將該內部組織留在體內以形成缺血性壞死,并最終經正常人體愈合機制在數天/數周后吸收或愈合。
在一個實施例中,通過將殼體內的組織在hifu能量中暴露足夠長的時間或暴露在具有足夠大功率的hifu能量中、以導致組織直接壞死來生成燒蝕殼體30。應當理解的是,說明書通篇中的“所施加的hifu功率和能量”這些概念用于大致描述發射至組織的hifu信號的振幅或“強度”。按照這種含義,術語“hifu功率”和“hifu能量”基本上可互換使用,除那些上下文有特定含意的場合之外。這與繼發性缺血壞死相區別,繼發性缺血壞死發生在殼體內的組織中,是由于該殼體內組織被切斷供血或因以上所列的其它效應而導致的。由于被燒蝕以生成殼體的組織區比要治療的整個組織區要小,因此,治療組合體積的組織(即,殼體加上封裝區)所需的時間縮短至小于直接燒蝕整個區域所需的時間。在此使用的術語“燒蝕”指的是因組織暴露于能量中而導致的直接熱和/或機械效應所引起的組織直接性壞死。在此使用的術語“殼體”指的是經燒蝕的表面,其減少或消除了沿該表面的血液流。該表面的幾何形狀可以是完全封裝某區域(例如,球面)或非閉合式、以僅部分地封裝該區域(例如,凹盤)。術語“封裝”指的是這種表面的生成。
圖1a展示了完全嵌入在肌瘤20區內的殼體30。當然,該殼體的尺寸可變化,以使其內部的非燒蝕區域封裝整個肌瘤20。替代性地,肌瘤20可具有在其中生成的多個殼體。
在另一實施例中,生成了一個或多個部分式殼體,這些部分式殼體不會徹底封裝組織單位,但減少或消除了從這些部分式殼體內部流出的或流入部分式殼體內部的、經過部分式殼體的血液流。這將使至少部分組織區壞死。
圖1b展示了肌瘤20內部和圍繞肌瘤20的殼體30的近距離視圖。如上所述,肌瘤20包括位于燒蝕殼體30內的內部區域25,該內部區域25將借助被切斷了外部供血的組織(一部分歸因于與愈合、例如發炎和細胞凋亡等相關的其它繼發性損傷機制)而缺血性壞死。形成燒蝕殼體30的組織通過暴露于hifu波束焦域的熱和/或機械效應而直接壞死。燒蝕殼體30外部的一些肌瘤組織35也可通過熱壞死(由于來自燒蝕殼體30的熱傳導)和/或繼發性損傷機制(缺血、發炎、細胞凋亡等)而部分或全部被破壞。
圖2展示了超聲成像換能器和其它超聲成像部件所產生的肌瘤20的平面圖像。如以下將詳述的,在一個實施例中,成像換能器和hifu換能器組合為一個單元。在一個實施例中,超聲成像換能器、超聲圖像處理器和顯示器(未圖示)用于產生提供給醫生的肌瘤20圖像。所述顯示可包括位于肌瘤20圖像上的十字線或其它標記38,其中標示出了相對于hifu換能器焦域的參照點,這樣,用戶能將hifu換能器對準在組織區。醫生可與所顯示的圖像進行互動,例如通過調節環繞十字線38并以其為圓心的圓形標記環40的半徑,以標示理想治療區的邊界或要生成的燒蝕殼體的邊界(二者可能是相同的)。處理系統,例如通用或專用計算機(未圖示),根據標記環40的尺寸所界定的邊界來計算要封裝肌瘤20應當生成的燒蝕殼體的尺寸。
在一些實施例中,可調節標記環40以形成除圓形外的其它形狀,例如橢圓形或圓錐形等,通過例如拉伸標記環40的側部以使醫生能夠界定立體燒蝕殼體的形狀。在一個實施例中,標記環40的尺寸由醫生手動調節。在另一實施例中,可基于要治療組織的邊界用圖像處理技術自動定出標記環的尺寸。需要時醫生可進一步調節所述邊界。在一些實施例中,可在組織的立體圖像上調節邊界。在一些實施例中,圖像處理算法可自動檢測要治療的結構的邊緣(例如,邊界檢測)。在這種情形下,醫生可通過將一個或多個點(十字線)置于結構內來定位該結構。接下來,圖像處理算法將通過以下方式尋找結構的邊界:(i)識別超聲圖像中對比度(例如光斑亮度)的局部變化;(ii)識別鏡面背向散射區域與來自斑靶的背向散射區域。本領域技術人員應當理解,其它技術也可用于識別邊界。一旦或手動或半自動或自動地識別了邊界,則可使用自動治療計劃算法來確定要產出充分燒蝕的殼體所需的基本治療區的數量和位置。醫生可在投送hifu之前先在超聲圖像上初步排出治療次序,并作出任意所需的調整。一旦確定了要生成的殼體的尺寸和/或次序,則具有hifu治療系統的計算機便開始控制hifu換能器焦域的位置,以燒蝕組織,生成殼體。
在另一實施例中,目標區可能大于可用的超聲圖像。另一種可能遭遇的情形是,在治療波束的移動范圍內無法對整個目標都進行治療。對于第一種情形,可通過手動移動治療儀將多個超聲平面圖像或立體區域拼接在一起,以完全程度顯示目標。可存儲該圖像數據以備將來參考。接下來,算法可基于拼接圖像而自動計劃治療過程,并建議治療應當從何處開始。醫生也可從拼接圖像數據來計劃治療過程。在計劃好治療過程后,醫生可將換能器移至一處區域,治療用換能器在該區域能生成位于目標內的初始基本治療區。可使用空間圖像相關技術來輔助醫生將治療儀關于目標進行定位。在這種情形下,將當前的超聲圖像與已在預治療調查中獲取的圖像相比較并存儲。也可使用設備位置傳感器(例如磁性傳感器)來輔助定位治療儀。所述設備位置傳感器也可與圖像相關技術相結合以獲得更好的精確度。在設備盡其所能生成了當前治療儀位置下的基本治療區后,可手動移動治療儀,以使用圖像相關技術和/或位置傳感器來輔助醫生針對下一治療部位定位治療儀。通過繼續進行這一過程,目標的全部范圍都得以治療。另外,手動移動治療儀以獲取圖像、從而顯示整個目標,這不是必須的。可在治療儀的一個位置上獲取要顯示整個目標所需的數據集;然而,由于治療儀內的治療設備的移動限制,因此,治療儀將需要如前所述那樣移動。
圖3a和3b展示了用于建構整個理想治療區的圓柱形基本治療區80的一個示范性設置。該基本治療區80是通過使hifu波束83的焦域81圍繞基本治療區周界聚集而生成的。所述焦域81可沿基本治療區的周界持續移動一段時間或更久,同時hifu發射器持續發射hifu脈沖,直到基本治療區80的周界得到充分燒蝕。替代性地,所述焦域81可移動至圍繞周界的離散位置,而hifu波束83的脈沖發射反復導通和關斷,以充分燒蝕圍繞基本治療區周界的不同位置。
如圖3b所示,基本治療區80具有中心區域79,其不直接暴露于或僅最低程度地暴露于hifu波束83的焦域81中。該中心區域79因燒蝕基本治療區周界時所產生的熱傳導而非直接式壞死。在一個特定優選實施例中,基本治療區80的直徑約為11mm,高度約為10mm,因此體積約為1cc。在該特定優選實施例中,基本治療區的體積約是焦域區的40倍。燒蝕基本治療區周界的帶來的熱量向內傳導,如箭頭67所示,以治療中心區域79。在基本治療區的外部,熱量向外散出,如箭頭69所示。
盡管圖3a和3b所示的基本治療區80為圓柱形,然而應當理解,還可生成其它形狀的基本治療區,例如球形或立方體形等,具體取決于hifu波束83的轉向性能。
圖3c展現了所施加的hifu功率等級對hifu治療體系的治療范圍及安全裕度的影響。對于那些不結合本文技術的效果的傳統技術而言,使治療體系又有效又安全的聲功率等級的范圍相對較窄,如范圍“a”所示。即,hifu功率發生小的變化,導致功率跌出該窄范圍“a”,從而使該療法失效或可能不安全。盡管如此,通過使用包括以下中一個或多個效應的組合效應集來治療目標組織,據信可增大安全有效的hifu功率等級的范圍,如范圍“b”所述,這樣,治療方法對所投送的hifu功率變化不敏感,所述效應包括:(1)焦域掃描(focalscanning)以產生基本治療區;(2)基本治療區中向內的熱傳導;以及(3)施加適度低基頻的高度非線性聲能所引起的空間特異性。以下將詳細描述這些協同作用以提高hifu治療效率和旁側組織安全性的效應。
基本治療區的尺寸可以隨多個因素的變化而變化,所述因素包括要施加治療能量的設備的幾何形狀。在圖3d所示實施例中,展示了基本治療區80的俯視圖和側視圖。該基本治療區大致為圓柱形,其寬度w和長度l都近似等于hifu換能器焦域的長度。隨著焦域圍繞基本治療區周界以速度v移動,基本治療區的整個橫截面80a或因直接暴露于hifu波束中、或因被治療周界向內的熱傳導引起的非直接式熱壞死而得到治療。
圖3e展示了直徑約為焦域直徑兩倍的一個較小的基本治療區85的俯視圖和側視圖。在這個實施例中,由于在生成基本治療區時焦域圍繞基本治療區的周界進行移動,因此,該基本治療區也具有良好界定的邊界。所述基本治療區具有橫截面85c,該橫截面85c在穿過基本治療區內部的所有路徑上都得到了基本均勻的治療。這種基本治療區85的缺點在于,其與圖3d所示的基本治療區相比更小,因此要治療理想組織單位所需的基本治療區會更多。
圖3f展示了另一基本治療區89的俯視圖和側視圖,該基本治療區89的直徑明顯大于hifu換能器焦域的直徑。在該例中,基本治療區內部的協作性加熱不會發生,且僅有基本治療區的周界89c進行了燒蝕。因此,基本治療區的內部可能不像所述的燒蝕環內的敞開式中心那樣進行治療。盡管基本治療區89這種幾何形狀對于生成用于治療組織區的“積木”而言不是優選的,然而如以下將詳述的,在生成圍繞組織治療部位的燒蝕殼體時,這種幾何形狀可能是有用的。在另一實施例中,“積木”(基本治療區)可由線性片段形成,所述線性片段通過沿片段長度多次掃過波束而生成。
圖3g展示了一種方案,治療能量的全部劑量以使hifu焦域沿著或圍繞基本區單次掃過的方式施加在組織上,這樣,焦域僅掃過每個特定點一次,絕不會再掃過。這類單次掃過的焦域運動能使能量迅速沉積,并導致過度加熱,而這可使組織中形成大型焦域氣泡或焦域前氣泡,所述氣泡反射治療能量并遮蔽了治療區的遠端區域。因此,氣泡的存在可阻止沿著或圍繞基本區所有深度處的均勻的燒蝕。于是生成了不均勻的或“不規則的”治療模式91a,該治療模式91a在傷口遠端側的不同點處具有程度各異的治療組織。相反,通過使用將焦域多次聚集在每一特定點的多掃描方式使治療能量劑量沿著或圍繞基本區分散于一串掃描中,可避免大氣泡的偽形成,并生成更均勻一致的治療模式91b,如圖3h所示。在每一次掃描時,一部分基本治療區被燒蝕,且基本治療區在傷口的所有點上一致開始逐漸“累積”。多掃描技術用于如下所述的基本治療區的生成中。
圖3i展示了一種用于生成弧形或片段類幾何形狀的基本治療區另一實施例的技術。該基本治療區可用于生成具有均勻治療深度的多個環或其它形狀,且可用在一種形成圍繞理想治療區的殼體的方法中。在該實施例中,hifu換能器的焦域在周界一部分(例如,一段弧)的上方來回移動。由于在治療中hifu焦域的來回移動將聲能分布在更寬泛的區域上方,防止形成那些能反射能量并導致非均勻或“不規則”治療模式的大型焦域氣泡或焦域前氣泡,因此,得到的是深度一致的組織燒蝕。因此,可依次成多個治療圓弧,以使理想治療區的治療周界變得完整。
在圖3a到3b和3d到3i所示的每個例子中,基本治療區具有與hifu換能器焦域的長度近似相等的高度或長度。在一些實施例中,可通過在施加治療能量時改變焦域深度以增大基本治療區的高度。
以下所述的一個實施例中,在生成基本治療區時,用機械擺動器以能將熱量極大地限制在治療區中央79內的速度使hifu波束83的焦域81在圓柱形基本治療區80的周界上移動。hifu信號的焦域圍繞基本治療區的周界以一種使治療區內部被向內的熱傳導燒蝕、但沉積在治療區外部邊界之外的能量保持低于導致熱損傷或機械損傷所需閾值水平的方式聚集。替代性地,可通過電動波束轉向使hifu波束83的焦域81圍繞基本治療區的周界轉動;在一個實施例中,可通過使能量沉積在圍繞周界的一組離散點上的方式而非焦域持續掃描來進行電動波束轉向操作。
為生成本文所述的基本治療區,對基本治療區的周界施加hifu能量的近似非線性脈沖波形,例如圖8b所示的波形230。該基本單位區技術的優選實施例取決于本質為近似非線性的hifu治療波形,即,入射波形的初始正弦特征被嚴重扭曲,當其到達hifu焦域時,本質上已經不具有正弦特征。焦域聲波形中存在的非線性特征表示能量從基礎聲頻率轉換為更高頻率的諧振,而諧振易于被位于焦域內以及直接鄰接焦域的組織所吸收。這一效應使加熱速度急劇增大,同時仍牢牢地保持在焦域內加熱,帶來的是治療效果的提高,同時保障了旁側組織的安全。該優選實施例中最佳的焦域波形非線性程度是能夠最低限度地確保焦域壓力波形中發生振動的那種非線性程度。
振動開始指的是,沿著焦域波形的一些點上具有局部壓力不連續性(即,壓力波形的斜率為無限值)。在接受治療的組織區內的一些情形下,本優選實施例中的焦域非線性程度也可更高,其延伸超出初始振動開始點,以將hifu焦點處組織內充分發展的激波陣面的形成包括在內。在一個實施例中,基礎的相當一部分能量(例如,20%或更多)轉換為治療信號基頻的諧振的能量。焦域hifu波形的非線性水平通常伴隨著壓力振幅,而壓力振幅可導致或來自聲源或來自熱源的氣泡的形成(例如,慣性空化、穩壓空化或組織沸騰)。只要用多次掃過焦域輻照方式以穿過或沿著單位區邊緣的分散方式來施加hifu能量,則來自這些源中任意一個源的氣泡在組織中的存在將不會消極影響基本治療區技術的效果和安全性。事實上,存在這種氣泡極其利于實現各種反饋技術(如果需要),這是因為分布有氣泡的橫截面可比橫截面本身的幾何尺寸大得多,因此可在治療開始和進行中用作易檢測到的指示器。
在一個特定實施例中,用于獲取hifu焦域的理想非線性水平的最優選聲功率峰值范圍為600到3100w,具體取決于特定基本組織區相對于人體表面的深度、hifu換能器的設計以及其功率處理能力。這些聲功率以脈沖形式投送至基本區,其中最優選的脈沖由1mhz常規操作頻率時的15到45個循環構成,并以2到8khz的脈沖重復頻率(pulserepetitionfrequencies,prfs)投送。這些脈沖隨后以一串持續突發脈沖進行投送,突發脈沖的總數決定了總治療時間。圖9展示了hifu治療信號的聲時間結構。每個治療信號由hifu信號的p個突發脈沖構成,其中每個突發脈沖具有在hifu換能器基頻(f0)上的k個循環的n個脈沖。hifu脈沖的這些突發脈沖隨后以m個脈沖的突發脈沖重復周期進行重復。下表展示了在使用具有125mm直徑的球形殼體和焦距與光圈直徑比值(f-number,也稱光圈值、f值或焦距比數)為1的hifu換能器治療組織時使所用的聲時間和聲功率參數的優選范圍。應當理解的是,所列參數可隨要治療的組織的深度以及要使用的hifu換能器的規格變化而改變。
表1:所選的聲時間參數的優選操作范圍
表2:作為組織深度的函數的聲功率的優選操作范圍
(換能器:125mm球形殼體,焦距與直徑的比值(f-number)=1.0)
hifu發射器施加這些規格的能量,同時通過機械擺動hifu焦域而生成圓柱形基本治療區,一個實施例中hifu焦域的fwhm尺寸為長約10mm、寬約2mm,以常規2hz速度圍繞最優選直徑為8到12mm的軌跡擺動。在該例中,hifu焦點旋轉所圍繞的直徑約等于hifu焦域的長度,且比hifu焦域的寬度大5倍。在最優選的實施例中,機械擺動和hifu治療以這種方式持續對每個基本區進行10到50秒總治療時長的治療。每單位區的治療時長取決于特定基本區生成所在的組織的深度,以及整個理想治療區。例如,由于許多相鄰單位區之間的協同加熱的優點,大型的總治療區通常每單位區所需的治療時間較短。類似地,預先治療的、較深層相鄰的淺層中生成的單位區通常需要較少的燒蝕時間,這是由于較深層在接受治療時對淺層進行了溫和的“預加熱”。因此,可通過由這些基本治療區中的一些治療區構成的連續“堆疊”層來獲得任意大型治療區,其中相鄰層之間最優選的軸向分離距離為8到12mm。下表總結了配合上述聲波形和功率使用的焦點移動參數的優選范圍。
表3:優選操作范圍
盡管該優選實施例使用的是在焦域為非線性的脈沖波形,然而應當理解,也可使用如圖8a所示的波形232這樣的連續波(continuous-wave,cw)或線性hifu信號,具體取決于所用的功率等級和焦域移動的速度。
盡管前述例子描述了圍繞基本區周界的2hz的機械旋轉速度,然而,更低或更高的速度都可用來燒蝕這些類型的基本區。然而,如果速度太低,則基本區內部所含的要燒蝕基本治療區周界的熱量可能不夠多,且可能對旁側組織產生副作用。而高旋轉速度可能需要使用前述的電動波束而不是機械旋轉,且也可能對必要的hifu治療功率產生影響。如果是電動轉向,則在一個實施例中,波束可能會聚焦在圍繞周界的一組離散點上,而不是連續掃描。如上表所示,在一個實施例中,hifu焦點圍繞單位區直徑的機械旋轉速度為至少0.25hz。在另一更優選的實施例中,這一旋轉速度為至少1hz,而在最優選實施例中該速度為2hz。無論旋轉速度多大,優選的是以允許整個基本治療區受到一致燒蝕的速度和功率等級,使用多次掃過方式圍繞周界在多次掃過(例如,兩次或更多次)中施加將能量,以使燒蝕基本區具有對稱的幾何形狀。
否則,在使焦域相對緩慢地掃過以實現燒蝕、而不再重新掃過某個特定點的單次掃過方式中,產生的過多熱量可導致形成大的焦域或焦域前氣泡,這些氣泡可導致遮蔽和扭曲,阻止產生均勻燒蝕的組織單位,如圖3g到3h所示以及前文所述。另外,應當注意到,盡管在使用單次掃過方式時,大的焦域或焦域前氣泡的存在減損了治療的均一性,但是,只要以多次掃過方式使hifu的焦點沿著或圍繞單位區掃過,以暫時分散聚集在所述區中任意一點上的治療能量,則來自于聲源或熱源的氣泡在組織中的存在便不會消極影響治療的功效。
應當理解,對基本治療區的尺寸進行優選,以使中央區域79接受非直接治療,同時不過多增加治療理想組織區所需的治療時間。如果基本治療區的尺寸過大,則中央區域79將不能通過向所述區內部有效的熱傳導而進行燒蝕。相反地,如果基本治療區的尺寸過小,則必須調節要治療理想組織區所需的時間,以避免對治療區過量施加能量、從而可能引起旁側組織的損傷。另外,隨著焦域向人體表面接近移動,要生成每個基本治療區的時間可能會縮短,這是由于來自對更遠端的基本區進行燒蝕而殘留在治療區中的剩余熱量。
在當前的優選實施例中,生成基本治療區的方法采用了hifu療法的多種特點,這些特點來自于高度非線性聲波形與hifu焦點圍繞單位區周界的機械或電動運動的協同效應。這些組合效應包括一組操作要點,這些操作要點使該治療方法在使用時所觀察到的安全性和功效提高了。這組操作要點包括以下組合:(1)基本治療區以其內部區域主要通過向內的熱傳導被破壞、而非由hifu直接燒蝕的方式來進行燒蝕。這一特點使基本區的尺寸增大,但不會增加要投送至組織以進行燒蝕的hifu劑量。(2)hifu焦域圍繞基本治療區周界的移動是通過以特定旋轉速度圍繞周界多次掃過而實現的,其與圍繞單位區的圓周進行單次掃過以實現燒蝕的方式相反。
這一特征使基本治療內的組織被燒蝕并具有一致而平滑的邊界,且在圍繞周界的大致全部點處具有相同的長度。(3)通過使用急劇增大焦域中的加熱速度的高度非線性的聲波形,基本治療區僅在hifu波束的焦點區域接受高聚聲能量。(4)hifu治療儀的聲基頻保持為足夠低,以確保經過非目標旁側組織進行安全傳播。由于系統具有不受組織特征變化或焦域中存在的氣泡的影響而生成大致均一的基本治療區的能力,因此,治療系統可不依賴于溫度反饋監控而操作,以實現更快治療并降低系統復雜性和成本。這些優點的結合確保療法具有足夠功效,避免了確定治療區內的溫度、以驗證已實現了熱壞死所需的溫度等級的需要。
另外,上述特征集組合利用了對每一單位區進行燒蝕以形成精確邊界、同時對治療區外部的旁側組織產生最低程度的熱侵入的協同效應。通過從基本治療區的“積木”積聚全部治療區,可使用每個單位區能承受的同一固有空間精確度和熱限制來燒蝕任意尺寸的治療區。圖3j和3k展示了一種使用基本治療區80來治療理想組織區的技術。在該實施例中,生成了相鄰基本治療區的立體模式,這些基本治療區一起形成了圍繞全部或部分理想組織治療區的燒蝕殼體。在圖3j和3k所示的實施例中,燒蝕殼體87由多個較小的燒蝕基本治療區80、82、84、86和88等形成。每個基本治療區都足夠靠近地生成,以形成位于封裝組織與其供血之間的壞死殼體或燒蝕組織屏障。
如圖所示,基本治療區80、82、84、86和88以彼此相鄰的環狀模式生成,該環狀模式具有從理想組織治療區遠端向組織區大致中間延伸的漸增的內部直徑,其中治療區的直徑最大。所述環狀模式的直徑隨后朝著要治療的組織區的近端逐漸減小。環形模式一起形成了具有“中空的”內部空間90的殼體,該殼體將要治療的理想組織區的一部分封裝起來。隨著基本治療區被彼此足夠靠近地設置,向肌瘤或要治療的其它組織的供血被切斷,或極大地減少了,以使該組織留在人體中缺血性壞死。另外,殼體中央內的一些或全部組織可能由于生成殼體時的熱傳導而壞死。由于未燒蝕整個治療區,因此,人體內產生可能會損傷非目標組織的過度熱量的可能性降低了,且治療時間與要直接燒蝕整個組織所需的時間相比顯著縮短了。在使用本文的技術的一項實驗中,活體豬大腿內的直徑為5cm的治療區通過在約320秒內形成圍繞球體表面的20個基本治療區殼體來進行治療,其中每個基本治療區的體積約為1立方厘米。在一個實施例中,殼體每一層中的單個基本治療區以一種使相鄰基本治療區不依次生成的模式來生成。即,殼體每一層的基本治療區的模式以一種使兩個依次生成的基本治療區之間具有最大距離的方式來生成。
盡管圖3j和3k所示的殼體87為空心的,然而應當理解,在一些情況下,理想的是在殼體內部生成一個或多個基本治療區,以主動使殼體87內一些或部分組織壞死。基本治療區的數量和間隔可由醫生根據經驗、治療可用時間、接受治療的組織的類型或其它因素來決定。替代性地,可向處理器中輸入程序以確定殼體內部是應當為空還是應當由一個或多個基本治療區來填充。
圖3j展示的殼體87圍繞其外表面大致是密封的。然而應當理解,即使各個基本治療區之間存在有間隙,仍可生成殼體87。將基本治療區設置得有多靠近以生成殼體,這取決于接受治療的組織的類型、組織的導熱率、吸收特性或其它因素。
應當理解,除基本治療區殼體外,其它模式也可用于治療理想組織區。例如,在理想組織區內也可生成水平分布的相鄰基本治療區的層。一層中的基本治療區之間的距離可以是靠近分布或隔開分布。
圖4a到4b展示了根據本文技術用于生成圍繞組織區的殼體92的替代性技術。在該實施例中,燒蝕殼體包括一串堆疊的環狀體,每個環狀體具有不同的內徑。內徑最小的環狀體94(或立方盤)置于要治療的組織相對于hifu換能器的遠端。附加的環狀體在靠近遠端環狀體94處生成,包括直徑漸增的環狀體95、96、98,直至環狀體100,該環狀體100具有最大內徑。隨著hifu焦域更加靠近地移動,這些環狀體102、104和106的內徑逐漸變小,最后由位于治療區最近端位置的內徑最小的環狀體108(或立方盤)閉合殼體9。從圖4b中可見,每個環狀體94到108的內部在堆疊時都形成了“中空”(即,未燒蝕)區域110,該區域110封裝要治療的組織區,并將該組織區與其血液供應相隔斷。在一個實施例中,環狀體94到108的外徑選擇為對應于肌瘤的外徑,以使hifu直接燒蝕的組織區最小化。在另一實施例中,環狀體92到106的外徑選擇為位于一組距離內,該組距離在肌瘤外部邊界之內,以使燒蝕殼體92外部的肌瘤組織通過熱壞死(由于來自燒蝕殼體92的熱傳導)和/或繼發性損傷通路機制(缺血、發炎、細胞凋亡等)部分或全部毀壞。在另一實施例中,環狀體94到108的內徑對應于組織區的外徑,使所生成的燒蝕殼體92的內部110稍大于組織區,從而更徹底地殺死腫瘤組織,但代價是殺掉了周圍少量的健康子宮肌層。這種實施例的另一優點是,具有生成殼體92、以使其與子宮內膜重疊的能力,從而使至少一些附近的子宮內膜壞死,減輕月經過多癥狀。
圖4c展示了燒蝕模式的另一實施例,其生成燒蝕殼體以封裝組織區,并將該組織區的外部供血隔斷。在圖示實施例中,以螺旋模式120生成了燒蝕殼體。該螺旋體在接受治療的組織區的遠端122處具有最小的直徑,該直徑增大至組織區約中點處的最大直徑,隨后朝著組織區的近端124逐漸減小。螺旋模式120的每個環都足夠接近其相鄰的環,以主動使組織壞死,從而生成圍繞組織區的燒蝕殼體,該燒蝕殼體切斷了殼體內組織的供血。應當理解,螺旋模式120還可用于生成上述及圖3a和3b所示的較小的基本治療區,具體取決于hifu換能器焦域的尺寸和基本治療區的理想尺寸。
圖4d展示了有三種不同類型肌瘤的子宮,包括壁內肌瘤130、漿膜下肌瘤132和黏膜下肌瘤134。在所示例子中,生成燒蝕殼體135以封裝位于子宮壁一側的整個黏膜下肌瘤134,以及位于子宮壁另一側的一部分附近的子宮內膜組織136。通過生成燒蝕殼體135以封裝肌瘤134以及一部分相鄰的子宮內膜136,月經過多癥狀可有所減輕。
盡管圖3j到3k、4a到4b和4c中所示的燒蝕殼體的形狀大致為球形,然而應當理解,燒蝕殼體還可以具有其它形狀,例如錐形或雙錐形、卵形(例如蛋形)或矩形。所生成的殼體的特定形狀可取決于要治療的組織區的形狀,以及用來以理想模式移動hifu換能器焦域的設備的性能。形成殼體內部組織與該組織的外部供血之間的屏障的任何形狀的燒蝕組織殼體都將發揮作用,使被封裝組織留在體內后缺血性壞死。還應當理解,作為用于燒蝕過大或非規則形狀殼體的一種替代性方式,可燒蝕彼此相鄰的兩個或更多規則形狀的殼體,以治療絕大部分或整個理想區(例如,在長形腫瘤內可并排燒蝕兩個球形殼體,而非燒蝕一個長形殼體)。如果組織區內生成了多個殼體,則可形成燒蝕基本組織區的矩陣(或“蜂窩”),其中存在有未燒蝕組織的分散區域,這些未燒蝕組織隨后在原處缺血性壞死。,這種矩陣可能涉及要實現同樣效果的燒蝕基本治療區的規則或隨機間隔,且該矩陣可由多個封閉殼體(例如,球形殼體)或堆疊/重疊的基本治療區的層構成。
本領域技術人員應當理解,殼體燒蝕方式還具有其它優點:(1)提高治療速度,這是因為僅對最終治療的組織的子區施加能量;(2)對于給定治療時間,治療尺寸更大;(3)與直接燒蝕包括治療區內部的整個治療區相比,所需能量更少。使hifu系統自動燒蝕對稱的(例如,球形的)殼體,將降低成像、瞄準和探測操作方面對用戶的要求。如果殼體是對稱的,則用戶可容易地想象其關于由例如超聲成像儀、mri、x光等成像機構所顯示的腫瘤邊界的投影關系。用戶僅需操縱hifu系統,將投影殼體的輪廓定位在目標組織的圖像內,將殼體直徑擴大至理想尺寸(例如,恰好位于腫瘤邊緣的內部),并在系統自動燒蝕特定的殼體模式時使系統相對于目標組織保持相對靜止。
圖5展示了可用于以上述方式治療組織的hifu治療裝置的一個實施例。該hifu治療裝置150為手持或手動引導治療儀,其包括成像換能器152和hifu換能器154。所述成像換能器152為固定的,用于捕獲包括hifu換能器154焦域在內的體內組織圖像。如以下將詳述的,hifu換能器154的焦域可以機械式和/或電動式轉向,以燒蝕相鄰分布的多個基本治療區,從而生成圍繞或封裝理想組織區的殼體或生成另一模式。將治療裝置150固定在從成像換能器152獲取信號所產生的圖像中確定的理想位置上,同時使hifu換能器154的焦域以一種燒蝕基本治療區、從而生成圍繞治療區的殼體或生成基本治療區另一模式的方式移動。
治療裝置150可連接至治療系統的其它部件,包括要操作成像換能器152并產生組織區圖像所需的成像處理器和顯示器。還包括驅動hifu換能器所需的信號源,以及以某種模式來定位hifu換能器的焦域、以生成理想模式的基本治療區的計算機,所述理想模式例如圍繞組織區的殼體。
圖6展示了用hifu信號治療內部人體組織的更詳細的機構的一個實施例,該機構用于在殼體或其它模式內生成一串基本治療區。治療裝置150包括hifu換能器154。在圖示示例中,hifu換能器154具有由包括換能器頭的壓電元件的曲率所界定的固定焦域。不明顯反射hifu信號的柔性膜設置在hifu換能器前方,以形成可引入、存儲和/或循環液體的室。例如水或除氣水(de-gassedwater)這樣的液體隨后填入該液體室,并包圍換能器154以用作組織的聲耦合劑。端口156將所述治療裝置連接至泵,以使恒定體積的液體圍繞hifu換能器流動。
為調節投送至患者的hifu信號焦域的深度,線性執行器160或電機通過螺桿或其它機構使hifu換能器154在治療裝置150的外殼內升高或降低。通過調節換能器154在殼體內的高度,可控制hifu信號在人體內的投送深度。
另外,治療裝置150包括偏移軸承170;當通過電機168旋轉時,該偏移軸承170擺動軸172的一個端部以圍繞偏移軸承170的中心旋轉。hifu換能器154通過可滑動軸承連接至軸172的另一端部。線性執行器164或電機將圍繞軸172的球形軸承174置于朝向或遠離偏移軸承170的位置上。球形軸承174在軸172上的位置控制著hifu換能器154的焦域的角度方位。
如圖6a和6b所示,通過轉動電機168的軸,以及通過調節球形軸承174沿軸172的長度的位置來改變hifu換能器焦域的角度方位,可在人體內各深度處生成由燒蝕圓柱體和/或球體構成的燒蝕組織的圓環或環形模式。
如果電機164和168以具有約90度相位差的信號在理想角度上同步來回旋轉,則hifu換能器的焦域將繪出偏離治療裝置150中心軸的近似圓形圖案,以在人體內的理想位置生成基本治療區,如圖6b所示。通過持續旋轉電機168,同時球形軸承174距離電機168最遠,基本治療區可生成在殼體的頂部和底部,具體取決于焦域深度。
在一個實施例中,為治療理想組織區,醫生使用成像換能器152獲取組織區圖像,并調節圖像上標記環的半徑,或使用其它一些圖形用戶界面或鍵盤界定理想殼體的邊界。基于標記環的半徑,計算機計算出要在人體內生成的燒蝕殼體的體積或形狀。治療裝置150內的hifu換能器和電機隨后被激活,以對某種模式的基本治療區進行燒蝕,從而形成圍繞或封裝該組織區或其它一些理想模式的基本治療區的殼體。當生成基本治療區時,hifu換能器的焦域可持續移動,直到治療區被燒蝕,或者,焦域可移至圍繞基本治療區周界的離散位置,并施加hifu信號以生成基本治療區。
在另一實施例中,同時操作調節焦域深度的線性執行器160、調節hifu換能器角度的線性執行器164和使軸172旋轉的電機168,以生成如圖4c所示類型的螺旋形殼體燒蝕模式。
在隨后的治療中,可對患者注入造影劑,以便醫生確定目標組織區內的血液灌注已適當減輕或消除了。“無灌注”充分表明所治療的組織區將經受(或已經受)缺血性壞死。這種造影劑是本領域中公知的,用于包括超聲波、mri、x光、ct等的各種成像形式。
應當理解,還可使用其它機構來選擇性地定位hifu換能器的焦域、以生成基本治療區并治療理想組織區。圖6c和6d展示了另一替代性實施例,其中換能器180通過一對線性執行器182和184在兩個正交方向上(x,y)移動。線性執行器可以是驅動渦輪或其它機構的電機,且線性執行器由計算機控制,以按理想方式移動hifu換能器180的焦域的位置。可通過計算機控制第三電機或執行器(未圖示),以改變換能器180的高度,從而改變焦域的深度。
圖7展示了對應于本文一個實施例的hifu超聲治療系統的基本框圖。在該實施例中,患者治療裝置同時包括hifu換能器154和超聲成像換能器152。這兩個換能器可以是如圖6所示的分離式設備,或可以是一體式設備,其中hifu和成像超聲元件位于同一換能器頭上。控制成像和hifu換能器的操作的是系統控制器200,該系統控制器200可包括一個或多個具有通用或專用程序的處理器,以執行上述功能。系統控制器200向hifu控制單元202提供控制信號,該hifu控制單元202選擇由hifu換能器154提供的hifu信號的功率。
在一個實施例中,操作功率等級是通過發射多個不同功率等級的測試信號并對所發射的測試信號生成的回聲信號進行解析而選擇的。當觀察到回聲信號的理想特征時,例如在回聲信號內檢測到不同基頻和諧振成分上的特定功率分布時,用于hifu治療的這一操作功率等級便被選擇。以下將詳細描述用于基于譜功率分布的預治療聲學評估而選擇操作功率等級的具體實施例。關于可能的選擇和控制hifu功率的方法的更多細節可在申請日為2009年8月6日的美國專利申請12/537,217(美國專利公開號2010/0036292)中找到,在此以引用的方式并入該申請。
成像換能器152通過成像超聲控制器204進行控制,該成像超聲控制器204包括傳統的超聲部件,例如發射/接收開關、波束形成器、射頻放大器和信號處理器。超聲控制器204的輸出反饋至超聲信號處理器210,以產生用于在視頻監控器212或其它顯示設備上顯示的超聲圖像信號。所述圖像信號可存儲在計算機可讀介質(dvd、錄像帶等)中、由打印機打出或以其它方式存儲,以便后續診斷或分析。
計算機控制轉向器205(或位置控制)由系統控制器200控制,以生成多個基本治療區來治療理想組織區。在一個實施例中,計算機控制轉向器205機械式調節hifu換能器154的角度方位或x,y位置以及焦域深度,以使hifu能量聚集在理想位置。在另一實施例中,計算機控制轉向器205電動調節hifu換能器154焦域的角度方位或x,y位置以及hifu換能器154焦域的深度,以生成基本治療區。
通過腳踏開關214,醫生或其助手能將hifu能量選擇性地投送至患者,以治療組織區。另外,醫生可使用控制面板216上的一個或更多控制鍵手動改變治療區的尺寸和形狀以及系統其它功能。
在一些實施例中,系統可包括圖像位置控制器220,其改變成像換能器152的方位,使醫生能夠以不同角度或在不同平面上查看要治療的理想目標組織區。圖像位置控制可以是機械式或電動式的,且可由系統控制器200進行控制。
圖7所示的系統無需使用溫度數據或其它反饋控制來對組織進行治療。由于不需要溫度數據或反饋控制,因此也不需要例如mri機器這樣的數據檢測系統。這使本文的系統能做到足夠小,以便在醫生辦公室中使用。
如上所述,如果在使治療信號在組織內為非線性的那些功率等級上投送hifu治療信號,則確定能同時獲得兩方面的顯著優勢:減少了生成創口所需時間,提高了創口的均一性。在上述一個實施例中,是基于在基頻的一個或多個諧振上檢測到的能量而選擇用于治療組織的功率等級的。另一種用于檢測相同效應的方式是,測量在所施加功率變化的情況下治療信號基頻的能量向基頻諧振的轉換,所測得的轉換結果用作一種選擇治療信號的功率等級的方法。
圖10展示了從焦域背向散射的、保留在hifu治療信號的基頻中的能量與投送至hifu換能器的電功率的變化之間的關系曲線300。該例中的曲線在約200w時達到常規最大值1.0,在該處所檢測到的背向散射信號中幾乎全部能量(100%)都包含在基頻中。然而,隨著所投送電功率的增大,能量從基頻轉換至基頻諧振,因而所保留的基頻能量(fundamentalenergyretained,fer)減少了。例如在圖10中,當施加功率為1500w時,約0.75的fer值表示75%的焦域信號保留在基頻,而其余25%已轉換為諧振頻率。如以下將詳述的,fer曲線300可用于選擇用于治療患者的hifu信號的發射功率。取決于組織差異水平,fer曲線可以是用于確定正確療法所需的唯一信息。
在一個實施例中,fer曲線300是這樣計算出的:對治療部位施加不同功率等級的多個測試信號,檢測接收到的背向散射信號,并確定背向散射信號中能量的頻率分布與像線性系統那樣對組織進行操作時將有的分布有何不同。例如,對于線性系統模型,如果電功率為500w的測試信號產生的是接收的背向散射信號中基頻的能量x,則1000w施加電功率將產生基頻能量2x。任何來自2x的變化都是從線性系統衍生而來的,因此這種變化與多少能量轉換為諧振頻率能量是相關的。
在fer曲線300中,區域302內的曲線上的那些點與信噪比(signaltonoise,s/n)相關,該信噪比可使數據變得不可靠。類似地,區域306內的曲線上的那些點是在組織可能空化的那些功率等級上產生的。由于組織因空化而改變狀態,因此,在該功率等級上接收的背向散射信號在確定有多少能量轉換為治療信號基頻諧振時可能是不可靠的。
為確定要治療組織單元而應當向患者施加的功率的量,有必要確定所施加的功率有多少實際投送至焦域。然而,在一些情形中,識別與所需fer值相關的功率等級便足以確定合適的施加功率。如果需要附加的信息,則可通過測量治療信號在hifu換能器與焦域之間的衰減而獲取實際投送至焦域的估計功率值。圖11展示了hifu換能器與hifu換能器焦域之間的估計衰減值與所施加的發射功率變化之間的關系曲線圖。在以下將詳述的一個實施例中,圖10所示的fer曲線300和圖11所述的曲線350用于選擇治療功率等級。
圖12展示了圍繞焦域的基頻所含能量與所施加電功率的變化的關系曲線360。曲線370描繪了基頻諧振所含能量隨圍繞焦域所施加的電功率改變的變化,曲線380描繪了施加至圍繞焦域的組織的總能量(即,基頻和諧振的功率)與所施加功率改變的關系圖。
在一個實施例中,曲線370用于選擇hifu信號的治療功率。例如,從動物試驗或其它來源獲取的經驗性數據可用來選擇應當在基頻諧振上投送至組織的理想功率。在活體豬大腿上進行的試驗中,發現焦域中功率為100到200w的諧振能量與在此所述的聲波形時間結構和運動軌跡參數一起使用時,產生均勻的壞死基本治療區,同時對旁側組織幾乎不造成損傷。曲線370用于確定要產生100到200w諧振能量,治療信號的輸入電功率應當多大。在圖示趨向中,1000到1700w之間的輸入功率將產生100到200w的諧振能量。因此,通過了解要治療的組織的fer和衰減曲線,以及要投送至組織的諧振能量的理想等級,可確定應當施加多少治療功率。
以下描述了幾種用于確定fer和衰減曲線的方法。圖13為信號處理流程圖,展示了用于計算對應于本文技術一個實施例的fer曲線的步驟。在步驟400,確定了hifu輸出所用的測量單位(通常是發射功率等級)。例如,發射功率等級可從數字化的發射信號的電流和電壓波形計算,或從發射信號的電流或電壓波形結合hifu換能器的阻抗計算。如果系統狀態是已知且穩定的,則在計算fer曲線時其初始狀態可再次使用。
在步驟410,來自以不同功率等級發射的多個測試信號的射頻背向散射信號被檢測并數字化,再存儲在內存或計算其它機可讀介質中。在步驟412,選擇要詢問的深度范圍,該范圍包括圍繞hufu換能器焦域的區域。在步驟414,對射頻背向散射信號進行了過濾,以確定發射信號基頻的能量。
在步驟416,確定要在基頻上獲取具有良好信噪比的背向散射信號所需的最小發射功率。可通過最近鄰關聯或通過確定在窗口中檢測到的功率與激勵功率改變在何處為線性相關來確定上述最小發射功率。在步驟418進行計算以確定組織中開始發生空化的發射功率等級。這種功率等級可使用例如模板方法、最近鄰關聯或噪聲層計算來確定。這些技術對超聲信號處理領域的普通技術人員而言都是已知的。
在步驟420,確定各種發射功率上滑動窗口中的基頻能量。所述窗口的尺寸通常由發射脈沖的屬性確定,可根據用戶輸入、從內存中調取或動態計算的方式進行選擇。確定窗口中基頻的能量,隨后窗口移至下一數據點集。得出的是組織中各種深度處的基頻能量與發射功率改變之間的表面曲線424。
在步驟426,確定深度范圍內每一深度的反向散射信號中的保留的基頻能量(fer)。在一個實施例中,將特定深度的反向散射信號中所含的基頻能量與像線性系統那樣對組織進行操作時的預期能量相對比。預期能量eexp可這樣確定:使在足以產生具有良好信噪比的信號的較低功率pl上檢測到的基頻能量e0,乘以待定發射功率ph除以除數pl所得的商。實際檢測到的基頻能量與預期能量eexp之間的差值用于產生局部fer值與深度和所施加功率之間的表面曲線428。
上述過程可在步驟430中重復進行,以針對圍繞焦域的不同詢問角度或位置。
在步驟432,為局部fer值獲取的結果針對每一詢問角度(如果有的話)進行復合(例如,通過求平均值)。將復合后的結果在多項式(可以是例如線性多項式的一階多項式)或其它數學定義的函數中進行擬合。在一個實施例中,fer曲線被歸一化為一條曲線,這樣fer曲線的全部值都小于具有使能量從基頻轉換為基頻諧振的深度和功率等級的值。
應當理解,還有用于產生fer曲線的其它技術。例如,步驟414的濾波可通過數字fir(finiteimpulseresponse,有限脈沖響應)濾波器進行,且可在步驟420進行fft(fastfouriertransform,快速傅里葉變換),以確定所接收到的背向散射信號中的基頻能量。類似地,可在基帶通過使背向散射信號乘以載波信號、并應用低通濾波器使剩余信號的振幅成為基頻所含能量的表征的方式進行信號處理。
為選擇對應于本實施例的治療功率,有必要了解組織表面所施加的功率有多少實際投送至焦域。為確定這一值,在計算機、例如系統控制器200中輸入程序,以估算從換能器到要治療的組織單元的組織路徑中的衰減。衰減值可從內存中調取,所述內存中存儲有基于先前實驗或已知類型組織的文獻研究的數值。然而,由于每個患者的生理狀況各不相同,也可基于組織對于一個或多個測試信號的響應而估算出衰減情況。
在圖14所示的實施例中,hifu信號在hifu換能器與目標治療部位之間的衰減是通過施加不同功率等級的多個測試信號來確定的。在步驟502,hifu換能器施加的實際能量或是通過先前確定的測量值來確定,或是通過施加至換能器的數字化電流和電壓波形來確定。替代性地,如果換能器的阻抗已知,則可使用電流或電壓波形來計算功率。
作為對以不同功率等級發射的多個測試信號的響應,在步驟504檢測到多個射頻背向散射信號。在一個實施例中,可使用具有寬帶寬的接收器(例如,成像換能器152)來檢測這種信號,該接收器能在例如發射信號的第二到第四個諧振上(如果可用,也可以是其它諧振)檢測信號。
在步驟512,選擇要測量的衰減的深度范圍。該深度范圍典型地包括換能器的焦域。在步驟514,選擇每一背向散射信號中包括所選深度范圍的窗口數據。在步驟516,系統控制器200或其它計算機進行fft或一些其它頻率分析,以確定背向散射信號第二到第四級或更高級諧振中存在有多少能量。隨后根據檢測系統的響應來校正諧振能量,所述響應例如由于前置放大器的滾降或檢測換能器的頻率響應而產生。在步驟520,確定射頻背向散射信號在諧振上具有良好信噪比的投送功率。該功率很可能會大于在基頻產生具有良好信噪比所需的功率。在步驟518,也以上述方式確定空化開始的能量等級。在步驟524,計算不同頻率下的能量與所施加的電功率的變化之間的表面曲線。在步驟526,計算每個諧振的能量與所施加的電功率的變化之間的關系。步驟510到526可在步驟528中重復,以針對不同的詢問點。在一個實施例中,圍繞理想治療部位的10個點上都進行了測量。
一旦確定了每個詢問點的諧振能量與所施加的電功率的變化之間的關系,則對結果進行復合,例如在步驟530求平均值。
在本發明的一個實施例中,作出這樣的假定:諧振是從hifu換能器焦域中的周邊區域發出的,且主要因所施加的hifu信號的非線性傳播而生成。因此,假定諧振頻率信號僅在從焦域返回至檢測換能器的單向路徑上衰減。一般地,組織中產生的諧振的信號幅度應當經歷滾降,這一點是已知的。例如,如果諧振的量已飽和,則滾降從1/n行為(其中n表示第n個諧振)后開始。該滾降應當根據fer值而校正,且可由fer值確定。由于檢測到的諧振能量已根據接收到的電子檢測換能器的頻率響應而校正,因此,一旦諧振等級根據當前滾降而校正,則諧振峰值之間的任何幅度差都可歸因為衰減。在步驟532,確定在每一特定輸入功率等級上每一諧振的能量等級,并將該值在多項式(或線性多項式)中擬合。多項式的斜率除以信號被測點處組織路徑的全部長度,得到hifu信號的衰減,該衰減的單位為db/mhz-cm。對于在獲取良好信噪比所需的最小功率與空化開始的功率等級之間的其它所施加輸入功率,也進行該計算。其結果是描繪衰減與所施加的輸入功率之間關系的衰減曲線。
在一些情形下,需要確定例如肌瘤自身的局部衰減值。如步驟544所示,hifu換能器可相對于組織而移動或改變其焦域,并以上述方式確定新的衰減曲線。因此,任意給定輸入功率的局部衰減等于每一深度上的衰減差值乘以其各自深度再除以深度差。
一旦組織的fer曲線和衰減曲線已知,則合適的治療輸入功率可這樣確定:使輸入功率乘以位于要獲取良好信噪比所需的最小功率等級與空化開始的功率等級之間的多個衰減曲線350。如圖12所示,利用衰減曲線350(圖11所示)來調整輸入功率的大小,得到圖12所示的曲線380。通過利用fer曲線300來調整曲線380的大小,從曲線380計算出曲線360。最后,諧振曲線370的功率可通過從曲線380中減去曲線360而計算出。從曲線370可確定如上所述的實現組織的理想諧振功率的必要適當輸入功率。
應當理解,用于治療組織的治療信號的功率也可預確定,并基于待定組織已測量的特性從存儲器中調取。如果組織的局部衰減是已知的,則可使用基于先前研究的fer曲線來預測應當施加多少能量,以獲得治療部位的理想諧振能量。替代性地,如果待定組織的fer曲線已確定,則可基于先前研究來選擇治療功率。依賴于預確定的經驗性治療定位點的另一可選方式是,測量有效地非衰減的組織路徑中任意部分(例如,膀胱內含的尿液)的高度,并從已知的經驗性確定的該組織深度功率值中減去適量的非衰減部分。例如,如果10cm的治療深度的組織路徑包含由膀胱中尿液構成的2cm片段,則可施加經驗性確定的、用于8cm治療深度的功率值作為適當的hifu輸出等級的第一階近似值。
盡管闡釋和描述的示意性實施例,然而應當清楚,在不脫離本發明范圍的前提下可作出各種改變。例如,盡管所公開的實施例中用于生成燒蝕殼體的能量源是hifu,但也可使用其它能量源,例如輻射、激光、射頻、微波、冷凍消融等。一些能量源具有最低程度的侵入性,因此其必須通過導管、內窺鏡或類似工具投送至組織區。施加來自這些能量源的能量,燒蝕組織區的周界,以生成燒蝕殼體。在另一實施例中,hifu換能器可經陰道或直腸插入人體。如果要治療的組織區從hifu換能器所在位置處是可見的,則可使用圖像傳感器而非超聲圖像傳感器來獲取組織的圖像。在一些實施例中,可使用另一類成像設備,例如mri、x光、紅外線或類似物,以一種使醫生能確定hifu正被投送至理想目標組織區的區域的方式來實現理想治療區的成像。因此,本發明的范圍是由權利要求及其等同例來確定的。
- 還沒有人留言評論。精彩留言會獲得點贊!