一種腫瘤靶向細胞藥物載體及其應用的制作方法
本發明屬于生物醫藥領域,具體涉及一種腫瘤靶向細胞藥物載體及其應用。
背景技術:
腫瘤是威脅人類健康的重大疾病,實現腫瘤的靶向治療,降低治療藥物對正常組織和器官的傷害對攻克腫瘤疾病這一重大難題具有重大意義。化療藥物,放療藥物,光動力學治療藥物已經被廣泛應用于腫瘤的治療,能夠在一定程度上抑制腫瘤的生長。但是,在腫瘤治療的過程中使用的藥物通常不具有選擇性,為實現腫瘤的有效抑制,需要加大治療藥物的用量。而腫瘤治療過程中的強毒副作用不僅極大的降低了腫瘤治療的效果,同時也降低了腫瘤患者的生活質量。因此,實現腫瘤治療藥物的靶向運輸,以達到對腫瘤的有效抑制,一直是生物醫學和生物材料領域的研究熱點。
腫瘤靶向藥物運輸一般可分為主動靶向和被動靶向。通過腫瘤細胞特異性表達的蛋白或者受體,利用抗體或者其他小分子靶向基團實現腫瘤細胞的運輸稱為主動靶向。利用腫瘤區域的“增強穿透和滯留”效應,納米藥物載體可以實現對腫瘤區域的富集成為被動靶向。但是,致密的腫瘤環境、腫瘤區域高滲透壓以及人體的免疫系統將極大的限制傳統靶向藥物載體對腫瘤的靶向運輸和穿透,從而使主動靶向和被動靶向都面臨著極大的應用難題。
近年來,利用循環細胞作為藥物載體,通過載體細胞對腫瘤環境的趨向性,避過免疫系統的清除,實現腫瘤的穿透,從而實現藥物對腫瘤的靶向運輸。傳統的細胞藥物載體是通過載體細胞對治療藥物的內吞和擴散實現藥物的包載和釋放的,極大的限制了這種細胞藥物載體的應用意義。首先,這種細胞藥物載體對細胞和藥物的要求較高,所以通常只能用單核細胞或者巨噬細胞作為細胞載體,同時只能局限于光熱治療和某些化療藥物的運輸;其次,藥物對載體細胞的毒性導致載體細胞不能實現長時間的體內循環;再次,由于內吞藥物處于復雜的細胞內環境,而載體細胞中諸如溶酶體和內涵體中的活性酶將導致藥物在載體細胞中的降解,同時也難以實現藥物從載體細胞亞細胞器中的逃逸;最后,藥物的帶電性質、親疏水性也極大的影響細胞載體的載藥率。因此,設計一種通用的細胞藥物載體,可以同時實現對各種類和多種藥物的腫瘤靶向運輸,對實現腫瘤的協同治療,精確治療,降低毒副作用和實現個性化治療具有重要意義。
技術實現要素:
為解決現有技術的不足,本發明的第一目的是提供一種腫瘤靶向細胞藥物載體,所述的細胞藥物載體由嵌細胞膜藥物鍵合物和載體細胞組成,嵌細胞膜藥物鍵合物嵌入載體細胞細胞膜,通過載體細胞對腫瘤的趨向性實現藥物傳遞。
進一步地,本發明的另一個目的是提供一種嵌細胞膜藥物鍵合物,由親水性聚精氨酸、烷基鏈和鍵合藥物組成,其化學結構式通式如式(Ⅰ)所示:
其中m=5-8;n=1-6;R為鍵合藥物,是光動力學治療光敏劑、化療藥物或者熒光分子的任意一種。
進一步地,本發明的另一個目的是提供一種嵌細胞膜藥物鍵合物,其為棕櫚酸-賴氨酸(喜樹堿)-精氨酸-精氨酸-精氨酸-精氨酸、棕櫚酸-賴氨酸(原卟啉)-精氨酸-精氨酸-精氨酸-精氨酸和棕櫚酸-賴氨酸(熒光素)-精氨酸-精氨酸-精氨酸-精氨酸中的任意一種。
進一步地,本發明的另一個目的是提供一種腫瘤靶向細胞藥物載體,所述的細胞藥物載體由兩種嵌細胞膜藥物鍵合物和載體細胞組成,兩種嵌細胞膜藥物鍵合物同時嵌入載體細胞細胞膜,所述的兩種嵌細胞膜藥物鍵合物的鍵合藥物為光動力學治療光敏劑、化療藥物或者熒光分子中的任意兩種。
進一步地,本發明的另一個目的是提供腫瘤靶向細胞藥物載體的載體細胞為循環細胞。
進一步地,本發明的另一個目的是提供腫瘤靶向細胞藥物載體的載體細胞,為紅細胞,巨噬細胞,單核細胞,白細胞。
本發明提供的腫瘤靶向細胞藥物載體在制備腫瘤成像的試劑中的應用。
本發明提供的腫瘤靶向細胞藥物載體在制備化療藥物中的應用。
本發明提供的腫瘤靶向細胞藥物載體在制備光動力學治療光敏劑中的應用。
本發明提供的腫瘤靶向細胞藥物載體在制備同時能夠完成腫瘤成像和化療的藥物中的應用。
本發明提供的腫瘤靶向細胞藥物載體在制備同時能夠完成腫瘤光動力學治療和化療的藥物中的應用。
本發明提供的腫瘤靶向細胞藥物載體在制備同時能夠完成腫瘤光動力學治療和腫瘤成像的藥物中的應用。
本發明的原理是:通過對細胞膜有嵌入作用的烷基鏈和對細胞膜有吸附作用的帶正電多肽鏈段結合形成細胞膜嵌合物,將小分子藥物通過化學鍵合到嵌合物側基形成嵌細胞膜藥物鍵合物。將嵌細胞膜藥物鍵合物嵌入到循環細胞的細胞膜中,實現藥物的運載。嵌細胞膜藥物鍵合物嵌入到載體細胞細胞膜后將不會影響載體細胞對腫瘤的趨向性。同時,利用循環細胞對腫瘤的趨向性,實現藥物對腫瘤的靶向運輸。
本發明的一個實施例證實了腫瘤靶向細胞藥物載體中嵌細胞膜藥物鍵合物可以作為化療藥物在載體細胞上嵌入及運輸,并在一定時間內具有一定的穩定性。
本發明的一個實施例證實了腫瘤靶向細胞藥物載體中嵌細胞膜藥物鍵合物可以作為光動力學治療光敏劑在載體細胞上嵌入及運輸,并在一定時間內具有一定的穩定性。
本發明的一個實施例證實了腫瘤靶向細胞藥物載體中嵌細胞膜藥物鍵合物可以作為熒光成像分子在載體細胞上嵌入及運輸,并在一定時間內具有一定的穩定性。
本發明的一個實施例證實了腫瘤靶向細胞藥物載體中嵌細胞膜藥物鍵合物可以嵌入到巨噬細胞、干細胞及紅細胞的細胞膜上。
本發明的一個實施例證實了腫瘤靶向細胞藥物載體中嵌細胞膜藥物鍵合物可以作為熒光成像分子和光動力學治療光敏劑在載體細胞上同時嵌入及運輸,從而實現腫瘤的成像和治療。
本發明的一個實施例證實了腫瘤靶向細胞藥物載體中嵌細胞膜藥物鍵合物可以作為化療藥物和光動力學治療光敏劑在載體細胞上的同時嵌入及運輸,從而實現腫瘤的協同治療。
本發明的一個實施例證實了腫瘤靶向細胞藥物載體中嵌細胞膜藥物鍵合物作為光動力學治療光敏劑在載體細胞上的嵌入及運輸,對載體細胞沒有毒性,相對于內吞形式的運輸更具生物相容性。
本發明的一個實施例證實了腫瘤靶向細胞藥物載體中嵌細胞膜藥物鍵合物作為光動力學治療光敏劑在載體細胞上的嵌入及運輸,光敏劑的載藥量隨嵌細胞膜光敏劑鍵合物與載體細胞的共培養時間增加而增大。
本發明的一個實施例證實了腫瘤靶向細胞藥物載體中嵌細胞膜藥物鍵合物作為光動力學治療光敏劑在載體細胞上的嵌入及運輸,光敏劑的載藥量隨載體細胞與共培養的嵌細胞膜光敏劑鍵合物的濃度增加而增大。
本發明的一個實施例證實了腫瘤靶向細胞藥物載體中嵌細胞膜藥物鍵合物作為光動力學治療光敏劑在載體細胞上的嵌入及運輸,載體細胞膜表面嵌入藥物鍵合物后對,載體細胞對腫瘤細胞的趨向性不受影響。
本發明的一個實施例證實了腫瘤靶向細胞藥物載體中嵌細胞膜藥物鍵合物作為光動力學治療光敏劑在載體細胞上的嵌入及運輸,嵌膜細胞載體對腫瘤具有靶向性。
本發明的一個實施例證實了腫瘤靶向細胞藥物載體中嵌細胞膜藥物鍵合物作為光動力學治療光敏劑在載體細胞上的嵌入及運輸,嵌膜細胞載體治療對腫瘤生長具有抑制效果。
本發明的一個實施例證實了腫瘤靶向細胞藥物載體中嵌細胞膜藥物鍵合物作為光動力學治療光敏劑在載體細胞上的嵌入及運輸,嵌膜細胞載體在腫瘤治療過程中,小鼠體重不變,具有較小的毒副作用。
本發明的一個實施例證實了腫瘤靶向細胞藥物載體中嵌細胞膜藥物鍵合物作為光動力學治療光敏劑在載體細胞上的嵌入及運輸,嵌膜細胞載體治療對腫瘤體積生長具有抑制效果。
本發明的一個實施例證實了腫瘤靶向細胞藥物載體中嵌細胞膜藥物鍵合物作為光動力學治療光敏劑在載體細胞上的嵌入及運輸,嵌膜細胞載體治療對腫瘤重量生長具有抑制效果。
本發明的優點是:1)利用細胞膜藥物嵌合物可以降低藥物對于載體細胞的細胞毒性。2)該細胞膜嵌合物具有通用性,可以用作化療藥物,光敏劑以及熒光分子的運載。3)嵌膜細胞藥物鍵合物對載體細胞的腫瘤趨向性沒有影響。4)嵌膜細胞藥物載體可以實現腫瘤的靶向運輸。5)這種腫瘤靶向細胞藥物載體中的細胞膜嵌合物制備簡單,提純容易,載體細胞的獲得也較容易。6)這種嵌膜細胞載體可以實現對腫瘤同時進行診斷和治療或協同治療等。
附圖說明
圖1:嵌細胞膜喜樹堿鍵合物對巨噬細胞的嵌膜及其對時間的穩定性圖。
圖2:嵌細胞膜原卟啉鍵合物對巨噬細胞的嵌膜及其對時間的穩定性圖。
圖3:嵌細胞膜鍵合物分別嵌入巨噬細胞,干細胞和紅細胞以及嵌細胞膜熒光素鍵合物嵌入巨噬細胞對時間的穩定性圖。
A嵌細胞膜喜樹堿鍵合物、嵌細胞膜熒光素鍵合物,嵌細胞膜原卟啉鍵合物分別嵌入巨噬細胞圖;
B嵌細胞膜喜樹堿鍵合物、嵌細胞膜熒光素鍵合物,嵌細胞膜原卟啉鍵合物分別嵌入干細胞圖;
C嵌細胞膜喜樹堿鍵合物、嵌細胞膜熒光素鍵合物,嵌細胞膜原卟啉鍵合物分別嵌入紅細胞圖;
D嵌細胞膜熒光素鍵合物嵌入巨噬細胞對時間的穩定性圖。
圖4.嵌細胞膜熒光素鍵合物和嵌細胞膜原卟啉鍵合物對巨噬細胞的嵌膜圖。
圖5:嵌細胞膜喜樹堿鍵合物和嵌細胞膜原卟啉鍵合物對巨噬細胞的嵌膜圖。
圖6:嵌細胞膜原卟啉鍵合物和原卟啉對巨噬細胞的細胞毒性圖。
圖7:嵌細胞膜原卟啉鍵合物對巨噬細胞細胞膜嵌膜能力隨培養時間的變化圖。
圖8:嵌細胞膜原卟啉鍵合物對巨噬細胞細胞膜嵌膜能力隨嵌細胞膜原卟啉鍵合物濃度梯度的變化圖。
圖9:嵌細胞膜原卟啉鍵合物巨噬細胞載體趨向性能力測試圖。
圖10:嵌細胞膜原卟啉鍵合物巨噬細胞載體對腫瘤的靶向能力圖。
圖11:各種條件下的腫瘤體積隨時間的變化圖。
圖12:各種條件下的小鼠體重隨時間變化圖。
圖13:各種條件下小鼠培養12天后剝離腫瘤的實物圖。
圖14:各種條件下小鼠培養12天后的腫瘤重量(克數)圖。
具體實施方式
通過以下詳細說明結合附圖可以進一步理解本發明的特點和優點。所提供的實施例僅是對本發明方法的說明,而不以任何方式限制本發明揭示的其余內容。
【實施例1】嵌細胞膜鍵合物的合成
嵌細胞膜鍵合物(棕櫚酸-賴氨酸(喜樹堿)-精氨酸-精氨酸-精氨酸-精氨酸),(棕櫚酸-賴氨酸(原卟啉)-精氨酸-精氨酸-精氨酸-精氨酸)和(棕櫚酸-賴氨酸(熒光素)-精氨酸-精氨酸-精氨酸-精氨酸)的合成:
(1)往裝有10mL重蒸過的N,N-二甲基甲酰胺的反應器中加入0.5g氯樹脂(1.01mmol/g),待氯樹脂在N,N-二甲基甲酰胺中溶脹2小時后抽除N,N-二甲基甲酰胺。
(2)將FMOC保護氨基和Pbf保護胍基的精氨酸(樹脂活性位點的4倍當量)、N,N-二異丙基乙胺(氨基酸的8倍當量)溶于10mL N,N-二甲基甲酰胺中,再加到反應器中室溫反應2小時將半胱氨酸鍵合到樹脂上,抽除溶劑,N,N-二甲基甲酰胺洗滌2~4次。
(3)往反應器中加入20%(V/V)哌啶/N,N-二甲基甲酰胺(即哌啶與N,N-二甲基甲酰胺體積比為2:8)溶液10mL,室溫反應15分鐘后,抽除溶劑;重復加入哌啶/N,N-二甲基甲酰胺溶液進行反應以切落FMOC保護基,反應結束后,抽除溶劑,用N,N-二甲基甲酰胺洗滌樹脂2~4次。
(4)將精基酸(樹脂活性位點的4倍當量)、苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸鹽(樹脂活性位點的4.8倍當量)、1-羥基苯并三氮唑(樹脂活性位點的4.8倍當量)、N,N-二異丙基乙胺(樹脂活性位點的8倍當量)溶于N,N-二甲基甲酰胺中,加入反應器中室溫反應2小時將賴氨酸鍵合上去,抽除溶劑,用N,N-二甲基甲酰胺洗滌樹脂2~4次。
(5)將剩下的精氨酸,精氨酸按照步驟(3)(4)逐一依次鍵合上去。
(6)按照步驟(3)脫除FMOC保護基,將FMOC保護氨基和Dde保護側基氨基的氨基酸(樹脂活性位點的4倍當量)、苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸鹽(樹脂活性位點的4.8倍當量)、1-羥基苯并三氮唑(樹脂活性位點的4.8倍當量)、N,N-二異丙基乙胺(樹脂活性位點的8倍當量)溶于N,N-二甲基甲酰胺中,加入反應器中室溫反應2小時將賴氨酸鍵合上去,抽除溶劑,用N,N-二甲基甲酰胺洗滌樹脂2~4次。
(7)按照步驟(3)脫除FMOC保護基,將棕櫚酸(樹脂活性位點的4倍當量)、苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸鹽(樹脂活性位點的4.8倍當量)、1-羥基苯并三氮唑(樹脂活性位點的4.8倍當量)、N,N-二異丙基乙胺(樹脂活性位點的8倍當量)溶于N,N-二甲基甲酰胺中,加入反應器中室溫反應2小時將賴氨酸鍵合上去,抽除溶劑,用N,N-二甲基甲酰胺洗滌樹脂2~4次。
(8)脫除Dde保護基,往反應器中加入2%(V/V)水合肼/N,N-二甲基甲酰胺(即哌啶與N,N-二甲基甲酰胺體積比為2:98)溶液10mL,室溫反應7分鐘后,抽除溶劑;重復加入水合肼/N,N-二甲基甲酰胺以切落Dde保護基,反應結束后,抽除溶劑,用N,N-二甲基甲酰胺洗滌樹脂2~4次。
(9)將原卟啉或者羧基化喜樹堿或者5(6)-羧基熒光素(樹脂活性位點的4倍當量)、苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸鹽(樹脂活性位點的4.8倍當量)、1-羥基苯并三氮唑(樹脂活性位點的4.8倍當量)、N,N-二異丙基乙胺(樹脂活性位點的8倍當量)溶于N,N-二甲基甲酰胺中,分別加入反應器中室溫反應4小時光敏劑或者化療藥物或者熒光分子鍵合上去,抽除溶劑,用N,N-二甲基甲酰胺洗滌樹脂2~4次。
(10)N,N-二甲基甲酰胺洗滌樹脂2~4次,甲醇洗滌2~4次,二氯甲烷洗滌2~4次。
(11)往反應器中加入由如下體積百分含量的組分組成的溶液于室溫下作用2h以切落氨樹脂上的多肽鍵合物及側基:95%三氟乙酸、5%水。
(12)收集切落液,旋蒸,真空干燥得到產物,于-20℃避光保存。
以下實施例2-12中均以實施例1中合成的嵌細胞膜鍵合物為例。
【實施例2】嵌細胞膜喜樹堿鍵合物對巨噬細胞的嵌膜及其對時間的穩定性
將巨噬細胞以1×105個細胞/孔的密度接種,37℃條件下在1mL培養基中培養。24小時后,將嵌細胞膜喜樹堿鍵合物溶解在培養基中,向巨噬細胞中加入1mL含有嵌細胞膜喜樹堿鍵合物(30微摩爾/升)的培養基。培養2小時后,將含有嵌細胞膜喜樹堿鍵合物的培養基吸出,有PBS緩沖溶液將細胞洗滌三次后加入新的培養基,用激光共聚焦顯微鏡觀察細胞內的喜樹堿的熒光強度。
結果如圖1所示,嵌細胞膜喜樹堿鍵合物能夠有效的嵌入巨噬細胞細胞膜中,同時,培養時間增加,細胞膜表面的熒光強度只有較弱減少,證明了嵌細胞膜喜樹堿鍵合物在細胞膜上的穩定性。
【實施例3】嵌細胞膜原卟啉鍵合物對巨噬細胞的嵌膜及其對時間的穩定性
將巨噬細胞以1×105個細胞/孔的密度接種,37℃條件下在1mL培養基中培養。24小時后,將嵌細胞膜原卟啉鍵合物溶解在培養基中,向巨噬細胞中加入1mL含有嵌細胞膜原卟啉鍵合物(30微摩爾/升)的培養基。培養2小時后,將含有嵌細胞膜原卟啉鍵合物的培養基吸出,有PBS緩沖溶液將細胞洗滌三次后加入新的培養基,用激光共聚焦顯微鏡觀察細胞內的原卟啉的熒光強度。
結果如圖2所示,嵌細胞膜原卟啉鍵合物能夠有效的嵌入巨噬細胞細胞膜中,同時,培養時間增加,細胞膜表面的熒光強度只有較弱減少,證明了嵌細胞膜原卟啉鍵合物在細胞膜上的穩定性。
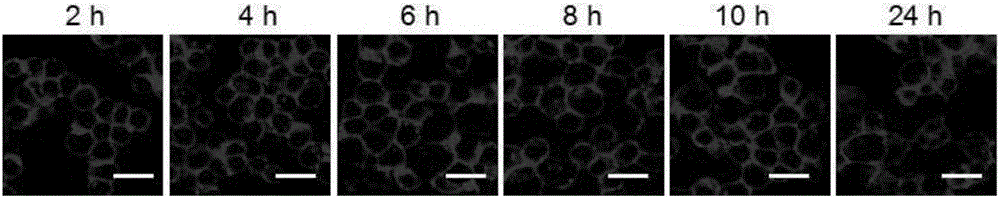
【實施例4】嵌細胞膜鍵合物分別嵌入巨噬細胞,干細胞和紅細胞以及嵌細胞膜熒光素鍵合物嵌入巨噬細胞對時間的穩定性
將紅細胞,巨噬細胞,干細胞分別以1×105個細胞/孔的密度接種,37℃條件下在1mL培養基中培養。24小時后,將嵌細胞膜熒光素鍵合物,嵌細胞膜原卟啉鍵合物,嵌細胞膜喜樹堿鍵合物分別溶解在培養基中,分別向紅細胞,巨噬細胞,干細胞中加入1mL含有嵌細胞膜熒光素鍵合物(30微摩爾/升),嵌細胞膜原卟啉鍵合物(30微摩爾/升),嵌細胞膜喜樹堿鍵合物(30微摩爾/升)的培養基。培養2小時后,將含有嵌細胞膜鍵合物的培養基吸出,有PBS緩沖溶液將細胞洗滌三次后加入新的培養基,用激光共聚焦顯微鏡觀察細胞內的熒光素的熒光強度。
結果如圖3所示,嵌細胞膜鍵合物能夠有效的嵌入紅細胞,干細胞和巨噬細胞細胞膜中,證明了嵌細胞膜鍵合物的通用性。同時,培養時間增加,細胞膜表面的熒光強度只有較弱減少,證明了嵌細胞膜熒光素鍵合物在細胞膜上的穩定性。
【實施例5】嵌細胞膜熒光素鍵合物和嵌細胞膜原卟啉鍵合物同時對巨噬細胞的嵌膜及其對時間的穩定性
將巨噬細胞以1×105個細胞/孔的密度接種,37℃條件下在1mL培養基中培養。24小時后,將嵌細胞膜熒光素鍵合物和嵌細胞膜原卟啉鍵合物溶解在培養基中,向巨噬細胞中加入1mL含有嵌細胞膜熒光素鍵合物和嵌細胞膜原卟啉鍵合物(分別為30微摩爾/升)的培養基。培養2小時后,將含有嵌細胞膜熒光素鍵合物和嵌細胞膜原卟啉鍵合物的培養基吸出,有PBS緩沖溶液將細胞洗滌三次后加入新的培養基,用激光共聚焦顯微鏡觀察細胞內的熒光素和原卟啉的熒光強度。
結果如圖4所示,嵌細胞膜熒光素鍵合物和嵌細胞膜原卟啉鍵合物能夠同時有效的嵌入巨噬細胞細胞膜中。證明了本發明腫瘤靶向細胞藥物載體可以同時對腫瘤進行成像和治療。
【實施例6】嵌細胞膜喜樹堿鍵合物和嵌細胞膜原卟啉鍵合物對巨噬細胞的嵌膜及其對時間的穩定性
將巨噬細胞以1×105個細胞/孔的密度接種,37℃條件下在1mL培養基中培養。24小時后,將嵌細胞膜喜樹堿鍵合物和嵌細胞膜原卟啉鍵合物溶解在培養基中,向巨噬細胞中加入1mL含有嵌細胞膜喜樹堿鍵合物和嵌細胞膜原卟啉鍵合物(分別為30微摩爾/升)的培養基。培養2小時后,將含有嵌細胞膜喜樹堿鍵合物和嵌細胞膜原卟啉鍵合物的培養基吸出,有PBS緩沖溶液將細胞洗滌三次后加入新的培養基,用激光共聚焦顯微鏡觀察細胞內的喜樹堿和原卟啉的熒光強度。
結果如圖5所示,嵌細胞膜熒光素鍵合物和嵌細胞膜原卟啉鍵合物能夠同時有效的嵌入巨噬細胞細胞膜中。證明了本發明腫瘤靶向細胞藥物載體可以完成對腫瘤進行化療和光動力學治療的協同治療。
【實施例7】嵌細胞膜原卟啉鍵合物和原卟啉對巨噬細胞的細胞毒性
巨噬細胞以6000個細胞/孔的密度接種在96孔板中,用100μL培養基培養24小時。然后,將用培養基配制的嵌細胞膜原卟啉鍵合物溶液和原卟啉溶液100μL分別加入到各孔中。所有細胞在避光條件下37攝氏度培養48小時。隨后在每個孔中加入20μL 5mg/mL的MTT(MTT溶解在PBS緩沖液中)。共培養4h后,吸出培養基,加入150μL二甲亞砜(DMSO)。酶標儀測量每個孔中570納米處的吸光值,計算細胞存活率,進而得到嵌細胞膜原卟啉鍵合物溶液和原卟啉對巨噬細胞的毒性。
結果如圖6所示,嵌細胞膜原卟啉鍵合物溶液具有較小的毒性,較原卟啉有更好的生物相容性。
【實施例8】嵌細胞膜原卟啉鍵合物對巨噬細胞細胞膜嵌膜能力與培養時間的關系
將巨噬細胞以1×105個細胞/孔的密度接種,37℃條件下在1mL培養基中培養。24小時后,將嵌細胞膜原卟啉鍵合物溶解在培養基中,向巨噬細胞中加入1mL含有嵌細胞膜原卟啉鍵合物(30微摩爾/升)的培養基。分別培養0小時,0.5小時,1小時,2小時和6小時后,將含有嵌細胞膜原卟啉鍵合物的培養基吸出,有PBS緩沖溶液將細胞洗滌三次后加入新的培養基,用激光共聚焦顯微鏡觀察細胞內的原卟啉的熒光強度。
結果如圖7所示,嵌細胞膜原卟啉鍵合物在巨噬細胞膜上的原卟啉的熒光強度隨培養時間增長而增加。證明了嵌細胞膜原卟啉鍵合物在巨噬細胞中的載藥率可以通過嵌細胞膜原卟啉鍵合物與巨噬細胞的共培養時間來調控。
【實施例9】嵌細胞膜原卟啉鍵合物對巨噬細胞細胞膜嵌膜能力與嵌細胞膜原卟啉鍵合物濃度梯度的關系
將巨噬細胞以1×105個細胞/孔的密度接種,37℃條件下在1mL培養基中培養。24小時后,將嵌細胞膜原卟啉鍵合物溶解在培養基中,向巨噬細胞中加入1mL分別含有嵌細胞膜原卟啉鍵合物濃度為0微摩爾/升,5微摩爾/升,10微摩爾/升,15微摩爾/升和30微摩爾/升的培養基。培養2小時后,將含有嵌細胞膜原卟啉鍵合物的培養基吸出,有PBS緩沖溶液將細胞洗滌三次后加入新的培養基,用激光共聚焦顯微鏡觀察細胞內的原卟啉的熒光強度。
結果如圖8所示,嵌細胞膜原卟啉鍵合物在巨噬細胞膜上的原卟啉的熒光強度隨嵌細胞膜原卟啉鍵合物濃度增大而增大。證明了嵌細胞膜原卟啉鍵合物在巨噬細胞中的載藥率可以通過巨噬細胞與嵌細胞膜原卟啉鍵合物的濃度來調控。
【實施例10】嵌細胞膜原卟啉鍵合物巨噬細胞載體趨向性能力測試
將巨噬細胞,巨噬細胞,嵌細胞膜原卟啉嵌合的巨噬細胞,巨噬細胞,嵌細胞膜原卟啉嵌合的巨噬細胞分別以3000個細胞/孔的密度接種在穿透膜上層。在各接種細胞下層分別加入1mL新的MEM培養基,4T1細胞培養過的MEM培養基,新的DMEM培養基和COS7培養過的DMEM培養基,37℃條件下培養。分別在培養12小時,24小時,36小時和48小時后,用倒置顯微鏡觀測穿透細胞的個數。
結果如圖9所示,嵌細胞膜原卟啉鍵合物嵌膜巨噬細胞在4T1細胞培養過的MEM培養基條件下培養穿過穿透膜的細胞個數與巨噬細胞在4T1細胞培養過的MEM培養基條件下培養穿過穿透膜的細胞個數相當。證明了嵌細胞膜原卟啉鍵合物對巨噬細胞的趨向性影響較小。
【實施例11】小白鼠體內嵌細胞膜原卟啉鍵合物巨噬細胞載體對腫瘤的靶向能力檢測
4~5周小白鼠(BALB/c)在小腿內側皮下注射100μL(PBS)含細胞個數為1×106的4T1細胞懸液造瘤,當腫瘤體積長到約200mm2時。將嵌細胞膜原卟啉鍵合物嵌合巨噬細胞尾靜脈注射到小白鼠體內。用小動物活體成像觀測小鼠體內熒光分布和變化。
結果如圖10所示,小鼠腫瘤區域材料熒光隨時間增加而增長,從而證明嵌細胞膜原卟啉鍵合物嵌合巨噬細胞具有腫瘤靶向運輸的能力。
【實施例12】嵌細胞膜原卟啉嵌合巨噬細胞載體對腫瘤的治療效果
4~5周小白鼠(BALB/c)在小腿內側皮下注射100μL(PBS)含細胞個數為1×106的4T1細胞懸液造瘤,當腫瘤體積長到約200mm2時。將小鼠隨機分為6組。PBS和巨噬細胞、嵌細胞膜原卟啉嵌合巨噬細胞、嵌細胞膜原卟啉鍵合物、嵌細胞膜原卟啉嵌合巨噬細胞和原卟啉尾靜脈注射。注射24小時和48小時后,用660nm He-Ne激光照射腫瘤,每只每次5min。每天測量腫瘤體積,腫瘤體積按照V=W2×L/2公式計算,其中W為較短的腫瘤寬度,L為較長的腫瘤寬度,通過相對腫瘤體積(V/V0,V為實時腫瘤體積,V0為治療前腫瘤體積)來反映腫瘤體積的變化情況。
結果見圖11,經嵌細胞膜原卟啉嵌合巨噬細胞治療后的小鼠腫瘤生長受到抑制,并且相對于經嵌細胞膜原卟啉和原卟啉有更優越的腫瘤抑制作用,從而證明嵌細胞膜原卟啉嵌合巨噬細胞載體對腫瘤的治療效果。與此同時,小鼠重量隨治療效果沒有大幅變化,說明經嵌細胞膜原卟啉嵌合巨噬細胞治療對小鼠沒有強毒副作用(圖12)。而腫瘤圖片中腫瘤體積(圖13)和重量(圖14)變化進一步說明了嵌細胞膜原卟啉嵌合巨噬細胞優越的腫瘤抑制作用。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 具有腫瘤細胞靶向性的超細磁性核殼納米材料及其制備和應用的制作方法與工藝
- 具有腫瘤細胞靶向性的超細磁性核殼納米材料及其制備和應用的制作方法與工藝
- 一種利用細胞通透性差異治療皮膚癌的靶向藥物的制作方法與工藝
- 一種基于細胞源性微囊泡的腫瘤靶向遞送載體及制備方法和應用與流程
- 靶向CLDN6的免疫效應細胞及其制備方法和應用與流程
- 一種檢測靶向CD33的CART細胞中CAR表達的熒光定量試劑盒的制作方法與工藝
- 靶向HBV核心啟動子的抗HBV藥物篩選細胞模型及其構建和應用的制作方法與工藝
- 一種響應過氧化氫殺滅腫瘤細胞的光敏感靶向抗腫瘤前藥及其制備方法與應用與流程
- 靶向循環腫瘤細胞的長循環納米粒及其制備和應用的制作方法與工藝
- 使用CRISPR/Cas9技術靶向敲除水稻矮桿基因SD1的方法與流程