一種中藥制劑及其制備與應用的制作方法
本發明涉及一種中藥組合物,特別涉及一種中藥組合物及其在制備治療慢性再生障礙性貧血藥物中的應用。(二)
背景技術:
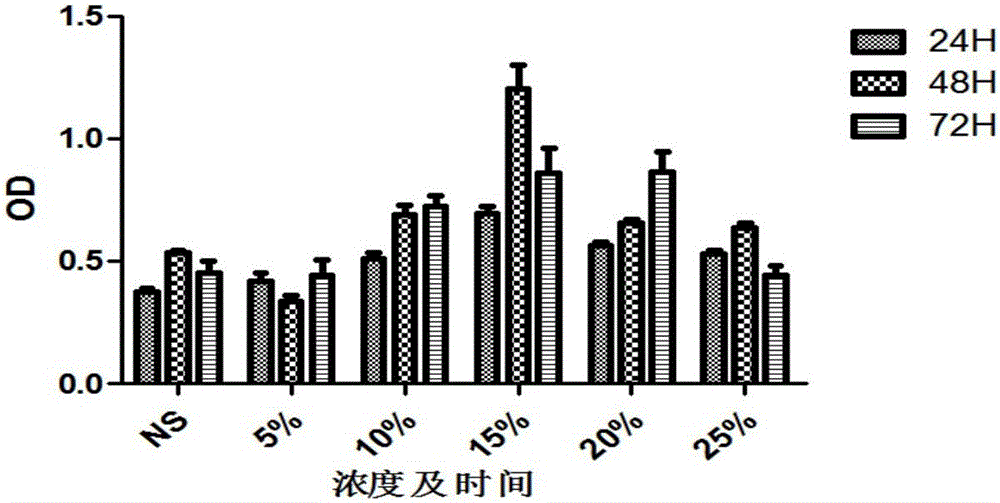
:再生障礙性貧血(aplasticanemia,AA)屬于骨髓造血功能衰竭性疾病,臨床表現為貧血、出血及感染,其中慢性再障約占到80%。目前圍繞慢性再障的主要治療方案主要包括免疫抑制劑(如:環孢霉素)及雄激素刺激造血,部分患者因長期用藥帶來的經濟負擔及藥物毒副反應而中止治療,導致疾病反復,總體預后較差,患者生活質量低下。中醫藥在AA中的應用已有50余年歷史,在調節免疫、刺激造血、減輕藥物毒副反應、改善生活質量等方面具有明確的優勢。目前臨床上沒有明確治療再障有效的特異性中成藥,常規應用補腎及刺激造血的相關中成藥,如生血合劑、右歸丸等,具有一定的輔助治療作用。中醫臨床圍繞再障主要還是“從腎論治”,然而缺少大樣本的臨床數據及實驗數據支撐,并且部分患者在藥物起效后期無法進一步獲得療效的提升,處于療效的瓶頸期。腎主骨生髓,再障中醫病名“髓勞”,臨床以腎陽虛證多見,并且慢性再障病程長,病情纏綿,伴有氣血虧虛,勞血動血,故常合并血滯脈內或血留脈外,導致“瘀證”內生。本發明涉及一種治療慢性再生障礙性貧血的中藥復方,由熟地、生地、肉桂、丹參、當歸、菟絲子、仙靈脾、補骨脂、太子參、制首烏、赤芍、茯苓、山藥、白術、甘草組成,在“從腎論治”的基礎上聯合活血化瘀藥味,具有補腎填精,活血益氣的功效,并進行了相關臨床及基礎研究,明確了“補腎活血方”的作用優勢及可能的療效機制。目前未有該復方及其制劑在慢性再障中的應用報道。(三)技術實現要素:本發明目的是提供一種中藥組合物及其在制備治療慢性再生障礙性貧血藥物中的應用,有望進一步提高慢性再障臨床治療效果的中藥組合物。本發明采用的技術方案是:本發明提供一種中藥制劑,所述中藥制劑由如下質量配比的原料制成:熟地10~30份、生地10~30份、肉桂3~6份、丹參10~20份、當歸10~20份、菟絲子10~20份、補骨脂10~20份、仙靈脾10~20份、太子參9~30份、制何首烏10~15份、赤芍8~15份、丹皮9~15份、茯苓9~15份、白術9~15份、山藥15~30份和甘草3~6份。進一步,優選所述中藥制劑由如下質量配比的原料制成:熟地15~20份、生地15~20份、肉桂3~4份、丹參10~15份、當歸10~15份、菟絲子10~15份、補骨脂15~20份、仙靈脾15~20份、太子參20~30份、制何首烏10~15份、赤芍8~10份、丹皮9~12份、茯苓10~12份、白術9~12份、山藥20~30份和甘草3~6份。更進一步,優選所述中藥制劑由如下質量配比的原料制成:熟地20份、生地15份、肉桂4份、丹參10份、當歸10份、菟絲子15份、補骨脂20份、仙靈脾20份、太子參30份、制何首烏10份、赤芍10份、丹皮9份、茯苓10份、白術12份、山藥30份和甘草3份。本發明所述中藥制劑為配方量原料用水煎煮后的濾液經干燥制成。本發明還提供一種所述中藥制劑的制備方法,所述方法為:按配方量,將各原料混合,加入3~5倍重量的水,浸泡1小時,水煎煮沸30分鐘后,一次過濾,獲得一次濾液和一次濾餅;一次濾餅加入各原料3~5倍重量的水,繼續水煎煮沸15分鐘,二次過濾,獲得二次濾液和二次濾餅,合并一次濾液和二次濾液,濃縮成浸膏,獲得所述中藥制劑。此外,本發明還提供一種所述中藥制劑在制備治療慢性再生障礙性貧血藥物中的應用。所述的藥物為片劑、顆粒劑、膠囊劑或口服液。慢性再障起病緩慢,臨床除面色蒼白、心悸氣短、頭暈乏力主癥外,尚可見潮熱盜汗、口渴思飲、舌邊尖紅少津、脈細數之“陰虛”證,或形寒肢冷、食少便溏、舌體胖大邊齒痕、苔白滑、脈沉弱之“陽虛”證。“腎藏精,精生髓,髓生骨…精足則髓足”(《醫精經義》),又“精者,血之所成也”(《諸病源候論》),可見腎作為先天本元,是髓骨、精血化生之源,是慢性再障發病的本臟所在。“五臟之傷,窮必及腎”。腎元久虛則無以煦養周身臟腑,氣血無以生化,形成惡性循環。故臨床治療多宗“從腎論治”。此外,脾胃為后天之本,腎精有藏,必賴于后天水谷精微不斷充實之。脾為中臟,調周身氣血,溝通上下,是為樞。根于腎,兼治脾,是為正治。慢性再障病程漫長,病情遷延反復,“久病必虛”、“久病必瘀”;且其人脾胃虛弱,痰濕自生,血不循經,溢于脈外即為瘀;痰瘀交阻,礙于髓骨,則令疾病進展,是謂“舊血不去,新血不生”。針對慢性再障上述的疾病特點和發病機制,本發明涉及的中藥制劑在單純“從腎論治”的基礎上,突出了活血益氣的價值。其中,熟地、生地、肉桂、丹參、當歸溫腎填精、活血養血為君藥,菟絲子、仙靈脾、補骨脂、太子參、制首烏、赤芍為臣藥,君臣共奏腎虛陰陽雙補、益氣活血之功。茯苓、山藥、白術健脾化濕為佐藥,甘草調和諸藥為使藥。與現有技術相比,本發明有益效果主要體現在:本發明中藥制劑用于治療慢生障礙性貧血,能在原單純補腎的基礎上進一步提高疾病的臨床療效,能有效改善血象,尤其促進血小板計數的提高,同時能有效調節機體免疫功能再平衡、提高生活質量;體外研究表明,該中藥制劑的含藥血清能促進AA患者骨髓間充質干細胞(MSCs)的增殖,通過激活SDF-1/CXCR4-PI3K/AKT信號通路有效促進再障MSCs功能的恢復。動物研究同樣表明該方能有效上調小鼠MSCsVEGF、SDF-1、CXCR4、Akt的mRNA表達,改善造血微環境。(四)附圖說明圖1不同濃度含藥血清作用時間OD值比較柱形圖。圖2藥物干預下各組細胞因子比較柱形圖;A:SDF-1陽性對照組B:空白對照組;C:中藥組,D:中藥+Akt抑制劑+PI3K抑制劑+CXCR4抑制劑組;E:中藥+Akt抑制劑+PI3K抑制劑;F:中藥+Akt抑制劑。圖3各組上清液中VEGFmRNA的相對表達量;A:SDF-1陽性對照組B:空白對照組;C:中藥組,D:中藥+Akt抑制劑+PI3K抑制劑+CXCR4抑制劑組;E:中藥+Akt抑制劑+PI3K抑制劑;F:中藥+Akt抑制劑。(五)具體實施方式下面結合具體實施例對本發明進行進一步描述,但本發明的保護范圍并不僅限于此:本發明實施例所用藥材按照《中國藥典》2015版采集制備。實施例1中藥制劑1中藥組合物306g,配方:熟地30份、生地30份、肉桂6份、丹參20份、當歸20份、菟絲子20份、補骨脂20份、仙靈脾20份、太子參30份、制何首烏15份、赤芍15份、丹皮15份、茯苓15份、白術15份、山藥30份、甘草6份。中藥組合物制備方法:按配方量,將各原料混合,加入3~5倍重量的水,浸泡1小時,水煎煮沸30分鐘后,留取中藥煎液。藥渣再加等量水,繼續水煎煮沸15分鐘,去除藥渣,合并中藥煎液,減壓濃縮成浸膏,獲得中藥制劑160g。實施例2:中藥制劑2中藥組合物218g,配方:熟地20份、生地15份、肉桂4份、丹參10份、當歸10份、菟絲子15份、補骨脂20份、仙靈脾20份、太子參30份、制何首烏10份、赤芍10份、丹皮9份、茯苓10份、白術12份、山藥30份、甘草3份。中藥組合物制備方法:按配方量,將各原料混合,加入3~5倍重量的水,浸泡1小時,水煎煮沸30分鐘后,留取中藥煎液。藥渣再加等量水,繼續水煎煮沸15分鐘,去除藥渣,合并中藥煎液,減壓濃縮成浸膏,獲得中藥制劑160g。實施例3:中藥制劑3中藥組合物145g,配方:熟地10份、生地10份、肉桂3份、丹參10份、當歸10份、菟絲子10份、補骨脂10份、仙靈脾10份、太子參9份、制何首烏10份、赤芍8份、丹皮9份、茯苓9份、白術9份、山藥15份、甘草3份。中藥組合物制備方法:按配方量,將各原料混合,加入3~5倍重量的水,浸泡1小時,水煎煮沸30分鐘后,留取中藥煎液。藥渣再加等量水,繼續水煎煮沸15分鐘,去除藥渣,合并中藥煎液,減壓濃縮成浸膏,獲得中藥制劑160g。實施例4(一)中藥制劑對慢性再障患者的治療作用及機制研究一、病例和方法1.納入標準1.1西醫診斷標準(參考張之南·《血液病診斷及療效標準》第二版)符合再障診斷,并具有以下特征者:1)臨床表現:發病較急性再障緩慢,貧血、感染、出血相對較輕。2)血象:血紅蛋白下降速度較慢,網織紅細胞、中性粒細胞及血小板降低,但達不到急性再障的程度。3)骨髓象:三系或兩系減少,至少一個部位增生不良,入增生活躍,則淋巴細胞相對增多,巨核細胞明顯減少;骨髓小粒中,非造血細胞(如脂肪細胞)增加。4)病程中如病情惡化,臨床、血象及骨髓象與急性再障相同,則稱重型再障Ⅱ型。1.2“腎陽虛”中醫診斷依據證候特點:面色晄白,形寒肢冷,唇甲色淡,氣短懶言,腰酸腿軟,食少便溏,出血色淡,舌胖大苔白邊有齒痕,脈沉弱。1.3入選標準和排除標準1.3.1納入病例標準:凡符合以上西醫診斷標準者,且排除慢性再障-重型再障Ⅱ型,同時符合中醫“腎陽虛”證型診斷,在滿足下列4點,即可納入臨床治療研究。納入符合“腎陰虛”的患者,用于比較與入組“腎陽虛”患者在內分泌相關指標的差異,不涉及療效觀察。1)能除外其他引起全血細胞減少的疾病,如骨髓增生異常綜合征、骨髓纖維化、急性造血功能停滯、陣發性睡眠性血紅蛋白尿癥、急性白血病、惡性組織細胞增多癥等;2)一般抗貧血藥物治療無效;3)自愿服用中藥治療,納入前應簽署知情同意書;4)能隨訪,依從性好可納入實驗病例。1.3.2排除標準:1)妊娠或哺乳期婦女;2)有心、肝、腎,糖尿病等嚴重原發性疾病,精神病患者;3)合并嚴重不可控制的感染;4)同時合并有未治愈的第二種血液病或其他惡性疾病;5)中醫證型較復雜,多型混雜者。1.3.3剔除標準1)凡不符合納入標準,資料不全,依從性差的患者;2)發生不良反應者應進行不良反應的統計;3)治療時間不足3個月者。1.病例來源研究選取2009.11-2012.4期間收治的符合病例入選標準的“腎陽虛型”慢性再生障礙性貧血患者,隨機分為“單純補腎組”和“補腎活血”治療組,選取健康體檢作為正常對照組。3.治療方法3.1中醫辨病/辨證論治1)單純補腎組治則:溫腎壯陽處方:熟地15g、肉桂3g、淡附片4g、補骨脂12g、仙靈脾8g、仙茅8g、鹿角膠10g(烊化)、杜仲12g、山萸肉15g、淮山藥15g、枸杞15g、制首烏12g、黃精15g。上述各胃藥加入3~5倍重量的水,浸泡1小時,水煎煮沸30分鐘后,留取中藥煎液。藥渣再加等量水,繼續水煎煮沸15分鐘,去除藥渣,合并中藥煎液,濃縮至約160ml,生藥量為0.9g/ml,分二次服用,每次80ml。補腎活血組治則:溫腎壯陽,活血益髓處方:實施例2制備的中藥制劑,每天二次服用,每次80ml。3.2西醫基礎治療1)雄激素:安雄每次80mgbid,每天兩次;康力龍每次1-2片,一天兩次;達那唑每次1片,一天兩次;十一酸睪丸酮每次250mg-500mg肌注,半月1次,從中選取1~2種雄激素;2)環孢霉素:CSA,3~5mg/Kg·d,一天分兩次口服,維持治療6個月以上。3.3支持治療主要包括成份輸血、預防感染和抗感染治療。1)血紅蛋白<75g/L;血紅蛋白<80g/L的高齡患者有明顯貧血癥狀,可考慮紅細胞懸液輸注;2)PLT<5.0×109/L(無出血危險因子)或PLT<20.0×109/L(有明顯出血傾向,或存在出血危險因子),給予血小板懸液輸注及對癥止血治療;控制感染應選用對致病菌敏感的抗生素治療。4.治療周期患者入組,給予西藥常規基礎免疫抑制及對癥支持治療,同時給予相應中藥辨病/辨證治療,共治療6個月。5.檢測標本采集5.1血液標本收集采集患者治療前及治療后3個月、6個月靜脈血各10ml,室溫靜置30分鐘,3000r/min離心10分鐘,分離血清置于-70℃冰箱中備檢,另取30例健康體檢者作為正常對照。“腎陰虛”患者僅采集治療期血樣標本。5.2骨髓標本收集留取部分慢性再障患者骨髓液,肝素抗凝后,Ficoll液分離提取單個核細胞,進而傳代分離培養骨髓間質細胞,進行后續相關中藥血清學體外基礎研究。6.主要實驗儀器及試劑1)200流式熒光儀(Luminex,美國)2)微量移液器(eppendorf,德國)3)酶標儀(DG3022A,中國)4)全自動免疫分析儀(ARCHITECTi2000SR,雅培)5)倒置生物顯微鏡(COIC-XDS-1B,中國)6)倒置熒光顯微鏡(OLYMPUS-IX71,日本)7)人淋巴細胞分離液(Ficoll液)(天津灝洋生物,中國)8)CD4、CD8、CD8-FITC/PE/PC5、CD40L-PE-CY5、CD69-FITC、CD22-FITC、CD40-FITC、Fas(CD95)FITC、Fas-LBio、CD19-PE、CD3-PerCP等單克隆抗體(BDPharMingen,美國)9)熒光標記的小鼠抗人CD31-FITC、CD49d-PE、CD44-FITC、CD106-PE以及同型對照(BioLegend,美國)10)VEGF試劑盒(R&Dsystem,美國)11)IFN-γ、TNF-α、IL-2、IL-4、IL-10流式抗體(R&Dsystem,美國)12)人糖皮質激素受體試劑盒、人雄激素受體試劑盒(Rapidbiolab公司,美國)13)IsotypeMouseIgG1-Bio、IsotypeMouseIgG1-FITC、IsotypeMouseIgG1-PE、IsotypeMouseIgG1-PE-cy5、IsotypeMouseIgG2a-PE、IsotypeMouseIgG2a-FITC、IsotypeMouseIgG2a-PE-cy5(BDPharMingen,美國)7.觀察指標及評價方法7.1臨床研究部分及評價方法1)臨床指標觀察①一般體檢項目;②血、尿、便常規:治療前后進行血、尿、糞常規化驗檢查;③心、肝腎功能:治療前后進行心電圖、肝功能(GPT)腎功能(BUN,Cr);④CsA血濃度;⑤藥物的毒副反應。2)療效觀察①患者治療前后血象、骨髓象變化;②中醫證候。3)臨床實驗室指標觀察①流式細胞儀檢測T細胞亞群:CD3+CD4+T細胞、CD3+CD8+T細胞、Th1細胞(CD4+IFN-γ+)、Th2細胞(CD4+IL-4+)占外周血淋巴細胞中的比例;②血清或骨髓單個核細胞培養上清的IFN-γ、TNF-α水平;③檢測治療前后血清血管內皮生長因子(VEGF)。7.2療效評價方法1)西醫療效評定:參照《血液病診斷及療效標準》第二版①基本治愈:貧血和出血癥狀消失。血紅蛋白男性達120g/L,女性達100g/L,白細胞達4×109/L,血小板達80×109/L,隨訪一年以上未復發。②緩解:貧血和出血癥狀消失,血紅蛋白男性達120g/L,女性達100g/L,白細胞達3.5×109/L,血小板也有一定程度的增加,隨訪3個月病情穩定或繼續進步。③明顯進步:貧血和出血癥狀明顯好轉,不輸血,血紅蛋白較治療前1個月內常見值增長30g/L以上,并能維持3個月。判定以上三項療效標準者,均應3個月內不輸血。④無效:經充分治療后,癥狀、血象未達明顯進步。2)中醫證候療效評分標準:參照《鄭筱萸.中藥新藥臨床研究指導原則.中國醫藥科技出版社.2002年.ISSN:9787506725811》。積分比=(治療前總積分-治療后總積分)/治療前總積分×100%①臨床痊愈:中醫臨床癥狀、體征消失或基本消失,積分比≥90%;②顯效:中醫臨床癥狀、體征消失或基本消失,積分比<90%,≥70%;③有效:中醫臨床癥狀、體征有改善,積分比<70%,≥30%;④無效:中醫臨床癥狀、體征均無改善,甚或加重,積分比<30%。8.統計方法運用SPSS17.0統計軟件包調取數據庫資料,建立SPSS文件,并對資料進行統計分析。本課題的主要統計方法:計量資料用均數±標準差表示,應用T檢驗或非參數檢驗(期間采用非參數檢驗中的Shapiro-Wilk,W檢驗)對數據進行正態分布檢驗,如果數據服從正態分布可以進行獨立樣本t檢驗,如果不服從正態分布則進行非參數檢驗;計數資料應用χ2檢驗。二、結果1.病例基本信息研究期間收治符合病例入選標準且能完成6個月臨床隨訪的“腎陽虛”慢性再戰患者63例,其中男性35例,女性28例,中位年齡32(11-59)。(見表1)。表1慢性再生障礙性貧血患者基本信息分布注:患者性別、年齡等的分布情況基本一致,經統計學分析無顯著性差異。2.腎陽虛患者療效分析2.1血象變化結果顯示,中藥治療能有效增加患者WBC計數,且在治療6個月后存在顯著性差異(P<0.05);Hb僅在單純補腎法中治療6個月后存在顯著性差異(P<0.05);PLT僅在補腎活血法中6個月后存在顯著性差異(P<0.05)。與單純補腎組比較,同期補腎活血在升高WBC、PLT計數上具有顯著性差異(P<0.05)。(見表2)表2患者治療前后血象差值比較注:同一治法間,與治療3個月計數差值比較,*P<0.05;不同治法同期比較,與單純補腎組,+P<0.05.2.2西醫療效評估結果顯示,不同中醫治法聯合西醫治療的西醫療效存在差異變化,以“補腎活血”為佳。但經多行多列卡方檢驗,組間χ2=0.717,P>0.05,不同中醫治法間無明顯統計學差異。(見表3)表3西醫臨床療效評估注:χ2=0.717,P>0.05.2.3中醫療效評估結果顯示,治療6月后,兩種中醫治法在改善患者中醫臨床證候無統計學差異(χ2=03.308,P>0.05),但不同治法間存在差異變化,“補腎活血”>“單純補腎”。(見表4,5)表4中醫證候積分表5治療6月中醫療效評估注:χ2=03.308,P>0.05.3.免疫抑制劑及雄激素毒副反應比較研究結果顯示,兩種中醫治法聯合西藥免疫抑制劑治療慢性再障均存在相關毒副反應,且各組間的發生率無顯著性差異。(見表6)表6免疫抑制劑的毒副反應表注:各組在整個治療過程中,均出現不同程度的不良反應,主要與使用免疫抑制劑有關,各組相比差異無有顯著性(P<0.05)4.腎陽虛患者治療前后免疫學指標變化4.1T細胞亞群比較“單純補腎”及“補腎活血”法聯合西藥治療CAA對CD3+細胞、CD3+CD4+細胞、Treg比例改善不明顯(P>0.05)。兩治療組CD3+CD8+細胞百分比例均有一定下調,其中治療后6個月CD3+CD8+與治療前比較存在顯著性差異(P<0.05);然而各組間同期比較無顯著差異(P>0.05)。兩組治療后6個月CD4+/CD8+與治療前相比顯著上調(P<0.05),且治療6月后,不同治法之間以“補腎活血法”上調的比例更高(P<0.05)。(見表7)表7各組治療前后T細胞亞群變化注:與各組治療前比較,*P<0.05;與其他兩組同期比較,#P<0.05.4.2血清細胞因子水平比較CAA患者治療前IL-2、IL-4、IL-6、IL-10、IFN-γ、TNF-α水平與正常對照組相比有顯著差異(P<0.05)。兩治療組治療前后IL-4、IL-6、IFN-γ水平均無顯著性差異(P>0.05),而IL-2、TNF-α、IL-10水平兩組治療后3個月、治療后6個月與治療前相比差異顯著(P<0.05)。治療6月同期比較,“補腎活血”組TNF-α下降更為顯著(P<0.05)。(見表8)表8各組治療前后外周血細胞因子變化注:與正常對照比較,各組治療期,*P<0.05,**P<0.01;與各組治療前比較,+P<0.05;與其他兩組同期比較,#P<0.05.(二)補腎活血法對再生障礙性貧血患者骨髓MSCs功能的影響一、實驗材料和方法1.實驗材料1.1實驗動物與飼養環境6周齡SPF級荷蘭兔,雄性,體重2-3Kg,飼養于浙江中醫藥大學動物實驗研究中心屏障環境中【SYXK(浙)2008-0116】;飼喂普通飼料,自由飲食。環境溫度:20~22℃,相對濕度:40%~60%。1.2藥物中藥處方:實施例2制備的中藥制劑。1.3主要試劑MSCs專用培養液MSCM:美國Sciencell公司;PBS(杭州吉諾生物醫藥技術有限公司,批號13061002);TBD人外周血淋巴細胞分離液:天津灝洋生物有限公司;含0.02%EDTA的胰酶溶液:美國GIBCO公司;β-甘油磷酸鈉、IBMX、地塞米松、吲哚美辛等:美國SIGMA公司;堿性磷酸酶(ALP)染色試劑盒:南京建成生物工程研究所;RNAisoPlus(總RNA提取試劑):大連Takara公司;逆轉錄試劑盒:大連Takara公司;熒光定量試劑盒:大連Takara公司;抗體鼠抗人CD44-FITC、CD29-FITC、CD34-PE、CD166-PE等:美國Biolegend公司。鼠抗SDF-1、CXCR4、PI3K、AKT、VEGF:美國CST;二抗:美國CST;抑制劑:AMD3100(CXCR4拮抗劑)、LY294002(PI3K抑制劑)、MK2206(Akt抑制劑):美國selleck公司。1.4主要溶液的配置(1)胎牛血清及補腎活血含藥血清的滅活:接通水浴箱電源,調節溫度控制鈕,當溫度計所示溫度保持在56℃時,將血清瓶放入水浴箱中,定時30分鐘;大瓶血清滅活后,0.22μm微孔濾膜過濾除菌,50ml離心管分裝,-20℃保存備用。(2)PBS液的配制:取市售0.lpm過濾除菌的PBS(pH7.4)500ml,加入青霉素和鏈霉素,使兩者的最終濃度均達到100U/ml,250ml瓶分裝,封口,4℃冰箱冷藏備用。1.5主要儀器超凈工作臺:上海上凈凈化設備有限公司;5%C02恒溫培養箱:美國Thermo公司;電熱恒溫水浴箱:北京長源實驗設備廠;倒置熒光顯微鏡:日本OLYMPUS公司;蒸汽壓力滅菌器:日本SANYO公司;臺式冷凍多用離心機:美國Thermo公司;多功能全波長酶標儀:美國Thermo公司;流式細胞儀:美國BDFACSCantoII;細胞培養瓶培養板:Corning公司;移液器(1mL,200μL,20μL,2μL):Discovery。2.實驗方法2.1血含藥血清的制備將實施例1-3制備的中藥制劑分別為組1-組3,組4為對照組。選清潔級雄性荷蘭兔,2-3Kg。組1將實施例1方法制備的中藥制劑570g加入30ml去離子水制成中藥液300ml,取20ml(高劑量,相當于生藥量1.9g/ml)中藥液灌胃雄性荷蘭兔;組2將實施例2制備的中藥制劑392g加入100ml去離子水制成中藥液300ml,取20ml(中劑量,生藥量1.4g/ml)中藥液灌胃雄性荷蘭兔;組3將實施例3制備的中藥制劑252g加入180ml去離子水制成中藥液300ml,取20ml中藥液灌胃雄性荷蘭兔(低劑量,生藥量0.9g/ml)。對照組每次灌胃生理鹽水20ml,每天2次,共7天;組1-組3每次灌胃20ml,每天2次,共7天。從實驗第4天起,每天對各兔在第二次灌胃2小時后耳靜脈取10ml全血,后立即離心,每組得到約5ml血清。將4次血清混合后,每組共得到約20ml血清,置于水浴箱中56℃,30min滅活,0.22μm過濾器過濾除菌,分別獲得含藥血清(高、中、低劑量),分裝至15ml離心管中,-20℃冷藏備用。2.2細胞系制備2.2.1健康供者入選標準取健康骨髓干細胞捐獻者6例作為正常對照組,其中男3名,女3名,中位年齡29歲(23~48)。所有志愿者均知情同意,簽署知情同意書。2.2.2再障患者入選標準選取2014年6月1日至2014年10月31日我院血液內科住院及門診的再生障礙性貧血患者10例,其中男5例,女5例,中位年齡26歲(18~56),病例診斷均符合張之南主編《血液病診斷及療效標準》(第三版)。所有病例均知情同意,簽署知情同意書。2.2.3骨髓MSCs的分離和培養常規抽取健康供者或重型再障患者骨髓5ml-10ml,緩慢加入含有7ml人淋巴細胞離液(比重為1.077)的離心管中,1500轉/分離心15min,吸取中間的環狀乳白色單核細胞層,置PBS中洗滌3次,洗滌后將細胞用MSCs專用培養液接種于25cm2培養瓶中,在37℃、5%CO2細胞培養箱中培養,72h后首次換液以純化細胞,以后每隔3d換液1次,待細胞融合率達80%以上時傳代培養,傳至3代備用。2.3細胞表面標志鑒定取傳至第3代生長狀況較好的細胞,用含0.02%EDTA的胰蛋白酶溶液消化,800轉/分離心5min棄上清,加入1mlPBS,調整細胞濃度至2×105個細胞/管,800轉/分離心5min棄上清,各樣本中加入100μlPBS,輕彈混勻,加入抗體CD44-FITC、CD29-FITC、CD34-PE、CD166-PE各10ul,室溫避光孵育30min,加入500μlPBS洗滌,800轉/分離心5min棄上清,加入300μlPBS終止反應,輕彈混勻,流式細胞儀檢測分析,結果見圖1。2.4定向誘導MSCs向成骨細胞分化的方法與鑒定收集消化后細胞,按3000cells/cm2接種于6孔板,待多數細胞貼壁后,換用含10%FBS的高糖DMEM培養液,加入成骨誘導體系(終濃度):地塞米松0.1μmol/L、β-甘油磷酸鈉10mmol/L、抗壞血酸磷酸鹽50μmol/L,每3天全量換液,維持2-3周。用堿性磷酸酶試劑盒染色。堿性磷酸酶(AP)染色:未分化細胞染色為藍/紫色,分化的細胞染色為無色,結果見圖2。2.5MTT法測含藥血清對MSCs增殖的影響取生長狀態良好的第3代MSCs,以5×103個細胞/孔的密度接種于96孔板中,每孔200μl,設實驗組與對照組。選取步驟2.1制備的含藥血清,加入無血清DMEM培養液(血清終濃度分別為5%、10%、15%、20%、25%),對照組則加入空白對照組血清,每組5個復孔,分別37℃,5%CO2培養24h、48h、72h后,加入MTT溶液10μl/孔,5%CO2,37℃細胞培養箱內培養4h,取出96孔板,吸出MTT,加入二甲基亞砜(DMSO)150μl,置搖床上低速震蕩10min,在酶標儀570nm波長處檢測吸光度(OD)值。2.6實驗分組及藥物處理方法將經鑒定的MSCs適當條件下培育,傳代至3代后,隨機分為:(A)SDF-1誘導陽性對照組:常規培養MSCs細胞系,生長至80%融合后,換用無血清DMEM培養基,加入終濃度為100ng/mlSDF-1繼續培養48h;(B)空白對照組:常規培養MSCs細胞系,生長至80%融合后,換用無血清DMEM培養基繼續培養48h;(C)含藥血清干預組:常規培養MSCs細胞系,生長至80%融合后,換用含有體積濃度15%含藥血清(高、中、低劑量)的DMEM培養基,繼續培養48h,分別為C1,C2,C3組;(D)含藥血清干預組+AMD3100+LY294002+MK2206:常規培養MSCs細胞系,生長至80%融合,以1μg/mlAMD3100預處理2h、1μmol/LLY294002預處理4h、200μmol/LMK2206預處理6h后,含有15%含藥血清(高、中、低劑量)的DMEM培養基繼續培養48h,分別為D1,D2,D3組;(E)含藥血清干預組+LY294002+MK2206:常規培養MSCs細胞系,生長至80%融合,以1μmol/LLY294002預處理4h、200μmol/LMK2206預處理6h后,含有15%含藥血清(高、中、低劑量)的DMEM培養基繼續培養48h,分別為E1,E2,E3組;(F)補腎活血含藥血清干預組+MK2206:常規培養MSCs細胞系,生長至80%融合,以200μmol/LMK2206預處理6h后,含有15%含藥血清(高、中、低劑量)的DMEM培養基繼續培養48h,分別為F1,F2,F3組。2.6.1ELISA法測VEGF、PECAM-1、VCAM-1胰酶消化各組經相應藥物處理備用的MSCs,收集細胞,3000r/min,10min離心,收集上清,按ELISA試劑盒說明書檢測標準品及細胞上清液中VEGF、PECAM-1、VCAM-1的吸光度值(OD值),并繪制標準曲線,最終計算得各濃度處理后各細胞因子濃度。具體步驟如下:(1)按試劑說明配置Washingbuffer、Cytokinestandard、Biotinylatedantibody、Streptavidin-HRP等溶液;(2)各試劑使用前,將其充分混勻,且避免產生泡沫;(3)根據實驗孔(空白和標準品)數量,確定所需的板條數目。樣品(含標準品)和空白孔都應做復孔。為避免操作時間所致誤差,每次實驗板板條數不宜太多。(4)加樣:標準品孔加入稀釋后的Cytokinestandard,樣品孔加入樣品,空白對照孔加入DilutionbufferR(1×),各100μL/well。(5)加檢測抗體:每孔快速而準確地加入50μL稀釋后的Biotinylatedantibody。混勻,蓋上封板膜,室溫(18-25℃)孵育2h。(6)洗板:倒去孔內液體,每孔300μL加入1×washingbuffer;作用1min左右后棄去孔內液體,在干凈濾紙上拍干,重復3次此操作過程。(7)加酶反應物:每孔內快速準確加入100μLStreptavidin-HRP,蓋上封板膜,室溫(18-25℃)孵育20min。(8)洗板:與步驟6方法相同。(9)顯色:每孔快速加入100μLTMB顯色液,室溫(18-25℃)避光孵育5-30min之間,根據孔內顏色的深淺(深藍色)來判定終止反應。通常顯色在10-20min可以達到很好的效果。(10)終止反應:根據步驟9中標準孔顯色效果,確定終止反應時間后,迅速加入Stopsolution100μL/well終止反應。(11)讀板:終止反應后10分鐘內,使用酶標儀雙波長即檢測波長(measurementwavelength)450nm,參考波長或校正波長(referencewavelength)610-630nm同時讀板,讀取OD值。2.6.2實時熒光定量PCR法測VEGFmRNA表達(1)細胞總RNA的提取①用細胞刮刮下細胞,PBS沖洗后1000rpm,離心5分鐘,得到細胞沉淀;②倒掉PBS,并加入1ml的Trizol,劇烈震蕩,室溫放置5min;③加入0.2ml的氯仿,蓋好后漩渦劇烈震蕩15秒,室溫放置2-3分鐘,然后離心12,000rpm,15min,4℃。離心后分成三層,下面的紅色為酚-氯仿相,一個中間層,一面是無色的水相。RNA只存在于水相中;④將上層水相轉移到另一干凈的EP管中,加入等體積的異丙醇,靜置30mins,-20℃,然后離心12,000rpm,15min,4℃;⑤去上清,加入1ml75%乙醇水溶液洗滌RNA沉淀,振蕩器混勻,離心7,500g,5min,4℃;⑥去上清,置真空或空氣中5-10分鐘,干燥RNA沉淀,(不能在真空中離心干燥)。注意不能將RNA沉淀完全干燥,這樣會極大地降低它的溶解度;⑦根據沉淀的量加入適量的RNasefree水溶解RNA,分裝RNA液,保留一管測定RNA濃度、純度及用于逆轉錄,其余RNA保存于-70℃冰箱中。(2)cDNA的合成cDNA合成的操作步驟按TAKARA公司產品說明進行,具體方法如下:表9逆轉錄反應體系試劑使用量5×PrimeScriptBuffer(forRealTime)4μLPrimeScriptRTEnzymeMix11μLOligodTPrimer(50uM)1.5μLRandom6mers(100uM)1.5μLTotalRNA≤1μgRNaseFreedH2Oupto20μL將已加好的逆轉錄體系加入無RNase的PCR管內,設置逆轉錄條件為:37℃15min,85℃5s。cDNA放至-20℃冰箱保存,備用。(3)RealTimePCR檢測操作按照TAKARA公司熒光定量試劑盒說明書進行,將cDNA用熒光定量PCR儀進行擴增,在冰上進行操作。按表格各組份配置逆轉錄反應液。表10實時熒光定量PCR反應體系(4)引物設計選取GAPDH為內參基因,打開引物管子前,12000rpm,4℃離心10min,再慢慢打開管蓋,用DEPC水將引物配置成100μmol/L的貯存液,上下振蕩10min,充分混勻,-20℃保存,用DEPC水將引物稀釋成10μmol/L的工作液,進行PCR反應,引物序列如下:表11mRNA引物序列PCR擴增條件:95℃預變性30s;95℃變性5ec;60℃退火30s,循環40次。PCR產物分析:根據Ct值,通過2-△△Ct法計算各個基因的相對表達量。2.7數據統計學處理所有計量數據均采用表示,用SPSS19.0軟件進行統計,采用ANOVA方差分析,方差齊性用LSD方法,方差不齊用Tamhane,sT2方法,P<0.05表示顯著差異;圖標繪制采用GraphPadPrism5.0軟件。二、實驗結果1.骨髓MSCs的鑒定1.1MSC表面抗原的檢測結果提示:MSCs高表達間質細胞標記CD105(96.7%)、CD29(98.4%)、CD73(99.6%)、CD166(61.2%),不表達造血細胞標記CD34(0.2%)、CD45(2.4%)、HLA-DR(1.4%),CD44(0.1%),如圖1。1.2不同濃度含藥血清對MSCs細胞增殖的影響結果表明,不同濃度的補腎活血含藥血清對MSCs的增殖促進作用有差異。與生理鹽水組相比較,含藥血清作用24h無明顯差異;而在作用48h后增殖作用最強(P<0.05),尤以15%的血清濃度下的細胞增殖最明顯,但在作用72h后OD值無明顯增加,表明細胞增殖無時間依賴性。而25%的濃度OD值有所下降,表明高濃度的血清對細胞增長具有抑制作用。據此結果,我們選取15%的補腎活血含藥血清濃度作用48h行進一步研究。表12不同濃度含藥血清對細胞增殖作用比較(x±s,n=5)注:與正常對照組比較:*P<0.05。2.ELISA(VEGF、PECAM-1、VCAM-1)結果依據說明書要求繪制各細胞因子標準曲線圖,根據ELISA標準孔的結果作半對數曲線,并行相關性檢驗,得出回歸方程,其中Y軸為細胞因子標準濃度,X軸為檢測OD值。各細胞因子具體回歸方程及R2值見表13。表13各細胞因子標準曲線方程與B組相比,A、C組中VEGF、PECAM-1、VCAM-1細胞因子表達水平均升高(P<0.05);與C組相比,D、E、F組VEGF、PECAM-1、VCAM-1細胞因子表達減少(P<0.05),尤以D組明顯減少(P<0.05)。F組與C組相比,PECAM-1表達差異無顯著性差異(P>0.05)。C、D、E、F各亞組間無顯著性差異。具體結果見表14和圖2。表14各組上清液中細胞因子比較(n=3)注:(1)A:SDF-1陽性對照組,B:空白對照組;C:中藥組,D:中藥+Akt抑制劑+PI3K抑制劑+CXCR4抑制劑組;E:中藥+Akt抑制劑+PI3K抑制劑;F:中藥+Akt抑制劑;C、D、E、F組按照中藥組方不同,分為高中低三個劑量的亞組。(2)與空白對照組比較:*P<0.05;與中藥干預組比較:#P<0.053.RT-PCR中VEGFmRNA表達量各組的上清液的VEGF基因擴增良好,引物特異性好,見表15。與B組相比,A、C組VEGFmRNA表達量升高(P<0.05),而A、C兩組間無明顯差異(P>0.05);E、F組VEGFmRNA表達與空白對照組相比無顯著增加(P>0.05);與C組相比,D、E、F組的VEGFmRNA表達均有下調(P<0.05),尤以D組有顯著下降(P<0.05);E組與F組相比無顯著性差異(P>0.05)。C、D、E、F各亞組間無顯著性差異。表15各組上清液中VEGFmRNA表達(n=3)與空白對照組比較:*P<0.05;與含藥血清組(C1~C3組)比較:#P<0.05;與陽性對照組比較:△P<0.05。(三)補腎活血法對再生障礙性貧血小鼠造血功能和骨髓MSCs功能的影響一)實驗材料與方法1.實驗動物Balb/c小鼠(雌性)6-8周齡,92只,16~20g。DBA/2小鼠(雌性)6-14周齡,6只,18~20g。均購于上海斯萊克實驗動物有限責任公司。2.實驗藥品中藥為實施例2制備的中藥制劑,生藥量1.4g/ml。AMD3100(CXCR4拮抗劑)(美國selleck公司)、LY294002(PI3K抑制劑)(美國selleck公司)、MK2206(Akt抑制劑)(美國selleck公司)、環孢素(NovartisPharmaSteinAG)3.實驗器材(1)試劑盒:RT-PCR(TaKaRa試劑盒RR047A)、SP-9001(中杉金橋)、DAB(中杉金橋)等(2)主要儀器SteponeplusPCR儀(ABI美國生物應用系統公司)、-20℃低溫冰箱、顯微鏡(日本奧林巴斯BX51T-PHD-J11)、CMOS(日本奧林巴斯)、切片機(德國萊卡RM2015)、HD-330型攤片機(湖北慧達儀器有限公司)、干燥箱(日本三洋MIR-153型)、全自動血細胞分析儀(BeckmanCoulterGen.S)、LDZ5-2型低速自動平衡離心機、微量移液器、小試管、離心管、玻璃器皿、EDTA管、注射器、灌胃針、電子天平、解剖刀等。4.實驗方法(1)建立免疫介導型再生障礙性貧血(AA)小鼠模型選用Balb/c小鼠80只,用免疫介導法建立AA模型。實驗前期完善了免疫介導小鼠再障模型的造模流程,目前能穩定可靠的重復免疫介導小鼠再障模型的制作,造模成功后的再障小鼠其血三系一直低下,觀察至造模后4-6周,發現其血三系在造模后的第四周有恢復跡象,為動物實驗打好了基礎工作。具體造模方法:將Balb/c小鼠(16-20g)固定在大小合適的容器內,互不干擾。以源皮距100cm,距床高3.7cm的位置,全身照射。6.0Gy的60Co-γ射線,劑量率1.0Gy/min,照射360秒,誤差±5%。取DBA/2小鼠(6-14周齡)6只,斷頸處死,用75%酒精浸泡消毒5分鐘。用鑷子把小鼠的毛翻起來,使酒精直接與皮膚接觸,把毛內的微生物殺死。開腹前需要把腹部切口周圍的毛剪去。無菌環境下取出小鼠胸腺,加RPMI-1640培養液清洗,用剪刀將胸腺反復剪切成糊狀,輕輕研磨后用200目銅網過濾,無菌NS洗滌2遍,成為單細胞懸液。取1滴苔盼藍滴入玻片上鑒定淋巴細胞活性在95%以上。經血細胞計數板計數后,用NS配成濃度為5×106細胞/ml(1*106個/0.2ml)濃度放入無菌玻璃瓶中備用,瓶口及瓶蓋均至酒精燈消毒,無菌紗布包扎封口。在60Co-γ射線照射后4小時內經Balb/c小鼠尾靜脈注入上述細胞懸液0.2ml/只。飼養于無菌環境下,每日觀察小鼠活動、進食、毛發等情況。7天左右小鼠眼眶取血,血常規可見白細胞、血紅蛋白、血小板等均有不同程度下降,以白細胞、血小板為著,提示造模成功。(2)實驗分組及給藥方法將造模成功的72只小鼠隨機分為6組:(A)模型對照組12只,PBS0.2ml/d,腹腔注射;(B)環孢素對照組12只,環孢素0.2ml/d(0.5mg/ml),腹腔注射;(C)中藥組12只,0.2ml/d,灌胃;PBS0.2ml/d,腹腔注射;(D)中藥+AMD3100組(CXCR4拮抗劑)12只,中藥0.2ml/d,灌胃;AMD31000.2ml/qod(5mg/kg)腹腔注射;(E)中藥+AMD3100(CXCR4拮抗劑)+LY294002(PI3K抑制劑)組12只,中藥0.2ml/d,灌胃;AMD31000.1ml/qod(5mg/kg),LY2940020.1ml/qod(10mg/kg)腹腔注射;(F)中藥+AMD3100(CXCR4拮抗劑)+LY294002(PI3K抑制劑)+MK2206(Akt抑制劑)組12只,中藥0.2ml/d,灌胃;AMD31000.1ml/qod(5mg/kg),LY2940020.1ml/qod(10mg/kg),MK22060.1ml/qod(5mg/kg)腹腔注射。(G)正常組12只,生理鹽水0.2ml/d灌胃,同時給予0.1ml生理鹽水腹腔注射。(3)觀察指標及測定記藥物干預為d0,于d1(輻照后7天)將全部Balb/c小鼠眼眶取血3-5滴。經血細胞計數儀測血常規。分別于d6、d12、d18將全部或所剩Balb/c小鼠眼眶取3-5滴全血裝入EDTA管測血常規,并隨機每次向每組取小鼠3只,每組至少共9只,眼眶取血致死,全血裝至1.5mlEP管經離心機離心后留取血清。將小鼠在無菌條件下解剖,取脾臟、左右股骨頭等標本。具體流程如下:a、提前對超凈工作臺進行紫外線照射1小時進行消毒,戴口罩及無菌手套;b、將小鼠尸體用75%酒精浸泡在燒杯中5min;用鑷子把小鼠的毛翻起來,讓酒精直接與皮膚接觸,把毛內的微生物殺死。開腹前需要把腹部切口周圍的毛剪去;c、無菌取出小鼠脾臟、左右股骨頭放入備好的培養皿中,加少量NS除去血污及表面粘附的結締組織;d、將脾臟裝入大小適中的無菌容器內,并放入氮液內保存。將左測股骨頭經RPMI-1640培養液沖洗后,計數有核細胞個數。右側股骨頭放入裝有福爾馬林試劑的EP管備用(病理切片)。分別于治療后d1、d6、d12、d18觀察。①一般狀態觀察:每天觀察有無倦怠、納差、豎毛、出血、腹瀉等表現。②外周血細胞常規檢測:分別于治療后d6、d12、d18用鑷子小鼠眼眶取血,用血細胞分析儀檢測小鼠Hb、WBC和Plt。③骨髓有核細胞計數:在無菌環境下取各組小鼠的左側股骨,使用RPMI-1640培養液沖洗,將沖洗后的骨髓液裝入離心管,加入紅細胞裂解液吹打混勻,放入離心機離心洗滌,分離出單個核細胞,再加入一定量的PBS制成單個核細胞混懸液,使用細胞計數器在顯微鏡下計數。④骨髓病理學檢測:⑴脫蠟和水化;⑵抗原修復(采用高壓熱修復);⑶染色(SP法);⑷脫水,透明,封片,鏡檢。⑥實時熒光定量PCR法測定VEGF、SDF-1、CXCR4、Akt的mRNA表達水平:本RT-qPCR實時熒光定量實驗,采用染料法(SYBRGreenI)進行相對定量分析,實驗設計是按照ΔΔCt解析法來進行設計。A、細胞總RNA的提取a、取小鼠股骨骨髓細胞,PBS沖洗后1000rpm,離心5分鐘,得到細胞沉淀;b、倒掉PBS,并加入1ml的Trizol,劇烈震蕩,室溫放置5min;c、加入0.2ml的氯仿,蓋好后漩渦劇烈震蕩15秒,室溫放置2-3分鐘,然后離心12,000rpm,15min,4℃。離心后分成三層,下面的紅色為酚-氯仿相,一個中間層,一面是無色的水相。RNA只存在于水相中;d、將上層水相轉移到另一干凈的EP管中,加入等體積的異丙醇,靜置30mins,-20℃,然后離心12,000rpm,15min,4℃;e、去上清,加入1ml75%乙醇洗滌RNA沉淀,振蕩器混勻,離心7,500g,5min,4℃;f、去上清,置真空或空氣中5-10分鐘,干燥RNA沉淀,(不能在真空中離心干燥)。注意不能將RNA沉淀完全干燥,這樣會極大地降低它的溶解度;g、根據沉淀的量加入適量的RNasefree水溶解RNA,分裝RNA液,保留一管測定RNA濃度、純度及用于逆轉錄,其余RNA保存于-70℃冰箱中。將已加好的逆轉錄體系加入無RNase的PCR管內,設置逆轉錄條件為:37℃15min,85℃5s。cDNA放至-20℃冰箱保存,備用。B、引物設計引物由TAKARA公司設計合成并質量檢驗:表16mRNA引物序列PCR擴增條件:95℃預變性30s;95℃變性5s;60℃退火30s,循環40次。PCR產物分析:根據Ct值,通過2-△△Ct法計算各個基因的相對表達量。二)統計方法建立SPSS數據庫,數據采用SPSS17.0統計軟件處理。實驗結果采用表示,所有資料進行正態性檢驗:符合正態分布者,采用單因素方差分析,不符合正態分布者,采用秩和檢驗。當P<0.05時,認為組間數據有顯著性差異,有統計學意義。三)實驗結果1.小鼠一般情況一般狀態觀察:每天觀察小鼠精神狀態、體重、納食、毛發、是否出血、大便質量等表現。免疫介入2-3天后(在造模后,輻照3天),小鼠逐漸出現怠倦、豎毛無光澤、納差、體重下降等癥狀,并逐漸加重。后隨著中藥介入時間的不同,小鼠上述癥狀表現與時間長短成反比(詳見表17)。表17小鼠造模前后一般情況變化(出現癥狀只數/總只數)2.血常規分別于藥物治療后第1、6、12、18天小鼠眼眶取血進行血常規測定。結果顯示,急性再障小鼠血常規的白細胞、血紅蛋白、血小板計數比正常對照組減少,以白細胞、血小板減少明顯。經過補腎活血中藥的介入,可以明顯提高急性再障小鼠血常規中白細胞、血紅蛋白、血小板計數,隨著中藥介入的時間的增加,小鼠血細胞計數與正常值越接近。d1,A、B、C、D、E、F各組間無明顯差異(p>0.05),與G組相比,各組間血三系不同程度下降,有統計學意義(p<0.05);d6,d12,d18數據顯示各組間有顯著性差異(p<0.05),與A組相比,B、C組血三系明顯升高(p<0.05),D、E、F組血三系變化無明顯差異(p>0.05);與B組相比,C組血三系變化無明顯差異(p>0.05)。具體見表18、表19、表20、表21。表18治療后d1血常規變化注:與正常組相比,帶*表示P<0.05。表19治療后d6血常規變化注:與模型對照組相比,帶*表示P<0.05。表20治療后d12血常規變化注:與模型對照組相比,帶*表示P<0.05。表21治療后d18血常規變化注:與模型對照組相比,帶*表示P<0.05。3.骨髓有核細胞計數藥物治療后第6、12、18天,予無菌環境下取各組小鼠左側股骨行有核細胞計數。各組骨髓有核細胞計數見下表:表22骨髓有核細胞變化(104個/HP,)注:與模型對照組相比,*表示P<0.05。與環孢素組相比,△表示P<0.05。與正常組相比,#表示P<0.05。通過數據統計分析發現d6、d12、d18各組間骨髓有核細胞計數不全相同(P<0.05),有統計學意義。與G組相比,各組有核細胞均下降,有統計學意義。與A組比較,B、C組有核細胞數明顯增多(P<0.05);d6,D、E、F組有核細胞數明顯少于A組(P<0.05),d12、d18,D、E、F組與A組無顯著性差異(P>0.05)。4.骨髓病理學檢測藥物治療后d6、d12、d18予無菌環境下取各組小鼠右側股骨行HE染色,做骨髓病理檢測。從病理上看,G組小鼠骨髓象增生活躍,各系細胞增生良好,各階段比例及形態正常,微血管面積正常。A、D、E、F組的小鼠骨髓增生明顯減低,粒、紅系及巨核細胞均不同程度減少,淋巴細胞、網狀細胞及漿細胞等非造血細胞比例增高,含較多脂肪滴,微血管面積較少。B組及C組上述病理特征介于G組與A、D、E、F各組之間,提示補腎活血法對骨髓的造血環境及微血管面積的恢復起到一定的作用,間接反映補腎活血法對骨髓MSCs的血管新生功能起促進作用,且可能是通過SDF-1/CXCR4-PI3K/Akt信號通路起作用。見圖3。5.實時熒光定量PCR法測定VEGF、SDF-1、CXCR4和Akt的mRNA表達水平正常組、模型組和各治療組的骨髓MSCs的VEGF、SDF-1、CXCR4和Akt基因擴增良好,引物特異性好,詳見表23。與G組相比,A、B、C、D、E、F各組的VEGFmRNA相對表達量明顯下降(P<0.05),SDF-1、CXCR4、Akt的mRNA相對表達量均升高(P<0.05)。與A組相比,B、C組VEGF、SDF-1、CXCR4、Akt的mRNA表達量均升高(P<0.05),D、E、F組VEGFmRNA表達量無顯著增加(P>0.05),而D、E、F組的SDF-1、CXCR4、Akt的mRNA表達量均有下調(P<0.05);與B組相比,C組VEGF、SDF-1、Akt的mRNA表達量無明顯差異(P>0.05),而CXCR4mRNA表達量升高(P<0.05)。具體見表23。表23各組骨髓MSCs的VEGF、SDF-1、CXCR4和Akt的mRNA相對表達量注:與正常組相比:*表示P<0.05。與模型組相比:#表示P<0.05。與環孢素組相比:△表示P<0.05。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1