一種長循環的氧化石蒜堿有機酸復合物新制劑的制作方法
本發明涉及一種明顯延長氧化石蒜堿體內循環時間和提高生物利用度的氧化石蒜堿有機酸復合物的脂質體制劑及其制備方法和應用,涉及醫藥
技術領域:
。
背景技術:
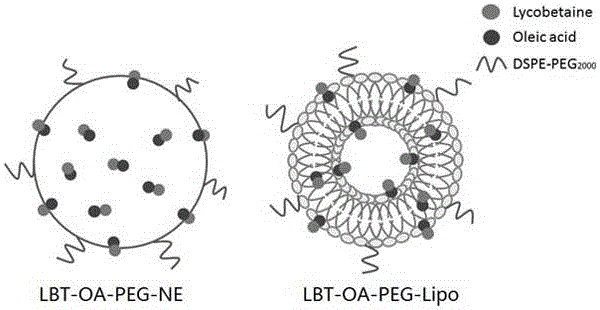
:氧化石蒜堿(Lycobetaine,縮寫LBT),又名恩其明,是一種四級啡啶類生物堿,主要從石蒜科植物中提取得到。氧化石蒜堿醋酸鹽(石蒜內銨)是一種抗腫瘤物質,化學名為2-羥基-9,1-次甲乙氧基-4,5-二氫-吡啶并[3,2,1-de]菲啶醋酸鹽,其結構如下:式1:氧化石蒜堿醋酸鹽的結構氧化石蒜堿作為選擇性拓撲異構酶IIβ抑制劑(BarthelmesHU,NiederbergerE,RothT,etal.LycobetaineactsasaselectivetopoisomeraseIIbetapoisonandinhibitsthegrowthofhumantumourcells.BritJCancer.2001;85(10):1585-1591.),其抑瘤的活性基團是結構中亞甲二氧基和內銨鹽的部分(翁尊堯,王肇瀛,嚴曉明.新抗腫瘤物質——恩其明(ungeremine,AT-1840)及其有關化合物的合成和構效關系.藥學學報,1982,17(10):744-749)。研究表明在多種腫瘤模型中,氧化石蒜堿醋酸鹽對腫瘤生長與生存表現出較好的抑制作用,對胃癌和卵巢癌有明顯的抑制效果。此外,氧化石蒜堿在與其他抗腫瘤藥物聯用,以及放射療法聯用治療過程中,并沒有觀察到化療中常見的骨髓抑制、腸道反應等毒副作用(吳云林,吳裕圻,余春仙等.石蒜堿內銨鹽和細小病毒H-1對胃癌細胞殺傷作用的實驗研究.上海醫學,1988,11(12):683-688.)。氧化石蒜堿也在臨床上進行了抗腫瘤研究,并沒有發現明顯的毒性(胡慶和,林兆翔,何萍等.石蒜內銨(AT-1840)綜合治療婦科晚期惡性腫瘤——附43例總結.浙江中西醫結合雜志,1997,7(3):134-136)。然而近幾年氧化石蒜堿并沒有在臨床上推廣使用,其主要原因是水溶液制劑生物利用度極低,體內半衰期極短,需要多次大劑量給藥以維持藥效,無疑給患者增加了負擔。此外氧化石蒜堿屬于水微溶性藥物,不適宜現有的納米粒、脂質體和納米乳等大部分載體,極大地限制了氧化石蒜堿在臨床中的使用。因此,開發一類新制劑以提高氧化石蒜堿生物利用度,達到更好的抗腫瘤效果,可以為臨床治療提供一個更好的選擇。專利201210252981.X和文獻(ZhaoH,LuH,GongT,ZhangZR.Nanoemulsionloadedwithlycobetaine-oleicacidioniccomplex:physicochemicalcharacteristics,invitro,invivoevaluation,andantitumoractivity.Int.J.Nanomed.2013;8:1959-1973.)提供了一種氧化石蒜堿油酸復合物納米粒制劑,該制劑采用油酸和氧化石蒜堿形成離子對復合物,從而增加藥物的脂溶性。再將復合物載入納米粒中,延長了藥物體內循環時間,提高了藥物的生物利用度,并顯著增加了氧化石蒜堿的抗癌活性。不過此制劑也只能延長氧化石蒜堿在體內循環時間到10小時左右,大鼠體內藥動學實驗表明,10小時左右血漿中氧化石蒜堿濃度下降到一個很低的水平。這一結果提示我們,延長氧化石蒜堿的體內循環時間應該是提高其療效的可行方法。綜上所述,一種能更好延長氧化石蒜堿體內循環時間,提高藥物生物利用度的新制劑是需要的。此新制劑的研發將有助于減輕患者的負擔,為社會創造更多的價值。技術實現要素:本發明的目的之一,提供一種新型的氧化石蒜堿有機酸離子對的脂質體制劑。本發明的目的之一,提供一種長循環的氧化石蒜堿有機酸離子對的脂質體制劑。相較于專利201210252981.X中氧化石蒜堿油酸離子對納米粒,有著更明顯的緩釋效果。本發明的目的之一,提供一種長循環的,能明顯提高氧化石蒜堿生物利用度,減少給藥頻率,延長給藥間隔,利于臨床使用的脂質體。發明人在實驗研究中,意外地發現,將氧化石蒜堿有機酸離子對制備成脂質體,其在體內的循環時間顯著長于已有的納米制劑。實驗結果表明,將氧化石蒜堿親脂化處理后,才能制備較高包封率、粒徑均勻、穩定性良好的氧化石蒜堿脂質體制劑。本發明將制備出較高脂溶性的氧化石蒜堿有機酸復合物,采用適當的有機溶劑將其與磷脂及其他表面活性劑等溶解作為油相,水作為水相,旋轉蒸發除去有機溶劑后,用水水化薄膜得混懸液,高壓均質制成脂質體,即得可以靜脈注射的脂質體制劑。本發明人研究發現,載氧化石蒜堿的脂質體比載氧化石蒜堿納米粒制劑有著更小的粒徑、更高的包封率。此外,載藥的脂質體還有著更慢的釋藥特性,更長的循環時間,以及更高的生物利用度的特點,表現出載藥脂質體的明顯優勢。本發明提供的脂質體粒徑在約10-500nm,優選在50-300nm。本發明的目的之一是提供了一種氧化石蒜堿有機酸復合物的脂質體,主要由氧化石蒜堿和有機酸形成的復合物、表面活性劑制成,其中氧化石蒜堿、有機酸、表面活性劑的重量份為氧化石蒜堿1份,有機酸1~10份,表面活性劑2~20份;優選地,氧化石蒜堿1份,有機酸1~5份,表面活性劑5~18份。本發明所述的有機酸是八個碳原子以上的有機酸類。本發明所述的有機酸選自中長鏈脂肪酸包括油酸、亞油酸、亞麻酸、硬脂酸、軟脂酸、反式維甲酸、辛酸中的一種或多種的混合物,優選油酸;也可以選自膽酸類有機酸包括膽酸、脫氧膽酸、熊去氧膽酸、牛去氧膽酸、鵝去氧膽酸、豬去氧膽酸、熊去氧膽酸、奧貝膽酸、甘氨膽酸、牛黃膽酸、石膽酸中的一種或多種的混合物。若有機酸為不溶于水的固體,可以加入含有機酸的有機溶劑溶液,所述有機溶劑自乙醇、甲醇、丙酮、乙腈、四氫呋喃、二甲基亞砜、N,N-2-甲基甲酰胺中的一種或者多種混合物,優選乙醇;所述有機溶劑為適量添加。本發明優選油酸作為氧化石蒜堿有機酸復合物的成分。油酸(oleicacid)學名為順-9-十八烯酸,是一種不飽和脂肪酸。本發明所述的氧化石蒜堿有機酸復合物脂質體制劑制備過程中加入適量的表面活性劑,選自大豆卵磷脂、蛋黃卵磷脂、二棕櫚酰基卵磷脂、二油酰基卵磷脂、棕櫚酰溶血卵磷脂、肉豆蔻酰溶血卵磷脂、硬脂酰溶血卵磷脂、二肉豆蔻酰基卵磷脂、1-棕櫚酰基-2-油酰基卵磷脂、二芥酰基卵磷脂、雙鯨蠟磷脂酰、硬脂磷脂酰、磷脂酸、二棕櫚酰磷脂酸、二棕櫚酰膽堿、二硬脂酰膽堿、磷脂酰膽堿、二肉豆蔻磷脂酰膽堿、二硬脂酰基磷脂酰膽堿、磷脂酰肌醇、磷脂酰乙醇胺、二芥酰基磷脂酰乙醇胺、二肉豆蔻酰基磷脂酰乙醇胺、二硬脂酰基磷脂酰基乙醇胺、二棕櫚酰基磷脂酰基乙醇胺、二油酰磷脂酰基乙醇胺、磷脂酰絲氨酸、二油酰基磷脂酰絲氨酸、膽固醇、膽固醇硫酸鈉鹽、磷脂酰甘油、二油酰磷脂酰甘油、蛋黃磷脂酰甘油、1-棕櫚酰基-2-油酰基磷脂酰甘油、1,2-棕櫚酰磷脂酰甘油、二硬脂酰磷脂酰甘油、二肉豆蔻酰磷脂酰甘油、PEG化磷脂、二棕櫚酰磷脂酰乙醇胺-聚乙二醇、二硬脂酰基磷脂酰乙醇胺-聚乙二醇、二硬脂酰磷脂酰乙醇胺-疊氮聚乙二醇、二肉豆蔻酰基磷脂酰乙醇胺-聚乙二醇等類似化合物的一種或者多種混合物;優選大豆卵磷脂和膽固醇混合物,兩者含量配比優選為1:1~5:1,更優選為2:1;或優選大豆卵磷脂、膽固醇和DSPE-PEG2000混合物,三者含量配比優選為2:1:1~2:1:0.1,更優選為2:1:0.27。當表面活性劑選自大豆卵磷脂、膽固醇和DSPE-PEG2000混合物時,本發明得到PEG化的氧化石蒜堿有機酸復合物的脂質體。本發明的目的之一是提供了一種氧化石蒜堿有機酸復合物脂質體的制備方法,其特性包括下述步驟:(1)取氧化石蒜堿的藥學上可接受的鹽溶于水中,先用堿性物質中和其對應的酸之后;再加入有機酸混合,形成氧化石蒜堿有機酸復合物;其中,若有機酸為不溶于水的固體,可以加入含有機酸的有機溶劑;(2)冷凍干燥步驟(1)得到氧化石蒜堿有機酸復合物,再加入適當的有機溶劑溶解上述復合物,得溶液;(3)根據表面活性劑的溶解特性,用水或者有機溶劑溶解,得溶液;(4)將溶液和溶液混合均勻,減壓蒸發除去有機溶劑;(5)再將其與水相混合后,薄膜水化得混懸液;(6)將步驟(5)中所述的混懸液均化制得氧化石蒜堿有機酸復合物脂質體。其中,步驟(1)中的堿性物質主要是用于中和氧化石蒜堿的藥學上可接受鹽中的酸根,獲得藥物分子形式游離堿。本發明所述的氧化石蒜堿主要是由氧化石蒜堿的藥學上可接受的鹽進行脫鹽反應而得,例如,氧化石蒜堿醋酸鹽與堿性物質反應而得。所述堿性物質選自氫氧化鉀、碳酸鉀、碳酸氫鉀、枸櫞酸鉀、氫氧化鈉、碳酸鈉、碳酸氫鈉、枸櫞酸鈉、三乙胺、單乙醇胺、二乙醇胺、氨水,或是兩種或多種堿性物質的混合物。步驟(1)所述堿性物質優選碳酸氫鈉,其加入量是本領域的常規選擇。優選堿性物質中和對應的酸的時間為5分鐘。優選的有機酸為油酸。優選油酸與氧化石蒜堿混合時間為30分鐘。步驟(2)中的有機溶劑選自氯仿、二氯甲烷、乙酸乙酯、乙醇、甲醇、四氫呋喃、乙腈、丙酮、乙醚、正己烷、正庚烷、脂肪烴、芳香烴、鹵代烴及其混合物,以及2種或2種以上這些溶劑的混合物或類似溶劑,優選二氯甲烷。步驟(3)中若表面活性劑溶于水中,則在步驟(4)中不需要將溶液進行旋蒸,將溶液作為步驟(5)中的水相進行混合。步驟(3)所述的表面活性劑優選大豆卵磷脂S100和膽固醇的混合物,或大豆卵磷脂、膽固醇和DSPE-PEG2000混合物。此外,有機溶劑于減壓下蒸發。蒸發方法包括使用旋轉蒸發器、降膜蒸發器、噴霧干燥器、冷凍干燥器和類似設備。本發明優選旋轉蒸發器。步驟(6)中所述的制備氧化石蒜堿有機酸復合脂質體方法是在高壓和高剪切條件下經均化作用形成的。可接受的均化方法包括選自高壓乳勻機、高壓微射流均質機、高剪切混合器、超聲處理器、高剪切攪拌器和類似設備。這種均化作用優選在高壓乳勻機內進行,典型的操作壓力是3000~30000psi的范圍內,優選的壓力在5000~15000psi的范圍。其優選的方案如下:(1)取氧化石蒜堿的藥學上可接受的鹽溶于水中,先用碳酸氫鈉中和其對應的酸之后;再加入油酸混合,形成氧化石蒜堿油酸復合物;(2)冷凍干燥步驟(1)得到氧化石蒜堿油酸復合物,再加入適當的二氯甲烷溶解上述復合物,得溶液;(3)根據卵磷脂、膽固醇(以及DSPE-PEG2000)的溶解特性,用二氯甲烷溶解,得溶液;(4)將溶液和溶液混合均勻,減壓蒸發除去有機溶劑;(5)再將其與水相混合后,薄膜水化得混懸液;(6)將步驟(5)中所述的混懸液經高壓均質在5000~15000psi的壓力下制得氧化石蒜堿油酸復合物脂質體。本發明的目的之一,提供了氧化石蒜堿有機酸復合物脂質體在制備抑制腫瘤生長的藥物中的應用。本發明的目的之一,提供了氧化石蒜堿有機酸復合物脂質體在制備治療腫瘤的藥物中的應用。本發明的目的之一,提供了氧化石蒜堿有機酸復合物脂質體在制備抑制胃癌、卵巢癌、肺癌、乳腺癌和淋巴癌生長的藥物中的應用。本發明的目的之一,提供了氧化石蒜堿有機酸復合物脂質體在制備治療胃癌、卵巢癌、肺癌、乳腺癌和淋巴癌的藥物中的應用。本發明通過制備氧化石蒜堿有機酸復合物脂質體制劑,并與之前的氧化石蒜堿油酸復合物納米粒制劑進行了對比,用相應的體內實驗證明所制備的氧化石蒜堿有機酸復合物脂質體較氧化石蒜堿油酸復合物納米粒,提高了藥物的生物利用度,延長體內循環時間。下面再以實施實例對本發明加以進一步說明,同時也結合實施例中附圖加以說明,但絕不是對本發明的范圍限制。有益效果(1)本發明的脂質體,有較高的包封率,有較好的水溶性、生物相容性和生物可降解性;(2)本發明的脂質體,粒徑可以通過處方篩選得到10-500nm的脂質體;(3)本發明的脂質體具有更明顯的緩釋效果和體內血液循環時間;(4)本發明的制備工藝簡單,可控,有機溶劑殘留少。附圖說明以下,結合附圖來詳細說明本發明的實施方案,其中:圖1為氧化石蒜堿油酸復合物脂質體和PEG化氧化石蒜堿油酸復合物脂質體的透射電鏡圖以及粒徑分布情況。標尺:200nm圖2為實施例1和2中制劑以及載LBT的納米粒制劑的體外釋放實驗結果。圖3為實施例1和2中制劑以及載LBT的納米粒制劑的血清穩定性試驗結果。圖4為實施例1和2中制劑以及載LBT的納米粒制劑的藥動學實驗結果。圖5為PEG化氧化石蒜堿油酸復合物納米粒和PEG化氧化石蒜堿油酸復合物脂質體結構示意圖。具體實施方式以下實施例是對本發明的進一步說明,但絕不是對本發明范圍的限制。下面參照實施例進一步詳細闡述本發明,但是本領域技術人員應當理解,本發明并不限于這些實施例以及使用的制備方法。而且,本領域技術人員根據本發明的描述可以對本發明進行等同替換、組合、改良或修飾,但這些都將包括在本發明的范圍內。實施例1取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入油酸30mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,油酸約30mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑200nm,即得氧化石蒜堿油酸復合物脂質體。實施例2取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入油酸30mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,油酸約30mg,DSPE-PEG20008mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑140nm,即得PEG化氧化石蒜堿油酸復合物脂質體。實施例3取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入油酸30mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,油酸約30mg,DSPE-PEG50008mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑158nm,即得PEG化氧化石蒜堿油酸復合物脂質體。實施例4取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入油酸30mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,油酸約30mg,DPPE-PEG20008mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑155nm,即得PEG化氧化石蒜堿油酸復合物脂質體。實施例5取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入油酸10mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,油酸約10mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑210nm左右,即得氧化石蒜堿油酸復合物脂質體。實施例6取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入油酸100mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,油酸約100mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑220nm左右,即得氧化石蒜堿油酸復合物脂質體。實施例7取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入硬脂酸10mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿硬脂酸復合物,其中氧化石蒜堿約10mg,硬脂酸約10mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑170nm左右,即得氧化石蒜堿硬脂酸復合物脂質體。實施例8取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入硬脂酸100mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿硬脂酸復合物,其中氧化石蒜堿約10mg,硬脂酸約100mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑270nm左右,即得氧化石蒜堿硬脂酸復合物脂質體。實施例9取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入脫氧膽酸10mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,脫氧膽酸約10mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑307nm左右,即得氧化石蒜堿脫氧膽酸復合物脂質體。實施例10取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入脫氧膽酸100mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,脫氧膽酸約100mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑400nm左右,即得氧化石蒜堿脫氧膽酸復合物脂質體。實施例11取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入辛酸30mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,辛酸約30mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑280nm左右,即得氧化石蒜堿辛酸復合物脂質體。實施例12取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入油酸30mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,油酸約30mg,再加入注射用蛋黃卵磷脂60mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑204nm左右,即得氧化石蒜堿油酸復合物脂質體。實施例13取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入油酸30mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,油酸約30mg,再加入注射用蛋黃卵磷脂30mg,大豆卵磷脂30mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑200nm左右,即得氧化石蒜堿油酸復合物脂質體。實施例14取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的Na2CO3溶液,強力渦旋5分鐘,加入油酸30mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,油酸約30mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑210nm左右,即得氧化石蒜堿油酸復合物脂質體。實施例15取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的KHCO3溶液,強力渦旋5分鐘,加入油酸30mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,油酸約30mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑212nm左右,即得氧化石蒜堿油酸復合物脂質體。實施例16取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的K2CO3溶液,強力渦旋5分鐘,加入油酸30mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,油酸約30mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用二氯甲烷將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑200nm左右,即得氧化石蒜堿油酸復合物脂質體。實施例17取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入油酸30mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,油酸約30mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用甲醇將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑205nm左右,即得氧化石蒜堿油酸復合物脂質體。實施例18取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入油酸30mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,油酸約30mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用氯仿將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑210nm左右,即得氧化石蒜堿油酸復合物脂質體。實施例19取10mg氧化石蒜堿醋酸鹽,超聲溶解在水中,得到濃度為1~2mg/ml的氧化石蒜堿醋酸水溶液。加入適量50mg/ml的NaHCO3溶液,強力渦旋5分鐘,加入油酸30mg,渦旋30分鐘,10000rpm離心5分鐘,取復合物沉淀凍干。凍干后取適量的氧化石蒜堿油酸復合物,其中氧化石蒜堿約10mg,油酸約30mg,再加入注射用大豆卵磷脂60mg,膽固醇30mg,用乙酸乙酯將其溶解,混合均勻后,旋蒸除去有機溶劑。加入適量注射用水,37℃搖床水化脫膜后,將水化液在高壓乳勻機內乳勻7個循環,粒徑215nm左右,即得氧化石蒜堿油酸復合物脂質體。實驗例1測定普通氧化石蒜堿油酸復合物脂質體(LBT-OA-Liposome)和PEG化氧化石蒜堿油酸復合物脂質體(LBT-OA-PEG-Liposome)的形態和粒徑。將實施例1和2中的脂質體稀釋成脂質濃度為3mg/ml,于透射電鏡下觀察兩種脂質體的形態。采用激光粒度分析儀測定制劑的粒徑和電位。圖1為LBT-OA-Liposome和LBT-OA-PEG-Liposome的透射電鏡圖以及粒徑分布情況。標尺:200nm。表示結果表明,LBT-OA-Liposome和LBT-OA-PEG-Liposome有明顯的磷脂雙分子層結構,外觀圓整,粒徑均一。LBT-OA-Liposome粒徑在200nm左右,LBT-OA-PEG-Liposome粒徑在140nm左右,如表1。表1:脂質體的性質(n=3)Size(nm)PDIZetapotential(mV)LBT-OA-Lipo200.97±7.940.278±0.012-31.3±1.5LBT-OA-PEG-Lipo139.03±5.390.231±0.012-26.4±0.5實驗例2LBT-OA-Lipo和LBT-OA-PEG-Lipo的包封率測定。專利文獻201210252981.X中制備出了一種新型的氧化石蒜堿油酸復合物納米粒(LBT-OA-NE)和PEG化的氧化石蒜堿油酸復合物納米粒(LBT-OA-PEG-NE)。本文后續實驗例中將載氧化石蒜堿的納米粒同本發明研究中的載氧化石蒜堿脂質體進行對比。用超濾法和葡聚糖凝膠柱層析法測定四個制劑的藥物包封率。超濾法:取四個制劑各0.4ml于截留分子量為3000的超濾管中,4000rpm離心15分鐘后,各取一定量的濾液稀釋,采用熒光分光光度計測定藥物的含量,計算包封率。柱層析法:將葡聚糖凝膠G-50用水飽和后,填滿裝柱,各取1ml制劑,利用紫外檢測器進行檢測,收集制劑部分的分離液,取一定量稀釋,測定藥物濃度,計算包封率。結果如表2。可見,超濾法測定四個制劑的包封率都在98%左右,而柱層析得到的結果卻表明脂質體有著比納米粒更高的包封率。可能的原因是,納米粒內部的油相是作為儲藏LBT的唯一儲庫,氧化石蒜堿油酸復合物可能在制備的過程中,不能充分地包裹在納米粒內部,部分被吸附在納米粒表面,在過柱分離過程中容易釋放出來。而脂質體的磷脂雙分子層可以用來儲存脂溶性藥物,脂質體的內水相也可以來儲存水溶性藥物,這樣,能更多地包裹氧化石蒜堿油酸復合物,吸附在脂質體外表面的復合物相對減少,達到更好的包封率。表2:不同方法測定不同制劑的包封率(n=3)方法LBT-OA-NELBT-OA-PEG-NELBT-OA-LipoLBT-OA-PEG-Lipo超濾法93.12±2.5695.33±1.2494.55±1.4797.44±1.98柱層析35.75±2.3340.53±0.7679.77±1.5785.46±1.23實驗例3制劑的體外釋放。將1ml的LBT溶液(1mg/ml)和各1ml的LBT-OA-NE,LBT-OA-PEG-NE,LBT-OA-Lipo,LBT-OA-PEG-Lipo(1mg/ml,按LBT的濃度計算)制劑置于透析袋中(分子截留量800~14000Da)。將透析袋置于300mlPBS(pH7.4)的錐形瓶中,于37℃搖床(70rmp)中振蕩。于不同的時間點各取1ml釋放介質,并補加相應體積的空白釋放介質。采用液質聯用方法測定藥物的釋放量。圖2為實施例1和2中制劑以及載LBT的納米粒制劑的體外釋放實驗結果。結果表明,LBT-OA-PEG-Lipo有著更好的緩釋效果。實驗例4制劑的血清穩定性。將制備好的LBT-OA-Lipo,LBT-OA-PEG-Lipo以及LBT-OA-NE,LBT-OA-PEG-NE制劑各取1ml,與等體積的50%胎牛血清混合后,于不同時間點下取少量混合物,測定制劑的粒徑變化。圖3為實施例1和2中制劑以及載LBT的納米粒制劑的血清穩定性試驗結果。結果表明,不論是LBT的納米粒制劑還是本發明中脂質體制劑,在血清24小時內都有良好的穩定性。實驗例5制劑的X射線光電子能譜分析(XPS)。將制備好的LBT-OA-Lipo,空白脂質體以及LBT-OA-NE,空白納米粒制劑各取數滴滴于載玻片上,待水分揮發干凈后用X射線光電子能譜分析儀分析表面3nm的碳、氮、氧和磷元素的含量。分析結果如表3所示。油酸跟氧化石蒜堿都含有氧元素,載藥的脂質體表面氧元素較空白脂質體有輕微地增加,而載藥納米粒相較于空白納米粒,氧元素有更多的增加,表明脂質體將更多的氧化石蒜堿包入在內部,而納米粒則有更多的藥物存在制劑的表面。表3:不同制劑的表面元素分析實驗例6制劑的藥動學實驗。25只SD大鼠隨機分為5組,每組5只,禁食12h后分布給予LBT溶液,LBT-OA-NE,LBT-OA-PEG-NE以及LBT-OA-Lipo,LBT-OA-PEG-Lipo,其中LBT的給藥劑量為10mg/kg。于尾靜脈注射后0.083、0.15、0.25、0.5、1、2、4、8、12、24、48h取血0.3ml至肝素鈉處理過的離心管中,5000rmp離心5分鐘,取出上層血漿100μl,于-40℃下凍存。血漿樣品處理:將血漿樣品于室溫下放置后,加入300μl乙腈沉淀蛋白,渦旋5分鐘后10000rpm離心5分鐘,取上層清液過0.22μm膜后,采用LC-MS/MS測定血漿內LBT的濃度。利用DAS軟件計算藥動學參數。藥動學參數如表4所示。如表中所示,LBT-OA-Lipo能顯著提高LBT的生物利用度,其AUC值是LBT原藥組的11.5倍,LBT-OA-NE組的3.0倍,是LBT-OA-PEG-NE組的1.8倍。另外PEG化的脂質體有著最高的生物利用度,其AUC值是LBT原藥組的42.6倍,LBT-OA-NE組的11.2倍,是LBT-OA-PEG-NE組的6.7倍,是LBT-OA-Lipo組的3.7倍。圖4為實施例1和2中制劑以及載LBT的納米粒制劑的藥動學實驗結果。結果表明,載LBT的脂質體,尤其是PEG化脂質體,能顯著延長藥物的循環時間(24h后仍有較高血藥濃度),提高藥物的生物利用度。表4:靜脈注射后LBT在不同制劑中的藥動學參數(n=5)P<0.05;a,vs.LBT-OA-liposome;b,vs.LBT-OA-PEG-liposome.縮寫:t1/2α分布半衰期;t1/2β清除半衰期;AUC0-24h表示0到24小時內藥物曲線下面積;MRT滯留時間;CL總清除率。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1