一種含銅光熱納米材料的合成方法及其應用與流程
本發明屬于納米材料和納米醫學領域,特別涉及了利用新型的熒光碳點合成含銅納米片光熱材料的制備以及穩定修飾方法及其生物醫學應用。
背景技術:
近年來,光熱治療作為一種治療癌癥的有效方法已經引起了越來越多的關注。光熱治療被認為是能夠替代靶向治療、不引起全身性影響的微創腫瘤治療方法。由于近紅外光不易被皮膚和組織吸收,具有較強組織穿透能力,因此利用近紅外光照射注射有光熱試劑的組織,利用光熱轉換從而可以達到有效殺死癌細胞的目的。目前,文獻中報導過的光熱材料主要分為以下四類:(1)有機化合物或聚合物,如七甲川花菁染料、聚苯胺、聚吡咯和聚噻吩等;(2)金屬納米材料,如金納米材料包括金納米球殼、金納米棒和鈀片等;(3)碳納米材料,如碳納米管、氧化石墨烯以及碳點等;(4)半導體化合物,如硫化銅納米顆粒、硫化鉬納米片和氧化鎢納米線等。然而,一些光熱材料因合成困難、光穩定性較差、光熱轉化效率和消光系數較低、生物相容性較差、水分散性差、粒徑太大或太小等,在腫瘤光熱治療的應用上仍然具有很多障礙。
碳點通常是指粒徑小于10nm并具有熒光發光性能的碳納米顆粒,其具有多種優勢。但是,目前尚未有將碳點用于制備光熱材料或提高光熱材料性能的簡便方法。
技術實現要素:
發明目的:本發明將開發一種利用碳點室溫制備具有優異光熱性能的含銅納米材料,再通過進一步的表面修飾提高該材料的穩定性,最終獲得水分散性好、毒性低、光熱性能優異的新型光熱納米材料,以用于腫瘤的光熱治療。
技術方案:本發明提供一種含銅光熱納米材料的合成方法,包括以下步驟:
(1)、將同時含有巰基和羧基的化合物A與含有多氨基的化合物B在水中溶解后混合,于120℃~200℃水熱中反應6~24h,降至室溫后,便得到帶有羧基、氨基以及含硫基團的水溶性熒光碳點;
(2)、將合成的水溶性熒光碳點與含銅鹽溶液混合,室溫反應0.5~6h,經透析或離心即得到含銅光熱納米材料的水溶液;
(3)、向含銅光熱納米材料的水溶液中加入穩定劑進行表面修飾,經透析或離心得到純凈的含銅光熱納米材料。
在進一步的實施例中,其中含有巰基和羧基的化合物A為L-半胱氨酸、D-半胱氨酸或巰基丁二酸。含有多氨基的化合物B為鄰苯二胺、4-甲基鄰苯二胺或N,N-二乙基鄰苯二胺。所述的含有多氨基的化合物B與含有巰基和羧基的化合物A的摩爾比為1:0.1~1:10。
步驟(2)中,所述的含銅鹽溶液為硫酸銅溶液、氯化銅溶液或硝酸銅溶液。水溶性熒光碳點與含銅鹽溶液中銅元素的質量比為50:1~1:1。
步驟(3)中,所述的穩定劑為帶巰基的聚乙二醇分子、牛血清白蛋白、人血清白蛋白或巰基葡萄糖中的至少一種。含銅光熱納米材料與穩定劑的摩爾比為1:0.1~1:10。
上述含銅光熱納米材料在制備或作為癌癥檢測/治療藥物或材料中的應用。即上述含銅光熱納米材料在制備或作為癌癥檢測/治療藥物中的應用。或者,含銅光熱納米材料在制備或作為癌癥檢測/治療材料中的應用。
有益效果:本發明采用一步水熱合成制得了低成本、高穩定性、易保存的新型熒光碳點,利用該碳點獨特的物理化學性質,創造性地用碳點與銅離子溶液的室溫混合靜置即得到了新型含銅光熱納米材料。該含銅光熱納米材料具有優異的光熱轉換效率(其消光系數為19.5Lg-1cm-1。其他已報導的光熱材料的消光系數為:金納米棒3.9Lg-1cm-1;氧化石墨烯納米片3.6Lg-1cm-1;黑磷量子點14.8Lg-1cm-1)。
具體而言,相對于現有技術,本發明提供的利用碳點制備含銅光熱納米材料的方法具有以下突出優勢:制備碳點僅需一步,方法簡單、原料價廉、可大量制備;利用碳點和含銅鹽溶液的室溫混合靜置即可制得含銅光熱納米材料,制備方法極為簡單、純化方便。且經簡單的表面修飾后即可在各種水溶液中分散并穩定;制得的含銅光熱納米材料光熱效果良好,細胞毒性很低,具有體內應用的潛力。
附圖說明
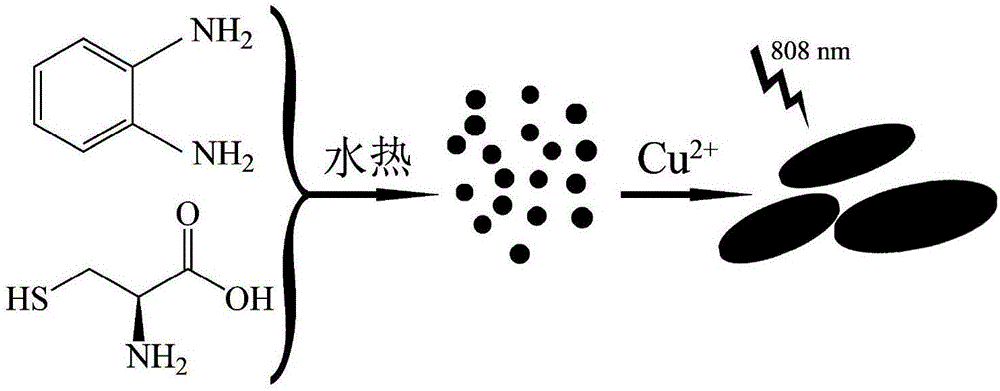
圖1為本發明制備碳點和含銅光熱納米材料的示意圖。
圖2a、圖2b和圖2c為本發明制備得到的碳點的透射電子顯微鏡(TEM)圖、衍射圖及粒徑分布圖。
圖3a、圖3b和圖3c為本發明制備得到的含銅光熱納米材料的透射電子顯微鏡(TEM)圖、衍射圖及粒徑分布圖。
圖4為含銅光熱納米材料的紫外–可見吸收光譜圖和消光系數擬合圖。
圖5為含銅光熱納米材料在808nm激光照射下的升溫結果圖。
圖6為含銅光熱納米材料對乳腺癌細胞(MCF-7)的光熱結果圖。
圖7為含銅光熱納米材料對正常肝細胞(L02)和肝癌細胞(HepG2)的毒性結果圖。
具體實施方式
為了解決背景技術存在的技術問題,申請人進行了深入地研究,提出了如下方案:制備熒光碳點并利用該碳點合成含銅光熱納米材料的方法,主要包括如下步驟:
(1)、一步水熱合成性質優良的新型熒光碳點;
(2)、合成碳點的保存:保存在常溫(25℃)的環境中或凍干后保存在–20℃環境中;
(3)、以合成碳點為反應物之一,將其與含銅鹽溶液反應,制得含銅光熱納米材料,并對其進行穩定;
(4)、含銅光熱納米材料的純化和保存:上述產物經透析或透析純化后,保存在4℃的環境中。
其中,制備性質優良的碳點的步驟具體如下:
(1)、將同時含有巰基和羧基的化合物A與含有多氨基的化合物B在水中溶解后混合;
(2)、混合溶液轉移至水熱反應釜中于120~200℃水熱中反應6~24h,降至室溫后制得碳點水溶液。
在上述實施例中,同時含有巰基和羧基的化合物A可以是L-半胱氨酸、D-半胱氨酸或巰基丁二酸等。如果同時含有巰基和羧基的化合物A在水中不能完全溶解,則可以加入一定量的氫氧化鈉溶液或稀酸使之完全溶解。
含有多氨基的化合物B可以是鄰苯二胺、4-甲基鄰苯二胺或N,N-二乙基鄰苯二胺等。
含有多氨基的化合物B與同時含有巰基和羧基的化合物A的摩爾比為1:0.1~1:10,優選1:2。
步驟3中,含銅光熱納米材料的制備方法,具體包括以下步驟:
(1)將合成的熒光碳點與含銅鹽溶液迅速混合;
(2)在20~80℃條件下攪拌或靜置反應0.5~6h;
(3)所得含銅光熱納米材料進行離心或于透析袋中透析后,得到純凈的含銅光熱納米材料水溶液;
(4)向含銅光熱納米材料的水溶液中加入穩定劑進行表面修飾,室溫攪拌反應過夜;
(5)反應后溶液進行離心或于透析袋中透析后,得到純凈且穩定的含銅光熱納米材料。
在上述實施例中,含銅鹽溶液可以是硫酸銅溶液、氯化銅溶液或硝酸銅溶液等。熒光碳點與含銅鹽溶液中銅元素的質量比為50:1~1:1,優選為14:1。穩定劑可以是帶巰基的聚乙二醇分子、牛血清白蛋白、人血清白蛋白或巰基葡萄糖等,或者是上述幾種分子的組合。含銅光熱納米材料與穩定劑的摩爾比為1:0.1~1:10,優選1:1。
上述含銅光熱納米材料具有在癌癥的光熱治療方面的應用,例如在制備或作為癌癥檢測/治療藥物中的應用,或者在制備或作為癌癥檢測/治療材料中的應用。
實施例1
新型熒光碳點的制備方法(見圖1),包括以下步驟:
(1)將672mg的L-半胱氨酸和300mg鄰苯二胺溶于超純水,可以加入一定量的氫氧化鈉溶液使L-半胱氨酸完全溶解。
(2)將兩種溶液混合后,定體積為30mL,轉移至50mL水熱反應釜中。
(3)于160℃水熱中反應10h,降至室溫后制得碳點水溶液。所制得的碳點粒徑為3.4nm左右(見圖2)。
實施例2
包括兩個子實驗,子實驗1與實施例1類似,將672mg的L-半胱氨酸換成67.2mg的L-半胱氨酸。子實驗2是,保持L-半胱氨酸量不變,將鄰苯二胺的量換成30mg。
實施例3
與實施例1類似,區別是步驟(3)中以200℃在水熱反應釜中反應6h。
實施例4
新型熒光碳點的制備方法,與實施例1類似,區別是步驟(3)中以120℃在水熱反應釜中反應24h。
實施例5
含銅光熱納米材料的制備方法(見圖1),包括以下步驟:
(1)將實施例1中得到的碳點水溶液稀釋,與摩爾濃度為20mM的硫酸銅迅速混合,使碳點與含銅鹽溶液中銅元素的質量比為14:1。
(2)以25℃靜置反應2h。
(3)所得含銅光熱納米材料于1k透析袋中透析后,得到純凈的含銅光熱納米材料水溶液;
(4)向含銅光熱納米材料的水溶液中加入巰基-聚乙二醇2000-甲氧基,使含銅光熱納米材料與穩定劑的摩爾比為1:1,室溫攪拌反應過夜。
(5)反應后溶液于7k透析袋中透析后,得到純凈且穩定的含銅光熱納米材料水溶液。含銅光熱納米材料的粒徑為20nm左右(見圖3)。
實施例6
包括兩組子實驗,與實施例5類似,子實驗1和子實驗2的區別是步驟(1)中使碳點與含銅鹽溶液中銅元素的質量比為50:1、1:1。
實施例7
含銅光熱納米材料的制備方法,與實施例5類似,區別在于步驟(1)中的硫酸銅溶液換成氯化銅或硝酸銅溶液等其他含銅離子的鹽溶液。
實施例8
含銅光熱納米材料的制備方法,與實施例5類似,區別在于步驟(2)中以25℃攪拌反應6h。
實施例9
含銅光熱納米材料的制備方法,與實施例5類似,區別在于步驟(2)中以70℃靜置反應1h。
實施例10
含銅光熱納米材料的制備方法,與實施例5類似,區別是步驟(4)中巰基-聚乙二醇2000-甲氧基換成巰基-聚乙二醇5000-甲氧基、牛血清白蛋白、人血清白蛋白或巰基葡萄糖等,或者是上述幾種分子的組合。
實施例11
測定實施例5的含銅光熱納米材料的紫外–可見光譜和消光系數,步驟如下:
將實施例5的含銅光熱納米材料用磷酸鹽緩沖液稀釋后以銅濃度為5,10,20,30μg/mL,用紫外–可見光譜儀分別測定其光譜,以銅濃度為橫坐標,溶液在808nm的吸收值為縱坐標擬合直線,其斜率即為含銅光熱納米材料的消光系數α。結果見圖4。
實施例12
測定實施例5的含銅光熱納米材料的升溫效果,步驟如下:
實施例5的含銅光熱納米材料,分別配置含銅元素的濃度分別為5,10,20,30μg/mL的水溶液,均取200μL體積。用808nm的激光器以2W/cm2功率照射,每15s記錄溶液溫度,持續監測5min以上。結果見圖5。
實施例13
測試實施例5的含銅光熱納米材料在體外對乳腺癌細胞(MCF-7)的光熱效果,步驟如下:
選擇乳腺癌細胞(MCF-7),以5×104個/mL細胞分別與銅濃度為0,5,10,20,30μg/mL的含銅光熱納米材料孵育4h后,用808nm的激光器以2W/cm2功率照射10min,并且設計不光照的對照組。接著繼續放入培養箱孵育12h后利用酶標儀采用MTT檢測法測定細胞存活率。結果見圖6。實驗結果表明經激光照射細胞的存活率相較未光照細胞的存活率大大降低,在銅濃度為20μg/mL時細胞存活率下降了70%以上,說明該含銅納米材料在20μg/mL時就有顯著的光熱效果。
實施例14
測試實施例5的含銅光熱納米材料的細胞毒性,步驟如下:選擇正常肝細胞(L02)和肝癌細胞(HepG2),以5×104個/mL細胞分別與銅濃度為0,1,5,10,20,30μg/mL的含銅光熱納米材料孵育24h后,利用酶標儀采用MTT檢測法測定含銅光熱納米材料對兩種細胞的毒性。結果見圖7。實驗結果表明含銅光熱納米材料以光熱濃度與細胞孵育后,正常細胞和癌細胞都有80%以上的存活率,說明該含銅光熱納米材料具有良好的生物相容性。
總之,本發明提供了一種新型熒光碳點的合成及用該碳點室溫制備新型含銅光熱納米材料的新方法。此外,本發明還對所得含銅光熱納米材料進行了表面修飾,大大提高了其在水中的穩定性。
- 還沒有人留言評論。精彩留言會獲得點贊!