葡聚糖硫酸鈉誘導的雞腸炎模型及其建立方法與流程
本發明涉及生物
技術領域:
,具體涉及葡聚糖硫酸鈉誘導的雞腸炎模型及其建立方法。
背景技術:
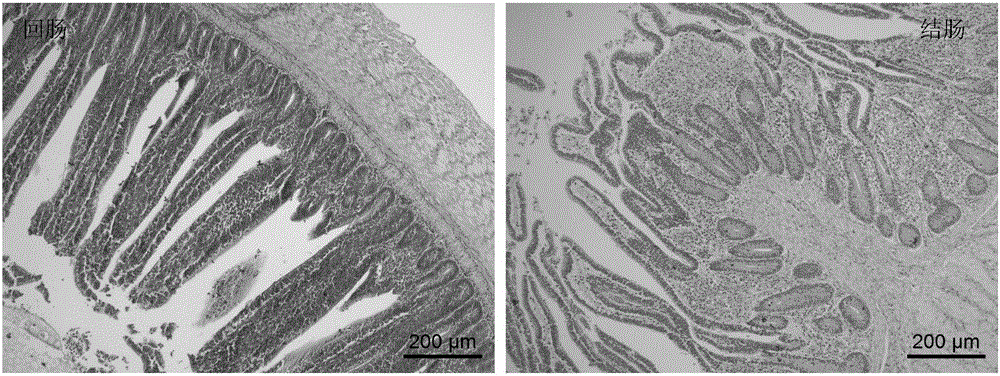
:隨著高密度和集約化養殖生產的快速發展,家禽腸道疾病的復雜化日益明顯,同時耐藥菌株不斷出現,嚴重威脅著雞只的健康。我國每年因球蟲病所致養雞業的經濟損失高達50億元以上,僅僅藥物一項就高達15.6~19.5億元(平均每只肉雞的抗球蟲藥支出約為0.12-0.15元)。加拿大農業與食品科學研究中心的Gong博士在2014年家禽營養與腸道健康國際學術交流會中指出,因壞死性腸炎導致的全球家禽業經濟損失每年高達400億美元。因此,養殖者越來越重視家禽腸道保健。有效調節雞腸道功能,對于維護正常的消化吸收功能至關重要,不但能保證雞獲得良好的生產性能,而且能有效抵御疾病的侵襲。家禽的腸道疾病主要有球蟲病、壞死性腸炎、沙門氏菌病等,在進行動物病理學、疫苗開發等研究,主要用上述疾病的病原菌或弱毒疫苗等造模。但這種造模方式,不僅要求在專門的動物隔離區進行試驗,而且發病程度難以控制,還會引起其他并發癥,給試驗研究帶來很多不確定因素,同時操作非常繁瑣,較難在免疫應激或炎癥研究中推廣應用。目前普遍使用的細菌脂多糖(Lipopolysaccharides,LPS)誘發的腸道炎癥模型,也存在因劑量大小和注射次數等差異而造成試驗結果重復性差及穩定性低等缺點;而且,該模型的作用靶位點并不直接在腸道,不能作為專門的腸道炎癥模型。葡聚糖硫酸鈉(Dextransulfatesodium,DSS),是葡聚糖的聚陰離子衍生物,由Dextran和chlorosulfonicacid的酯化反應形成,具有增強或抑制細胞介導的免疫應答等作用。日本學者于1985年首次應用硫酸葡聚糖制備了小鼠UC模型,此后,該模型廣泛用于篩選治療人體炎癥性腸病(IBD)的新方法和臨床前新藥物的開發及其發病機制的研究。但是,家禽和小鼠是兩種不同綱的動物,在體型大小、消化系統和對DSS可耐受的劑量范圍均具有較大差異,而且不同分子量的DSS會引發不同的病癥,因此將小鼠UC模型運用到家禽上需另辟蹊徑。近兩年,有文獻報道當雞自由飲用分子量為40kDa的DSS溶液低于0.5%wt/vol(重量百分濃度)時未引起雞任何病變,飲用0.75%wt/vol的DSS溶液會出現拉稀、便血等癥狀,6天后引起雞只超過50%體重的下降,飲用1.5%-3%wt/vol的DSS溶液3天后雞只全部死亡,若采用口服灌胃DSS0.45g/只/天(連續2天),則出現比飲用0.75%wt/volDSS溶液更嚴重的病癥。但上述研究存在發病時間短、病情過于劇烈和有效劑量范圍窄等一系列問題,口服灌喂還存在操作繁瑣、重復性差和穩定性低等缺點,使其應用受到了限制。因此,研究出一種操作簡單、有效劑量范圍大、穩定可靠的雞腸炎模型,是本領域技術人員亟待解決的問題。技術實現要素:為克服現有技術存在的缺陷,本發明的目的在于提供一種雞腸道炎癥模型的建立方法,為實現上述目的,本發明的技術方案如下:本發明的雞腸炎模型的建立方法,包括以下步驟:(1)將葡聚糖硫酸鈉溶于飲用水中,配制成葡聚糖硫酸鈉溶液,現配現用;所述葡聚糖硫酸鈉的分子量為36~50kDa;(2)選擇14~18日齡雞作為建立雞腸炎模型的對象;(3)將所述步驟(2)中選擇的雞飼養在雞舍中,自由飲用所述步驟(1)配制的葡聚糖硫酸鈉溶液10天以上。優選的,所述葡聚糖硫酸鈉溶液的重量百分濃度為0.75%~2.5%。更優選的,所述葡聚糖硫酸鈉溶液的重量百分濃度為1.25%。優選的,所述雞為健康快長型雞。優選的,所述飼養采用籠養方式,連續光照進行飼養,保證充足飲水,自由采食,試驗基礎飼糧參考我國行業標準(NY/T33-2004)黃羽肉雞營養需要配合而成,每天清掃雞舍與定期清洗水箱,適時通風換氣,保持良好的雞舍衛生環境,并進行常規的免疫程序。優選的,所述自由飲用采用乳頭式飲水器自由飲水。用本發明的上述方法可以得到雞腸炎模型。本發明提供的雞腸炎模型的建立方法可用于研究家禽腸道相關疾病的發病機制、篩選改善腸道炎癥的方法、測試添加劑預防效果或藥物的治療效果,以提高腸道結構的完整性,從而增加對營養物質的吸收利用,減少在高密度和集約化家禽養殖過程中因腸道疾病引起的經濟損失。與現有技術相比,本發明的DSS誘導雞腸炎模型的建立方法操作簡便,DSS有效劑量范圍大,病理變化程度可調節,有利于在實驗中進行大規模的推廣和應用。附圖說明為了更清楚地說明本發明實施例或現有技術中的技術方案,下面將對實施例或現有技術描述中所需要使用的附圖作簡單地介紹,顯而易見地,下面描述中的附圖僅僅是本發明的實施例,對于本領域普通技術人員來講,在不付出創造性勞動的前提下,還可以根據提供的附圖獲得其他的附圖。圖1為0.75%組顯微鏡下腸道病理學觀察結果圖(HE染色X100);圖2為1.25%組顯微鏡下腸道病理學觀察結果圖(HE染色X100);圖3為1.5%組顯微鏡下腸道病理學觀察結果圖(HE染色X100);圖4為2.5%組顯微鏡下腸道病理學觀察結果圖(HE染色X100);圖5為實施例1中不同濃度DSS溶液對腸道粘膜形態的影響結果,其中,不同字母表示差異顯著。具體實施方式下面將結合本發明實施例中的附圖,對本發明實施例中的技術方案進行清楚、完整地描述,顯然,所描述的實施例僅僅是本發明實施例中的一個優選實施例,而不是全部的實施例。基于本發明中的實施例,本領域普通技術人員在沒有做出創造性勞動前提下所獲得的所有其他實施例,都屬于本發明保護的范圍。實施例1葡聚糖硫酸鈉誘導的公雞腸炎模型的建立本實施例的葡聚糖硫酸鈉誘導的公雞腸炎模型的建立方法按下述步驟操作:1、將分子量為36~50kDa的葡聚糖硫酸鈉(美國MPBIO產品)溶于普通飲用水中,分別配制重量百分濃度為0.75%、1.25%、1.5%和2.5%的葡聚糖硫酸鈉溶液,現配現用。2、選擇240羽16日齡健康快長型公雞,隨機分為5組,每組3個重復,每個重復16只,飼養在種雞育雛舍中。采用籠養方式,連續光照進行飼養,采用乳頭式飲水器自由飲水。自由采食,試驗基礎飼糧參考我國行業標準(NY/T33-2004)黃羽肉雞營養需要配合而成;每天清掃雞舍與定期清洗水箱,適時通風換氣,保持良好的雞舍衛生環境,并進行常規的免疫程序。3、對照組自由飲用常規水,4個處理組分別自由飲用0.75%、1.25%、1.5%和2.5%wt/vol的葡聚糖硫酸鈉溶液10天。4、試驗期每天觀察每重復組雞只活動度、飲水量、飲食量、體重變化、糞便軟硬度及便血情況,記錄糞便軟硬、便血和體重變化情況。5、10天后,每個重復組全群稱重,并隨機挑選3只雞進行屠宰,采血用于細胞因子檢測,采集3-5cm回腸和結腸組織用于H&E染色,進行常規病理學觀察。實驗結果:1、飲水中添加DSS濃度為0.75%wt/vol時,雞只未發生便血、拉稀、死亡、體重下降等現象,其回腸黏膜長度和絨毛高度降低,回腸和結腸腔中有少許脫落的黏膜上皮,詳見圖1。2、飲水中添加DSS濃度為1.25%wt/vol時,雞只發生輕微的便血、拉稀現象,體重略微下降,平均約5.7%體重的降低,給藥10天死亡率為2.1%。其回腸黏膜長度和絨毛高度顯著降低,結腸皺襞黏膜長度顯著降低,回腸和結腸黏膜少許變性、脫落,詳見圖2。3、飲水中添加DSS濃度為1.5%wt/vol時,雞只發生較嚴重的便血、拉稀現象,體重略微下降,平均約有6%體重的降低,給藥10天死亡率為4.2%。其回腸黏膜長度和絨毛高度顯著降低,結腸皺襞黏膜長度顯著降低,回腸和結腸黏膜部分變性、崩解、脫落,黏膜少量淋巴細胞和異嗜白細胞浸潤,詳見圖3。4、飲水中添加DSS濃度為2.5%wt/vol時,雞只發生嚴重的便血、拉稀現象,體重下降非常明顯,平均超過17%體重的降低,給藥10天死亡率為20.8%。其回腸黏膜長度和絨毛高度極顯著降低,回腸黏膜大部分變性、崩解、脫落,黏膜大量淋巴細胞和異嗜白細胞浸潤;結腸大量淋巴細胞和異嗜白細胞浸潤,甚至可達黏膜下層,絨毛和黏膜輪廓不清晰,部分腺體排列紊亂,詳見圖4。總結10天后,每組雞只死亡率分別是:0、0、2.1%、4.2%和20.8%;表1為快長型公雞16-27日齡體重變化,由表1結果可見,與對照組比,處理組給藥10天后降低的體重分別為:1.1%、5.7%、6.0%和17.4%;由圖5可知,病癥嚴重程度為:2.5%組>1.5%組>1.25%組>0.75%組>對照組。表1組別試驗期增加的體重:g試驗后,與對照組比,體重降幅對照組455.83±10.14a0.75%組439.58±3.35a1.1%1.25%組406.25±7.83b5.7%1.5%組396.71±8.17b6.0%2.5%組296.67±15.66c17.4%注:不同字母表示差異顯著實施例2葡聚糖硫酸鈉誘導的母雞腸炎模型的建立為進一步研究腸道炎癥的適用范圍及炎癥發展程度,用本發明的方法,將試驗對象為17日齡健康快長型母雞隨機分為2組,每組3個重復,每個重復16只雞,對照組飲用常規水,處理組飲用1.5%wt/vol的DSS溶液,試驗期為16天。飼養方式及管理同實施例1。實驗結果觀察:試驗期間,雞只前10天發病癥狀與實施例1中1.5%組基本一致,10天后,發病程度加快,發生嚴重的便血、拉稀現象,體重下降非常明顯;16天試驗結束后,對照組和處理組雞只死亡率分別為2.1%和8.3%;表2為快長型母雞18-32日齡體重變化,由表2結果可見,處理組降低的體重為20.4%。表2注:不同字母表示差異顯著。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1