一種PLL?DBM多孔復合骨移植材料、其制備方法及應用與流程
本申請涉及多孔材料領域,特別是涉及一種PLL-DBM多孔復合骨移植材料、其制備方法及應用。
背景技術:
自體紅骨髓經皮注射治療骨不連和骨缺損已取得一定成功,但應用直接注入的方法,局部干細胞密度低、容易流失,影響療效。骨髓干細胞富集技術用于修復骨缺損和脊柱融合術,可獲得與自體骨移植相當的效果,已成為骨修復研究領域的熱點。其核心在適用于選擇性細胞滯留技術的支架材料及其成骨效果的研究。
鑒于此,提高骨髓細胞的選擇性滯留率成為本領域亟待解決的技術問題。
技術實現要素:
本申請主要解決的技術問題是提供一種PLL-DBM多孔復合骨移植材料,能夠提高骨髓細胞的選擇性滯留率,適合作為骨髓干細胞富集材料,可滿足創傷、骨病及急診骨缺損對骨修復治療技術和骨移植物的應用需求。
為解決上述技術問題,本發明實施例采用的一個技術方案是:提供一種PLL-DBM多孔復合骨移植材料,與現有技術相比,其不同之處在于,該材料包括:
具有三維多孔網絡結構的礦物基材;和
設于礦物基材表面的生物聚合物修飾層,所述生物聚合物分布在所述三維多孔網絡的至少一部分內;
其中,所述礦物基材為脫鈣骨基質,所述生物聚合物為多聚左旋賴氨酸。
優選地,該材料通過用生物聚合物對具有三維多孔網絡結構的礦物基材進行表面修飾而形成。
優選地,位于礦物基材孔隙中的生物聚合物修飾層具有二級多孔網絡結構。
優選地,所述脫鈣骨基質與所述多聚左旋賴氨酸的質量比為1000:(0.05~1)。
為解決上述技術問題,本發明實施例采用的另一個技術方案是:提供一種PLL-DBM多孔復合骨移植材料的制備方法,包括如下步驟:
于水介質中,將礦物基材和生物聚合物混合形成浸泡液,使礦物基材和生物聚合物充分接觸;
將所得浸泡液放置足夠時間以實現生物聚合物對礦物基材的表面修飾;
于溫度-42℃~-47℃、負壓20~28Pa下,將所得浸泡液進行冷卻;
將冷卻的浸泡液進行冷凍干燥;
其中,所述礦物基材為脫鈣骨基質,所述生物聚合物為多聚左旋賴氨酸。
優選地,在冷卻步驟之前還包括對浸泡液進行負壓抽濾的步驟。
優選地,包括如下步驟:
對脫鈣骨基質進行超聲清洗;
將多聚左旋賴氨酸用雙蒸水配制成濃度為0.01~0.2mg/ml的多聚左旋賴氨酸溶液,再將脫鈣骨基質置于多聚左旋賴氨酸溶液中,形成浸泡液,其中,脫鈣骨基質與多聚左旋賴氨酸溶液的比例為1g:5ml;
將所得浸泡液放置足夠時間以實現多聚左旋賴氨酸對脫鈣骨基質的表面修飾;
將盛裝有浸泡液的容器放置于分別連接負壓抽濾瓶和負壓抽濾機的無菌干燥皿中,密封好接頭與無菌干燥皿蓋口,于18℃~22℃下負壓抽濾4~8小時,直至未見氣泡從孔隙溢出;
于溫度-42℃~-47℃、負壓20~28Pa下,將所得浸泡液進行冷卻;
將冷卻的浸泡液進行冷凍干燥。
本發明還提供了上述的PLL-DBM多孔復合骨移植材料作為用于骨和/或軟骨再生的材料的應用。
本申請實施例的有益效果是:區別于現有技術的情況,本發明實施例的多孔復合骨移植材料通過用生物聚合物對具有三維多孔網絡結構的礦物基材進行表面修飾而形成,對骨髓細胞的選擇性滯留率高,與骨髓干細胞快速構建的骨移植材料具有良好的生物相容性和成骨活性,可滿足作為用于創傷、骨病及急診骨缺損對骨修復高成骨活性骨移植材料的應用需求。
附圖說明
為了更清楚地說明本申請實施例的技術方案,下面將對本申請實施例中所需要使用的附圖作簡單地介紹。顯而易見地,下面所描述的附圖僅僅是本申請的一些實施例,對于本領域普通技術人員來講,在不付出創造性勞動的前提下,還可以根據這些附圖獲得其他的附圖。
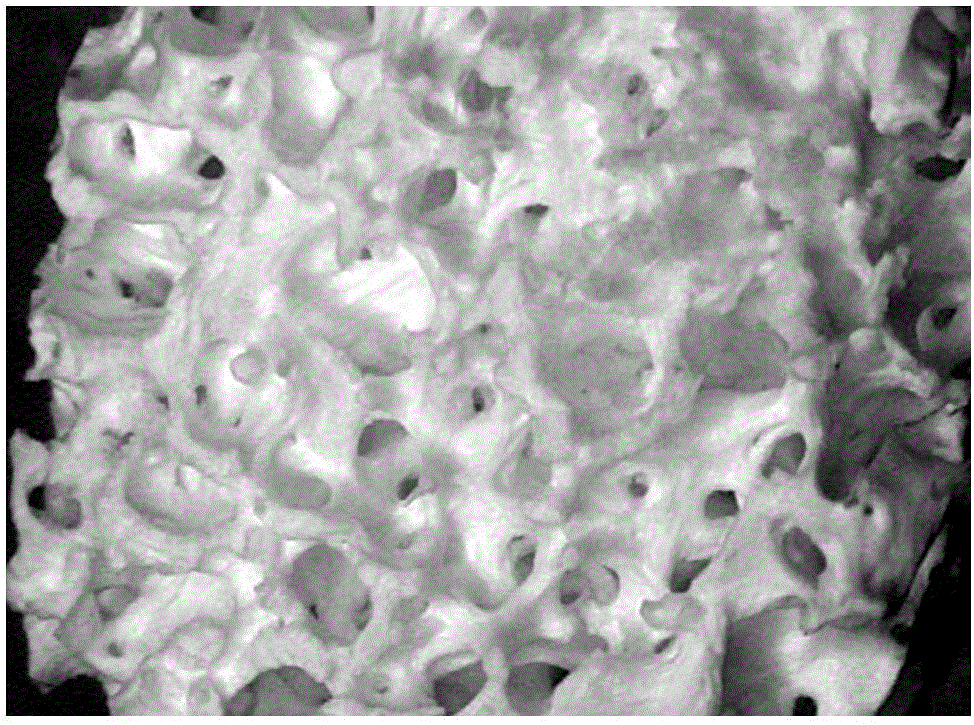
圖1是本發明實施例1的材料的外觀圖。
圖2是本發明實施例1的材料的三維視頻顯微鏡觀察圖。
圖3是本發明實施例1的材料的掃描電鏡圖(×600倍)。
具體實施方式
為了使本申請的目的、技術方案及優點更加清楚明白,以下結合附圖及實施例,對本申請進行進一步詳細說明。應當理解,此處所描述的具體實施例僅用以解釋本申請,并不用于限定本申請。
本發明實施例的PLL-DBM多孔復合骨移植材料,包括:具有三維多孔網絡結構的礦物基材;和設于礦物基材表面的生物聚合物修飾層,所述生物聚合物分布在所述三維多孔網絡的至少一部分內,其中,所述礦物基材為脫鈣骨基質,所述生物聚合物為多聚左旋賴氨酸。該材料通過用生物聚合物對具有三維多孔網絡結構的礦物基材進行表面修飾而形成,位于礦物基材孔隙中的生物聚合物修飾層具有二級多孔網絡結構。
在本實施例的優選方案中,所述脫鈣骨基質與所述多聚左旋賴氨酸的質量比為1000:(0.05~1)。
需要說明的是,本說明書中,多聚左旋賴氨酸(PLL),英文為poly-L-lysine;脫鈣骨基質(DBM),英文為demineralized bone matrix,是一種是由膠原蛋白、非膠原蛋白以及較低濃度的生長因子(如骨形成蛋白,骨中的骨形成蛋白被致密的礦物成份包繞,未脫鈣骨無誘導成骨能力,脫鈣程度不同對應的機械強度也不同)等組成的復合物天然骨移植材料,主要來源于人或動物(豬、牛、狗、兔等)的顱骨、股骨干和脛骨干。
該材料將多聚左旋賴氨酸(poly-L-lysine,PLL)與脫鈣骨基質(demineralized bone matrix,DBM)按優選的比例浸泡、負壓抽濾和冷凍干燥,對脫鈣骨基質表面進行修飾及優化,促進人骨髓間充質干細胞(bone marrow stromal cells,BMSCs)的黏附、增殖與分泌基質等細胞功能,從而制備高成骨活性的骨移植材料。
本實施例的材料按照如下制備方法得到,首先,于水介質中,將脫鈣骨基質和多聚左旋賴氨酸混合形成浸泡液,使脫鈣骨基質和多聚左旋賴氨酸充分接觸。其次,將所得浸泡液放置足夠時間以實現多聚左旋賴氨酸對脫鈣骨基質的表面修飾。再次,于溫度-42℃~-47℃、負壓20~28Pa下,將所得浸泡液進行冷卻。最后,將冷卻的浸泡液進行冷凍干燥。
作為優選實施方式,在冷卻步驟之前還包括對浸泡液進行負壓抽濾的步驟。
具體地,本實施例的材料按照如下制備方法得到:
(1)對脫鈣骨基質進行超聲清洗;
(2)將多聚左旋賴氨酸用雙蒸水配制成濃度為0.01~0.2mg/ml的多聚左旋賴氨酸溶液,再將脫鈣骨基質置于多聚左旋賴氨酸溶液中,形成浸泡液,其中,脫鈣骨基質與多聚左旋賴氨酸溶液的比例為1g:5ml;
(3)將所得浸泡液放置足夠時間以實現多聚左旋賴氨酸對脫鈣骨基質的表面修飾;
(4)將盛裝有浸泡液的容器放置于分別連接負壓抽濾瓶和負壓抽濾機的無菌干燥皿中,密封好接頭與無菌干燥皿蓋口,于18℃~22℃下負壓抽濾4~8小時,直至未見氣泡從孔隙溢出;
(5)于溫度-42℃~-47℃、負壓20~28Pa下,將所得浸泡液進行冷卻;
(6)將冷卻的浸泡液進行冷凍干燥。
實施例1
本實施例提供了一種PLL-DBM多孔復合骨移植材料,該材料為骨髓干細胞富集材料,是由DBM與PLL復合構成,其PLL的濃度為0.1%(0.1mg/ml),DBM的重量:PLL的體積=1g:5ml。所述PLL-DBM的制備方法步驟如下:
(1)DBM的清洗
取DBM置于超聲波清洗機中,再次用無菌雙蒸水洗滌3次,每2小時跟換雙蒸水一次,至PH7.3±0.1(酸度計測定)。無菌操作臺上瀝干4h,并置38℃恒溫箱烘干24h,,稱重封裝并標記待用。
(2)PLL浸泡DBM
無菌操作下,用雙蒸水與PLL配制0.1%的PLL并經0.22μm濾器過濾除菌。分別用上述配置好的PLL浸泡自制DBM(DBM重量:PLL體積=1g:5ml)15h,每3h震蕩搖勻浸泡液,使PLL與DBM充分接觸。
(3)負壓抽濾
將上述浸泡容器置于連接負壓抽濾瓶、負壓抽濾機的無菌干燥皿中,密封好接頭與干燥皿蓋口,20℃持續負壓抽濾5h,直至未見任何氣泡自骨塊表面孔隙溢出,取出浸泡容器置-20℃冰箱冷凍隔夜。
(4)冷凍干燥
將浸泡容器置于冷凍干燥機托盤,冷凍干燥機預置―42℃~―47℃,負壓20-28Pa,預冷30min后開始抽真空,真空度100MT以下。冷凍干燥48h,見材料已完全顯露,白色多聚賴氨酸已絕大部分吸附到材料中,材料邊緣與瓶底僅余很少量多聚賴氨酸白色沉淀物,將材料稱重并封裝,貼上標簽,外面再用一層聚乙烯袋封口。
(5)滅菌與保存
鈷-60γ射線照射滅菌,常用劑量為15-25kGyCo,置-20℃低溫冰箱保存待用。取少許DBM送需氧、厭氧菌、霉菌培養。
實施例2
本實施例提供了一種PLL-DBM多孔復合骨移植材料,與實施例1相比,區別在于PLL的濃度為0.01%(0.01mg/ml)。
實施例3
本實施例提供了一種PLL-DBM多孔復合骨移植材料,與實施例1相比,區別在于PLL的濃度為0.05%(0.05mg/ml)。
實施例4
本實施例提供了一種PLL-DBM多孔復合骨移植材料,與實施例1相比,區別在于PLL的濃度為0.08%(0.08mg/ml)。
實施例5
本實施例提供了一種PLL-DBM多孔復合骨移植材料,與實施例1相比,區別在于PLL的濃度為0.15%(0.15mg/ml)。
實施例6
本實施例提供了一種PLL-DBM多孔復合骨移植材料,與實施例1相比,區別在于PLL的濃度為0.20%(0.20mg/ml)。
以實施例1所得產品為例進行產品驗證:
結構特點和表征
PLL-DBM具有三維網孔結構,密度約為0.25~0.29g/ml,平均為(0.27±0.02)g/ml,孔隙率為(73±11)%。材料及孔隙表面有厚度約2~7μm的乳白色PLL覆蓋,且在孔隙中形成更小的、孔徑約20~65μm的網孔結構,大部分孔與孔之間有約100μm左右小孔貫通,三維視頻顯微鏡觀察可見材料整體及孔隙表面有均勻的乳白色PLL覆蓋,拉曼光譜分析表明材料內外表面任一位點由DBM和多聚賴氨酸構成,組織學觀察PLL-DBM在膠原孔狀結構內表面有淺色PLL涂層與網孔結構,請參閱圖1至圖3所示,圖中可見在脫鈣骨基質天然的網孔結構中形成了更細小的多聚左旋賴氨酸網孔。
PLL-DBM的細胞毒性檢測
參照ISO10993及GB/T10886的有關標準,將PLL-DBM材料及其浸提液分別與人骨髓基質干細胞(BMSCs)體外共培養,于培養20h、3d、7d行細胞形態學觀察,四甲基偶氮唑鹽法測定培養1、3、5、7d的細胞增殖活性,應用分光光度法進行溶血試驗。結果示:與PLL-DBM及其浸提液共培養的人BMSCs表現出更好的黏附與增殖特性,且隨浸提液濃度增加而增加,細胞毒性為0~1級。浸提液組溶血指數為2.17%,達到標準要求。
PLL-DBM成骨效果檢測
將成人骨髓干細胞通過骨髓富集裝置復合PLL-DBM后植入裸鼠皮下,術后X線攝片和組織學檢查均顯示其成骨效果良好,與自體骨組比較無明顯差異,并在各時間點與明顯強于DBM組。
PLL-DBM選擇性細胞滯留效果檢測
①對骨髓有核細胞、血小板和骨髓干細胞的選擇性滯留效果的觀察:PLL-DBM對有核細胞選擇性滯留的倍數為3.18±0.31倍,粘附率達53%±12%;對血小板選擇性滯留的倍數為3.88±0.68倍,粘附率達34%±10%;對人骨髓干細胞選擇性滯留的倍數為5.25±1.40倍,粘附率達73%±13%,選擇率達1.41±0.34。②對促成骨生長因子的選擇性滯留效果的觀察:PLL-DBM與紅骨髓富集處理后可以顯著提高TGF-β1和PDGF含量。
綜上所述,PLL-DBM是經多聚賴氨酸表面修飾的脫鈣骨基質,對骨髓細胞的選擇性滯留率高,與骨髓干細胞快速構建的骨移植材料具有良好的生物相容性和成骨活性,可滿足創傷、骨病及急診骨缺損對骨修復高成骨活性骨移植物的需求。
以上所述僅為本申請的實施例,并非因此限制本發明的專利范圍,凡是利用本申請說明書及附圖內容所作的等效結構或等效流程變換,或直接或間接運用在其他相關的技術領域,均同理包括在本申請的專利保護范圍內。
- 還沒有人留言評論。精彩留言會獲得點贊!