一種制備復合結構的方法與流程
本發明涉及生物學,再生醫學,生物打印(例如3D生物打印),組織工程學等
技術領域:
。特別地,本發明提供了一種制備包含至少兩種細胞的復合結構的方法,以及通過該方法獲得的復合結構。特別優選地,本發明的復合結構是包含骨和軟骨的復合結構,或者包含內皮細胞和平滑肌細胞的復合結構。因此,本發明提供了一種制備包含骨細胞和軟骨細胞的復合結構的方法,和一種制備包含內皮細胞和平滑肌細胞的復合結構的方法,以及通過所述方法獲得的復合結構。此外,本發明還涉及所獲得的復合結構的各種應用。
背景技術:
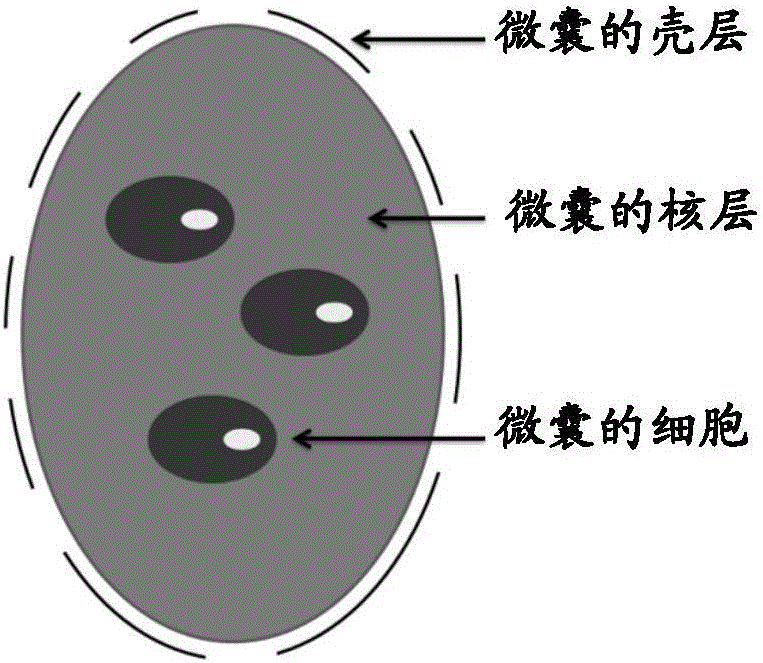
:關節軟骨的活力狀態是關節維持其結構和功能的關鍵。關節軟骨的缺失,將引起關節炎并極大限制關節的功能。關節軟骨由于缺乏血管,且軟骨細胞不能自主遷移、成熟軟骨細胞不能增殖等,因此即便受到輕微損傷也難以自行愈合。臨床上軟骨缺損常伴有軟骨下骨的缺損。近年來,研究人員試圖使用人工軟骨對人體受損軟骨進行修復或替換,但是通過長期研究發現,單純的人工軟骨在植入體內后,由于軟骨-骨界面難以快速融合,使得植入的人工軟骨與周圍骨組織無法完全整合,甚至出現移位、脫出的情況,導致修復失敗。已有研究表明,骨-骨的結合比軟骨-骨的結合更加快速和牢固,因此在修復軟骨缺損時,應同時考慮軟骨下骨的修復,即構建同時帶有軟骨組織和骨組織的人工植入物。間充質干細胞(MSC)是組織工程構建骨組織或軟骨組織常用的種子細胞,研究人員通過在培養基中添加0.1μM地塞米松、0.05mM抗壞血酸(AA)、以及10mM甘油磷酸,將MSCs誘導分化為成骨細胞;通 過添加10ng/mlTGF-β3、100nM地塞米松、50μg/ml的2-磷酸抗壞血酸、100μg/ml丙酮酸鈉、40μg/ml脯氨酸以及胰島素-轉鐵蛋白-硒溶液(ITS+,CollaborativeBiomedical,Bedford,MA,USA),將MSCs誘導分化為成軟骨細胞。在支架復合細胞的技術方法上,常見的選擇包括:1、使用支架復合種子細胞構建骨組織,同時將形成軟骨組織的種子細胞直接種植在骨組織支架上方形成軟骨組織;2、分別用支架附和種子細胞的方法形成骨組織和軟骨組織,再將兩種組織進行整合成為復合型植入物;3、在單一種類或復合型支架表面同時種植形成骨組織和軟骨組織的種子細胞,通過體外培養形成骨、軟骨復合型植入物;4、在含有不同誘導分化因子的雙層支架材料中植入同種祖源細胞后置于特制的單腔或雙腔生物反應器中復合培養。雖然相關技術已經經歷了多年的發展,但是仍存在顯著不足:1、MSCs誘導分化的培養過程非常繁瑣,將MSCs誘導分化為不同種類細胞時,需要不同的培養體系。2、需要先對MSCs進行擴增培養,進而誘導分化,再將分化后的細胞與支架材料相復合,最終再通過體內、外培養形成完整的人工植入物。整個培養過程耗費時間長,極大的增加了污染的風險。3、使用將種子細胞種植于支架材料表面的方法構建人工植入物,難以對生長在材料表面的細胞進行精確排布,從而導致形成的人工植入物結構混亂,功能不足。發明概述為了解決上述技術問題,本申請發明人開發了一種構建復合人工組織植入物(特別是包含骨和軟骨的復合人工組織植入物,或者包含內皮細胞和平滑肌細胞的復合結構)的新型技術方法。該方法無需將種子細胞種植至材料支架的操作過程,而是直接使用包含細胞的微囊(例如包含MSC細胞的微囊)來構建人工植入物。同時,該方法在操作細胞(例如MSC細胞)之前無需預先對細胞進行體外大量增殖;相反地,該方法在將包含細胞的微囊構建成人工植入物后,其所包含的細胞直接在微囊內大量增殖并最終形成完整植入物。此外,該方法無需多種培養體 系;相反地,該方法能夠在同一個培養體系下同時培養多種微囊,并使得微囊中的細胞增殖和/或分化為所需的各種目的細胞(例如,該方法能夠在同一個培養體系下同時誘導MSCs分別分化為成骨細胞和成軟骨細胞,或者同時誘導MSCs分別分化為內皮細胞和平滑肌細胞)。最后,通過對包含細胞的微囊的精確排布,該方法能夠實現多種目的細胞(例如成骨細胞和成軟骨細胞,例如內皮細胞和平滑肌細胞)的精確排布,并最終形成結構功能完整的人工植入物(例如,包含骨細胞和軟骨細胞的復合結構,或者包含內皮細胞和平滑肌細胞的復合結構)。因此,在一個方面,本發明提供了一種制備包含m種細胞的復合結構的方法,其中,m為≥2的整數,所述方法包括:(1)提供m種包含細胞的微囊,其中,每種微囊各自對應于復合結構中的一種細胞,即,每種微囊各自包含復合結構中的一種細胞,和/或能夠分化為復合結構中的該種細胞的干細胞;(2)提供所述復合結構的細胞分布信息;(3)基于所述復合結構的細胞分布信息,對所述m種微囊進行排布,以制備構建體;(4)培養步驟(3)獲得的構建體,產生所述復合結構。在本發明的某些優選實施方案中,所述復合結構是包含骨細胞和軟骨細胞的復合結構。在某些優選的實施方案中,所述方法包括:(1)提供兩種包含細胞的微囊,其中,第一微囊包含MSC細胞,以及誘導MSC向成骨細胞或骨細胞分化的誘導因子;并且,第二微囊包含MSC細胞,以及誘導MSC向成軟骨細胞或軟骨細胞分化的誘導因子;(2)提供包含骨細胞和軟骨細胞的復合結構的細胞分布信息;(3)基于所述復合結構的細胞分布信息,對所述第一微囊和第二微囊進行排布,以制備構建體;(4)培養步驟(3)獲得的構建體,產生所述復合結構。在某些優選的實施方案中,所述微囊(例如第一微囊和/或第二微囊)包含細胞(例如MSC細胞),和包裹所述細胞的核層,其中所述核層 由生物可降解材料制成。在某些優選的實施方案中,所述微囊還包含封裝所述核層的殼層,其中所述殼層由生物可降解材料制成。在本發明的某些優選實施方案中,所述復合結構是包含內皮細胞和平滑肌細胞的復合結構。在某些優選的實施方案中,所述方法包括:(1)提供兩種包含細胞的微囊,其中,第一微囊包含MSC細胞和內皮細胞;并且,第二微囊包含MSC細胞和平滑肌細胞;(2)提供包含內皮細胞和平滑肌細胞的復合結構的細胞分布信息;(3)基于所述復合結構的細胞分布信息,對所述第一微囊和第二微囊進行排布,以制備構建體;(4)培養步驟(3)獲得的構建體,產生所述復合結構;優選地,所述微囊(例如第一微囊和/或第二微囊)包含細胞(例如MSC細胞,以及內皮細胞或平滑肌細胞),包裹細胞的核層,和,任選地,封裝所述核層的殼層;優選地,所述核層和任選的殼層各自獨立地由生物可降解材料制成。在另一個方面,還提供了通過本發明方法制備的復合結構。在某些優選的實施方案中,所述復合結構是包含骨細胞和軟骨細胞的復合結構。在某些優選的實施方案中,所述復合結構是包含內皮細胞和平滑肌細胞的復合結構。在另一個方面,還提供了本發明的復合結構的各種應用,例如用于研究領域或醫藥領域的應用。例如,本發明的復合結構可用于研究干細胞分化,用于藥物發現,用于藥物篩選,用于體內或體外測定,用于植入宿主體內,用于組織工程或用于組織再生。在另一個方面,本發明提供了一種試劑盒,其包含通過本發明方法制備的復合結構(例如包含骨細胞和軟骨細胞的復合結構,例如包含內皮細胞和平滑肌細胞的復合結構)。下面將結合附圖和發明詳述來對本發明的實施方案進行詳細闡釋。但是,本領域技術人員將理解,下列附圖和發明詳述僅用于說明本發明,而不是對本發明的范圍的限定。根據附圖和發明詳述的詳細 公開內容,本發明的各種目的和有利方面對于本領域技術人員來說將變得顯然。附圖說明圖1示意性描述了本發明的一種微囊的結構,其包括:細胞,其能夠進行生長、增殖、分化或遷移;包裹所述細胞的核層,其由生物可降解材料制成,并且為細胞的生命活動提供微環境,例如營養物質;和,任選地,封裝所述核層的殼層,其位于最外側,由生物可降解材料制成,并且為內部的核層和細胞提供力學保護。此外,所述殼層是通透性的,具有用于微囊內外物質交換的通道。在優選的實施方案中,細胞可均勻分散于核層中,或者可以聚集在一起,位于核層內部。圖2A-C示意性描述了使用本發明微囊構建的三維構建體的結構實例。圖2A-B描述的三維構建體包括兩層結構,即,成骨層(其包含第一微囊)和成軟骨層(其包含第二微囊)。其中,成骨層由第一微囊構建;成軟骨層由第二微囊構建。成骨層和成軟骨層各自可以由一層或多層細胞構成,根據所使用的微囊中含有的細胞的具體數量而定。微囊之間的間隙填充有生物粘合劑。在優選的實施方案中,生物粘合劑中可進一步包含維持、促進、改善、調控微囊內的細胞的生命活動的試劑。在優選的實施方案中,本發明的三維構建體是使用本發明的第一和第二微囊,通過3D生物打印方法而構建的。然而,不受于理論限制,本發明的三維構建體也可以使用本發明的第一和第二微囊,通過任何其他已知的方法(例如手工放置的方法)來構建。圖2C描述的三維構建體包括三層結構,即,內皮細胞層,平滑肌細胞層和成纖維細胞層。其中,內皮細胞層由包含內皮細胞的微囊構建;平滑肌細胞層由包含平滑肌細胞的微囊構建;成纖維細胞層由包含成纖維細胞的微囊構建。內皮細胞層,平滑肌細胞層和成纖維細胞層各自可以由一層或多層細胞構成,根據所使用的微囊中含有的細胞的具體數量而定。微囊之間的間隙填充有生物粘合劑。在優選的實施 方案中,生物粘合劑中可進一步包含維持、促進、改善、調控微囊內的細胞的生命活動的試劑。例如,當微囊中的細胞為內皮細胞時,生物粘合劑中可進一步包含促進內皮細胞生長和分化的細胞因子。在優選的實施方案中,本發明的三維構建體是使用本發明的微囊,通過3D生物打印方法而構建的。然而,不受于理論限制,本發明的三維構建體也可以使用本發明的微囊,通過任何其他已知的方法(例如手工放置的方法)來構建。圖3A-3C顯示了使用造粒儀在不同儀器參數下制備的微囊的相差顯微照片,其中,圖3A中的微囊的直徑為約120μm(標尺為100μm);圖3B中的微囊的直徑為約200μm(標尺為100μm);圖3C中的微囊的直徑為約450μm(標尺為200μm)。圖3A-3C的微囊中所使用的細胞為人臍靜脈內皮細胞(HUVEC),殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原。這些結果表明,可通過控制造粒儀的儀器參數(例如,同心噴嘴的內噴嘴和外噴嘴的直徑)來控制微囊的尺寸。本發明的微囊的尺寸是可控的,可根據需要進行選擇。圖4顯示了通過實施例1方法制備的微囊A的顯微照片,其中,高亮部分代表微囊的殼層,且該殼層的厚度為約2μm(標尺為50μm)。圖4的微囊中所使用的細胞為人臍靜脈內皮細胞(HUVEC),殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原。結果表明,可通過控制造粒儀的同心噴嘴的內噴嘴和外噴嘴的直徑,殼層材料的泵出速度等參數來控制殼層的厚度。本發明的微囊的殼層厚度是可控的,可根據需要進行選擇。圖5A-5C顯示了通過實施例1方法制備的微囊的顯微照片,其中,圖5A中的微囊包裹的細胞數為約50個(標尺為100μm);圖5B中的微囊包裹的細胞數為約8個(標尺為100μm);圖5C中的微囊包裹的細胞數為約2個(標尺為100μm)。圖5A-5C的微囊中所使用的細胞為人臍靜脈內皮細胞(HUVEC),殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原。這些結果表明,可通過控制細胞懸液的細胞濃度來控制微囊包裹的細胞數。本發明微囊包含的細胞的數量是可 控的,可根據需要進行選擇。圖6A-6D顯示了使用造粒儀制備的微囊B1-B4的顯微照片,其中,圖6A中的微囊為微囊B1,其直徑為約600μm(標尺為500μm);圖6B中的微囊為微囊B2,其直徑為約500μm(標尺為500μm);圖6C中的微囊為微囊B3,其直徑為約500μm(標尺為500μm);圖6D中的微囊為微囊B4,其直徑為約500μm(標尺為500μm)。這些結果表明,可使用各種合適的生物可降解材料來制備本發明的微囊。圖6E顯示了用包裹有trackerCM-Dil(紅色熒光)標記的細胞的核層材料和帶有FITC(綠色熒光)的殼層材料制備的微囊B2的共聚焦顯微圖像,其中,綠色熒光代表殼層,紅色熒光代表核層所包裹的細胞。圖7A顯示了使用本發明的微囊制備的生物墨汁的顯微照片。其中,微囊包含人臍靜脈內皮細胞(HUVEC),并且其殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原,且包含甲基紫染料;生物粘合劑的主要成分是海藻酸鈉+明膠。如圖7A所示,紫色染色僅存在于微囊內部,而不存在于生物墨汁的載體(生物粘合劑)中。這表明微囊的殼層能夠在生物墨汁中保持微囊的完整性。圖7B顯示了用本發明的生物墨汁打印得到的單細胞層的顯微照片。其中,微囊包含人臍靜脈內皮細胞(HUVEC),并且其殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原,且包含甲基紫染料;生物粘合劑的主要成分是海藻酸鈉+明膠。如圖7B所示,紫色染色僅存在于微囊內部,而不存在于生物墨汁的載體(生物粘合劑)中。這表明微囊的殼層能夠在生物打印過程中保持微囊的完整性。圖8顯示了所使用的生物粘合劑(海藻酸鈉+明膠)的粘度分析。結果顯示,在25℃-40℃下,所使用的生物粘合劑的粘度為30-160Pas;并且,隨著溫度升高,生物粘合劑的粘度有所下降。圖9A-9D顯示了使用共聚焦顯微鏡觀察通過實施例1方法制備的微囊中細胞活力的分析結果,其中,所述微囊用鈣黃綠素(綠色熒光)和碘化丙啶(紅色熒光)進行了雙重染色;所使用的細胞為人臍靜脈內 皮細胞(HUVEC),殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原。圖9A顯示了在微囊制備之后立即進行的微囊中細胞活力的分析結果。在圖9A中,每個標記的白色圓圈代表一個微囊,并且,高亮點為紅色熒光(代表死細胞),低亮點為綠色熒光(代表活細胞)。圖9A的結果顯示,在用實施例1的方法制備微囊后,微囊中98%以上的細胞存活。圖9B顯示了將制備的微囊在4℃下貯存3小時后,微囊中細胞活力的分析結果。在圖9B中,每個標記的白色圓圈代表一個微囊,并且,高亮點為紅色熒光(代表死細胞),低亮點為綠色熒光(代表活細胞)。圖9B的結果顯示,所制備的微囊在4℃下保存3小時后,微囊中的細胞仍然保持高活力(存活率為90%)。圖9C顯示了在將微囊制備成生物墨汁并進行生物打印后,立即進行的微囊中細胞活力的分析結果。在圖9C中,高亮點為紅色熒光(代表死細胞),低亮點為綠色熒光(代表活細胞)。圖9C的結果顯示,將微囊制備成生物墨汁并立即進行生物打印后,微囊中的細胞仍然保持高活力(存活率為97%)。圖9D顯示了所制備的微囊在37℃下,在H-DMEM培養基中培養5天后,微囊中細胞活力的分析結果。在圖9D中,高亮點為紅色熒光(代表死細胞),低亮點為綠色熒光(代表活細胞)。圖9D的結果顯示,所制備的微囊在37℃下培養5天后,微囊中的細胞仍然保持高活力(存活率為95%)。圖10A-10B顯示了使用共聚焦顯微鏡觀察通過實施例1方法制備的微囊中細胞的粘附和伸展的分析結果,其中,所述微囊用鈣黃綠素(綠色熒光)和碘化丙啶(紅色熒光)進行了雙重染色;所使用的細胞為HepG2細胞,殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原。圖10A顯示了在培養微囊第1天,使用共聚焦顯微鏡觀察到的照片(放大倍數:40倍),其中細胞呈圓形,未粘附伸展。圖10B顯示了 培養所述微囊5天后,使用共聚焦顯微鏡觀察到的照片(放大倍數:200倍),其中細胞粘附伸展。圖10A-10B的結果表明,在培養5天后,微囊內的細胞伸展并建立細胞間連接。圖11顯示了使用共聚焦顯微鏡觀察微囊中的細胞增殖的分析結果(放大倍數:200倍),其中,所述微囊用DAPI(藍色熒光)和EdU(紅色熒光)進行了雙重染色;所使用的細胞為HepG2細胞,殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原。圖11的結果表明,在培養5天后,微囊內的細胞處于增殖狀態。圖12A-12B顯示了通過傳統方法制備的細胞微球在培養過程中的細胞增殖情況(標尺為500μm)。結果顯示,與培養之前(圖12A)相比,培養7天后(圖12B)的細胞微球中的細胞增殖不明顯,細胞呈圓形,散在分布。圖12C-12D顯示了使用實施例1方法制備的微囊在培養過程中的細胞增殖情況(標尺為500μm)。結果顯示,與培養之前(圖12C)相比,培養7天后(圖12D)的微囊中的細胞增殖明顯,細胞在微囊中伸展、粘附,并相互連接在一起。圖12E顯示了使用實施例1方法制備的微囊在培養7天后的顯微照片(標尺為100μm)。結果顯示,微囊中的HepG2細胞之間相互連接,形成有機的整體。圖12A-12E的結果表明,與傳統方法制備的細胞微球相比,本發明的微囊能夠更好地促進細胞的增殖,促進細胞之間建立連接。圖13顯示了使用共聚焦顯微鏡觀察培養7天后的微囊的結果(圖中標尺為100μm),其中,所使用的微囊包含用綠色熒光標記的HepG2細胞和用紅色熒光標記的HUVEC細胞,并且圖中的黃色區域是由紅色熒光和綠色熒光疊加所致,這表明HepG2細胞和HUVEC細胞之間建立了連接。結果顯示,微囊內部的HepG2細胞之間、HUVEC細胞之間以及HepG2細胞與HUVEC細胞之間均建立了細胞間連接。圖14A顯示了使用共聚焦顯微鏡觀察培養7天后的微囊的結果(圖中標尺為100μm),其中,所使用的微囊包含分別用celltrackerGreenCMFDA(綠色熒光)標記的HepG2細胞和HUVEC細胞。結果顯示,兩個微囊的細胞之間建立了細胞連接,如方框中的橋狀結構所顯示的。圖14B顯示了使用共聚焦顯微鏡觀察培養7天后的微囊的結果(圖中標尺為500μm),其中,使用了兩種微囊:一種微囊包含用celltrackerGreenCMFDA(綠色熒光)標記的HepG2細胞,且另一種微囊包含用trackerCM-Dil(紅色熒光)標記的HUVEC細胞;并且,圖中的黃色區域是由紅色熒光和綠色熒光疊加所致。結果顯示,表達紅色熒光的微囊與表達綠色熒光的微囊之間建立了細胞連接,如圖中的黃色區域所顯示的。圖14C顯示了使用共聚焦顯微鏡觀察培養7天后的微囊的結果(圖中標尺為500μm),其中,所使用的微囊包含用celltrackerGreenCMFDA(綠色熒光)標記的HepG2細胞和HUVEC細胞;并且,圖中的各個白色圓環分別表示一個微囊。結果顯示,不同微囊的細胞之間建立了細胞連接,并形成有機的整體。圖15顯示了包含MSC細胞的微囊的顯微照片,其中,圖15A顯示了包含MSC細胞的單個微囊(標尺為100μm);圖15B顯示了培養7天后的包含MSC細胞的微囊(標尺為500μm);圖15C顯示了培養9天后的包含MSC細胞的微囊(標尺為500μm)。結果顯示,培養7天后,多個包含MSC細胞的微囊相互融合(如圖15B中的白色箭頭所指示的);并且,培養9天后,包含MSC細胞的微囊完全融合,形成有機整體(如圖15C所顯示的)。圖16A顯示了通過實施例10的方法制備的第一微囊在37℃,5%CO2下培養1天后的顯微照片。結果顯示,細胞正常生長,但未出現分化。圖16B顯示了通過實施例10的方法制備的第一微囊在37℃,5%CO2下培養10天后經茜素紅染色的顯微照片,其中,粗箭頭所指處為一個完整的微囊,細箭頭所指處為鈣結節。結果顯示,微囊內出現大量鈣結節,如細箭頭所指示的。這表明,第一微囊中的MSC細胞向成骨細胞分化。圖17顯示了使用本發明的微囊制備含有內皮細胞和平滑肌細胞的復合結構的過程,包括將實施例15制備的第一微囊規則排列在組織前 體的外層,將實施例15制備的第二微囊規則排列在組織前體的內部,形成組織前體。圖18顯示了使用本發明的微囊制備的含有內皮細胞和平滑肌細胞的復合結構的染色結果。結果顯示:(1)經過培養后,第一微囊內的MSC干細胞分化為內皮細胞,且,第二微囊內的MSC干細胞分化為平滑肌細胞;(2)第一微囊和第二微囊內的細胞按照設計好的結構規則排列:含有內皮細胞的組織位于組織塊的外層,含有平滑肌細胞的組織位于組織塊的內部;并且,(3)兩種微囊融合成有機的整體(即,復合結構)。這些實驗結果表明,所制備的微囊可以用于制備含有內皮細胞和平滑肌細胞的復合結構。圖19示意性地描述了使用本發明的微囊/生物墨汁來生物打印血管的流程圖。發明詳述術語定義在本發明中,除非另有說明,否則本文中使用的科學和技術名詞具有本領域技術人員所通常理解的含義。然而,為了更好地理解本發明,下面提供本說明書中的相關術語的定義和解釋。當本說明書中給出的定義與本領域技術人員所通常理解的含義相沖突時,以本說明書中的定義為準。如本說明書和所附權利要求書中使用的,單數形式“一個”、“一種”和“該/所述”包括復數的指示物,除非上下文另有明確規定。此外,本文中任何提及的“或”意在包括“和/或”,除非另有說明。如本文中所使用的,術語“微囊”用于指本發明人構建的一種基本結構單元,其可用于多個領域,例如生物打印(如3D生物打印)、組織工程、再生醫學等領域。特別地,本發明的微囊具有特定的結構和組成,即,其包括:細胞,和包裹所述細胞的核層,其中所述核層由生物可降解材料制成。在某些優選的實施方案中,所述微囊還任選地包括,封裝所述核層的殼層,其中所述殼層由生物可降解材料制成。 本發明的微囊的一種示意性結構可參見圖1。在本發明中,微囊不局限于特定的形狀或大小,例如,其可以是球形的,或者任何期望的形狀。如本文中使用的,術語“生物打印”是指:利用生物材料(包括但不限于,生物分子例如蛋白質,脂質,核酸和代謝產物;細胞例如細胞溶液、含細胞的凝膠、細胞懸浮液、細胞濃縮物、多細胞聚集體和多細胞體;亞細胞結構例如細胞器和細胞膜;與生物分子相關的分子例如合成的生物分子或生物分子的類似物)的打印。如本文中使用的,術語“打印”是指,按照預定的模式沉積材料的過程。在本發明中,生物打印優選地通過與自動的或半自動的、計算機輔助的三維原型裝置(例如生物打印機)相匹配的方法來實現。然而,在本發明中,“打印”(例如生物打印)可通過各種方法來進行,包括但不限于,使用打印機(例如3D打印機或生物打印機)進行打印;使用自動化或非自動化機械過程(而非打印機)進行打印;通過手工放置或手工沉積(例如使用移液器)進行打印。如本文中使用的,術語“組織”是指由形態相同或類似、機能相同的細胞群構成的細胞集合體,并且通常還包含非細胞形態的物質(稱為細胞間質,例如基質、纖維等)。組織可包括一種或多種細胞。如本文中使用的,術語“器官”是指由不同的細胞和組織構成的、用于實現某一或某些特定功能的結構。器官可包括一種或多種組織。“人工組織”是指,不是通過天然組織生成或發育過程在生物體內形成的組織。人工組織可以是人為制造的組織,例如通過生物打印方法獲得的組織。在本發明中,術語“人工組織”和“組織構建體”可互換使用。如本文中使用的,術語“組織前體”是指細胞集合體,其在培養、誘導或操作步驟后,能夠形成組織。在本發明中,組織前體可以是人為制造的組織前體(即,人工組織前體)。特別地,在本發明中,組織的實例包括但不限于:結締組織(例如,疏松結締組織、致密結締組織、彈性組織、網狀結締組織和脂肪組織)、肌肉組織(例如,骨骼肌、平滑肌和心肌)、泌尿生殖組織、胃腸組織、 肺組織、骨組織、軟骨組織、神經組織和上皮組織(例如,單層上皮和復層上皮)、內胚層來源的組織、中胚層來源的組織和外胚層來源的組織。特別優選地,在本發明中,組織是骨組織,軟骨組織,和/或關節組織。如本文中使用的,術語“構建體”是指,使用本發明的微囊構建的物體,其可以具有二維或三維的結構,并且可以是組織前體,組織或器官。特別優選地,在本發明中,構建體是包含骨和軟骨的復合結構,或用于形成包含骨和軟骨的復合結構。如本文中使用的,術語“組織工程”具有本領域技術人員通常理解的含義。特別地,組織工程是跨學科的領域,其應用并結合了工程學和生命科學的原理,并且通常是指,使用生物替代品(例如本發明的微囊)來恢復、保持或改善組織功能。經典組織工程學的基本原理是:從機體獲取少量的活體組織,用特殊的酶或其他方法將細胞(又稱種子細胞)從組織中分離出來在體外進行培養擴增,然后將擴增的細胞與具有良好生物相容性、可降解性和可吸收的生物材料(支架)按一定的比例混合,使細胞黏附在生物材料(支架)上形成細胞-材料復合物;將該復合物植入機體的組織或器官病損部位,隨著生物材料在體內逐漸被降解和吸收,植入的細胞在體內不斷增殖并分泌細胞外基質,最終形成相應的組織或器官,從而達到修復創傷和重建功能的目的。本發明的微囊具有下述顯著的優點:微囊所包裹的細胞(例如MSC細胞)的數目是可控的;并且微囊本身的尺寸也是可控的;并且,微囊的核層和任選的殼層各自由生物可降解材料制成;從而特別適合用于組織工程。如本文中使用的,“生物相容性材料”是指這樣的材料,其(以及其降解產物)對于細胞是無毒性的,并且在植入宿主(例如人體)后與宿主相容,不會造成顯著的或者嚴重的副作用,例如,不會對宿主(例如人體組織)造成毒害作用,不會引起宿主的免疫排斥反應、過敏反應或炎癥反應等等。如本文中使用的,“生物可降解材料”是指這樣的材料,其能夠被細胞或生物體降解和吸收,并且其降解產物是生物相容性的。此類 材料可以是天然來源的(例如來源于動植物),也可以是人工合成的。如本文中使用的,“經過改性的可降解聚合物”是指,通過化學和/或物理方法,改變原始聚合物具有的化學性質和/或物理性質而得到的可降解聚合物。例如,可通過化學反應改變原始聚合物的主鏈或側鏈上的原子或原子團的種類和/或結合方式,從而獲得經過改性的可降解聚合物。例如,對海藻酸鈉進行氧化反應,以得到改性的海藻酸鈉(即,氧化的海藻酸鈉)。如本文中所使用的,術語“力學保護”是指,殼層具有一定的硬度和彈性模量,從而能夠減少或避免其封裝的細胞遭受外界的機械損傷/力學損傷(例如,3D生物打印過程中可能產生的剪切力,擠壓力等引起的損傷)。如本文中使用的,“生物粘合劑”是指,起粘合作用的、與細胞和生物體相容的、可降解的材料。其具體實例可包括,但不限于膠原、纖維蛋白、殼聚糖、海藻酸鹽、淀粉、透明質酸、層粘連蛋白、彈性蛋白、明膠、聚氨基酸(例如聚賴氨酸)、瓊脂糖、葡聚糖、甲基纖維素、聚乙烯醇、聚丙烯酸及其衍生物(例如聚甲基丙烯酸,丙烯酸和甲基丙烯酸的共聚物),或其任何組合。如本文中使用的,“凝聚”指將細胞、細胞聚集體、多細胞聚集體、多細胞體和/或它們的層結合起來的細胞-細胞粘附。該術語可以與“融合”互換使用。如本文中使用的,“層狀”是指多層的、生物打印的組織,其中兩個或多個平面層組合起來以增加該組織在z平面(即,垂直平面)的總厚度。在一些實施方案中,每個平面層在結構和/或組成上可以是基本類似的。在其它實施方案中,每個平面層在結構和/或組成上可以是基本上獨特的,即彼此不同。此外,在每個平面層的x-y平面(即:水平平面)內,多個微囊(或者其中的細胞)和/或空隙空間相對于彼此空間布置成設定的圖案。如本文中使用的,“一層或多層”是指,由至少一個平面層/組織層組成,其中每個平面層/組織層是一個或多個細胞層的厚度。由于本 發明的微囊可以包含一個細胞,也可以包含多個細胞(例如100個或1000個)。因此,在一些實施方案中,平面層/組織層為一個細胞層的厚度。在其它實施方案中,平面層/組織層為多個細胞層的厚度。此外,在3D生物打印過程中,可以一次沉積一個層,也可以同時沉積多個層。任選地,每個平面層/組織層包含多種細胞類型。此外,在每個平面層/組織層中的多種細胞類型任選地在x-y平面(即:水平平面)上以空間限定的結構相對于彼此排列。此外,在某些情況下,在z-平面(即:垂直平面)上的組織層增加導致細胞在組織層內相對于彼此的受控空間定位,使得空間限定的結構在z-平面上繼續。如本文中使用的,“試劑”是指化學試劑,生化試劑或藥物,包括但不限于,小分子化合物,激素,肽(例如寡肽或蛋白質),核酸(寡核苷酸,DNA,RNA或化學修飾的核酸)等,其對細胞活性,功能和/或行為具有作用或影響。試劑可以是天然來源的,重組產生的,或化學合成的。“刺激”是指,化學因素(例如試劑,酸,堿,氧濃度等)或物理因素(例如溫度,輻照,機械力等),其對細胞活性,功能和/或行為具有作用或影響。如本文中使用的,“受試者”是指動物,例如脊椎動物。優選地,受試者為哺乳動物,例如人,牛科動物,馬科動物,貓科動物,犬科動物,嚙齒類動物或靈長類動物。特別優選地,受試者為人。在本文中,該術語可以與“患者”、“受體”和“供體”互換使用。在本文中,除非上下文明確指出,否則術語“微囊”是指m種微囊中的任意一種或多種,例如第一微囊和/或第二微囊。因此,在一個方面,本發明提供了一種制備包含m種細胞的復合結構的方法,其中,m為≥2的整數,所述方法包括:(1)提供m種包含細胞的微囊,其中,每種微囊各自對應于復合結構中的一種細胞,即,每種微囊各自包含復合結構中的一種細胞,和/或能夠分化為復合結構中的該種細胞的干細胞;(2)提供所述復合結構的細胞分布信息;(3)基于所述復合結構的細胞分布信息,對所述m種微囊進行排布,以制備構建體;(4)培養步驟(3)獲得的構建體,產生所述復合結構。在某些優選的實施方案中,所述復合結構的m種細胞是由同一種干細胞分化而來的。在這種情況下,步驟(1)所述的m種微囊可包含相同的干細胞,并且每種微囊各自包含誘導所述干細胞分化為復合結構中的一種細胞的誘導因子。例如,在某些優選的實施方案中,所述復合結構是包含骨細胞和軟骨細胞的復合結構。骨細胞和軟骨細胞可以由相同的干細胞(例如MSC細胞)分化而來。例如,可使用誘導MSC向成骨細胞或骨細胞分化的誘導因子來誘導微囊中的MSC細胞分化為骨細胞;并且,可使用誘導MSC向成軟骨細胞或軟骨細胞分化的誘導因子來誘導微囊中的MSC細胞分化為軟骨細胞。因此,在這種情況下,本發明的方法可包括:(1)提供兩種包含細胞的微囊,其中,第一微囊包含MSC細胞,以及誘導MSC向成骨細胞或骨細胞分化的誘導因子;并且,第二微囊包含MSC細胞,以及誘導MSC向成軟骨細胞或軟骨細胞分化的誘導因子;(2)提供包含骨細胞和軟骨細胞的復合結構的細胞分布信息;(3)基于所述復合結構的細胞分布信息,對所述第一微囊和第二微囊進行排布,以制備構建體;(4)培養步驟(3)獲得的構建體,產生所述復合結構。在某些優選的實施方案中,所述微囊(例如第一微囊和/或第二微囊)包含細胞(例如MSC細胞),和包裹所述細胞的核層,其中所述核層由生物可降解材料制成。在某些優選的實施方案中,所述微囊(例如第一微囊和/或第二微囊)任選地還包含封裝所述核層的殼層,其中所述殼層由生物可降解材料制成。在某些優選的實施方案中,所述微囊(例如第一微囊和/或第二微囊)包含干細胞(例如MSC細胞)。在此情況下,在某些優選的實施方案 中,所述微囊的核層和任選的殼層還可包含誘導所述干細胞分化為復合結構中的一種細胞的誘導因子(例如,誘導MSC向成骨細胞或骨細胞分化的誘導因子,或誘導MSC向成軟骨細胞或軟骨分化的誘導因子)。在某些優選的實施方案中,所述m種微囊包含相同的干細胞,但各自包含不同的誘導所述干細胞分化的誘導因子。在某些優選的實施方案中,所述第一微囊包括:MSC細胞,包裹所述MSC細胞的核層,和,任選地,封裝所述核層的殼層,其中所述核層和任選的殼層各自獨立地由生物可降解材料制成,并且所述核層包含誘導MSC向成骨細胞或骨細胞分化的誘導因子。在某些優選的實施方案中,所述第二微囊包括:MSC細胞,包裹所述MSC細胞的核層,和,任選地,封裝所述核層的殼層,其中所述核層和任選的殼層各自獨立地由生物可降解材料制成,并且所述核層包含誘導MSC向成軟骨細胞或軟骨分化的誘導因子。在某些優選的實施方案中,所述復合結構的m種細胞是由同一種干細胞分化而來的,步驟(1)所述的m種微囊既包含相同的干細胞,還各自包含復合結構中的一種細胞。例如,在某些優選的實施方案中,所述復合結構是包含內皮細胞和平滑肌細胞的復合結構。內皮細胞和平滑肌骨細胞可以由相同的干細胞(例如MSC細胞)分化而來。因此,在這種情況下,本發明的方法可包括:(1)提供兩種包含細胞的微囊,其中,第一微囊包含MSC細胞和內皮細胞;并且,第二微囊包含MSC細胞和平滑肌細胞;(2)提供包含內皮細胞和平滑肌細胞的復合結構的細胞分布信息;(3)基于所述復合結構的細胞分布信息,對所述第一微囊和第二微囊進行排布,以制備構建體;(4)培養步驟(3)獲得的構建體,產生所述復合結構;在某些優選的實施方案中,所述第一微囊包括:MSC細胞和內皮細胞,包裹所述MSC細胞和內皮細胞的核層,和,任選地,封裝所述 核層的殼層;優選地,所述核層和任選的殼層各自獨立地由生物可降解材料制成;在某些優選的實施方案中,所述第二微囊包括:MSC細胞和平滑肌細胞,包裹所述MSC細胞和平滑肌細胞的核層,和,任選地,封裝所述核層的殼層,其中所述核層和任選的殼層各自獨立地由生物可降解材料制成;在本發明的某些優選實施方案中,所述核層和任選的殼層中的生物可降解材料能夠減少或避免微囊內的細胞在操作(例如生物打印)過程中遭受機械損傷,并且能夠提供物質(例如營養物質,細胞外基質,細胞因子,藥物活性成分等)的可控釋放,以促進細胞活性和功能(增殖、分化、遷移、分泌或新陳代謝)。在某些實施方案中,所述方法用于制備包含骨細胞和軟骨細胞的復合結構,所述方法包括提供兩種包含細胞的微囊,其中,第一微囊和第二微囊均包含MSC細胞,并且第一微囊包含誘導因子,其能夠促進MSC細胞分化為成骨細胞,并最終形成骨細胞和骨結構;第二微囊包含誘導因子,其能夠促進MSC細胞分化為成軟骨細胞,并最終形成軟骨細胞核軟骨結構。在某些優選的實施方案中,所述核層提供了適合細胞粘附和伸展的空間結構和微環境,從而細胞在該結構內能夠正常進行增殖、分化、遷移、分泌或新陳代謝。所述微環境指細胞所生長的環境,其包含的要素包括物理因素,比如空間結構、力學強度、溫度、濕度、滲透壓等;化學因素,比如酸堿度、離子濃度等;生物因素,包括細胞、細胞因子等。這些要素共同構成細胞生命活動的環境,并對在這個環境中生長的細胞的增殖、分化、遷移、分泌和新陳代謝進行動態調控。在某些實施方案中,所述核層能夠為細胞的生命活動提供微環境,例如空間結構、營養物質等。優選地,所述核層各自獨立地由生物可降解材料制成,并且所述生物可降解材料是生物相容性的。在本發明中,使用生物可降解材料來制備微囊的核層是特別優選的。特別地,對于微囊的某些用途(例如,生物打印,制備構建體, 組織工程等)而言,無法降解的材料的使用是不利的。這是因為,一方面,這些無法降解的材料將被保留在所獲得的構建體或人工組織中,從而限制構建體或人工組織的應用;另一方面,這些無法降解的材料將阻礙不同微囊的細胞之間建立細胞連接,不利于構建有機的整體(例如,人工組織)。因此,生物可降解材料在核層中的使用對于利用微囊來制備構建體、人工組織、器官是特別有利的和優選的。在本發明的實施方案中,用于制備核層的生物可降解材料可以是天然存在的(例如來源于動植物的天然存在的生物可降解材料,例如膠原蛋白,纖維蛋白,殼聚糖,海藻酸鹽,淀粉,透明質酸,層粘連蛋白,瓊脂糖,明膠,葡聚糖,以及其任意組合),人工合成的,重組產生的,經過改性的,或者其任何組合。在某些優選的實施方案中,用于制備核層的所述生物可降解材料是天然存在的可降解聚合物。優選地,所述可降解聚合物選自膠原蛋白,纖維蛋白,殼聚糖,海藻酸鹽,淀粉,透明質酸,層粘連蛋白,瓊脂糖,明膠,葡聚糖,以及其任意組合。在某些優選的實施方案中,用于制備核層的所述生物可降解材料是經過改性的可降解聚合物,例如經過改性的海藻酸鹽,例如氧化海藻酸鹽(例如氧化海藻酸鈉)。在某些優選的實施方案中,用于制備核層的所述生物可降解材料是合成的可降解聚合物。此類可降解聚合物包括但不限于,聚磷腈,聚丙烯酸及其衍生物(例如聚甲基丙烯酸,丙烯酸和甲基丙烯酸的共聚物),聚乳酸(PLA),聚羥基乙酸(PGA),聚乳酸-乙醇酸共聚物(PLGA),聚原酸酯(POE),聚己內酯(PCL),聚羥基丁酸酯(PHB),聚氨基酸(polyaminoacid)(例如聚賴氨酸),可降解性聚氨酯,以及其任何組合。在某些優選的實施方案中,用于制備核層的所述生物可降解材料包含天然存在的可降解聚合物和合成的可降解聚合物。在某些優選的實施方案中,用于制備核層的所述生物可降解材料能夠被酶(例如細胞分泌的酶)所降解。不同的生物可降解材料的降解 速率差異很大,其范圍可以為一個月到數年。然而在本發明中,特別優選地,用于制備核層的生物可降解材料在不超過2個月的時間內降解,例如在不超過1個月的時間內降解,例如在不超過30天、不超過25天、不超過20天、不超過15天、不超過10天、不超過5天、不超過4天、不超過3天、不超過2天、或不超過1天的時間內降解。例如,用于制備核層的生物可降解材料可以在1-2天,2-3天,3-4天,4-5天,5-10天,10-15天,15-20天,20-25天,25-30天,或30-60天的時間內降解。降解速率與生物可降解材料的分子組成、分子量大小和分子排列(例如,直鏈或支鏈)密切相關。一般情況下,分子量越高、分子排列越緊密,降解時間越長。因此,核層的降解速率可通過對核層的組分和/或含量的配置來控制。例如,為了獲得更快的降解速率,可使用低含量(例如低于0.5%、1%、2%、3%、4%、或5%)的生物可降解材料、低分子量(例如低于500Da、1kDa、2kDa、3kDa、5kDa、或10kDa)的生物可降解材料,和/或具有疏松分子排布的生物可降解材料。為了獲得更慢的降解速率,可使用高含量(例如高于0.5%、1%、2%、3%、4%、或5%)的生物可降解材料、高分子量(例如高于500Da、1kDa、2kDa、3kDa、5kDa、或10kDa)的生物可降解材料,和/或具有緊密分子排布的生物可降解材料。另外,還可通過改變微囊的結構(如:多層包裹、表面多孔、孔隙率大小、比表面積等)來調節生物可降解材料的降解速率。此外,生物可降解材料的降解速率還可以通過改變合成該材料的聚合方式和共聚物比例來進行調節;或者,可通過對該材料的交聯來進行調節。各種生物可降解材料是本領域技術人員已知的,并且其降解性能已被進行了廣泛研究(參見例如,AlexanderD.Augst,HyunJoonKong,DavidJ.Mooney,AlginateHydrogelsasBiomaterials,Macromol.Biosci.2006,6,623-633)。本領域技術人員可根據實際需要,選擇合適的生物可降解材料來制備核層。在某些優選的實施方案中,所述核層的降解能夠提供維持或促進所述細胞的生命活動的微環境,例如營養物質。在某些優選的實施方 案中,核層的降解產物為小分子化合物,例如有機酸、單糖(例如葡萄糖)、寡糖、氨基酸、脂質等。此類降解產物可參與到細胞的新陳代謝活動中,用于合成細胞外基質或轉化為活動所需的能量。在某些優選的實施方案中,用于制備核層的生物可降解材料及其降解產物對于細胞是無毒的,和/或對于宿主是非免疫原性的。在某些優選的實施方案中,用于制備核層的生物可降解材料選自膠原蛋白(例如I型,II型,III型膠原蛋白)、纖維蛋白、殼聚糖、海藻酸鹽(例如海藻酸鈉)、氧化的海藻酸鹽(例如氧化的海藻酸鈉)、淀粉、透明質酸,層粘連蛋白,彈性蛋白,明膠、葡聚糖、聚氨基酸(例如聚賴氨酸)、瓊脂糖,可降解性聚氨酯,或其任何組合。在某些優選的實施方案中,用于制備核層的生物可降解材料含有細胞外基質或其類似物(例如膠原蛋白)。細胞外基質或其類似物(例如膠原蛋白)的使用能夠為微囊內的細胞的生命活動(特別是細胞的生長、粘附、伸展,以及細胞間連接的建立)提供類似于體內的有利的微環境,從而是優選的。例如,I型膠原的空間結構與細胞外基質的空間結構類似,能夠為細胞生存和增殖提供類似于細胞外基質骨架結構的微環境,為細胞生物學功能的實現提供支持。因此,在某些優選的實施方案中,用于制備核層的生物可降解材料為I型膠原或者含有I型膠原。在某些優選的實施方案中,所述核層包含I型膠原蛋白和/或海藻酸鹽,例如包含I型膠原蛋白和海藻酸鈉。在某些優選的實施方案中,I型膠原蛋白和海藻酸鈉在核層中的重量比為約1:1、1:2、1:4、1:6、1:8、3:25、1:9、1:10、1:20、1:30、或1:50。在某些優選的實施方案中,I型膠原蛋白和海藻酸鈉在核層中的重量比為1:1-1:2、1:2-1:4、1:4-1:6、1:6-1:8、1:8-1:9、1:9-1:10、1:10-1:20、1:20-1:30、1:30-1:50、1:1-1:5、1:5-1:10、1:7-1:10、或1:8-1:9。在某些優選的實施方案中,I型膠原蛋白在核層中的重量百分比為約0.01%、0.05%、0.1%、0.125%、0.15%、0.175%、0.2%、0.25%、0.3%、0.4%、0.5%、1%、2%、3%、4%、或5%。在某些優選的實施方案中,I 型膠原蛋白在核層中的重量百分比為0.01%-0.05%、0.05%-0.1%、0.1%-0.125%、0.125%-0.15%、0.15%-0.175%、0.175%-0.2%、0.2%-0.25%、0.25%-0.3%、0.3%-0.4%、0.4%-0.5%、0.5%-1%、1%-2%、2%-3%、3%-4%、4%-5%、0.01%-0.1%、0.1%-0.2%、0.125%-0.175%、0.2%-0.5%、0.1%-0.5%、0.1%-1%、或0.05%-5%。在某些優選的實施方案中,海藻酸鈉在核層中的重量百分比為約0.1%、0.5%、1%、1.25%、1.5%、2%、3%、4%、5%、7.5%、或10%。在某些優選的實施方案中,海藻酸鈉在核層中的重量百分比為0.1%-0.5%、0.5%-1%、1%-1.25%、1.25%-1.5%、1.5%-2%、2%-3%、3%-4%、4%-5%、5%-7.5%、7.5%-10%、0.1%-1%、1%-1.5%、1%-2%、0.5-2.5%、1%-3%、5-10%、或0.5-5%。在某些優選的實施方案中,所述核層包含海藻酸鈉。在某些優選的實施方案中,所述核層包含I型膠原蛋白。在某些優選的實施方案中,所述核層包含淀粉。在某些優選的實施方案中,所述核層包含可降解性聚氨酯。在某些優選的實施方案中,所述核層包含層粘連蛋白。在某些優選的實施方案中,所述核層包含海藻酸鹽(例如海藻酸鈉或海藻酸鈣)和氧化海藻酸鹽(例如氧化海藻酸鈉)。在某些優選的實施方案中,海藻酸鹽(例如海藻酸鈉或海藻酸鈣)和氧化海藻酸鹽(例如氧化海藻酸鈉)在核層中的重量比為約10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1、1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、或1:10。在某些優選的實施方案中,海藻酸鹽(例如海藻酸鈉或海藻酸鈣)和氧化海藻酸鹽(例如氧化海藻酸鈉)在核層中的重量比為10:1-9:1、9:1-8:1、8:1-7:1、7:1-6:1、6:1-5:1、5:1-4:1、4:1-3:1、3:1-2:1、2:1-1:1、1:1-1:2、1:2-1:3、1:3-1:4、1:4-1:5、1:5-1:6、1:6-1:7、1:7-1:8、1:8-1:9、1:9-1:10、10:1-5:1、5:1-1:1、1:1-1:5、1:5-1:10、2:1-1:2、4:1-1:4、或10:1-1:10。在某些優選的實施方案中,所述核層為凝膠狀。在某些實施方案中,所述方法用于制備包含骨細胞和軟骨細胞的復合結構,所述方法包括提供兩種包含細胞的微囊,其中,第一微囊包含MSC細胞,以及誘導MSC向成骨細胞或骨細胞分化的誘導因子; 并且,第二微囊包含MSC細胞,以及誘導MSC向成軟骨細胞或軟骨細胞分化的誘導因子。在某些優選的實施方案中,所述誘導MSC向成骨細胞或骨分化的誘導因子包含地塞米松、抗壞血酸和甘油磷酸。在某些優選的實施方案中,所述核層能夠以受控的方式釋放誘導MSC向成骨細胞或骨分化的誘導因子。在某些優選的實施方案中,所述誘導MSC向成軟骨細胞或軟骨分化的誘導因子包含TGF-β3、地塞米松、2-磷酸抗壞血酸、丙酮酸鈉、脯氨酸和胰島素-轉鐵蛋白-硒溶液。在某些優選的實施方案中,所述核層能夠以受控的方式釋放誘導MSC向成軟骨細胞或軟骨分化的誘導因子。此外,在某些優選的實施方案中,本發明的第一微囊的任選的殼層也包含誘導MSC向成骨細胞或骨分化的誘導因子。在某些優選的實施方案中,所述誘導MSC向成骨細胞或骨分化的誘導因子包含地塞米松、抗壞血酸和甘油磷酸。在某些優選的實施方案中,所述任選的殼層能夠以受控的方式釋放誘導MSC向成骨細胞或骨分化的誘導因子。在某些優選的實施方案中,本發明的第二微囊的任選的殼層也包含誘導MSC向成軟骨細胞或軟骨分化的誘導因子。在某些優選的實施方案中,所述誘導MSC向成軟骨細胞或軟骨分化的誘導因子包含TGF-β3、地塞米松、2-磷酸抗壞血酸、丙酮酸鈉、脯氨酸和胰島素-轉鐵蛋白-硒溶液。在某些優選的實施方案中,所述任選的殼層能夠以受控的方式釋放誘導MSC向成軟骨細胞或軟骨分化的誘導因子。微囊的殼層為包裹的細胞提供了力學保護。在某些優選的實施方案中,所述微囊或微囊的殼層具有一定的力學強度,從而能夠實現立體堆積。在本發明中,特別優選地,微囊及其殼層具有適當的力學保護性能(例如,具有合適的硬度和/或彈性模量)。一方面,微囊內的細胞在操作過程中(例如,在3D打印過程中)易于因外界壓力或剪切力的傷害而受損或死亡。因此,如果微囊及其殼層的硬度和/或彈性模量太低, 那么將導致微囊內的細胞存活率在人工操作后顯著下降,進而導致微囊的應用受到限制,或者需要使用大量的細胞。另一方面,如果微囊及其殼層的硬度和/或彈性模量太高,那么將導致微囊內的細胞的伸展、遷移受到限制,并且阻礙不同微囊的細胞之間建立細胞連接,不利于構建有機的整體(例如,人工組織)。因此,適當的力學保護性能不僅使得能夠對本發明的微囊進行各種操作(例如進行3D生物打印,進行微囊的精確排布等),而且有利于微囊內的細胞伸展、遷移、建立細胞連接,并形成有機的構建體(例如人工組織),因此,是特別優選的。在某些優選的實施方案中,所述任選的殼層為包裹的細胞提供了力學保護。在某些優選的實施方案中,所述微囊或微囊的殼層各自獨立地具有一定的力學強度,從而能夠實現立體堆積。在某些優選的實施方案中,所述微囊或微囊的殼層各自獨立地具有約0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.15、0.2、0.3、或0.4GPa的硬度。在某些優選的實施方案中,所述微囊或微囊的殼層各自獨立地具有0.01-0.02、0.02-0.03、0.03-0.04、0.04-0.05、0.05-0.06、0.06-0.07、0.07-0.08、0.08-0.09、0.09-0.1、0.1-0.15、0.15-0.2、0.2-0.3、0.3-0.4、0.01-0.4、0.01-0.05、0.05-0.1、0.1-0.2、0.2-0.4、0.05-0.15、或0.06-0.1GPa的硬度。在某些優選的實施方案中,所述微囊或微囊的殼層各自獨立地具有約0.083GPa的硬度。在某些優選的實施方案中,所述微囊或微囊的殼層各自獨立地具有約0.01、0.05、0.1、0.5、0.8、1、1.2、1.4、1.6、1.8、2、2.4、2.8、3.2、4、10、20、30、40、50、80、或100MPa的彈性模量。在某些優選的實施方案中,所述微囊或微囊的殼層各自獨立地具有0.01-0.05、0.05-0.1、0.1-0.5、0.5-0.8、0.8-1、1-1.2、1.2-1.4、1.4-1.6、1.6-1.8、1.8-2、2-2.4、2.4-2.8、2.8-3.2、3.2-4、4-10、10-20、20-30、30-40、40-50、50-80、80-100、0.5-4、0.5-1、1-1.5、1.5-2、2-3、0.8-1.6、1.4-2.4、0.8-3.2、0.01-100、1-100、10-100、或0.5-50MPa的彈性模量。在某些優選的實施方案中,所述微囊或微囊的殼層各自獨立地具有約1.683MPa的彈性模量。殼層的力學保護 作用(例如,硬度和彈性模量)可通過對殼層的組分和/或含量的配置來控制。在某些優選的實施方案中,所述任選的殼層也能夠為細胞的生命活動提供微環境,例如營養物質。優選地,所述殼層各自獨立地由生物可降解材料制成,并且所述生物可降解材料是生物相容性的。在本發明中,使用生物可降解材料來制備微囊的殼層是特別優選的。特別地,對于微囊的某些用途(例如,生物打印,制備構建體,組織工程等)而言,無法降解的材料的使用是不利的。這是因為,一方面,這些無法降解的材料將被保留在所獲得的構建體或人工組織中,從而限制構建體或人工組織的應用;另一方面,這些無法降解的材料將阻礙不同微囊的細胞之間建立細胞連接,不利于構建有機的整體(例如,人工組織)。因此,生物可降解材料在殼層中的使用對于利用微囊來制備構建體、人工組織、器官是特別有利的和優選的。在本發明的實施方案中,用于制備殼層的生物可降解材料可以是天然存在的(例如來源于動植物的天然存在的生物可降解材料,例如膠原蛋白,纖維蛋白,殼聚糖,海藻酸鹽,淀粉,透明質酸,層粘連蛋白,瓊脂糖,明膠,葡聚糖,以及其任意組合),人工合成的,重組產生的,經過改性的,或者其任何組合。在某些優選的實施方案中,用于制備殼層的所述生物可降解材料是天然存在的可降解聚合物。優選地,所述可降解聚合物選自膠原蛋白,纖維蛋白,殼聚糖,海藻酸鹽,淀粉,透明質酸,層粘連蛋白,瓊脂糖,明膠,葡聚糖,以及其任意組合。在某些優選的實施方案中,用于制備殼層的所述生物可降解材料是經過改性的可降解聚合物,例如經過改性的海藻酸鹽,例如氧化海藻酸鹽(例如氧化海藻酸鈉)。在某些優選的實施方案中,用于制備殼層的所述生物可降解材料是合成的可降解聚合物。此類可降解聚合物包括但不限于,聚磷腈,聚丙烯酸及其衍生物(例如聚甲基丙烯酸,丙烯酸和甲基丙烯酸的共聚物),聚乳酸(PLA),聚羥基乙酸(PGA),聚乳酸-乙醇酸共聚物(PLGA), 聚原酸酯(POE),聚己內酯(PCL),聚羥基丁酸酯(PHB),聚氨基酸(polyaminoacid)(例如聚賴氨酸),可降解性聚氨酯,以及其任何組合。在某些優選的實施方案中,用于制備殼層的所述生物可降解材料包含天然存在的可降解聚合物和合成的可降解聚合物。在某些優選的實施方案中,用于制備核層和任選的殼層的生物可降解材料是相同的或不同的。在某些優選的實施方案中,核層和任選的殼層分別以不同的重量比包含相同的生物可降解材料。在某些優選的實施方案中,用于制備殼層的所述生物可降解材料能夠被酶(例如細胞分泌的酶)所降解。不同的生物可降解材料的降解速率差異很大,其范圍可以為一個月到數年。在某些優選的實施方案中,然而在本發明中,特別優選地,用于制備殼層的生物可降解材料在不超過1個月的時間內降解,例如在不超過30天、不超過25天、不超過20天、不超過15天、不超過10天、不超過5天、不超過4天、不超過3天、不超過2天、或不超過1天的時間內降解。例如,用于制備殼層的生物可降解材料可以在1-2天,2-3天,3-4天,4-5天,5-10天,10-15天,15-20天,20-25天,或25-30天的時間內降解。特別優選地,用于制備殼層的生物可降解材料在不超過10天的時間內降解。降解速率與生物可降解材料的分子組成、分子量大小和分子排列(例如,直鏈或支鏈)密切相關。一般情況下,分子量越高、分子排列越緊密,降解時間越長。因此,殼層的降解速率可通過對核層的組分和/或含量的配置來控制。例如,為了獲得更快的降解速率,可使用低含量(例如低于0.5%、1%、2%、3%、4%、或5%)的生物可降解材料、低分子量(例如低于500Da、1kDa、2kDa、3kDa、5kDa、或10kDa)的生物可降解材料,和/或具有疏松分子排布的生物可降解材料。為了獲得更慢的降解速率,可使用高含量(例如高于0.5%、1%、2%、3%、4%、或5%)的生物可降解材料、高分子量(例如高于500Da、1kDa、2kDa、3kDa、5kDa、或10kDa)的生物可降解材料,和/或具有緊密分子排布的生物可降解材料。另外,還可通過改變微囊的 結構(如:多層包裹、表面多孔、孔隙率大小、比表面積等)來調節生物可降解材料的降解速率。此外,生物可降解材料的降解速率還可以通過改變合成該材料的聚合方式和共聚物比例來進行調節;或者,可通過對該材料的交聯來進行調節。此外,用于制備殼層的生物可降解材料的降解速率還可受細胞生命活動的影響。在本發明中,特別優選的是,微囊內的細胞能夠生長、伸展、增殖、遷移,并與其他微囊內的細胞建立細胞連接,形成有機的構建體(例如人工組織)。因此,在某些優選的實施方案中,所述微囊的殼層在相對短的時間(例如不超過30天的時間內,例如不超過10天的時間內)降解,以促進不同微囊之間的細胞連接的建立,避免因殼層的存在而阻礙或影響不同微囊之間的細胞建立相互的細胞連接。在某些優選的實施方案中,所述微囊的殼層在不超過30天、不超過25天、不超過20天、不超過15天、不超過10天、不超過5天、不超過4天、不超過3天、不超過2天、或不超過1天的時間內降解。例如,所述微囊的殼層可以在1-2天,2-3天,3-4天,4-5天,5-10天,10-15天,15-20天,20-25天,或25-30天的時間內降解。各種生物可降解材料是本領域技術人員已知的,并且其降解性能已被進行了廣泛研究(參見例如,AlexanderD.Augst,HyunJoonKong,DavidJ.Mooney,AlginateHydrogelsasBiomaterials,Macromol.Biosci.2006,6,623-633)。本領域技術人員可根據實際需要,選擇合適的生物可降解材料來制備殼層。在某些優選的實施方案中,所述任選的殼層的降解能夠提供維持或促進所述細胞的生命活動的微環境,例如營養物質。在某些優選的實施方案中,殼層的降解產物為小分子化合物,例如有機酸、單糖(例如葡萄糖)、寡糖、氨基酸、脂質等。此類降解產物可參與到細胞的新陳代謝活動中,用于合成細胞外基質或轉化為活動所需的能量。在某些優選的實施方案中,用于制備殼層的生物可降解材料及其降解產物對于細胞是無毒的,和/或對于宿主是非免疫原性的。在某些優選的實施方案中,用于制備殼層的生物可降解材料含有 細胞外基質或其類似物(例如彈性蛋白)。細胞外基質或其類似物(例如彈性蛋白)的使用能夠為微囊內的細胞的生命活動(特別是細胞的生長、粘附、伸展,以及細胞間連接的建立)提供類似于體內的有利的微環境,從而是優選的。在某些優選的實施方案中,用于制備殼層的生物可降解材料選自膠原蛋白(例如I型,II型,III型膠原蛋白)、纖維蛋白、殼聚糖、海藻酸鹽(例如海藻酸鈉或海藻酸鈣)、氧化海藻酸鹽(例如氧化海藻酸鈉)、淀粉、透明質酸,層粘連蛋白,彈性蛋白,明膠、葡聚糖、聚氨基酸(例如聚賴氨酸)、瓊脂糖,或其任何組合。在某些優選的實施方案中,所述殼層包含海藻酸鹽(例如海藻酸鈉或海藻酸鈣),例如包含海藻酸鈣和明膠,任選地還包含彈性蛋白。在某些優選的實施方案中,所述殼層包含海藻酸鹽(例如海藻酸鈉或海藻酸鈣)和明膠。在某些優選的實施方案中,海藻酸鹽(例如海藻酸鈉或海藻酸鈣)和明膠在殼層中的重量比為約10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1、1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、或1:10。在某些優選的實施方案中,海藻酸鹽(例如海藻酸鈉或海藻酸鈣)和明膠在殼層中的重量比為10:1-9:1、9:1-8:1、8:1-7:1、7:1-6:1、6:1-5:1、5:1-4:1、4:1-3:1、3:1-2:1、2:1-1:1、1:1-1:2、1:2-1:3、1:3-1:4、1:4-1:5、1:5-1:6、1:6-1:7、1:7-1:8、1:8-1:9、1:9-1:10、10:1-5:1、5:1-1:1、1:1-1:5、1:5-1:10、2:1-1:2、4:1-1:4、或10:1-1:10。在某些優選的實施方案中,所述殼層還包含彈性蛋白。在某些優選的實施方案中,海藻酸鹽(例如海藻酸鈉或海藻酸鈣)和彈性蛋白在殼層中的重量比為約1000:1、500:1、400:1、300:1、250:1、200:1、100:1、50:1或10:1。在某些優選的實施方案中,海藻酸鹽(例如海藻酸鈉或海藻酸鈣)和彈性蛋白在殼層中的重量比為10:1-50:1、50:1-100:1、100:1-200:1、200:1-250:1、250:1-300:1、300:1-400:1、400:1-500:1、500:1-1000:1、10:1-100:1、100:1-200:1、200:1-300:1、300:1-400:1、400:1-1000:1、或100:1-500:1。在某些優選的實施方案中,明膠和 彈性蛋白在殼層中的重量比為約1000:1、500:1、400:1、300:1、250:1、200:1、100:1、50:1或10:1。在某些優選的實施方案中,明膠和彈性蛋白在殼層中的重量比為10:1-50:1、50:1-100:1、100:1-200:1、200:1-250:1、250:1-300:1、300:1-400:1、400:1-500:1、500:1-1000:1、10:1-100:1、100:1-200:1、200:1-300:1、300:1-400:1、400:1-1000:1、或100:1-500:1。在某些優選的實施方案中,海藻酸鹽(例如海藻酸鈉或海藻酸鈣)、明膠和彈性蛋白在殼層中的重量比為約250:250:1。在某些優選的實施方案中,海藻酸鹽(例如海藻酸鈉或海藻酸鈣)在殼層中的重量百分比為約0.1%、0.5%、1%、1.25%、1.5%、2%、3%、4%、5%、7.5%、或10%。在某些優選的實施方案中,海藻酸鹽(例如海藻酸鈉或海藻酸鈣)在殼層中的重量百分比為0.1%-0.5%、0.5%-1%、1%-1.25%、1.25%-1.5%、1.5%-2%、2%-3%、3%-4%、4%-5%、5%-7.5%、7.5%-10%、0.1%-1%、1%-1.5%、1%-2%、0.5-2.5%、1%-3%、5-10%、或0.5%-5%。在某些優選的實施方案中,明膠在殼層中的重量百分比為約0.1%、0.5%、1%、1.25%、1.5%、2%、3%、4%、5%、7.5%、或10%。在某些優選的實施方案中,明膠在殼層中的重量百分比為0.1%-0.5%、0.5%-1%、1%-1.25%、1.25%-1.5%、1.5%-2%、2%-3%、3%-4%、4%-5%、5%-7.5%、7.5%-10%、0.1%-1%、1%-1.5%、1%-2%、0.5-2.5%、1%-3%、5-10%、或0.5%-5%。在某些優選的實施方案中,彈性蛋白在殼層中的重量百分比為約0.01%、0.02%、0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.1%、0.15%、0.2%、或0.5%。在某些優選的實施方案中,彈性蛋白在殼層中的重量百分比為0.01%-0.02%、0.02%-0.03%、0.03%-0.04%、0.04%-0.05%、0.05%-0.06%、0.06%-0.07%、0.07%-0.08%、0.08%-0.1%、0.1%-0.15%、0.15%-0.2%、0.2%、0.2%-0.5%、0.01%-0.03%、0.03%-0.05%、0.05%-0.08%、0.08%-0.15%、0.01%-0.05%、0.05%-0.1%、0.03%-0.07%、0.04%-0.06%、0.01%-0.1%、0.1%-0.5%、或0.01%-0.5%。在某些優選的實施方案中,所述殼層包含海藻酸鹽(例如海藻酸鈉或海藻酸鈣),例如包含海藻酸鈣和明膠,任選地還包含彈性蛋白。在 某些優選的實施方案中,所述殼層包含氧化海藻酸鹽(例如氧化海藻酸鈉)。在某些優選的實施方案中,所述殼層包含海藻酸鹽(例如海藻酸鈉或海藻酸鈣)和瓊脂糖。在某些優選的實施方案中,可使用氧化的海藻酸鹽(例如氧化的海藻酸鈉和氧化的海藻酸鈣)來制備微囊的殼層/外殼,并且可通過控制海藻酸鹽的氧化度來調節其降解速度,從而使殼層/外殼的降解速度與包裹在其中的細胞生長速度相匹配。因此,在某些優選的實施方案中,本發明微囊的至少一個殼層包含氧化的海藻酸鹽(例如氧化的海藻酸鈉和/或氧化的海藻酸鈣),從而使得能夠對微囊(或其殼層)的降解速度進行控制(例如,通過控制海藻酸鹽的氧化度)。在某些優選的實施方案中,本發明微囊的至少一個殼層(例如所有殼層)包含氧化的海藻酸鹽(例如氧化的海藻酸鈉和/或氧化的海藻酸鈣)。在某些優選的實施方案中,本發明微囊的位于最外側的殼層包含氧化的海藻酸鹽(例如氧化的海藻酸鈉和/或氧化的海藻酸鈣)。在某些優選的實施方案中,在本發明的微囊中,僅位于最外側的殼層包含氧化的海藻酸鹽(例如氧化的海藻酸鈉和/或氧化的海藻酸鈣)。在某些優選的實施方案中,所述氧化的海藻酸鹽包含氧化的海藻酸鈉和/或氧化的海藻酸鈣。在某些優選的實施方案中,所述氧化的海藻酸鹽包含氧化的海藻酸鈉。在某些優選的實施方案中,所述氧化的海藻酸鹽包含氧化的海藻酸鈣。在某些優選的實施方案中,所述氧化的海藻酸鹽包含氧化的海藻酸鈉和氧化的海藻酸鈣。在某些優選的實施方案中,所述氧化的海藻酸鹽的分子量為4kDa-1500kDa。在某些優選的實施方案中,所述氧化的海藻酸鹽的分子量為4-10kDa、10-20kDa、20-30kDa、30-40kDa、40-50kDa、50-60kDa、60-70kDa、70-80kDa、80-90kDa、90-100kDa、100-200kDa、200-300kDa、300-400kDa、400-500kDa、500-600kDa、700-800kDa、800-900kDa、900-1000kDa、1100-1200kDa、1200-1300kDa、1300-1400kDa、或1400-1500kDa。在某些優選的實施方案中,所述 氧化的海藻酸鹽的分子量為32k-250kDa。在某些優選的實施方案中,所述氧化的海藻酸鹽是可溶于水的。在某些優選的實施方案中,所述氧化的海藻酸鹽的G/M值為0.2-5。在某些優選的實施方案中,所述氧化的海藻酸鹽的G/M值為0.2-0.3、0.3-0.4、0.4-0.5、0.5-0.6、0.6-0.7、0.7-0.8、0.8-0.9、0.9-1.0、1.0-1.5、1.5-2.0、2.0-2.5、2.5-3.0、3.0-3.5、3.5-4.0、4.0-4.5、或4.5-5.0。在某些優選的實施方案中,所述氧化的海藻酸鹽的G/M值為0.2-2.5。在某些優選的實施方案中,所述氧化的海藻酸鹽的氧化度為1-40%。在某些優選的實施方案中,所述氧化的海藻酸鹽的氧化度為1-2%、2-3%、3-4%、4-5%、5-6%、6-7%、7-8%、8-9%、9-10%、11-12%、12-13%、13-14%、14-15%、15-16%、16-17%、17-18%、18-19%、19-20%、20-25%、25-30%、30-35%、或35-40%。在某些優選的實施方案中,所述氧化的海藻酸鹽的氧化度為2.5-4.4%、4.4-8.8%、8.8-17.6%或17.6-22%。在某些優選的實施方案中,用于制備殼層的氧化的海藻酸鹽的粘度為100-3000mPa·s。在某些優選的實施方案中,用于制備殼層的氧化的海藻酸鹽的粘度為100-200、200-300、300-400、400-500、500-600、600-700、700-800、800-900、900-1000、1000-1100、1100-1200、1200-1300、1300-1400、1400-1500、1500-1600、1600-1700、1700-1800、1800-1900、1900-2000、2000-2100、2100-2200、2200-2300、2300-2400、2400-2500、2500-2600、2600-2700、2700-2800、2800-2900、或2900-3000mPa·s。在某些優選的實施方案中,用于制備殼層的氧化的海藻酸鹽的粘度為200-2000mPa·s。在某些優選的實施方案中,所述氧化的海藻酸鹽是通過將從藻類(例如褐藻,例如海帶和馬尾藻)中提取到的海藻酸鹽氧化而獲得的。在某些優選的實施方案中,本發明微囊的至少一個殼層包含1-25%(wt)的氧化的海藻酸鹽。在某些優選的實施方案中,本發明微 囊的至少一個殼層包含1-2%、2-3%、3-4%、4-5%、5-6%、6-7%、7-8%、8-9%、9-10%、10-15%、15-20%、20-25%(wt)的氧化的海藻酸鹽。在某些優選的實施方案中,本發明微囊的至少一個殼層包含至少5%(wt)的氧化的海藻酸鹽。在某些優選的實施方案中,本發明微囊的至少一個殼層包含氧化的海藻酸鹽(例如,上文所定義的氧化的海藻酸鹽),以及海藻酸鹽(例如海藻酸鈉和/或海藻酸鈣)。在某些優選的實施方案中,包含于所述至少一個殼層中的海藻酸鹽的分子量為4kDa-1500kDa。在某些優選的實施方案中,包含于所述至少一個殼層中的海藻酸鹽的分子量為4-10kDa、10-20kDa、20-30kDa、30-40kDa、40-50kDa、50-60kDa、60-70kDa、70-80kDa、80-90kDa、90-100kDa、100-200kDa、200-300kDa、300-400kDa、400-500kDa、500-600kDa、700-800kDa、800-900kDa、900-1000kDa、1100-1200kDa、1200-1300kDa、1300-1400kDa、或1400-1500kDa。在某些優選的實施方案中,包含于所述至少一個殼層中的海藻酸鹽的分子量為32k-250kDa。在某些優選的實施方案中,包含于所述至少一個殼層中的海藻酸鹽的G/M值為0.2-5。在某些優選的實施方案中,包含于所述至少一個殼層中的海藻酸鹽的G/M值為0.2-0.3、0.3-0.4、0.4-0.5、0.5-0.6、0.6-0.7、0.7-0.8、0.8-0.9、0.9-1.0、1.0-1.5、1.5-2.0、2.0-2.5、2.5-3.0、3.0-3.5、3.5-4.0、4.0-4.5、或4.5-5.0。在某些優選的實施方案中,包含于所述至少一個殼層中的海藻酸鹽的G/M值為0.2-2.5。在某些優選的實施方案中,用于制備所述至少一個殼層的海藻酸鹽的粘度為100-3000mPa·s。在某些優選的實施方案中,用于制備所述至少一個殼層的海藻酸鹽的粘度為100-200、200-300、300-400、400-500、500-600、600-700、700-800、800-900、900-1000、1000-1100、1100-1200、1200-1300、1300-1400、1400-1500、1500-1600、1600-1700、1700-1800、1800-1900、1900-2000、2000-2100、 2100-2200、2200-2300、2300-2400、2400-2500、2500-2600、2600-2700、2700-2800、2800-2900、或2900-3000mPa·s。在某些優選的實施方案中,用于制備所述至少一個殼層的海藻酸鹽的粘度為200-2000mPa·s。在某些優選的實施方案中,在所述至少一個殼層中,海藻酸鹽與氧化的海藻酸鹽的質量比為1:9至9:1。在某些優選的實施方案中,在所述至少一個殼層中,海藻酸鹽與氧化的海藻酸鹽的質量比為1:9、2:8、3:7、4:6、5:5、6:4、7:3、8:2、9:1。在某些優選的實施方案中,所述殼層包含海藻酸鹽(例如海藻酸鈉或海藻酸鈣)和氧化海藻酸鹽(例如氧化海藻酸鈉)。在某些優選的實施方案中,海藻酸鹽(例如海藻酸鈉或海藻酸鈣)和氧化海藻酸鹽(例如氧化海藻酸鈉)在殼層中的重量比為約10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1、1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、或1:10。在某些優選的實施方案中,海藻酸鹽(例如海藻酸鈉或海藻酸鈣)和氧化海藻酸鹽(例如氧化海藻酸鈉)在殼層中的重量比為10:1-9:1、9:1-8:1、8:1-7:1、7:1-6:1、6:1-5:1、5:1-4:1、4:1-3:1、3:1-2:1、2:1-1:1、1:1-1:2、1:2-1:3、1:3-1:4、1:4-1:5、1:5-1:6、1:6-1:7、1:7-1:8、1:8-1:9、1:9-1:10、10:1-5:1、5:1-1:1、1:1-1:5、1:5-1:10、2:1-1:2、4:1-1:4、或10:1-1:10。在某些優選的實施方案中,所述至少一個殼層在不超過28天的時間內完全降解。在某些優選的實施方案中,所述至少一個殼層在不超過21天、不超過14天、不超過12天、不超過10天、不超過9天、不超過8天、不超過7天、不超過6天、不超過5天、不超過4天、不超過3天、或不超過2天的時間內完全降解。在某些優選的實施方案中,所述至少一個殼層在2-5天,2-6天,2-8天,2-10天,2-12天,或2-14天內完全降解。在某些優選的實施方案中,所述至少一個殼層的粘度為100-3000mPa·s。在某些優選的實施方案中,所述至少一個殼層的粘度為100-200、200-300、300-400、400-500、500-600、600-700、700-800、 800-900、900-1000、1000-1100、1100-1200、1200-1300、1300-1400、1400-1500、1500-1600、1600-1700、1700-1800、1800-1900、1900-2000、2000-2100、2100-2200、2200-2300、2300-2400、2400-2500、2500-2600、2600-2700、2700-2800、2800-2900、或2900-3000mPa·s。在某些優選的實施方案中,所述至少一個殼層的粘度為200-2000mPa·s。在某些優選的實施方案中,微囊的殼層各自任選地經過處理(例如使用殼層固定液進行處理,例如,以改善殼層的力學性能)。在某些優選的實施方案中,第一微囊和第二微囊的殼層均經過處理(例如使用殼層固定液進行處理,例如,以改善殼層的力學性能)。在某些優選的實施方案中,用于制備核層和殼層的生物可降解材料可以是相同的或不同的。然而,特別優選地,根據其預期的目的,核層和殼層具有不同的組成。不拘于理論限制,通常認為,殼層提供了主要的力學保護作用,而核層則提供了細胞生命活動所需的主要的營養成分和微環境。因此,在某些優選的實施方案中,與殼層相比,核層具有更多的營養物質。在某些優選的實施方案中,與核層相比,殼層具有較低的降解速率,但具有更高的硬度和/或彈性模量。在某些優選的實施方案中,殼層中不包含細胞。因此,在某些優選的實施方案中,核層和殼層由不同的生物可降解材料制成。例如,在某些優選的實施方案中,用于制備核層的生物可降解材料為,海藻酸鈉和任選的I型膠原;并且,用于制備殼層的生物可降解材料為,海藻酸鈣和任選的彈性蛋白。在某些優選的實施方案中,用于制備核層的生物可降解材料為淀粉;并且,用于制備殼層的生物可降解材料為海藻酸鈣。在某些優選的實施方案中,用于制備核層的生物可降解材料為I型膠原;并且,用于制備殼層的生物可降解材料為聚賴氨酸。在某些優選的實施方案中,用于制備核層的生物可降解材料為I型膠原;并且,用于制備殼層的生物可降解材料為海藻酸鈣。在某些優選的實施方案中,用于制備核層的生物可降解材料為聚氨酯;并且,用于制備殼層的生物可降解材料為海藻酸鈣。在 某些優選的實施方案中,用于制備核層的生物可降解材料為海藻酸鈉;并且,用于制備殼層的生物可降解材料為聚賴氨酸。在某些優選的實施方案中,核層和殼層分別以不同的重量比包含相同的生物可降解材料。換言之,核層和殼層可以由相同的生物可降解材料制成,但以不同的重量比包含生物可降解材料。例如,在某些優選的實施方案中,核層和殼層均由海藻酸鈉制成;但核層包含不超過2%(例如1.5%)的海藻酸鈉,而殼層包含超過4%(例如5%)的海藻酸鈉。不超過2%(例如1.5%)的海藻酸鈉能夠為細胞在核層中的生長、增殖、分化或遷移提供優良的條件(通常,細胞難以在超過2%的海藻酸鈉的條件下生長和存活);而超過4%(例如5%)的海藻酸鈉則能夠為殼層提供足夠的硬度和彈性。在某些優選的實施方案中,所述核層和殼層包含選自下述的組合:核層殼層組合1I型膠原海藻酸鈉組合2I型膠原氧化海藻酸鈉組合3I型膠原海藻酸鈉+氧化海藻酸鈉(二者濃度比為9:1)組合4I型膠原海藻酸鈉+氧化海藻酸鈉(二者濃度比為7:3)組合5層粘連蛋白海藻酸鈉+瓊脂糖(二者濃度比為8:2)組合6淀粉氧化海藻酸鈉組合7淀粉海藻酸鈉+氧化海藻酸鈉(二者濃度比為7:3)組合8可降解聚氨酯氧化海藻酸鈉組合9可降解聚氨酯海藻酸鈉+氧化海藻酸鈉(二者濃度比為9:1)組合10可降解性聚氨酯海藻酸鈉+明膠(二者濃度比為85:15)在某些優選的實施方案中,所述任選的殼層各自獨立地是通透性的。例如,所述殼層對于水,氧氣,和營養物質(糖類例如葡萄糖,脂肪,蛋白質,氨基酸,短肽,礦物質,維生素、細胞因子、核苷酸等)是通透性的。一般認為,半通透的(即,選擇通透的)殼層的使用可能是有利的, 因為其能夠使得水,氧氣,葡萄糖,礦物質,和氨基酸等營養物質透過殼層,進入核層,并提供給細胞,并且能夠阻止對細胞有害的物質(例如來自宿主免疫系統的抗體蛋白)進入核層。然而,在本發明的微囊中,通透性殼層的使用是優選的和有利的。特別地,通透性的殼層使得各種營養物質(包括大分子和小分子營養物質,例如葡萄糖,脂肪,蛋白質,氨基酸,短肽,礦物質,維生素、細胞因子、核苷酸等)能夠更加容易、順暢地進行交換,避免局部區域的細胞無法獲得充足的營養物質。例如,當使用本發明的微囊構建大尺寸的人工組織時,通透性的殼層將能夠促進各種營養物質的交換,促進人工組織內部/核心區域的微囊內的細胞獲得充足的營養物質。此外,通透性的殼層有利于不同微囊之間的細胞進行信號傳遞和建立細胞連接。特別地,細胞在生長過程中會分泌多種物質(包括細胞外基質的某些組分和多種信號分子),與鄰近的、甚至遠端的細胞進行信號傳遞和/或物質交流,并由此對細胞自身的生命活動以及鄰近的、甚至遠端的細胞的生命活動產生影響或進行調控。因此,如果使用選擇通透性的殼層的話,那么細胞之間的信號傳遞和/或物質交流將有可能受到影響/阻礙,例如細胞分泌的某些大分子信號物質(例如細胞因子蛋白)可能無法透過殼層,從而可能阻礙不同微囊之間的細胞信號的傳遞和細胞連接的建立,不利于構建有機的整體(例如,人工組織)。因此,通透性殼層的使用對于本發明的微囊而言是優選的。在本發明中,表述“通透性殼層”意指,各種小分子和大分子物質(例如蛋白質)能夠自由通過殼層。例如,在某些優選的實施方案中,所述殼層對于分子量在5000kDa以下的分子是通透的。例如,在某些實施方案中,所述殼層對于分子量在200kDa以下或分子量在200kDa-300kDa、300kDa-400kDa、400kDa-500kDa、500kDa-800kDa、800kDa-1000kDa、1000kDa-1500kDa、1500kDa-2000kDa、2000kDa-3000kDa、3000kDa-4000kDa或4000kDa-5000kDa范圍內的分子是通透的。在某些實施方案中,所述殼層對于免疫球蛋白(例如IgG、IgM、IgA、IgD、IgE)是通透的。在某些優選的實施方案中,所述任選的殼層各自獨立地具有用于微 囊內外物質交換的通道或孔。在某些優選的實施方案中,營養物質(糖類例如葡萄糖,脂肪,蛋白質,氨基酸,短肽,礦物質,維生素、細胞因子、核苷酸等)通過所述通道或孔擴散進入所述微囊內。在某些優選的實施方案中,所述通道的直徑為至少10、20、50、100、150、200、250、300、350、400、或500nm。在某些優選的實施方案中,所述通道的直徑為例如1nm-5μm;10nm-2μm;100nm-1μm;200-800nm等。在某些優選的實施方案中,所述孔的直徑為至少100、200、400、600、800、1000、1500、2000、4000、或5000nm。本發明的m種微囊的任選的殼層的厚度可以各自獨立地根據實際需要進行選擇,而不受特別限制。例如,本發明微囊的殼層的厚度各自獨立地可以為1-20μm,例如5-15μm,例如8-12μm。在某些優選的實施方案中,本發明的微囊的殼層的厚度各自獨立地可以為約0.1、0.5、1、2、5、10、15、20、25、30、或50μm。在某些優選的實施方案中,本發明的微囊的殼層的厚度各自獨立地可以為0.1-0.5、0.5-1、1-2、2-5、5-10、10-15、15-20、20-25、25-30、30-50、50-100、100-200、200-300、300-400、400-500、0.1-1、1-5、1-10、5-10、10-20、10-30、5-20、或1-20μm。在某些優選的實施方案中,本發明的微囊的殼層不包含細胞。在某些優選的實施方案中,所述核層和/或任選的殼層各自獨立地還包含額外的試劑,例如,營養物質、細胞外基質、細胞因子和/或藥物活性成分。優選地,所述額外的試劑能夠調控(例如促進)細胞(例如MSC細胞)的增殖、分化、遷移、分泌和/或新陳代謝。在某些優選的實施方案中,所述核層包含至少一種(例如1、2、3、4、5或更多種)能夠調控(例如促進)細胞(例如MSC細胞)的增殖、分化、遷移、分泌和/或新陳代謝的額外的試劑。在某些優選的實施方案中,所述核層能夠以受控的方式釋放所述額外的試劑。在某些優選的實施方案中,所述營養物質包括但不限于,核苷酸,氨基酸,多肽,碳水化合物(例如單糖,寡糖,多糖),脂質,維生素 等。在某些優選的實施方案中,細胞外基質選自多糖,例如糖胺聚糖、蛋白聚糖;結構蛋白,例如膠原和彈性蛋白;粘著蛋白,例如纖粘連蛋白和層粘連蛋白。在某些優選的實施方案中,所述細胞因子可以是用于調控細胞(例如MSC細胞)的增殖、分化、遷移、分泌和/或新陳代謝的細胞因子,包括但不限于:-與細胞(例如MSC細胞)生長相關的細胞因子,例如胰島素、類胰島素生長因子(如IGF-Ⅰ、IGF-Ⅱ)、轉化生長因子(如TGFα和TGFβ)、血管內皮生長因子、表皮生長因子、成纖細胞生長因子、血小板來源生長因子、骨肉瘤來源生長因子、生長激素釋放抑制因子、神經生長因子、白細胞介素(如IL-1、IL-11、IL-3)、紅細胞生長素、集落刺激因子、皮質醇、甲狀腺素,或其任何組合;-與細胞(例如MSC細胞)分化相關的細胞因子,例如Oct3/4,Sox2,Klf4,c-Myc,GATA4,TSP1,β-甘油磷酸鈉,地塞米松,維生素C,胰島素,IBMX,吲哚美鋅,血小板衍生生長因子BB(PDGF-BB),5-氮雜胞苷,或其任何組合;-與細胞(例如MSC細胞)遷移相關的細胞因子,例如環磷酸腺苷,三磷酸磷脂酰肌醇,基質細胞衍生因子-1,N-鈣粘蛋白,核因子κB,骨連接素,血栓素A2,Ras,或其任何組合;和/或-與細胞(例如MSC細胞)新陳代謝相關的細胞因子,例如胰島素生長因子1、TRIP-Br2、DKK-1、sRANKL、OPG、TRACP-5b、ALP、SIRT1(2-7)、PGC-1α、PGC-1β、OPG、IL-3、IL-4、IL-6、TGF-β、PGE2、G-CSF、TNF-α,或其任何組合。在某些優選的實施方案中,所述藥物活性成分為能夠調控(例如促進)細胞(例如MSC細胞)的增殖、分化、遷移、分泌和/或新陳代謝的試劑。在某些優選的實施方案中,所述藥物活性成分選自rhIL-2、rhIL-11、rhEPO、IFN-α、IFN-β、IFN-γ、G-CSF、GM-CSF、rHuEPO、sTNF-R1、和rhTNF-α。在某些優選的實施方案中,所述微囊包括:MSC細胞,包裹所述MSC細胞的核層,和,封裝所述核層的殼層;優選地,所述核層和殼層各自獨立地由生物可降解材料制成,并且所述核層提供誘導MSC向成骨細胞或骨分化的微環境(例如,所述核層包含誘導MSC向成骨細胞或骨分化的誘導因子)。在某些優選實施方案中,此類微囊的殼層也提供誘導MSC向成骨細胞或骨分化的微環境(例如,所述殼層包含誘導MSC向成骨細胞或骨分化的誘導因子)。在某些優選實施方案中,所述誘導MSC向成骨細胞或骨分化的誘導因子包含地塞米松、抗壞血酸和甘油磷酸。在某些優選的實施方案中,所述微囊包括:MSC細胞,包裹所述MSC細胞的核層,和,封裝所述核層的殼層;優選地,所述核層和殼層各自獨立地由生物可降解材料制成,并且所述核層提供誘導MSC向成軟骨細胞或軟骨分化的微環境(例如,所述核層包含誘導MSC向成軟骨細胞或軟骨分化的誘導因子)。在某些優選實施方案中,此類微囊的殼層也提供誘導MSC向成軟骨細胞或軟骨分化的微環境(例如,所述殼層包含誘導MSC向成軟骨細胞或軟骨分化的誘導因子)。在某些優選實施方案中,所述誘導MSC向成軟骨細胞或軟骨分化的誘導因子包含TGF-β3、地塞米松、2-磷酸抗壞血酸、丙酮酸鈉、脯氨酸和胰島素-轉鐵蛋白-硒溶液。本發明m種微囊所包含的細胞的數量可以各自獨立地根據實際需要進行選擇,而不受特別限制。例如,本發明微囊各自獨立地可以包含1-106個細胞,例如10-900、20-800、30-700、40-600、50-500、60-400、70-300、80-200、10-100個、10-103個、10-104個、10-105個、10-106個細胞。在某些優選的實施方案中,本發明微囊各自獨立地包含至少1、2、4、6、8、10、15、20、25、30、40、50、60、70、80、90、100、150、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、104、2x104、3x104、4x104、5x104、6x104、7x104、8x104、9x104、105、2x105、3x105、4x105、5x105、6x105、7x105、8x105、9x105、或106個細胞。在某些優選的實施方案中,本發明微囊各自獨立地可以包含1-2、2-4、4-6、6-8、8-10、10-15、 15-20、20-25、25-30、30-40、40-50、50-60、60-70、70-80、80-90、90-100、100-150、150-200、200-300、300-400、400-500、500-1000、1000-2000、2000-3000、3000-4000、4000-5000、5000-104、104-2x104、2x104-3x104、3x104-4x104、4x104-5x104、5x104-105、105-2x105、2x105-3x105、3x105-4x105、4x105-5x105、5x105-106、1-10、2-10、2-5、5-10、10-20、20-30、30-50、2-25、25-50、2-50、50-100、100-200、50-250、250-500、500-2000、2-100、2-500、或2-2000個細胞。不受理論限制,本發明的微囊可以包含任何種類和類型的細胞。在某些優選的實施方案中,本發明的微囊可以包含1、2、3、4、5、6、7、8、9、10、15、20、或更多種類型的細胞。例如,所述細胞可以為細菌、酵母、植物細胞或動物細胞,例如哺乳動物細胞,優選人細胞。優選地,所述細胞為粘附細胞,例如分化的粘附細胞或未分化的粘附細胞。優選地,所述細胞為多能干細胞。在某些優選的實施方案中,所述粘附細胞來源于選自下述的組織:結締組織(例如,疏松結締組織、致密結締組織、彈性組織、網狀結締組織和脂肪組織)、肌肉組織(例如,骨骼肌、平滑肌和心肌)、泌尿生殖組織、胃腸組織、肺組織、骨組織、神經組織和上皮組織(例如,單層上皮和復層上皮)、內胚層來源的組織、中胚層來源的組織和外胚層來源的組織。在某些優選的實施方案中,所述粘附細胞選自肌肉細胞(例如,骨骼肌細胞、心肌細胞、平滑肌細胞和成肌細胞)、結締組織細胞(例如,骨細胞、軟骨細胞、成纖維細胞以及分化為成骨細胞、軟骨細胞或淋巴組織的細胞)、骨髓細胞、內皮細胞、皮膚細胞、上皮細胞、乳腺細胞、血管細胞、血細胞、淋巴細胞、神經細胞、許旺細胞、胃腸細胞、肝細胞、胰細胞、肺細胞、氣管細胞、角膜細胞、泌尿生殖細胞、腎細胞、脂肪細胞、實質細胞、周細胞、間皮細胞、基質細胞、未分化的細胞(如干細胞和祖細胞)、內胚層來源的細胞、中胚層來源的細胞、外胚層來源的細胞、癌來源的細胞,細胞系、誘導的多能干細胞(iPS)、或其任何組合。在某些優選的實施方案中,所述核層包裹的細胞獲自動物,例如哺 乳動物,例如人、猿、大猩猩、牛、豬、犬、綿羊和山羊。在某些實施方案中,所述細胞為動物細胞,優選人細胞或大鼠細胞。在某些優選的實施方案中,所述核層包裹的細胞包括未分化的細胞,例如干細胞、祖細胞或其組合。在某些優選的實施方案中,所述干細胞為多能干細胞,例如誘導的多能干細胞。在某些優選的實施方案中,所述干細胞包括間充質干細胞。在某些優選的實施方案中,所述間充質干細胞是骨髓、脂肪、臍帶、臍帶血、和/或胎盤來源的間充質干細胞。在某些優選的實施方案中,所述間充質干細胞是骨髓來源的間充質干細胞。在某些優選的實施方案中,所述間充質干細胞獲自動物,例如哺乳動物,例如人、猿、大猩猩、牛、豬、犬、綿羊和山羊。在某些優選的實施方案中,除了如上描述的未分化的細胞之外,所述核層包裹的細胞還包括額外細胞。在某些優選的實施方案中,所述額外細胞來源于選自下述的組織:結締組織(例如,疏松結締組織、致密結締組織、彈性組織、網狀結締組織和脂肪組織)、肌肉組織(例如,骨骼肌、平滑肌和心肌)、泌尿生殖組織、胃腸組織、肺組織、骨組織、神經組織和上皮組織(例如,單層上皮和復層上皮)、內胚層來源的組織、中胚層來源的組織和外胚層來源的組織。在某些優選的實施方案中,所述額外細胞選自肌肉細胞(例如,骨骼肌細胞、心肌細胞、平滑肌細胞和成肌細胞)、結締組織細胞(例如,骨細胞、軟骨細胞、成纖維細胞以及分化為成骨細胞、軟骨細胞或淋巴組織的細胞)、骨髓細胞、皮膚細胞、上皮細胞、乳腺細胞、血管細胞、血細胞、淋巴細胞、神經細胞、許旺細胞、胃腸細胞、肝細胞、胰細胞、肺細胞、氣管細胞、角膜細胞、泌尿生殖細胞、腎細胞、脂肪細胞、實質細胞、周細胞、間皮細胞、基質細胞、內胚層來源的細胞、中胚層來源的細胞、外胚層來源的細胞、癌來源的細胞、細胞系、或其任何組合。在某些優選的實施方案中,所述額外細胞為內皮細胞。在某些優選的實施方案中,所述額外細胞為平滑肌細胞。在某些優選的實施方案中,所述微囊包含未分化的細胞和額外細胞。在某些優選的實施方案中,所述未分化的細胞和額外細胞包裹于 同一核層或不同核層。例如,所述未分化的細胞位于第一核層且所述額外的細胞位于第二核層,或者相反。在某些優選的實施方案中,所述微囊包含未分化的細胞和額外細胞。在某些優選的實施方案中,所述未分化的細胞占細胞總數量的1%-100%,例如,2%-90%、3%-80%、4%-70%、5%-60%、5.5%-50%、6%-40%、6.5%-30%、7%-20%、7.5%-19%、8%-18%、8.5%-17%、9%-16%、9.1%-15%、9.2%-14%、9.3%-13%、9.4%-12%、9.5%-11.5%、9.6%-11%、9.7%-10.9%、9.8%-10.8%、9.9%-10.7%、9.9%-10.6%、9.9%-10.5%、9.9%-10.4%、9.9%-10.3%、9.9%-10.2%、9.9%-10.1%、或10.0%。在某些優選的實施方案中,所述額外細胞占細胞總數量的0%-99%,例如,1%-90%、5%-80%、10%-70%、15%-65%、20%-60%、25%-55%、30%-50%、35%-45%、36%-44%、37%-43%、38%-42%、39%-41%、39.1%、39.2%、39.3%、39.4%、39.5%、39.6%、39.7%、39.8%、39.9%、40.0%、40.1%、40.2%、40.3%、40.4%、40.5%、40.6%、40.7%、40.8%或40.9%。在某些優選的實施方案中,所述額外細胞與未分化的細胞的比例為約1:20-約1:1,例如約1:19、約1:18、約1:17、約1:16、約1:15、約1:14、約1:13、約1:12、約1:11、約1:10、約1:9、約1:8、約1:7、約1:6、約1:5、約1:4、約1:3、約1:2、或約1:1.5。在某些優選的實施方案中,所述額外細胞與未分化的細胞的比例為約1:15、約1:14、約1:13、約1:12、約1:11.5、約1:11、約1:10.5、約1:10、約1:9.5、約1:9、約1:8.5、約1:8、約1:7、約1:6、約1:5、約1:4、約1:3。在某些優選的實施方案中,所述額外細胞與未分化的細胞的比例為約1:10或約1:3。在某些優選的實施方案中,所述核層包裹的細胞包括內皮細胞和未分化的細胞,且所述未分化的細胞為間充質干細胞,所述內皮細胞和間充質干細胞的比例為約1:10。在某些優選的實施方案中,所述核層包裹的細胞包括平滑肌細胞和未分化的細胞,且所述未分化的細胞為間充質干細胞,所述平滑肌細胞和間充質干細胞的比例為約1:3。本發明的m種微囊的尺寸可以各自獨立地根據實際需要進行選擇,而不受特別限制。球形微囊的尺寸通常可以通過其直徑來進行明確定義。在嚴格定義的情況下,術語“直徑”不能用于描述非球形的結構。然而,在本發明中,也使用術語“直徑”來描述非球形的微囊的尺寸。在此情況下,術語“直徑”表示,與非球形的微囊具有相同體積的球形微囊的直徑。換言之,在本發明中,使用球形微囊的直徑來描述具有相同體積的非球形的微囊的尺寸。因此,在某些優選的實施方案中,本發明微囊的尺寸(即,本文所定義的直徑)各自獨立地可以為20-2000μm,例如30-1900μm,40-1800μm,50-1700μm,60-1600μm,70-1500μm,80-1400μm,90-1300μm,100-1200μm,200-1000μm,300-800μm,400-600μm,100-500μm。在某些優選的實施方案中,本發明微囊的尺寸(即,本文所定義的直徑)各自獨立地可以為20-30、30-50、50-100、100-150、150-200、200-250、250-300、300-350、350-400、400-450、450-500、500-600、600-700、700-800、800-900、900-1000、1000-1500、1500-2000、20-50、20-100、100-200、200-400、500-600、600-800、800-1000、或1000-2000μm。在某些優選的實施方案中,本發明微囊的尺寸(即,本文所定義的直徑)各自獨立地為至少20、30、50、100、120、150、200、250、300、350、400、450、500、600、700、800、900、1000、1500、或2000μm。本發明的m種微囊的形狀可以各自獨立地根據實際需要進行選擇,而不受特別限制。例如,本發明微囊各自獨立地可以是球形,或者任何期望的形狀(例如立方體,矩形棱柱,六棱柱,圓柱,或不規則的形狀)。例如,一些形狀(例如球形,立方體,矩形棱柱,六棱柱)可用于實現微囊在構建體中的緊密堆積。在某些優選的實施方案中,本發明的微囊各自獨立地為固體或半固體。在某些優選的實施方案中,本發明的微囊為凝膠態。例如,本發明的微囊的核層和/或殼層可以為凝膠態。在某些優選的實施方案中,本發明的微囊包含水凝膠。在某些優選的實施方案中,所述水凝膠包含海藻酸鹽,瓊脂糖,明膠,殼聚糖,或其它水溶性或親水性聚合物。在某些優選的實施方案中,本發明的微囊以混合物的形式存在。在此類實施方案中,微囊可以與混合物中的另一微囊接觸或融合。在某些優選的實施方案中,本發明的微囊是分離的微囊。例如,在某些實施方案中,微囊不與其他的微囊直接接觸。在某些優選的實施方案中,本發明的分離的微囊提供于容器中。本發明的微囊可使用各種方法來制備。例如,在某些優選的實施方案中,可使用用于制造微球體的方法來制備本發明的微囊,例如使用造粒儀來進行制備。在某些優選的實施方案中,本發明的微囊是在無菌條件下制備的。某些優選的實施方案中,本發明的微囊是在GMP工作間中制備的。在某些優選的實施方案中,本發明的微囊在即將使用前被制備。在某些優選的實施方案中,本發明的微囊在制備后貯存于4℃,例如貯存3小時、6小時、12小時、1天、2天、或3天。在某些優選的實施方案中,本發明的微囊能夠減少細胞在生物打印過程中受到的機械損傷。例如,在某些優選的實施方案中,在使用相同生物打印機和相同打印條件的情況下,與將細胞直接用于生物打印相比,本發明的微囊能夠減少細胞受到的機械損傷至少5%、10%、15%、20%、25%、30%、40%、50%、70%、80%、或90%。在某些優選的實施方案中,本發明的微囊能夠在生物打印過程中保留微囊內的細胞的生物活性(例如,增殖、分化、遷移、分泌和/或新陳代謝)。在某些優選的實施方案中,微囊內至少80%、85%、87.5%、90%、92.5%、95%、或98%的細胞在生物打印后存活至少24小時。在某些優選的實施方案中,微囊內至少90%的細胞在生物打印后存活至少3小時、6小時、12小時、1天、2天、4天、或7天。在某些優選的實施方案中,微囊內至少80%、85%、87.5%、90%、92.5%、95%、或98%的細胞在生物打印24小時后能夠增殖和/或分化。在某些優選的實施方案中,微囊內至少80%、85%、87.5%、90%、92.5%、95%、或98%的細胞在生物打印24小時后具有正常的新陳代謝。在某些優選的實施方案中,微囊內至少80%、85%、87.5%、90%、92.5%、95%、或98%的細胞在生物打印24小時后能夠遷移。在某些優選的實施方案中,微囊內至少80%、85%、87.5%、90%、92.5%、95%、或98%的細胞在 生物打印24小時后能夠分泌。本發明的一種微囊的示意性結構示于圖1中。如圖1所示,本發明的一種示例性微囊包括:細胞(例如MSC細胞),其能夠進行生長、增殖、分化或遷移;包裹所述細胞的核層,其由生物可降解材料制成,并且為細胞的生命活動提供微環境;和,任選地,封裝所述核層的殼層,其位于最外側,由生物可降解材料制成,并且為內部的核層和細胞提供力學保護。在優選的實施方案中,細胞可均勻分散于核層中,或者可以聚集在一起,位于核層內部。在某些優選的實施方案中,本發明的m種微囊(例如第一微囊和第二微囊)各自包含在不同的容器中。在某些優選的實施方案中,本發明的m種微囊(例如第一微囊和第二微囊)提供于單個容器中。合適的容器包括但不限于,皿(例如組織培養皿或細胞培養皿),瓶,管(例如試管,離心管,微量離心管等),多孔板的孔等。在某些優選的實施方案中,本發明的m種微囊(例如第一微囊和第二微囊)用于平行測定或高通量測定中。在某些優選的實施方案中,本發明的m種微囊(例如第一微囊和第二微囊)各自獨立地以組合物的形式存在,其中所述組合物任選地還包含載體(所述載體優選包含生物粘合劑)。在某些優選的實施方案中,本發明的m種微囊(例如第一微囊和第二微囊)共同存在于相同的組合物中,其中所述組合物任選地還包含載體(所述載體優選包含生物粘合劑)。在某些優選的實施方案中,所述載體包含生物粘合劑,或者由生物粘合劑組成。在某些優選的實施方案中,所述載體(例如生物粘合劑)及其降解產物對于細胞是無毒的,和/或對于宿主是非免疫原性的。在某些優選的實施方案中,所述載體(例如生物粘合劑)包含生物可降解材料。在某些優選的實施方案中,所述載體(例如生物粘合劑)中的生物可降解材料是生物相容性的。在某些優選的實施方案中,所述載體(例如生物粘合劑)中的生物可降解材料的降解能夠提供維持或促進微囊內的細胞的生命活動的微環境,例如營養物質。在某些優選的實施方案中,降解產物為小分子化合物,例如有機酸、單糖(例如葡萄糖)、寡糖、氨基酸、脂質等。此類降解產物可參與到細胞的新陳代謝活動中(例如用于合成細胞外基質),用于合成細胞外基質或轉化為活動所需的能量。在某些優選的實施方案中,所述載體(例如生物粘合劑)中的生物可降解材料是天然存在的(例如來源于動植物的天然存在的生物可降解材料,例如膠原蛋白,纖維蛋白,殼聚糖,海藻酸鹽,淀粉,透明質酸,層粘連蛋白,瓊脂糖,明膠,葡聚糖,以及其任意組合),人工合成的,重組產生的,經過改性的,或者其任何組合。在某些優選的實施方案中,所述載體(例如生物粘合劑)中的生物可降解材料是天然存在的可降解聚合物。優選地,所述可降解聚合物選自膠原蛋白,纖維蛋白,殼聚糖,海藻酸鹽,淀粉,透明質酸,層粘連蛋白,明膠,葡聚糖,彈性蛋白,以及其任意組合。在某些優選的實施方案中,所述載體(例如生物粘合劑)中的生物可降解材料是經過改性的可降解聚合物,例如經過改性的海藻酸鹽,例如氧化海藻酸鹽(例如氧化海藻酸鈉)。在某些優選的實施方案中,所述載體(例如生物粘合劑)中的生物可降解材料是合成的可降解聚合物。此類可降解聚合物包括但不限于,聚磷腈,聚丙烯酸及其衍生物(例如聚甲基丙烯酸,丙烯酸和甲基丙烯酸的共聚物),聚乳酸(PLA),聚羥基乙酸(PGA),聚乳酸-乙醇酸共聚物(PLGA),聚原酸酯(POE),聚己內酯(PCL),聚羥基丁酸酯(PHB),聚氨基酸(polyaminoacid)(例如聚賴氨酸),可降解性聚氨酯,以及其任何組合。在某些優選的實施方案中,所述載體(例如生物粘合劑)中的生物可降解材料選自膠原、纖維蛋白、殼聚糖、海藻酸鹽(例如海藻酸鈉或海藻酸鈣)、氧化海藻酸鹽(例如氧化海藻酸鈉)、淀粉、透明質酸、層粘連蛋白、彈性蛋白、明膠、聚氨基酸(例如聚賴氨酸)、瓊脂糖、葡 聚糖、甲基纖維素、聚乙烯醇、聚丙烯酸及其衍生物(例如聚丙烯酸或其酯、聚甲基丙烯酸或其酯)、聚丙烯酰胺、聚N-取代丙烯酰胺或其任何組合。在某些優選的實施方案中,所述載體(例如生物粘合劑)包含海藻酸鈉和/或氧化的海藻酸鈉。在某些優選的實施方案中,所述載體(例如生物粘合劑)包含海藻酸鹽(例如海藻酸鈉或海藻酸鈣)和氧化海藻酸鹽(例如氧化海藻酸鈉)。在某些優選的實施方案中,海藻酸鹽(例如海藻酸鈉或海藻酸鈣)和氧化海藻酸鹽(例如氧化海藻酸鈉)在載體中的重量比為約10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1、1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、或1:10。在某些優選的實施方案中,海藻酸鹽(例如海藻酸鈉或海藻酸鈣)和氧化海藻酸鹽(例如氧化海藻酸鈉)在載體中的重量比為10:1-9:1、9:1-8:1、8:1-7:1、7:1-6:1、6:1-5:1、5:1-4:1、4:1-3:1、3:1-2:1、2:1-1:1、1:1-1:2、1:2-1:3、1:3-1:4、1:4-1:5、1:5-1:6、1:6-1:7、1:7-1:8、1:8-1:9、1:9-1:10、10:1-5:1、5:1-1:1、1:1-1:5、1:5-1:10、2:1-1:2、4:1-1:4、或10:1-1:10。在某些優選的實施方案中,與微囊的核層或任選的殼層相比,所述載體(例如生物粘合劑)以不同的濃度包含相同的生物可降解材料,或者以不同的重量比包含相同的生物可降解材料的組合。在某些優選的實施方案中,與微囊的核層或任選的殼層相比,所述載體(例如生物粘合劑)包含不同的生物可降解材料。在某些優選的實施方案中,所述載體還包含水,無機鹽,pH緩沖劑,穩定劑,防腐劑,或其任何組合。在某些優選的實施方案中,所述載體(例如生物粘合劑)促進微囊在構建體(例如三維構建體,組織前體,或組織)上的安置,和/或將微囊固定在構建體(例如三維構建體,組織前體,或組織)上。在某些優選的實施方案中,載體(例如生物粘合劑)為液體或半液體(例如凝膠)。在某些優選的實施方案中,所述載體(例如生物粘合劑)的粘度為1-1000Pas,例如30-160Pas。在某些優選的實施方案中,所述載體(例如生物粘合劑)的粘度為約1、2、3、4、5、6、7、8、9、10、 12、14、16、18、20、25、30、50、80、100、200、300、400、500、800、或1000Pas。在某些優選的實施方案中,所述載體(例如生物粘合劑)的粘度為1-2、2-3、3-4、4-5、5-6、6-7、7-8、8-9、9-10、10-12、12-14、14-16、16-18、18-20、20-25、25-30、30-50、50-80、80-100、100-200、200-300、300-400、400-500、500-800、或800-1000、1-3、3-8、8-16、3-10、10-20、20-50、50-160Pas、或30-160Pas。在某些優選的實施方案中,本發明的m種微囊(例如第一微囊和第二微囊)各自獨立地以至少約10%、20%、30%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、或99%(按重量計,w/w)的濃度存在于組合物中。在某些優選的實施方案中,本發明的m種微囊(例如第一微囊和第二微囊)各自獨立地以10%-20%、20%-30%、30%-40%、40%-50%、50%-55%、55%-60%、60%-65%、65%-70%、70%-75%、75%-80%、80%-85%、85%-90%、90%-95%、95%-100%、50%-60%、60%-70%、70%-80%、80%-90%、90%-100%、50%-75%、75%-100%、或50%-100%(按重量計,w/w)的濃度存在于組合物中。在某些優選的實施方案中,本發明的m種微囊(例如第一微囊和第二微囊)共同地以至少約10%、20%、30%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、或99%(按重量計,w/w)的濃度存在于組合物中。在某些優選的實施方案中,本發明的m種微囊(例如第一微囊和第二微囊)共同地以10%-20%、20%-30%、30%-40%、40%-50%、50%-55%、55%-60%、60%-65%、65%-70%、70%-75%、75%-80%、80%-85%、85%-90%、90%-95%、95%-100%、50%-60%、60%-70%、70%-80%、80%-90%、90%-100%、50%-75%、75%-100%、或50%-100%(按重量計,w/w)的濃度存在于組合物中。在某些優選的實施方案中,除了微囊(例如第一微囊和/或第二微囊)中包含的液體之外,所述組合物基本上不含液體,例如具有少于約1%、2.5%、5%、7.5%、或10%的液體。在某些優選的實施方案中,第一微囊和/或第二微囊以組合物的形式存在。在某些優選的實施方案中,所述組合物中的第一微囊和/或第 二微囊的平均尺寸(即,本文所定義的直徑)為約20、30、50、100、120、150、200、250、300、350、400、450、500、600、700、800、900、1000、1500、或2000μm。在某些優選的實施方案中,所述組合物中的第一微囊和/或第二微囊的平均尺寸為20-30、30-50、50-100、100-150、150-200、200-250、250-300、300-350、350-400、400-450、450-500、500-600、600-700、700-800、800-900、900-1000、1000-1500、1500-2000、20-50、20-100、100-200、200-400、500-600、600-800、800-1000、1000-2000、20-100、100-500、500-1000、300-800、30-50、30-200、30-500、30-1000、30-2000、或20-2000μm。在某些優選的實施方案中,所述組合物中的第一微囊和/或第二微囊的尺寸的變異程度小于微囊的平均尺寸的1%、5%、10%、15%、20%、25%、30%、或35%。在某些優選的實施方案中,所述組合物中的第一微囊和/或第二微囊所包含的細胞的平均數目為至少1、2、4、6、8、10、15、20、25、30、40、50、60、70、80、90、100、150、200、300、400、500、600、700、800、900、1000、2000、3000、4000、5000、6000、7000、8000、9000、104、2x104、3x104、4x104、5x104、6x104、7x104、8x104、9x104、105、2x105、3x105、4x105、5x105、6x105、7x105、8x105、9x105、或106個細胞。在某些優選的實施方案中,所述組合物中的微囊所包含的細胞的平均數目為1-2、2-4、4-6、6-8、8-10、10-15、15-20、20-25、25-30、30-40、40-50、50-60、60-70、70-80、80-90、90-100、100-150、150-200、200-300、300-400、400-500、500-1000、1000-2000、2000-3000、3000-4000、4000-5000、5000-104、104-2x104、2x104-3x104、3x104-4x104、4x104-5x104、5x104-105、105-2x105、2x105-3x105、3x105-4x105、4x105-5x105、5x105-106、1-10、2-10、2-5、5-10、10-20、20-30、30-50、2-25、25-50、2-50、50-100、100-200、50-250、250-500、500-2000、2-100、2-500、或2-2000個細胞。在某些優選的實施方案中,在本發明的組合物中,相同類型的微囊之間細胞數目的變異程度小于相同類型的微囊的平均細胞數目的1%、5%、10%、15%、20%、25%、30%、或35%。在某些優選的實施方案中,通過將第一微囊和/或第二微囊與上文 論述的載體(例如生物粘合劑)混合而制備所述組合物。在某些優選的實施方案中,所述組合物是在無菌條件下制備的。在某些優選的實施方案中,所述組合物是在GMP工作間中制備的。在某些優選的實施方案中,所述組合物在即將使用前被制備。在某些優選的實施方案中,所述組合物在制備后貯存于4℃,例如貯存3小時、6小時、12小時、1天、2天、或3天。在某些優選的實施方案中,所述組合物用于生物打印構建體(例如三維構建體)。在某些優選的實施方案中,所述組合物與其他生物相容性材料或組合物一起用于生物打印。如上文所描述的,本發明微囊的殼層是通透性的。因此,在某些優選的實施方案中,載體(例如生物粘合劑)可包含額外的試劑,例如,營養物質、細胞外基質、細胞因子和/或藥物活性成分。優選地,所述額外的試劑能夠調控(例如促進)細胞的增殖、分化、遷移、分泌和/或新陳代謝。在某些優選的實施方案中,所述載體(例如生物粘合劑)包含至少一種(例如1、2、3、4、5或更多種)能夠調控(例如促進)細胞的增殖、分化、遷移、分泌和/或新陳代謝的額外的試劑。在某些優選的實施方案中,所述載體(例如生物粘合劑)能夠以受控的方式釋放所述額外的試劑。在某些優選的實施方案中,所述載體(例如生物粘合劑)可包括,維持或促進細胞的生命活動的營養物質(包括但不限于,核苷酸,氨基酸,多肽,碳水化合物(例如單糖,寡糖,多糖),脂質,維生素,細胞培養基等等)。在某些優選的實施方案中,所述載體(例如生物粘合劑)可包括,改善或調控細胞的生命活動的物質,例如細胞因子,細胞外基質,抗凋亡劑,抗氧化劑,藥物活性成分,或其任何組合。在某些優選的實施方案中,細胞外基質選自多糖,例如糖胺聚糖、蛋白聚糖;結構蛋白,例如膠原和彈性蛋白;粘著蛋白,例如纖粘連蛋白和層粘連蛋白。在某些優選的實施方案中,所述細胞因子可以是用于調控細胞的增殖、分化、遷移、分泌和/或新陳代謝的細胞因子,包括但不限于:-與細胞生長相關的細胞因子,例如胰島素、類胰島素生長因子(如IGF-Ⅰ、IGF-Ⅱ)、轉化生長因子(如TGFα和TGFβ)、血管內皮生長因子、表皮生長因子、成纖細胞生長因子、血小板來源生長因子、骨肉瘤來源生長因子、生長激素釋放抑制因子、神經生長因子、白細胞介素(如IL-1、IL-11、IL-3)、紅細胞生長素、集落刺激因子、皮質醇、甲狀腺素,或其任何組合;-與細胞分化相關的細胞因子,例如Oct3/4,Sox2,Klf4,c-Myc,GATA4,TSP1,β-甘油磷酸鈉,地塞米松,維生素C,胰島素,IBMX,吲哚美鋅,血小板衍生生長因子BB(PDGF-BB),5-氮雜胞苷,或其任何組合;-與細胞遷移相關的細胞因子,例如環磷酸腺苷,三磷酸磷脂酰肌醇,基質細胞衍生因子-1、N-鈣粘蛋白,核因子κB,骨連接素,血栓素A2,Ras,或其任何組合;和/或-與細胞新陳代謝相關的細胞因子,例如胰島素生長因子1、TRIP-Br2、DKK-1、sRANKL、OPG、TRACP-5b、ALP、SIRT1(2-7)、PGC-1α、PGC-1β、OPG、IL-3、IL-4、IL-6、TGF-β、PGE2、G-CSF、TNF-α,或其任何組合。在某些優選的實施方案中,所述藥物活性成分為能夠調控(例如促進)細胞的增殖、分化、遷移、分泌和/或新陳代謝的試劑。在某些優選的實施方案中,所述藥物活性成分選自rhIL-2、rhIL-11、rhEPO、IFN-α、IFN-β、IFN-γ、G-CSF、GM-CSF、rHuEPO、sTNF-R1、和rhTNF-α。在某些優選的實施方案中,本發明的組合物包含,上文所描述的含有MSC細胞和誘導MSC向成骨細胞或骨分化的誘導因子的微囊。優選地,在此類組合物中,所述載體(例如生物粘合劑)也包含誘導MSC向成骨細胞或骨分化的誘導因子。在某些優選的實施方案中,本發明的組合物包含,上文所描述的含有MSC細胞和誘導MSC向成軟骨細胞或軟骨分化的誘導因子的微囊。優選地,在此類組合物中,所述載體(例如生物粘合劑)也包含誘導MSC向 成軟骨細胞或軟骨分化的誘導因子。在某些優選的實施方案中,所述組合物為液體,半固體(例如凝膠)或固體組合物,例如溶液,懸浮液,凝膠,或濃縮物。在某些優選的實施方案中,所述載體(例如生物粘合劑)和/或組合物的粘度為1-1000Pas,例如30-160Pas,例如40-120Pas,50-150Pas,80-100Pas。在某些優選的實施方案中,所述組合物是可擠出的組合物。由此,所述組合物能夠被用于生物打印,以產生特定的平面和/或層狀幾何形狀;并且優選地,所產生的平面和/或層狀幾何形狀能夠進一步堆疊,從而形成具有特定形狀和結構的構建體(例如三維構建體)。因此,所述組合物可用于形成構建體(例如三維構建體)。在某些優選的實施方案中,步驟(2)所述的細胞分布信息選自,復合結構的各個細胞層的位置或類型,各個層的細胞的類型,各個層中不同細胞的比率,各個層中的細胞分布模式,或其任何組合。在某些優選的實施方案中,在步驟(3)中,通過生物打印(例如3D生物打印)對所述m種微囊進行排布,以制備構建體。在某些優選的實施方案中,所述構建體是三維構建體。在某些優選的實施方案中,所述構建體是活的構建體。在某些優選的實施方案中,所述構建體包含多個微囊。在某些優選的實施方案中,所述微囊以預定的模式(即,復合結構的細胞分布模式)排布。在某些優選的實施方案中,所述復合結構是包含骨細胞和軟骨細胞的復合結構,或者包含是包含內皮細胞和平滑肌細胞的復合結構,因此,所述預定的模式可基于天然組織或器官的結構和細胞分布模式(例如包含骨和軟骨的天然結構或者包含包含內皮細胞和平滑肌細胞的天然結構)。在某些優選的實施方案中,所述構建體(例如三維構建體)的尺寸為至少30μm、50μm、100μm、200μm、500μm、1mm、2mm、5mm、1cm、2cm、5cm、10cm、20cm、或50cm。在某些優選的實施方案中,所述構建體的至少一個部分是生物打 印的。生物打印一般通過使用快速原型技術的方法來進行。快速原型技術是基于通過三維遞送裝置(例如生物打印機)將細胞/微囊和任選的限制材料向生物相容性表面(例如由水凝膠和/或多孔膜組成的生物相容性表面)上進行三維、自動化、計算機輔助的沉積。如本文中使用的,在用于指代組織和/或器官時,術語“工程化的”是指:根據計算機腳本,通過計算機輔助的裝置(例如生物打印機),將細胞、細胞溶液、細胞懸浮液、包含細胞的凝膠或漿料、細胞濃縮物、多細胞聚集體、微囊和它們的層放置以形成三維結構。在進一步的實施方案中,計算機腳本例如是一個或多個計算機程序、計算機應用或計算機模塊。在更進一步的實施方案,通過細胞、多細胞體或微囊的打印后融合來形成三維組織結構。盡管有許多方法可以用來將細胞、多細胞聚集體、微囊和/或它們的層布置在生物相容性表面上以產生三維結構(例如手動放置),但通過自動化的、計算機輔助的機器(例如生物打印機)來放置是有利的。采用生物打印機來遞送細胞、多細胞體、微囊是有利的,其優點包括:快速、精確和可再現地放置細胞、多細胞體、微囊以產生構建體,該構建體表現出具有各種組成的細胞、多細胞聚集體、微囊和/或它們的層的計劃的或預先確定的取向或圖案。在一些實施方案中,生物打印方法是連續的和/或基本連續的。連續生物打印方法的非限制性實例是:經由連接到生物墨汁儲存器的分配末端(例如,注射器、毛細管等)從生物打印機分配生物墨汁(例如與生物粘合劑或擠出化合物組合的微囊)。在進一步的非限制性實施方案中,連續生物打印方法是按功能單元的重復圖案分配生物墨汁。在各個實施方案中,重復功能單元具有任何適宜的幾何形狀,包括例如:圓形、正方形、矩形、三角形、多邊形和不規則的幾何形狀,從而產生具有通過獨特生物墨汁和/或間隙空間的空間圖案化而獲得的平面幾何形狀的一個或多個組織層。在進一步的實施方案中,生物打印的功能單元的一個重復圖案包括一個層,相鄰地生物打印(例如堆疊)多個層以形成具有層狀幾何形狀的工程化組織或器官。在各個實施方案 中,相鄰地生物打印(例如堆疊)了2、3、4、5、6、7、8、9、10、11、12、13、14、15個或更多個層,以形成工程化組織或器官。在進一步的實施方案中,具有層狀幾何形狀的組織的一個或多個層也具有平面幾何形狀。除了噴墨生物打印技術之外,還可使用低溫沉降成型技術或紫外光固化成型技術,對所述m種微囊進行排布,以制備構建體。關于噴墨生物打印技術、低溫沉降成型技術和紫外光固化成型技術的詳細描述,可參見例如,25thAnniversaryArticle:EngineeringHydrogelsforBiofabrication,其通過引用以其全文并入本文。在某些優選的實施方案中,所述構建體具有一層或多層結構。進一步優選的,每一個層結構各自由一層或多層微囊構建。不同的結構層所使用的微囊可以是相同或者不同的。例如,所述構建體可具有類似于關節的、包含骨和軟骨的復合結構的細胞分布模式。在某些優選的實施方案中,所述構建體由微囊內的細胞凝聚而形成。特別地,在本發明的實施方案中,微囊的核層和任選的殼層,以及載體(例如生物粘合劑)各自由生物可降解材料制成。因此,在生物打印后,可對構建體進行培養,由此,在微囊內部/外部各種活性物質的刺激下,微囊內的細胞開始進行生長、增殖、分化、分泌和/或遷移;微囊的核層和殼層以及載體(例如生物粘合劑)開始不斷降解;細胞之間逐步凝聚/融合,建立連接(包括微囊內部的細胞連接,微囊之間的細胞連接);并且,細胞分泌的細胞外基質也相互融合形成一體;由此,打印后精確排布的所有細胞融合形成有機排列的、一體化的復合結構(例如包含骨細胞和軟骨細胞的復合結構,或者包含包含內皮細胞和平滑肌細胞的復合結構)。在某些優選的實施方案中,所述構建體的尺寸可以為微米至厘米級別,例如1μm-1cm,例如,10μm-5mm,50μm-1mm,100μm-800μm,300μm-600μm。在某些優選的實施方案中,所述構建體的尺寸可以為至少30μm、50μm、100μm、200μm、500μm、1mm、2mm、5mm、1cm、2cm、5cm、10cm、20cm、或50cm。在某些優選的實施方案中,所述構建體的各種微囊可在相同的培養體系中進行進一步的培養。在某些優選的實施方案中,在培養過程中,構建體的微囊中的細胞生長,增殖,分化、分泌和/或遷移;并且微囊的核層和/或殼層的生物可降解材料被至少部分降解。在某些優選的實施方案中,微囊內的細胞在培養后增殖至少2、5、10、20、50、100、200、500、1000、2000、5000、10000、20000、50000、或100000倍。在某些優選的實施方案中,微囊的核層和/或殼層的生物可降解材料被降解至少10%、20%、30%、40%、50%、60%、70%、80%、或90%。在某些優選的實施方案中,在培養后,構建體中的不同微囊之間的細胞彼此連接,并且微囊的核層和/或殼層的生物可降解材料被至少部分降解。在某些優選的實施方案中,不同微囊之間,至少10%、20%、30%、40%、50%、60%、70%、80%、或90%的細胞彼此連接。在某些優選的實施方案中,載體(例如生物粘合劑)中的生物可降解材料被降解至少10%、20%、30%、40%、50%、60%、70%、80%、或90%。在某些優選的實施方案中,核層和/或殼層和/或載體中的生物可降解材料的降解產物為細胞提供了營養物質或細胞外基質材料。在某些優選的實施方案中,所述構建體被培養至少0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、25、或30天,例如1-3、3-5、5-7、7-10、10-14、14-21、21-28、1-7、7-14、1-14、或14-28天,以產生復合結構,例如包含骨細胞和軟骨細胞的復合結構,或者包含包含內皮細胞和平滑肌細胞的復合結構。在某些優選的實施方案中,所述構建體在3D培養箱中進行培養。在某些優選的實施方案中,所述構建體在生物反應器中進行培養。在某些優選的實施方案中,在培養過程中對構建體施加物理刺激(例如壓力,剪切力,光照,加熱等)。在某些優選的實施方案中,在培養過程中對構建體施加化學刺激(例如激素,細胞因子,化學試劑等)。使用本發明微囊構建的三維構建體的一個實例的示意性結構示于圖2中。如圖2所示,該三維構建體包括兩層結構,即,成骨層(其包含第一微囊)和成軟骨層(其包含第二微囊)。其中,成骨層由第一微囊 構建;成軟骨層由第二微囊構建。成骨層和成軟骨層各自可以由一層或多層細胞構成,根據所使用的微囊中含有的細胞的具體數量而定。微囊之間的間隙填充有生物粘合劑。在優選的實施方案中,生物粘合劑中可進一步包含維持、促進、改善、調控微囊內的細胞的生命活動的試劑。使用本發明微囊構建的三維構建體的一個實例的示意性結構示于圖3中。如圖3所示,該三維構建體包括兩部分結構,即,包含內皮細胞的部分(其包含第一微囊)和包含平滑肌細胞的部分(其包含第二微囊)。其中,包含內皮細胞的部分由第一微囊構建;包含平滑肌細胞的部分由第二微囊構建。包含內皮細胞的部分和包含平滑肌細胞的部分各自可以由一層或多層細胞構成,根據所使用的微囊中含有的細胞的具體數量而定。在某些優選的實施方案中,本發明的三維構建體是使用本發明的微囊,通過3D生物打印方法而構建的。然而,不受于理論限制,本發明的三維構建體也可以使用本發明的微囊,通過任何其他已知的方法(例如手工放置的方法)來構建。在某些優選的實施方案中,在步驟(3)中,通過生物打印(例如3D生物打印)對所述m種微囊進行排布,以制備構建體。在某些優選的實施方案中,本發明方法中的生物打印步驟是連續的和/或基本連續的。在某些優選的實施方案中,本發明方法包括,連續地生物打印多個層,以獲得具有預定模式的、包含多個層的三維構建體,其中每個層根據預定的模式用上文定義的微囊或組合物進行生物打印。在某些優選的實施方案中,本發明方法包括,連續地生物打印多個區段,以獲得具有預定模式的、包含多個區段的三維構建體,其中每個區段根據預定的模式用上文定義的微囊或組合物進行生物打印。在某些優選的實施方案中,組合物中的載體包含生物粘合劑,其將層、區段和/或構建體中的微囊粘結在一起。在某些優選的實施方案中,組合物中的載體包含生物粘合劑,其將微囊固定在層、區段和/或構建體中。在某些優選 的實施方案中,所述預定的模式通過支架來限定。在某些優選的實施方案中,本發明的微囊或組合物被打印至支架上。優選地,所述支架具有預定的模式。在某些優選的實施方案中,所述支架為包含生物可降解材料的人工結構,其能夠支持組合物中的微囊形成人工組織或組織前體。在某些優選的實施方案中,本發明的制備構建體的方法不使用支架。本發明方法中,制備構建體的步驟與本領域已知的其他生物打印方法是相容的。例如,制備構建體的步驟可使用Cyfuse、Organovo和EnvisionTEC開發的生物打印機來進行。目前已開發了三種主要的生物打印機,即,噴墨型生物打印機,擠出型生物打印機和激光輔助型生物打印機(參見MurphSVandAtalaA.(2014)NatureBiotechnology,32(8):773-785)。備選地,制備構建體的步驟可使用自動化或非自動化機械過程(而非打印機)的生物打印方法來進行,或者使用手工放置或手工沉積法(例如使用移液器)的生物打印方法來進行。在某些優選的實施方案中,通過噴墨方式來進行生物打印。在某些優選的實施方案中,通過擠出的方式來進行生物打印。在某些優選的實施方案中,通過手工放置或手工沉積來進行生物打印。在某些優選的實施方案中,在步驟(3)中,使用本發明的微囊或組合物在體內進行生物打印,以在體內產生構建體。在某些優選的實施方案中,在受試者(例如人受試者)上直接進行生物打印。在某些優選的實施方案中,在受試者的組織(例如皮膚組織)的損傷位點直接進行生物打印。在某些優選的實施方案中,所述組織因創傷,感染,疾病,或老齡化而遭致損傷。在某些優選的實施方案中,根據組織或組織損傷位點的細胞分布信息,在受試者的組織(例如皮膚組織)的損傷位點直接進行生物打印。在某些優選的實施方案中,所述細胞分布信息選自,組織或組織損傷位點的各個細胞層的位置或類型,各個層的細胞的類型,各個層中不同細胞的比率,各個層中的細胞分布模式,或其任何組合。在某些優選的實施方案中,在進行生物打印之前,獲得組織或組織損傷位點的細胞分布信息。在某些優選的實施方案中,所述 方法還包括,獲得組織或組織損傷位點的細胞分布信息,然后根據所述細胞分布信息進行生物打印。在某些優選的實施方案中,用于在受試者上進行生物打印的微囊或組合物中的細胞來源于所述受試者。在某些優選的實施方案中,用于在受試者上進行生物打印的微囊或組合物中的細胞來源于與所述受試者具有相似或相同特征(例如,物種,年齡,性別,遺傳信息等)的其他受試者。在某些優選的實施方案中,用于在受試者上進行生物打印的組合物中的細胞來源于同種異體。在某些優選的實施方案中,用于在受試者上進行生物打印的微囊或組合物中的細胞來源于細胞系。在某些優選的實施方案中,使用本發明的微囊或組合物在體外進行生物打印。本發明方法中制備構建體的步驟不會對組合物中或微囊內的細胞造成機械損傷。在某些優選的實施方案中,組合物中或微囊內至少80%、85%、87.5%、90%、92.5%、95%、或98%的細胞在生物打印后存活。在某些優選的實施方案中,組合物中或微囊內至少90%的細胞在生物打印后存活至少3小時、6小時、12小時、1天、2天、4天、或7天。在某些優選的實施方案中,組合物中或微囊內至少80%、85%、87.5%、90%、92.5%、95%、或98%的細胞在生物打印后能夠增殖和/或分化。在某些優選的實施方案中,組合物中或微囊內至少80%、85%、87.5%、90%、92.5%、95%、或98%的細胞在生物打印后具有正常的新陳代謝。在某些優選的實施方案中,組合物中或微囊內至少80%、85%、87.5%、90%、92.5%、95%、或98%的細胞在生物打印后能夠遷移。在某些優選的實施方案中,組合物中或微囊內至少80%、85%、87.5%、90%、92.5%、95%、或98%的細胞在生物打印后能夠分泌。在某些優選的實施方案中,在步驟(4)中,在允許微囊內的細胞增殖、分化、遷移、分泌和/或新陳代謝的條件下,培養所獲得的構建體。培養條件取決于所使用的細胞類型,所使用的微囊的類型,構建體的結構和形狀等等。本領域技術人員能夠選擇合適的培養條件,例如培養基,pH,溫度,CO2水平和持續時間。一般的組織和細胞培養條件可參見例如,Doyle,Alan,andJ.BryanGriffiths,eds.Celland tissueculture:laboratoryproceduresinbiotechnology.NewYork:Wiley,1998。在某些優選的實施方案中,在步驟(4)中,在相同的培養體系中培養經過排布的m種微囊(即,構建體)。在某些優選的實施方案中,培養所獲得的構建體至少0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、25、或30天,例如以獲得所述復合結構(例如人工組織或其前體)。在某些優選的實施方案中,培養所獲得的構建體1-3、3-5、5-7、7-10、10-14、14-21、21-28、1-7、7-14、1-14、或14-28天,例如以獲得所述復合結構(例如人工組織或其前體)。在某些優選的實施方案中,在3D培養箱中培養所獲得的構建體。在某些優選的實施方案中,在生物反應器中培養所獲得的構建體。在某些優選的實施方案中,在37℃,5%CO2的條件下培養所獲得的構建體。在某些優選的實施方案中,在培養過程中對構建體施加物理刺激(例如壓力,剪切力,光照,加熱等)。在某些優選的實施方案中,在培養過程中對構建體施加化學刺激(例如激素,細胞因子,化學試劑等)。在某些優選的實施方案中,微囊的核層和/或殼層和/或載體中的生物可降解材料在培養過程中至少一部分被降解。優選地,此類生物可降解材料的降解產物為微囊中的細胞提供了營養物質和/或細胞外基質。在某些優選的實施方案中,細胞在培養過程中的分泌物整合入構建體的細胞外基質中。在某些優選的實施方案中,微囊內的細胞在培養過程中彼此連接。在某些優選的實施方案中,微囊之間的細胞在培養過程中彼此連接。在某些優選的實施方案中,所述構建體在培養后具有高細胞密度(例如至少100、200、500、1000、2000、5000、10000、20000、50000、或100000細胞/mm3)。在某些優選的實施方案中,微囊內的細胞在培養后增殖至少2、5、10、20、50、100、200、500、1000、2000、5000、10000、20000、50000、或100000倍。本發明方法所制備的復合結構可具有任何預定的模式,例如任何預定的形狀。例如,所述復合結構可以是片狀結構(例如長方形,正方形,圓形,橢圓形,六角形或不規則形狀的片狀結構),或中空管狀結 構,或中空三維結構(例如中空立方體,中空球體,中空的矩形棱柱體,中空圓柱體,或中空的不規則形狀的三維結構),或實心三維結構(例如實心立方體,實心球體,實心矩形棱柱體,實心圓柱體,或實心不規則形狀的三維結構),或其任何組合。在某些優選的實施方案中,所述復合結構的形狀模擬天然組織或器官(例如骨組織,軟骨組織,和關節組織)的形狀。在某些優選的實施方案中,所述復合結構的尺寸為至少30μm、50μm、100μm、200μm、500μm、1mm、2mm、5mm、1cm、2cm、5cm、10cm、20cm、或50cm。與現有技術方法不同,在剛剛完成生物打印步驟之時,構建體中的不同微囊之間的細胞彼此不互相連接。對構建體進行進一步培養將導致細胞首先在微囊殼層內生長、增殖、分化、分泌和/或遷移;隨后在培養過程中,隨著微囊內生物可降解材料(例如核層和殼層中的生物可降解材料)的降解,細胞可突破微囊的殼層。由此,可在基于微囊的構建體中實現精確的細胞排布,這進而使得能夠產生更加復雜的復合結構(例如組織或器官)。在另一個方面,本發明提供了通過上述方法制備的復合結構。在某些優選的實施方案中,所述復合結構是組織前體,組織或器官。在某些優選的實施方案中,所述復合結構是包含骨細胞和軟骨細胞的復合結構。在某些優選的實施方案中,所述復合結構是包含內皮細胞和平滑肌細胞的復合結構。在某些優選的實施方案中,所述復合結構是骨組織、軟骨組織、關節組織、或包含骨和軟骨的復合結構。對于此類復合結構而言,其可包含,上文所描述的含有MSC細胞和誘導MSC向成骨細胞或骨分化的誘導因子的微囊,和/或,上文所描述的含有MSC細胞和誘導MSC向成軟骨細胞或軟骨分化的誘導因子的微囊。此類復合結構可通過使用上文所描述的含有MSC細胞和誘導MSC向成骨細胞或骨分化的誘導因子的微囊,和/或,上文所描述的含有MSC細胞和誘導MSC向成軟骨細胞或軟骨分化的誘導因子的微囊而制備。在某些優選的實施方案中,所述復合結構是包含內皮細胞和平滑肌細胞的復合結構。對于此類復合結構而言,其可包含,上文所描述的含有MSC細胞和內皮細胞的微囊,和/或,上文所描述的含有MSC細胞和平滑肌細胞的微囊。此類復合結構可通過使用上文所描述的含有MSC細胞和和內皮細胞的微囊,和/或,上文所描述的含有MSC細胞和平滑肌細胞的微囊而制備。在另一個方面,本發明提供了通過上述方法獲得的構建體或復合結構(例如包含骨細胞和軟骨細胞的復合結構,或包含內皮細胞和平滑肌細胞的復合結構)的用途。本發明的構建體或復合結構可用于各種應用,例如用于研究領域或醫藥領域的應用。例如,本發明的構建體或復合結構可用于研究干細胞分化,用于藥物發現,用于藥物篩選,用于體內或體外測定,用于植入宿主體內,用于組織工程或用于組織再生。本發明的構建體或復合結構還可用于制備試劑盒,所述試劑盒用于各種應用,例如用于研究領域或醫藥領域的應用。例如,本發明的構建體或復合結構可用于研究干細胞分化,用于藥物發現,用于藥物篩選,用于體內或體外測定,用于植入宿主體內,用于組織工程或用于組織再生。在某些優選的實施方案中,本發明的構建體或復合結構可用于組織工程。在某些優選的實施方案中,構建體或復合結構中的微囊為微囊內的細胞提供了獨特的微環境,從而允許研究培養條件(例如三維培養條件)的作用/影響,例如研究培養條件(例如三維培養條件)對細胞增殖、分化、新陳代謝、遷移、分泌、組織發育或器官生成(例如骨組織,軟骨組織,和關節組織的發育)的影響。在某些優選的實施方案中,本發明的構建體或復合結構可用于研究干細胞分化(例如MSC細胞分化)。在某些優選的實施方案中,本發明的構建體或復合結構可用于體外測定。在某些優選的實施方案中,所述體外測定是用于檢測或測量物質(例如化學試劑,生化試劑,藥物等)在生物學樣品(例如細胞聚集 體,組織,器官,生物體等)中的存在或活性的方法。在某些優選的實施方案中,所述體外測定是定性的。在某些優選的實施方案中,所述體外測定是定量的。示例性的體外測定包括但不限于,基于圖像的測定,分泌的蛋白質的測定,標志物的表達和蛋白質的產生。在某些優選的實施方案中,體外測定用于檢測或測量下述中的一個或多個:分子結合(包括放射性配體結合),分子攝取,活性(例如,酶活性和受體活性等),基因表達,蛋白質表達,受體激動作用,受體拮抗作用,細胞信號傳導,細胞凋亡,化學敏感性,轉染,細胞遷移,趨化性,細胞活力,細胞增殖,安全性,有效性,新陳代謝,毒性和濫用傾向。在某些優選的實施方案中,體外測定是免疫測定,例如競爭性免疫測定和非競爭性免疫測定。在某些優選的實施方案中,體外測定是酶聯免疫吸附測定。在某些優選的實施方案中,本發明的構建體或復合結構提供了體外測定中測量或檢測的分子,細胞,細胞群或組織。在某些優選的實施方案中,體外測定用于基礎研究,以發現、開發或研究任何分子,細胞,或其結構或作用機制。體外測定的示例性應用包括但不限于,開發三維培養系統,研究信號傳導通路,干細胞誘導和分化,細胞間相互作用等等。在某些優選的實施方案中,本發明的構建體或復合結構可用于藥物篩選或藥物發現。在某些優選的實施方案中,本發明的構建體或復合結構用于制備細胞的陣列,微陣列或芯片,多細胞聚集體或組織,從而用于藥物篩選或藥物發現。在某些優選的實施方案中,本發明的構建體或復合結構存在于多孔容器的孔中。優選地,所述容器與自動化藥物篩選方法和/或裝置兼容。在某些優選的實施方案中,本發明的構建體或復合結構用于藥物篩選或藥物發現,以研究或開發可用于治療疾病的藥物。優選地,所述疾病包括但不限于,感染性疾病,血液疾病,腫瘤疾病,兒科疾病,心血管疾病,中樞神經系統疾病,神經內科疾病,消化內科疾病,肝病科疾病,泌尿科疾病,不孕不育,眼科疾病,腎內科疾病,骨科疾病,疼痛,呼吸病,皮膚疾病,免疫疾病,精神疾病。例如,所述疾病可以為骨科疾病。在某些優選的實施方案中,本發明的構建體或復合結構用于體內測定。在某些優選的實施方案中,本發明的構建體或復合結構用作受試者(例如動物模型)中的異種移植物。在某些優選的實施方案中,本發明的構建體或復合結構用作移植物,用于植入受試者體內。在某些優選的實施方案中,本發明的構建體或復合結構用于分析細胞在體內響應刺激或試劑而產生的變化(例如形態變化或功能變化)。在此類實施方案中,將構建體或復合結構的微囊中的細胞暴露于所述刺激或試劑,和,評估微囊中的細胞的功能變化。在某些優選的實施方案中,所述微囊位于受試者體內。在某些優選的實施方案中,本發明的構建體或復合結構用于研究干細胞分化(特別是MSC細胞分化)。在某些優選的實施方案中,本發明的構建體或復合結構用于評估因子(例如,化學試劑,例如化合物;物理刺激,例如輻射或加熱)對組織或組織中的細胞的作用。在某些優選的實施方案中,本發明的構建體或復合結構用于三維組織培養。在某些優選的實施方案中,本發明的構建體或復合結構用于修復受試者中損傷組織(例如,骨組織,軟骨組織,關節組織,或包含內皮細胞和平滑肌細胞的組織)。在某些優選的實施方案中,本發明的微囊用于直接在受試者中進行生物打印。在某些優選的實施方案中,根據組織的細胞分布信息來進行生物打印。在某些優選的實施方案中,所述微囊被打印至受試者中的支架上。在某些優選的實施方案中,在生物打印過程中不使用支架。在某些優選的實施方案中,所述受試者是動物模型。在某些優選的實施方案中,本發明的構建體或復合結構用于研究體內微環境的影響,因為構建體或復合結構的微囊中的細胞能夠在受試者體內增殖,分化,遷移,新陳代謝,分泌或發育。在某些優選的實施方案中,本發明的構建體或復合結構用于研究化合物(例如藥物)在體內對微囊中的細胞的作用。在某些優選的實施方案中,本發明的構建體或復合結構用于組織再生。在某些優選的實施方案中,本發明的構建體或復合結構用于體 內組織或器官移植。在某些優選的實施方案中,本發明的構建體或復合結構用于保護、修復或替換受試者(例如人)體內的受損的,患病的或衰竭的組織或器官(例如,骨組織,軟骨組織,關節組織,或包含內皮細胞和平滑肌細胞的組織)。在某些優選的實施方案中,本發明的構建體或復合結構用于生產細胞(例如干細胞,祖細胞,前體細胞,免疫細胞等等),以用于細胞療法。在某些優選的實施方案中,本發明的構建體或復合結構用于生產生物活性分子(例如激素,生長因子,細胞因子,配體等等)。優選地,所述生物活性分子可用于誘導接受本發明的構建體或復合結構或其產物(例如細胞或生物活性分子)的受試者(例如人)的組織再生。在另一個方面,本發明提供了評估因子(例如,化學試劑,例如化合物;物理刺激,例如輻射或加熱)對組織或組織中的細胞的作用的方法,其包括,將本發明的構建體或復合結構暴露于所述因子,和,評估所述構建體或復合結構中的細胞響應所述因子的變化(例如形態變化或功能變化),從而確定所述因子對組織或組織中的細胞的作用。在某些優選的實施方案中,所述化合物是藥物。在某些優選的實施方案中,所述方法用于測定所述藥物的功效。在某些優選的實施方案中,所述方法用于篩選藥物。在某些優選的實施方案中,所述構建體或復合結構的微囊中的細胞來源于需要所述藥物的受試者。在另一個方面,本發明提供了修復受試者中損傷組織的方法,其包括,將通過本發明方法獲得的構建體或復合結構植入受試者的損傷組織,或者通過上述方法在受試者中組織的損傷位點直接生物打印出構建體或復合結構。在某些優選的實施方案中,在置于組織損傷位點的支架上進行生物打印。在某些優選的實施方案中,在生物打印過程中不使用支架。在某些優選的實施方案中,所述方法包括,獲得組織或組織損傷位點的細胞分布信息,然后根據所述細胞分布信息進行生物打印。在某些優選的實施方案中,用于在受試者上進行生物打印的微囊或組合物中的細胞來源于所述受試者。在某些優選的實施方案中, 用于在受試者上進行生物打印的微囊或組合物中的細胞來源于與所述受試者具有相似或相同特征(例如,物種,年齡,性別,遺傳信息等)的其他受試者。在某些優選的實施方案中,用于在受試者上進行生物打印的微囊或組合物中的細胞來源于同種異體。在某些優選的實施方案中,用于在受試者上進行生物打印的微囊或組合物中的細胞來源于細胞系。在另一個方面,本發明提供了一種藥物組合物,其包含通過上述方法獲得的構建體或復合結構。在某些優選的實施方案中,所述藥物組合物用于組織再生。在某些優選的實施方案中,所述藥物組合物還包含藥學可接受的載體,賦形劑,穩定劑或能夠為所述藥物組合物的施用(例如施用給人受試者)提供有利性質的其他試劑。合適的藥物載體包括例如,無菌水,鹽水,葡萄糖,蓖麻油和環氧乙烷的縮合產物,液體酸,低級醇,油(例如玉米油,花生油,芝麻油;其任選還包含乳化劑如脂肪酸的單-或二-甘油酯,或磷脂例如卵磷脂),乙二醇,聚亞烷基二醇,藻酸鈉,等等。所述載體任選地還可包含佐劑,防腐劑,穩定劑,潤濕劑,乳化劑,滲透增強劑等。在某些優選的實施方案中,所述藥物組合物是無菌的。此外,所述藥物組合的粘度可通過選擇合適的溶劑或賦形劑來控制和維持。在某些優選的實施方案中,賦形劑和稀釋劑可包括但不限于,乳糖,葡萄糖,蔗糖,山梨醇,甘露糖醇,淀粉,阿拉伯樹膠,磷酸鈣,海藻酸鹽,黃蓍膠,明膠,硅酸鈣,微晶纖維素,纖維素,水,鹽水溶液,糖漿,甲基纖維素,羥基苯甲酸甲酯和丙酯,滑石,硬脂酸鎂和礦物油。在某些優選的實施方案中,所述藥物組合物經配制具有4.5-9.0,5.0-8.0,6.5-7.5,或6.5-7.0的pH。在某些優選的實施方案中,所述藥物組合物是與血液等滲的。在某些優選的實施方案中,所述藥物組合物用于治療需要保護、修復或置換組織(例如骨組織,軟骨組織,關節組織,或包含內皮細胞和平滑肌細胞的組織)的受試者,例如人受試者。在某些優選的實施方 案中,本發明提供了保護組織(例如骨組織,軟骨組織,關節組織,或包含內皮細胞和平滑肌細胞的組織)的方法,其包括,給有此需要的受試者施用有效量的本發明的藥物組合物。在某些優選的實施方案中,本發明提供了修護受損組織(例如骨組織,軟骨組織,關節組織,或包含內皮細胞和平滑肌細胞的組織)的方法,其包括,給有此需要的受試者施用有效量的本發明的藥物組合物。在某些優選的實施方案中,本發明提供了置換組織(例如受損組織,缺陷組織;例如骨組織,軟骨組織,關節組織,或包含內皮細胞和平滑肌細胞的組織)的方法,其包括,給有此需要的受試者施用有效量的本發明的藥物組合物。在某些優選的實施方案中,所述受試者是人。在某些優選的實施方案中,所述藥物組合物用于組織再生。在某些優選的實施方案中,所述藥物組合物用于細胞療法。在某些優選的實施方案中,本發明提供了細胞療法,其包括,給有此需要的受試者施用有效量的本發明的藥物組合物。在某些優選的實施方案中,有效量的藥物組合物足以改善組織(例如骨組織,軟骨組織,關節組織,或包含內皮細胞和平滑肌細胞的組織)的條件(例如完整性,健康,外觀等)至少約10%、20%、30%、40%、50%、60%、70%、80%、或90%。藥物組合物的有效量可根據實際情況來確定。本發明的藥物組合物可以通過任何合適的方式來施用。在某些優選的實施方案中,通過手術植入來使用所述藥物組合物。在某些優選的實施方案中,所述藥物組合物被施用一次。在某些優選的實施方案中,所述藥物組合物被施用多次。在某些優選的實施方案中,所述藥物組合物以選自下述的頻率施用:每天三次,每天兩次,每天一次,每兩天一次,每3天一次,每周一次,每兩周一次,每三周一次,每月一次,每兩個月一次,每3個月一次,每六個月一次或每年一次。在另一個方面,本發明提供了通過上述方法獲得的構建體或復合結構用于制備上述藥物組合物的用途。在某些優選的實施方案中,所述藥物組合物用于組織再生,或體內組織或器官移植。在某些優選的實施方案中,所述組織是骨組織,軟骨組織,和/或關節組織。在某些優選的實施方案中,所述組織是包含內皮細胞和平滑肌細胞的組織。在另一個方面,本發明提供了一種試劑盒,其包含通過上述方法獲得的構建體或復合結構(例如包含骨和軟骨的復合結構,和/或包含內皮細胞和平滑肌細胞的復合結構)。在某些優選的實施方案中,所述試劑盒包含本發明的構建體。在某些優選的實施方案中,本發明的構建體是使用上述方法制備的(例如通過生物打印)。在某些優選的實施方案中,所述試劑盒還包含,培養基,緩沖劑,和/或用于培養構建體所需的其他試劑。在某些優選的實施方案中,所述試劑盒還包含使用說明書,其描述了培養所述構建體的方法。在某些優選的實施方案中,所述試劑盒用于再生醫學,例如體內移植或細胞療法。在某些優選的實施方案中,所述試劑盒用于體外測定或藥物篩選。在某些優選的實施方案中,所述試劑盒還包含,體外測定、藥物篩選或再生醫學(例如體內移植或細胞療法)所需的其他試劑,和/或使用說明書。在某些優選的實施方案中,所述試劑盒還包含支架,或者用于制備支架的材料。在某些優選的實施方案中,所述試劑盒可用于分析細胞響應刺激或試劑而產生的功能變化,用于藥物篩選或藥物發現,用于治療有此需要的受試者,用于研究干細胞分化,用于評估因子(例如,化學試劑,例如化合物;物理刺激,例如輻射或加熱)對組織或組織中的細胞的作用,用于三維組織培養,用于修復受試者中損傷組織。在某些優選的實施方案中,所述組織是骨組織,軟骨組織,和/或關節組織,和/或包含內皮細胞和平滑肌細胞的復合結構。本發明的試劑盒可置于任何合適的包裝中。此類包裝包括但不限于,瓶,罐,和軟包裝(如聚酯薄膜或塑料袋)。在另一個方面,本發明提供了本發明的構建體或復合結構(例如包含骨和軟骨的復合結構)用于制備試劑盒的用途,所述試劑盒可用于上文所論述的各種應用。例如,所述試劑盒可用于分析細胞響應刺激或試劑而產生的功能變化,用于藥物篩選或藥物發現,用于治療有此需要的受試者,用于研究干細胞分化,用于評估因子(例如,化學試劑, 例如化合物;物理刺激,例如輻射或加熱)對組織或組織中的細胞的作用,用于三維組織培養,用于修復受試者中損傷組織。在某些優選的實施方案中,所述組織是骨組織,軟骨組織,和/或關節組織,和/或包含內皮細胞和平滑肌細胞的復合結構。發明的有益效果與現有技術相比,本發明的技術方案具有以下有益效果:(1)本發明的方法無需將種子細胞種植至材料支架的操作過程,而是直接使用包含細胞的微囊(例如包含MSC細胞的微囊)來構建人工植入物。(2)本發明的方法在操作細胞(例如MSC細胞、內皮細胞和/或平滑肌細胞)之前無需預先對細胞進行體外大量增殖;相反地,本發明的方法在將包含細胞的微囊構建成人工植入物后,其所包含的細胞直接在微囊內大量增殖并最終形成完整植入物。(3)本發明的方法無需多種培養體系;相反地,本發明的方法能夠在同一個培養體系下同時培養多種微囊,并使得微囊中的細胞增殖和/或分化為所需的各種目的細胞(例如,該方法能夠在同一個培養體系下同時誘導MSCs分別分化為成骨細胞和成軟骨細胞,或者在同一個培養體系下同時誘導MSCs分別分化為內皮細胞和成平滑肌細胞)。(4)通過對包含細胞的微囊的精確排布,本發明的方法能夠實現多種目的細胞(例如成骨細胞和成軟骨細胞,或內皮細胞細胞和成平滑肌細胞)的精確排布,并最終形成結構功能完整的人工植入物(例如,包含骨細胞和軟骨細胞的復合結構或包含內皮細胞和平滑肌細胞的復合結構)。具體實施方式現參照下列意在舉例說明本發明(而非限定本發明)的實施例來描述本發明。實施例中未指明其來源的試劑、試劑盒或儀器均為市場上商購可 得的常規產品。本領域技術人員知曉,實施例以舉例方式描述本發明,且不意欲限制本發明所要求保護的范圍。實施例1.微囊的制備本實施例提供了制備微囊的示例性方法。微囊的制備方法應當在無菌條件下進行。此外,如果意欲將微囊應用于人體的話,那么其制備方法的生物安全等級應當達到GMP車間級別。本方法所使用的儀器為造粒儀(BUCHI,Encapsulator,B-395Pro),其配備的同心噴嘴的直徑如下:內層噴嘴,200μm;外層噴嘴,300μm。本方法所使用的材料如下:(1)用于制備核層的材料I型膠原:4mg/ml,使用無菌1MNaOH進行中和;海藻酸鈉:使用去離子水溶解稀釋;血管內皮生長因子VEGF;將I型膠原與2%(w/v)(即,2g/100ml,下同)海藻酸鈉溶液以1:1的比例(按重量計)混合,用于制備核層。(2)用于制備殼層的材料4%海藻酸鈉;彈性蛋白;殼層固定液,即,0.1mol/LCaCl2溶液。(3)所使用的細胞:人臍靜脈內皮細胞(HUVEC)(購買自ATCC)。制備微囊的操作步驟如下(以下實驗步驟均在冰上操作):將120μlNaOH溶液與750μlI型膠原混合,然后向其中加入130μl血管內皮細胞懸液(細胞濃度為1x105個/ml,懸浮于PBS中),從而獲得1ml細胞包裹液。然后,將細胞包裹液與1ml2%海藻酸鈉(包含終濃度為20ng/ml的VEGF)混合,使細胞均勻分散,從而獲得包裹細胞的核層材料。向2ml4%海藻酸鈉溶液中加入100ng彈性蛋白(elastin,其終 濃度為50ng/ml),充分混勻,該混合物用作殼層材料,用于制備微囊的殼層。此外,取300ml0.1mol/LCaCl2溶液置于燒杯中,用于殼層材料的固定。將如上制備的核層材料和殼層材料分別置于2支5ml注射器中。按照制造商的說明書,設置造粒儀的壓力、離散力、泵的速度等參數,然后使用所述核層材料和殼層材料進行造粒和包被。造粒儀的內噴嘴的直徑設置為200μm,外噴嘴的直徑設置為300μm。將獲得的微囊微粒收集于裝有300ml0.1mol/LCaCl2溶液的燒杯中,固定5min,制備獲得微囊。所制備的微囊可以在4℃下保存,或可直接用于3D生物打印。實施例2.微囊的表征本實施例具體分析了通過實施例1方法制備的微囊的性能,包括微囊的尺寸,殼層的厚度和力學保護作用,所包含的細胞的數量等。使用顯微鏡來觀察通過實施例1方法制備的微囊,結果示于圖3A-3C中。圖3A-3C顯示了使用造粒儀在不同儀器參數(同心噴嘴的內噴嘴和外噴嘴的直徑)下制備的微囊的顯微照片,其中,圖3A中的微囊的直徑為約120μm(標尺為100μm);圖3B中的微囊的直徑為約200μm(標尺為100μm);圖3C中的微囊的直徑為約450μm(標尺為200μm)。這些結果表明,可通過控制造粒儀的儀器參數(例如,同心噴嘴的內噴嘴和外噴嘴的直徑)來控制微囊的尺寸。本發明的微囊的尺寸是可控的,可根據需要進行選擇。還使用顯微鏡進一步觀察了通過實施例1方法制備的微囊的殼層厚度,結果示于圖4中。圖4顯示了通過實施例1方法制備的微囊的顯微照片,其中,高亮部分代表微囊的殼層,且該殼層的厚度為約2μm(標尺為50μm)。結果表明,可通過控制造粒儀的同心噴嘴的內噴嘴和外噴嘴的直徑,殼層材料的泵出速度等參數來控制殼層的厚度。本發明的微囊的殼層厚度是可控的,可根據需要進行選擇。還使用顯微鏡進一步觀察了通過實施例1方法制備的微囊所包含 的細胞的數量。結果示于圖5A-5C中。圖5A-5C顯示了通過實施例1方法制備的微囊的顯微照片,其中,圖5A中的微囊包裹的細胞數為約50個(標尺為100μm);圖5B中的微囊包裹的細胞數為約8個(標尺為100μm);圖5C中的微囊包裹的細胞數為約2個(標尺為100μm)。這些結果表明,可通過控制細胞懸液的細胞濃度來控制微囊包裹的細胞數。本發明微囊包含的細胞的數量是可控的,可根據需要進行選擇。另外,還根據制造商的說明書,使用美國Hysitron(海思創)TI-950型納米壓痕儀,檢測了通過實施例1方法制備的微囊(尺寸為約400μm)的力學性能。檢測結果顯示,該批次的微囊的硬度平均大約為0.083GPa,彈性模量平均大約為1.683MPa。這些結果表明,本發明微囊具有優良的力學保護性能,可有效避免微囊內的細胞遭受外界的力學損傷/機械損傷。此外,還已發現,可通過控制微囊的殼層厚度和殼層材料等參數來控制微囊的力學保護性(數據未顯示)。本發明微囊的力學保護性能是可控的,可根據需要進行選擇。實施例3.其他類型的微囊的制備還使用與實施例1類似的方法,利用造粒儀,以下述原料制備了其他類型的微囊(即,微囊B1-B4)。圖6A-6D顯示了使用造粒儀制備的微囊B1-B4的顯微照片,其中,圖6A中的微囊為微囊B1,其直徑為約600μm(標尺為500μm);圖6B中的微囊為微囊B2,其直徑為約500μm(標尺為500μm);圖6C 中的微囊為微囊B3,其直徑為約500μm(標尺為500μm);圖6D中的微囊為微囊B4,其直徑為約500μm(標尺為500μm)。這些結果表明,可使用各種合適的生物可降解材料來制備本發明的微囊。另外,為了更清楚地觀察所制備的微囊的結構,還使用trackerCM-Dil(紅色熒光)對用于制備微囊B2的核層材料所包裹的細胞進行標記;并且,使用帶有FITC(綠色熒光)的聚賴氨酸作為制備微囊B2的殼層材料。隨后,使用共聚焦顯微鏡來觀察用含有trackerCM-Dil標記的細胞的核層材料和帶有FITC的殼層材料所制備的微囊B2。結果示于圖6E中。圖6E顯示了用經標記的核層材料和殼層材料制備的微囊B2的共聚焦顯微圖像,其中,綠色熒光代表殼層,紅色熒光代表核層所包裹的細胞。實施例4.殼層含有氧化海藻酸鹽的微囊的制備本實施例提供了殼層含有氧化海藻酸鹽的微囊的示例性制備方法。微囊的制備方法應當在無菌條件下進行。此外,如果意欲將微囊應用于人體的話,那么其制備方法的生物安全等級應當達到GMP車間級別。本方法所使用的儀器為造粒儀(BUCHI,Encapsulator,B-395Pro),其配備的同心噴嘴的直徑如下:內層噴嘴,200μm;外層噴嘴,300μm。本方法所使用的材料如下:(1)用于制備核層的材料I型膠原:4mg/ml,使用無菌1MNaOH進行中和;(2)用于制備殼層的材料指定濃度的氧化海藻酸鈉溶液,或含有指定濃度的氧化海藻酸鈉和其他殼層材料的混合溶液;殼層固定液,即,0.1mol/LCaCl2溶液。(3)所使用的細胞:人臍靜脈內皮細胞(HUVEC)(購買自ATCC)、肝癌細胞(HepG2,購買自ATCC)、人成纖維細胞(購買自ATCC)、大 鼠間充質干細胞(MSC,原代)。制備微囊的操作步驟如下(以下實驗步驟均在冰上操作):(1)將120μlNaOH溶液與750μlI型膠原混合,然后向其中加入130μl細胞懸液(細胞濃度為1x105個/ml,懸浮于PBS中),從而獲得1ml細胞包裹液,用作核層材料。(2)配制50ml5wt%氧化海藻酸鈉溶液用作殼層材料。(3)配制300ml0.1MCaCl2溶液置于燒杯中,用于殼層材料的固定。(4)將如上制備的核層材料置于2ml注射器中,并且將50ml殼層材料置于造粒儀的包裹液瓶中,隨后,用所述核層材料和殼層材料進行造粒和包被。(5)將步驟(4)的產物收集于裝有300ml0.1mol/LCaCl2溶液的燒杯中,固定5min,制備獲得微囊。所制備的微囊可以在4℃下保存,或可直接用于3D生物打印。實施例5.殼層含有氧化海藻酸鹽的微囊的表征本實施例具體分析了通過實施例4方法制備的微囊的性能,包括微囊的尺寸,殼層的厚度和力學保護作用,所包含的細胞的數量等。使用顯微鏡來觀察通過實施例4方法制備的微囊。在制備過程中,使用了不同的造粒儀的儀器參數(例如,同心噴嘴的內噴嘴和外噴嘴的直徑),制備了不同尺寸的微囊。結果顯示,可通過控制造粒儀的儀器參數(例如,同心噴嘴的內噴嘴和外噴嘴的直徑)來控制微囊的尺寸。本發明的微囊的尺寸是可控的,可根據需要進行選擇。還使用顯微鏡進一步觀察了通過實施例4方法制備的微囊的殼層厚度。結果表明,可通過控制造粒儀的同心噴嘴的內噴嘴和外噴嘴的直徑,殼層材料的泵出速度等參數來控制殼層的厚度。本發明的微囊的殼層厚度是可控的,可根據需要進行選擇。還使用顯微鏡進一步觀察了通過實施例4方法制備的微囊所包含的細胞的數量。結果表明,可通過控制細胞懸液的細胞濃度來控制微 囊包裹的細胞數。本發明微囊包含的細胞的數量是可控的,可根據需要進行選擇。另外,還根據制造商的說明書,使用美國Hysitron(海思創)TI-950型納米壓痕儀,檢測了通過實施例4方法制備的微囊的力學性能。結果顯示,本發明微囊具有優良的力學保護性能,可有效避免微囊內的細胞遭受外界的力學損傷/機械損傷。此外,還已發現,可通過控制微囊的殼層厚度和殼層材料等參數來控制微囊的力學保護性(數據未顯示)。本發明微囊的力學保護性能是可控的,可根據需要進行選擇。實施例6.微囊殼層的降解速度的調控在本實施例中,對微囊的殼層降解速度進行了研究。本實施例所使用的微囊基本上按照實施例4描述的方法來制備,其中根據實驗設置,對所使用的造粒儀的儀器參數(例如,同心噴嘴的內噴嘴和外噴嘴的直徑)、細胞(類型和數量),核層材料,和殼層材料進行了調整。并且,在本實施例中,通過下述方法來檢測所制備的微囊的殼層降解速度:將微囊在37℃培養箱中進行培養,并在指定的時間點檢測微囊的質量,測定微囊的失重率。另外,還可繪制失重率-時間曲線,作為微囊殼層的降解曲線。首先,我們檢測了所使用的細胞的類型和數量,以及氧化海藻酸鈉的氧化度對微囊殼層的降解速度的影響。按照實施例4描述的方法來制備微囊,其中,所使用的細胞為HUVEC、HepG2和MSC;所使用的細胞密度為4×106/mL,6×106/mL,或12×106/mL;所使用的核層材料為包裹細胞的I型膠原;所使用的殼層材料為5wt%氧化海藻酸鈉,并且氧化海藻酸鈉的氧化度為2.5%、4.4%、8.8%、17.6%或22%。隨后,按照上文描述的方法,測定所制備的微囊的殼層降解速度。測定結果示于表1中。表1.上述結果表明,用于制備微囊的細胞的類型和數量以及氧化海藻酸鈉的氧化度均能夠影響微囊殼層的降解速度。具體而言,(1)細胞的生長和增殖速度越快,則微囊殼層的降解速度也越快。例如,HUVEC/HepG2細胞的生長和增殖速度快于MSC,因此,在同等條件下,包含HUVEC/HepG2的微囊的殼層降解速度快于包含MSC的微囊,如微囊4和9所顯示的。(2)細胞的數量越多,則微囊殼層的降解速度越快,例如,如微囊5和7所顯示的。(3)氧化海藻酸鈉的氧化度越高,則微囊殼層的降解速度越快,例如,如微囊4-6,或微囊9和11所顯示的。其次,我們檢測了微囊殼層中氧化海藻酸鈉的濃度對微囊殼層的降解速度的影響。按照實施例4描述的方法來制備微囊,其中,所使用的核層材料為包裹細胞的I型膠原;所使用的殼層材料為指定濃度(5%、6%、7%、8%、9%、或10%)的氧化海藻酸鈉,并且氧化海藻酸鈉的氧化度為8.8%。隨后,按照上文描述的方法,測定所制備的微囊的殼層降解速度。實驗結果見表2。表2實驗結果表明,微囊殼層中氧化海藻酸鈉的濃度能夠影響微囊殼層的降解速度。特別地,氧化海藻酸鈉的濃度越高,則微囊殼層的降解速度越慢。另外,我們還研究了微囊殼層中其他生物可降解材料(例如,海藻酸鈉)的存在對微囊殼層的降解速度的影響。特別地,我們使用不同比例的海藻酸鈉和氧化海藻酸鈉來制備微囊的殼層,并研究了海藻酸鈉和氧化海藻酸鈉的比例對微囊殼層的降解速度的影響。按照實施例4描述的方法來制備微囊,其中,所使用的核層材料為包裹細胞的I型膠原;所使用的殼層材料為指定比例的氧化海藻酸鈉(OSA)和海藻酸鈉(SA),并且氧化海藻酸鈉(OSA)和海藻酸鈉(SA)的總濃度為5%。隨后,按照上文描述的方法,測定所制備的微囊的殼層降解速度。實驗結果見表3。表3結果表明,微囊殼層中氧化海藻酸鈉含量的降低將導致微囊殼層的降解速度下降。特別地,氧化海藻酸鈉在殼層中所占的比例越高,則微囊殼層的降解速度越快;反之,氧化海藻酸鈉在殼層中所占的比例越低,則微囊殼層的降解速度越慢。此外,我們還檢測了所使用的細胞的類型對微囊殼層的降解速度的影響。按照實施例4描述的方法來制備微囊,其中,所使用的細胞為MSC、HUVEC、HepG2或成纖維細胞;并且,在制備微囊過程中,使用相同的細胞密度(例如6×106/mL),相同的核層材料(例如I型膠原),相同的殼層材料(例如,5wt%氧化海藻酸鈉,并且氧化海藻酸鈉的氧化度為8.8%),并且使用相同的造粒儀的儀器參數。隨后,按照上文描述的方法,測定所制備的包含不同類型的細胞的微囊的殼層降解速度。結果顯示,用于制備微囊的細胞的類型能夠影響微囊殼層的降解速度。具體而言,細胞的生長和增殖速度越快,則微囊殼層的降解速度也越快。例如,HUVEC/HepG2細胞的生長和增殖速度快于MSC,因此,在同等條件下,包含HUVEC/HepG2的微囊的殼層降解速度快于包含MSC的微囊。另外,我們還檢測了所使用的細胞的數量對微囊殼層的降解速度的影響。按照實施例4描述的方法來制備微囊,其中,所使用的細胞密度為4×106/mL,6×106/mL,8×106/mL,12×106/mL,16×106/mL,或24×106/mL;并且,在制備微囊過程中,使用相同的細胞(例如HepG2細胞),相同的核層材料(例如I型膠原),相同的殼層材料(例如,5wt% 氧化海藻酸鈉,并且氧化海藻酸鈉的氧化度為8.8%),并且使用相同的造粒儀的儀器參數。隨后,按照上文描述的方法,測定所制備的包含不同數量的細胞的微囊的殼層降解速度。結果顯示,用于制備微囊的細胞的數量能夠影響微囊殼層的降解速度。具體而言,細胞的數量越多,則微囊殼層的降解速度越快。反之,細胞的數量越少,則微囊殼層的降解速度越慢。此外,我們還檢測了所制備的微囊的殼層厚度對微囊殼層的降解速度的影響。按照實施例4描述的方法來制備微囊,其中,在制備微囊過程中,使用相同的細胞(例如HepG2細胞),相同的細胞密度(例如6×106/mL),相同的核層材料(例如I型膠原),相同的殼層材料(例如,5wt%氧化海藻酸鈉,并且氧化海藻酸鈉的氧化度為8.8%),但是通過調整造粒儀的儀器參數(例如,同心噴嘴的內噴嘴和外噴嘴的直徑),制備具有不同殼層厚度的微囊。隨后,按照上文描述的方法,測定所制備的具有不同殼層厚度的微囊的殼層降解速度。結果顯示,微囊的殼層厚度能夠影響微囊殼層完全降解所需的時間。具體而言,微囊的殼層越厚,則殼層完全降解所需的時間越長。實施例7.生物墨汁的制備和表征本實施例將根據實施例1中描述的方法制備的微囊與生物粘合劑均勻混合,制備成用于生物打印的生物墨汁。所使用的生物粘合劑為海藻酸鈉+明膠。在制備所述生物墨汁后,立即使用相差顯微鏡來進行觀察。為了便于觀察,在制備微囊時,在核層中添加了甲基紫染料。觀察結果示于圖7A中。圖7A顯示了使用本發明的微囊制備的生物墨汁的顯微照片。其中,微囊包含人臍靜脈內皮細胞(HUVEC),并且其殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原,且包含甲基紫染料; 生物粘合劑的主要成分是海藻酸鈉+明膠。另外,由于微囊和生物粘合劑的部分成分是一致的,因此,為了便于觀察,在微囊中添加了甲基紫染料。從而,在圖7A中,微囊顯示為紫色。如圖7A所示,紫色染色僅存在于微囊內部,而不存在于生物墨汁的載體(生物粘合劑)中。這表明微囊的殼層能夠在生物墨汁中保持微囊的完整性。進一步,將如上制備的生物墨汁打印為單細胞層(寬度約為250)μm,并使用顯微鏡來進行觀察。觀察結果示于圖7B中。圖7B顯示了用本發明的生物墨汁打印得到的單細胞層的顯微照片。其中,微囊包含人臍靜脈內皮細胞(HUVEC),并且其殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原,且包含甲基紫染料;生物粘合劑的主要成分是海藻酸鈉+明膠。在圖7B中,微囊因甲基紫染料的存在,而顯示為紫色。如圖7B所示,紫色染色僅存在于微囊內部,而不存在于生物墨汁的載體(生物粘合劑)中。這表明微囊的殼層能夠在生物打印過程中保持微囊的完整性。為了進一步表征生物墨汁,使用粘度測定儀,測量生物粘合劑的粘度隨溫度(25℃-40℃)的變化情況。結果示于圖8中。圖8顯示了所使用的生物粘合劑(海藻酸鈉+明膠)的粘度分析。結果顯示,在25℃-40℃下,所使用的生物粘合劑的粘度為30-160Pas;并且,隨著溫度升高,生物粘合劑的粘度有所下降。另外,還已發現,生物粘合劑與微囊混合后(即,生物墨汁)的粘度未發生顯著改變(數據未顯示)。生物墨汁的粘度主要取決于載體(例如生物粘合劑)的粘度。可通過控制生物粘合劑的組分的類型和含量來調整生物墨汁/生物粘合劑的粘度。通常,粘度在1-1000Pas范圍內的生物墨汁可與生物打印機相容。因此,本發明的生物墨汁在4-40℃的溫度下可用于本領域已知的生物打印系統。實施例8.微囊/生物墨汁的細胞相關的性能分析細胞的活力在本實驗中,通過染色法檢測了微囊內的細胞活性。所使用的試 劑如下:鈣黃綠素CaAM(公司:Invitrogen,貨號:C3100MP),其用于活細胞染色,能夠對細胞漿進行標記,顯示綠色熒光。使用方法:用10ulDMSO溶解50ug鈣黃綠素,然后添加10mlPBS并混勻。所獲得的溶液中鈣黃綠素的終濃度為5mmol/l。碘化丙啶核酸染料(公司:Invitrogen,貨號:P1304MP),其用于死細胞染色,能夠對細胞核進行標記,顯示紅色熒光。使用方法:用雙蒸水將碘化丙啶核酸染料稀釋至1mg/ml,用作儲存液;然后用PBS將儲存液以1:3000的比例稀釋至終濃度500nM,用作工作液。染色方法如下:將通過實施例1方法制備的微囊(包含HUVEC,100個細胞/微囊)置于1mlCaAM中,于37℃孵育1h;然后加入1ml碘化丙啶核酸染料,染色15min。之后,使用激光共聚焦顯微鏡觀察微囊的染色結果。結果示于圖9A-9D中。圖9A-9D顯示了使用共聚焦顯微鏡觀察通過實施例1方法制備的微囊中細胞活力的分析結果,其中,所述微囊用鈣黃綠素(綠色熒光)和碘化丙啶(紅色熒光)進行了雙重染色;所使用的細胞為人臍靜脈內皮細胞(HUVEC),殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原。圖9A顯示了在微囊制備之后立即進行的微囊中細胞活力的分析結果。在圖9A中,每個標記的白色圓圈代表一個微囊,并且,高亮點為紅色熒光(代表死細胞),低亮點為綠色熒光(代表活細胞)。使用imageproplus軟件,對紅色、綠色進行顏色聚類統計,并計算紅光斑和綠光斑的數量、面積、平均光密度、直徑、累計光密度,由此確定紅、綠像素點的個數,并計算細胞生存率。細胞生存率=活細胞數量/(活細胞數+死細胞數)。圖9A的結果顯示,在用實施例1的方法制備微囊后,微囊中98%以上的細胞存活。圖9B顯示了將制備的微囊在4℃下貯存3小時后,微囊中細胞活力的分析結果。在圖9B中,每個標記的白色圓圈代表一個微囊,并且, 高亮點為紅色熒光(代表死細胞),低亮點為綠色熒光(代表活細胞)。如圖9A,使用imageproplus軟件計算細胞生存率。圖9B的結果顯示,所制備的微囊在4℃下保存3小時后,微囊中的細胞仍然保持高活力(存活率為90%)。圖9C顯示了在將微囊制備成生物墨汁并進行生物打印后,立即進行的微囊中細胞活力的分析結果。在圖9C中,高亮點為紅色熒光(代表死細胞),低亮點為綠色熒光(代表活細胞)。如圖9A,使用imageproplus軟件計算細胞生存率。圖9C的結果顯示,將微囊制備成生物墨汁并立即進行生物打印后,微囊中的細胞仍然保持高活力(存活率為97%)。圖9D顯示了所制備的微囊在37℃下,在H-DMEM培養基中培養5天后,微囊中細胞活力的分析結果。在圖9D中,高亮點為紅色熒光(代表死細胞),低亮點為綠色熒光(代表活細胞)。如圖9A,使用imageproplus軟件計算細胞生存率。圖9D的結果顯示,所制備的微囊在37℃下培養5天后,微囊中的細胞仍然保持高活力(存活率為95%)。細胞的粘附和伸展將包含HepG2細胞的微囊在37℃,5%CO2,含10%FBS(胎牛血清)的H-DMEM培養基中培養5天,以允許細胞伸展,增殖,并建立微囊內的細胞之間的連接(即,粘附)。如上文所述的,使用鈣黃綠素(綠色熒光)和碘化丙啶(紅色熒光)對微囊進行雙重染色,并使用激光共聚焦顯微鏡進行觀察。觀察結果示于圖10A-10B中。圖10A-10B顯示了使用共聚焦顯微鏡觀察通過實施例1方法制備的微囊中細胞的粘附和伸展的分析結果,其中,所述微囊用鈣黃綠素(綠色熒光)和碘化丙啶(紅色熒光)進行了雙重染色;所使用的細胞為HepG2細胞,殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原。圖10A顯示了在培養微囊第1天,使用共聚焦顯微鏡觀察到的照片(放大倍數:40倍),其中細胞呈圓形,未粘附伸展。圖10B顯示了 培養所述微囊5天后,使用共聚焦顯微鏡觀察到的照片(放大倍數:200倍),其中細胞粘附伸展。圖10A-10B的結果表明,在培養5天后,微囊內的細胞伸展并建立細胞間連接。細胞的增殖將包含HepG2細胞的微囊(100個細胞/微囊)在37℃,5%CO2,含10%FBS(胎牛血清)的H-DMEM培養基中培養5天,以允許細胞增殖。隨后,使用DAPI(藍色熒光)和EdU(紅色熒光)對細胞進行雙重染色,并使用激光共聚焦顯微鏡進行觀察。觀察結果示于圖11中。圖11顯示了使用共聚焦顯微鏡觀察微囊中的細胞增殖的分析結果(放大倍數:200倍),其中,所述微囊用DAPI(藍色熒光)和EdU(紅色熒光)進行了雙重染色;所使用的細胞為HepG2細胞,殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原。圖11的結果表明,在培養5天后,微囊內的細胞處于增殖狀態。微囊與細胞微球的比較在本實驗中,將本發明微囊中的細胞增殖/連接情況與通過傳統方法制備的細胞微球中的細胞增殖/連接情況進行了比較。通過下述傳統方法來制備細胞微球:使用造粒儀,用海藻酸鈉直接包裹細胞,以形成細胞液滴;隨后,將細胞液滴置于CaCl2溶液中,以使海藻酸鈉在鈣離子的作用下形成海藻酸鈣,從而將細胞液滴交聯固化成細胞微球。另外,通過實施例1的方法來制備微囊,其中,所使用的細胞為HepG2細胞,殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原。將如上制備的細胞微球和微囊于37℃、5%CO2環境下培養7天。并且,在培養之前和培養7天后,用鈣黃綠素(綠色熒光)對細胞微球和微囊進行染色。染色結果示于圖12A-12E中。圖12A-12B顯示了通過傳統方法制備的細胞微球在培養過程中的 細胞增殖情況(標尺為500μm)。結果顯示,與培養之前(圖12A)相比,培養7天后(圖12B)的細胞微球中的細胞增殖不明顯,細胞呈圓形,散在分布,細胞之間未建立連接。圖12C-12D顯示了使用實施例1方法制備的微囊在培養過程中的細胞增殖情況(標尺為500μm)。結果顯示,與培養之前(圖12C)相比,培養7天后(圖12D)的微囊中的細胞增殖明顯,細胞在微囊中伸展、粘附,并相互連接在一起。圖12E顯示了使用實施例1方法制備的微囊在培養7天后的顯微照片(標尺為100μm)。結果顯示,微囊中的HepG2細胞之間相互連接,形成有機的整體。圖12A-12E的結果表明,與傳統方法制備的細胞微球相比,本發明的微囊能夠更好地促進細胞的增殖,促進細胞之間建立連接。這對于后續的組織形成具有重要意義。細胞間連接的建立-1在本實驗中,使用共聚焦顯微鏡觀察微囊內部的細胞間連接的建立。通過實施例1的方法來制備微囊,其中,所使用的細胞為HepG2,其用celltrackerGreenCMFDA(綠色熒光)進行標記,以及人HUVEC細胞,其用trackerCM-Dil(紅色熒光)進行標記;殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原。將所制備的微囊于37℃、5%CO2環境下培養7天,隨后用共聚焦顯微鏡進行觀察。觀察結果示于圖13中。圖13顯示了使用共聚焦顯微鏡觀察培養7天后的微囊的結果(圖中標尺為100μm),其中,所使用的微囊同時包含用綠色熒光標記的HepG2細胞和用紅色熒光標記的HUVEC細胞,并且圖中的黃色區域是由紅色熒光和綠色熒光疊加所致,這表明HepG2細胞和HUVEC細胞之間建立了連接。結果顯示,微囊內部的HepG2細胞之間、HUVEC細胞之間以及HepG2細胞與HUVEC細胞之間均建立了細胞間連接。細胞間連接的建立-2本實驗中,使用共聚焦顯微鏡觀察微囊之間的細胞連接的建立情況。通過實施例1方法來制備微囊,其中,殼層的主要成分是海藻酸鈣,核層的主要成分是海藻酸鈉+I型膠原。微囊于37℃、5%CO2環境下培養7天后,用共聚焦顯微鏡進行觀察。結果如圖14A-14C所示。圖14A顯示了使用共聚焦顯微鏡觀察培養7天后的微囊的結果(圖中標尺為100μm),其中,所使用的微囊包含分別用celltrackerGreenCMFDA(綠色熒光)標記的HepG2細胞和HUVEC細胞。結果顯示,兩個微囊的細胞之間建立了細胞連接,如方框中的橋狀結構所顯示的。圖14B顯示了使用共聚焦顯微鏡觀察培養7天后的微囊的結果(圖中標尺為500μm),其中,使用了兩種微囊:一種微囊包含用celltrackerGreenCMFDA(綠色熒光)標記的HepG2細胞,且另一種微囊包含用trackerCM-Dil(紅色熒光)標記的HUVEC細胞;并且,圖中的黃色區域是由紅色熒光和綠色熒光疊加所致。結果顯示,表達紅色熒光的微囊與表達綠色熒光的微囊之間建立了細胞連接,如圖中的黃色區域所顯示的。圖14C顯示了使用共聚焦顯微鏡觀察培養7天后的微囊的結果(圖中標尺為500μm),其中,所使用的微囊包含用celltrackerGreenCMFDA(綠色熒光)標記的HepG2細胞和HUVEC細胞;并且,圖中的各個白色圓環分別表示一個微囊。結果顯示,不同微囊的細胞之間建立了細胞連接,并形成有機的整體。本實施例的結果顯示,細胞在本發明的微囊內具有高活力(存活率為98%以上),并且能夠在微囊內正常生長,增殖,伸展和分化。此外,本實施例的結果還顯示,微囊內部的細胞之間以及不同微囊的細胞之間能夠建立細胞間連接。這表明,本發明的微囊以及其制備方法能夠有效保持細胞的活力,并且能夠促進細胞在微囊內增殖,促進細胞之間建立連接,從而可有利地用于下游的各種應用,例如生物打印。實施例9.包含MSC細胞的微囊的制備及應用使用與實施例1類似的方法,利用造粒儀,制備了包裹MSC細胞的微囊,其中,所使用的細胞為來自原代培養的大鼠的MSC細胞(其用celltrackerdil標記紅色熒光),核層材料為I型膠原,殼層材料為聚賴氨酸。將包含MSC細胞的微囊在37℃,5%CO2的環境下進行培養,以允許細胞伸展,增殖,并建立細胞之間的連接。使用顯微鏡來觀察培養之前、培養7天后以及培養9天后的包含MSC細胞的微囊,結果示于圖15中。圖15顯示了包含MSC細胞的微囊的顯微照片,其中,圖15A顯示了培養第2天的包含MSC細胞的單個微囊(標尺為100μm);圖15B顯示了培養7天后的包含MSC細胞的微囊(標尺為500μm);圖15C顯示了培養9天后的包含MSC細胞的微囊(標尺為500μm)。結果顯示,培養7天后,多個包含MSC細胞的微囊相互融合(如圖15B中的白色箭頭所指示的);并且,培養9天后,包含MSC細胞的微囊完全融合,形成有機整體(如圖15C所顯示的)。實施例10.包含MSC細胞和誘導因子的微囊的制備本實施例提供了制備包含MSC細胞和誘導因子的第一微囊和第二微囊的示例性方法。微囊的制備方法應當在無菌條件下進行。此外,如果意欲將微囊應用于人體的話,那么其制備方法的生物安全等級應當達到GMP車間級別。本方法所使用的儀器為造粒儀(BUCHI,Encapsulator,B-395Pro),其配備的同心噴嘴的直徑如下:內層噴嘴,200μm;外層噴嘴,300μm。本方法所使用的材料如下:(1)用于制備核層的材料海藻酸鈉:使用去離子水溶解稀釋;I型膠原:4mg/ml,使用無菌1MNaOH進行中和;在I型膠原中添加下述因子:(1)誘導MSC向成骨細胞或骨分化的誘導因子:0.1μM地塞米松、0.05mM抗壞血酸、以及10mM甘油磷酸;用于制備第一微囊。或者(2)誘導MSC向成軟骨細胞或軟骨分化的誘導因子:10ng/mlTGF-β3、100nM地塞米松、50μg/ml的2-磷酸抗壞血酸、100μg/ml丙酮酸鈉、40μg/ml脯氨酸以及胰島素-轉鐵蛋白-硒溶液(ITS+,CollaborativeBiomedical,Bedford,MA,USA);用于制備第二微囊。將I型膠原與2%(w/v)海藻酸鈉以1:1的比例(按重量計)混合,用于制備核層。(2)用于制備殼層的材料4%海藻酸鈉;彈性蛋白;殼層固定液,即,0.1mol/LCaCl2溶液。(3)所使用的細胞:MSC細胞(購買自ATCC)。制備微囊的操作步驟如下(以下實驗步驟均在冰上操作):將120μlNaOH溶液與750μlI型膠原混合,然后向其中加入130μlMSC細胞懸液(細胞濃度為1x105個/ml,懸浮于PBS中),從而獲得1ml細胞包裹液。然后,將細胞包裹液與1ml2%海藻酸鈉混合,使細胞均勻分散,從而獲得包裹細胞的核層材料。向2ml4%海藻酸鈉溶液中加入100ng彈性蛋白(elastin,其終濃度為50ng/ml),充分混勻,該混合物用作殼層材料,用于制備微囊的殼層。此外,取300ml0.1mol/LCaCl2溶液置于燒杯中,用于殼層材料的固定。將如上制備的核層材料和殼層材料分別置于2支5ml注射器中。按照制造商的說明書,設置造粒儀的壓力、離散力、泵的速度等參數,然后使用所述核層材料和殼層材料進行造粒和包被。造粒儀的內噴嘴 的直徑設置為200μm,外噴嘴的直徑設置為300μm。將獲得的微囊微粒收集于裝有300ml0.1mol/LCaCl2溶液的燒杯中,固定5min,制備獲得第一微囊和第二微囊。所制備的微囊可以在4℃下保存,或可直接用于3D生物打印。實施例11.包含MSC細胞和誘導因子的微囊的表征本實施例具體分析了通過實施例10方法制備的微囊的性能,包括微囊的尺寸,殼層的厚度和力學保護作用,所包含的細胞的數量等。使用顯微鏡來觀察通過實施例10方法制備的第一微囊,結果示于圖16A-16B中。圖16A顯示了通過實施例10方法制備的第一微囊在37℃,5%CO2下培養1天后的顯微照片。結果顯示,細胞正常生長,但未出現分化。圖16B顯示了通過實施例1方法制備的第一微囊在37℃,5%CO2下培養10天后經茜素紅染色的顯微照片,其中,粗箭頭所指處為一個完整的微囊,細箭頭所指處為鈣結節。結果顯示,微囊內出現大量鈣結節,如細箭頭所指示的。這表明,第一微囊中的MSC細胞向成骨細胞分化。此外,還如實施例2中所描述的,使用不同的造粒儀的儀器參數(例如,同心噴嘴的內噴嘴和外噴嘴的直徑),制備了不同尺寸的微囊。結果顯示,可通過控制造粒儀的儀器參數(例如,同心噴嘴的內噴嘴和外噴嘴的直徑)來控制包含MSC細胞和誘導因子的微囊的尺寸。本發明的微囊的尺寸是可控的,可根據需要進行選擇。另外,還如實施例2中所描述的,使用顯微鏡進一步觀察了通過實施例10方法制備的微囊的殼層厚度。結果表明,可通過控制造粒儀的同心噴嘴的內噴嘴和外噴嘴的直徑,殼層材料的泵出速度等參數來控制殼層的厚度。本發明的包含MSC細胞和誘導因子的微囊的殼層厚度是可控的,可根據需要進行選擇。還如實施例2中所描述的,使用顯微鏡進一步觀察了通過實施例10方法制備的微囊所包含的MSC細胞的數量。結果表明,可通過控制細胞懸液的細胞濃度來控制微囊包裹的細胞數。本發明微囊包含的 MSC細胞的數量是可控的,可根據需要進行選擇。另外,還根據制造商的說明書,使用美國Hysitron(海思創)TI-950型納米壓痕儀,檢測了通過實施例10方法制備的微囊的力學性能。結果顯示,本發明的包含MSC細胞和誘導因子的微囊具有優良的力學保護性能,可有效避免微囊內的細胞遭受外界的力學損傷/機械損傷。此外,還已發現,可通過控制微囊的殼層厚度和殼層材料等參數來控制微囊的力學保護性(數據未顯示)。本發明微囊的力學保護性能是可控的,可根據需要進行選擇。實施例12.用于生物打印的組合物的制備和表征本實施例將根據實施例10中描述的方法制備的微囊與生物粘合劑均勻混合,制備成用于生物打印的組合物。所使用的生物粘合劑為海藻酸鈉+明膠。在制備所述組合物后,立即使用相差顯微鏡來進行觀察。結果顯示,微囊的殼層能夠在組合物中保持微囊的完整性。進一步,將如上制備的組合物打印為單細胞層(寬度約為250)μm,并使用顯微鏡來進行觀察。結果顯示,本發明的微囊的殼層能夠在生物打印過程中保持微囊的完整性。為了進一步表征用于生物打印的組合物,使用粘度測定儀,測量生物粘合劑的粘度隨溫度(25℃-40℃)的變化情況。結果顯示,隨著溫度升高,生物粘合劑的粘度有所下降。另外,還已發現,生物粘合劑與微囊混合后的粘度未發生顯著改變(數據未顯示)。用于生物打印的組合物的粘度主要取決于載體(例如生物粘合劑)的粘度。可通過控制生物粘合劑的組分的類型和含量來調整組合物/生物粘合劑的粘度。通常,粘度在1-1000Pas范圍內的組合物可與生物打印機相容。因此,本發明的組合物在4-40℃的溫度下可用于本領域已知的生物打印系統。實施例13.包含MSC細胞和誘導因子的微囊/組合物的細胞相關 的性能分析細胞的活力在本實驗中,通過染色法檢測了微囊內的細胞活性。所使用的試劑如下:鈣黃綠素CaAM(公司:Invitrogen,貨號:C3100MP),其用于活細胞染色,能夠對細胞漿進行標記,顯示綠色熒光。使用方法:用10ulDMSO溶解50ug鈣黃綠素,然后添加10mlPBS并混勻。所獲得的溶液中鈣黃綠素的終濃度為5mmol/l。碘化丙啶核酸染料(公司:Invitrogen,貨號:P1304MP),其用于死細胞染色,能夠對細胞核進行標記,顯示紅色熒光。使用方法:用雙蒸水將碘化丙啶核酸染料稀釋至1mg/ml,用作儲存液;然后用PBS將儲存液以1:3000的比例稀釋至終濃度500nM,用作工作液。染色方法如下:將通過實施例10方法制備的微囊(包含HUVEC,100個細胞/微囊)置于1mlCaAM中,于37℃孵育1h;然后加入1ml碘化丙啶核酸染料,染色15min。之后,使用激光共聚焦顯微鏡觀察微囊的染色結果。結果顯示,在用實施例10的方法制備微囊后,微囊中98%以上的細胞存活;并且,所制備的微囊在4℃下保存3小時后,微囊中的細胞仍然保持高活力(存活率為98%)。此外,結果還顯示,將微囊制備成組合物并立即進行生物打印后,微囊中的細胞仍然保持高活力(存活率為97%);并且,所制備的微囊在37℃下培養5天后,微囊中的細胞仍然保持高活力(存活率為95%)。細胞的粘附和伸展使用共聚焦顯微鏡觀察通過實施例10方法制備的微囊中MSC細胞的粘附和伸展。結果顯示,在培養5天后,微囊內的MSC細胞伸展并建立細胞間連接。細胞的增殖使用共聚焦顯微鏡觀察微囊中的MSC細胞增殖結果表明,在培養5天后,微囊內的MSC細胞處于增殖狀態。本實施例的結果顯示,MSC細胞在本發明的微囊內具有高活力(存活率為98%以上),并且能夠在微囊內正常生長,增殖,伸展和分化。這表明,本發明的包含MSC細胞和誘導因子的微囊以及其制備方法能夠有效保持細胞的活力,從而可有利地用于下游的各種應用,例如生物打印。實施例14.包含骨和軟骨的三維構建體的生物打印本實施例示例性地使用包含根據實施例10描述的方法制備的微囊的組合物,通過生物打印方法,構建了包含骨和軟骨的復合結構。簡言之,該方法包含下述步驟:(1)采集大鼠關節(例如膝關節)的生物學信息,并構建關節結構數字模型。(2)使用實施例10中描述的方法,構建第一微囊和第二微囊。(3)將生物粘合劑分別與前一步驟獲得的2種微囊混合,制備獲得2種組合物。所使用的生物粘合劑為海藻酸鈉+明膠;生物粘合劑與微囊的用量比為1:4(按重量計)。應當注意的是,步驟(1)可以在步驟(2)和(3)之前,與之同時,或之后進行。(4)使用3D生物打印機,以旋轉打印方式進行打印。打印過程中,以關節結構數字模型為模板,使用對應的組合物進行生物打印。微囊通過生物粘合劑而固化,形成關節前體。(5)將關節前體置于三維培養箱中,在37℃,5%CO2的條件下使用常規細胞培養基(H-DMEM培養基+10%胎牛血清)對關節前體進行培養。培養過程中,可對關節前體施加物理刺激,例如剪切力。連續培養7-10天,使關節前體形成關節組織。實施例15.包含內皮細胞或平滑肌細胞的微囊的制備方法(1)制備含內皮細胞和MSC細胞的微囊使用MSCs和內皮細胞以10:1的比例共混(細胞濃度:4x106/ml),作為微囊的種子細胞,使用聚賴氨酸制備微囊的殼層,I型膠原制備微囊的核層,按照實施例1的過程制成第一微囊。(2)制備含平滑肌細胞和MSC細胞的微囊使用MSCs和平滑肌細胞以3:1的比例共混(細胞濃度:4.6x106/ml),作為微囊的種子細胞,使用聚賴氨酸制備微囊的殼層,I型膠原制備微囊的核層,按照實施例1的過程制成第二微囊。實施例16.包含內皮細胞和平滑肌細胞的復合結構的制備如圖17所示,將實施例15制備的第一微囊規則排列在組織前體的外層,將實施例15制備的第二微囊規則排列在組織前體的內部,形成組織前體。將組織前體置于37℃、5%CO2、含10%胎牛血清的H-DMEM環境下培養7天,形成直徑約3mm大小的組織塊。隨后,對獲得的組織塊進行HE染色和免疫組化染色;其中,針對CD31的免疫組化染色用于指示內皮細胞,且針對α-SMA的免疫組化染色用于指示平滑肌細胞。染色結果示于圖18。圖18的染色結果顯示:(1)經過培養后,第一微囊內的MSC干細胞分化為內皮細胞,且,第二微囊內的MSC干細胞分化為平滑肌細胞;(2)第一微囊和第二微囊內的細胞按照設計好的結構規則排列:含有內皮細胞的組織位于組織塊的外層,含有平滑肌細胞的組織位于組織塊的內部;并且,(3)兩種微囊融合成有機的整體(即,復合結構)。這些實驗結果表明,所制備的微囊可以用于制備含有內皮細胞和平滑肌細胞的復合結構。實施例17.三維構建體的生物打印本實施例示例性地使用包含根據實施例1描述的方法制備的微囊 的生物墨汁,通過生物打印方法,構建了三維構建體(例如血管)。圖19示意性地描述了使用本發明的微囊/生物墨汁來生物打印血管的流程圖。具體而言,該方法包含下述步驟:(1)用DIO(綠色)、Mitochacker(紅色)和hoechst(藍色)對血管的內皮細胞、平滑肌細胞和成纖維細胞進行染色,然后采集大鼠血管的生物學信息,并構建血管結構數字模型。根據該模型,血管分為三層結構,即,位于最內層的血管內皮細胞,位于中間層的血管平滑肌細胞,以及位于最外層的成纖維細胞。(2)使用實施例1中描述的方法,構建包含血管內皮細胞的微囊、包含血管平滑肌細胞的微囊、以及包含成纖維細胞的微囊。其中,所使用的血管內皮細胞、血管平滑肌細胞和成纖維細胞分別為來源于大鼠的原代培養的細胞;所使用的核層材料和殼層材料如實施例1所述。另外,為了促進細胞增殖和分化,在包含血管內皮細胞的微囊核層中添加血管內皮生長因子(VEGF);在包含血管平滑肌細胞的微囊核層中添加血小板源生長因子(PDGF);在包含成纖維細胞的微囊核層中添加成纖維細胞生長因子(FGF)。所制備的包含血管內皮細胞的微囊大小為約30μm,內含2-3個血管內皮細胞;包含血管平滑肌細胞的微囊大小為約200μm,內含50個左右的血管平滑肌細胞;包含成纖維細胞的微囊大小為約100μm,內含10個左右的成纖維細胞。(3)將生物粘合劑分別與前一步驟獲得的3種微囊混合,制備獲得三種生物墨汁。所使用的生物粘合劑為海藻酸鈉+明膠;生物粘合劑與微囊的用量比為1:4(按重量計)。應當注意的是,步驟(1)可以在步驟(2)和(3)之前,與之同時,或之后進行。(4)使用3D生物打印機,以旋轉打印方式進行打印。打印過程中,以血管結構數字模型為模板,使用對應的生物墨汁進行生物打印,其中,如圖2A-B所示,血管的最內層結構使用包含含有血管內皮細胞的微囊的生物墨汁進行打印,中間層結構使用包含含有血管平滑肌細胞 的微囊的生物墨汁進行打印,最外層結構使用包含含有成纖維細胞的微囊的生物墨汁進行打印。微囊通過生物粘合劑而固化,形成血管前體。(5)將血管前體置于三維培養箱中,在37℃,5%CO2的條件下使用常規細胞培養基(H-DMEM培養基+10%胎牛血清)對血管前體進行培養。培養過程中,可對血管前體施加物理刺激,例如剪切力。連續培養7-10天,使血管前體形成血管。實施例18:微囊的各種應用干細胞分化的研究使用實施例10中描述的方法,構建第一微囊和/或第二微囊。任選地,向第一微囊和/或第二微囊中添加額外的試劑或試劑組合,以促進或抑制MSC細胞朝向成骨細胞,脂肪細胞,軟骨細胞或肌細胞分化。在相同的培養系統,例如在相同的容器(例如培養皿或培養瓶)中培養所述微囊。觀察各個分離的微囊中的細胞,分析細胞中的干細胞標志物的表達情況,并評估不同的微環境對MSC干細胞分化的影響。組織再生本實施例提供了示例性的組織再生方法,其用于修復關節中的損傷。首先,使用醫學成像方法來掃描關節中的損傷,以獲得關節以及損傷部位的結構信息。其次,基于醫學成像數據,根據損傷部位的結構信息和關節組織的細胞分布信息,構建數字修復模型。進一步,基于數字修復模型,制備相應類型的微囊,包括本發明的第一微囊,本發明的第二微囊。隨后,根據數字修復模型,將這些微囊用于直接在損傷部位上進行生物打印。在某些情況下,微囊中的細胞來源于獲自相同受試者的自體干細胞。在生物打印后,微囊中的細胞在損傷部位的不同層和微環境中增 殖和分化,形成了相應的組織層和結構,從而修復了關節中的損傷。實施例19:構建體的各種應用使用構建體來體外研究組織發育制備本發明的第一微囊和/或第二微囊。根據目的組織(例如骨組織,軟骨組織,關節組織)的細胞分布模式,使用所制備的微囊進行生物打印,獲得相應的構建體(即,組織前體)。在合適的條件下,體外培養所獲得的組織前體,以使其發育為目的組織。將微囊中的細胞暴露于可能影響組織發育的候選試劑或試劑組合。然后,觀察整個發育過程中,微囊中的細胞的變化以及組織發育過程的變化。移植物免疫學的體內研究制備包含來源于即將接受組織移植的受試者(實驗動物)的MSC細胞的第一微囊和/或第二微囊。使用所制備的微囊進行生物打印,以獲得組織前體或人工組織(例如骨組織,軟骨組織,關節組織)。隨后,將組織前體或人工組織植入受試者中,并觀察受試者對組織前體或人工組織的免疫學應答,包括生物相容性和免疫排斥。藥物篩選使用實施例10中描述的方法來制備關節組織。所使用的微囊中的細胞來源于即將接受藥物的受試者。將所制備的關節組織暴露于各種藥物(每一種藥物設置多個不同的劑量),然后評估各個劑量下,各種藥物對關節組織的功效和影響。隨后,根據評估結果,將具有最高功效和/或最低副作用的藥物及其劑量施用給受試者,以治療影響關節組織的疾病。藥物發現制備本發明的第一微囊和/或第二微囊,并將其打印為與藥物功能相關的人工組織(例如骨組織,軟骨組織,關節組織)。根據制備過程 中所使用的條件,例如微囊中的細胞的來源,微囊的核層中包含的試劑或刺激,或培養條件,此類人工組織可以為健康組織或患病組織。將所獲得的人工組織暴露于一組化合物,并任選地,將各種化合物對患病的人工組織的作用與相同化合物對相應健康的人工組織的作用進行比較,從而確定各種化合物對與該組織相關的疾病的治療效果。還基于化合物對健康的人工組織的影響來確定各種化合物的毒性和副作用。隨后,將具有最佳治療效果和/或最低毒性和副作用的化合物,或者在治療效果與副作用之間取得最佳平衡的化合物確定為前導化合物,用于進一步的藥物研發。盡管本發明的具體實施方式已經得到詳細的描述,但本領域技術人員將理解:根據已經公開的所有教導,可以對細節進行各種修改和變動,并且這些改變均在本發明的保護范圍之內。本發明的全部范圍由所附權利要求及其任何等同物給出。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1