硼中子捕獲治療系統的制作方法
本發明涉及一種放射性射線照射治療系統,尤其是一種硼中子捕獲治療系統。
背景技術:
隨著原子科學的發展,例如鈷六十、直線加速器、電子射束等放射線治療已成為癌癥治療的主要手段之一。然而傳統光子或電子治療受到放射線本身物理條件的限制,在殺死腫瘤細胞的同時,也會對射束途徑上大量的正常組織造成傷害;另外由于腫瘤細胞對放射線敏感程度的不同,傳統放射治療對于較具抗輻射性的惡性腫瘤(如:多行性膠質母細胞瘤(glioblastomamultiforme)、黑色素細胞瘤(melanoma))的治療成效往往不佳。
為了減少腫瘤周邊正常組織的輻射傷害,化學治療(chemotherapy)中的標靶治療概念便被應用于放射線治療中;而針對高抗輻射性的腫瘤細胞,目前也積極發展具有高相對生物效應(relativebiologicaleffectiveness,rbe)的輻射源,如質子治療、重粒子治療、中子捕獲治療等。其中,中子捕獲治療便是結合上述兩種概念,如硼中子捕獲治療,借由含硼藥物在腫瘤細胞的特異性集聚,配合精準的中子射束調控,提供比傳統放射線更好的癌癥治療選擇。
硼中子捕獲治療(boronneutroncapturetherapy,bnct)是利用含硼(10b)藥物對熱中子具有高捕獲截面的特性,借由10b(n,α)7li中子捕獲及核分裂反應產生4he和7li兩個重荷電粒子。參照如下的10b(n,α)7li中子捕獲核反應方程式。
兩荷電粒子的平均能量約為2.33mev,具有高線性轉移(linearenergytransfer,let)、短射程特征,α粒子的線性能量轉移與射程分別為150kev/μm、8μm,而7li重荷粒子則為175kev/μm、5μm,兩粒子的總射程約相當于一個細胞大小,因此對于生物體造成的輻射傷害能局限在細胞層級,當含硼藥物選擇性地聚集在腫瘤細胞中,搭配適當的中子射源,便能在不對正常組織造成太大傷害的前提下,達到局部殺死腫瘤細胞的目的。
因硼中子捕獲治療的成效取決于腫瘤細胞位置含硼藥物濃度和熱中子數量,故又被稱為 二元放射線癌癥治療(binarycancertherapy);由此可知,含硼藥物的開發及中子射源通量與品質的改善在硼中子捕獲治療的研究中均占有重要角色。
技術實現要素:
為了實現改善現有的硼中子捕獲治療系統,本發明的一方面提供了一種硼中子捕獲治療系統,其包括:硼中子捕獲治療裝置以及類α-氨基酸三氟化硼化物。
所述類α-氨基酸三氟化硼化物具有如式(ⅰ)所示的結構:
其中:r為氫、甲基、異丙基、1-甲基丙基、2-甲基丙基、羥甲基、1-羥基乙基、苯甲基或羥基苯甲基;m為h或金屬原子。
所述硼中子捕獲治療裝置產生的中子束作用到所述類α-氨基酸三氟化硼化物后產生的能量破壞腫瘤細胞dna。
bnct是一種理想的腫瘤治療方法,其為許多用傳統方法無法治療的腫瘤提供了一種新的治療方法。
本發明所述的腫瘤為惡性腫瘤或轉移性腫瘤進程,優選腦膠質瘤、復發性頭頸部腫瘤、惡性黑色素瘤、乳腺癌或轉移性肝癌瘤。惡性腫瘤就是人們常說的癌癥,它是100多種相關疾病的統稱。當身體內細胞發生突變后,它會不斷地分裂,不受身體控制,最后形成癌癥。惡性腫瘤的細胞能侵犯、破壞鄰近的組織和器官,而且該細胞可從腫瘤中穿出,進入血液或淋巴系統,這就是惡性腫瘤如何從原發的部位到其它器官形成新的腫瘤,這個過程就叫惡性腫瘤的轉移。
本發明所述的腫瘤進一步為腦腫瘤或黑色素瘤。腦腫瘤是指生長于顱內的腫瘤,包括由腦實質發生的原發性腦瘤和由身體其他部位轉移至顱內的繼發性腦瘤。黑色素瘤又稱為惡性黑色素瘤,是一種能產生黑色素的高度惡性腫瘤,多發生于皮膚或接近皮膚的黏膜,也見于軟腦膜和脈絡膜。
本發明所述的腦瘤更進一步為腦膠質瘤。源于神經上皮的腫瘤稱為腦膠質瘤,占顱腦腫瘤的40-50%,是常見的顱內惡性腫瘤。
所述類α-氨基酸三氟化硼化物在該硼中子捕獲治療系統中的應用中占有重要作用,將在下文中詳述。
優選地,所述類α-氨基酸三氟化硼化物中的m為鉀或鈉。
優選地,所述類α-氨基酸三氟化硼化物中的b為10b。
為了進一步提高含硼藥物中10b含量,所述類α-氨基酸三氟化硼化物中10b的純度≥95%。
所述類α-氨基酸三氟化硼化物中的至少一個f為18f,這樣設置,在放射治療體積內的腫瘤和所有組織中以及周圍的硼濃度和分布可以在照射前和照射期間非侵入地準確而快速地測定。該診斷信息使得通過降低超熱中子在已知含有高水平硼的組織區域暴露,可以更快、更準確和更安全地進行硼中子捕獲治療。
進一步地,硼中子捕獲治療裝置包括中子產生部和射束整形體,所述射束整形體用于將由中子產生部產生的中子束能譜調整到超熱中子能區。
在改善中子射源通量與品質,射束整形體也占有重要作用。所述射束整形體包括鄰接于所述中子產生部的緩速體、包圍在所述緩速體外的反射體、與所述緩速體鄰接的熱中子吸收體、設置在所述射束整形體內的輻射屏蔽和射束出口,所述中子產生部與入射的質子束發生核反應以產生中子,所述緩速體將自所述中子產生部產生的中子減速至超熱中子能區,所述反射體將偏離的中子導回以提高超熱中子射束強度,所述熱中子吸收體用于吸收熱中子以避免治療時與淺層正常組織造成過多劑量,所述輻射屏蔽用于屏蔽滲漏的中子和光子以減少非照射區的正常組織劑量。
所述硼中子捕獲治療裝置進一步包括設置在射束出口處用于匯聚所述超熱中子的準直器。
附圖說明
圖1是基于加速器型的硼中子捕獲治療系統的平面示意圖。
圖2是基于反應堆型的硼中子捕獲治療系統的平面示意圖。
具體實施方式
下面結合具體實施例及附圖對本發明做進一步的詳細說明,以令本領域技術人員參照說明書文字能夠據以實施。所述實施例的目的僅用于說明和描述本發明當前的最佳模式。本發明的保護范圍不以任何方式受此處所述實施例的限制。
應當理解,本文所使用的諸如“具有”、“包含”以及“包括”術語并不排除一個或多個其它成分或其組合的存在或添加。
本文所述的快中子為能區大于40kev的中子,超熱中子能區在0.5ev到40kev之間,熱中子能區小于0.5ev。
中子捕獲治療作為一種有效的治療癌癥的手段近年來的應用逐漸增加,其中以硼中子捕獲治療最為常見,供應硼中子捕獲治療的中子可以由核反應堆或加速器供應。本發明的實施 例以加速器硼中子捕獲治療為例,加速器硼中子捕獲治療的基本組件通常包括用于對帶電粒子(如質子、氘核等)進行加速的加速器、靶材與熱移除系統和射束整形體,其中加速帶電粒子與金屬靶材作用產生中子,依據所需的中子產率與能量、可提供的加速帶電粒子能量與電流大小、金屬靶材的物化性等特性來挑選合適的核反應,常被討論的核反應有7li(p,n)7be及9be(p,n)9b,這兩種反應皆為吸熱反應。兩種核反應的能量閥值分別為1.881mev和2.055mev,由于硼中子捕獲治療的理想中子源為kev能量等級的超熱中子,理論上若使用能量僅稍高于閥值的質子轟擊金屬鋰靶材,可產生相對低能的中子,不須太多的緩速處理便可用于臨床,然而鋰金屬(li)和鈹金屬(be)兩種靶材與閥值能量的質子作用截面不高,為產生足夠大的中子通量,通常選用較高能量的質子來引發核反應。
理想的靶材應具備高中子產率、產生的中子能量分布接近超熱中子能區(將在下文詳細描述)、無太多強穿輻射產生、安全便宜易于操作且耐高溫等特性,但實際上并無法找到符合所有要求的核反應,本發明的實施例中采用鋰金屬制成的靶材。但是本領域技術人員熟知的,靶材的材料也可以由其他除了上述談論到的金屬材料之外的金屬材料制成。
針對熱移除系統的要求則根據選擇的核反應而異,如7li(p,n)7be因金屬靶材(鋰金屬)的熔點及熱導系數差,對熱移除系統的要求便較9be(p,n)9b高。本發明的實施例中采用7li(p,n)7be的核反應。
無論硼中子捕獲治療的中子源來自核反應堆或加速器帶電粒子與靶材的核反應,產生的皆為混合輻射場,即射束包含了低能至高能的中子、光子;對于深部腫瘤的硼中子捕獲治療,除了超熱中子外,其余的輻射線含量越多,造成正常組織非選擇性劑量沉積的比例越大,因此這些會造成不必要劑量的輻射應盡量降低。除了空氣射束品質因素,為更了解中子在人體中造成的劑量分布,本發明的實施例中使用人體頭部組織假體進行劑量計算,并以假體射束品質因素來作為中子射束的設計參考,將在下文詳細描述。
國際原子能機構(iaea)針對臨床硼中子捕獲治療用的中子源,給定了五項空氣射束品質因素建議,此五項建議可用于比較不同中子源的優劣,并供以作為挑選中子產生途徑、設計射束整形體時的參考依據。這五項建議分別如下:
超熱中子射束通量epithermalneutronflux>1x109n/cm2s
快中子污染fastneutroncontamination<2x10-13gy-cm2/n
光子污染photoncontamination<2x10-13gy-cm2/n
熱中子與超熱中子通量比值thermaltoepithermalneutronfluxratio<0.05
中子電流與通量比值epithermalneutroncurrenttofluxratio>0.7
注:超熱中子能區在0.5ev到40kev之間,熱中子能區小于0.5ev,快中子能區大于40kev。
1、超熱中子射束通量:
中子射束通量和腫瘤中含硼藥物濃度共同決定了臨床治療時間。若腫瘤含硼藥物濃度夠高,對于中子射束通量的要求便可降低;反之,若腫瘤中含硼藥物濃度低,則需高通量超熱中子來給予腫瘤足夠的劑量。iaea對于超熱中子射束通量的要求為每秒每平方厘米的超熱中子個數大于109,此通量下的中子射束對于目前的含硼藥物而言可大致控制治療時間在一小時內,短治療時間除了對病人定位和舒適度有優勢外,也可較有效利用含硼藥物在腫瘤內有限的滯留時間。
2、快中子污染:
由于快中子會造成不必要的正常組織劑量,因此視之為污染,此劑量大小和中子能量呈正相關,因此在中子射束設計上應盡量減少快中子的含量。快中子污染定義為單位超熱中子通量伴隨的快中子劑量,iaea對快中子污染的建議為小于2x10-13gy-cm2/n。
3、光子污染(γ射線污染):
γ射線屬于強穿輻射,會非選擇性地造成射束路徑上所有組織的劑量沉積,因此降低γ射線含量也是中子束設計的必要要求,γ射線污染定義為單位超熱中子通量伴隨的γ射線劑量,iaea對γ射線污染的建議為小于2x10-13gy-cm2/n。
4、熱中子與超熱中子通量比值:
由于熱中子衰減速度快、穿透能力差,進入人體后大部分能量沉積在皮膚組織,除黑色素細胞瘤等表皮腫瘤需用熱中子作為硼中子捕獲治療的中子源外,針對腦瘤等深層腫瘤應降低熱中子含量。iaea對熱中子與超熱中子通量比值建議為小于0.05。
5、中子電流與通量比值:
中子電流與通量比值代表了射束的方向性,比值越大表示中子射束前向性佳,高前向性的中子束可減少因中子發散造成的周圍正常組織劑量,另外也提高了可治療深度及擺位姿勢彈性。iaea對中子電流與通量比值建議為大于0.7。利用假體得到組織內的劑量分布,根據正常組織及腫瘤的劑量-深度曲線,推得假體射束品質因素。如下三個參數可用于進行不同中子射束治療效益的比較。
1、有效治療深度:
腫瘤劑量等于正常組織最大劑量的深度,在此深度之后的位置,腫瘤細胞得到的劑量小于正常組織最大劑量,即失去了硼中子捕獲的優勢。此參數代表中子射束的穿透能力, 有效治療深度越大表示可治療的腫瘤深度越深,單位為cm。
2、有效治療深度劑量率:
即有效治療深度的腫瘤劑量率,亦等于正常組織的最大劑量率。因正常組織接收總劑量為影響可給予腫瘤總劑量大小的因素,因此參數影響治療時間的長短,有效治療深度劑量率越大表示給予腫瘤一定劑量所需的照射時間越短,單位為cgy/ma-min。
3、有效治療劑量比:
從大腦表面到有效治療深度,腫瘤和正常組織接收的平均劑量比值,稱之為有效治療劑量比;平均劑量的計算,可由劑量-深度曲線積分得到。有效治療劑量比值越大,代表該中子射束的治療效益越好。
為了使射束整形體在設計上有比較依據,除了五項iaea建議的空氣中射束品質因素和上述的三個參數,本發明實施例中也利用如下的用于評估中子射束劑量表現優劣的參數:
1、照射時間≤30min(加速器使用的質子電流為10ma)
2、30.0rbe-gy可治療深度≥7cm
3、腫瘤最大劑量≥60.0rbe-gy
4、正常腦組織最大劑量≤12.5rbe-gy
5、皮膚最大劑量≤11.0rbe-gy
注:rbe(relativebiologicaleffectiveness)為相對生物效應,由于光子、中子會造成的生物效應不同,所以如上的劑量項均分別乘上不同組織的相對生物效應以求得等效劑量。
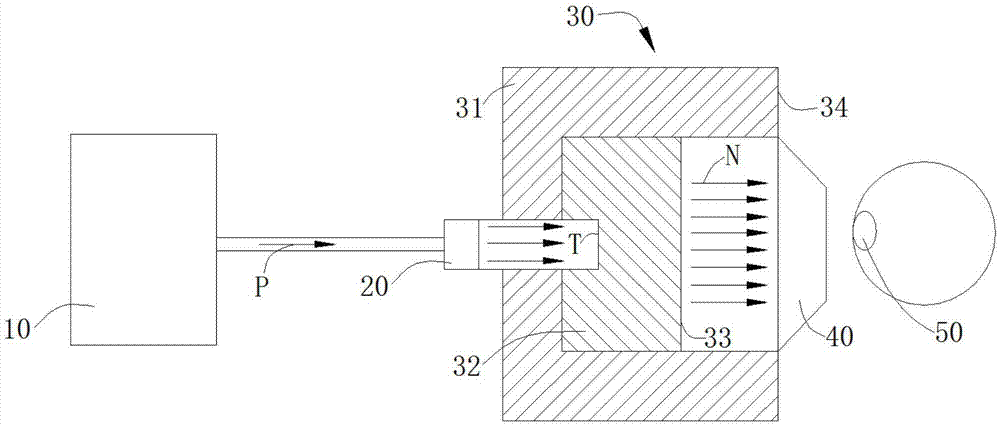
請參見圖1,其揭示了一種基于加速器型的硼中子捕獲治療系統的平面示意圖,硼中子捕獲治療系統包括加速器10、擴束裝置20、用于通過帶電粒子束p的帶電粒子束入口、帶電粒子束p、經與帶電粒子束p發生核反應從而產生中子束n的中子產生部t、用于調整經中子產生部t產生的中子射束通量與品質的射束整形體30、鄰接于射束整形體30的準直器40和被經準直器40處出來的射束照射的類α-氨基酸三氟化硼化物50。其中,加速器10用來給帶電粒子束p加速,可以為回旋加速器或者直線加速器等適用于加速器型中子捕獲治療系統的加速器;這里的帶電粒子束p優選為質子束;擴束裝置20設置在加速器10及中子產生部t之間;帶電粒子束入口緊鄰中子產生部t并容納在射束整形體30內,在中子產生部t及擴束裝置20之間的三個箭頭作為帶電粒子束入口;中子產生部t容納在射束整形體30內,這里的中子產生部t優選為鋰金屬;射束整形體30包括反射體31、被反射體31包圍并鄰接于中子產生部t的緩速體32、與緩速體32鄰接的熱中子吸收體33、設置在射束整形體30內的輻射屏蔽34,中子產生部t與自帶電粒子束入口入射的帶電粒子束p發生核反應以產生中子 束n,緩速體32將自中子產生部t產生的中子減速至超熱中子能區,反射體31將偏離的中子導回以提高超熱中子射束強度,熱中子吸收體33用于吸收熱中子以避免治療時與淺層正常組織造成過多劑量,輻射屏蔽34用于屏蔽滲漏的中子和光子以減少非照射區的正常組織劑量,準直器40用于將中子束聚集;經準直器40射出的中子束作用到類α-氨基酸三氟化硼化物50后產生的能量破壞腫瘤細胞dna。
請參見圖2,其揭示了一種基于反應堆型的硼中子捕獲治療系統的平面示意圖,硼中子捕獲治療系統包括反應堆100(中子束由所述反應堆內產生,因此亦可稱之為中子產生部)、擴束裝置200、中子束入口、用于調整經中子產生部產生的中子射束通量與品質的射束整形體300、鄰接于射束整形體300的準直器400和被經準直器400處出來的射束照射的類α-氨基酸三氟化硼化物500。其中,反應堆100可以由本領域技術人員熟知地能夠產生需要的能量的中子的相關核反應,如鈾-235或钚-239產生裂變反應時放出來的快中子;擴束裝置200設置在反應堆100及中子束入口之間;在擴束裝置200之后的三個箭頭作為中子束入口;射束整形體300包括反射體310、被反射體310包圍的緩速體320、與緩速體320鄰接的熱中子吸收體330、設置在射束整形體300內的輻射屏蔽340,緩速體320將自中子產生部100產生的中子減速至超熱中子能區,反射體310將偏離的中子導回以提高超熱中子射束強度,熱中子吸收體330用于吸收熱中子以避免治療時與淺層正常組織造成過多劑量,輻射屏蔽340用于屏蔽滲漏的中子和光子以減少非照射區的正常組織劑量,準直器400用于將中子束聚集;經準直器400射出的中子束作用到類α-氨基酸三氟化硼化物500后產生的能量破壞腫瘤細胞dna。
射束整形體30、300能將中子緩速至超熱中子能區,并降低熱中子及快中子含量。反射體31、310由具有中子反射能力強的材料制成,作為一種優選實施例,反射體31、310由pb或ni中的至少一種制成。緩速體32、320由具有快中子作用截面大、超熱中子作用截面小的材料制成,作為一種優選實施例,緩速體32、320由d2o、alf3、fluentaltm、caf2、li2co3、mgf2和al2o3中的至少一種制成。熱中子吸收體33、330由與熱中子作用截面大的材料制成,作為一種優選實施例,熱中子吸收體33、330由6li制成。輻射屏蔽34、340包括光子屏蔽和中子屏蔽,作為一種優選實施例,輻射屏蔽34、340包括由鉛(pb)制成的光子屏蔽和由聚乙烯(pe)制成的中子屏蔽。準直器40、400由對中子匯聚能力強的材料制成,作為一種優選實施例,準直器40、400由石墨、鉛中的至少一種制成。
本領域技術人員熟知地,除了上述加速器型及反應堆型的中子產生方式,還可以采用其他的中子產生方式,如d-d中子發生器,d-t中子發生器等,也可以根據實際需要對射束整形體的材料、結構及組成進行相應的調整。
在bnct中,當以治療有效量進行給予時,含硼的化合物必須是無毒的或低毒性的,以及能夠選擇性地積聚在腫瘤組織中。雖然bpa具有低化學毒性的優勢,但是它以低于期望的水平積聚在臨界正常組織中。尤其是,腫瘤中的硼濃度相對于正常腦以及腫瘤相對于血液的比率大約為3:1。這樣低的特異性(專一性)限制了bpa對腫瘤的最大劑量,這是因為用于正常組織的可允許的劑量是限制性因素。
因此,需要開發新的化合物,其在腫瘤中具有較長的保留時間,并選擇性地靶向和破壞腫瘤細胞而對正常組織具有最小的損傷。
α-氨基酸是蛋白質的主要組分,是生物體中最重要的氨基酸,在atp的產生和神經傳遞過程中發揮著非常重要的作用。此外,α-氨基酸還是癌細胞生存和增殖的關鍵營養素。α-氨基酸中的-cooh被-bf3取代即得到類α-氨基酸的三氟化硼化物,其為α-氨基酸的等電子體化合物。有研究表明,細胞攝取類α-氨基酸的三氟化硼化物的途徑跟α-氨基酸相同,都是通過酶介導途徑,且兩者具有相同的轉運蛋白。類α-氨基酸的三氟化硼化物在用于bnct的新型硼載體化合物的設計中引起我們強烈的關注,該化合物穩定性高,靶向性好,在腫瘤細胞內富集度高。相比較fdg,炎癥區域對該化合物的吸收幾乎可忽略不計。此外,類α-氨基酸的三氟化硼化物易于合成,通常由相應的硼酸酯在酸性條件下與khf2反應制得。
此外,在bnct中利用18f標記的類α-氨基酸的三氟化硼化合物,在放射治療體積內的腫瘤和所有組織中以及周圍的硼濃度和分布可以在照射前和照射期間非侵入地準確而快速地測定。該診斷信息使得通過降低超熱中子在已知含有高水平硼的組織區域暴露,可以更快、更準確和更安全地進行硼中子俘獲治療。
下面將結合具體實施例對類α-氨基酸的三氟化硼化合物進行詳細的闡述。
實施例1phe-bf3制備
反應路線
于1.5ml微量反應器中加入芐基硼酸酯(15mg,0.05mmol),kf(0.15mmol,0.05ml)溶液,hcl(0.2mmol,0.03ml)溶液,0.1mlmecn溶液,室溫條件下反應2h,得到phe-bf3粗品。粗品經hplc進一步純化,得到phe-bf3。1hnmr(300mhz,meod):δppm7.30(m,5h),3.04(d,j=9.8hz,1h),2.67(t,j=9.8hz,1h),2.42(brs,1h);[m-h]-188.0901,found:188.0589。
根據本發明的化合物的體外研究
對本實施例1的純化材料(以下稱作phe-bf3)進行的體外試驗使用四種不同的來源于人 的腫瘤細胞株u343mga、人的肝癌細胞株hep3b、人的乳腺癌細胞株mcf7和人的肉瘤細胞株4ss。將細胞平鋪在未涂覆的組織培養皿上,并且在37℃下在具有用5%co2平衡的濕潤空氣的溫育器中進行培養(所述培養基中添加了10%的fcs和pest(青霉素100iu/ml和鏈霉素100mg/ml))。為了細胞的通過,將細胞用胰蛋白酶-edta(具有0.25%的胰蛋白酶和0.02%的edta、不含鈣和鎂的磷酸鹽緩沖鹽水(pbs))進行胰蛋白酶化。
實施例2phe-bf3的細胞攝取
將u343mga細胞以75%的細胞密度平鋪在petri培養皿上,并且用溶于組織培養基的1,4-二羥基硼苯丙氨酸(bpa)或phe-bf3溫育6小時。兩種含硼化合物均以相對于硼含量(5×10-4mol/l硼)的等摩爾濃度加入并溶解在組織培養基中。通過除去含硼組織培養基以及為了從細胞上洗去過量的培養基而加入冷磷酸緩沖鹽溶液(pbs緩沖液)來結束溫育。通過使用橡膠淀帚從培養皿上鏟下來而即刻收獲細胞,它們在冷的pbs中收集并且通過離心形成沉淀。
根據bradford標準程序對細胞樣品進行總蛋白分析。通過直流原生質原子發射光譜(dcp-aes)對沉淀細胞進行硼分析。在60℃下用硫酸/硝酸(1/1)對樣品(50-130mg)消化。加入tritonx-100和水從而得到50mg組織/ml、15%總酸v/v和5%tritonx-100v/v的濃度。硼濃度是基于已知對照樣品的。結果見下表1。由表1可以看出,phe-bf3優于對作為硼苯丙氨酸(bpa)的硼的攝取。
表1:不同的硼化合物的細胞攝取
對于兩個平行試驗(試驗1和2)中的不同的硼化合物來說,硼含量表示為u343mga細胞中總細胞蛋白的函數(μg硼/g細胞蛋白)(在試驗1和試驗2中分別為7.2和7.7μg硼/ml培養基)。
實施例3不同腫瘤細胞對phe-bf3的攝取
將四種來源于人的不同腫瘤細胞株:u343mga、hep3b、mcf7和4ss以40-50%(低)以及90-100%(高)細胞密度平鋪在petri培養皿上,并且如上述用溶于組織培養基的phe-bf3溫育6小時。通過除去含硼培養基以及為了從細胞上洗去過量的培養基而加入冷的pbs緩沖液來結束溫育。通過使用橡膠淀帚從培養皿上鏟下來而即刻收獲細胞,它們在冷的pbs中收集并且通過離心形成沉淀。根據bradford標準程序對細胞樣品進行總蛋白分析(如上)。結果 見下表2。對于以低和高細胞密度測試的所有四種人的腫瘤細胞株(膠質母細胞瘤(u343mga)、肝癌(hep3b)、乳腺癌(mcf7)、肉瘤(4ss))對比中,發現phe-bf3是一種高效的硼載體。
表2:phe-bf3的細胞攝取。硼含量表示為總細胞蛋白的函數(μg硼/g細胞蛋白)。
實施例4phe-bf3的細胞內保留
將u343mga細胞以75%的細胞密度平鋪在petri培養皿上,并且用于組織培養基中的1,4-二羥基硼苯丙氨酸(bpa)或phe-bf3溫育18小時。兩種硼化合物均以相對于硼含量(5×10-4mol/l硼)的等摩爾的濃度加入組織培養基中。通過用沒有硼的培養基代替含硼培養基而結束溫育。細胞樣品分別在時間點0、2和7小時進行取樣,其中0時間點代表剛好用硼化合物溫育18小時。
細胞用冷的pbs洗滌,并通過使用橡膠淀帚從培養皿上鏟下來而即刻將其收獲,它們在冷的pbs中收集并且通過離心形成沉淀。同上述操作對細胞沉淀進行總蛋白和硼含量的分析。結果見下表3。隨著細胞內的攝取,在培養基中的ⅰa完全耗盡后7h時,保留在腫瘤細胞中的式(i)化合物為總攝取的50%。
表3:在清除含硼培養基之后的0、2和7h時u343mga細胞中的硼含量(μg硼/g細胞沉淀)。
綜上所述,正如實施例2-4中顯示的,化合物phe-bf3已經在體外試驗中顯示出預期的結果,其在腫瘤細胞攝取、積累和保留方面都優于bpa。
實施例5phe-bf3細胞毒性研究試驗
將含肽牛血清的細胞培養液置于37℃培養24h。將傳代培養的小鼠成纖細胞l-929細胞,用細胞培養液制成1×105個/ml的細胞懸液,將該細胞懸液接種于96孔細胞培養板(100μl/孔),置37℃二氧化碳培養箱中培養24h。等細胞貼壁生長后,去除上清液,加入對照液(不含化合物ⅰa),試驗組(phe-bf3的濃度為5mmol/l)的培養液進行交換,置37℃二氧化碳培養箱中繼續培養。于2天后取出,加入mtt液繼續培養4h。吸除原液,加入dmso,振 蕩10min。用酶聯免疫檢測儀在波長為630nm下測定其吸光度值,并根據其吸光度按公式計算細胞的相對增殖度(rgr)。結果見下表4。
表4:mtt比色法測得的細胞相對增殖度(rgr)結果
注:
根據細胞相對增殖度來評定細胞的毒性反應,見下表5。
表5:細胞毒性反應評定
結論:由表5可以看出,phe-bf3并沒有出現任何毒性的跡象。
本發明揭示的硼中子捕獲治療系統并不局限于以上實施例所述的內容以及附圖所表示的結構。在本發明的基礎上對其中構件的材料、形狀及位置所做的顯而易見地改變、替代或者修改,都在本發明要求保護的范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!