藥物微球動脈栓塞劑的藥代動力模型及檢測方法與流程
本發明涉及藥物微球栓塞于動脈后藥代動力學領域,具體涉及一種含藥微球栓塞劑動脈栓塞后局部藥物釋放的藥物代謝模型和檢測方法。
背景技術:
介入治療技術是目前醫學治療腫瘤、結核、咯血及血管性疾病的前沿醫學手段,其中利用含藥微球的介入治療在腫瘤、結核的治療上取得了明顯的療效,越來越得到臨床的重視。其原理是:在透視引導下通過將微導管經外周血管送至目標病變組織血管中,然后將藥物微球栓塞劑注入病變組織中,實現一方面阻斷病變組織血運,另一方面利用微球所攜帶藥物給病變組織帶來針對性的治療,實現控制病變組織進一步生長的目的。例如,海藻酸鈉微球血管栓塞劑是一種天然、可降解的新型血管栓塞劑,已用于咯血、肝癌、脾功能亢進、動脈瘤、子宮肌瘤等動脈栓塞臨床治療。采用微囊技術將海藻酸鈉微球包裹利福平,制備成一種新型載藥微球血管栓塞劑,即利福平海藻酸鈉微球栓塞劑(rifampicinsodiumalginatemicrosphereembolicagents,rfp-kmg),rfp-kmg具有作用靶向性強、藥物緩釋、保持局部組織內的藥物高濃度等優點,在機械栓塞的同時增強了藥物生物利用度。
藥物微球栓塞治療后其所載藥物如何進入周圍組織及其藥代動力學一直有較大爭議,目前無一種理想的藥代動力學模型。含藥微球的應用目的是:保證病變組織局部藥物的高濃度的同時進行局部栓塞治療,實現藥物和栓塞治療的雙重療效。若微球不能釋放藥物,含藥微球只能發揮栓塞的功效,若微球過快釋放藥物入血,則外周血藥濃度過高會給人體帶來副作用。所以明確微球局部藥代動力學是含藥微球在臨床應用的關鍵。傳統方法是通過動物實驗,將藥物微球于靶組織動脈栓塞后,然后分時間點測外周血藥濃度,以及取樣靶組織并勻漿后測組織血藥濃度。但這種測量方法存在兩個弊端:1.靶組織本身含有血管,組織血管中的血藥濃度干擾組織血藥濃度的準確性;2.靶組織含有微球栓塞劑,微球栓塞劑本身的藥物濃度也會干擾組織的藥物濃度的測定。
針對現有技術在藥物微球檢測方面所面臨的困難,本發明提供一種可以準確反映藥物微球動脈栓塞的局部組織藥物濃度的藥代動力學模型和檢測方法。
技術實現要素:
本發明提供一種藥物微球動脈栓塞的局部組織藥物濃度的藥代動力學模型和檢測方法,能夠排除血管內殘留藥物的干擾,準確檢測局部組織內的藥物濃度。
具體而言,本發明的技術方案主要是通過以下方式實現的:
本發明提供一種藥物微球動脈栓塞的局部組織藥物濃度的藥代動力學模型,截試驗動物的股動脈制成生物膜囊袋,并以藥物微球填充形成藥物囊袋,將藥物囊袋包埋入活體試驗動物的肝臟內,考察肝臟局部組織滲透釋放特征。
進一步地,試驗動物可選用雄性家兔。
進一步地,藥物微球可為利福平海藻酸鈉微球栓塞劑(rifampicinsodiumalginatemicrosphereembolicagents,rfp-kmg)…等。
進一步地,采用實驗動物的一段股動脈,一端縫扎,將藥物微球塞入后縫扎另一端構建成含藥微球藥物囊袋。
本發明還提供一種藥物微球動脈栓塞的局部組織藥物濃度的檢測方法,包含截取試驗動物的股動脈,制成生物膜囊袋,以藥物微球填充形成藥物囊袋,將藥物囊袋包埋入肝臟組織中,通過外周靜脈取血,并在不同時間點取出包埋藥物囊袋,檢測藥物代謝剩余量,以囊袋包埋肝臟點位中心,按照梯度遠近的原則,通過高效液相色譜法(hplc)檢測近端濃度、中端濃度和遠端濃度,考察載藥物微球栓塞劑的肝臟局部組織滲透釋放特征。
進一步地,試驗動物可選用雄性家兔。
進一步地,藥物微球可為利福平海藻酸鈉微球栓塞劑(rifampicinsodiumalginatemicrosphereembolicagents,rfp-kmg)…等。
進一步地,將藥物囊袋包埋入肝臟組織后,可于1天、3天、1周、2周、1個月的不同時間點取出藥物囊袋。
進一步地,可以在囊袋包埋肝臟點位中心,每隔1.5cm,取1cm3的肝臟組織。
進一步地,可通過試驗動物耳緣取血。
進一步地,可于30分鐘、1小時、2小時、4小時、6小時、12小時、1天、2天、3天、4天、5天、1周、2周、1個月經家兔耳緣靜脈取血0.5ml。
進一步地,通過hplc檢測藥物囊袋剩余藥量、肝臟局部組織梯度濃度,外周血藥濃度等肝臟局部組織滲透釋放特征
進一步地,可采用pksolver2.0藥動學軟件對血藥濃度-時間數據進行擬合,根據理論血藥濃度值與實驗測定值的aic最小的原則,同時參考相關系數(r2)最大,作為判斷標準,選擇最佳房室模型,并分別求得藥動學參數,計算出t1/2(α)、t1/2(β)、auc、cl、cmax等參數并擬合出血藥濃度-時間曲線圖。所有數據均用x±sd表示。其中,t1/2(α)表示分布半衰期,t1/2(β)表示消除半衰期,auc表示血藥濃度-時間曲線下面積,cmax表示藥峰濃度,aic表示akaike信息判據,r2表示相關指數。
本發明首次研究建立微球栓塞于動脈后其所載藥物如何緩釋進入周圍組織及藥代動力學模型和檢測方法。通過模型可檢測包括在活體動物體內微球藥物釋放通過動脈壁進入周圍局部組織,動脈內代謝剩余量及外周血藥濃度,從而檢測藥物微球栓塞劑藥物緩釋代謝及局部組織滲透釋放特征,解決了待測組織的取材方法不能排除血管內殘留藥物的影響的難題,并且應用動物自體動脈制造囊袋,增加了模型的準確性。
附圖說明
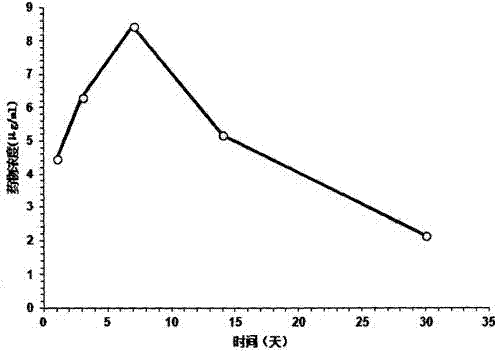
圖1肝臟組織近端濃度-時間曲線
圖2利福平海藻酸鈉微球動脈囊袋在家兔體內血藥濃度與時間曲線圖
圖3囊袋中利福平剩余百分率
圖41周時的單室及二室模型的藥動學參數結果
圖51個月時的二室模型藥動學參數結果
具體實施例說明
1實驗動物
實驗動物:清潔級實驗雄性新西蘭白兔30只,體重(2.3±0.2)kg,由解放軍第三○九醫院實驗動物中心二級實驗動物室提供,室溫正常飼養1周。
2實驗方法
2.1rfp-kmg動脈囊袋肝臟包埋動物實驗
2.1.1以利福平海藻酸鈉微球栓塞劑(rfp-kmg)為例,制作rfp-kmg動脈囊袋(藥物囊袋)。30只雄性新西蘭白兔均分為5組(1天組、3天組、1周組、2周組、1個月組,每組6只(rfp-kmg試驗組5只;kmg空白對照組1只),試驗兔麻醉,右后肢大腿內側備皮,切口,分離出約3cm股動脈,遠端雙側結扎,近端一側結扎,剪取中間動脈血管,套管針輔助下,試驗組將避光稱量的定量(3mg·kg-1)rfp-kmg塞入血管,空白對照組填充入kmg,另一側結扎,將制作好的囊袋,放入生理鹽水中浸潤備用,大腿內側創口縫合。
2.1.2囊袋肝臟包埋
新西蘭白兔胸腹部備皮,上腹部橫向切口,暴露出肝臟,迅速將藥物囊袋包埋入肝臟,用明膠海綿壓住止血,腹部創口縫合。術后正常飼養。
2.1.3生物樣本制備
2.1.3.1血樣處理
新西蘭白兔手術后,于不同時間點(30分鐘、1小時、2小時、4小時、6小時、12小時、1天、2天、3天、4天、5天、1周、2周、1個月)經耳緣靜脈取血0.5ml,置于肝素管中離心(溫度4℃,轉速30分鐘、1小時、2小時、4小時、6小時、12小時、1天、2天、3天、4天、5天、1周、2周、1個月3000r·min-1,時間5min),取上清0.1ml,加乙腈0.1ml沉淀蛋白,旋渦混勻1min后離心(溫度4℃,轉速10000r·min-1,時間10min),取上清液再離心(溫度4℃,轉速10000r·min-1,時間10min),取上清液過0.45μm微孔濾膜,4℃保存,待測。
2.1.3.2肝臟組織樣本處理
新西蘭白兔手術后,于不同時間點(1天、3天、1周、2周、1個月)處死,立即解剖取出肝臟,首先將動脈載藥囊袋剝離出(見圖3),并以囊袋包埋點為中心,按照梯度遠近的原則,每隔1.5cm,取約1cm3肝臟組織,用生理鹽水清洗表面浮血,濾紙吸干后稱重,剪碎,加入定量生理鹽水(體重∶生理鹽水=1∶3)勻漿,取勻漿液0.4ml,加乙腈0.4ml沉淀蛋白,旋渦混勻1min后離心(溫度4℃,轉速10000r·min-1,時間10min),取上清液0.4ml,加乙腈0.4ml沉淀蛋白,旋渦混勻1min后再離心(溫度4℃,轉速10000r·min-1,時間10min),取上清液過0.45μm微孔濾膜,4℃保存,待測。載藥囊袋同上處理,4℃保存,待測。
2.2高效液相色譜法檢測生物樣本
2.2.1色譜條件
色譜柱:diamonsilods-2(4.6×250mm,5μm);流動相:甲醇-乙腈-0.075mol·l-1磷酸二氫鉀溶液-1.0mol·l-1枸櫞酸溶液(30∶32∶36∶4);流速為1.0ml·min-1;柱溫35℃;檢測波長254nm;進樣量:10μl。
2.2.2標準溶液的配制
2.2.2.1標準溶液儲備液
精密稱取利福平對照品10mg,置于10ml的棕色容量瓶中,加入乙腈溶解后,乙腈定容,配制成濃度為1000μg·ml-1的標準品儲備液,避光置于4℃冰箱備用。
2.2.2.2二級標準溶液儲備液
移取1000μg·ml-1的利福平標準品儲備液,配制濃度分別為100μg·ml-1和10μg·ml-1利福平二級濃度標準品儲備液,避光置于4℃冰箱備用。
2.2.3系統適應性考察(空白、對照品、供試品、陰性)
2.2.4血漿樣本檢測方法學考察
2.2.4.1精密度試驗
取10μg·ml-1利福平對照品儲備液,精取0.25ml至5ml棕色容量瓶,加空白血漿樣本定容至刻度,混勻,按“2.1.3.1”項下方法操作除蛋白,制備成0.5μg·ml-1對照品血漿生物樣品,所制得的樣品按“2.2.1”項下色譜條件,連續進樣6次,計算精密度結果。
2.2.4.2重復性試驗
平行制備6份0.5μg·ml-1對照品血漿生物樣品(按“2.2.4.1”項下方法操作),所制得的樣品按“2.2.1”項下色譜條件,分別進樣1次,計算重復性結果。
2.2.4.3穩定性試驗
配置對照品血漿生物樣品,分別于0,2,4,6,8,12和24h時進樣分析,計算該樣品在24h內的穩定性;采用hplc測定對照品血漿生物樣品經從-20℃到室溫3次凍融穩定性。
2.2.4.1.4線性回歸
使用乙腈將利福平對照品二級濃度儲備液稀釋,制得60,30,10,5,1μg·ml-1的利福平對照品溶液,見圖3,充分混合均勻后避光置于4℃冰箱。移取上述系列濃度的標準溶液工作液50μl加入450μl空白血漿基質中,避光梯度配置0.1,0.5,1,3,6μg·ml-1的對照品血漿生物樣品溶液,按“2.1.3.1”項下方法操作除蛋白后,渦旋混勻,過0.45μm微孔濾膜后進樣,記錄利福平的峰面積,繪制空白血漿利福平標準曲線。
2.2.4.5回收率試驗
取空白血漿樣本,分別加入適量利福平對照品溶液,制成高、中、低3個濃度的樣品溶液,依“2.1.3.1”項下制備供試品溶液,每種濃度平行做3份,hplc測定,計算加樣回收率。
2.2.5肝臟樣本檢測方法學考察
2.2.5.1精密度試驗
取10μg·ml-1利福平對照品儲備液,精取5ml至10ml棕色容量瓶,加空白肝臟組織勻漿樣本定容至刻度,混勻,按“2.1.3.2”項下方法操作除蛋白,制備成5μg·ml-1對照品肝臟組織生物樣品,所制得的樣品按“2.2.1”項下色譜條件,連續進樣6次,計算精密度結果。
2.2.5.2重復性試驗
平行制備6份5μg·ml-1對照品肝臟組織生物樣品(按“2.2.5.1”項下方法操作),所制得的樣品按“2.2.1”項下色譜條件,分別進樣1次,計算重復性結果。
2.2.5.3穩定性試驗
配置對照品肝臟組織生物樣品,分別于0,2,4,6,8,12和24小時進樣分析,計算該樣品在24小時內的穩定性;采用hplc測定對照品肝臟組織生物樣品經從-20℃到室溫3次凍融穩定性。
2.2.5.4線性回歸
使用乙腈將利福平對照品二級濃度儲備液稀釋,制得500,300,100,70,50,30,10,7,3,1μg·ml-1的利福平對照品溶液,充分混合均勻后避光置于4℃冰箱。移取上述系列濃度的標準溶液工作液50μl加入450μl空白組織勻漿基質中,避光梯度配置0.1,0.3,0.7,1,3,5,7,10,30,50μg·ml-1的對照品肝臟組織生物樣品溶液,按“2.1.3.2”項下方法操作除蛋白后,渦旋混勻,過0.45μm微孔濾膜后進樣,記錄利福平的峰面積,繪制空白肝臟組織利福平標準曲線。
2.2.5.5回收率試驗
取空白肝臟組織勻漿樣本,分別加入適量利福平對照品溶液,制成高、中、低3個濃度的樣品溶液,依“2.1.3.2”項下制備供試品溶液,每種濃度平行做3份,hplc測定,計算加樣回收率。
2.2.6生物樣本檢測
按“2.1.3.1”項下操作,取已制備好的血漿樣品,hplc測定,記錄利福平的峰面積,外標法測定血漿樣本中藥物的濃度。
按“2.1.3.2”項下操作,取已制備好的組織樣品,hplc測定,記錄利福平的峰面積,外標法測定組織樣本中藥物的濃度。
2.2.7數據處理
采用pksolver2.0藥動學軟件[24]對血藥濃度-時間數據進行擬合,根據理論血藥濃度值與實驗測定值的aic最小的原則,同時參考相關系數(r2)最大,作為判斷標準,選擇最佳房室模型,并分別求得藥動學參數,計算出t1/2(α)、t1/2(β)、auc、cl、cmax等參數并擬合出血藥濃度-時間曲線圖。所有數據均用均數±標準差表示。
3檢測結果
3.1囊袋中利福平剩余百分率
包埋1d后,代謝剩余百分率為(74.59±1.48)%;包埋3d后,代謝剩余百分率為(52.56±1.24)%;包埋1周后,代謝剩余百分率為(33.11±1.95)%;包埋2周后,代謝剩余百分率為(19.48±1.87)%;包埋1個月后,代謝剩余百分率為(1.34±0.65)%。見圖3。
3.2局部釋放
肝臟組織近端濃度-時間曲線見圖1,結果顯示在釋放前期有突釋效應,在包埋植入7d后濃度最大,局部濃度可達8.46μg·ml-1,在前14天內的釋放均保持在較高濃度,隨后緩慢釋放,1個月時,局部濃度為2.14μg·ml-1,仍高于對結核桿菌的最低殺菌濃度。相同時間點處死的平行實驗新西蘭大白兔,以囊袋包埋肝臟點為中心,按照梯度遠近的原則,hplc檢測結果顯示:近端濃度>中端濃度>遠端濃度。1個月處死時間點,個別樣本出現:近端濃度>遠端濃度>中端濃度。
3.3外周血藥濃度
試驗兔血藥濃度檢測發現,載藥囊袋在局部包埋時,血藥濃度在術后20h達到最高,保持有效藥物濃度的緩釋時間為96h。1周時的房室模型與藥動學參數結果如圖4、圖5所示。利福平海藻酸鈉微球動脈囊袋在家兔體內血藥濃度與時間曲線如圖2所示。利用pksolver2.0軟件對其在家兔體內的血藥濃度按一室模型,二室模型進行擬合,得到載藥囊袋動脈包埋后在兩種模型下理論血藥濃度與實測血藥濃度的相關系數(r2)與aic值。給藥方式的藥動學過程用二室模型來描述較為合理(權重系數1/c2)。
- 還沒有人留言評論。精彩留言會獲得點贊!