對FAP和DR5特異性的雙特異性抗體和化療劑的組合療法的制作方法
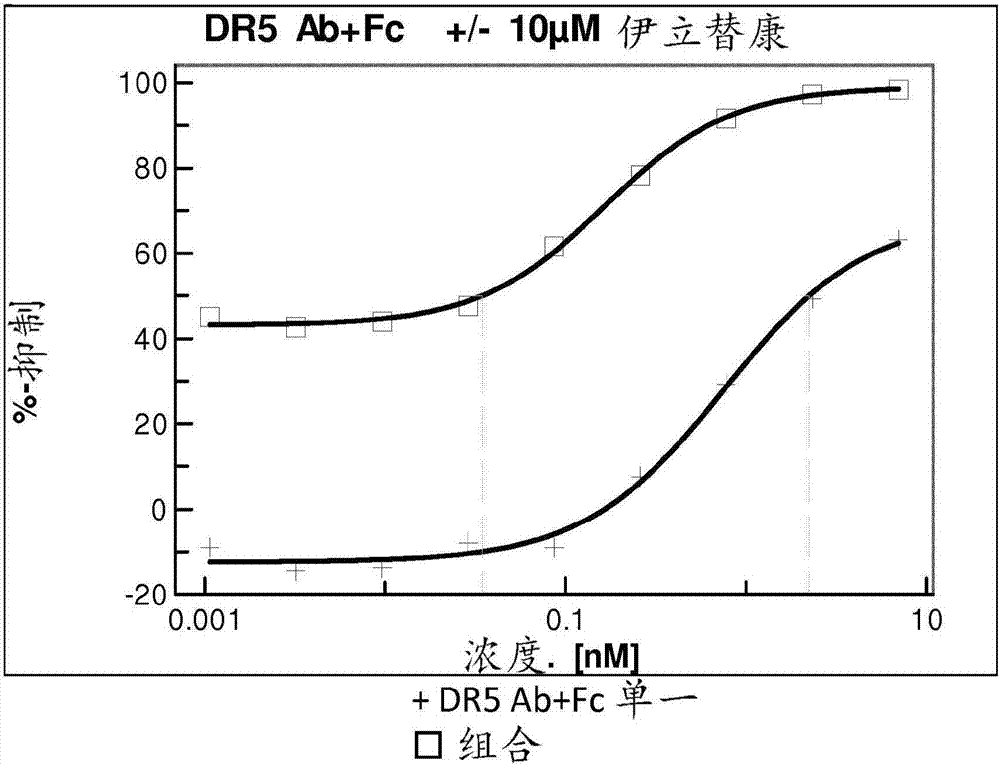
發明領域本發明涉及采用包含對死亡受體5(dr5)特異性的第一抗原結合位點和對成纖維細胞活化蛋白(fap)特異性的第二抗原結合位點的雙特異性抗體和化療劑的組合療法,及這些組合療法用于治療癌癥的用途。發明背景單克隆抗體是癌癥治療中有力的治療劑,因為它們選擇性靶向癌癥細胞上差異表達的抗原。用激動性單克隆抗體靶向癌細胞上的trail(tnf相關凋亡誘導性配體)死亡受體代表新一代單克隆抗體療法,因為它們能夠直接誘導靶定細胞凋亡。在結合trail后,tnfr-sf家族的死亡受體諸如dr4和dr5變成三聚化。三聚化誘導外在的凋亡途徑和復雜的事件級聯,包括胱天蛋白酶活化,其最終導致殺死靶細胞。如果發生dr5超聚簇(即多個三聚體聚簇)的話,凋亡誘導得到進一步增強。雖然死亡受體在多種細胞類型上廣泛表達,但是經外在途徑的凋亡誘導局限于腫瘤細胞。既然激動性dr4或dr5結合抗體能夠交聯死亡受體及由此誘導凋亡,那么這些受體就是癌癥療法中感興趣的靶物。至少八種死亡受體靶向性分子進入了臨床開發且已經在臨床試驗中評估不同適應癥的可能治療,諸如晚期實體瘤,像結直腸或肺癌。另外,已經嘗試治療其它適應癥,諸如淋巴瘤和多發性骨髓瘤。us2007/0031414和wo2006/083971中記載的完全人的dr5激動性抗體drozitumab在高濃度在交聯缺失下顯示一些體外凋亡活性。然而,體內數據揭示了一種不同的作用模式:在fcγr突變型小鼠中(或當使用fcγr結合受到抑制的抗體變體時),drozitumab沒有活性,指示這種分子的體內活性主要依賴于fcγr介導的交聯。這種分子測試到臨床ii期,看來是安全的(直到20mg/kg沒有達到mtd),但是沒有展現任何顯著功效。ep1922337a中記載的conatumumab是另一種完全人的dr5激動性抗體。conatumumab的活性嚴格依賴于經fc受體的交聯。與drozitumab形成對比,這種抗體是非配體阻斷性的。同樣,這種分子在臨床試驗中只顯示非常有限的功效。嵌合dr5抗體lby-135展現就交聯依賴性活性和非配體阻斷性特性而言與conatumumab類似的特征,而且在單一療法中沒有展現任何顯著功效。另外,lby-135在部分登記i期試驗的患者中顯示免疫原性的跡象。dr4和dr5(trail)的重組生產天然配體dulanermin在臨床試驗中只顯示有限的客觀響應。天然配體的使用不知何故是不利的:trail靶向多種受體,包括死亡受體和誘餌受體二者,因此,選擇性堪憂。另外,trail具有與單克隆抗dr抗體相比短得多的血液半衰期,這個因素影響劑量和時間表參數。與單克隆抗dr抗體相比,trail很短的血液半衰期要求大和頻繁的劑量。另外,重組trail的生產非常困難且冗長。上文所述三種dr5激動性抗體和配體的開發均已中止。另外兩種完全人的抗體,mapatumumab(抗dr4)和lexatumumab(抗dr5),仍在開發中,雖然這些分子也沒有在單一療法中展現有希望的功效。tigatuzumab是一種人源化dr5激動性抗體,據記載在體外在次級交聯缺失下(在低濃度已經)有活性,這當然帶來系統性毒性問題的風險。然而,正如所有其它記載的激動性dr5抗體,這種分子也至今沒有在i/ii期研究中展現令人信服的功效,而且最大耐受劑量mtd證明只有8mg/kg。用分子tas266,一種四聚體dr5結合性納米抗體(wo2011/098520),從事通過靶向死亡受體來誘導凋亡的一種不同辦法。由于dr5結合模塊的四價構造,認為dr5交聯與標準二價抗體相比升高,這可導致活性升高。然而,由于它們的尺寸較小,這些分子具有(與抗體相比)半衰期相當短的缺點。另外,既然這種四聚體分子沒有靶向腫瘤,那么系統性毒性的風險升高。本申請的發明人已經將在雙特異性抗體平臺中組合dr5抗體drozitumab與腫瘤抗原結合模塊或腫瘤周圍的基質中存在的抗原描述為實現兩項效果的一種新辦法:第一,可以將dr5結合抗體靶向腫瘤部位,這可避免潛在的系統性毒性問題(尤其當使用展現交聯不依賴性活性的dr5抗體時)。第二,這種腫瘤或腫瘤基質靶向性模塊然后也充當交聯單元來誘導dr5超聚簇和隨后的腫瘤部位特異性凋亡。已經使用靶向不同腫瘤類型的drozitumab_scfv融合分子證明了基本概念(參見wo2011/039126)。已經提議能夠結合dr5和人成纖維細胞活化蛋白(fap;genbank登錄號aac51668)的雙特異性抗體。人fap最初是使用單克隆抗體(mab)f19(記載于wo93/05804,atcc編號hb8269)在培養的成纖維細胞中鑒定的。在數個物種中發現了該蛋白質的同系物,包括小鼠(niedermeyeretal.,intjcancer71,383-389(1997);niedermeyeretal.,eurjbiochem254,650-654(1998);genbank登錄號aah19190)。fap具有獨特的組織分布:發現它的表達在超過90%的所有原發性和轉移性上皮腫瘤,包括肺,結直腸,膀胱,卵巢和乳腺癌的反應性基質成纖維細胞上高度上調,而它通常在正常成年組織中缺失(rettigetal.,procnatlacadsciusa85,3110-3114(1988);garin-chesaetal.,procnatlacadsciusa87,7235-7239(1990))。后續報告顯示fap不僅在基質成纖維細胞中表達,而且在一些類型的上皮起源的惡性細胞中表達,而且fap表達與惡性表型直接相關(jinetal.,anticancerres23,3195-3198(2003))。上文所述常規dr5靶向性分子的活性依賴于fc受體(fcr)介導的超聚簇,而且受腫瘤中的免疫浸潤和活化狀態影響(li和ravetch,pnas2012;wilson,cancercell2011;wo2011/098520)。fc/fcr相互作用可受生理性人igg水平削弱。因此,常規dr5靶向性分子的活性常常限于少數浸潤細胞(moessner,blood2010)。通過使用靶向dr5和fap二者的雙特異性抗體,敏感性腫瘤細胞的百分比可通過經fap的超交聯顯著增大,而且針對dr5激動劑的內在抗性的風險降低。新穎的dr5結合模塊只在與fap交聯后有活性,這可導致與dr5結合物drozitumab和tigatuzumab相比改善的安全性和毒性概況。至今已經測試的dr5激動劑在臨床中是安全的,然而這些臨床程序受到dr5靶向性分子的低功效阻礙。找到使用dr5激動性抗體靶向癌癥的有效療法仍然是本領域的一個問題。發明概述寬泛地,本發明涉及組合死亡受體5(dr5)靶向性抗原結合位點與靶向成纖維細胞活化蛋白(fap)的第二抗原結合位點的雙特異性抗體及它們與別的化療劑組合的用途。依照本發明采用的雙特異性抗體使得死亡受體變成交聯的且對靶定的腫瘤細胞誘導凋亡。勝過常規死亡受體靶向性抗體的優勢在于只在表達fap的部位誘導凋亡的特異性以及這些雙特異性抗體因誘導dr5超聚簇所致的更高效力。因而,在一個方面,本發明提供一種供作為組合療法在治療癌癥的方法中使用的包含至少一個對dr5特異性的抗原結合位點和至少一個對fap特異性的抗原結合位點的結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體,其中該雙特異性抗體與選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑,bcl-2抑制劑,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑,異磷酰胺或抗vegf抗體的化療劑組合使用。優選地,該化療劑選自伊立替康,多柔比星,奧沙利鉑,異磷酰胺或抗vegf抗體。在一個實施方案中,該雙特異性抗體與伊立替康組合使用。在一個此類實施方案中,要治療的癌癥為結直腸癌。在一個實施方案中,該雙特異性抗體與抗vegf抗體組合使用。在一個此類實施方案中,要治療的癌癥為結直腸癌。在一個實施方案中,該雙特異性抗體與多柔比星組合使用。在一個此類實施方案中,要治療的癌癥為肉瘤。在一個實施方案中,該雙特異性抗體與多柔比星異磷酰胺組合使用。在一個此類實施方案中,要治療的癌癥為肉瘤。在一個實施方案中,該雙特異性抗體與吉西他濱和abraxane組合使用。在一個此類實施方案中,要治療的癌癥為胰腺癌。在一個實施方案中,該mdm2抑制劑為rg7388。在一個實施方案中,該bcl-2抑制劑為abt199。在一個實施方案中,該parp抑制劑為pj34。在一個實施方案中,該parp抑制劑為olaparip。在一個實施方案中,本發明提供一種供作為組合療法在治療癌癥的方法中使用的包含至少一個對dr5特異性的抗原結合位點和至少一個對fap特異性的抗原結合位點的結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體,其中該癌癥為結直腸癌,肉瘤,頭和頸癌,鱗狀細胞癌,乳腺癌,胰腺癌,胃癌,非小細胞肺癌,小細胞肺癌和間皮瘤。在一個實施方案中,該癌癥為結直腸癌。在一個實施方案中,該肉瘤為軟骨肉瘤,平滑肌肉瘤,胃腸基質腫瘤,纖維肉瘤,骨肉瘤,脂肪肉瘤或惡性纖維組織細胞瘤。在一個實施方案中,本發明提供一種供作為組合療法在治療癌癥的方法中使用的包含至少一個對dr5特異性的抗原結合位點和至少一個對fap特異性的抗原結合位點的結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體,其中該雙特異性抗體和化療劑一起施用,任選作為組合配制劑。在一個實施方案中,該雙特異性抗體和該化療劑交替施用。在一個實施方案中,該化療劑在該雙特異性抗體之前施用。在一個實施方案中,該化療劑在該雙特異性抗體之后施用。在一個實施方案中,該組合以約一周至三周的間隔施用。在一些實施方案中,本發明采用一種雙特異性抗體,其中對dr5特異性的抗原結合位點包含:(a)seqidno.:1的重鏈cdr1;(b)seqidno.:2的重鏈cdr2;(c)seqidno.:3的重鏈cdr3;(d)seqidno.:4的輕鏈cdr1;(e)seqidno.:5的輕鏈cdr2;和(f)seqidno.:6的輕鏈cdr3。在一些實施方案中,本發明采用一種雙特異性抗體,其中對fap特異性的抗原結合位點包含:(a)seqidno.:9的重鏈cdr1;(b)seqidno.:10的重鏈cdr2;(c)seqidno.:11的重鏈cdr3;(d)seqidno.:12的輕鏈cdr1;(e)seqidno.:13的輕鏈cdr2;和(f)seqidno.:14的輕鏈cdr3。在一個實施方案中,該雙特異性抗體包含至少一個對dr5特異性的抗原結合位點,其包含包含下述氨基酸序列的可變重鏈和可變輕鏈:seqidno.:7和seqidno.:8。在一些實施方案中,本發明,該雙特異性抗體包含對fap特異性的抗原結合位點,其包含包含選自下組的氨基酸序列的可變重鏈和可變輕鏈:seqidno.:15和seqidno.:16。在一些實施方案中,本發明,該雙特異性抗體包含對dr5特異性的抗原結合位點,其包含:(a)seqidno.:1的重鏈cdr1;(b)seqidno.:2的重鏈cdr2;(c)seqidno.:3的重鏈cdr3;(d)seqidno.:4的輕鏈cdr1;(e)seqidno.:5的輕鏈cdr2;(f)seqidno.:6的輕鏈cdr3,和對fap特異性的抗原結合位點,其包含:(a)seqidno.:9的重鏈cdr1;(b)seqidno.:10的重鏈cdr2;(c)seqidno.:11的重鏈cdr3;(d)seqidno.:12的輕鏈cdr1;(e)seqidno.:13的輕鏈cdr2;(f)seqidno.:14的輕鏈cdr3。在一個實施方案中,該雙特異性抗體包含至少一個對dr5特異性的抗原結合位點,其包含包含seqidno.:7的氨基酸序列的可變重鏈和包含seqidno.:8的氨基酸序列的可變輕鏈,和至少一個對fap特異性的抗原結合位點,其包含包含seqidno.:15的氨基酸序列的重鏈可變區和包含seqidno.:16的氨基酸序列的輕鏈可變區。在一些實施方案中,本發明,該雙特異性抗體包含seqidno:18,19和20的氨基酸序列,或者該雙特異性抗體包含seqidno:17,19和20的氨基酸序列在本發明的所有方面,有利的是,所述雙特異性抗體是人的或人源化的。在一些實施方案中,該雙特異性抗體包含一個fc域,至少一個包含對dr5特異性的抗原結合位點的fab片段,和至少一個包含對fap特異性的抗原結合位點的fab片段。在一些實施方案中,該雙特異性抗體包含一個fc域,兩個各自包含對dr5特異性的抗原結合位點的fab片段,和兩個各自包含對fap特異性的抗原結合位點的fab片段。在一些實施方案中,該雙特異性抗體對dr5和fap二者是二價的。在一些實施方案中,該雙特異性抗體包含一個或多個包含對fap特異性的抗原結合位點的fab片段,其中重和輕鏈的可變區或恒定區是交換的。在一些實施方案中,該雙特異性抗體包含一個fc域,至少一個包含對dr5特異性的抗原結合位點的fab片段,和至少一個包含對fap特異性的抗原結合位點的fab片段,其中至少一個fab片段的重和輕鏈的可變區或恒定區任一是交換的。在一些實施方案中,該雙特異性抗體包含:a)一個fc域,b)兩個包含對dr5特異性的抗原結合位點的fab片段,其中所述fab片段在恒定重鏈(ch1)的c末端處連接至該fc域的第一或第二亞基,c)兩個包含對fap特異性的抗原結合位點的fab片段,其中該兩個fab片段在可變重鏈(vh)的n末端處連接至該fc域的第一或第二亞基。在一個實施方案中,至少一個所述fab片段經肽接頭連接至該fc域。在一個實施方案中,所述雙特異性抗體包含一個fc域,其包含一處或多處降低對fc受體的結合和/或效應器功能的氨基酸替代。在一個實施方案中,所述一處或多處氨基酸替代在一個或多個選自下組的位置:l234,l235,和p329。在一個實施方案中,該fc域的每個亞基包含三處消除對活化性或抑制性fc受體的結合和/或效應器功能的氨基酸替代,其中所述氨基酸替代為l234a,l235a和p329g。在又一個方面,本發明提供一種藥物組合物,其包含本文所述雙特異性抗體和選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑,bcl-2抑制劑,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑,異磷酰胺或抗vegf抗體的化療劑。在一個實施方案中,該藥物組合物包含本文所述雙特異性抗體,吉西他濱和帕利他賽或abraxane。在一個實施方案中,該mdm2抑制劑為rg7388。在一個實施方案中,該bcl-2抑制劑為abt199。在一個實施方案中,該parp抑制劑為pj34。在一個實施方案中,該parp抑制劑為olaparip。在又一個方面,本發明提供一種藥物組合物,其包含本文所述雙特異性抗體和選自伊立替康,多柔比星,奧沙利鉑,異磷酰胺或抗vegf抗體的化療劑。在又一個方面,本發明提供一種藥物組合物,其包含本文所述雙特異性抗體和伊立替康。在又一個方面,本發明提供一種藥物組合物,其包含本文所述雙特異性抗體,帕利他賽和吉西他濱或abraxane。在又一個方面,本發明提供結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和化療劑的組合在制造用于治療癌癥的藥物中的用途,其中該雙特異性抗體與選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑,bcl-2抑制劑abt199,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑,異磷酰胺或抗vegf抗體的化療劑組合使用。在一個方面,本發明提供結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體,帕利他賽和abraxane的組合在制造用于治療癌癥的藥物中的用途。在又一個方面,本發明提供結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和化療劑的組合在制造用于治療癌癥的藥物中的用途,其中該雙特異性抗體與選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑rg7388,bcl-2抑制劑abt199,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑pj34,異磷酰胺或抗vegf抗體的化療劑組合使用。在又一個方面,本發明提供一種試劑盒,其包含:(i)第一容器,裝有包含本文所述雙特異性抗體的組合物;和(ii)第二容器,裝有包含選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑,bcl-2抑制劑,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑,異磷酰胺或抗vegf抗體的化療劑的組合物。在又一個方面,本發明提供一種試劑盒,其包含:(i)第一容器,裝有包含本文所述雙特異性抗體的組合物;和(ii)第二容器,裝有包含選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑rg7388,bcl-2抑制劑abt199,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑pj34,異磷酰胺或抗vegf抗體的化療劑的組合物。在又一個方面,本發明提供一種試劑盒,其包含:(i)第一容器,裝有包含本文所述雙特異性抗體的組合物;和(ii)第二容器,裝有abraxane;和(iii)第三容器,裝有吉西他濱。在又一個方面,本發明提供一種用于治療癌癥的方法,其包括作為組合配制劑或交替地將治療劑組合施用于哺乳動物,其中該治療劑組合包含治療有效量的包含至少一個對dr5特異性的抗原結合位點和至少一個對fap特異性的抗原結合位點的結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和治療有效量的選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑,bcl-2抑制劑,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑,異磷酰胺或抗vegf抗體的化療劑。在又一個方面,本發明提供一種用于治療癌癥的方法,其包括作為組合配制劑或交替地將治療劑組合施用于哺乳動物,其中該治療劑組合包含治療有效量的包含至少一個對dr5特異性的抗原結合位點和至少一個對fap特異性的抗原結合位點的結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和治療有效量的選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑rg7388,bcl-2抑制劑abt199,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑pj34,異磷酰胺或抗vegf抗體的化療劑。在又一個方面,本發明提供一種用于治療癌癥的方法,其包括作為組合配制劑或交替地將治療劑組合施用于哺乳動物,其中該治療劑組合包含治療有效量的包含至少一個對dr5特異性的抗原結合位點和至少一個對fap特異性的抗原結合位點的結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和治療有效量的abraxane和治療有效量的吉西他濱。在一些實施方案中,該癌癥為結直腸癌,肉瘤,頭和頸癌,鱗狀細胞癌,乳腺癌,胰腺癌,胃癌,非小細胞肺癌,小細胞肺癌,結締組織增生性黑素瘤和間皮瘤。在一個實施方案中,該癌癥為結直腸癌。在其它實施方案中,該肉瘤為軟骨肉瘤,平滑肌肉瘤,胃腸基質腫瘤,纖維肉瘤,骨肉瘤,脂肪肉瘤或惡性纖維組織細胞瘤。在一些實施方案中,該雙特異性抗體和該化療劑一起施用,任選作為組合配制劑。或者,該雙特異性抗體和該化療劑可以交替施用,或是該化療劑在該雙特異性抗體之前施用,或是該化療劑在該雙特異性抗體之后施用。該組合可以依照臨床實踐來施用,例如以約一周至三周的間隔施用。現在會參考附圖通過舉例而非限制的方式描述本發明的實施方案。然而,鑒于本公開文本,本發明的各種別的方面和實施方案對于本領域技術人員會是顯而易見的。“和/或”在本文中使用時要視為具體公開兩個規定特征或組件的每一個,具有或沒有另一個。例如,“a和/或b”要視為具體公開(i)a,(ii)b和(iii)a和b中的每一個,就像在本文中單獨列出每一個一樣。除非上下文另有規定,上文列出的特征的描述和定義不限于本發明的任何特定方面或實施方案,而且同等地應用于所描述的所有方面和實施方案。附圖簡述圖1。fap-dr5雙特異性抗體分子設計和作用模式的示意性呈現。圖2。對于單獨的和與10μm伊立替康組合的多種濃度的dr5抗體+fc,3天時ht29crc細胞的%抑制(細胞存活力測定法)的圖。圖3。對于單獨的和與20nmabraxane(nab-帕利他賽)組合的多種濃度的dr5抗體+fc,3天時bxpc3細胞的%抑制(細胞存活力測定法)的圖。圖4。對于單獨的和與20nm硼替佐米組合的多種濃度的dr5抗體+fc,3天時capan2pdac細胞的%抑制(細胞存活力測定法)的圖。圖5。用媒介,dr5-fap雙特異性抗體(1和10mg/kg)或drozitumablala(10mg/kg)任一處理的攜帶dld-1crc異種移植物的小鼠中體內中值腫瘤體積隨時間的變化的圖。第9至20天動物用dr5-fap雙特異性抗體處理4次,并用drozitumablala處理一周一次。dr5-fap處理的腫瘤生長抑制分別計算為89%(10mg/kg)和79%(1.0mg/kg)。圖6。用媒介,dr5-fap雙特異性抗體(10mg/kg),伊立替康(15mg/kg)或dr5-fap雙特異性抗體和伊立替康的組合任一處理的攜帶dld-1crc異種移植物的小鼠中體內中值腫瘤體積隨時間的變化的圖。動物用dr5-fap雙特異性抗體一周一次處理5次,并每5天用伊立替康處理總共3次。dr5-fap和伊立替康組合處理的腫瘤消退計算為72%。圖7。用媒介,dr5-fap雙特異性抗體(10mg/kg),伊立替康(15mg/kg)或平行或順序應用的dr5-fap雙特異性抗體和伊立替康的組合任一處理的攜帶dld-1crc異種移植物的小鼠中體內中值腫瘤體積隨時間的變化的圖。動物自第7天起一周一次用dr5-fap雙特異性抗體靜脈內處理5次(第7,14,21,28,35天),并5天每天用伊立替康腹膜內處理總共3個周期(第7-11,19-23,33-36天)圖8。用媒介,dr5-fap雙特異性抗體(10mg/kg),伊立替康(15mg/kg)或dr5-fap雙特異性抗體和伊立替康的組合任一處理的攜帶hct116crc異種移植物的小鼠中體內中值腫瘤體積隨時間的變化的圖。動物自第7天起一周一次用dr5-fap雙特異性抗體處理3次,并每5天用伊立替康處理總共2次。dr5-fap處理的腫瘤生長抑制計算為46%,而且含伊立替康的組合誘導腫瘤消退(tgi>100%)。圖9。用媒介,dr5-fap雙特異性抗體(10mg/kg),奧沙利鉑(5mg/kg)或dr5-fap雙特異性抗體和奧沙利鉑的組合任一處理的攜帶hct116crc異種移植物的小鼠中體內中值腫瘤體積隨時間的變化的圖。動物自第7天起一周一次用dr5-fap雙特異性抗體處理3次(第7,14,21天),并用奧沙利鉑腹膜內處理總共2個周期(第7-10,21-23天)。dr5-fap和奧沙利鉑組合處理的腫瘤生長抑制計算為67%。圖10。用媒介,dr5-fap雙特異性抗體(10mg/kg)或drozitumablala(10mg/kg)任一處理的攜帶lox-imvi結締組織增生性黑素瘤異種移植物的小鼠中體內中值腫瘤體積隨時間的變化的圖。動物第13至20天用dr5-fap雙特異性抗體或drozitumablala處理兩次。dr5-fap處理的腫瘤生長抑制計算為超過100%,而drozitumablala處理計算為65%。圖11。用媒介或dr5-fap雙特異性抗體(30mg/kg)任一處理的攜帶患者衍生co5896crc異種移植物的小鼠中體內中值腫瘤體積隨時間的變化的圖。動物第18至34天用dr5-fap雙特異性抗體處理6次。dr5-fap處理的腫瘤生長抑制計算為76%。圖12。用媒介,dr5-fap雙特異性抗體(30mg/kg),伊立替康(15mg/kg)或dr5-fap雙特異性抗體和伊立替康的組合任一處理的攜帶患者衍生co5896crc異種移植物的小鼠中體內中值腫瘤體積隨時間的變化的圖。動物一周一次用dr5-fap雙特異性抗體處理4次,并第15-19天用伊立替康處理。dr5-fap和伊立替康組合處理在所有動物中導致完全腫瘤消退(10/10)。圖13。顯示攜帶患者衍生co5896crc異種移植物的小鼠中的fap+基質的ihc圖像。圖14。用媒介或dr5-fap雙特異性抗體(10mg/kg)任一處理的攜帶患者衍生sarc4605肉瘤異種移植物的小鼠中體內中值腫瘤體積隨時間的變化的圖。動物第10至31天用dr5-fap雙特異性抗體處理4次。dr5-fap處理的腫瘤生長抑制計算為超過100%。圖15。用媒介,dr5-fap雙特異性抗體(10mg/kg),ang2/vegf雙特異性抗體(10mg/kg)或dr5-fap雙特異性抗體(10mg/kg)和ang2/vegf雙特異性抗體(10mg/kg)的組合任一處理的攜帶dld-1crc異種移植物的小鼠中體內中值腫瘤體積隨時間的變化的圖。兩種抗體均在第8,15和22天一周一次給予。雖然dr5-fap抗體作為單一藥劑的處理導致顯著的腫瘤生長抑制(tgi87%),含抗ang/vegf單抗的組合具有疊加的功效并將腫瘤生長抑制提高至94%。單獨的ang2/vegf抗體處理以75%抑制腫瘤生長。圖16。用媒介,dr5-fap雙特異性抗體(10mg/kg)或多柔比星(5mg/kg)或dr5-fap雙特異性抗體(10mg/kg)和多柔比星(5mg/kg)的組合任一處理的攜帶lox-imvi結締組織增生性黑素瘤異種移植物的小鼠中體內中值腫瘤體積隨時間的變化的圖。動物第8至15天用dr5-fap雙特異性抗體或組合處理兩次。雖然dr5-fap抗體(10mg/kg,第8和15天)作為單一藥劑的處理導致腫瘤停滯(tgi97%),含多柔比星的組合具有大于疊加的功效并引起明顯的腫瘤消退(93%)。單獨的多柔比星處理以77%抑制腫瘤生長。圖17。用媒介,dr5-fap雙特異性抗體(10mg/kg),多柔比星(5mg/kg),或dr5-fap雙特異性抗體(10mg/kg)和多柔比星(5mg/kg)的組合任一處理的攜帶患者衍生sarc4605肉瘤異種移植物的小鼠中體內中值腫瘤體積隨時間的變化的圖。動物第20至41天用dr5-fap雙特異性抗體或組合處理4次。雖然dr5-fap抗體(10mg/kg,第20,27,34和41天)作為單一藥劑的處理導致腫瘤停滯(tgi99%),含多柔比星的組合具有大于疊加的功效并引起明顯的腫瘤消退(83%)。單獨的多柔比星處理以77%抑制腫瘤生長。圖18。用媒介,dr5-fap雙特異性抗體(10mg/kg),吉西他濱(40mg/kg),吉西他濱(40mg/kg)和nab-帕利他賽(6mg/kg),或dr5-fap雙特異性抗體(10mg/kg)和吉西他濱(40mg/kg)和nab-帕利他賽(6mg/kg)的組合任一處理的攜帶患者衍生pa1178pdac異種移植物的小鼠中體內中值腫瘤體積隨時間的變化的圖。動物第32至81天用dr5-fap雙特異性抗體或組合處理7次。雖然dr5-fap抗體作為單一藥劑的處理導致96%的腫瘤生長抑制,三重組合是有效的,實現完全腫瘤消退。圖19。用媒介,dr5-fap雙特異性抗體(10mg/kg),異磷酰胺(100mg/kg),或dr5-fap雙特異性抗體(10mg/kg)和異磷酰胺(100mg/kg)的組合任一處理的攜帶患者衍生sarc4605肉瘤異種移植物的小鼠中體內中值腫瘤體積隨時間的變化的圖。動物第20至41天用dr5-fap雙特異性抗體或組合處理4次,dr5-fap雙特異性抗體(10mg/kg)與烷化藥物異磷酰胺(100mg/kg,q7dx2)組合。單獨的dr5-fap抗體(10mg/kg,q7dx8)處理導致較強的腫瘤消退(96%及80%無腫瘤),而含異磷酰胺的組合具有略微更高的功效(86%無腫瘤)。另外,組合中的腫瘤消退的動力學更快。圖20。在用單一藥劑雙特異性dr5-fap抗體(10mg/kg;dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)處理之后的luminex數據。雙特異性dr5-fap抗體針對dld-1/3t3異種移植物誘導較強的時間相關腫瘤細胞凋亡。在抗體處理之后不久(6小時)觀察到較強的效果。圖21。在用單一藥劑雙特異性dr5-fap抗體(10mg/kg;dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)或與多柔比星(10mg/kg)組合處理之后的luminex數據。雙特異性dr5-fap抗體以時間相關方式強烈誘導腫瘤細胞凋亡。雙特異性dr5-fap抗體與多柔比星一起的組合處理的腫瘤細胞凋亡誘導是卓越的。a:誘導受到切割的胱天蛋白酶-3(效應器胱天蛋白酶)的分析。b:誘導活化的胱天蛋白酶-8(外在的凋亡途徑)的分析。c:誘導活化的胱天蛋白酶-9(內在的凋亡途徑)的分析。圖22。在用單一藥劑雙特異性dr5-fap抗體(10mg/kg;dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)或與伊立替康(15mg/kg)或奧沙利鉑(5mg/kg)組合處理之后的luminex數據。雙特異性dr5-fap抗體以時間相關方式強烈誘導腫瘤細胞凋亡。雙特異性dr5-fap抗體與伊立替康或奧沙利鉑一起的組合處理的腫瘤細胞凋亡誘導是卓越的。a:誘導受到切割的parp的分析。b:誘導胱天蛋白酶-3(效應器胱天蛋白酶)的分析。c:誘導活化的胱天蛋白酶-9(內在的凋亡途徑)的分析。d:誘導活化的胱天蛋白酶-8(外在的凋亡途徑)的分析。發明詳述i.定義出于本文中的目的,“受體人框架”指包含自人免疫球蛋白框架或如下文定義的人共有框架衍生的輕鏈可變域(vl)框架或重鏈可變域(vh)框架的氨基酸序列的框架。自人免疫球蛋白框架或人共有框架“衍生”的受體人框架可以包含其相同的氨基酸序列,或者它可以含有氨基酸序列變化。在一些實施方案中,氨基酸變化的數目是10或更少,9或更少,8或更少,7或更少,6或更少,5或更少,4或更少,3或更少,或2或更少。在一些實施方案中,vl受體人框架與vl人免疫球蛋白框架序列或人共有框架序列在序列上相同。“親和力”指分子(例如抗體)的單一結合位點與其結合配偶體(例如抗原)之間全部非共價相互作用總和的強度。除非另有指示,如本文中使用的,“結合親和力”指反映結合對的成員(例如抗體和抗原)之間1:1相互作用的內在結合親和力。分子x對其配偶體y的親和力通常可以用解離常數(kd)來表述。親和力可以通過本領域知道的常用方法來測量,包括本文中所描述的方法。下文描述了用于測量結合親和力的具體的說明性和例示性的實施方案。“親和力成熟的”抗體指在一個或多個高變區(hvr)中具有一處或多處改變的抗體,與不擁有此類改變的親本抗體相比,此類改變導致該抗體對抗原的親和力改善。術語“特異性結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體”指如下的雙特異性抗體,其能夠以足夠親和力結合dr5和fap,使得該抗體可用作靶向表達dr5和fap的細胞的診斷劑和/或治療劑。具體而言,“特異性結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體”指靶向腫瘤細胞上的dr5和所述腫瘤周圍的基質中的fap的雙特異性抗體。在一個實施方案中,特異性結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體結合無關非fap或非dr5蛋白質的程度小于該抗體對dr5或fap的結合的約10%,如例如通過酶聯免疫吸附測定法(elisa),基于表面等離振子共振(spr)的測定法(例如biacore)或流式細胞術(facs)測量的。在某些實施方案中,特異性結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體具有≤1μm,≤100nm,≤10nm,≤1nm,≤0.1nm,≤0.01nm,或≤0.001nm(例如10-8m或更少,例如10-8m至10-13m,例如,10-9m至10-13m)的解離常數(kd)。在某些實施方案中,特異性結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體結合在來自不同物種的dr5或fap間保守的dr5或fap表位。優選地,所述雙特異性抗體結合人和獼猴dr5及人,獼猴和小鼠fap。術語“特異性結合死亡受體5(dr5)的抗體”指如下的抗體,其能夠以足夠親和力結合dr5,使得該抗體可用作靶向表達dr5的細胞的診斷劑和/或治療劑。在一個實施方案中,特異性結合死亡受體5(dr5)的抗體結合無關非dr5蛋白質的程度小于該抗體對dr5的結合的約10%,如例如通過放射免疫測定法(ria)或流式細胞術(facs)測量的。在某些實施方案中,特異性結合死亡受體5(dr5)的抗體具有≤1μm,≤100nm,≤10nm,≤1nm,≤0.1nm,≤0.01nm,或≤0.001nm(例如10-8m或更少,例如10-8m至10-13m,例如,10-9m至10-13m)的解離常數(kd)。在某些實施方案中,特異性結合死亡受體5(dr5)的抗體結合在來自不同物種的dr5間保守的dr5表位。優選地,所述抗體結合人和獼猴dr5。術語“特異性結合死亡受體5(dr5)的抗體”還涵蓋能夠結合dr5和第二抗原的雙特異性抗體。本文中的術語“抗體”以最廣義使用,并且涵蓋各種抗體結構,包括但不限于單克隆抗體,多克隆抗體,多特異性抗體(例如雙特異性抗體),和抗體片段,只要它們展現出期望的抗原結合活性。“抗體片段”指與完整抗體不同的分子,其包含完整抗體中的如下部分,該部分結合完整抗體所結合的抗原。抗體片段的例子包括但不限于fv,fab,fab’,fab’-sh,f(ab’)2;雙抗體;cross-fab片段;線性抗體;單鏈抗體分子(例如scfv);和由抗體片段形成的多特異性抗體。例如,scfv抗體記載于huston,j.s.,methodsinenzymol.203(1991)46-96。另外,抗體片段包含具有vh域或vl域的特征(即能夠與vl域或vh域一起裝配成功能性抗原結合位點,并且由此提供全長抗體的抗原結合特性)的單鏈多肽。如本文中使用的,“fab片段”指包含輕鏈片段(其包含vl域和輕鏈恒定域(cl))及vh域和重鏈第一恒定域(ch1)的抗體片段。在一個實施方案中,本發明的雙特異性抗體包含至少一個fab片段,其中重和輕鏈的可變區或恒定區任一是交換的。由于可變區或恒定區任一的交換,所述fab片段也稱作“cross-fab”片段或“xfab”片段或“交換fab”片段。交換fab分子的兩種不同鏈組成是可能的且包含在本發明的雙特異性抗體中:一方面,fab重和輕鏈的可變區是交換的,即交換fab分子包含由輕鏈可變區(vl)和重鏈恒定區(ch1)構成的一條肽鏈及由重鏈可變區(vh)和輕鏈恒定區(cl)構成的一條肽鏈。這種交換fab分子也稱作crossfab(vlvh)。另一方面,當fab重和輕鏈的恒定區交換時,交換fab分子包含由重鏈可變區(vh)和輕鏈恒定區(cl)構成的一條肽鏈及由輕鏈可變區(vl)和重鏈恒定區(ch1)構成的一條肽鏈。這種交換fab分子也稱作crossfab(clch1)。包含交換fab片段的雙特異性抗體型式已有描述,例如在wo2009/080252,wo2009/080253,wo2009/080251,wo2009/080254,wo2010/136172,wo2010/145792和wo2013/026831中。“單鏈fab片段”或“scfab”是由抗體重鏈可變域(vh),抗體恒定域1(ch1),抗體輕鏈可變域(vl),抗體輕鏈恒定域(cl)和接頭組成的多肽,其中所述抗體域和所述接頭n端至c端方向具有下述次序之一:a)vh-ch1-接頭-vl-cl,b)vl-cl-接頭-vh-ch1,c)vh-cl-接頭-vl-ch1或d)vl-ch1-接頭-vh-cl;且其中所述接頭是至少30個氨基酸,優選介于32和50個氨基酸之間的多肽。所述單鏈fab片段a)vh-ch1-接頭-vl-cl,b)vl-cl-接頭-vh-ch1,c)vh-cl-接頭-vl-ch1和d)vl-ch1-接頭-vh-cl經cl域和ch1域之間的天然二硫鍵穩定化。另外,通過經插入半胱氨酸殘基(例如可變重鏈中的位置44和可變輕鏈中的位置100,依照kabat編號方式)生成鏈間二硫鍵可以進一步穩定化這些單鏈fab分子。術語“n端”表示n端最后一個氨基酸,術語“c端”表示c端最后一個氨基酸。“融合”或“連接”表示各成分(例如fab分子和fc域亞基)是通過肽鍵相連接的,或是直接的或是經由一個或多個肽接頭。如本文中使用的,術語“接頭”指肽接頭且優選是具有長度為至少5個氨基酸,優選長度為5-100個,更優選10-50個氨基酸的氨基酸序列的肽。在一個實施方案中,所述肽接頭是(gxs)n或(gxs)ngm,其中g=甘氨酸,s=絲氨酸,且(x=3,n=3,4,5或6且m=0,1,2或3)或(x=4且n=2,3,4或5且m=0,1,2或3),優選地x=4且n=2或3,更優選地x=4且n=2。在一個實施方案中,所述肽接頭是(g4s)2。術語“免疫球蛋白分子”指具有天然存在的抗體結構的蛋白質。例如,igg類的免疫球蛋白是約150,000道爾頓的異四聚體糖蛋白,其由二硫鍵連接的兩條輕鏈和兩條重鏈構成。從n端至c端,每條重鏈具有可變區(vh),也稱為可變重域或重鏈可變域,接著是3個恒定域(ch1,ch2和ch3),也稱為重鏈恒定區。類似地,從n端至c端,每條輕鏈具有可變區(vl),也稱為可變輕域或輕鏈可變域,接著是恒定輕(cl)域(也稱為輕鏈恒定區)。免疫球蛋白的重鏈可以歸入稱為α(iga),δ(igd),ε(ige),γ(igg)或μ(igm)的5類之一,其中一些可以進一步分成亞類,例如γ1(igg1),γ2(igg2),γ3(igg3),γ4(igg4),α1(iga1)和α2(iga2)。基于其恒定域的氨基酸序列,免疫球蛋白的輕鏈可以歸入稱為卡帕(κ)和拉姆達(λ)的兩類之一。免疫球蛋白基本由經由免疫球蛋白鉸鏈區連接的兩個fab分子和fc域組成。與參照抗體“結合相同表位的抗體”指在競爭測定法中將參照抗體對其抗原的結合阻斷50%或更多的抗體,且相反,參照抗體在競爭測定法中將該抗體對其抗原的結合阻斷50%或更多。本文中提供了例示性的競爭測定法。術語“抗原結合域”指抗原結合分子中包含特異性結合部分或整個抗原并與部分或整個抗原互補的區域的部分。在抗原較大的情況中,抗原結合分子可以僅結合抗原的特定部分,該部分稱作表位。抗原結合域可以由例如一個或多個抗體可變域(也稱作抗體可變區)提供。優選地,抗原結合域包含抗體輕鏈可變區(vl)和抗體重鏈可變區(vh)。術語“嵌合”抗體指其中重和/或輕鏈的一部分自特定的來源或物種衍生,而重和/或輕鏈的剩余部分自不同來源或物種衍生的抗體,其通常通過重組dna技術來制備。包含家兔可變區和人恒定區的嵌合抗體是優選的。本發明涵蓋的“嵌合抗體”的其它優選形式是那些其中恒定區已經自初始抗體的恒定區修飾或改變以生成依照本發明的特性(特別地關于c1q結合/或fc受體(fcr)結合)的。此類嵌合抗體又稱為“類轉換抗體”。嵌合抗體是包含編碼免疫球蛋白可變區的dna區段和編碼免疫球蛋白恒定區的dna區段的免疫球蛋白基因的表達產物。用于生成嵌合抗體的方法牽涉常規的重組dna和基因轉染技術,其是本領域中公知的。參見例如morrison,s.l.等,proc.natl.acad.sci.usa81(1984)6851-6855;美國專利no.5,202,238和5,204,244。在用于本文時,術語“細胞毒劑”指抑制或阻止細胞功能和/或引起細胞死亡或破壞的物質。細胞毒劑包括但不限于:放射性同位素(例如at211,i131,i125,y90,re186,re188,sm153,bi212,p32,pb212和lu的放射性同位素);化學治療劑或藥物(例如甲氨蝶呤(methotrexate),阿霉素(adriamicin),長春花生物堿類(vincaalkaloids)(長春新堿(vincristine),長春堿(vinblastine),依托泊苷(etoposide)),多柔比星(doxorubicin),美法侖(melphalan),絲裂霉素(mitomycin)c,苯丁酸氮芥(chlorambucil),柔紅霉素(daunorubicin)或其它嵌入劑);生長抑制劑;酶及其片段,諸如溶核酶;抗生素;毒素,諸如小分子毒素或者細菌,真菌,植物或動物起源的酶活性毒素,包括其片段和/或變體;及下文公開的各種抗腫瘤或抗癌劑。“效應器功能”指那些可歸于抗體fc區且隨抗體同種型而變化的生物學活性。抗體效應器功能的例子包括:c1q結合和補體依賴性細胞毒性(cdc),fc受體結合,抗體依賴性細胞介導的細胞毒性(adcc),抗體依賴性細胞吞噬作用(adcp),細胞因子分泌,免疫復合物介導的抗原呈遞細胞的抗原攝取,細胞表面受體(例如b細胞受體)下調和b細胞活化。如本文中使用的,術語“工程化”視為包括對肽主鏈的任何操作或對天然存在或重組的多肽或其片段的翻譯后修飾。工程化包括對氨基酸序列,糖基化模式或各氨基酸側鏈基團的修飾,以及這些辦法的組合。如本文中使用的,術語“氨基酸突變”意為涵蓋氨基酸替代,缺失,插入和修飾。可以進行取代,缺失,插入和修飾的任意組合來實現最終構建體,只要最終構建體擁有期望的特性,例如降低的對fc受體的結合,或與另一種肽的增加的聯合。氨基酸序列缺失和插入包括氨基和/或羧基端缺失和氨基酸插入。具體的氨基酸突變是氨基酸替代。為了改變例如fc區的結合特征,特別優選非保守性的氨基酸替代,即將一個氨基酸用具有不同結構和/或化學特性的另一種氨基酸替換。氨基酸替代包括由非天然存在的氨基酸或由20種標準氨基酸的天然存在的氨基酸衍生物(例如4-羥脯氨酸,3-甲基組氨酸,鳥氨酸,高絲氨酸,5-羥賴氨酸)替換。可以使用本領域中公知的遺傳或化學方法生成氨基酸突變。遺傳方法可以包括定點誘變,pcr,基因合成等。通過與遺傳工程化不同的方法如化學修飾來改變氨基酸側鏈基團的方法也可能可用。本文中可使用各種名稱來指示同一氨基酸突變。例如,從fc域第329位脯氨酸到甘氨酸的取代可指示為329g,g329,g329,p329g或pro329gly。藥劑(例如藥物配制劑)的“有效量”指在必需的劑量和時段上有效實現期望的治療或預防結果的量。本文中術語“fc域”或“fc區”用于定義免疫球蛋白重鏈中至少含有恒定區的一部分的c端區域。該術語包括天然序列fc區和變體fc區。雖然igg重鏈的fc區的邊界可以略微變化,但是人igg重鏈fc區通常定義為自cys226或pro230延伸至重鏈的羧基端。然而,可以存在或不存在fc區的c端賴氨酸(lys447)。除非本文中另外指定,fc區或恒定區中氨基酸殘基的編號方式依照eu編號系統,也稱為eu索引,如記載于kabat等,sequencesofproteinsofimmunologicalinterest,第5版publichealthservice,nationalinstitutesofhealth,bethesda,md,1991的。如本文中使用的,fc域的“亞基”指形成二聚體fc域的兩個多肽之一,即包含免疫球蛋白重鏈中能夠穩定自身聯合的c端恒定區的多肽。例如,iggfc域的亞基包含iggch2和iggch3恒定域。“促進fc域的第一和第二亞基聯合的修飾”是降低或防止包含fc域亞基的多肽與相同多肽聯合以形成同二聚體的肽主鏈操作或fc域亞基的翻譯后修飾。如本文中使用的,具體地,促進聯合的修飾包括對期望聯合的兩個fc域亞基(即fc域的第一和第二亞基)中的每一個進行的分開的修飾,其中所述修飾彼此互補,從而促進兩個fc域亞基的聯合。例如,促進聯合的修飾可以改變一種或兩種fc域亞基的結構或電荷,從而在立體或靜電上分別促進它們的聯合。如此,異二聚化在包含第一fc域亞基的多肽和包含第二fc域亞基的多肽之間發生,其在融合至每個亞基的別的組分(例如抗原結合模塊)不同這一意義上講可能是不相同的。在一些實施方案中,促進聯合的修飾包含在fc域中的氨基酸突變,具體為氨基酸替代。在一個具體的實施方案中,促進聯合的修飾包含fc域的兩個亞基的每一個中分開的氨基酸突變,具體為氨基酸替代。“框架”或“fr”指除高變區(hvr)殘基外的可變域殘基。一般地,可變域的fr由4個fr域組成:fr1,fr2,fr3,和fr4。因而,hvr和fr序列在vh(或vl)中一般以如下的順序出現:fr1-h1(l1)-fr2-h2(l2)-fr3-h3(l3)-fr4。術語“全長抗體”,“完整抗體”,和“全抗體”在本文中可互換使用,指與天然抗體結構具有基本上類似的結構或者具有含有如本文中所限定的fc區的重鏈的抗體。術語“宿主細胞”,“宿主細胞系”,和“宿主細胞培養物”可互換使用,并且指已經導入外源核酸的細胞,包括此類細胞的后代。宿主細胞包括“轉化體”和“經轉化的細胞”,其包括原代的經轉化的細胞及自其衍生的后代而不考慮傳代的次數。后代在核酸內容物上可以與親本細胞不完全相同,而是可以含有突變。本文中包括具有與在初始轉化細胞中篩選或選擇的相同功能或生物學活性的突變體后代。“人抗體”指擁有與由人或人細胞生成的或利用人抗體全集或其它人抗體編碼序列自非人來源衍生的抗體的氨基酸序列對應的氨基酸序列的抗體。人抗體的此定義明確排除包含非人抗原結合殘基的人源化抗體。正如關于依照本發明的嵌合和人源化抗體也提及的,如本文中使用的,術語“人抗體”也包含恒定區中經過修飾以生成依照本發明的特性的此類抗體,尤其在c1q結合和/或fcr結合方面,例如通過“類轉換”即fc部分的改變或突變(例如自igg1至igg4和/或igg1/igg4突變)。如本文中所使用的,術語“重組人抗體”意圖包括通過重組手段制備,表達,創建或分離的所有人抗體,諸如自宿主細胞諸如ns0或cho細胞或者自對于使用轉染入宿主細胞中的重組表達載體表達的人免疫球蛋白基因或抗體而言轉基因的動物(例如小鼠)分離的抗體。此類重組人抗體具有重排形式的可變和恒定區。依照本發明的重組人抗體已經進行過體內體細胞超突變。如此,重組抗體的vh和vl區的氨基酸序列是雖然自人種系vh和vl序列衍生及與其相關,但可以不天然存在于體內的人抗體種系全集內的序列。“人共有框架”指代表人免疫球蛋白vl或vh框架序列選集中最常存在的氨基酸殘基的框架。通常,人免疫球蛋白vl或vh序列選集來自可變域序列亞組。通常,序列亞組是如kabat等,sequencesofproteinsofimmunologicalinterest,第五版,nihpublication91-3242,bethesdamd(1991),第1-3卷中的亞組。在一個實施方案中,對于vl,亞組是如kabat等,見上文中的亞組κi。在一個實施方案中,對于vh,亞組是如kabat等,見上文中的亞組iii。“人源化”抗體指包含來自非人hvr的氨基酸殘基和來自人fr的氨基酸殘基的嵌合抗體。在某些實施方案中,人源化抗體會包含至少一個,通常兩個基本上整個可變域,其中所有或基本上所有hvr(例如,cdr)對應于非人抗體的那些,且所有或基本上所有fr對應于人抗體的那些。任選地,人源化抗體可以至少包含自人抗體衍生的抗體恒定區的一部分。抗體(例如非人抗體)的“人源化形式”指已經經歷人源化的抗體。本發明涵蓋的“人源化抗體”的其它形式是那些其中的恒定區已經另外自初始抗體的恒定區進行過修飾或改變以生成依照本發明的特性(特別地關于c1q結合/或fc受體(fcr)結合)的。在用于本文時,術語“高變區”或“hvr”指抗體可變域中在序列上高變的和/或形成結構上限定的環(“高變環”)的每個區。一般地,天然的4鏈抗體包含6個hvr;三個在vh中(h1,h2,h3),且三個在vl中(l1,l2,l3)。hvr一般包含來自高變環和/或來自“互補決定區”(cdr)的氨基酸殘基,后一種是最高序列變異性的和/或牽涉抗原識別。例示性高變環存在于氨基酸殘基26-32(l1),50-52(l2),91-96(l3),26-32(h1),53-55(h2),和96-101(h3)(chothiaandlesk,j.mol.biol.196:901-917(1987))。例示性cdr(cdr-l1,cdr-l2,cdr-l3,cdr-h1,cdr-h2和cdr-h3)存在于氨基酸殘基24-34(l1),50-56(l2),89-97(l3),31-35b(h1),50-65(h2),和95-102(h3)(kabatetal.,sequencesofproteinsofimmunologicalinterest,5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md(1991))。高變區(hvr)也稱作互補決定區(cdr),而且這些術語在述及形成抗原結合區的可變區部分時在本文中可交換使用。此特定區域已由kabat等,u.s.dept.ofhealthandhumanservices,sequencesofproteinsofimmunologicalinterest(1983)及由chothia等,jmolbiol196:901-917(1987)描述,其中定義包括在彼此比較時氨基酸殘基的重疊或子集。然而,應用任一種定義來指抗體或其變體的cdr意圖在如本文中定義和使用的術語的范圍內。涵蓋如由上文引用的每篇參考文獻定義的cdr的適宜的氨基酸殘基在下表a中列出作為比較。涵蓋特定cdr的確切殘基編號將隨著cdr的序列和大小而變化。鑒于抗體的可變區氨基酸序列,本領域技術人員可以常規確定哪些殘基構成特定cdr。表a:cdr定義1cdrkabatchothiaabm2vhcdr131-3526-3226-35vhcdr250-6552-5850-58vhcdr395-10295-10295-102vlcdr124-3426-3224-34vlcdr250-5650-5250-56vlcdr389-9791-9689-971表a中所有cdr定義的編號方式依照由kabat等(見下文)提出的編號慣例。2如表a中使用的具有小寫字母“b”的“abm”指由oxfordmolecular的“abm”抗體建模軟件定義的cdr。kabat等還定義針對可變區序列的編號系統,其可應用于任何抗體。本領域的普通技術人員可以明確地將此“kabat編號”系統用于任何可變區序列,不依賴于序列本身外的任何實驗數據。如本文中使用的,“kabat編號方式”指由kabat等,u.s.dept.ofhealthandhumanservices,“sequenceofproteinsofimmunologicalinterest”(1983)提出的編號系統。除非另外說明,提及抗體可變區中特定氨基酸殘基位置的編號方式依照kabat編號系統。除了vh中的cdr1外,cdr一般包含形成高變環的氨基酸殘基。cdr還包含“特異性決定殘基”,或“sdr”,其是接觸抗原的殘基。sdr包含在稱作縮短的-cdr,或a-cdr的cdr區內。例示性的a-cdr(a-cdr-l1,a-cdr-l2,a-cdr-l3,a-cdr-h1,a-cdr-h2,和a-cdr-h3)存在于l1的氨基酸殘基31-34,l2的50-55,l3的89-96,h1的31-35b,h2的50-58,和h3的95-102(見almagro和fransson,front.biosci.13:1619-1633(2008))。除非另有指示,可變域中的hvr殘基和其它殘基(例如,fr殘基)在本文中依照kabat等,見上文編號。“免疫綴合物”指與一種或多種異源分子(包括但不限于細胞毒劑)綴合的抗體。“個體”或“受試者”是哺乳動物。哺乳動物包括但不限于馴養的動物(例如,牛,綿羊,貓,犬,和馬),靈長類(例如,人和非人靈長類諸如猴),家兔,和嚙齒類(例如,小鼠和大鼠)。在某些實施方案中,個體或受試者是人。“分離的”抗體指已經與其天然環境的組分分開的抗體。在一些實施方案中,抗體純化至大于95%或99%的純度,如通過例如電泳(例如,sds-page,等電聚焦(ief),毛細管電泳)或層析(例如,離子交換或反相hplc)測定的。關于用于評估抗體純度的方法的綜述,見例如flatman等,j.chromatogr.b848:79-87(2007)。“分離的”的核酸指已經與其天然環境的組分分開的核酸分子。分離的核酸包括通常含有核酸分子的細胞中含有的核酸分子,但是核酸分子在染色體外或在與其天然染色體位置不同的染色體位置處存在。“編碼特異性結合dr5和fap的雙特異性抗體的分離的核酸”指編碼抗體重和輕鏈(或其片段)的一種或多種核酸分子,包括單一載體或分開的載體中的此類核酸分子,和存在于宿主細胞中的一個或多個位置的此類核酸分子。如本文中使用的,術語“單克隆抗體”指從一群基本上同質的抗體獲得的抗體,即構成群體的各個抗體是相同的和/或結合相同表位,除了例如含有天然存在的突變或在單克隆抗體制備物的生成期間發生的可能的變體抗體外,此類變體一般以極小量存在。與通常包含針對不同決定簇(表位)的不同抗體的多克隆抗體制備物不同,單克隆抗體制備物的每個單克隆抗體針對抗原上的單一決定簇。如此,修飾語“單克隆”指示抗體自一群基本上同質的抗體獲得的特性,而不應解釋為要求通過任何特定方法來生成抗體。例如,可以通過多種技術來生成要依照本發明使用的單克隆抗體,包括但不限于雜交瘤方法,重組dna方法,噬菌體展示方法,和利用含有所有或部分人免疫球蛋白基因座的轉基因動物的方法,本文中描述了用于生成單克隆抗體的此類方法和其它例示性方法。“裸抗體”指未與異源模塊(例如細胞毒性模塊)或放射性標記物綴合的抗體。裸抗體可以存在于藥物配制劑中。“天然抗體”指具有不同結構的天然存在的免疫球蛋白分子。例如,天然igg抗體是約150,000道爾頓的異四聚糖蛋白,由二硫化物鍵合的兩條相同輕鏈和兩條相同重鏈構成。從n至c端,每條重鏈具有一個可變區(vh),又稱作可變重域或重鏈可變域,接著是三個恒定域(ch1,ch2,和ch3)。類似地,從n至c端,每條輕鏈具有一個可變區(vl),又稱作可變輕域或輕鏈可變域,接著是一個恒定輕(cl)域。根據其恒定域氨基酸序列,抗體輕鏈可歸入兩種類型中的一種,稱作卡帕(κ)和拉姆達(λ)。術語“包裝插頁”用于指治療產品的商業包裝中通常包含的用法說明書,其含有關于涉及此類治療產品應用的適應癥,用法,劑量,施用,聯合療法,禁忌癥和/或警告的信息。“沒有實質性交叉反應性”意指分子(例如,抗體)不識別或特異性結合與該分子的實際靶抗原不同的抗原(例如與靶抗原密切相關的抗原),特別地在與該靶抗原相比時。例如,抗體可以結合少于約10%至少于約5%的與實際靶抗原不同的抗原,或者可以以由少于約10%,9%,8%,7%,6%,5%,4%,3%,2%,1%,0.5%,0.2%,或0.1%組成的量結合所述與實際靶抗原不同的抗原,優選地少于約2%,1%,或0.5%,且最優選地少于約0.2%或0.1%與實際靶抗原不同的抗原。關于參照多肽序列的“百分比(%)氨基酸序列同一性”定義為比對序列并在必要時引入缺口以獲取最大百分比序列同一性后,且不將任何保守替代視為序列同一性的一部分時,候選序列中與參照多肽序列中的氨基酸殘基相同的氨基酸殘基的百分率。為測定百分比氨基酸序列同一性目的的對比可以以本領域技術范圍內的多種方式進行,例如使用公眾可得到的計算機軟件,諸如blast,blast-2,align或megalign(dnastar)軟件。本領域技術人員能決定用于比對序列的合適參數,包括對所比較序列全長獲得最大對比所需的任何算法。然而,為了本發明的目的,%氨基酸序列同一性值是使用序列比較計算機程序align-2產生的。align-2序列比較計算機程序由genentech,inc.編寫,并且源代碼已經連同用戶文檔一起提交給美國版權局(uscopyrightoffice,washingtond.c.,20559),在那里其以美國版權注冊號txu510087注冊。公眾自genentech,inc.,southsanfrancisco,california可獲得align-2程序,或者可以從源代碼編譯。align-2程序應當編譯成在unix操作系統,包括數碼unixv4.0d上使用。所有序列比較參數由align-2程序設定且不變。在采用align-2來比較氨基酸序列的情況中,給定氨基酸序列a相對于(to),與(with),或針對(against)給定氨基酸序列b的%氨基酸序列同一性(或者可表述為具有或包含相對于,與,或針對給定氨基酸序列b的某一%氨基酸序列同一性的給定氨基酸序列a)如下計算:分數x/y乘100其中x是由序列比對程序align-2在該程序的a和b比對中評分為相同匹配的氨基酸殘基數,且其中y是b中的氨基酸殘基總數。應當領會,若氨基酸序列a的長度與氨基酸序列b的長度不相等,則a相對于b的%氨基酸序列同一性將不等于b相對于a的%氨基酸序列同一性。除非另有明確說明,本文中所使用的所有%氨基酸序列同一性值都是依照上一段所述,使用align-2計算機程序獲得的。術語“藥物配制劑”指處于如下的制劑,其形式使得容許其中含有的活性成分的生物學活性是有效的,且不含對會接受配制劑施用的受試者具有不可接受的毒性的別的組分。“藥學可接受載體”指藥物配制劑中與活性成分不同的,且對受試者無毒的成分。藥學可接受載體包括但不限于緩沖劑,賦形劑,穩定劑,或防腐劑。如本文中使用的,術語“死亡受體5(dr5)”指來自任何脊椎動物來源,包括哺乳動物諸如靈長類(例如人)和嚙齒類(例如小鼠和大鼠)的任何天然dr5,除非另外指明。該術語涵蓋“全長”,未加工的dr5以及dr5因細胞中的加工所致的任何形式。該術語還涵蓋dr5的天然存在變體,例如剪接變體或等位變體。例示性人dr5的氨基酸序列披露于wo2011/039126。如本文中使用的,術語“成纖維細胞活化蛋白(fap)”指來自任何脊椎動物來源,包括哺乳動物諸如靈長類(例如人)和嚙齒類(例如小鼠和大鼠)的任何天然fap,除非另外指明。該術語涵蓋“全長”,未加工的fap以及fap因細胞中的加工所致的任何形式。該術語還涵蓋fap的天然存在變體,例如剪接變體或等位變體。優選地,本發明的抗fap抗體結合fap的胞外域。例示性fap多肽序列的氨基酸序列,包括人fap的序列披露于wo2012/020006。在用于本文時,“治療/處理”(及其語法變型)指試圖改變所治療個體的天然過程的臨床干預,并且可以為了預防或者在臨床病理學的過程期間實施。治療的期望效果包括但不限于預防疾病的發生或再發生,減輕癥狀,減輕/減少疾病的任何直接或間接病理后果,預防轉移,降低疾病進展速率,改善或減輕疾病狀態,和消退或改善的預后。在一些實施方案中,使用本發明的抗體來延遲疾病的形成或減緩疾病的進展。如本文中使用的,術語癌癥指增殖性疾病,諸如癌癥為結直腸癌,肉瘤,頭和頸癌,鱗狀細胞癌,乳腺癌,胰腺癌,胃癌癥,非小細胞肺癌,小細胞肺癌和間皮瘤,包括任何上述癌癥的頑固性型式,或一種或多種上述癌癥的組合。在一個實施方案中,癌癥為結直腸癌癥,而且,任選的是,化療劑為伊立替康。如本文中使用的,“肉瘤”指在結締組織中生長的癌癥類型。肉瘤包括胃腸基質腫瘤(在胃和腸中找到的一類軟組織肉瘤,通常稱作gist),軟組織肉瘤(例如平滑肌肉瘤,成纖維細胞肉瘤,脂肪肉瘤,卡波西(kaposi)氏肉瘤(ks),血管肉瘤,惡性周圍神經鞘瘤(mpnst),滑膜肉瘤,橫紋肌肉瘤)和骨的肉瘤(例如軟骨肉瘤,骨肉瘤,尤因(ewing)氏肉瘤,脊索瘤)。在癌癥為肉瘤的實施方案中,任選的是,肉瘤為軟骨肉瘤,平滑肌肉瘤,胃腸基質腫瘤,纖維肉瘤,骨肉瘤,脂肪肉瘤或惡性纖維組織細胞瘤。術語“可變區”或“可變域”指抗體重或輕鏈中牽涉抗體結合抗原的域。天然抗體的重鏈和輕鏈可變域(分別為vh和vl)一般具有類似的結構,其中每個域包含4個保守的框架區(fr)和3個高變區(hvr)(見例如kindt等kubyimmunology,第6版,w.h.freemanandco.,第91頁(2007))。單個vh或vl域可以足以賦予抗原結合特異性。此外,可以分別使用來自結合抗原的抗體的vh或vl域篩選互補vl或vh域的文庫來分離結合特定抗原的抗體。見例如,portolano等,j.immunol.150:880-887(1993);clarkson等,nature352:624-628(1991)。術語“抗體的抗原結合位點”在用于本文時指抗體中負責抗原結合的氨基酸殘基。抗體的抗原結合部分包含來自“互補決定區”或“cdr”的氨基酸殘基。“框架”或“fr”區是可變域中那些與本文中定義的高變區殘基不同的區。因此,抗體的輕和重鏈可變域自n至c端包含域fr1,cdr1,fr2,cdr2,fr3,cdr3,和fr4。尤其地,重鏈的cdr3是對抗原結合貢獻最大且限定抗體特性的區。cdr和fr區依照kabatetal.,sequencesofproteinsofimmunologicalinterest,5thed.,publichealthservice,nationalinstitutesofhealth,bethesda,md(1991)的標準定義和/或那些來自“高變環”的殘基來確定。抗體特異性指抗體對抗原的特定表位的選擇性識別。例如,天然抗體是單特異性的。依照本發明的“雙特異性抗體”是具有兩種不同抗原結合特異性的抗體。本發明的抗體是對兩種不同抗原特異性,即作為第一抗原的dr5和作為第二抗原的fap。如本文中使用的,術語“單特異性”抗體表示抗體具有一個或多個結合位點,每個結合相同抗原的相同表位。如本文中使用的,術語“雙特異性”抗體表示抗體具有至少兩個結合位點,每個結合不同抗原或相同抗原的不同表位。本文中提供的抗體是多特異性抗體,例如雙特異性抗體。多特異性抗體指對至少兩種不同位點具有結合特異性的單克隆抗體。本文中提供雙特異性抗體,其具有針對fap和dr5的結合特異性。在某些實施方案中,雙特異性抗體可以結合dr5的兩種不同表位。雙特異性抗體也可以用于將細胞毒劑定位于表達dr5的細胞。可以作為全長抗體或抗體片段制備雙特異性抗體。用于生成多特異性抗體的技術包括但不限于具有不同特異性的兩對免疫球蛋白重鏈-輕鏈對的重組共表達(見milstein和cuello,nature305:537(1983)),wo93/08829,和traunecker等,emboj.10:3655(1991)),和“突起-入-空穴”工程化(見例如美國專利no.5,731,168)。也可以通過用于生成抗體fc-異二聚體分子的工程化靜電操縱效應(wo2009/089004);交聯兩個或更多個抗體或片段(見例如美國專利no.4,676,980,及brennan等,science,229:81(1985));使用亮氨酸拉鏈來生成雙特異性抗體(見例如kostelny等,j.immunol.,148(5):1547-1553(1992));使用用于生成雙特異性抗體片段的“雙抗體”技術(見例如hollinger等,proc.natl.acad.sci.usa,90:6444-6448(1993));及使用單鏈fv(sfv)二聚體(見例如gruber等,j.immunol.,152:5368(1994));及如例如tutt等j.immunol.147:60(1991)中所描述的,制備三特異性抗體來生成多特異性抗體。本文中還包括具有三個或更多個功能性抗原結合位點的工程化改造抗體,包括“章魚抗體”(見例如us2006/0025576a1)。本文中的抗體或片段還包括包含至少一個結合fap或dr5以及另一種不同抗原的抗原結合位點的“雙重作用fab”或“daf”(參見例如us2008/0069820)。如本申請內使用的,術語“效價”或“價”表示抗體分子中存在指定數目的結合位點。如此,術語“二價”,“四價”,和“六價”分別表示抗體分子中存在兩個結合位點,四個結合位點,和六個結合位點。依照本發明的雙特異性抗體至少是“二價”的,而且可以是“三價”的或“多價”的(例如“四價”或“六價”)。本發明的抗體具有兩個或更多個結合位點且是雙特異性的。就是說,該抗體可以是雙特異性的,即使在有超過兩個結合位點的情況中(即該抗體是三價或多價的)。本發明的雙特異性抗體包括例如多價單鏈抗體,雙抗體和三抗體,以及如下的抗體,該抗體具有全長抗體的恒定域結構,對其經一個或多個肽接頭連接別的抗原結合位點(例如單鏈fv,vh域和/或vl域,fab,或(fab)2)。所述抗體可以是來自單一物種的全長,或者是嵌合化的或人源化的。在用于本文時,術語“載體”指能夠增殖與其連接的另一種核酸的核酸分子。該術語包括作為自身復制型核酸結構的載體及并入接受其導入的宿主細胞的基因組中的載體。某些載體能夠指導與其可操作連接的核酸的表達。此類載體在本文中稱為“表達載體”。如本本申請內使用的,術語“氨基酸”表示天然存在的羧基α-氨基酸組,包括丙氨酸(三字母代碼:ala,單字母代碼:a),精氨酸(arg,r),天冬酰胺(asn,n),天冬氨酸(asp,d),半胱氨酸(cys,c),谷氨酰胺(gln,q),谷氨酸(glu,e),甘氨酸(gly,g),組氨酸(his,h),異亮氨酸(ile,i),亮氨酸(leu,l),賴氨酸(lys,k),甲硫氨酸(met,m),苯丙氨酸(phe,f),脯氨酸(pro,p),絲氨酸(ser,s),蘇氨酸(thr,t),色氨酸(trp,w),酪氨酸(tyr,y),和纈氨酸(val,v)。如本文中所使用的,表述“細胞”,“細胞系”,和“細胞培養物”可互換使用,并且所有此類名稱包括后代。如此,詞語“轉化體”和“經轉化的細胞”包括原代主題細胞和自其衍生的培養物,而不管傳代的次數。還應當理解,由于有意或無意的突變,所有后代在dna內容上可能不是正好相同的。包括具有如在初始轉化細胞中篩選的相同功能或生物學活性的變體后代。“親和力”指分子(例如抗體)的單一結合位點與其結合配偶體(例如抗原)之間全部非共價相互作用總和的強度。除非另有指示,如本文中使用的,“結合親和力”指反映結合對的成員(例如抗體和抗原)之間1:1相互作用的內在結合親和力。分子x對其配偶體y的親和力通常可以用解離常數(kd)來表述。親和力可以通過本領域知道的常用方法來測量,包括本文中所描述的方法。下文描述了用于測量結合親和力的具體的說明性和例示性的實施方案。如本文中所使用的,術語“結合”或“特異性結合”指在體外測定法中,優選地在表面等離振子共振測定法(spr,biacore,ge-healthcareuppsala,sweden)中抗體對抗原的表位的結合。結合親和力通過術語ka(來自抗體/抗原復合物的抗體的結合速率常數),kd(解離常數),和kd(kd/ka)限定。結合或特異性結合意指10-8mol/l或更小,優選10-9m至10-13m的結合親和力(kd)。抗體對死亡受體的結合可以通過biacore測定法(ge-healthcareuppsala,sweden)來調查。結合親和力通過術語ka(來自抗體/抗原復合物的抗體的結合速率常數),kd(解離常數),和kd(kd/ka)限定。術語“表位”包括能夠與抗體特異性結合的任何多肽決定簇。在某些實施方案中,表位決定簇包括分子的化學活性表面聚組,諸如氨基酸,糖側鏈,磷酰基,或磺酰基,并且在某些實施方案中可以具有特定的三維結構特征,和/或特定的電荷特征。表位是抗原中被抗體結合的區域。如本文中所使用的,認為特別地具有前綴“糖”的術語“工程化”或“工程化改造”及術語“糖基化工程”包括對天然存在的或重組的多肽或其片段的糖基化樣式的任何操作。糖基化工程包括細胞的糖基化機制的代謝工程,包括對寡糖合成途徑的遺傳操作以實現細胞中表達的糖蛋白的改變的糖基化。此外,糖基化工程包括突變和細胞環境對糖基化的影響。在一個實施方案中,糖基化工程是糖基轉移酶活性的變化。在一個具體的實施方案中,工程化改造導致改變的葡糖胺基轉移酶活性和/或巖藻糖基轉移酶活性。ii.組合物和方法在一個方面,本發明基于包含對trail死亡受體5(dr5)特異性的第一抗原結合位點和對成纖維細胞活化蛋白(fap)特異性的第二抗原結合位點的雙特異性抗體和別的化療劑的治療劑組合的用途,例如用于治療癌癥。a.對fap和dr5特異性的雙特異性抗體的組合療法寬泛地,本發明涉及組合死亡受體5(dr5)靶向性抗原結合位點與靶向成纖維細胞活化蛋白(fap)的第二抗原結合位點的雙特異性抗體及它們與別的化療劑組合的用途。依照本發明采用的雙特異性抗體使得死亡受體變成交聯的且對靶定的腫瘤細胞誘導凋亡。勝過常規死亡受體靶向性抗體的優勢在于只在表達fap的部位誘導凋亡的特異性以及這些雙特異性抗體因誘導dr5超聚簇所致的更高效力。因而,在一個方面,本發明提供一種供作為組合療法在治療癌癥的方法中使用的包含至少一個對dr5特異性的抗原結合位點和至少一個對fap特異性的抗原結合位點的結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體,其中該雙特異性抗體與選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑,bcl-2抑制劑,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑,異磷酰胺或抗vegf抗體的化療劑組合使用。優選地,該化療劑選自伊立替康,多柔比星,奧沙利鉑,異磷酰胺或抗vegf抗體。在一個實施方案中,該化療劑選自伊立替康,多柔比星或奧沙利鉑。在一個實施方案中,該雙特異性抗體與伊立替康組合使用。在一個實施方案中,該雙特異性抗體與帕利他賽和吉西他濱組合使用。在一個實施方案中,該雙特異性抗體與異磷酰胺組合使用。伊立替康是一種用于治療癌癥的藥物。伊立替康通過抑制拓樸異構酶1來阻止dna解開。伊立替康是天然生物堿喜樹堿的一種半合成類似物,而且名稱為[1,4’聯哌啶]-1’-羧酸(s)-4,11-二乙基-3,4,12,14-四氫-4-羥基-3,14-二氧代1h-吡喃并[3’,4’:6,7]-中氮茚并[1,2-b]喹啉-9-基-酯。伊立替康具有結構:多柔比星是用于治療一大批癌癥的化療劑。多柔比星插入dna,導致抑制dna合成;干擾拓樸異構酶2,阻止dna復制和提高自由基的生成,促成它的細胞毒性。多柔比星是一種蒽環類抗生素,與天然的柔紅霉素密切相關,而且名稱為(7s,9s)-7-[(2r,4s,5s,6s)-4-氨基-5-羥基-6-甲基口惡烷-2-基]氧基-6,9,11-三羥基-9-(2-羥基乙酰基)-4-甲氧基-8,10-二氫-7h-并四苯-5,12-二酮。多柔比星具有結構:奧沙利鉑(sanofi)是一種用于治療癌癥,特別是結直腸癌的基于鉑的化療藥物。在生理學溶液中,奧沙利鉑經歷非酶促轉變,變成活性衍生物,并導致dna交聯,抑制dna合成和轉錄。奧沙利鉑名稱為[(1r,2r)-環己烷-1,2-二胺](乙二酸合-o,o')鉑(ii)且具有結構:5-fu(5-氟尿嘧啶)廣泛用于治療癌癥。5-fu是尿嘧啶的一種類似物,運輸入細胞中并轉變成活性代謝物。這些代謝物破壞rna合成并抑制酶胸苷酸合酶,阻斷胸苷合成,胸苷是dna復制和修復所必需的。5-fu的名稱為5-氟-1h,3h-嘧啶-2,4-二酮且具有該結構:mdm2抑制劑阻斷p53-mdm2結合,導致p53途徑激活,這導致細胞周期阻滯和/或凋亡。在一個實施方案中,mdm2抑制劑為rg7388。mdm2抑制劑rg7388是小分子吡咯烷化合物,正在進行治療癌癥的臨床調查(dingetal.,j.med.chem.56(14):5979-5983,2013)。mdm2抑制劑rg7388的名稱為4-((2r,3s,4r,5s)-3-(3-氯-2-氟苯基)-4-(4-氯-2-氟苯基)-4-氰基-5-新戊基吡咯烷-2-甲酰胺基)-3-甲氧基苯甲酸且具有結構:在另一個實施方案中,mdm2抑制劑為mk-8242。其它mdm2抑制劑是本領域已知的且記載于例如swatupalitdebandsumitradeb:mutantp53andmdm2incancer,subcellularbiochemistry85,springer(isbn978-94-017-9211-0)。bcl-2(b細胞淋巴瘤2)抑制劑靶向bcl-2家族蛋白且旨在恢復癌細胞對促凋亡信號的敏感性。在一個實施方案中,bcl-2抑制劑為abt199。bcl-2抑制劑abt199,也稱作gdc-0199,是一種選擇性抑制劑,正在進行治療癌癥的臨床調查(souersetal.,(2013)nat.med.19(2):202-208)。它設計成模擬bcl-2蛋白上存在的bh3結構元件的結合,在凋亡的調節中是重要的。abt199的名稱為(4-(4-{[2-(4-氯苯基)-4,4-二甲基環己-1-烯-1-基]甲基}哌嗪-1-基)-n-({3-硝基-4-[(四氫-2h-吡喃-4-基甲基)氨基]苯基}磺酰基)-2-(1h-吡咯并[2,3-b]吡啶-5-基氧基)苯甲酰胺)且具有結構:紫杉烷(帕利他賽和abraxane)是自太平洋紫杉樹taxusbrevifolia的小枝,針葉和樹皮衍生的藥物。它們已經在多種腫瘤類型中展現抗腫瘤活性。紫杉烷通過超穩定化微管的結構來干擾它們的生長來發揮功能,破壞細胞在細胞分裂期間使用它的細胞骨架的能力并導致異常細胞功能和最終細胞死亡。帕利他賽在稱作cremophor(蓖麻油的一種有毒衍生物)的溶劑中溶解,投遞入細胞。清蛋白結合的帕利他賽(商品名abraxane,也稱作nab-帕利他賽)是一種備選配制劑,其中帕利他賽結合至清蛋白納米顆粒,它是一種備選的,毒性較低的投遞劑。帕利他賽的名稱為5β,20-環氧基-1,2α,4,7β,10β,13α-六羥基紫衫-11-烯-9-酮4,10-二乙酸酯2-苯甲酸酯與(2r,3s)-n-苯甲酰基-3-苯基異絲氨酸的13-酯且具有結構:硼替佐米是一種用于治療癌癥的治療性蛋白酶體抑制劑。也稱作ps-341,硼替佐米特異性且可逆抑制26s蛋白酶體(一種涉及對癌細胞存活至關重要的多種蛋白的降解的酶復合物)的蘇氨酸殘基。抑制這些蛋白的降解使細胞對凋亡敏化。硼替佐米的名稱為[(1r)-3-甲基-1-[(2s)-3-苯基-2-(吡嗪-2-基甲酰胺基)丙酰胺基]丁基]硼酸且具有結構:吉西他濱是一種殺死正在經歷dna合成的細胞的化療劑。吉西他濱是一個核苷類似物,由核苷激酶代謝成二磷酸和三磷酸核苷。二磷酸吉西他濱抑制核糖核苷酸還原酶(dna合成所需要的一種酶),而三磷酸吉西他濱與脫氧胞苷競爭摻入dna。吉西他濱的名稱為4-氨基-1-(2-脫氧-2,2-二氟-β-d-赤式-呋喃戊糖基)嘧啶-2(1h)-酮且具有結構:環巴胺是一種天然生物堿,正在作為潛在癌癥治療進行調查。hedgehog途徑的不當激活與腫瘤形成和生長有關。環巴胺能夠通過直接結合受體smoothened來破壞hedgehog信號傳導途徑來殺死癌細胞。環巴胺的名稱為(3β,23r)-17,23-環氧基藜蘆-3-醇且具有結構:parp抑制劑是酶聚adp核糖聚合酶(parp)的一組藥理學抑制劑。在一個實施方案中,parp抑制劑為pj34。parp抑制劑pj34引起parp1不依賴性,p21依賴性有絲分裂阻滯。參見madisonetal.,dnarepair(amst).2011oct10;10(10):1003-13.doi:10.1016/j.dnarep.2011.07.006.epub2011aug12。pj34阻斷parp-1的活性,阻止含有受損dna的細胞修復單鏈斷裂并導致細胞死亡。pj34的名稱為鹽酸n-(5,6-二氫-6-氧代-2-菲啶基)-2-乙酰胺且具有結構:在一個實施方案中,parp抑制劑為olaparip。olaparip是聚adp核糖聚合酶(parp)(一種涉及dna修復的酶)的一種抑制劑。它在具有遺傳性brca1或brca2突變的人中針對癌癥起作用,這包括許多卵巢,乳腺和前列腺癌。olaparip的名稱為4-[(3-[(4-環丙基羰基)哌嗪-4-基]羰基)-4-氟苯基]甲基(2h)酞嗪-1-酮且具有結構:異磷酰胺是一種用于治療癌癥的氮芥烷化劑,系統名稱為n-3-二(2-氯乙基)-1,3,2-氧雜氮雜磷雜環己烷-2-胺-2-氧化物,也稱作例如商品名ifex且具有結構:異磷酰胺是一種用于治療不同癌癥(包括睪丸癌,肉瘤和一些類型的淋巴瘤)的化療藥物。含本發明的雙特異性dr5-fap抗體的治療劑組合中可采用的又一類化療劑是抗vegf抗體。抗vegf抗體的例子包括抗vegf抗體或靶向血管發生促進性生長因子受體的肽-抗體融合物,例如貝伐珠單抗(雷尼珠單抗),西妥昔單抗拉米魯珠單抗伊曲庫巴,humv833,2c3,阿柏西普和imc-1c11。一種優選的抗vegf抗體是貝伐珠單抗抗vegf抗體的又一個例子是wo2010/040508和wo2011/117329中記載的抗vegf-ang2雙特異性抗體。在又一個方面,本發明提供一種藥物組合物,其包含本文所述雙特異性抗體和選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑,bcl-2抑制劑,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑,異磷酰胺或抗vegf抗體的化療劑。在又一個方面,本發明提供一種藥物組合物,其包含本文所述雙特異性抗體和選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑rg7388,bcl-2抑制劑abt199,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑pj34,異磷酰胺或抗vegf抗體的化療劑。在又一個方面,本發明提供一種藥物組合物,其包含本文所述雙特異性抗體和abraxane和吉西他濱。在又一個方面,本發明提供一種試劑盒,其包含:(i)第一容器,裝有包含本文所述雙特異性抗體的組合物;和(ii)第二容器,裝有包含選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑,bcl-2抑制劑,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑,異磷酰胺或抗vegf抗體的化療劑的組合物。在又一個方面,本發明提供一種試劑盒,其包含:(i)第一容器,裝有包含本文所述雙特異性抗體的組合物;和(ii)第二容器,裝有包含選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑rg7388,bcl-2抑制劑abt199,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑pj34,異磷酰胺或抗vegf抗體的化療劑的組合物。在又一個方面,本發明提供一種試劑盒,其包含:(i)第一容器,裝有包含本文所述雙特異性抗體的組合物;和(ii)第二容器,裝有包含選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑rg7388,bcl-2抑制劑abt199,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑pj34,異磷酰胺或抗vegf抗體的化療劑的組合物。在又一個方面,本發明提供一種試劑盒,其包含:(i)第一容器,裝有包含本文所述雙特異性抗體的組合物;和(ii)第二容器,裝有帕利他賽或abraxane;和(iii)第三容器,裝有吉西他濱。在又一個方面,本發明提供結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和化療劑的組合在制造用于治療癌癥的藥物中的用途,其中該雙特異性抗體與選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑,bcl-2抑制劑abt199,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑,異磷酰胺或抗vegf抗體的化療劑組合使用。在又一個方面,本發明提供結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和化療劑的組合在制造用于治療癌癥的藥物中的用途,其中該雙特異性抗體與選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑rg7388,bcl-2抑制劑abt199,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑pj34,異磷酰胺或抗vegf抗體的化療劑組合使用。在又一個方面,本發明提供結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和化療劑的組合在制造用于治療癌癥的藥物中的用途,其中該雙特異性抗體與伊立替康組合使用。在一個此類方面,要治療的癌癥為結直腸癌。在又一個方面,本發明提供結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和化療劑的組合在制造用于治療癌癥的藥物中的用途,其中該雙特異性抗體與抗vegf抗體,優選貝伐珠單抗組合使用。在一個此類方面,要治療的癌癥為結直腸癌。在又一個方面,本發明提供結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和化療劑的組合在制造用于治療癌癥的藥物中的用途,其中該雙特異性抗體與多柔比星組合使用。在一個此類方面,要治療的癌癥為肉瘤。在又一個方面,本發明提供結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和化療劑的組合在制造用于治療癌癥的藥物中的用途,其中該雙特異性抗體與異磷酰胺組合使用。在一個此類方面,要治療的癌癥為肉瘤。在又一個方面,本發明提供結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和化療劑的組合在制造用于治療癌癥的藥物中的用途,其中該雙特異性抗體與abraxane和吉西他濱組合使用。在一個此類方面,要治療的癌癥為胰腺癌。在又一個方面,本發明提供一種用于治療癌癥的方法,其包括作為組合配制劑或交替地將治療劑組合施用于哺乳動物,其中該治療劑組合包含治療有效量的包含至少一個對dr5特異性的抗原結合位點和至少一個對fap特異性的抗原結合位點的結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和治療有效量的選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑,bcl-2抑制劑,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑,異磷酰胺或抗vegf抗體的化療劑。在又一個方面,本發明提供一種用于治療癌癥的方法,其包括作為組合配制劑或交替地將治療劑組合施用于哺乳動物,其中該治療劑組合包含治療有效量的包含至少一個對dr5特異性的抗原結合位點和至少一個對fap特異性的抗原結合位點的結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和治療有效量的選自伊立替康,多柔比星,奧沙利鉑,5-fu,mdm2抑制劑rg7388,bcl-2抑制劑abt199,abraxane,帕利他賽,吉西他濱,硼替佐米,環巴胺,parp抑制劑pj34,異磷酰胺或抗vegf抗體的化療劑。在一些實施方案中,該癌癥為結直腸癌,肉瘤,頭和頸癌,鱗狀細胞癌,乳腺癌,胰腺癌,胃癌,非小細胞肺癌,小細胞肺癌,結締組織增生性黑素瘤和間皮瘤。在一個實施方案中,該癌癥為結直腸癌。在其它實施方案中,該肉瘤為軟骨肉瘤,平滑肌肉瘤,胃腸基質腫瘤,纖維肉瘤,骨肉瘤。脂肪肉瘤或惡性纖維組織細胞瘤。在又一個方面,本發明提供一種用于治療癌癥的方法,其包括作為組合配制劑或交替地將治療劑組合施用于哺乳動物,其中該治療劑組合包含治療有效量的包含至少一個對dr5特異性的抗原結合位點和至少一個對fap特異性的抗原結合位點的結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和治療有效量的伊立替康。在一個此類方面,要治療的癌癥為結直腸癌。在又一個方面,本發明提供一種用于治療癌癥的方法,其包括作為組合配制劑或交替地將治療劑組合施用于哺乳動物,其中該治療劑組合包含治療有效量的包含至少一個對dr5特異性的抗原結合位點和至少一個對fap特異性的抗原結合位點的結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和治療有效量的抗vegf抗體,例如貝伐珠單抗。在一個此類方面,要治療的癌癥為結直腸癌。在又一個方面,本發明提供一種用于治療癌癥的方法,其包括作為組合配制劑或交替地將治療劑組合施用于哺乳動物,其中該治療劑組合包含治療有效量的包含至少一個對dr5特異性的抗原結合位點和至少一個對fap特異性的抗原結合位點的結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和治療有效量的abraxane和治療有效量的吉西他濱。在一個此類方面,要治療的癌癥為胰腺癌。在又一個方面,本發明提供一種用于治療癌癥的方法,其包括作為組合配制劑或交替地將治療劑組合施用于哺乳動物,其中該治療劑組合包含治療有效量的包含至少一個對dr5特異性的抗原結合位點和至少一個對fap特異性的抗原結合位點的結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和治療有效量的多柔比星。在一個此類方面,要治療的癌癥為肉瘤。在又一個方面,本發明提供一種用于治療癌癥的方法,其包括作為組合配制劑或交替地將治療劑組合施用于哺乳動物,其中該治療劑組合包含治療有效量的包含至少一個對dr5特異性的抗原結合位點和至少一個對fap特異性的抗原結合位點的結合死亡受體5(dr5)和成纖維細胞活化蛋白(fap)的雙特異性抗體和治療有效量的異磷酰胺。在一個此類方面,要治療的癌癥為肉瘤。在一些實施方案中,該雙特異性抗體和該化療劑一起施用,任選作為組合配制劑。或者,該雙特異性抗體和該化療劑可以交替施用,或是該化療劑在該雙特異性抗體之前施用,或是該化療劑在該雙特異性抗體之后施用。該組合可以依照臨床實踐來施用,例如以約一周至三周的間隔施用。b.例示性的結合dr5和fap的雙特異性抗體在一個方面,本發明提供分離的結合dr5和fap的雙特異性抗體。fap結合模塊已經記載于wo2012/020006,通過援引將其完整收錄。下述實施方案中描繪了要在dr5-fap雙特異性抗體中使用的特別感興趣的fap結合模塊。在某些實施方案中,結合dr5和fap的雙特異性抗體特異性交聯死亡受體且靶細胞的凋亡得以誘導。這些雙特異性死亡受體激動性抗體勝過常規死亡受體靶向性抗體的優勢在于只在表達fap的部位誘導凋亡的特異性。如上文描繪的,本發明的發明人開發了與已知的dr5結合物相比具有卓越特性的dr5結合模塊,其可并入新穎的且有利的dr5-fap雙特異性抗體中。在一個方面,本發明提供包含結合dr5和fap的雙特異性抗體的治療劑組合,該雙特異性抗體包含至少一個對dr5特異性的抗原結合位點,其包含(a)seqidno.:1的重鏈cdr1;(b)seqidno.:2的重鏈cdr2;(c)seqidno.:3的重鏈cdr3;(d)seqidno.:4的輕鏈cdr1;(e)seqidno.:5的輕鏈cdr2;(f)seqidno.:6的輕鏈cdr3,和至少一個對fap特異性的抗原結合位點,其包含(a)seqidno.:9的重鏈cdr1;(b)seqidno.:10的重鏈cdr2;(c)seqidno.:11的重鏈cdr3;(d)seqidno.:12的輕鏈cdr1;(e)seqidno.:13的輕鏈cdr2;(f)seqidno.:14的輕鏈cdr3。在一個實施方案中,該雙特異性抗體包含至少一個對dr5特異性的抗原結合位點,其包含包含seqidno.:7的氨基酸序列的可變重鏈和包含seqidno.:8的氨基酸序列的可變輕鏈;和至少一個對fap特異性的抗原結合位點,其包含包含seqidno.:15的氨基酸序列的重鏈可變區和包含seqidno.:16的氨基酸序列的輕鏈可變區。在一個優選的實施方案中,提供一種雙特異性抗體,其包含seqidno.:18,seqidno.:19和seqidno.:20。在另一個實施方案中,提供一種雙特異性抗體,其包含seqidno.:17,seqidno.:19和seqidno.:20。在另一個方面,結合dr5和fap的雙特異性抗體包含至少一個對dr5特異性的抗原結合位點,其包含與seqidno.:7的氨基酸序列具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的重鏈可變域(vh)序列,和至少一個對fap特異性的抗原結合位點,其包含seqidno.:15的可變重鏈和seqidno.:16的可變輕鏈。在某些實施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的vh序列相對于參照序列含有替代(例如保守替代),插入,或刪除,但是包含該序列的結合dr5和fap的雙特異性抗體保留結合fap和dr5的能力。在某些實施方案中,在seqidno.:7中替代,插入和/或刪除總共1至10個氨基酸。在某些實施方案中,替代,插入,或刪除發生在hvr以外的區域中(即在fr中)。任選地,結合dr5和fap的雙特異性抗體包含seqidno.:7中的vh序列,包括該序列的翻譯后修飾。在另一個方面,結合dr5和fap的雙特異性抗體包含至少一個對dr5特異性的抗原結合位點,其包含與seqidno.:8的氨基酸序列具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的輕鏈可變域(vl)序列,和至少一個對fap特異性的抗原結合位點,其包含seqidno.:15的可變重鏈和seqidno.:16的可變輕鏈。在某些實施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的vl序列相對于參照序列含有替代(例如保守替代),插入,或刪除,但是包含該序列的結合dr5和fap的雙特異性抗體保留結合dr5和fap的能力。在某些實施方案中,在seqidno.:8中替代,插入和/或刪除總共1至10個氨基酸。在某些實施方案中,替代,插入,或刪除發生在hvr以外的區域中(即在fr中)。任選地,結合dr5和fap的雙特異性抗體包含seqidno:8中的vl序列,包括該序列的翻譯后修飾。在另一個方面,提供結合dr5和fap的雙特異性抗體,該雙特異性抗體包含至少一個對dr5特異性的抗原結合位點,其包含seqidno.:8的可變輕鏈和seqidno.:7的可變重鏈;和至少一個對fap特異性的抗原結合位點,其包含與seqidno.:15的氨基酸序列具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的重鏈可變域(vh)序列。在某些實施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的vh序列相對于參照序列含有替代(例如保守替代),插入,或刪除,但是包含該序列的結合dr5和fap的雙特異性抗體保留結合fap和dr5的能力。在某些實施方案中,在seqidno.:15中替代,插入和/或刪除總共1至10個氨基酸。在某些實施方案中,替代,插入,或刪除發生在hvr以外的區域中(即在fr中)。任選地,結合dr5和fap的雙特異性抗體包含seqidno.:15中的vh序列,包括該序列的翻譯后修飾。在另一個方面,提供結合dr5和fap的雙特異性抗體,該雙特異性抗體包含至少一個對dr5特異性的抗原結合位點,其包含seqidno.:8的可變輕鏈和seqidno.:7的可變重鏈,和至少一個對fap特異性的抗原結合位點,其包含與seqidno.:16的氨基酸序列具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%序列同一性的輕鏈可變域(vl)。在某些實施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%,或99%同一性的vl序列相對于參照序列含有替代(例如保守替代),插入,或刪除,但是包含該序列的結合dr5和fap的雙特異性抗體保留結合dr5和fap的能力。在某些實施方案中,在seqidno.:16中替代,插入和/或刪除總共1至10個氨基酸。在某些實施方案中,替代,插入,或刪除發生在hvr以外的區域中(即在fr中)。任選地,結合dr5和fap的雙特異性抗體包含seqidno:16中的vl序列,包括該序列的翻譯后修飾。在另一個方面,提供結合dr5和fap的雙特異性抗體,其中該抗體包含上文提供的任何實施方案中的vh和上文提供的任何實施方案中的vl。在一個實施方案中,該抗體包含分別在seqidno:7和seqidno:8,及seqidno:15和seqidno:16中的vh和vl序列,包括那些序列的翻譯后修飾。在本發明的又一個方面,依照任何上述實施方案的結合dr5和fap的雙特異性抗體為單克隆抗體,包括嵌合,人源化或人抗體。在一個實施方案中,依照任何上述實施方案的所述結合dr5和fap的雙特異性抗體為人抗體。c.結合dr5和fap的雙特異性抗體的例示性型式在一個實施方案中,結合dr5和fap的雙特異性抗體包含抗體片段,例如fv,fab,fab’,scfv,xfab,scfab,雙抗體,或f(ab’)2片段。在另一個實施方案中,該抗體包含全長抗體,例如完整igg1抗體或本文中定義的其它抗體類或同種型。依照本發明的雙特異性抗體至少是二價的且可以是三價的或多價的,例如四價的或六價的。本發明的雙特異性抗體包含一個fc域,至少一個包含對dr5特異性的抗原結合位點的fab片段,和至少一個包含對fap特異性的抗原結合位點的fab片段,其中至少一個fab片段的重和輕鏈的可變區或恒定區任一是交換的。在另一個實施方案中,該雙特異性抗體包含一個fc域,至少一個包含對dr5特異性的抗原結合位點的fab片段,和至少一個包含對fap特異性的抗原結合位點的fab片段,其中至少一個fab片段經重鏈(vhch1)連接至該fc域的第一或第二亞基。在任何實施方案中,fab片段可以直接或經由包含一個或多個氨基酸,通常約2-20個氨基酸的肽接頭融合至fc域或彼此融合。肽接頭是本領域已知的,而且本文中有描述。合適的非免疫原性肽接頭包括例如(g4s)n,(sg4)n,(g4s)n或g4(sg4)n肽接頭。“n”一般為1和10之間,通常2和4之間的數值。一種對于將第一和第二抗原結合模塊的fab輕鏈彼此融合特別合適的肽接頭為(g4s)2。一種適合于連接第一和第二抗原結合模塊的fab重鏈的例示性肽接頭為epksc(d)-(g4s)2。另外,接頭可以包含(部分)免疫球蛋白鉸鏈區。特別地,在抗原結合模塊融合至fc域亞基的n末端的情況中,它可以經免疫球蛋白鉸鏈區或其部分融合,有或無另外的肽接頭。優選地,所述雙特異性抗體是四價的,具有兩個各自分別靶向fap和dr5的結合位點(2+2型式)。在另一個實施方案中,所述雙特異性抗體是四價的,具有三個針對dr5的結合位點和一個針對fap的結合位點(3+1型式)。3+1型式可以例如經由將一個靶向fap的fab片段和一個靶向dr5的fab片段融合至具有兩個dr5結合位點的igg分子的重鏈的c末端來實現。這在下文更加詳細地描繪。在另一個優選實施方案中,所述雙特異性抗體是三價的(2+1型式),具有兩個各自靶向dr5的結合位點和一個靶向fap的結合位點。2+1型式可以例如經由將一個靶向fap的fab片段融合至具有兩個dr5結合位點的igg分子的重鏈的c末端來實現,其中第一抗體的fc部分是依照下文描述的節入穴策略修飾的。在另一個優選實施方案中,所述雙特異性抗體是二價的(1+1型式),即對dr5和fap每項是單價的。本發明的二價抗體具有一個靶向dr5的結合位點和一個靶向fap的結合位點。1+1型式可以例如通過schaeferetal。procnatlacadsciusa2011;108:11187-92中描述和下文描繪的crossmab技術來實現。其中提供的是包含依照任何上述實施方案的任何序列的結合dr5和fap的不同雙特異性抗體型式。1.2+2型式的雙特異性dr5-fap抗體在一個優選的實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個fc域,兩個各自包含對dr5特異性的抗原結合位點的fab片段,和兩個各自包含對fap特異性的抗原結合位點的fab片段,其中至少一個fab片段的重和輕鏈的可變區或恒定區任一是交換的。既然上述雙特異性抗體對fap和dr5二者是二價的,具有各2個針對fap和dr5的結合位點,那么這種型式也稱作“2+2”型式。圖1中描繪具有2+2型式的雙特異性抗體的例示性結構。由于可變區或恒定區任一的交換,上述fab片段也稱作“cross-fab片段”或“xfab片段”或“交換fab片段”。在一個優選的實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個fc域,兩個各自包含對dr5特異性的抗原結合位點的fab片段,和兩個各自包含對fap特異性的抗原結合位點的fab片段,其中全部兩個包含對fap特異性的抗原結合位點的fab片段的重和輕鏈的可變區或恒定區任一是交換的。在另一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個fc域,兩個各自包含對dr5特異性的抗原結合位點的fab片段,和兩個各自包含對fap特異性的抗原結合位點的fab片段,其中全部兩個包含對dr5特異性的抗原結合位點的fab片段的重和輕鏈的可變區或恒定區任一是交換的。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個fc域,兩個各自包含對dr5特異性的抗原結合位點的fab片段,和兩個各自包含對fap特異性的抗原結合位點的fab片段,其中全部兩個包含對fap特異性的抗原結合位點的fab片段的重和輕鏈的可變區是交換的。在另一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個fc域,兩個各自包含對dr5特異性的抗原結合位點的fab片段,和兩個各自包含對fap特異性的抗原結合位點的fab片段,其中全部兩個包含對dr5特異性的抗原結合位點的fab片段的重和輕鏈的可變區是交換的。由于fab重和輕鏈的可變區的交換,對fap特異性的交換fab片段各自包含由輕鏈可變區(vl)和重鏈恒定區(ch1)構成的肽鏈,和由重鏈可變區(vh)和輕鏈恒定區(cl)構成的肽鏈。這些交換fab片段也稱作crossfab(vlvh)且各自包含vlch1和vhcl鏈。在一個優選的實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個fc域,兩個各自包含對dr5特異性的抗原結合位點的fab片段,和兩個各自包含對fap特異性的抗原結合位點的fab片段,其中全部兩個包含對fap特異性的抗原結合位點的fab片段的重和輕鏈的恒定區是交換的。在另一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個fc域,兩個各自包含對dr5特異性的抗原結合位點的fab片段,和兩個各自包含對fap特異性的抗原結合位點的fab片段,其中全部兩個包含對dr5特異性的抗原結合位點的fab片段的重和輕鏈的恒定區是交換的。由于fab重和輕鏈的恒定區的交換,對fap特異性的交換fab片段各自包含由重鏈可變區(vh)和輕鏈恒定區(cl)構成的肽鏈,和由輕鏈可變區(vl)和重鏈恒定區(ch1)構成的肽鏈。這些交換fab片段也稱作crossfab(clch1)且包含vhcl和vlch1鏈。在一個實施方案中,依照任何上述實施方案的所述結合dr5和fap的雙特異性抗體包含一個fc域,對其兩個fab片段融合至n末端且兩個fab片段融合至c末端,其中至少一個fab片段的重和輕鏈的可變區或恒定區任一是交換的。在一個實施方案中,兩個fab片段經由免疫球蛋白鉸鏈區融合至fc域的n末端。在一個實施方案中,免疫球蛋白鉸鏈區為人igg1鉸鏈區。在一個實施方案中,兩個包含對dr5特異性的抗原結合位點的fab片段和fc域是免疫球蛋白分子的部分。在一個特定實施方案中,免疫球蛋白分子為igg類免疫球蛋白。在一個甚至更加特定的實施方案中,免疫球蛋白為igg1亞類免疫球蛋白。在另一個實施方案中,免疫球蛋白為igg4亞類免疫球蛋白。在又一個特定實施方案中,免疫球蛋白為人免疫球蛋白。在其它實施方案中,免疫球蛋白為嵌合免疫球蛋白或人源化免疫球蛋白。在一個實施方案中,兩個包含對fap特異性的抗原結合位點的fab片段經肽接頭連接至fc域。在一個實施方案中,兩個包含對fap特異性的抗原結合位點的fab片段經肽接頭連接至fc域的第一或第二亞基的c末端。在一個此類實施方案中,所述包含對fap特異性的抗原結合位點的fab片段經肽接頭連接至fc域的第二亞基(ch3鏈)的c末端。在一個實施方案中,依照任何上述實施方案的所述結合dr5和fap的雙特異性抗體包含a)一個具有兩個對dr5特異性的結合位點(即兩個對dr5特異性的fab片段)的免疫球蛋白g(igg)分子,和b)兩個對fap特異性的fab片段,其中重和輕鏈的可變區或恒定區任一是交換的。在另一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個具有兩個對dr5特異性的結合位點(fab片段)的免疫球蛋白g(igg)分子,其中重和輕鏈的可變區或恒定區任一是交換的,和b)兩個對fap特異性的fab片段。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,和b)兩個對fap特異性的fab片段,其中fab重和輕鏈的可變區是交換的。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,和b)兩個對fap特異性的fab片段,其中fab重和輕鏈的恒定區是交換的。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,和b)兩個對fap特異性的fab片段,其中重和輕鏈的可變區或恒定區任一是交換的,其中兩個fab片段融合至所述igg分子的恒定重鏈。在一個實施方案中,所述兩個fab片段融合至所述igg分子的恒定重鏈的c末端。在一個實施方案中,所述兩個fab片段在可變重鏈(vh)的n末端處融合至所述igg分子的fc域的第一或第二亞基。在一個實施方案中,所述兩個fab片段融合至所述igg分子的fc域的第二亞基(ch3)的c末端。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,和b)兩個對fap特異性的fab片段,其中fab重和輕鏈的可變區是交換的,其中兩個fab片段融合至所述igg分子的恒定重鏈。在一個實施方案中,所述兩個fab片段融合至所述igg分子的恒定重鏈的c末端。在一個實施方案中,所述兩個fab片段在恒定重鏈(ch1)的c末端處融合至所述igg分子的fc域的第一或第二亞基。在一個實施方案中,所述兩個fab片段融合至所述igg分子的fc域的第二亞基(ch3)的c末端。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,和b)兩個對fap特異性的fab片段,其中fab重和輕鏈的恒定區是交換的,其中兩個fab片段融合至所述igg分子的恒定重鏈。在一個實施方案中,所述兩個fab片段融合至所述igg分子的恒定重鏈的c末端。在一個實施方案中,所述兩個fab片段在恒定重鏈(ch1)的c末端處融合至所述igg分子的fc域的第一或第二亞基。在一個實施方案中,所述兩個fab片段融合至所述igg分子的fc域的第二亞基(ch3)的c末端。在又一個優選的實施方案中,兩個對fap特異性的fab片段通過肽接頭,優選具有約10-30個氨基酸的長度的肽接頭融合至igg分子。優選地,所述肽接頭為(g4s)2或(g4s)4接頭。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,和b)兩個對fap特異性的fab片段,其中fab重和輕鏈的可變區是交換的,其中兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈。在一個實施方案中,所述兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈的c末端。在一個實施方案中,所述兩個fab片段通過肽接頭在恒定重鏈(ch1)的c末端處融合至所述igg分子的fc域的第一或第二亞基。在一個實施方案中,所述兩個fab片段通過肽接頭融合至所述igg分子的fc域的第二亞基(ch3)的c末端。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,和b)兩個對fap特異性的fab片段,其中fab重和輕鏈的恒定區是交換的,其中兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈。在一個實施方案中,所述兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈的c末端。在一個實施方案中,所述兩個fab片段通過肽接頭在可變重鏈(vh)的n末端處融合至所述igg分子的fc域的第一或第二亞基。在一個實施方案中,所述兩個fab片段通過肽接頭融合至所述igg分子的fc域的第二亞基(ch3)的c末端。在一個實施方案中,該雙特異性抗體包含一個fc域,兩個包含對dr5特異性的抗原結合位點的fab片段,和兩個包含對fap特異性的抗原結合位點的fab片段,其中至少一個fab片段經重鏈(vhch1)融合至fc域的第一或第二亞基。在一個實施方案中,該雙特異性抗體包含:a)一個fc域,b)兩個包含對dr5特異性的抗原結合位點的fab片段,其中所述fab片段在恒定重鏈(ch1)的c末端處連接至fc域的第一或第二亞基,和c)兩個包含對fap特異性的抗原結合位點的fab片段,其中兩個fab片段在可變重鏈(vh)的n末端處連接至fc域的第一或第二亞基。在一個實施方案中,該雙特異性抗體包含a)一個fc域,b)兩個包含對dr5特異性的抗原結合位點的fab片段,其中所述fab片段在恒定重鏈(ch1)的c末端處連接至fc域的第一亞基的n末端,和c)兩個包含對fap特異性的抗原結合位點的fab片段,其中兩個fab片段在可變輕鏈(vl)的n末端處連接至fc域的第二亞基(ch3)。在一個實施方案中,所述兩個包含對dr5特異性的抗原結合位點的fab片段各自經由免疫球蛋白鉸鏈區融合至fc域。在一個具體的實施方案中,免疫球蛋白鉸鏈區為人igg1鉸鏈區。在一個實施方案中,兩個包含對dr5特異性的抗原結合位點的fab片段和fc域是免疫球蛋白分子的部分。在一個特定實施方案中,免疫球蛋白分子為igg類免疫球蛋白。在一個甚至更加特定的實施方案中,免疫球蛋白為igg1亞類免疫球蛋白。在另一個實施方案中,免疫球蛋白為igg4亞類免疫球蛋白。在又一個特定實施方案中,免疫球蛋白為人免疫球蛋白。在其它實施方案中,免疫球蛋白為嵌合免疫球蛋白或人源化免疫球蛋白。在一個實施方案中,兩個包含對fap特異性的抗原結合位點的fab片段經肽接頭連接至fc域。例示性的具有2+2型式的抗體在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個免疫球蛋白g(igg)分子,該免疫球蛋白g(igg)分子具有兩個對dr5特異性的結合位點,其包含seqidno.:1的重鏈cdr1;seqidno.:2的重鏈cdr2;seqidno.:3的重鏈cdr3;seqidno.:4的輕鏈cdr1;seqidno.:5的輕鏈cdr2;seqidno.:6的輕鏈cdr3;和b)兩個對fap特異性的fab片段,其包含seqidno.:9的重鏈cdr1;seqidno.:10的重鏈cdr2;seqidno.:11的重鏈cdr3;seqidno.:12的輕鏈cdr1;seqidno.:13的輕鏈cdr2;seqidno.:14的輕鏈cdr3;其中fab重和輕鏈的恒定區是交換的,其中兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個免疫球蛋白g(igg)分子,該免疫球蛋白g(igg)分子具有兩個對dr5特異性的結合位點,其包含seqidno.:1的重鏈cdr1;seqidno.:2的重鏈cdr2;seqidno.:3的重鏈cdr3;seqidno.:4的輕鏈cdr1;seqidno.:5的輕鏈cdr2;和seqidno.:6的輕鏈cdr3;和b)兩個對fap特異性的fab片段,其包含seqidno.:9的重鏈cdr1;seqidno.:10的重鏈cdr2;seqidno.:11的重鏈cdr3;seqidno.:12的輕鏈cdr1;seqidno.:13的輕鏈cdr2;和seqidno.:14的輕鏈cdr3;其中fab重和輕鏈的可變區是交換的,其中兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個免疫球蛋白g(igg)分子,該免疫球蛋白g(igg)分子具有兩個對dr5特異性的結合位點,其包含seqidno.:7的可變重鏈和seqidno.:8的可變輕鏈;和b)兩個對fap特異性的fab片段,其包含包含seqidno.:15的氨基酸序列的重鏈可變區和包含seqidno.:16的氨基酸序列的輕鏈可變區;其中fab重和輕鏈的恒定區是交換的,其中兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個免疫球蛋白g(igg)分子,該免疫球蛋白g(igg)分子具有兩個對dr5特異性的結合位點,其包含seqidno.:7的可變重鏈和seqidno.:8的可變輕鏈;和b)兩個對fap特異性的fab片段,其包含包含seqidno.:15的氨基酸序列的重鏈可變區和包含seqidno.:16的氨基酸序列的輕鏈可變區;其中fab重和輕鏈的可變區是交換的,其中兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈。在另一個實施方案中,本發明的所述雙特異性抗體包含igg分子的fc部分中的修飾,如下文描繪的。在一個實施方案中,提供具有上文所述2+2型式的雙特異性抗體,其包含兩個seqidno.:18的vh(dr5)-fc部分-vh(fap)-cl鏈,兩個seqidno.:19的vl(dr5)-卡帕輕鏈和兩個seqidno.:20的vlch1(fap)鏈。在一個實施方案中,提供具有如上所述2+2型式的雙特異性抗體,其包含兩個seqidno.:17的vh(dr5)-fc部分-vh(fap)-cl鏈,兩個seqidno.:19的vl(dr5)-卡帕輕鏈和兩個seqidno.:20的vlch1(fap)鏈。2.2+1型式的雙特異性dr5-fap抗體在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個fc域,兩個包含對dr5特異性的抗原結合位點的fab片段,和一個包含對fap特異性的抗原結合位點的fab片段,其中至少一個fab片段的重和輕鏈的可變區或恒定區任一是交換的。既然上述雙特異性抗體是三價的,具有一個針對fap的結合位點和兩個針對dr5的結合位點,那么這種型式也稱作“2+1”型式。因此,這節中提供的雙特異性抗體對dr5是二價的且對fap是單價的。由于可變區或恒定區任一的交換,上述fab片段也稱作“cross-fab片段”或“xfab片段”或“交換fab片段”。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個fc域,兩個各自包含對dr5特異性的抗原結合位點的fab片段,和一個包含對fap特異性的抗原結合位點的fab片段,其中包含對fap特異性的抗原結合位點的fab片段的重和輕鏈的可變區或恒定區任一是交換的。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個fc域,兩個各自包含對dr5特異性的抗原結合位點的fab片段,和一個包含對fap特異性的抗原結合位點的fab片段,其中包含對fap特異性的抗原結合位點的fab片段的重和輕鏈的可變區是交換的。由于fab重和輕鏈的可變區的交換,對fap特異性的交換fab片段各自包含由輕鏈可變區(vl)和重鏈恒定區(ch1)構成的肽鏈,和由重鏈可變區(vh)和輕鏈恒定區(cl)構成的肽鏈。這些交換fab片段也稱作crossfab(vlvh)且包含vlch1和vhcl鏈。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個fc域,兩個各自包含對dr5特異性的抗原結合位點的fab片段,和一個包含對fap特異性的抗原結合位點的fab片段,其中全部兩個包含對fap特異性的抗原結合位點的fab片段的重和輕鏈的恒定區是交換的。由于fab重和輕鏈的恒定區的交換,對fap特異性的交換fab片段各自包含由重鏈可變區(vh)和輕鏈恒定區(cl)構成的肽鏈,和由輕鏈可變區(vl)和重鏈恒定區(ch1)構成的肽鏈。這些交換fab片段也稱作crossfab(clch1)且包含vhcl和vlch1鏈。在一個實施方案中,依照任何上述實施方案的所述結合dr5和fap的雙特異性抗體包含一個fc域,對其兩個fab片段融合至n末端。在一個實施方案中,兩個fab片段經由免疫球蛋白鉸鏈區融合至fc域的n末端。在一個實施方案中,免疫球蛋白鉸鏈區為人igg1鉸鏈區。在一個特定實施方案中,免疫球蛋白分子為igg類免疫球蛋白。在一個甚至更加特定的實施方案中,免疫球蛋白為igg1亞類免疫球蛋白。在另一個實施方案中,免疫球蛋白為igg4亞類免疫球蛋白。在又一個特定實施方案中,免疫球蛋白為人免疫球蛋白。在其它實施方案中,免疫球蛋白為嵌合免疫球蛋白或人源化免疫球蛋白。有fap結合物融合至c末端的2+1型式的雙特異性dr5-fap抗體在一個實施方案中,兩個包含對dr5特異性的抗原結合位點的fab片段和fc域是免疫球蛋白分子的部分。在一個實施方案中,一個包含對fap特異性的抗原結合位點的fab片段經肽接頭融合至fc域的第一或第二亞基的c末端。在一個此類實施方案中,所述包含對fap特異性的抗原結合位點的fab片段經肽接頭融合至fc域的第二亞基(ch3鏈)的c末端。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點(fab片段)的免疫球蛋白g(igg)分子,和b)一個對fap特異性的fab片段,其中重和輕鏈的可變區或恒定區任一是交換的。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,和b)一個對fap特異性的fab片段,其中fab重和輕鏈的可變區是交換的。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,和b)一個對fap特異性的fab片段,其中fab重和輕鏈的恒定區是交換的。在一個優選的實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,和b)一個對fap特異性的fab片段,其中重和輕鏈的可變區或恒定區任一是交換的,其中fab片段融合至所述igg分子的恒定重鏈。在一個實施方案中,b)的所述對fap特異性的fab片段融合至所述igg分子的fc域的第一或第二亞基的c末端。在一個實施方案中,b)的所述fab片段融合至所述igg分子的fc域的第二亞基(ch3)的c末端。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,和b)一個對fap特異性的fab片段,其中fab重和輕鏈的可變區是交換的,其中fab片段融合至所述igg分子的恒定重鏈。在一個實施方案中,b)的所述對fap特異性的fab片段融合至所述igg分子的fc域的第一或第二亞基的c末端。在一個實施方案中,b)的所述fab片段融合至所述igg分子的fc域的第二亞基(ch3)的c末端。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,和b)一個對fap特異性的fab片段,其中fab重和輕鏈的恒定區是交換的,其中fab片段融合至所述igg分子的恒定重鏈。在一個實施方案中,b)的所述fab片段對fap特異性的融合至所述igg分子的fc域的第一或第二亞基的c末端。在一個實施方案中,所述fab片段ofb)融合至所述igg分子的fc域的第二亞基(ch3)的c末端。有fap結合物融合至n末端的2+1型式的雙特異性dr5-fap抗體在另一個實施方案中,一個包含對dr5特異性的抗原結合位點的fab片段,一個包含對fap特異性的抗原結合位點的fab片段和fc域是免疫球蛋白分子的部分。在一個實施方案中,另一個包含對dr5特異性的抗原結合位點的fab片段經肽接頭融合至igg分子的包含對dr5特異性的抗原結合位點的fab片段的n末端。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有一個對dr5特異性的結合位點(fab片段)和一個對fap特異性的結合位點(fab片段)的免疫球蛋白g(igg)分子,其中對fap特異性的fab片段為crossfab片段(即重和輕鏈的可變區或恒定區任一是交換的);和b)一個對dr5特異性的fab片段。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有一個對dr5特異性的結合位點和一個對fap特異性的結合位點的免疫球蛋白g(igg)分子,其中對fap特異性的fab片段為crossfab(vlvh)片段(即重和輕鏈的可變區是交換的);和b)一個對dr5特異性的fab片段。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有一個對dr5特異性的結合位點和一個對fap特異性的結合位點的免疫球蛋白g(igg)分子,其中對fap特異性的fab片段為crossfab(clch1)片段(即重和輕鏈的恒定區是交換的);和b)一個對dr5特異性的fab片段。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有一個對dr5特異性的結合位點和一個對fap特異性的結合位點的免疫球蛋白g(igg)分子,其中對fap特異性的fab片段為crossfab片段(即重和輕鏈的可變區或恒定區任一是交換的);和b)一個對dr5特異性的fab片段,其中所述fab片段融合至igg分子的可變重或輕鏈的n末端。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有一個對dr5特異性的結合位點(fab片段)和一個對fap特異性的結合位點的免疫球蛋白g(igg)分子,其中對fap特異性的fab片段為crossfab(vlvh)片段(即重和輕鏈的可變區是交換的);和b)一個對dr5特異性的fab片段,其中所述fab片段融合至igg分子的可變重或輕鏈的n末端。在一個實施方案中,b)的對dr5特異性的fab片段融合至a)的對dr5特異性的fab片段的可變重或輕鏈的n末端。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有一個對dr5特異性的結合位點和一個對fap特異性的結合位點的免疫球蛋白g(igg)分子,其中對fap特異性的fab片段為crossfab(clch1)片段(即重和輕鏈的恒定區是交換的);和b)一個對dr5特異性的fab片段,其中所述fab片段融合至igg分子的可變重或輕鏈的n末端。在一個實施方案中,b)的對dr5特異性的fab片段融合至a)的對dr5特異性的fab片段的可變重或輕鏈的n末端。在又一個優選的實施方案中,對dr5特異性的fab片段通過肽接頭融合至igg分子,優選具有約10–30個氨基酸的長度的肽接頭。優選地,所述肽接頭為(g4s)2或(g4s)4接頭。在另一個實施方案中所述本發明的雙特異性抗體包含igg分子的fc部分中的修飾,如下文描繪的。3.3+1型式的雙特異性dr5-fap抗體在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:一個fc域,三個各自包含對dr5特異性的抗原結合位點的fab片段,和一個包含對fap特異性的抗原結合位點的fab片段,其中至少一個fab片段的重和輕鏈的可變區或恒定區任一是交換的。既然上述雙特異性抗體是四價的,具有一個針對fap的結合位點和三個針對dr5的結合位點,那么這種型式也稱作“3+1”型式。因此,這節中描述的雙特異性分子對dr5是三價的且對fap是單價的。由于可變區或恒定區任一的交換,上述fab片段也稱作“cross-fab片段”或“xfab片段”或“交換fab片段”。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個fc域,三個各自包含對dr5特異性的抗原結合位點的fab片段,和一個包含對fap特異性的抗原結合位點的fab片段,其中包含對fap特異性的抗原結合位點的fab片段的重和輕鏈的可變區或恒定區任一是交換的。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個fc域,三個各自包含對dr5特異性的抗原結合位點的fab片段,和一個包含對fap特異性的抗原結合位點的fab片段,其中包含對fap特異性的抗原結合位點的fab片段的重和輕鏈的可變區是交換的。由于fab重和輕鏈的可變區的交換,對fap特異性的交換fab片段包含由輕鏈可變區(vl)和重鏈恒定區(ch1)構成的肽鏈,和由重鏈可變區(vh)和輕鏈恒定區(cl)構成的肽鏈。這種交換fab片段也稱作crossfab(vlvh)且包含vlch1和vhcl鏈。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個fc域,三個各自包含對dr5特異性的抗原結合位點的fab片段,和一個包含對fap特異性的抗原結合位點的fab片段,其中包含對fap特異性的抗原結合位點的fab片段的重和輕鏈的恒定區是交換的。由于fab重和輕鏈的恒定區的交換,對fap特異性的交換fab片段各自包含由重鏈可變區(vh)和輕鏈恒定區(cl)構成的肽鏈,和由輕鏈可變區(vl)和重鏈恒定區(ch1)構成的肽鏈。這種交換fab片段也稱作crossfab(clch1)且包含vhcl和vlch1鏈。在一個實施方案中,依照任何上述實施方案的所述結合dr5和fap的雙特異性抗體包含一個fc域,對其兩個fab片段融合至n末端且兩個fab片段融合至c末端,其中一個對fap特異性的fab片段的重和輕鏈的可變區或恒定區任一是交換的。在一個實施方案中,兩個fab片段經由免疫球蛋白鉸鏈區融合至fc域的n末端。在一個實施方案中,免疫球蛋白鉸鏈區為人igg1鉸鏈區。在一個實施方案中,兩個包含對dr5特異性的抗原結合位點的fab片段和fc域是免疫球蛋白分子的部分。在一個特定實施方案中,免疫球蛋白分子為igg類免疫球蛋白。在一個甚至更加特定的實施方案中,免疫球蛋白為igg1亞類免疫球蛋白。在另一個實施方案中,免疫球蛋白為igg4亞類免疫球蛋白。在又一個特定實施方案中,免疫球蛋白為人免疫球蛋白。在其它實施方案中,免疫球蛋白為嵌合免疫球蛋白或人源化免疫球蛋白。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點(fab片段)的免疫球蛋白g(igg)分子,b)一個對fap特異性的fab片段,其中重和輕鏈的可變區或恒定區任一是交換的;和c)一個對dr5特異性的fab片段。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點(fab片段)的免疫球蛋白g(igg)分子,b)一個對fap特異性的fab片段,其中fab重和輕鏈的可變區是交換的;和c)一個對dr5特異性的fab片段。任選地,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個具有兩個對dr5特異性的結合位點(fab片段)的免疫球蛋白g(igg)分子,b)一個對fap特異性的fab片段,其中fab重和輕鏈的恒定區是交換的;和c)一個對dr5特異性的fab片段。在一個優選的實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點(fab片段)的免疫球蛋白g(igg)分子,b)一個對fap特異性的fab片段,其中重和輕鏈的可變區或恒定區任一是交換的;和c)一個對dr5特異性的fab片段,其中b)和c)的fab片段融合至所述igg分子的fc域的第一或第二亞基的c末端。在一個實施方案中,b)和c)的所述兩個fab片段融合至所述igg分子的fc域的第二亞基(ch3)的c末端。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點(fab片段)的免疫球蛋白g(igg)分子,b)一個對fap特異性的fab片段,其中fab重和輕鏈的可變區是交換的;和c)一個對dr5特異性的fab片段,其中b)和c)的fab片段融合至所述igg分子的fc域的第一或第二亞基。在一個實施方案中,b)和c)的所述兩個fab片段融合至所述igg分子的fc域的第二亞基(ch3)的c末端。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點(fab片段)的免疫球蛋白g(igg)分子,b)一個對fap特異性的fab片段,其中fab重和輕鏈的恒定區是交換的,和c)一個對dr5特異性的fab片段,其中b)和c)的fab片段融合至所述igg分子的fc域的第一或第二亞基。在一個實施方案中,b)和c)的所述兩個fab片段融合至所述igg分子的fc域的第二亞基(ch3)的c末端。在又一個優選的實施方案中,這節中描述的任何實施方案的b)和c)的兩個fab片段通過肽接頭融合至igg分子,優選具有約10–30個氨基酸的長度的肽接頭。優選地,所述肽接頭為(g4s)2或(g4s)4接頭。在另一個實施方案中,所述本發明的雙特異性抗體包含igg分子的fc部分中的修飾,如下文描繪的。4.1+1型式的雙特異性dr5-fap抗體在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個fc域,一個包含對dr5特異性的抗原結合位點的fab片段,和一個包含對fap特異性的抗原結合位點的fab片段,其中至少一個fab片段的重和輕鏈的可變區或恒定區任一是交換的。既然上述雙特異性抗體是二價的,具有一個針對fap的結合位點和一個針對dr5的結合位點,那么這種型式也稱作“1+1”型式。因此,這節中描述的雙特異性抗體對dr5是單價的且對fap是單價的。由于可變區或恒定區任一的交換,上述fab片段也稱作“cross-fab片段”或“xfab片段”或“交換fab片段”。1+1型式的igg分子也稱作crossmab型式(參見schaeferetal.,procnatlacadsciusa2011;108:11187-92)。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:一個fc域,一個包含對dr5特異性的抗原結合位點的fab片段,其中包含對dr5特異性的抗原結合位點的fab片段的重和輕鏈的可變區或恒定區任一是交換的,和一個包含對fap特異性的抗原結合位點的fab片段。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:一個fc域,一個包含對dr5特異性的抗原結合位點的fab片段,和一個包含對fap特異性的抗原結合位點的fab片段,其中包含對fap特異性的抗原結合位點的fab片段的重和輕鏈的可變區或恒定區任一是交換的。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:一個fc域,一個包含對dr5特異性的抗原結合位點的fab片段,和一個包含對fap特異性的抗原結合位點的fab片段,其中包含對fap特異性的抗原結合位點的fab片段的重和輕鏈的可變區是交換的。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:一個fc域,一個包含對dr5特異性的抗原結合位點的fab片段,和一個包含對fap特異性的抗原結合位點的fab片段,其中包含對fap特異性的抗原結合位點的fab片段的重和輕鏈的恒定區是交換的。在一個實施方案中,依照任何上述實施方案的所述結合dr5和fap的雙特異性抗體包含一個fc域,對其兩個fab片段融合至n末端,其中至少一個fab片段的重和輕鏈的可變區或恒定區任一是交換的。在一個實施方案中,兩個fab片段經由免疫球蛋白鉸鏈區融合至fc域的n末端。在一個實施方案中,免疫球蛋白鉸鏈區為人igg1鉸鏈區。在一個實施方案中,包含對dr5特異性的抗原結合位點的fab片段,包含對fap特異性的抗原結合位點的fab片段和fc域是免疫球蛋白分子的部分。在一個特定實施方案中,免疫球蛋白分子為igg類免疫球蛋白。在一個甚至更加特定的實施方案中,免疫球蛋白為igg1亞類免疫球蛋白。在另一個實施方案中,免疫球蛋白為igg4亞類免疫球蛋白。在又一個特定實施方案中,免疫球蛋白為人免疫球蛋白。在其它實施方案中,免疫球蛋白為嵌合免疫球蛋白或人源化免疫球蛋白。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個具有一個對dr5特異性的結合位點和一個對fap特異性的結合位點的免疫球蛋白g(igg)分子,其中igg分子的一個臂(fab片段)的重和輕鏈的可變區或恒定區任一是交換的。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個具有一個對dr5特異性的結合位點和一個對fap特異性的結合位點的免疫球蛋白g(igg)分子,其中igg分子的一個臂(fab片段)的重和輕鏈的可變區是交換的。這種抗體型式也稱作crossmab(vhvl)。在一個實施方案中,igg分子的包含對fap特異性的結合位點的一個臂(fab片段)的重和輕鏈的可變區是交換的。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個具有一個對dr5特異性的結合位點和一個對fap特異性的結合位點的免疫球蛋白g(igg)分子,其中igg分子的一個臂(fab片段)的重和輕鏈的恒定區是交換的。這種抗體型式也稱作crossmab(ch1cl)。在一個實施方案中,igg分子的包含對fap特異性的結合位點的一個臂(fab片段)的重和輕鏈的恒定區是交換的。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個具有一個對dr5特異性的結合位點和一個對fap特異性的結合位點的免疫球蛋白g(igg)分子,其中igg分子的一個臂(fab片段)的整個vh-ch1和vl-cl域是交換的。這意味著至少一個fab片段經輕鏈(vlcl)融合至fc域的n末端。在一個實施方案中,另一個fab片段經重鏈(vhch1)融合至fc域的n末端。這種抗體型式也稱作crossmabfab。在一個實施方案中,全部兩個fab片段經由免疫球蛋白鉸鏈區融合至fc域的n末端。d.降低fc受體結合和/或效應器功能的fc域修飾在一個優選的實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個免疫球蛋白g(igg)分子,其中fc部分是經過修飾的。經過修飾的fc部分具有與野生型fc部分相比降低的對fcγ受體的結合親和力。本發明的雙特異性抗體的fc域由一對包含免疫球蛋白分子重鏈域的多肽鏈組成。例如,免疫球蛋白g(igg)分子的fc域是二聚體,其每個亞基包含ch2和ch3igg重鏈恒定域。fc域的兩個亞基能夠彼此穩定聯合。在一個實施方案中,本發明的雙特異性抗體的fc域是iggfc域。在一個具體的實施方案中,fc域是igg1fc域。在另一個實施方案中,fc域是igg4fc域。在一個更加具體的實施方案中,fc域是包含位置s228(kabat編號方式)處的氨基酸替代,特別是氨基酸替代s228p的igg4fc域。在一個更加具體的實施方案中,fc域是包含氨基酸替代l235e和s228p和p329g的igg4fc域。此氨基酸替代降低igg4抗體的體內fab臂交換(參見stubenrauch等,drugmetabolismanddisposition38,84-91(2010))。在又一個具體的實施方案中,fc域是人的。fc域賦予本發明的雙特異性抗體以有利的藥動學特性,包括長血清半衰期,其有助于在靶組織中的較好積累和有利的組織-血液分配比。然而,同時它可能導致不想要的本發明的雙特異性抗體對表達fc受體的細胞而非優選的攜帶抗原的細胞的靶向。因而,在具體的實施方案中,本發明的雙特異性抗體的fc域展現出與天然igg1fc域相比降低的對fc受體的結合親和力和/或降低的效應器功能。在一個此類實施方案中,fc域(或包含所述fc域的本發明的雙特異性抗體)展現出與天然igg1fc域(或包含天然igg1fc域的本發明的雙特異性抗體)相比少于50%,優選少于20%,更優選少于10%且最優選少于5%的對fc受體的結合親和力,和/或與天然igg1fc域(或包含天然igg1fc域的本發明的雙特異性抗體)相比少于50%,優選少于20%,更優選少于10%且最優選少于5%的效應器功能。在一個實施方案中,fc域(或包含所述fc域的本發明的雙特異性抗體)沒有實質性結合fc受體和/或誘導效應器功能。在一個具體的實施方案中,所述fc受體是fcγ受體。在一個實施方案中,所述fc受體是人fc受體。在一個實施方案中,所述fc受體是活化性fc受體。在一個特定的實施方案中,所述fc受體是活化性人fcγ受體,更具體地是人fcγriiia,fcγri或fcγriia,最具體地是人fcγriiia。在一個實施方案中,所述fc受體是抑制性fc受體。在一個具體的實施方案中,所述fc受體是抑制性人fcγ受體,更具體地是人fcγriiib。在一個實施方案中,效應器功能是cdc,adcc,adcp,和細胞因子分泌中的一項或多項。在一個具體的實施方案中,所述效應器功能是adcc。在一個實施方案中,所述fc域展現出與天然igg1fc域相比基本相似的對新生兒fc受體(fcrn)的結合親和力。當fc域(或包含所述fc域的本發明的雙特異性抗體)展現出超過約70%,特別是超過約80%,更特別是超過約90%的天然igg1fc域(或包含天然igg1fc域的本發明的雙特異性抗體)對fcrn的結合親和力時,實現基本相似的對fcrn的結合。在某些實施方案中,fc域工程化改造為具有與非工程化fc域相比降低的對fc受體的結合親和力和/或降低的效應器功能。在具體的實施方案中,本發明的雙特異性抗體的fc域包含一處或多處降低fc域對fc受體的結合親和力和/或效應器功能的氨基酸突變。通常,fc域的兩個亞基的每一個中存在相同的一處或多處氨基酸突變。在一個實施方案中,所述氨基酸突變降低fc域對fc受體的結合親和力。在一個實施方案中,所述氨基酸突變將fc域對fc受體的結合親和力降低至少2倍,至少5倍,或至少10倍。在有超過一處降低fc域對fc受體的結合親和力的氨基酸突變的實施方案中,這些氨基酸突變的組合可以將fc域對fc受體的結合親和力降低至少10倍,至少20倍,或甚至至少50倍。在一個實施方案中,包含工程化fc域的本發明的雙特異性抗體展現出與包含非工程化fc域的本發明的雙特異性抗體相比少于20%,特別是少于10%,更特別是少于5%的對fc受體的結合親和力。在一個具體的實施方案中,所述fc受體是fcγ受體。在一些實施方案中,所述fc受體是人fc受體。在一個實施方案中,所述fc受體是抑制性fc受體。在一個具體的實施方案中,所述fc受體是抑制性人fcγ受體,更具體地是人fcgriib。在一些實施方案中,所述fc受體是活化性fc受體。在一個特定的實施方案中,所述fc受體是活化性人fcγ受體,更特別是人fcγriiia,fcγri或fcγriia,最特別是人fcγriiia。優選地,對這些受體的每一種的結合是降低的。在一些實施方案中,對補體成分的結合親和力,特別是對c1q的結合親和力也是降低的。在一個實施方案中,對新生兒fc受體(fcrn)的結合親和力沒有降低。當fc域(或包含所述fc域的本發明的雙特異性抗體)展現出非工程化形式的fc域(或包含所述非工程化形式的fc域的本發明的雙特異性抗體)對fcrn的結合親和力的超過約70%時,實現基本相似的對fcrn的結合,即保留該fc域對所述受體的結合親和力。fc域或包含所述fc域的本發明的雙特異性抗體可以展現出超過約80%和甚至超過約90%的此類親和力。在某些實施方案中,本發明的雙特異性抗體的fc域工程化改造為具有與非工程化fc域相比降低的效應器功能。所述降低的效應器功能可包括但不限于下列一項或多項:降低的補體依賴性細胞毒性(cdc),降低的抗體依賴性細胞介導的細胞毒性(adcc),降低的抗體依賴性細胞吞噬作用(adcp),降低的細胞因子分泌,降低的免疫復合物介導的抗原呈遞細胞的抗原攝取,降低的對nk細胞的結合,降低的對巨噬細胞的結合,降低的對單核細胞的結合,降低的對多形核細胞的結合,降低的誘導凋亡的直接信號傳導,降低的樹突細胞成熟,或降低的t細胞引發。在一個實施方案中,所述降低的效應器功能是降低的cdc,降低的adcc,降低的adcp,和降低的細胞因子分泌中的一項或多項。在一個具體的實施方案中,所述降低的效應器功能是降低的adcc。在一個實施方案中,所述降低的adcc小于20%的由非工程化fc域(或包含非工程化fc域的本發明的雙特異性抗體)誘導的adcc。在一個實施方案中,所述降低fc域對fc受體的結合親和力和/或效應器功能的氨基酸突變是氨基酸替代。在一個實施方案中,fc域包含在e233,l234,l235,n297,p331和p329位置處的氨基酸替代。在一個更特定的實施方案中,fc域包含在l234,l235和p329位置處的氨基酸替代。在一些實施方案中,fc域包含氨基酸替代l234a和l235a。在一個此類實施方案中,fc域是igg1fc域,特別是人igg1fc域。在一個實施方案中,fc域包含在位置p329處的氨基酸替代。在一個更加特定的實施方案中,氨基酸替代是p329a或p329g,特別是p329g。在一個實施方案中,fc域包含在位置p329處的氨基酸替代和在選自以下的位置處的又一處氨基酸替代:e233,l234,l235,n297和p331。在一個更加特定的實施方案中,所述又一處氨基酸替代是e233p,l234a,l235a,l235e,n297a,n297d或p331s。在具體的實施方案中,所述fc域包含在位置p329,l234和l235處的氨基酸替代。在更具體的實施方案中,所述fc域包含氨基酸突變l234a,l235a和p329g(“p329glala”)。在一個此類實施方案中,fc域是igg1fc域,特別是人igg1fc域。氨基酸替代組合“p329glala”幾乎完全消除了人igg1fc域的fcγ受體結合,如記載于wo2012/130831,其通過提述完整并入本文。wo2012/130831還描述了制備此類突變體fc域的方法和用于測定其特性(諸如fc受體結合或效應器功能)的方法。igg4抗體展現出與igg1抗體相比降低的對fc受體的結合親和力和降低的效應器功能。因此,在一些實施方案中,本發明的雙特異性抗體的fc域是igg4fc域,特別是人igg4fc域。在一個實施方案中,所述igg4fc域包含在位置s228處的氨基酸替代,具體是氨基酸替代s228p。為了進一步降低其對fc受體的結合親和力和/或其效應器功能,在一個實施方案中,所述igg4fc域包含在位置l235處的氨基酸替代,具體是氨基酸替代l235e。在另一個實施方案中,所述igg4fc域包含在位置p329處的氨基酸替代,具體是氨基酸替代p329g。在一個具體的實施方案中,所述igg4fc域包含在位置s228,l235和p329處的氨基酸替代,具體是氨基酸替代s228p,l235e和p329g。此類igg4fc域突變體及其fcγ受體結合特性記載于wo2012/130831,其通過提述完整并入本文。在一個具體的實施方案中,展現出與天然igg1fc域相比降低的對fc受體的結合親和力和/或降低的效應器功能的fc域是包含氨基酸替代l234a,l235a和任選地p329g的人igg1fc域,或包含氨基酸替代s228p,l235e和任選地p329g的人igg4fc域。在某些實施方案中,已消除fc域的n-糖基化。在一個此類實施方案中,所述fc域包含在位置n297處的氨基酸突變,特別是用丙氨酸(n297a)或天冬氨酸(n297d)替換天冬酰胺的氨基酸替代。在上文和wo2012/130831中描述的fc域以外,具有降低的fc受體結合和/或效應器功能的fc域還包括那些具有fc域殘基238,265,269,270,297,327和329中一個或多個的替代的(美國專利no.6,737,056)。此類fc突變體包括具有在氨基酸位置265,269,270,297和327中的兩個或更多個處的替代的fc突變體,包括所謂的“dana”fc突變體,其具有殘基265和297變成丙氨酸的替代(美國專利no.7,332,581)。可以使用本領域中公知的遺傳或化學方法通過氨基酸刪除,替代,插入或修飾來制備突變體fc域。遺傳方法可以包括編碼dna序列的位點特異性誘變,pcr,基因合成等。正確的核苷酸變化可以通過例如測序來驗證。可以容易地測定對fc受體的結合,例如通過elisa或通過使用標準儀器諸如biacore儀(gehealthcare)的表面等離振子共振(spr)進行,并且fc受體諸如可通過重組表達獲得。本文中描述了一種合適的此類結合測定法。或者,可使用已知表達特定fc受體的細胞系,如表達fcγiiia受體的人nk細胞來評估fc域或包含fc域的細胞活化性雙特異性抗原結合分子對fc受體的結合親和力。可通過本領域中已知的方法來測量fc域或包含fc域的本發明的雙特異性抗體的效應器功能。評估感興趣分子的adcc活性的體外測定法的例子記載于美國專利no.5,500,362;hellstrom等,procnatlacadsciusa83,7059-7063(1986)和hellstrom等,procnatlacadsciusa82,1499-1502(1985);美國專利no.5,821,337;bruggemann等,jexpmed166,1351-1361(1987)。或者,可采用非放射性測定方法(參見例如用于流式細胞術的actitm非放射性細胞毒性測定法(celltechnology,inc.mountainview,ca);和cytotox非放射性細胞毒性測定法(promega,madison,wi))。對于此類測定法有用的效應細胞包括外周血單個核細胞(pbmc)和天然殺傷(nk)細胞。或者/另外,可體內評估感興趣分子的adcc活性,例如在動物模型中,諸如披露于clynes等,procnatlacadsciusa95,652-656(1998)的。在一些實施方案中,fc域對補體成分(特別是對c1q)的結合是降低的。因而,在fc域工程化為具有降低的效應器功能的一些實施方案中,所述降低的效應器功能包括降低的cdc。可實施c1q結合測定法來測定本發明的雙特異性抗體是否能夠結合c1q并因此具有cdc活性。參見例如wo2006/029879和wo2005/100402中的c1q和c3c結合elisa。為了評估補體激活,可實施cdc測定法(參見例如gazzano-santoro等,jimmunolmethods202,163(1996);cragg等,blood101,1045-1052(2003);以及cragg和glennie,blood103,2738-2743(2004))。下面的部分描述本發明的雙特異性抗體的優選實施方案,其包含降低fc受體結合和/或效應器功能的fc域修飾。在一個優選的實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,其中fc域展現與天然igg1fc域相比降低的對fc受體的結合親和力和/或降低的效應器功能;和b)兩個對fap特異性的fab片段,其中重和輕鏈的可變區或恒定區任一是交換的。在一個優選的實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,其中fc域包含一處或多處降低對fc受體的結合和/或效應器功能的氨基酸替代;和b)兩個對fap特異性的fab片段,其中重和輕鏈的可變區或恒定區任一是交換的。在一個優選的實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,其中所述一處或多處氨基酸替代在l234,l235,和p329中的一個或多個位置處;和b)兩個對fap特異性的fab片段,其中重和輕鏈的可變區或恒定區任一是交換的。在一個優選的實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,其中fc域的每個亞基包含三處降低對活化性或抑制性fc受體的結合和/或效應器功能的氨基酸替代,其中所述氨基酸替代為l234a,l235a和p329g;和b)兩個對fap特異性的fab片段,其中重和輕鏈的可變區或恒定區任一是交換的。在一個優選的實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,其中fc域的每個亞基包含三處降低對活化性或抑制性fc受體的結合和/或效應器功能的氨基酸替代,其中所述氨基酸替代為l234a,l235a和p329g;和b)兩個對fap特異性的fab片段,其中fab重和輕鏈的可變區是交換的。在一個優選的實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,其中fc域的每個亞基包含三處降低對活化性或抑制性fc受體的結合和/或效應器功能的氨基酸替代,其中所述氨基酸替代為l234a,l235a和p329g;和b)兩個對fap特異性的fab片段,其中fab重和輕鏈的恒定區是交換的。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,其中fc域的每個亞基包含三處降低對活化性或抑制性fc受體的結合和/或效應器功能的氨基酸替代,其中所述氨基酸替代為l234a,l235a和p329g;和b)兩個對fap特異性的fab片段,其中fab重和輕鏈的可變區是交換的,其中兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個具有兩個對dr5特異性的結合位點的免疫球蛋白g(igg)分子,其中fc域的每個亞基包含三處降低對活化性或抑制性fc受體的結合和/或效應器功能的氨基酸替代,其中所述氨基酸替代為l234a,l235a和p329g;和b)兩個對fap特異性的fab片段,其中fab重和輕鏈的恒定區是交換的,其中兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個免疫球蛋白g(igg)分子,該免疫球蛋白g(igg)分子具有兩個對dr5特異性的結合位點,其包含seqidno.:1的重鏈cdr1;seqidno.:2的重鏈cdr2;seqidno.:3的重鏈cdr3;seqidno.:4的輕鏈cdr1;seqidno.:5的輕鏈cdr2;和seqidno.:6的輕鏈cdr3;其中fc域的每個亞基包含三處降低對活化性和抑制性fc受體的結合和/或效應器功能的氨基酸替代,其中所述氨基酸替代為l234a,l235a和p329g;和b)兩個對fap特異性的fab片段,其包含seqidno.:9的重鏈cdr1;seqidno.:10的重鏈cdr2;seqidno.:11的重鏈cdr3;seqidno.:12的輕鏈cdr1;seqidno.:13的輕鏈cdr2;和seqidno.:14的輕鏈cdr3;其中重和輕鏈的可變區或恒定區任一是交換的,其中兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個免疫球蛋白g(igg)分子,該免疫球蛋白g(igg)分子具有兩個對dr5特異性的結合位點,其包含seqidno.:1的重鏈cdr1;seqidno.:2的重鏈cdr2;seqidno.:3的重鏈cdr3;seqidno.:4的輕鏈cdr1;seqidno.:5的輕鏈cdr2;和seqidno.:6的輕鏈cdr3;其中fc域的每個亞基包含三處降低對活化性或抑制性fc受體的結合和/或效應器功能的氨基酸替代,其中所述氨基酸替代為l234a,l235a和p329g;和b)兩個對fap特異性的fab片段,其包含seqidno.:9的重鏈cdr1;seqidno.:10的重鏈cdr2;seqidno.:11的重鏈cdr3;seqidno.:12的輕鏈cdr1;seqidno.:13的輕鏈cdr2;和seqidno.:14的輕鏈cdr3;其中fab重和輕鏈的恒定區是交換的,其中兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個免疫球蛋白g(igg)分子,該免疫球蛋白g(igg)分子具有兩個對dr5特異性的結合位點,其包含seqidno.:1的重鏈cdr1;seqidno.:2的重鏈cdr2;seqidno.:3的重鏈cdr3;seqidno.:4的輕鏈cdr1;seqidno.:5的輕鏈cdr2;seqidno.:6的輕鏈cdr3;其中fc域的每個亞基包含三處降低對活化性或抑制性fc受體的結合和/或效應器功能的氨基酸替代,其中所述氨基酸替代為l234a,l235a和p329g;和b)兩個對fap特異性的fab片段,其包含seqidno.:9的重鏈cdr1;seqidno.:10的重鏈cdr2;seqidno.:11的重鏈cdr3;seqidno.:12的輕鏈cdr1;seqidno.:13的輕鏈cdr2;和seqidno.:14的輕鏈cdr3;其中fab重和輕鏈的可變區是交換的,其中兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含:a)一個免疫球蛋白g(igg)分子,該免疫球蛋白g(igg)分子具有兩個對dr5特異性的結合位點,其包含seqidno.:7的可變重鏈和seqidno.:8的可變輕鏈;其中fc域的每個亞基包含三處降低對活化性或抑制性fc受體的結合和/或效應器功能的氨基酸替代,其中所述氨基酸替代為l234a,l235a和p329g;和b)兩個對fap特異性的fab片段,其包含包含seqidno.:15的氨基酸序列的重鏈可變區和包含seqidno.:16的氨基酸序列的輕鏈可變區,其中重和輕鏈的可變區或恒定區任一是交換的,其中兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個免疫球蛋白g(igg)分子,該免疫球蛋白g(igg)分子具有兩個對dr5特異性的結合位點,其包含seqidno.:7的可變重鏈和seqidno.:8的可變輕鏈;其中fc域的每個亞基包含三處降低對活化性或抑制性fc受體的結合和/或效應器功能的氨基酸替代,其中所述氨基酸替代為l234a,l235a和p329g,和b)兩個對fap特異性的fab片段,其包含包含seqidno.:15的氨基酸序列的重鏈可變區和包含seqidno.:16的氨基酸序列的輕鏈可變區,其中fab重和輕鏈的恒定區是交換的,其中兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含a)一個免疫球蛋白g(igg)分子,該免疫球蛋白g(igg)分子具有兩個對dr5特異性的結合位點,其包含seqidno.:7的可變重鏈和seqidno.:8的可變輕鏈;其中fc域的每個亞基包含三處降低對活化性或抑制性fc受體的結合和/或效應器功能的氨基酸替代,其中所述氨基酸替代為l234a,l235a和p329g;和b)兩個對fap特異性的fab片段,其包含包含seqidno.:15的氨基酸序列的重鏈可變區和包含seqidno.:16的氨基酸序列的輕鏈可變區,其中fab重和輕鏈的可變區是交換的,其中兩個fab片段通過肽接頭融合至所述igg分子的恒定重鏈。e.促進異二聚化的fc域修飾本發明的雙特異性dr5-fap抗體包含不同的抗原結合模塊,其融合至fc域的兩個亞基之一個或另一個,如此fc域的兩個亞基通常包含在兩條不相同的多肽鏈中。這些多肽的重組共表達和隨后二聚化導致兩種多肽的數種可能組合。為了改進重組生產中本發明的雙特異性抗體的產率和純度,如此在本發明的雙特異性抗體的fc域中引入促進期望多肽聯合的修飾會是有利的。因而,在具體的實施方案中,本發明的雙特異性抗體的fc域包含促進fc域的第一和第二亞基聯合的修飾。人iggfc域的兩個亞基之間最廣泛的蛋白質-蛋白質相互作用的位點在fc域的ch3域中。如此,在一個實施方案中,所述修飾在fc域的ch3域中。在一個特定的實施方案中,所述修飾是所謂的“節-入-穴”修飾,其包含在fc域的兩個亞基之一中的“節”修飾和在fc域的兩個亞基之另一中的“穴”修飾。節-入-穴技術記載于例如us5,731,168;us7,695,936;ridgway等,proteng9,617-621(1996)和carter,jimmunolmeth248,7-15(2001)。一般地,該方法牽涉在第一多肽的界面處引入隆起(“節”)并在第二多肽的界面中引入相應的空腔(“穴”),使得隆起可以置于空腔中從而促進異二聚體形成并阻礙同二聚體形成。通過將來自第一多肽界面的小氨基酸側鏈用更大的側鏈(例如酪氨酸或色氨酸)替換來構建隆起。在第二多肽的界面中創建具有與隆起相同或相似大小的互補性空腔,其通過將大氨基酸側鏈用更小的氨基酸側鏈(例如丙氨酸或蘇氨酸)替換進行。因而,在一個具體的實施方案中,在本發明的雙特異性抗體的fc域的第一亞基的ch3域中,一個氨基酸殘基用具有更大側鏈體積的氨基酸殘基替換,由此在第一亞基的ch3域內生成隆起,其可安置于第二亞基的ch3域內的空腔中,而且在fc域的第二亞基的ch3域中,一個氨基酸殘基用具有更小側鏈體積的氨基酸殘基替換,由此在第二亞基的ch3域內生成空腔,其中可安置第一亞基的ch3域內的隆起。可以通過改變編碼多肽的核酸,例如通過位點特異性誘變或通過肽合成來生成隆起和空腔。在一個特定的實施方案中,在fc域第一亞基的ch3域中,第366位的蘇氨酸殘基用色氨酸殘基替換(t366w),而在fc域第二亞基的ch3域中,第407位的酪氨酸殘基用纈氨酸殘基替換(y407v)。在一個實施方案中,在fc域第二亞基中,另外,第366位的蘇氨酸殘基用絲氨酸殘基替換(t366s)且第368位的亮氨酸殘基用丙氨酸殘基替換(l368a)。在還有又一個實施方案中,在fc域的第一亞基中,另外,第354位的絲氨酸殘基用半胱氨酸殘基替換(s354c),而在fc域的第二亞基中,另外,第349位的酪氨酸殘基用半胱氨酸殘基替換(y349c)。這兩個半胱氨酸殘基的引入導致在fc域的兩個亞基之間形成二硫橋,進一步穩定了二聚體(carter,jimmunolmethods248,7-15(2001))。在一個備選的實施方案中,促進fc域的第一和第二亞基聯合的修飾包含介導靜電操縱效應(electrostaticsteeringeffect)的修飾,例如如記載于wo2009/089004的。一般地,此方法涉及將在兩個fc域亞基界面處的一個或多個氨基酸殘基替換為帶電荷的氨基酸殘基,從而在靜電上不利于同二聚體形成而在靜電上有利于異二聚化。在一個實施方案中,依照任何上述實施方案的結合dr5和fap的雙特異性抗體包含一個免疫球蛋白g(igg)分子,其具有兩個對dr5特異性的結合位點,其中第一重鏈的fc部分包含第一二聚化模塊且第二重鏈的fc部分包含第二二聚化模塊,容許igg分子的兩條重鏈異二聚化。在又一個優選的實施方案中,依照節入穴策略(參見carterp.;ridgwayj.b.b.;prestal.g.:immunotechnology,volume2,number1,february1996,pp.73-73(1)),第一二聚化模塊包含節且第二二聚化模塊包含穴。f.核酸序列,載體和生產方法編碼能夠結合dr5和fap的雙特異性抗體的多核苷酸可用于它的生產。編碼本發明的雙特異性抗體或結合dr5的抗體的多核苷酸可以作為編碼完整雙特異性抗原結合分子或完整結合dr5的抗體的單條多核苷酸或作為多條(例如兩條或更多條)共表達的多核苷酸來表達。由共表達的多核苷酸編碼的多肽可經由例如二硫鍵或其它手段聯合以形成功能性雙特異性抗體或結合dr5的抗體。例如,fab片段的輕鏈部分可以與雙特異性抗體或結合dr5的抗體中包含fab片段的重鏈部分,fc域亞基和任選(部分)另一個fab片段的部分由分開的多核苷酸編碼。當共表達時,重鏈多肽會與輕鏈多肽聯合以形成fab片段。又例如,本文中提供的雙特異性抗體或結合dr5的抗體中包含兩個fc域亞基中的一個和任選(部分)一個或多個fab片段的部分可以與本文中提供的雙特異性抗體或結合dr5的抗體中包含兩個fc域亞基中的另一個和任選(部分)fab片段的部分由分開的多核苷酸編碼。當共表達時,fc域亞基會聯合以形成fc域。在某些實施方案中,所述多核苷酸或核酸為dna。在其它實施方案中,本發明的多核苷酸為rna,例如信使rna(mrna)的形式。本發明的rna可以是單鏈的或雙鏈的。g.抗體變體在某些實施方案中,在上文描述的那些以外,還涵蓋本文中提供的雙特異性抗體或結合dr5的抗體的氨基酸序列變體。例如,可以期望改善雙特異性抗體或結合dr5的抗體的結合親和力和/或其它生物學特性。可以通過將合適的修飾引入編碼雙特異性抗體或結合dr5的抗體的核苷酸序列中,或者通過肽合成來制備雙特異性抗體或結合dr5的抗體的氨基酸序列變體。此類修飾包括例如對抗體的氨基酸序列內的殘基的刪除,和/或插入和/或替代。可以進行刪除,插入,和替代的任何組合以得到最終的構建體,只要最終的構建體擁有期望的特征,例如抗原結合。1.替代,插入,和刪除變體在某些實施方案中,提供了具有一處或多處氨基酸替代的抗體變體。替代誘變感興趣的位點包括hvr和fr。保守替代在表b中在“保守替代”的標題下顯示。更實質的變化在表b中在“例示性替代”的標題下提供,并且如下文參照氨基酸側鏈類別進一步描述的。可以將氨基酸替代引入感興趣的抗體中,并且對產物篩選期望的活性,例如保留/改善的抗原結合,降低的免疫原性,或改進的adcc或cdc。表b初始殘基例示性替代優選的替代ala(a)val;leu;ilevalarg(r)lys;gln;asnlysasn(n)gln;his;asp;lys;argglnasp(d)glu;asnglucys(c)ser;alasergln(q)asn;gluasnglu(e)asp;glnaspgly(g)alaalahis(h)asn;gln;lys;argargile(i)leu;val;met;ala;phe;正亮氨酸leuleu(l)正亮氨酸;ile;val;met;ala;pheilelys(k)arg;gln;asnargmet(m)leu;phe;ileleuphe(f)trp;leu;val;ile;ala;tyrtyrpro(p)alaalaser(s)thrthrthr(t)val;sersertrp(w)tyr;phetyrtyr(y)trp;phe;thr;serpheval(v)ile;leu;met;phe;ala;正亮氨酸leu依照共同的側鏈特性,氨基酸可以如下分組:(1)疏水性的:正亮氨酸,met,ala,val,leu,ile;(2)中性,親水性的:cys,ser,thr,asn,gln;(3)酸性的:asp,glu;(4)堿性的:his,lys,arg;(5)影響鏈取向的殘基:gly,pro;(6)芳香族的:trp,tyr,phe。非保守替代會需要用這些類別之一的成員替換另一個類別的。一類替代變體牽涉替代親本抗體(例如人源化或人抗體)的一個或多個高變區殘基。一般地,為進一步研究選擇的所得變體相對于親本抗體會具有某些生物學特性的改變(例如改善)(例如升高的親和力,降低的免疫原性)和/或會基本上保留親本抗體的某些生物學特性。例示性的替代變體是親和力成熟的抗體,其可以例如使用基于噬菌體展示的親和力成熟技術諸如本文中所描述的那些技術來方便地生成。簡言之,將一個或多個hvr殘基突變,并將變體抗體在噬菌體上展示,并對其篩選特定的生物學活性(例如結合親和力)。可以對hvr做出變化(例如,替代),例如以改善抗體親和力。可以對hvr“熱點”,即由在體細胞成熟過程期間以高頻率經歷突變的密碼子編碼的殘基(見例如chowdhury,methodsmol.biol.207:179-196(2008)),和/或sdr(a-cdr)做出此類變化,其中對所得的變體vh或vl測試結合親和力。通過次級文庫的構建和再選擇進行的親和力成熟已經記載于例如hoogenboom等于methodsinmolecularbiology178:1-37(o’brien等編,humanpress,totowa,nj,(2001))。在親和力成熟的一些實施方案中,通過多種方法(例如,易錯pcr,鏈改組,或寡核苷酸指導的誘變)將多樣性引入為成熟選擇的可變基因。然后,創建次級文庫。然后,篩選文庫以鑒定具有期望的親和力的任何抗體變體。另一種引入多樣性的方法牽涉hvr指導的方法,其中將幾個hvr殘基(例如,一次4-6個殘基)隨機化。可以例如使用丙氨酸掃描誘變或建模來特異性鑒定牽涉抗原結合的hvr殘基。特別地,經常靶向cdr-h3和cdr-l3。在某些實施方案中,可以在一個或多個hvr內發生替代,插入,或刪除,只要此類變化不實質性降低抗體結合抗原的能力。例如,可以對hvr做出保守變化(例如,保守替代,如本文中提供的),其不實質性降低結合親和力。此類變化可以在hvr“熱點”或sdr外部。在上文提供的變體vh和vl序列的某些實施方案中,每個hvr是未改變的,或者含有不超過1,2或3處氨基酸替代。一種可用于鑒定抗體中可以作為誘變靶位的殘基或區域的方法稱作“丙氨酸掃描誘變”,如由cunningham和wells(1989)science,244:1081-1085所描述的。在此方法中,將一個殘基或一組靶殘基(例如,帶電荷的殘基諸如arg,asp,his,lys,和glu)鑒定,并用中性或帶負電荷的氨基酸(例如,丙氨酸或多丙氨酸)替換以測定抗體與抗原的相互作用是否受到影響。可以在對初始替代表明功能敏感性的氨基酸位置引入進一步的替代。或者/另外,抗原-抗體復合物的晶體結構來鑒定抗體與抗原間的接觸點。作為替代的候選,可以靶向或消除此類接觸殘基和鄰近殘基。可以篩選變體以確定它們是否含有期望的特性。氨基酸序列插入包括長度范圍為1個殘基至含有100或更多個殘基的多肽的氨基和/或羧基端融合,及單個或多個氨基酸殘基的序列內插入。末端插入的例子包括具有n端甲硫氨酰基殘基的抗體。抗體分子的其它插入變體包括抗體的n或c端與酶(例如對于adept)或延長抗體的血清半衰期的多肽的融合物。2.糖基化變體在某些實施方案中,改變本文中提供的雙特異性抗體或結合dr5的抗體以提高或降低抗體糖基化的程度。可以通過改變氨基酸序列,使得創建或消除一個或多個糖基化位點來方便地實現對抗體的糖基化位點的添加或刪除。在雙特異性抗體或結合dr5的抗體包含fc區的情況中,可以改變其附著的碳水化合物。由哺乳動物細胞生成的天然抗體通常包含分支的,雙觸角寡糖,其一般通過n連接附著于fc區的ch2域的asn297。見例如wright等tibtech15:26-32(1997)。寡糖可以包括各種碳水化合物,例如,甘露糖,n-乙酰葡糖胺(glcnac),半乳糖,和唾液酸,以及附著于雙觸角寡糖結構“主干”中的glcnac的巖藻糖。在一些實施方案中,可以對本發明的雙特異性抗體或結合dr5的抗體中的寡糖進行修飾以創建具有某些改善的特性的抗體變體。在一個實施方案中,提供了雙特異性抗體變體或結合dr5的抗體的變體,其具有缺乏附著(直接或間接)于fc區的巖藻糖的碳水化合物結構。例如,此類抗體中的巖藻糖量可以是1%至80%,1%至65%,5%至65%或20%至40%。通過相對于附著于asn297的所有糖結構(例如,復合的,雜合的和高甘露糖的結構)的總和,計算asn297處糖鏈內巖藻糖的平均量來測定巖藻糖量,如通過maldi-tof質譜術測量的,例如如記載于wo2008/077546的。asn297指位于fc區中的約第297位(fc區殘基的eu編號方式)的天冬酰胺殘基;然而,asn297也可以由于抗體中的微小序列變異而位于第297位上游或下游約±3個氨基酸,即在第294位和第300位之間。此類巖藻糖基化變體可以具有改善的adcc功能。見例如美國專利公開文本no.us2003/0157108(presta,l.);us2004/0093621(kyowahakkokogyoco.,ltd)。涉及“脫巖藻糖基化的”或“巖藻糖缺乏的”抗體變體的出版物的例子包括:us2003/0157108;wo2000/61739;wo2001/29246;us2003/0115614;us2002/0164328;us2004/0093621;us2004/0132140;us2004/0110704;us2004/0110282;us2004/0109865;wo2003/085119;wo2003/084570;wo2005/035586;wo2005/035778;wo2005/053742;wo2002/031140;okazaki等j.mol.biol.336:1239-1249(2004);yamane-ohnuki等biotech.bioeng.87:614(2004)。能夠生成脫巖藻糖基化抗體的細胞系的例子包括蛋白質巖藻糖基化缺陷的lec13cho細胞(ripka等arch.biochem.biophys.249:533-545(1986);美國專利申請nous2003/0157108a1,presta,l;及wo2004/056312a1,adams等,尤其在實施例11),和敲除細胞系,諸如α-1,6-巖藻糖基轉移酶基因fut8敲除cho細胞(見例如yamane-ohnuki等biotech.bioeng.87:614(2004);kanda,y.等,biotechnol.bioeng.,94(4):680-688(2006);及wo2003/085107)。進一步提供了具有兩分型寡糖的雙特異性抗體變體或結合dr5的抗體的變體,例如其中附著于雙特異性抗體或結合dr5的抗體fc區的雙觸角寡糖是通過glcnac兩分的。此類雙特異性抗體變體或結合dr5的抗體的變體可以具有降低的巖藻糖基化和/或改善的adcc功能。此類抗體變體的例子記載于例如wo2003/011878(jean-mairet等);美國專利no.6,602,684(umana等);及us2005/0123546(umana等)。還提供了在附著于fc區的寡糖中具有至少一個半乳糖殘基的抗體變體。此類抗體變體可以具有改善的cdc功能。此類抗體變體記載于例如wo1997/30087(patel等);wo1998/58964(raju,s.);及wo1999/22764(raju,s.)。3.經半胱氨酸工程化改造的抗體變體在某些實施方案中,可以期望創建經半胱氨酸工程化改造的雙特異性抗體或結合dr5的抗體,例如,“thiomab”,其中雙特異性抗體或結合dr5的抗體的一個或多個殘基用半胱氨酸殘基替代。在具體的實施方案中,替代的殘基存在于雙特異性抗體或結合dr5的抗體的可接近位點。通過用半胱氨酸替代那些殘基,反應性硫醇基團由此定位于抗體的可接近位點,并且可以用于將抗體與其它模塊,諸如藥物模塊或接頭-藥物模塊綴合,以創建免疫綴合物。在某些實施方案中,可以用半胱氨酸替代下列殘基之任一個或多個:輕鏈的v205(kabat編號方式);重鏈的a118(eu編號方式);和重鏈fc區的s400(eu編號方式)。可以如例如美國專利no.7,521,541所述生成經半胱氨酸工程化改造的抗體。h.重組方法和組合物可以例如通過固相肽合成(例如merrifield固相肽合成)或重組生成來獲得本發明的雙特異性抗體和結合dr5的抗體。對于重組生成,分離一種或多種編碼所述雙特異性抗體(片段)或結合dr5的抗體(片段)的多核苷酸(例如如上文描述的),并將其插入一種或多種載體中用于在宿主細胞中進一步克隆和/或表達。可以使用常規規程容易分離并測序此類多核苷酸。在一個實施方案中,提供包含一種或多種本發明的多核苷酸的載體(優選為表達載體)。可以使用本領域技術人員公知的方法來構建含有雙特異性抗體(片段)或結合dr5的抗體(片段)的編碼序列以及適宜的轉錄/翻譯控制信號的表達載體。這些方法包括體外重組dna技術,合成技術和體內重組/遺傳重組。參見例如記載于maniatis等,molecularcloning:alaboratorymanual,coldspringharborlaboratory,n.y.(1989);和ausubel等,currentprotocolsinmolecularbiology,greenepublishingassociatesandwileyinterscience,n.y(1989)的技術。表達載體可以是質粒,病毒的一部分或可以是核酸片段。表達載體包含表達盒,其中(在與啟動子和/或其它轉錄或翻譯控制元件的可操作聯合中)克隆編碼雙特異性抗體(片段)或結合dr5的抗體(片段)的多核苷酸(即編碼區)。如本文中使用的,“編碼區”是核酸中由翻譯成氨基酸的密碼子組成的一部分。盡管“終止密碼子”(tag,tga或taa)不翻譯成氨基酸,但可將其視為編碼區的一部分(若存在的話),但任何側翼序列例如啟動子,核糖體結合位點,轉錄終止子,內含子,5’和3’非翻譯區等,不是編碼區的一部分。兩個或更多個編碼區可以存在于單一多核苷酸構建體中(例如在單一載體上),或存在于分開的多核苷酸構建體中,例如在分開的(不同的)載體上。此外,任何載體可含有單個編碼區,或可包含兩個或更多個編碼區,例如本發明的載體可以編碼一種或多種多肽,其經由蛋白水解切割在翻譯后或共翻譯分開成最終蛋白質。另外,本發明的載體,多核苷酸或核酸可以編碼異源編碼區,其與編碼本發明的雙特異性抗體(片段)或結合dr5的抗體(片段)或其變體或衍生物的多核苷酸融合或未融合。異源編碼區包括但不限于特殊化的元件或基序,諸如分泌信號肽或異源功能域。當基因產物例如多肽的編碼區與一種或多種調節序列以某種方式聯合從而使得該基因產物的表達置于該調節序列的影響或控制下時,即為可操作聯合。若誘導啟動子功能導致編碼期望的基因產物的mrna的轉錄并且若兩個dna片段之間的連接的性質不干擾表達調節序列指導基因產物表達的能力或不干擾dna模板被轉錄的能力,則兩個dna片段(諸如多肽編碼區和與其聯合的啟動子)為“可操作聯合的”。如此,如果啟動子能夠實現編碼多肽的核酸的轉錄,那么該啟動子區將是與該核酸可操作聯合。啟動子可以是細胞特異性啟動子,其僅在預先確定的細胞中指導dna的實質性轉錄。除啟動子以外,其它轉錄控制元件例如增強子,操縱基因,阻遏物和轉錄終止信號能與多核苷酸可操作聯合以指導細胞特異性轉錄。在本文中公開了合適的啟動子和其它轉錄控制區。多種轉錄控制區是本領域技術人員已知的。這些包括但不限于在脊椎動物細胞中發揮功能的轉錄控制區,諸如但不限于來自巨細胞病毒的啟動子和增強子區段(例如立即早期啟動子,連同內含子-a),猿病毒40(例如早期啟動子)和逆轉錄病毒(諸如例如勞斯(rous)肉瘤病毒)。其它轉錄控制區包括那些自脊椎動物基因諸如肌動蛋白,熱休克蛋白,牛生長激素和家兔a-球蛋白衍生的,以及能夠控制真核細胞中基因表達的其它序列。另外的合適的轉錄控制區包括組織特異性啟動子和增強子以及誘導型啟動子(例如四環素誘導型啟動子)。類似地,多種翻譯控制元件是本領域普通技術人員已知的。這些包括但不限于核糖體結合位點,翻譯起始和終止密碼子以及自病毒系統衍生的元件(具體地,內部核糖體進入位點或ires,亦稱為cite序列)。表達盒還可以包含其它特征,諸如復制起點和/或染色體整合元件,諸如逆轉錄病毒長末端重復(ltr)或腺伴隨病毒(aav)反向末端重復(itr)。本發明的多核苷酸和核酸編碼區可以與編碼分泌或信號肽的另外的編碼區聯合,所述分泌或信號肽指導由本發明的多核苷酸編碼的多肽的分泌。例如,如果期望分泌雙特異性抗體或結合dr5的抗體,那么可以將編碼信號序列的dna置于編碼本發明雙特異性抗體或本發明結合dr5的抗體或其片段的核酸上游。依照信號假說,由哺乳動物細胞分泌的蛋白質具有信號肽或分泌前導序列,一旦啟動將生長中的蛋白質鏈跨越粗面內質網輸出,就將該信號肽或分泌前導序列從成熟的蛋白質切去。本領域中普通技術人員知曉由脊椎動物細胞分泌的多肽一般具有融合至多肽n端的信號肽,其從所翻譯的多肽切去以生成分泌或“成熟”形式的多肽。在某些實施方案中,使用天然的信號肽,例如免疫球蛋白重鏈或輕鏈信號肽,或該序列的保留指導與其可操作聯合的多肽分泌的能力的功能性衍生物。或者,可以使用異源哺乳動物信號肽或其功能性衍生物。例如,可以將野生型前導序列用人組織纖溶酶原激活劑(tpa)或小鼠β-葡糖醛酸糖苷酶的前導序列取代。可以將編碼能用于促進后期純化(例如組氨酸標簽)或輔助標記雙特異性抗體或結合dr5的抗體的短蛋白質序列的dna納入雙特異性抗體(片段)或結合dr5的抗體(片段)編碼多核苷酸內或其末端。在又一個實施方案中,提供包含本發明的一種或多種多核苷酸的宿主細胞。在某些實施方案中,提供包含本發明的一種或多種載體的宿主細胞。多核苷酸和載體可以單獨地或組合地摻入本文中分別關于多核苷酸和載體所描述的任何特征。在一個此類實施方案中,宿主細胞包含載體(例如已用該載體轉化或轉染),所述載體包含編碼本發明雙特異性抗體或結合dr5的抗體(的部分)的多核苷酸。如本文中使用的,術語“宿主細胞”指任何種類能工程化改造以生成本發明的雙特異性抗體或結合dr5的抗體或其片段的細胞系統。適用于復制雙特異性抗體或結合dr5的抗體及支持其表達的宿主細胞是本領域中公知的。在適當時,可用特定的表達載體轉染或轉導此類細胞,并且可以培養大量的含載體細胞以用于接種大規模發酵罐,從而獲得充足量的雙特異性抗體或結合dr5的抗體用于臨床應用。合適的宿主細胞包括原核微生物諸如大腸桿菌,或各種真核細胞,諸如中國倉鼠卵巢細胞(cho),昆蟲細胞等。例如,可以在細菌中生成多肽,特別是在不需要糖基化時。在表達后,可以將多肽在可溶性級分中與細菌細胞糊分離并可以進一步純化。除了原核生物外,真核微生物諸如絲狀真菌或酵母也是適合多肽編碼載體的克隆或表達宿主,包括其糖基化途徑已被“人源化”,導致生成具有部分或完全人的糖基化樣式的多肽的真菌和酵母菌株。參見gerngross,natbiotech22,1409-1414(2004),和li等,natbiotech24,210-215(2006)。適用于表達(糖基化)多肽的宿主細胞還自多細胞生物體(無脊椎動物和脊椎動物)衍生。無脊椎動物細胞的例子包括植物和昆蟲細胞。已鑒定出可與昆蟲細胞一起使用的大量桿狀病毒株,特別是用于轉染草地貪夜蛾(spodopterafrugiperda)細胞。也可以將植物細胞培養物用作宿主。參見例如美國專利no.5,959,177,6,040,498,6,420,548,7,125,978和6,417,429(描述用于在轉基因植物中生成抗體的plantibodiestm技術)。脊椎動物細胞也可以用作宿主。例如,適應于在懸浮液中生長的哺乳動物細胞系可以是有用的。有用的哺乳動物宿主細胞系的其它例子是由sv40轉化的猴腎cv1系(cos-7);人胚腎系(293或293t細胞,如例如記載于graham等,jgenvirol36,59(1977)),幼倉鼠腎細胞(bhk),小鼠塞托利(sertoli)細胞(tm4細胞,如例如記載于mather,biolreprod23,243-251(1980)的),猴腎細胞(cv1),非洲綠猴腎細胞(vero-76),人宮頸癌細胞(hela),犬腎細胞(mdck),牛鼠(buffalorat)肝細胞(brl3a),人肺細胞(w138),人肝細胞(hepg2),小鼠乳房腫瘤細胞(mmt060562),tri細胞(如例如記載于mather等,annalsn.y.acadsci383,44-68(1982)的),mrc5細胞和fs4細胞。其它有用的哺乳動物宿主細胞系包括中國倉鼠卵巢(cho)細胞,包括dhfr-cho細胞(urlaub等,procnatlacadsciusa77,4216(1980));和骨髓瘤細胞系諸如yo,ns0,p3x63和sp2/0。對于某些適用于蛋白質生產的哺乳動物宿主細胞系的綜述,參見例如yazaki和wu,methodsinmolecularbiology,第248卷(b.k.c.lo編,humanapress,totowa,nj),pp.255-268(2003)。宿主細胞包括培養的細胞,例如哺乳動物培養細胞,酵母細胞,昆蟲細胞,細菌細胞和植物細胞等,但還包括在轉基因動物,轉基因植物或培養的植物或動物組織中包含的細胞。在一個實施方案中,宿主細胞是真核細胞,優選為哺乳動物細胞諸如中國倉鼠卵巢(cho)細胞,人胚腎(hek)細胞或淋巴樣細胞(例如y0,ns0,sp20細胞)。本領域中已知在這些系統中表達外來基因的標準技術。可以將表達包含抗原結合域諸如抗體的重鏈或輕鏈的多肽的細胞工程化改造為使得還表達另一抗體鏈,從而使得表達的產物是具有重鏈和輕鏈兩者的抗體。在一個實施方案中,提供了生成依照本發明的雙特異性抗體或結合dr5的抗體的方法,其中所述方法包括在適合于雙特異性抗體或結合dr5的抗體表達的條件下培養包含編碼雙特異性抗體或結合dr5的抗體的多核苷酸的宿主細胞(如本文中提供的),并從宿主細胞(或宿主細胞培養液)回收雙特異性抗體或結合dr5的抗體。雙特異性抗體或結合dr5的抗體的組分彼此遺傳融合。雙特異性抗體或結合dr5的抗體可設計為使其組分直接彼此融合或經由接頭序列間接融合。可依照本領域中公知的方法確定接頭的組成和長度,并可以測試功效。雙特異性抗體不同組分之間的接頭序列的例子見于本文中提供的序列。還可包含另外的序列以納入切割位點來分開融合物的各個組分(若期望的話),例如內肽酶識別序列。在某些實施方案中,雙特異性抗體或結合dr5的抗體的fab片段形成部分至少包含能夠結合抗原性決定簇的抗體可變區。可變區能形成天然或非天然存在的抗體及其片段的一部分及自其衍生。生成多克隆抗體和單克隆抗體的方法是本領域中公知的(參見例如harlow和lane,“antibodies,alaboratorymanual”,coldspringharborlaboratory,1988)。非天然存在的抗體可以使用固相肽合成構建,可以重組生成(例如如記載于美國專利no.4,186,567的)或可通過例如篩選包含可變重鏈和可變輕鏈的組合庫獲得(參見例如mccafferty的美國專利no.5,969,108)。可以將任何動物種類的抗體,抗體片段,抗原結合域或可變區用于本發明的雙特異性抗體或結合dr5的抗體。可用于本發明的非限制性抗體,抗體片段,抗原結合域或可變區可以是鼠,靈長類或人起源的。如果雙特異性抗體或結合dr5的抗體意圖供人使用,那么可以使用嵌合形式的抗體,其中抗體的恒定區來自人。也可以依照本領域中公知的方法制備人源化或全人形式的抗體(參見例如winter的美國專利no.5,565,332)。人源化可以通過各種方法實現,包括但不限于(a)將非人(例如供體抗體)cdr嫁接到人(例如受體抗體)框架和恒定區上,保留或不保留關鍵的框架殘基(例如那些對于保留較好的抗原結合親和力或抗體功能重要的殘基),(b)僅將非人特異性決定區(sdr或a-cdr;對于抗體-抗原相互作用關鍵的殘基)嫁接到人框架和恒定區上,或(c)移植完整的非人可變域,但通過替換表面殘基用人樣部分來“掩飾(cloak)”它們。人源化的抗體及其制備方法綜述于例如almagro和fransson,frontbiosci13,1619-1633(2008),并且還記載于例如riechmann等,nature332,323-329(1988);queen等,procnatlacadsciusa86,10029-10033(1989);美國專利no.5,821,337,7,527,791,6,982,321和7,087,409;jones等,nature321,522-525(1986);morrison等,procnatlacadsci81,6851-6855(1984);morrison和oi,advimmunol44,65-92(1988);verhoeyen等,science239,1534-1536(1988);padlan,molecimmun31(3),169-217(1994);kashmiri等,methods36,25-34(2005)(描述sdr(a-cdr)嫁接);padlan,molimmunol28,489-498(1991)(描述“表面重建”);dall’acqua等,methods36,43-60(2005)(描述“fr改組”);和osbourn等,methods36,61-68(2005)以及klimka等,brjcancer83,252-260(2000)(描述了fr改組的“引導選擇”辦法)。可以使用本領域中已知的各種技術來生成人抗體和人可變區。人抗體一般記載于vandijk和vandewinkel,curropinpharmacol5,368-74(2001)以及lonberg,curropinimmunol20,450-459(2008)。人可變區能形成通過雜交瘤方法制備的人單克隆抗體的一部分及自其衍生(參見例如monoclonalantibodyproductiontechniquesandapplications,pp.51-63(marceldekker,inc.,newyork,1987))。還可以通過對轉基因動物施用免疫原來制備人抗體和人可變區,所述轉基因動物已經過修飾以應答抗原刺激而生成完整的人抗體或具有人可變區的完整抗體(參見例如lonberg,natbiotech23,1117-1125(2005))。還可以通過分離自人衍生的噬菌體展示庫選擇的fv克隆可變區序列來生成人抗體和人可變區(參見例如hoogenboom等,于methodsinmolecularbiology178,1-37(o’brien等編,humanpress,totowa,nj,2001);和mccafferty等,nature348,552-554;clackson等,nature352,624-628(1991))。噬菌體通常展示抗體片段,作為單鏈fv(scfv)片段或作為fab片段。在某些實施方案中,將可用于本發明的fab片段工程化改造為具有增強的結合親和力,其依照例如公開于美國專利申請公開文本no.2004/0132066的方法進行,其完整內容通過提述據此并入。可以經由酶聯免疫吸附測定法(elisa)或本領域技術人員熟知的其它技術來測量本發明的雙特異性抗體或結合dr5的抗體結合特定抗原性決定簇的能力,所述其它技術例如表面等離振子共振技術(在biacoret100系統上分析)(liljeblad等,glycoj17,323-329(2000))和傳統的結合測定法(heeley,endocrres28,217-229(2002))。可以使用競爭測定法來鑒定與參照抗體競爭對特定抗原的結合的抗體,抗體片段,抗原結合域或可變域。在某些實施方案中,此類競爭性抗體結合由參照抗體結合的相同表位(例如線性或構象表位)。用于定位抗體結合的表位的詳細的例示性方法在morris(1996)“epitopemappingprotocols,”于methodsinmolecularbiologyvol.66(humanapress,totowa,nj)中提供。在一種例示性競爭測定法中,將固定化的抗原在溶液中溫育,所述溶液包含結合該抗原的第一經標記抗體和測試其與第一經抗體競爭對抗原的結合的第二未標記抗體。第二抗體可以存在于雜交瘤上清液中。作為對照,將固定化的抗原在溶液中溫育,所述溶液包含第一標記抗體但沒有第二未標記抗體。在允許第一抗體結合抗原的條件下溫育后,除去過量的未結合的抗體,并測量與固定化抗原聯合的標記物的量。如果與固定化抗原聯合的標記物的量在測試樣品中相對于對照樣品實質性降低,那么這指示第二抗體與第一抗體競爭對抗原的結合。參見harlow和lane(1988)antibodies:alaboratorymanualch.14(coldspringharborlaboratory,coldspringharbor,ny)。可以通過本領域已知的技術來純化如本文中描述的那樣制備的雙特異性抗體或結合dr5的抗體,所述技術諸如高效液相層析,離子交換層析,凝膠電泳,親和層析,大小排阻層析等。用于純化具體蛋白質的實際條件將部分取決于諸如凈電荷,疏水性,親水性等因素,而且對于本領域中的技術人員將是明顯的。對于親和層析純化,可以使用雙特異性抗體或結合dr5的抗體結合的抗體,配體,受體或抗原。例如,對于本發明的雙特異性抗體的親和層析純化,可以使用具有蛋白a或蛋白g的基質。可以連續使用蛋白a或g親和層析和大小排阻層析來分離雙特異性抗體,基本如實施例中描述的。可以通過多種公知的分析方法中的任一種來測定雙特異性抗體或結合dr5的抗體的純度,包括凝膠電泳,高壓液相層析等。i.測定法可以通過本領域中已知的多種測定法對本文中提供的結合dr5和fap的雙特異性抗體和結合dr5的抗體鑒定,篩選,或表征其物理/化學特性和/或生物學活性。1.親和力測定法可以依照實施例中提出的方法使用標準的儀器如biacore儀(gehealthcare)通過表面等離振子共振(spr)測定本文中提供的雙特異性抗體和結合dr5的抗體對dr5和/或fap的親和力,而且諸如可以通過重組表達獲得受體或靶蛋白。或者,可以例如通過流式細胞術(facs),使用表達特定受體或靶抗原的細胞系來評估本文中提供的雙特異性抗體和結合dr5的抗體對dr5和/或fap的結合。可以通過表面等離振子共振使用t100儀(gehealthcare)于25℃測量kd。為了分析fc部分與fc受體之間的相互作用,通過固定化于cm5芯片上的抗五his抗體(qiagen)來捕捉帶his標簽的重組fc受體并將雙特異性構建體用作分析物。簡言之,將羧甲基化的葡聚糖生物傳感器芯片(cm5,gehealthcare)依照供應商說明書用n-乙基-n’-(3-二甲基氨丙基)-碳二亞胺氫氯化物(edc)和n-羥基琥珀酰亞胺(nhs)活化。將抗五his抗體用10mm醋酸鈉ph5.0稀釋至40μg/ml,接著以5μl/分鐘的流速注射以實現約6500響應單位(ru)的偶聯蛋白質。在注射配體后,注射1m乙醇胺以封閉未反應的基團。然后,在4或10nm捕捉fc受體60秒。對于動力學測量,將雙特異性構建體的4倍連續稀釋液(范圍為約500nm至4000nm)在hbs-ep(gehealthcare,10mmhepes,150mmnacl,3mmedta,0.05%表面活性劑p20,ph7.4)中于25℃以30μl/min的流速注射120秒。為了測定對靶抗原的親和力,通過固定化于活化cm5傳感器芯片表面上的抗人fab特異性抗體(gehealthcare)來捕捉雙特異性構建體,如對于抗五his抗體所描述的。偶聯蛋白質的最終量為約12000ru。雙特異性構建體在300nm捕捉90秒。使靶抗原在從250至1000nm的濃度范圍以30μl/min的流速通過流動池達180秒。監測解離達180秒。通過扣除在參照流動池上獲得的響應來校正批量折射率(bulkrefractiveindex)差異。使用穩定態響應通過langmuir結合等溫線的非線性曲線擬合來導出解離常數kd。使用簡單的1對1langmuir結合模型(t100評估軟件版本1.1.1)通過同時擬合結合和解離傳感圖來計算結合速率(k結合)和解離速率(k解離)。平衡解離常數(kd)計算為比率k解離/k結合。參見例如chen等,jmolbiol293,865-881(1999)。2.結合測定法和其它測定法在一個方面,對本發明的雙特異性抗體或結合dr5的抗體測試其抗原結合活性,例如通過已知的方法諸如elisa,western印跡,等來進行。在另一個方面,可使用競爭測定法來鑒定分別與特定抗fap抗體或特定抗dr5抗體競爭對fap或dr5的結合的抗體。在某些實施方案中,此類競爭性抗體結合與特定抗fap抗體或特定抗dr5抗體所結合表位相同的表位(例如線性或構象表位)。用于定位抗體所結合表位的詳細例示性方法見morris(1996)“epitopemappingprotocols”,methodsinmolecularbiologyvol.66(humanapress,totowa,nj)。實施例部分描述了別的方法。3.活性測定法在一個方面,提供了用于鑒定具有生物學活性的結合dr5和fap的雙特異性抗體或結合dr5的抗體的測定法。生物學活性可包括例如dna片段化,誘導凋亡和靶細胞裂解。還提供了在體內和/或在體外具有此類生物學活性的抗體。在某些實施方案中,對本發明的雙特異性抗體或結合dr5的抗體測試此類生物學活性。用于檢測細胞裂解(例如通過測量ldh釋放)或凋亡(例如使用tunel測定法)的測定法是本領域公知的。用于測量adcc或cdc的測定法還記載于wo2004/065540(參見其中的實施例1),通過述及將其完整內容收入本文。j.藥物配制劑通過混合具有期望純度的此類雙特異性抗體或抗體與一種或多種任選的藥學可接受載劑(remington’spharmaceuticalsciences第16版,osol,a.編(1980))以凍干配制劑或水性溶液形式制備如本文中所描述的結合dr5和fap的雙特異性抗體或結合dr5的抗體的藥物配制劑。一般地,藥學可接受載劑在所采用的劑量和濃度對接受者是無毒的,而且包括但不限于緩沖劑,諸如磷酸鹽,檸檬酸鹽,和其它有機酸;抗氧化劑,包括抗壞血酸和甲硫氨酸;防腐劑(諸如氯化十八烷基二甲基芐基銨;氯化己烷雙胺;苯扎氯銨,芐索氯銨;酚,丁醇或苯甲醇;對羥基苯甲酸烴基酯,諸如對羥基苯甲酸甲酯或丙酯;鄰苯二酚;間苯二酚;環己醇;3-戊醇;和間甲酚);低分子量(少于約10個殘基)多肽;蛋白質,諸如血清清蛋白,明膠或免疫球蛋白;親水性聚合物,諸如聚乙烯吡咯烷酮;氨基酸,諸如甘氨酸,谷氨酰胺,天冬酰胺,組氨酸,精氨酸或賴氨酸;單糖,二糖和其它碳水化合物,包括葡萄糖,甘露糖或糊精;螯合劑,諸如edta;糖類,諸如蔗糖,甘露醇,海藻糖或山梨醇;成鹽相反離子,諸如鈉;金屬復合物(例如zn-蛋白質復合物);和/或非離子表面活性劑,諸如聚乙二醇(peg)。本文中的例示性的藥學可接受載劑進一步包含間質藥物分散劑諸如可溶性中性活性透明質酸酶糖蛋白(shasegp),例如人可溶性ph-20透明質酸酶糖蛋白,諸如rhuph20(baxterinternational,inc.)。某些例示性的shasegp和使用方法,包括rhuph20記載于美國專利公開文本no.2005/0260186和2006/0104968。在一個方面,將shasegp與一種或多種另外的糖胺聚糖酶諸如軟骨素酶組合。例示性的凍干抗體配制劑記載于美國專利no.6,267,958。水性抗體配制劑包括那些記載于美國專利no.6,171,586和wo2006/044908的,后一種配制劑包含組氨酸-乙酸鹽緩沖液。本文中的配制劑還可含有所治療具體適應癥所必需的超過一種活性組分,優選那些活性互補且彼此沒有不利影響的。此類活性組分適于以有效用于所需目的的量而組合存在。活性組分可包載于例如通過凝聚技術或通過界面聚合制備的微膠囊中(例如分別是羥甲基纖維素或明膠微膠囊和聚(甲基丙烯酸甲酯)微膠囊),在膠狀藥物投遞系統中(例如脂質體,清蛋白微球體,微乳劑,納米顆粒和納米膠囊),或在粗滴乳狀液中。此類技術披露于例如remington'spharmaceuticalsciences,第16版,osol,a.編(1980)。可以制備持續釋放制劑。持續釋放制劑的合適的例子包括含有抗體的固體疏水性聚合物的半透性基質,該基質為成形物品形式,例如膜,或微膠囊。要用于體內施用的配制劑一般是無菌的。無菌性可容易地實現,例如通過穿過無菌濾膜過濾。k.治療性方法和組合物可以在治療性方法中使用本文中提供的包含一種或多種結合dr5和fap的雙特異性抗體和別的化療劑的治療劑組合。在一個方面,提供了作為藥物使用的結合dr5和fap的雙特異性抗體,用于與別的化療劑組合使用。在某些實施方案中,提供了用于與別的化療劑組合使用的結合dr5和fap的雙特異性抗體,用于在治療方法中使用。在某些實施方案中,本發明提供了用于在治療具有癌癥的個體的方法中使用的結合dr5和fap的雙特異性抗體,該治療包括對個體施用有效量的結合dr5和fap的雙特異性抗體。在一個此類實施方案中,該方法進一步包括對個體施用有效量的至少一種另外的治療劑,例如如下文所描述的。依照任何上述實施方案的“個體”優選是人。在一個優選實施方案中,所述癌癥是胰腺癌,肉瘤或結直腸癌。在其它實施方案中,該癌癥為結直腸癌,肉瘤,頭和頸癌,鱗狀細胞癌,乳腺癌,胰腺癌,胃癌,非小細胞肺癌,小細胞肺癌或間皮瘤。在該癌癥為乳腺癌的實施方案中,該乳腺癌可以是三重陰性乳腺癌。在又一個方面,本發明提供了包含結合dr5和fap的雙特異性抗體和別的化療劑的治療劑組合在制造或制備藥物中的用途。在一個實施方案中,該藥物用于治療癌癥。在又一個實施方案中,該藥物用于治療癌癥的方法,其包括對具有癌癥的個體施用有效量的該藥物。在一個此類實施方案中,該方法進一步包括對個體施用有效量的至少一種另外的治療劑,例如如下文所描述的。依照任何上述實施方案的“個體”可以是人。在又一個方面,本發明提供了用于治療癌癥的方法。在一個實施方案中,該方法包括對具有癌癥的個體施用有效量的包含結合dr5和fap的雙特異性抗體和別的化療劑的治療劑組合。在一個此類實施方案中,該方法進一步包括對個體施用有效量的至少一種另外的治療劑,如下文所描述的。依照任何上述實施方案的“個體”可以是人。在一個優選實施方案中,所述癌癥是胰腺癌,肉瘤或結直腸癌。在其它實施方案中,該癌癥為結直腸癌,肉瘤,頭和頸癌,鱗狀細胞癌,乳腺癌,胰腺癌,胃癌,非小細胞肺癌,小細胞肺癌或間皮瘤。在又一個方面,本發明提供了藥物配制劑,其包含本文中提供的任何結合dr5和fap的雙特異性抗體,例如在任何上述治療性方法中使用,和別的化療劑。在一個實施方案中,藥物配制劑包含本文中提供的任何結合dr5和fap的雙特異性抗體和藥學可接受載劑。在另一個實施方案中,藥物配制劑包含本文中提供的任何結合dr5和fap的雙特異性抗體和至少一種另外的治療劑,例如如下文所描述的。可以通過任何合適的手段,包括胃腸外,肺內,和鼻內,及若期望用于局部治療的話,損傷內施用來施用雙特異性抗體。胃腸外輸注包括肌肉內,靜脈內,動脈內,腹膜內,或皮下施用。部分根據施用是短暫的還是長期的,劑量給藥可以通過任何合適的路徑,例如通過注射,諸如靜脈內或皮下注射進行。本文中涵蓋各種劑量給藥日程表,包括但不限于單次施用或在多個時間點里的多次施用,推注施用,和脈沖輸注。雙特異性抗體可以以一種符合良好的醫學實踐的方式配制,確定劑量及施用。在此背景中考慮的因素包括所治療的特定病癥,所治療的特定哺乳動物,患者個體的臨床狀況,病癥的起因,藥劑投遞的部位,施用的方法,施用進度,以及醫學從業人員知道的其它因素。雙特異性抗體無需但任選地與一種或多種目前用于預防或治療所討論病癥的藥劑一起配制。此類其它藥劑的有效量取決于配制劑中存在的抗體的量,病癥或治療的類型,及上文討論的其它因素。這些藥劑通常以本文所述相同的劑量和施用途徑使用,或以約1-99%的本文所述劑量使用,或以憑經驗/臨床確定為合適的任何劑量并通過任何途徑使用。為了預防或治療疾病,雙特異性抗體的合適劑量會取決于要治療的疾病的類型,抗體的種類,疾病的嚴重性和病程,所給予雙特異性抗體的預防或治療目的,之前的療法,患者的臨床史和對雙特異性抗體的應答及主治醫師的斟酌決定。雙特異性抗體適合于在一次或一系列的治療中施用于患者。取決于疾病的類型和嚴重性,約1μg/kg-15mg/kg(例如0.1mg/kg-10mg/kg)的雙特異性抗體或結合dr5的新穎抗體可作為首次候選用量給予患者,無論是例如通過一次或多次分開的給藥或通過連續輸注。取決予上述提及的因素,一種典型的日劑量可在約1μg/kg-100mg/kg或更多的范圍內。對于幾天或更長時間的重復給藥,取決于病情,治療通常會持續直至出現疾病癥狀得到期望的抑制為止。雙特異性抗體的一種例示性劑量會在約0.05mg/kg至約10mg/kg的范圍中。如此,可以對患者施用約0.5mg/kg,2.0mg/kg,4.0mg/kg或10mg/kg的一劑或多劑。上述劑量可間歇給予,如每周或每三周(例如使得患者得到約2-約20劑,或例如約6劑雙特異性抗體)。可給予初始較高的加載劑量,接著給予較低的一或多劑。然而,可使用其它劑量方案。通過常規技術和測定法易于監測該療法的進展。應當理解,可以替換結合dr5和fap的雙特異性抗體或在結合dr5和fap的雙特異性抗體外使用本發明的免疫綴合物實施任何上述配制劑或治療性方法。l.制品在本發明的另一個方面,提供了一種制品,其含有可用于治療,預防和/或診斷上文所描述的病癥的材料。制品包含容器和容器上或與容器聯合的標簽或包裝插頁。合適的容器包括例如瓶,管形瓶,注射器,iv溶液袋,等等。容器可以由多種材料諸如玻璃或塑料形成。容器容納單獨或與另一種組合物組合有效治療,預防和/或診斷狀況的組合物,并且可以具有無菌存取口(例如,容器可以是具有由皮下注射針可穿過的塞子的管形瓶或靜脈內溶液袋)。組合物中的至少一種活性劑是雙特異性抗體且另外的活性劑是本文所述別的化療劑。標簽或包裝插頁指示使用組合物來治療選擇的狀況。此外,制品可以包含(a)其中裝有組合物的第一容器,其中組合物包含雙特異性抗體;和(b)其中裝有組合物的第二容器,其中組合物包含別的細胞毒性或其它方面治療性的藥劑。本發明的這個實施方案中的制品可以進一步包含包裝插頁,其指示可以使用組合物來治療特定的狀況。或者/另外,制品可以進一步包含第二(或第三)容器,其包含藥學可接受緩沖液,諸如抑菌性注射用水(bwfi),磷酸鹽緩沖鹽水,ringer氏溶液和右旋糖溶液。它可以進一步包含從商業和用戶觀點看期望的其它材料,包括其它緩沖液,稀釋劑,濾器,針,和注射器。應當理解,任何上述制品可包括本發明的免疫綴合物來代替或補充結合dr5和fap的雙特異性抗體。iii.實施例下面是本發明的方法和組合物的實施例。要理解,鑒于上文提供的一般描述,可以實施各種其它實施方案。雖然出于清楚理解的目的,前述發明已經作為例示和例子相當詳細地進行了描述,但是說明書和實施例不應解釋為限制本發明的范圍。通過提及而明確將本文中引用的所有專利和科學文獻的公開內容完整收錄。實施例1:dr5-fap死亡受體激動性雙特異性抗體一種通過死亡受體(如dr5)的交聯(除經由腫瘤細胞表達的抗原的交聯之外)來誘導凋亡的辦法靶向腫瘤周圍的基質。在該情況中,靶定抗原不由腫瘤細胞直接展示,而是由第二種不同細胞類型展示。此類抗原的一個例子會是fap(成纖維細胞活化蛋白)。這種蛋白質在活化的成纖維細胞上表達,正如在腫瘤基質中發現它們那樣。通過噬菌體展示鑒定新穎的dr5結合物。對通過噬菌體展示獲得的dr5結合物篩選凋亡誘導,特異性,物種交叉反應性,和表位特異性。選擇dr5結合物5e11并轉變成四價雙特異性分子。這些雙特異性抗體含有兩種結合模塊,各自針對dr5和fap。fap結合模塊已經記載于wo2012/020006。使用(g4s)4連接頭將28h1crossfab域(vhcl)融合至抗dr5重鏈的c端,提供2+2型式的雙特異性抗體。表1:雙特異性,四價dr5-fapcrossmab分子(均使用(g4s)4連接頭將28h1crossfab域(vhcl)融合至抗dr5重鏈的c端,fap結合物:vhseqidno.:15,vlseqidno.:16)在瞬時轉染的hek293ebna細胞中生成dr5-fap雙特異性分子,并經由蛋白a和大小排阻層析來純化。獲得的產物產量在合理范圍中(20mg/l左右)。對于所有分子,最后的純化步驟之后的單體含量在96%以上。通過表面等離振子共振(biacore)進行的靶物結合分析揭示了2+2型式的雙特異性抗體能夠同時結合重組dr5和fap(人和鼠)。為了評估dr5-fap雙特異性分子是否能夠誘導mda-mb-231靶細胞系凋亡,用重組人fap包被96孔板,用于經由隨后添加的雙特異性抗體來交聯靶細胞上的dr5。在添加靶細胞(mda-mb231)和溫育24小時之后,通過標準dna片段化elisa測定法來測定凋亡誘導。dr5-fap雙特異性分子在板上包被的fap存在下展現凋亡誘導活性,指示此活性依賴于經由重組fap的交聯。實施例2:dr5-fap雙特異性抗體能夠對不同靶細胞誘導凋亡在含gm05389人fap+成纖維細胞的共培養測定法中在實驗中對包含融合至fap28h1crossfab模塊的新分離的dr5結合物的2+2型式的dr5-fap雙特異性抗體測試對兩種不同細胞系(mda-mb-231和g401)誘導凋亡的情況。在0.0007–7nm的濃度范圍上測試雙特異性抗體。dna片段化測定法的結果顯示所測試的雙特異性抗體對兩種細胞系均展示較好的凋亡誘導活性。依照用mda-mb-231細胞獲得的結果,雙特異性2+2型式的抗體在高濃度沒有顯示活性下降,而是上至最高濃度保持恒定或甚至升高。在含gm05389成纖維細胞的共培養物中有g401細胞的實驗中,早在0.07nm的濃度就達到了最大凋亡誘導,然后保持恒定。在這種設置中,所有分子就凋亡誘導水平而言性能相似。表1a:fap-dr5雙特異性抗體的表征實施例3:人腫瘤中的fap流行度通過ihc評估人腫瘤中fap的流行度以了解雙特異性dr5-fap抗體的可能臨床用途。在ventanabenchmarkxt上使用來自vitatex(mabs1001)的大鼠抗人seprase抗體(igg2a,克隆d8)免疫染色來自多種腫瘤適應癥的2.5μmffpet切片。對切片進行標準cc1處理,接著是于37℃在dako抗體稀釋液(s3022)中以5μg/ml的濃度的抗體溫育60分鐘,并使用ultraviewdab檢測系統(ventana,#760-4456)檢測陽性染色。使用匹配的來自abcam的同種型抗體(ab18450)作為陰性對照。fap+基質浸潤物存在于不同適應癥的人腫瘤中,包括sclc,標志著雙特異性dr5-fap抗體的潛在感興趣臨床適應癥(表2)。表2:人上皮腫瘤中的fap流行度fap-dr5的另一種感興趣臨床適應癥是肉瘤,其中在跨越肉瘤亞型的大約50%的病例中fap不在基質上表達但在惡性細胞自身上表達(表3)。表3:人肉瘤亞型中的fap流行度實施例4:體外組合研究為了評估fap-dr5與不同抗癌藥物的組合潛力,在體外使用dr5抗體(drozitumab,記載于us2007/0031414)+經由抗fc抗體的交聯作為在fap+細胞缺失下的交聯的替代。在一個細胞系子集中確認了體外細胞培養物實驗中fap交聯和fc交聯之間較好的相關性用于原理證明(數據未顯示)。評估一組crc和pdac細胞系,并使用與相應腫瘤適應癥潛在臨床相關的組合配偶來評估組合效果(crc:伊立替康,奧沙利鉑,5-fu,mdm2抑制劑(rg7388),bcl-2抑制劑(abt199);pdac:abraxane,帕利他賽,吉西他濱,多柔比星,mdm2i(rg7388),bcl2i(abt199),硼替佐米,環巴胺,parp抑制劑(pj34))。結果描述于表4和表5和圖2-4。化合物的ic50值的測定在具有透明,平坦底的黑色96孔微量板中接種細胞(數目隨細胞系而變化),并于37℃和5%co2溫育過夜。在檢查細胞貼壁/匯合之后,去除培養基并對每個孔添加100μl含有相應化合物的新鮮培養基。每種化合物(n=3)使用8個濃度的順序稀釋系列(1:4)。使用相應dmso濃度和單獨的培養基作為對照。在于37℃和5%co2培養3天之后,對板添加每孔100μlcelltiter-glo試劑(promega)。在于室溫搖動30分鐘之后測量發光。用xl-fit軟件計算ic50值。一種化合物的每項實驗重復至少兩次。dr5抗體組合:在具有透明,平坦底的黑色96孔微量板中接種細胞(數目隨細胞系而變化),并于37℃和5%co2溫育過夜。在檢查細胞貼壁/匯合之后,去除培養基并對每個孔添加100μl含有相應化合物或組合的新鮮培養基。在96孔pp-v底微量板中制備drozitumab/抗人fc的9個濃度的順序1:3稀釋系列(n=6)。以等摩爾濃度混合的drozitumab/抗人fc的預稀釋液,drozitumab/抗人fc的范圍為0–28nm而化療劑為800nm。然后將25μl/孔drozitumab/抗人fc系列轉移至細胞。然后用1xic50濃度的化合物和7nm或最高濃度200nm任一的drozitumab/抗人fc達到終濃度。在于37℃和5%co2溫育3天之后,對板給予每孔100μlcelltiter-glo試劑(promega)。在于室溫搖動30分鐘之后測量發光。對于drozitumab/抗人fc和drozitumab/抗人fc+化合物的每個濃度,在同一塊板上制備一式三份,而且每項實驗重復至少兩次。表4:組合篩選pdac細胞系表5:組合篩選crc細胞系n.s.=不顯著n.c.=未計算(因數據不合適)n.t.=未測試實施例5:fap-dr5與化療劑組合的體內抗腫瘤功效可以在移植到裸小鼠上的多種腫瘤起源(例如crc,胰腺癌,結締組織增生性黑素瘤和肉瘤)的基于細胞和碎片的患者衍生(pdx)模型中檢測雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)的體內抗腫瘤功效。例如,針對crc異種移植物模型dld-1和hct116(基于細胞系的,共注射模型l)和co5896(基于碎片的)顯示了雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)和化療劑激活內在凋亡途徑的組合功效的數據。測試藥劑作為來自roche(penzberg,germany)的儲液提供雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)。抗體緩沖液包括組氨酸。注射前在緩沖液中自儲液適當稀釋抗體溶液。作為來自roche(penzberg,germany)的儲液提供現有技術dr5特異性抗體drozitumab的一種fc突變體。這種抗體包含fc域中消除對活化性或抑制性fc受體的結合和/或效應器功能的三處氨基酸替代,其中所述氨基酸替代為l234a,l235a和p329g。drozitumab的這種fc突變體也稱作“drozitumablala”。細胞系和培養條件dld-1和hct116人crc細胞最初是自atcc獲得的;lox-imvi人結締組織增生性黑素瘤細胞最初是在nci建立并自atcc購買的。例行地在水飽和氣氛中于37℃和5%co2在含1.0mm丙酮酸鈉,補充有10%胎牛血清,2.0mml-谷氨酰胺,10mmhepes的dmem高葡萄糖培養基中培養腫瘤細胞系。每三天用胰蛋白酶/edta1x分瓶實施培養物傳代。另外,鼠成纖維細胞nih3t3購自atcc,并在含1.0mm丙酮酸鈉,10%fcs和2.0mml-谷氨酰胺的dmem高葡萄糖中培養。患者衍生異種移植物模型(pdx)crc腫瘤異種移植物co5896,肉瘤腫瘤異種移植物sarc4605和胰腺導管腺癌(pdac)腫瘤異種移植物pa1178和pa3137最初是自患者獲得的,并適當傳代3-5次,直至建立穩定生長樣式。為了后續體內研究,自在裸小鼠中連續傳代的異種移植物獲得co5896,sarc4605,pa1178和pa3137腫瘤碎片。自供體小鼠取出后,將腫瘤切成碎片(4-5mm直徑)并放置在pbs中,直至皮下植入。異氟烷麻醉下的小鼠在體側中接受單側皮下腫瘤植入物。動物裸小鼠購自育種公司(例如charlesriver,sulzfeld,germany),并依照提交的指導方針(gv-solas;felasa;tierschg)以12小時光照/12小時黑暗的日周期在無特定病原體的條件下維持。實驗性研究方案得到當地政府的審查和批準。到達后,將動物在動物房的檢疫部分中維持一周適應新環境和進行觀察。定期進行連續健康監測。隨意提供飲食食物(provimikliba3337)和水(酸化的ph2.5-3)。監測每天對動物管理臨床癥狀和不利作用檢測。對于貫穿實驗的監測,記錄動物的體重。對動物的處理在細胞或碎片移植后當中值腫瘤大小為約100-200mm3時進行動物隨機化,此后開始動物處理。作為單一藥劑以1.0,10或30mg/kg靜脈內施用抗體,一周一次或兩次,持續數周,取決于模型。在同一天施用相應媒介。抗體功效基于dld-1和hct116crc共注射細胞系的異種移植物模型研究第9至20天以10和1.0mg/kg的劑量用雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)處理攜帶dld-1crc異種移植物的小鼠4次。結果是,雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)處理顯示劑量相關的顯著的抗腫瘤功效,具有較強的針對皮下dld-1異種移植物的抗腫瘤功效。腫瘤生長抑制(tgi)分別計算為89%(10mg/kg)和79%(1.0mg/kg)。相反,用dr5fc突變體抗體drozitumab,lala(10mg/kg,一周一次)處理后沒有注意到抗腫瘤功效(圖5)。而且,在一項組合中,用雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)(10mg/kg,靜脈內,一周一次,5x)和伊立替康(15mg/kg,腹膜內,5天,3x)處理攜帶dld-1腫瘤的小鼠。該組合處理展現與相應單一藥劑相比卓越的功效并實現72%腫瘤消退(圖6)。測試在伊立替康處理之前,之后5天或平行地用雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)處理攜帶dld-1腫瘤的小鼠。平行組合處理展現與兩種藥劑的順序處理相比卓越的功效(圖7)。在又一項臨床前研究中,攜帶dld-1腫瘤的小鼠接受雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)(10mg/kg)與抗vegf抗體b20(10mg/kg)或ang2/vegf抗體(10mg/kg)一起的組合處理,如記載于wo2011/117329。兩種抗體均在第8,15和22天一周一次給予。雖然dr5-fap抗體作為單一藥劑的處理導致顯著的腫瘤生長抑制(tgi87%),含抗ang/vegf單抗的組合具有疊加的功效并將腫瘤生長抑制提高至94%。單獨的ang2/vegf抗體處理以75%抑制腫瘤生長(圖15)。在第二種基于細胞系的crc模型(hct116)中,評估雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)(10mg/kg,靜脈內,一周一次,3x)與伊立替康(15mg/kg,腹膜內,5天,2x)和奧沙利鉑(5mg/kg)的組合。植入后7天開始處理,而且雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)的單一療法導致46%tgi。含伊立替康的組合展現卓越的功效并引起腫瘤消退(圖8)。而且,雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)與奧沙利鉑的組合療法提高功效至67%tgi(圖9)。基于lox-imvi結締組織增生性黑素瘤細胞系的異種移植物模型研究第13至20天以10mg/kg的劑量用雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)處理攜帶lox-imvi異種移植物的小鼠2次。另一組攜帶腫瘤的小鼠以10mg/kg(第13和20天)接受dr5靶向性fc突變體抗體drozitumablala的處理。結果是,雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)處理針對皮下lox-imvi異種移植物顯示顯著的強抗腫瘤功效(腫瘤停滯)。腫瘤生長抑制(tgi)對于雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)計算為超過100%(10mg/kg),而drozitumablala處理功效較低(tgi65%)(圖10)。另外,用雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)(10mg/kg)與蒽環類抗生素多柔比星(adriamycin,5mg/kg,q7d)的組合處理攜帶lox-imvi的小鼠。雖然dr5-fap抗體(10mg/kg,第8和15天)作為單一藥劑的處理導致腫瘤停滯(tgi97%),含多柔比星的組合具有大于疊加的功效并引起明顯的腫瘤消退(93%)。單獨的多柔比星處理以77%抑制腫瘤生長(圖16)。基于co5896crc碎片的患者衍生異種移植物模型(pdx)研究第18至34天作為單一藥劑以30mg/kg的劑量用雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)處理攜帶co5896crc異種移植物的小鼠6次(見圖11)。結果是,雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)處理顯示顯著的抗腫瘤功效,具有較強的針對皮下co5896患者衍生異種移植物的抗腫瘤功效。腫瘤生長抑制(tgi)計算為76%。另外,在一項組合研究中,自研究第15天起作為單一藥劑每周一次給予雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)(30mg/kg)(4次)并與伊立替康(15mg/kg,第15-19天)組合。在雙特異性dr5-fap抗體與伊立替康的組合中觀察到卓越的功效,在所有動物中導致完全腫瘤消退(10/10無腫瘤)(圖12)。通過ihc確認co5896患者衍生異種移植物的基質中存在fap(圖13)。基于sarc4605肉瘤碎片的患者衍生異種移植物模型(pdx)研究第10至31天作為單一藥劑以10mg/kg的劑量用雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)處理攜帶sarc4605肉瘤異種移植物的小鼠4次(圖14)。結果是,雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)處理顯示顯著的抗腫瘤功效,具有較強的針對皮下sarc4605患者衍生異種移植物的抗腫瘤功效(腫瘤停滯)。腫瘤生長抑制(tgi)計算為超過100%。另外,用雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)(10mg/kg)與蒽環類抗生素多柔比星(adriamycin,5mg/kg,q7d)組合處理攜帶sarc4605腫瘤的小鼠。雖然dr5-fap抗體(10mg/kg,第20,27,34和41天)作為單一藥劑的處理導致腫瘤停滯(tgi99%),含多柔比星的組合具有大于疊加的功效并引起明顯的腫瘤消退(83%)。單獨的多柔比星處理以77%抑制腫瘤生長(圖17)。而且,用雙特異性抗體dr5-fap(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)(10mg/kg)與烷化藥物異磷酰胺(100mg/kg,q7dx2)組合處理攜帶sarc4605腫瘤的小鼠。單獨的dr5-fap抗體(10mg/kg,q7dx8)處理導致較強的腫瘤消退(96%及80%無腫瘤),而含異磷酰胺的組合具有略微更高的功效(86%無腫瘤)。另外,組合中的腫瘤消退的動力學更快(圖19)。基于pa1178和pa3137pdac碎片的異種移植物模型(pdx)研究第32至81天作為單一藥劑和與吉西他濱和nab-帕利他賽的組合以10mg/kg的劑量用雙特異性dr5-fap抗體(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)處理攜帶pa1178異種移植物的小鼠7次(見圖18)。作為單一藥劑以10mg/kg腹膜內一周一次施用雙特異性抗體。在同一天施用相應媒介。一周兩次腹膜內以40mg/kg給予吉西他濱數周,并連續4天以6mg/kg靜脈內施用nab-帕利他賽兩個周期。結果是,dr5-fap雙特異性抗體(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)作為單一藥劑的處理顯示顯著的抗腫瘤功效,具有較強的針對皮下pa1178患者衍生異種移植物的抗腫瘤功效。與對照相比,腫瘤生長抑制(tgi)計算為96%。而且,與吉西他濱和nab-帕利他賽(abraxane)組合給予dr5-fap雙特異性抗體(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)。該三重組合是有效的,在所有接受處理的動物中實現完全腫瘤消退,這在吉西他濱/nab-帕利他賽雙重組合給藥組中沒有實現。在第二種基于碎片的pdacpdx模型(pa3137)中,作為單一藥劑和與吉西他濱(腹膜內,一周一次,40mg/kg)和nab-帕利他賽(6mg/kg,連續四天,靜脈內)的組合評估雙特異性dr5-fap抗體(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)(10mg/kg,腹膜內,一周一次,x8)的功效。植入后31天開始動物處理,直至第66天。單一療法中雙特異性dr5-fap抗體(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)的功效導致40%tgi。雙特異性dr5-fap抗體(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)與吉西他濱和nab-帕利他賽(abraxane)的組合展現較好的功效,大多具有完全腫瘤消退(數據未顯示)。實施例6:臨床前藥效學生物標志物和組合策略進行臨床前轉化研究來證明上靶(on-target)作用模式,確保最大活性及指導藥效學(pd)分析以闡明潛在抗性機制。材料和方法在與成纖維細胞共注射的基于結直腸癌(crc)細胞系的異種移植物模型(dld-1)中設計一項動力學研究。在雙特異性dr5-fap抗體(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)(10mg/kg)單劑處理之后6,16,72和168小時外植腫瘤,并收獲進行針對凋亡標志物的基于免疫組織化學(ihc)和elisa的蛋白質分析,諸如受到切割的胱天蛋白酶3(cc3),受到切割的parp和活化的胱天蛋白酶8和9。用用于平臺的凋亡人3-plex小組(lifetechnologies)測定受到切割的胱天蛋白酶3水平。使用map7-plex來測定磷酸化akt(ser473),jnk(thr183/tyr185),bad(ser112),bcl-2(ser70),p53(ser46),活性胱天蛋白酶-8(asp384)和活性胱天蛋白酶-9(asp315)的變化。對于ihc分析,將腫瘤在3.8%緩沖的甲醛溶液中固定最多48小時并在paraplast中包埋。遵循一種例行的ihc染色方案使用ventanadiscoveryxt載玻片染色儀應用針對受到切割的胱天蛋白酶-3的家兔多克隆抗體(asp175;cellsignalling)。為了分析雙特異性dr5-fap抗體(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)(10mg/kg)與多柔比星(5mg/kg)的組合處理,使用一種fap陽性結締組織增生性黑素瘤細胞系衍生模型(lox-imvi)。在處理之后3,6,16,72和168小時外植腫瘤。結果我們通過ihc和elisa在基質中或直接在腫瘤細胞上表達fap的異種移植物腫瘤中觀察到用雙特異性dr5-fap抗體處理后顯著的時間依賴性凋亡誘導。與媒介對照相比在處理之后早期通過ihc觀察到水平較高的瞬時的凋亡標志物諸如cc3。通過elisa對等同組織裂解物的分析還揭示dld-1crc異種移植物模型中單一療法中cc3,受到切割的parp和活化的胱天蛋白酶8和9的快速誘導,它在lox-imvi結締組織增生性黑素瘤模型中與多柔比星一起給予時是卓越的。通過elisa對等同組織裂解物的分析揭示dld-1crc異種移植物模型中單一療法中cc3,受到切割的parp和活化的胱天蛋白酶8和9的快速誘導,它在與伊立替康或奧沙利鉑一起給予時是卓越的。圖20顯示在用單一藥劑雙特異性dr5-fap抗體(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)處理之后的luminex數據(elisa)。雙特異性dr5-fap抗體針對dld-1/3t3異種移植物誘導較強的時間相關腫瘤細胞凋亡。在抗體處理之后不久(6小時)觀察到較強的效果。圖21顯示在用單一藥劑雙特異性dr5-fap抗體(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)或與多柔比星(10mg/kg)組合處理之后的luminex數據(elisa)。雙特異性dr5-fap抗體以時間相關方式強烈誘導腫瘤細胞凋亡。雙特異性dr5-fap抗體與多柔比星一起的組合處理在lox-imvi結締組織增生性黑素瘤模型中的腫瘤細胞凋亡誘導是卓越的。圖22顯示在用單一藥劑雙特異性dr5-fap抗體(10mg/kg;dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)或與伊立替康(15mg/kg)或奧沙利鉑(5mg/kg)組合處理之后的luminex數據(elisa)。雙特異性dr5-fap抗體在dld-1crc異種移植物模型中以時間相關方式強烈誘導腫瘤細胞凋亡。雙特異性dr5-fap抗體與伊立替康或奧沙利鉑一起的組合處理的腫瘤細胞凋亡誘導是卓越的。我們鑒定了雙特異性dr5-fap抗體(dr5結合物:vhseqidno.:7,vlseqidno.:8,fap結合物:vhseqidno.:15,vlseqidno.:16)在體內在注射之后不久強烈誘導腫瘤細胞凋亡,不依賴于fap是在腫瘤基質上或是在腫瘤細胞處表達,而且發現了最佳藥效學標志物和用于采樣和分析的時間點。序列1.噬菌體展示衍生的dr5結合物的氨基酸序列2.fap結合物的氨基酸序列3.包含噬菌體展示衍生的dr5結合物的雙特異性分子的氨基酸序列雖然顯示和描述了本發明當前優選的實施方案,但是要清楚地理解,本發明不限于此而是可以在所述權利要求書的范圍內以其它方式多種多樣地體現和實施。序列表<110>豪夫邁·羅氏有限公司(f.hoffmann-larocheag)<120>對fap和dr5特異性的雙特異性抗體和化療劑的組合療法<130>32336wo<160>20<170>patentinversion3.5<210>1<211>5<212>prt<213>人工序列<220><223>dr5(5e11)_cdrh1<400>1sertyralametser15<210>2<211>17<212>prt<213>人工序列<220><223>dr5(5e11)_cdrh2<400>2alaileserglyserglyglyserthrtyrtyralaaspservallys151015gly<210>3<211>8<212>prt<213>人工序列<220><223>dr5(5e11)_cdrh3<400>3glyvalargvalserpheasptyr15<210>4<211>12<212>prt<213>人工序列<220><223>dr5(5e11)_cdrhl1<400>4argalaserglnservalsersersertyrleuala1510<210>5<211>7<212>prt<213>人工序列<220><223>dr5(5e11)_cdrl2<400>5glyalaserserargalathr15<210>6<211>9<212>prt<213>人工序列<220><223>dr5(5e11)_cdrl3<400>6glnglnglythrthrhisproilethr15<210>7<211>117<212>prt<213>人工序列<220><223>dr5(5e11)_vh<400>7gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrphesersertyr202530alametsertrpvalargglnalaproglylysglyleuglutrpval354045seralaileserglyserglyglyserthrtyrtyralaaspserval505560lysglyargphethrileserargaspasnserlysasnthrleutyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alalysglyvalargvalserpheasptyrtrpglyglnglythrleu100105110valthrvalserser115<210>8<211>108<212>prt<213>人工序列<220><223>dr5(5e11)_vl<400>8gluilevalleuthrglnserproglythrleuserleuserprogly151015gluargalathrleusercysargalaserglnservalserserser202530tyrleualatrptyrglnglnlysproglyglnalaproargleuleu354045iletyrglyalaserserargalathrglyileproaspargpheser505560glyserglyserglythraspphethrleuthrileserargleuglu65707580progluaspphealavaltyrtyrcysglnglnglythrthrhispro859095ilethrpheglyglnglythrlysvalgluilelys100105<210>9<211>5<212>prt<213>人工序列<220><223>fap(28h1)_cdrh1<400>9serhisalametser15<210>10<211>16<212>prt<213>人工序列<220><223>fap(28h1)_cdrh2<400>10alailetrpalaserglygluglntyrtyralaaspservallysgly151015<210>11<211>8<212>prt<213>人工序列<220><223>fap(28h1)_cdrh3<400>11glytrpleuglyasnpheasptyr15<210>12<211>12<212>prt<213>人工序列<220><223>fap(28h1)_cdrl1<400>12argalaserglnservalserargsertyrleuala1510<210>13<211>7<212>prt<213>人工序列<220><223>fap(28h1)_cdrl2<400>13glyalaserthrargalathr15<210>14<211>9<212>prt<213>人工序列<220><223>fap(28h1)_cdrl3<400>14glnglnglyglnvalileproprothr15<210>15<211>116<212>prt<213>人工序列<220><223>fap(28h1)_vh<400>15gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrpheserserhis202530alametsertrpvalargglnalaproglylysglyleuglutrpval354045seralailetrpalaserglygluglntyrtyralaaspservallys505560glyargphethrileserargaspasnserlysasnthrleutyrleu65707580glnmetasnserleuargalagluaspthralavaltyrtyrcysala859095lysglytrpleuglyasnpheasptyrtrpglyglnglythrleuval100105110thrvalserser115<210>16<211>108<212>prt<213>人工序列<220><223>fap(28h1)_vl<400>16gluilevalleuthrglnserproglythrleuserleuserprogly151015gluargalathrleusercysargalaserglnservalserargser202530tyrleualatrptyrglnglnlysproglyglnalaproargleuleu354045ileileglyalaserthrargalathrglyileproaspargpheser505560glyserglyserglythraspphethrleuthrileserargleuglu65707580progluaspphealavaltyrtyrcysglnglnglyglnvalilepro859095prothrpheglyglnglythrlysvalgluilelys100105<210>17<211>691<212>prt<213>人工序列<220><223>dr5(5e11)-fap(28h1)vhcl<400>17gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrphesersertyr202530alametsertrpvalargglnalaproglylysglyleuglutrpval354045seralaileserglyserglyglyserthrtyrtyralaaspserval505560lysglyargphethrileserargaspasnserlysasnthrleutyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alalysglyvalargvalserpheasptyrtrpglyglnglythrleu100105110valthrvalserseralaserthrlysglyproservalpheproleu115120125alaproserserlysserthrserglyglythralaalaleuglycys130135140leuvallysasptyrpheprogluprovalthrvalsertrpasnser145150155160glyalaleuthrserglyvalhisthrpheproalavalleuglnser165170175serglyleutyrserleuserservalvalthrvalproserserser180185190leuglythrglnthrtyrilecysasnvalasnhislysproserasn195200205thrlysvalasplyslysvalgluprolyssercysasplysthrhis210215220thrcysproprocysproalaprogluleuleuglyglyproserval225230235240pheleupheproprolysprolysaspthrleumetileserargthr245250255progluvalthrcysvalvalvalaspvalserhisgluaspproglu260265270vallyspheasntrptyrvalaspglyvalgluvalhisasnalalys275280285thrlysproargglugluglntyrasnserthrtyrargvalvalser290295300valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys305310315320cyslysvalserasnlysalaleuproalaproileglulysthrile325330335serlysalalysglyglnproarggluproglnvaltyrthrleupro340345350proserargaspgluleuthrlysasnglnvalserleuthrcysleu355360365vallysglyphetyrproseraspilealavalglutrpgluserasn370375380glyglnprogluasnasntyrlysthrthrproprovalleuaspser385390395400aspglyserphepheleutyrserlysleuthrvalasplysserarg405410415trpglnglnglyasnvalphesercysservalmethisglualaleu420425430hisasnhistyrthrglnlysserleuserleuserproglylysser435440445glyglyglyglyserglyglyglyglyserglyglyglyglysergly450455460glyglyglysergluvalglnleuleugluserglyglyglyleuval465470475480glnproglyglyserleuargleusercysalaalaserglyphethr485490495pheserserhisalametsertrpvalargglnalaproglylysgly500505510leuglutrpvalseralailetrpalaserglygluglntyrtyrala515520525aspservallysglyargphethrileserargaspasnserlysasn530535540thrleutyrleuglnmetasnserleuargalagluaspthralaval545550555560tyrtyrcysalalysglytrpleuglyasnpheasptyrtrpglygln565570575glythrleuvalthrvalserseralaservalalaalaproserval580585590pheilepheproproseraspgluglnleulysserglythralaser595600605valvalcysleuleuasnasnphetyrproargglualalysvalgln610615620trplysvalaspasnalaleuglnserglyasnserglngluserval625630635640thrgluglnaspserlysaspserthrtyrserleuserserthrleu645650655thrleuserlysalaasptyrglulyshislysvaltyralacysglu660665670valthrhisglnglyleuserserprovalthrlysserpheasnarg675680685glyglucys690<210>18<211>689<212>prt<213>人工序列<220><223>dr5(5e11)-fap(28h1)vhcl去除fc中的c端賴氨酸p329g/lalamut.<400>18gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrphesersertyr202530alametsertrpvalargglnalaproglylysglyleuglutrpval354045seralaileserglyserglyglyserthrtyrtyralaaspserval505560lysglyargphethrileserargaspasnserlysasnthrleutyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alalysglyvalargvalserpheasptyrtrpglyglnglythrleu100105110valthrvalserseralaserthrlysglyproservalpheproleu115120125alaproserserlysserthrserglyglythralaalaleuglycys130135140leuvallysasptyrpheprogluprovalthrvalsertrpasnser145150155160glyalaleuthrserglyvalhisthrpheproalavalleuglnser165170175serglyleutyrserleuserservalvalthrvalproserserser180185190leuglythrglnthrtyrilecysasnvalasnhislysproserasn195200205thrlysvalasplyslysvalgluprolyssercysasplysthrhis210215220thrcysproprocysproalaproglualaalaglyglyproserval225230235240pheleupheproprolysprolysaspthrleumetileserargthr245250255progluvalthrcysvalvalvalaspvalserhisgluaspproglu260265270vallyspheasntrptyrvalaspglyvalgluvalhisasnalalys275280285thrlysproargglugluglntyrasnserthrtyrargvalvalser290295300valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys305310315320cyslysvalserasnlysalaleuglyalaproileglulysthrile325330335serlysalalysglyglnproarggluproglnvaltyrthrleupro340345350proserargaspgluleuthrlysasnglnvalserleuthrcysleu355360365vallysglyphetyrproseraspilealavalglutrpgluserasn370375380glyglnprogluasnasntyrlysthrthrproprovalleuaspser385390395400aspglyserphepheleutyrserlysleuthrvalasplysserarg405410415trpglnglnglyasnvalphesercysservalmethisglualaleu420425430hisasnhistyrthrglnlysserleuserleuserproglyglygly435440445glyglyserglyglyglyglyserglyglyglyglyserglyglygly450455460glysergluvalglnleuleugluserglyglyglyleuvalglnpro465470475480glyglyserleuargleusercysalaalaserglyphethrpheser485490495serhisalametsertrpvalargglnalaproglylysglyleuglu500505510trpvalseralailetrpalaserglygluglntyrtyralaaspser515520525vallysglyargphethrileserargaspasnserlysasnthrleu530535540tyrleuglnmetasnserleuargalagluaspthralavaltyrtyr545550555560cysalalysglytrpleuglyasnpheasptyrtrpglyglnglythr565570575leuvalthrvalserseralaservalalaalaproservalpheile580585590pheproproseraspgluglnleulysserglythralaservalval595600605cysleuleuasnasnphetyrproargglualalysvalglntrplys610615620valaspasnalaleuglnserglyasnserglngluservalthrglu625630635640glnaspserlysaspserthrtyrserleuserserthrleuthrleu645650655serlysalaasptyrglulyshislysvaltyralacysgluvalthr660665670hisglnglyleuserserprovalthrlysserpheasnargglyglu675680685cys<210>19<211>215<212>prt<213>人工序列<220><223>dr5(5e11)lc<400>19gluilevalleuthrglnserproglythrleuserleuserprogly151015gluargalathrleusercysargalaserglnservalserserser202530tyrleualatrptyrglnglnlysproglyglnalaproargleuleu354045iletyrglyalaserserargalathrglyileproaspargpheser505560glyserglyserglythraspphethrleuthrileserargleuglu65707580progluaspphealavaltyrtyrcysglnglnglythrthrhispro859095ilethrpheglyglnglythrlysvalgluilelysargthrvalala100105110alaproservalpheilepheproproseraspgluglnleulysser115120125glythralaservalvalcysleuleuasnasnphetyrproargglu130135140alalysvalglntrplysvalaspasnalaleuglnserglyasnser145150155160glngluservalthrgluglnaspserlysaspserthrtyrserleu165170175serserthrleuthrleuserlysalaasptyrglulyshislysval180185190tyralacysgluvalthrhisglnglyleuserserprovalthrlys195200205serpheasnargglyglucys210215<210>20<211>214<212>prt<213>人工序列<220><223>fap(28h1)_vlch1<400>20gluilevalleuthrglnserproglythrleuserleuserprogly151015gluargalathrleusercysargalaserglnservalserargser202530tyrleualatrptyrglnglnlysproglyglnalaproargleuleu354045ileileglyalaserthrargalathrglyileproaspargpheser505560glyserglyserglythraspphethrleuthrileserargleuglu65707580progluaspphealavaltyrtyrcysglnglnglyglnvalilepro859095prothrpheglyglnglythrlysvalgluilelysserseralaser100105110thrlysglyproservalpheproleualaproserserlysserthr115120125serglyglythralaalaleuglycysleuvallysasptyrphepro130135140gluprovalthrvalsertrpasnserglyalaleuthrserglyval145150155160histhrpheproalavalleuglnserserglyleutyrserleuser165170175servalvalthrvalproserserserleuglythrglnthrtyrile180185190cysasnvalasnhislysproserasnthrlysvalasplyslysval195200205gluprolyssercysasp210當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1
- 用于治療HBV感染和相關病癥的三特異性結合分子的制造方法與工藝
- 對磺胺類藥物具有特異性的固相微萃取纖維的制備方法與流程
- 一種檢測豬初乳中抗PEDV特異性IgA抗體的夾心ELISA試劑盒的制造方法與工藝
- 用于施用CD19xCD3雙特異性抗體的給藥方案的制造方法與工藝
- 雙特異性抗?VEGF/抗?ANG?2抗體及其在治療眼血管疾病中的應用的制造方法與工藝
- 特異性人EWS?FLI1融合蛋白抗體的制備方法及在制備尤文肉瘤診斷抗體試劑的應用與制造工藝
- 雙特異性四價抗體及其制造和使用方法與制造工藝
- 利用特異性揮發物篩選昆蟲相關嗅覺蛋白的方法與制造工藝
- 使用與表面偶聯的單特異性四聚抗體復合物組合物從樣品中分離出靶實體的方法與制造工藝
- 抗-WT1/HLA雙特異性抗體的制造方法與工藝