用于治療癡呆中的激越行為的包含右美沙芬化合物和奎尼丁的藥物組合物的制作方法
優先權本申請主張下列美國臨時申請的利益:于2014年9月14日提出申請的第62/050,170號、于2014年10月8日提出申請的第62/061,451號、于2014年10月13日提出申請的第62/063,122號、于2014年10月14日提出申請的第62/063,861號、于2014年10月26日提出申請的第62/068,742號、于2015年2月2日提出申請的第62/111,053號、于2015年2月3日提出申請的第62/111,590號、于2015年3月4日提出申請的第62/128,446號、于2015年5月15日提出申請的第62/162,140號、于2015年5月22日提出申請的第62/165,535號、于2015年6月2日提出申請的第62/169,997號、于2015年6月15日提出申請的第62/180,026號、于2015年7月16日提出申請的第62/193,347號;和于2015年8月14日提出申請的第62/205,061號、于2015年9月10日提出申請的第62/216,636號、于2015年9月11日提出申請的第62/217,142號;和于2015年9月11日提出申請的第62/217,470號,其皆在此并入本案作為參考。本發明涉及與中樞神經系統(cns)障礙諸如阿爾茨海默癥相關的行為障礙諸如激越行為(agitation)和/或攻擊行為和/或相關癥狀的治療。與本發明相關的方法包括對于患有中樞神經系統(cns)障礙諸如阿爾茨海默癥中激越行為和/或攻擊行為和/或相關癥狀的受試者,單獨給藥右美沙芬化合物或給藥右美沙芬化合物和cyp2d6抑制劑諸如奎尼丁(q)的組合。本發明還涉及藥物組合,其包含單獨的右美沙芬化合物或右美沙芬化合物與cyp2d6抑制劑諸如奎尼丁(q)的組合。
背景技術:
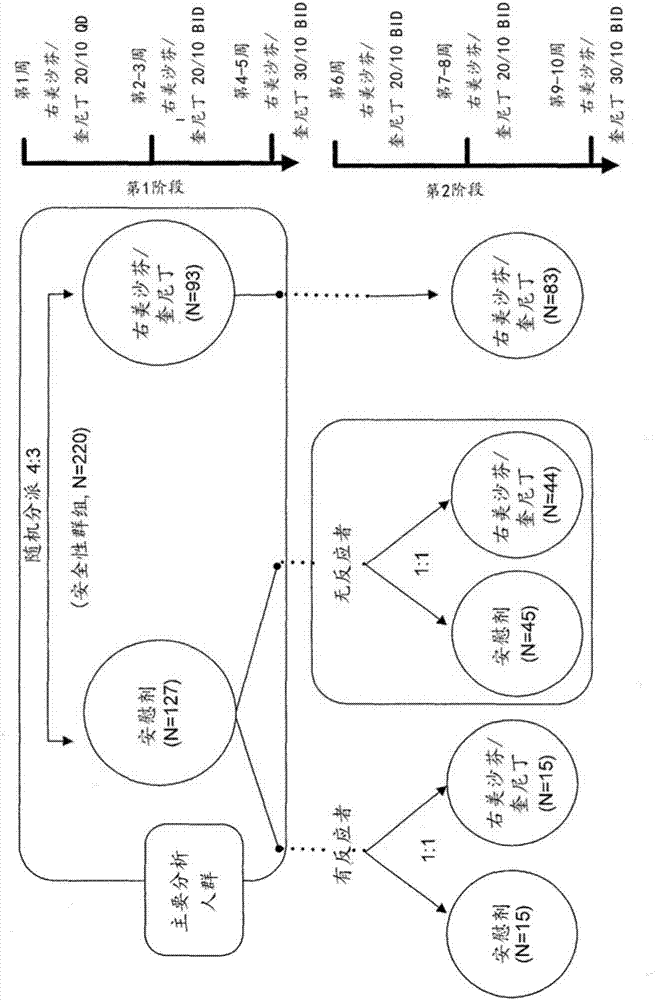
:阿爾茨海默癥是一種進行性神經變性疾病,最終會導致死亡。據估計,有540萬名美國人患有阿爾茨海默癥。自1980年以來,該數據已增加了一倍;預計到2050年,患病人數將高達1600萬(brookmeyer等人,alzheimersdement.2011;7(1):61-73)。在美國65歲以上的成年人當中,癡呆的患病率估計為5%至15%,而阿爾茨海默癥為癡呆中最常見的類型(kaplanandsadock’ssynopsisofpsychiatry:behavioralsciences,1998;evans等人,jama.1989;262(18):2551-6;losonczy等人,publichealthreports.,1998;113:273-80)。廣泛認為激越行為是阿爾茨海默癥及其他形式的癡呆的常見和重要的臨床特征(ballardcg等人,natrevneurol.2009;5(5):245-255)。雖然臨床醫師與護理人員可容易辨識出癡呆中激越行為,但是直到最近才由國際老年精神病學學會(ipa)的激越行為定義工作小組(adwg)擬定出一個共識定義,其判定標準如下:“1)發生在患有認知缺損或癡呆綜合征的患者中;2)所表現出的行為與情緒困擾相符;3)表現出過度的動作活動、言語或人身攻擊行為;及4)導致過度障礙從而損害了關系和/或日常活動、且并非完全歸因于另一種障礙(精神病學、醫學或精神活性物質相關的障礙)的明顯行為”(cummingsj等人,int.psychogeriatr.2014:1-11)。估計高達約80%的癡呆患者受到激越行為和/或攻擊行為的影響(ryus-h等人,amjgeriatrpsychiatry.2005;13(11):976-983;tractenbergre等人,jgeriatrpsychiatryneurol.2003;16(2):94-99),并且患病率隨著病情的進展而升高。癡呆患者的激越行為伴隨著下列各者:功能障礙增加(rabinspv等人,alzheimer’sdement.2013;9(2):204-207);生活品質更差(gonzález-salvadort等人,intjgeriatrpsychiatry.2000;15(2):181-189);更早被病院安置(steelec等人,amjpsychiatry.1990;147(8):1049-1051);增加護理者的負擔(rabinspv等人,alzheimer’sdement.2013;9(2):204-207);增加醫療費用(murmandl等人,neurology.2002;59(11):1721-1729);發展成重度癡呆所需的時間更短(petersme等人,amjgeriatrpsychiatry.2014;22(3):s65-s66);及加速死亡(petersme等人,amjgeriatrpsychiatry.2014;22(3):s65-s66)。鑒于這些原因,激越行為與攻擊行為是阿爾茨海默癥患者最可能需要藥物介入的神經精神病學癥狀(ballardcg等人,natrevneurol.2009;5(5):245-255)。然而,目前并無fda批準的用于治療阿爾茨海默癥中激越行為的藥物,而臨床醫師最終僅能借助于抗精神病藥物、鎮靜劑/安眠藥、抗焦慮藥物、抗抑郁劑的脫靶(off-target)用途,以試圖控制癥狀(maherar等人jama.2011;306(12):1359-1369)。不幸地,這些治療的效用有限,僅有的小幅療效也因著相對較差的依從性、安全性與耐受性而被抵消(ballardcg等人,natrevneurol.2009;5(5):245-255;schneiderls等人,nengljmed.2006;355(15):1525-1538;huybrechtskf等人,bmj2012;344:e977)。因而,急迫需要研發用于治療癡呆中激越行為的安全又有效的藥物介入。該項治療可對于患者護理有深遠的影響,減輕護理者的負擔,并潛在地改善總體的疾病預后。因為尚無美國食品藥物管理局(fda)批準的用于阿爾茨海默癥相關行為癥狀的治療方法,一直以來普遍通過脫靶使用抗精神病藥物處方來治療諸如攻擊行為與激越行為的癥狀(salzman等人,j.clin.psychiatry.2008;69(6):889-98;levensonandcrecelius,amda:publications–caringfortheages.,2003;4(6):31,34-35)。非典型抗精神病藥物的短期治療(6至12周)對于攻擊行為具有小幅效果,但較長期治療的效益有限,因為不良反應往往抵消了潛在療效(scheider等人,n.engl.j.med.2006;355(15):1525-38)。對于諸如激越行為的其他癥狀的效益則較不明確(sultzer等人,am.j.psychiatry.2008;165(7):844-54)。此外,使用抗精神病藥物引發嚴重不良結果的可能性亦受到嚴重關切,包括引發中風與死亡率升高(hybrechts等人,bmj.2012;344:e977)。也研究了非抗精神病的精神科用藥在緩解癥狀與作為二級預防方面的用途,但其成效甚微(tariot等人,arch.gen.psychiatry.2011;68(8):853-61)。因此,勢必需要仔細考量用于治療阿爾茨海默癥患者的激越行為與攻擊行為的其他藥理與非藥理方法(ballard等人,curr.opin.psychiatry.2009;22(6):532-40;lyketsos等人,thejournalofalzheimer’sassociation.2011;7(5):532-9)。右美沙芬是(+)-3-甲氧基-n-甲基嗎啡喃的通用名稱。其為嗎啡樣阿片類物質的右旋類似物的分子類型中的一者。已知右美沙芬具有影響中樞神經系統神經元的至少三種不同的受體活性。雖然右美沙芬的藥理性質指向針對數種適應癥的臨床療效,但當單獨給藥右美沙芬時,其療效相較于安慰劑而言是令人失望的。長久以來,已知在大多數人(估計涵蓋約90%的美國總人口)的體內,右美沙芬在肝臟進行大規模的o-去甲基作用而成為右啡烷,右啡烷則經cyp2d6催化并被迅速排出體外(ramachander等人,j.pharm.sci.1977;66(7):1047-8;和vetticaden等人,pharm.res.1989;6(1):13-9)。cyp2d6為以高濃度存在于肝臟中的氧化酶類型中的一員,并被稱作細胞色素p450酶(kronbach等人,anal.biochem.1987;162(1):24-32;和dayer等人,clin.pharmacol.ther.1989;45(1):34-40)。除了代謝右美沙芬外,cyp2d6亦負責人類體內的多態性異喹胍羥化作用(schmid等人,clin.pharmacol.ther.1985;38:618-624)。一替代途徑主要由cyp3a4與n-去甲基作用介導而形成3-甲氧基嗎啡喃(vonmoltke等人,j.pharm.pharmacol.,1998;50:997-1004)。右啡烷與3-甲氧基嗎啡喃皆可進一步去甲基成為3-羥基嗎啡喃,3-羥基嗎啡喃然后進行葡萄苷酸化作用。在大多數人的體內,將右美沙芬轉化為右啡烷的途徑是主要代謝途徑,這也是使用右美沙芬作為探針而將個體分成cyp2d6泛代謝者與不良代謝者表現型的背后的原理(kupfer等人,lancet.1984;2:517-518;guttendorf等人,ther.drugmonit.1988;10:490-498)。約有7%的白種人顯現不良代謝者的表型,而在華人與非洲黑人中的不良代謝者表型的發生率還要更低(droll等人,pharmacogenetics.1998;8:325-333)。在檢測右美沙芬在泛代謝者與不良代謝者中增加疼痛閾值的能力的一項研究中發現,右美沙芬的鎮痛效應在不良代謝者中顯著,但在泛代謝者中不顯著(desmeules等人,j.pharmacol.exp.ther.1999;288:607-612)。這些結果與母體右美沙芬(而非右啡烷代謝物)對于神經調節作用的直接效應相符。技術實現要素:如上所述,針對阿爾茨海默癥患者的激越行為、攻擊行為和/或相關癥狀,仍迫切需要其他或改進形式的治療。本發明提供治療阿爾茨海默癥患者的激越行為和/或攻擊行為和/或相關癥狀的方法,且不增加嚴重不良反應的風險。本發明的第一方面提供用于治療癡呆受試者的激越行為和/或攻擊行為和/或相關癥狀的方法,其通過給藥與cyp2d6抑制劑諸如奎尼丁(q)組合的右美沙芬化合物。本發明亦涵蓋在所述方法中使用右美沙芬化合物與奎尼丁中任一者或二者的藥學上可接受的鹽類。亦可在本發明所述的方法中使用奎尼丁的類似物或衍生物。在一個實施方案中,該癡呆為阿爾茨海默癥類型的癡呆。本發明的第二方面涉及右美沙芬化合物與cyp2d6抑制劑諸如奎尼丁的組合。本發明亦涵蓋在所述組合中使用右美沙芬化合物與奎尼丁中任一者或二者的藥學上可接受的鹽類。該組合可用于治療癡呆受試者的激越行為和/或攻擊行為和/或相關癥狀。在該組合中亦可使用奎尼丁的類似物或衍生物。在一個實施方案中,該癡呆為阿爾茨海默癥類型的癡呆。在一些實施方案中,依據本發明的第一與第二方面,右美沙芬化合物的給藥量或用量為每天約10mg至每天約200mg,而奎尼丁的給藥量或用量為每天約0.05mg至每天少于約50mg。在一些實施方案中,奎尼丁的給藥量或用量為每天約4.75mg至每天約20mg。在一些實施方案中,右美沙芬化合物的給藥量或用量為每天約10mg至每天約90mg。在一些實施方案中,奎尼丁和右美沙芬化合物中任一者或二者為藥學上可接受的鹽的形式。根據本發明的藥學上可接受的鹽包括堿金屬鹽、鋰鹽、鈉鹽、鉀鹽、堿土金屬鹽、鈣鹽、鎂鹽、賴氨酸鹽、n,n’二芐基乙二胺鹽、氯普魯卡因鹽、膽堿鹽、二乙醇胺鹽、乙二胺鹽、葡甲胺鹽、普魯卡因鹽、tris鹽、游離酸的鹽、游離堿的鹽、無機鹽、硫酸鹽、鹽酸鹽和氫溴酸鹽。在一些實施方案中,該右美沙芬化合物為右美沙芬氫溴酸鹽或氘化右美沙芬氫溴酸鹽的形式。在一些實施方案中,奎尼丁為硫酸奎尼丁的形式。在一些實施方案中,右美沙芬化合物和奎尼丁以單位劑型給藥或使用。在一些實施方案中,該單位劑型包含約4.75mg、4.9mg、9mg、或10mg奎尼丁(例如、硫酸奎尼丁)和約45mg、34mg、30mg、28mg、24mg、23mg、20mg、18mg、15mg、或10mg右美沙芬化合物(例如,氘化右美沙芬氫溴酸鹽或右美沙芬氫溴酸鹽)。在一個實施方案中,該單位劑型包含約10mg奎尼丁(例如,硫酸奎尼丁)和約20mg或30mg右美沙芬化合物(例如,右美沙芬氫溴酸鹽或氘化右美沙芬氫溴酸鹽)。在另一實施方案中,該單位劑型包含約9mg奎尼丁(例如,硫酸奎尼丁)和約15mg或23mg右美沙芬化合物(例如,右美沙芬氫溴酸鹽或氘化右美沙芬氫溴酸鹽)。在另一實施方案中,該單位劑型包含約4.9mg奎尼丁(例如,硫酸奎尼丁)和約18mg、24mg、28mg、30mg、或34mg右美沙芬化合物(例如,右美沙芬氫溴酸鹽或氘化右美沙芬氫溴酸鹽)。在另一實施方案中,該單位劑型包含約4.75mg奎尼丁(例如,硫酸奎尼丁)和約18mg、24mg、28mg、30mg、或34mg右美沙芬化合物(例如,右美沙芬氫溴酸鹽或氘化右美沙芬氫溴酸鹽)。在一些實施方案中,右美沙芬化合物和奎尼丁的單位劑型為片劑或膠囊的形式。在一些實施方案中,右美沙芬化合物和奎尼丁以組合的劑量或獨立劑量給藥或使用,其中右美沙芬化合物與奎尼丁的重量比為約1:1或更少。在一些實施方案中,該重量比為約1:1、1:0.95、1:0.9、1:0.85、1:0.8、1:0.75、1:0.7、1:0.65、1:0.6、1:0.55或1:0.5或更少。同樣,在某些實施方案中,所述劑量具有的右美沙芬化合物與奎尼丁的重量比小于約1:0.5,例如,約1:0.45、1:0.4、1:0.35、1:0.3、1:0.25、1:0.2、1:0.15、或1:0.1、1:0.09、1:0.08、1:0.07、1:0.06、1:0.05、1:0.04、1:0.03、1:0.02、或1:0.01或更少。該重量比可為例如、約1:0.75、約1:0.68、約1:0.6、約1:0.56、約1:0.5、約1:0.44、約1:0.39、約1:0.38、約1:0.31、約1:0.30、約1:0.29、約1:0.28、約1:0.27、約1:0.26、約1:0.25、約1:0.24、約1:0.23、約1:0.22、約1:0.21、約1:0.20、約1:0.19、約1:0.18、約1:0.17、1:0.16、約1:0.15、約1:0.14、約1:0.13、約1:0.12、約1:0.11和約1:0.10。在一些實施方案中、右美沙芬游離堿與奎尼丁游離堿的重量比為約1:0.68、約1:0.56、約1:0.44、約1:0.38。在某些其它實施方案中、d6-氘化右美沙芬的游離堿與奎尼丁游離堿的重量比為約1:0.30、約1:0.22、約1:0.19、約1:0.18、約1:0.16和約1:0.15。該右美沙芬化合物和奎尼丁可以每天一份組合劑量或以每天至少兩份組合劑量給藥或使用。在一個實施方案中該右美沙芬化合物和奎尼丁聯合給藥。在一些實施方案中,通過使用與奎尼丁組合的右美沙芬化合物進行治療而在阿爾茨海默癥受試者的激越行為和/或攻擊行為和/或相關癥狀中所獲的改善,可通過下列一或多項評分的改善而予以測量:·神經精神癥狀問卷(npi)的激越行為/攻擊行為領域;·npi總評分;·npi激越行為/攻擊行為、易怒性/不穩定性、異常的動作行為及焦慮領域的綜合評分(npi4a);·npi激越行為/攻擊行為、易怒性/不穩定性、異常的動作行為及去抑制作用領域的綜合評分(npi4d);·npi護理者的困擾-激越行為/攻擊行為領域;·修正型阿爾茨海默癥合作研究-對于激越行為的臨床總體印象改變(adcs-cgic)評分;和/或·對于激越行為的患者總體印象改變(pgi-c)評分。在一個實施方案中,相比于未治療的受試者或給藥安慰劑的受試者,受試者的激越行為/攻擊行為npi評分減少至少1.5。在一個實施方案中,相比于未治療的受試者或給藥安慰劑的受試者,受試者的np14a評分減少至少2.4。在一個實施方案中,相比于未治療的受試者或給藥安慰劑的受試者,受試者的np14d評分減少至少3.0。在一個實施方案中,相比于未治療的受試者或給藥安慰劑的受試者,受試者的激越行為的adcs–cgic評分改善至少0.5。在一個實施方案中,相比于未治療的受試者或給藥安慰劑的受試者,受試者的激越行為的pgi-c評分改善至少0.6。本文公開的藥物制劑可任選地包括藥學上可接受的載體、佐劑、填料或其他藥物組合物,且可依本領域所知的多種形式或途徑中的任一者給藥。本文公開的方法亦可任選地包括連同其他治療劑一起給藥右美沙芬化合物與cyp2d6抑制劑諸如奎尼丁,所述其他治療劑諸如例如已知或鑒定用于治療阿爾茨海默癥的一或多種治療劑。應該理解前述的一般說明與如下的詳細說明僅為例示性與說明性,其意欲提供本發明的進一步的非限制性說明。附圖簡述圖1顯示本發明的右美沙芬化合物的一種實施方案,即,d6-氘-修飾的右美沙芬的化學結構。圖2提供阿爾茨海默癥中激越行為的臨床研究的研究設計。“右美沙芬/奎尼丁20/10”是指20mg的右美沙芬與10mg的奎尼丁的劑量。qd與bhd分別指每天一次與每天二次的劑量。星號(*)表示參與者在第1周訪問前即中止,因此并無可用于主要療效終點的任何基線后數據。圖3提供本申請所述的阿爾茨海默癥中激越行為臨床研究的報告試驗的統一標準(consort)患者流程圖的示意圖。標示有的群體代表被包括在連續平行比較設計(spcd)中的那些。圖4說明本申請所述的阿爾茨海默癥中激越行為臨床研究所包括的受試者在第一階段中的平均npi激越行為/攻擊行為評分,其采用連續平行比較設計(或spcd)。示出了各次訪問的p值,其從分析協方差(ancova)模型(以治療為固定效應且以基線為協變量)計算而得。a=所觀察的情況。圖5說明阿爾茨海默癥中激越行為臨床研究(采用spcd)所包括的受試者在第二階段中的平均npi激越行為/攻擊行為評分。示出各次訪問的p值,其從ancova模型(以治療為固定效應且以基線為協變量)計算而得。a=所觀察的情況。圖6說明在本申請所述的阿爾茨海默癥中激越行為臨床研究的10周的次級分析中平均npi激越行為/攻擊行為評分。為期10周的次級分析僅包括在研究期間一直被分配為相同治療中的受試者,亦即在整個研究期間經隨機分配僅接受右美沙芬/奎尼丁或僅接受安慰劑的受試者,從而模擬平行設計。示出各次訪問的p值,其從ancova模型(以治療為固定效應且以基線為協變量)計算而得。a=所觀察的情況。圖7顯示帕羅西汀與avp-786-第1組的治療隨時間的平均血漿濃度。圖8顯示帕羅西汀與avp-786-第2組的治療隨時間的平均血漿濃度。圖9顯示度洛西汀與avp-786-第3組的治療隨時間的平均血漿濃度。圖10顯示度洛西汀與avp-786-第4組的治療隨時間的平均血漿濃度。發明詳述下列詳細說明與實施例說明本發明的某些實施方案。本
技術領域:
的技術人員將認知到存在本發明的各種變化與修飾,其被包括在本發明范圍內。因此,特定實施方案的說明不應被視為限制本發明的范圍。在本申請中所引述的所有參考文獻,包括但不限于已公開與未公開的申請、專利及文獻參考資料,皆在此完整地并入本案作為參考,及據此成為本說明書的一部分。定義“改善”與“治療”等術語以可互換方式使用,且包括治療性處理。該二術語是指改善、減少、抑制、減弱、減輕、遏制或穩定疾病(如本申請中所述的疾病或障礙)或疾病的單一癥狀或一群癥狀(如綜合征)的發展或進行。在本申請中所用的“治療”是指緩解或減輕受試者疾病的至少一種癥狀。例如,就行為障礙而言,“治療”可指緩解或減輕激越行為和/或攻擊行為和/或相關癥狀及其表現的任何組合(如擊打、咒罵、捶打、踱步、抗拒等)和相關行為(如易怒性、焦慮等)。在本發明的含義的內,術語“治療”亦表示遏止、延緩其發作(即疾病在臨床表現前的期間),和/或降低疾病發生或惡化的風險。“疾病”是指損害或干擾細胞、組織、器官或生物體的正常功能的任一病癥或障礙。術語“癡呆”是指歸因于器官性或心理因素的總體心智退化;其特征在于定向力障礙;記憶力、判斷力及智力受損;及情緒表淺而不穩定。本申請中的癡呆包括血管型癡呆、缺血性血管型癡呆(ivd)、額顳葉型癡呆(ftd)、路易氏體癡呆、阿爾茨海默氏癡呆等。最常見的癡呆形式系與阿爾茨海默癥(ad)相關聯。“阿爾茨海默癥(ad)”是指進行性心智退化,其表現出記憶喪失、混淆及定向力障礙,一般在晚年發病,及通常在5至10年間導致死亡。阿爾茨海默癥可由熟練的神經科醫師或臨床醫師診斷出來。在一個實施方案中,患有阿爾茨海默癥的受試者將符合美國國家神經疾病與溝通障礙及中風研究所/阿爾茨海默癥與相關疾病學會(nincds/adrda)針對推定存在阿爾茨海默癥的標準。術語“類似物”或“衍生物”在本申請中按常規的藥學含義使用,指在結構上與基準分子(諸如右美沙芬、氘化右美沙芬或奎尼丁)類似的分子,但已依靶向和受控的方式用替代取代基代替該基準分子的一或多個特定取代基,以使得產生在結構上與該基準分子類似的分子。類似物的合成和篩選(如使用結構和/或生物化學分析)以鑒定可具有改進或偏移的特性(諸如效力較高和/或對于特定的靶向受體類型的選擇性較高、穿透哺乳類動物的血腦屏障的能力較高、副作用較少等)的已知化合物的略作修飾的版本,是藥學化學中眾所周知的一種藥物設計方法。此外,使用本領域技術人員所知的方法,可產生本發明的化合物的具有增進的治療效力的類似物與衍生物,即具有較高的效力和/或對于特定的靶向受體類型的選擇性較高、穿透哺乳類動物的血腦屏障的能力較高或較低(如較高或較低的血腦屏障滲透率)、較少的副作用、在受試者體內留存較久等。如本發明中所用的術語“激越行為”是一總稱,其可指一系列的行為失調或障礙,包括攻擊行為、好斗及過動。就本發明的目的而言,該定義包括如下所述的激越行為:cummings等人internationalpsychogeriatrics;volume27;issue01;2015年1月,pp7-17。廣義上,cummings等人將激越行為定義為:1)發生在患有認知缺損或癡呆綜合征的患者中;2)所表現出的行為與情緒困擾相符;3)表現出過度的動作活動、言語或人身攻擊行為;及4)導致過度障礙且并非完全歸因于另一種障礙(精神病學、醫學或精神活性物質相關的)的明顯行為。術語激越行為還包括:1)與內心的緊張感相關聯的過度的動作活動。該活動通常是無益及重復性的,且由諸如無法坐著不動、踱步、擰扭雙手及拉扯衣服的行為所組成;2)無法就需求或混亂(confusion)本身來解釋的不適當的言語、聲音或動作活動。包括諸如漫無目的游蕩、踱步、咒罵、尖叫、咬及打斗的行為;3)在一特定環境中的具有破壞性、不安全或干擾護理進行的聲音或動作行為。其包括四種行為領域,如發出聲音、動作失調、攻擊性及抗拒護理;4)讓他人得知該個體正經歷不愉快的激動狀態及在介入減少內在與外在刺激后仍維持不變的這些行為,介入性治療處置包括處理抗拒情況、緩解令人厭惡的身體征象、減少所積累壓力的來源;及5)該個體拒絕合作、不讓人幫忙或者難以處理的行為。如本申請所用的術語“相關癥狀”是指與患者相關聯的癥狀,而該患者符合認知缺損或癡呆綜合征(如阿爾茨海默癥、額顳葉型癡呆、路易氏體癡呆、血管型癡呆、其他癡呆、一種前癡呆認知缺損綜合征諸如輕微認知缺損或其他認知性障礙)的標準。相關癥狀例如包括與所觀察到或推斷的情緒困擾的證據(如情緒的快速變化、易怒、脾氣爆發)相關的行為。在一些情況下,該行為在至少為期兩周的期間是持續性或經常復發的,且代表不同于患者平時的行為。術語“相關癥狀”還包括過度的動作活動(實例包括:踱步、來回擺動、做手勢、指指點點、煩躁不安、進行重復性舉止);言語攻擊(如大呼小叫、用過大的聲音說話、罵臟話、尖叫、呼喊);人身攻擊(如抓取、推擠、推、抗拒、擊打別人、踢物體或人、抓傷、咬、投擲物體、擊打自己、摔門、撕東西和毀壞財物)。在涉及活性成分時所用的術語“組合”在本申請中用于限定單一藥物組合物(制劑),其包含本發明的二種藥物(即右美沙芬化合物與奎尼丁),或用于限定待聯合給藥的二種獨立的藥物組合物(制劑),其各包含本發明的一種藥物(即右美沙芬化合物或奎尼丁)。在本發明的含義內,術語“聯合給藥”系用于指右美沙芬化合物與奎尼丁在一種組合物中的同時給藥,或在不同組合物中的同時給藥,或相繼給藥。對于被視為“聯合給藥”的相繼給藥,右美沙芬化合物與奎尼丁需間隔一段時間給藥,使得在受試者中產生針對中樞神經系統(cns)障礙的相關行為障礙產生治療、預防、遏止、延緩其發作和/或降低其惡化風險的有益效應。例如在一些實施方案中,右美沙芬化合物與奎尼丁在同一天給藥(如每天各給藥一次或二次)。如本文所述,總npi評分為標準12項npi領域的綜合評分。npi是在包括癡呆在內的多種疾病情況下用于評估精神病理學的一種經過驗證的臨床工具。npi為一種回顧性的護理者-被調查者訪談,其涵蓋12項神經精神病學癥狀領域:妄想、幻覺、激越行為/攻擊行為、煩躁/抑郁、焦慮、欣快癥/興高采烈、淡漠/漠不關心、去抑制化行為、易怒性/不穩定性、異常的動作行為、夜間行為失調及食欲/飲食失調。定稿的npi訪談包括針對各癥狀領域的綜合篩選問題;當一個篩選問題引發陽性回應時,則有要接續提出的關乎領域特定行為的一系列問題。一種領域內的神經精神病學表現由護理者同時按頻率(0至4)與嚴重性(1至3)進行評分,而獲得各認定為陽性的領域的1至12的綜合(頻率x嚴重性)癥狀領域評分。已在頻率與嚴重性評量表中限定了定位點,以提高護理者的回應的可信度。在通過評分0(毫不困擾)至5(極度困擾)所定位的量表上,就各陽性的神經精神病學癥狀領域來評定護理者的困擾分數。如本申請所用,npi4a評分為包含npi激越行為/攻擊行為、異常的動作行為、易怒性/不穩定性及焦慮領域的綜合評分。如本申請所用,npi4d評分為包含npi激越行為/攻擊行為、異常的動作行為、易怒性/不穩定性及去抑制化行為領域的綜合評分。在論及劑量或量時所用的術語“治療有效的”是指化合物或藥物組合物的量,其在給藥至有需要的受試者時足以產生所需活性。在本申請中,當術語“治療有效量/劑量”用于包含右美沙芬化合物的藥物組合物時,其可與術語“神經學上有效量/劑量”互換使用,且是指化合物或藥物組合物的量/劑量,其足以產生有效的神經學反應,即在給藥至受試者時改善與中樞神經系統障礙相關聯的行為障礙。與本發明的組合物結合使用的“藥學上可接受的”一詞,是指當給藥至受試者(如人類)時,該組合物的分子實體及其他成分為生理上可耐受的,及通常不會產生不良反應。在一些實施方案中,“藥學上可接受的”一詞是指由聯邦政府或州政府的主管機關批準,或指在美國藥典或其他一般公認的藥典中列為適用于哺乳類動物及尤其適用于人類。用于本發明的藥物組合物的術語“載體”,是指伴隨活性化合物(如右美沙芬化合物或奎尼丁)給藥的稀釋劑、賦形劑或載劑。該藥物載體可為無菌液體,諸如水、鹽水溶液、右旋糖水溶液、甘油水溶液;及油類,包括那些來自石油、動物、植物或合成來源者,諸如花生油、大豆油、礦物油、芝麻油等。適宜的藥物載體描述于e.w.martin的“remington'spharmaceuticalsciences”的第18版中。如本申請所用的術語“受試者”包括哺乳動物(如嚙齒動物諸如小鼠或大鼠)。在一些實施方案中,該術語是指呈現與中樞神經系統障礙相關的行為障礙的人類,該障礙諸如激越行為和/或攻擊行為。術語“受試者”亦包括呈現癡呆的神經精神病學癥狀或行為癥狀的人類。應理解在所合成的化合物中存在天然同位素豐度的一些變化,其取決于合成中所用的化學原料來源。因而,右美沙芬的制劑將固有地含有少量的氘化和/或含13c的同位素體(isotopologue)。盡管存在該變化,相較于本發明的化合物的穩定的同位素取代程度,天然豐度的穩定氫與碳同位素的濃度是微小且無關緊要的。參見,例如,wadae等人,seikagaku1994,66:15;ganeslz等人,compbiochemphysiolamolintegrphysiol1998,119:725。在本發明的化合物中,當一特定位置被指定具有氘時,應理解在該位置的氘豐度顯著大于氘的天然豐度(一般約為0.015%)。在該化合物中指定為氘的各原子上,指定具有氘的位置通常具有至少為3000的最低同位素富集因子(摻入45%的氘)。如本申請所用的術語“同位素富集因子”是指特定同位素的同位素豐度與天然豐度間的比率。在其它實施方案中,本發明的化合物對各指定的氘原子具有的同位素富集因子為至少3500(在各指定氘原子處摻入52.5%氘),至少4000(摻入60%氘),至少4500(摻入67.5%氘),至少5000(摻入75%氘),至少5500(摻入82.5%氘),至少6000(摻入90%氘),至少6333.3(摻入95%氘),至少6466.7(摻入97%氘),至少6600(摻入99%氘),或至少6633.3(摻入99.5%氘)。在本發明的化合物中,未特別指定為特定同位素的任何原子是指代表該原子的任何穩定同位素。除非另有說明,否則當一位置特別指定為“h”或“氫”時,應理解該位置所具有的氫為其天然豐度同位素組成。術語“同位素體”是指,除了在一或多個位置的同位素組成之外(如氫相對于氘),其所具有的化學結構與化學式和本發明的特定化合物相同的物質。因而,同位素體與本發明的特定化合物的差異僅在于其同位素組成上。如本申請所用的術語“化合物”意欲包括其任一鹽類、溶劑化物或水合物。為了便于在本申請中使用,術語“右美沙芬化合物”將包括下列術語:右美沙芬;或氘化右美沙芬;或右美沙芬的類似物或衍生物;或氘化右美沙芬的類似物或衍生物。通常,本發明的右美沙芬化合物在被稱作“嗎啡喃”結構的構型中具有四個分子環,其如下所示:在該圖中,碳原子按常規方式編號,而與碳原子9及13偶聯的楔形鍵表明這些鍵在嗎啡喃結構中的其他三個環的平面上凸起。在酸與該化合物的堿性基團諸如氨基官能團之間,或者在堿與該化合物的酸性基團諸如羧基官能團之間,形成本發明的化合物的鹽。依據另一實施方案,該化合物為藥學上可接受的酸加成鹽。通常用于形成藥學上可接受的鹽的酸包括無機酸,如氫二硫化物(hydrogenbisulfide)、鹽酸、氫溴酸、氫碘酸、硫酸和磷酸,以及有機酸如對甲苯磺酸、水楊酸、酒石酸、酸式酒石酸(bitartaricacid)、抗壞血酸、馬來酸、苯磺酸(besylicacid)、富馬酸、葡糖酸、葡糖醛酸、甲酸、谷氨酸、甲磺酸、乙磺酸、苯磺酸、乳酸、草酸、對溴苯基磺酸、碳酸、琥珀酸、檸檬酸、苯甲酸和乙酸,以及相關無機和有機酸。該藥學上可接受的鹽因此包括硫酸鹽、焦硫酸鹽、硫酸氫鹽、亞硫酸鹽、亞硫酸氫鹽、磷酸鹽、磷酸一氫鹽、磷酸二氫鹽、偏磷酸鹽、焦磷酸鹽、氯化物、溴化物、碘化物、乙酸鹽、丙酸鹽、癸酸鹽(decanoate)、辛酸鹽、丙烯酸鹽、甲酸鹽、異丁酸鹽、癸酸鹽(caprate)、庚酸鹽、丙炔酸鹽、草酸鹽、丙二酸鹽、琥珀酸鹽、辛二酸鹽、癸二酸鹽、富馬酸鹽、馬來酸鹽、丁炔-1,4-二酸鹽、己炔-1,6-二酸鹽、苯甲酸鹽、氯苯甲酸鹽、甲基苯甲酸鹽、二硝基苯甲酸鹽、羥基苯甲酸鹽、甲氧基苯甲酸鹽、鄰苯二甲酸鹽、對苯二甲酸鹽、磺酸鹽、二甲苯磺酸鹽、苯基乙酸鹽、苯基丙酸鹽、苯基丁酸鹽、檸檬酸鹽、乳酸鹽、β-羥基丁酸鹽、羥乙酸鹽、馬來酸鹽、酒石酸鹽、甲磺酸鹽、丙磺酸鹽、萘-1-磺酸鹽、萘-2-磺酸鹽、扁桃酸鹽及其他鹽類。在一個實施方案中,藥學上可接受的酸加成鹽包括與礦物酸(如鹽酸和氫溴酸)所形成的那些,且包括與有機酸如馬來酸所形成的那些。在一些實施方案中,藥學上可接受的鹽包括堿金屬鹽、鋰鹽、鈉鹽、鉀鹽、堿土金屬鹽、鈣鹽、鎂鹽、賴氨酸鹽、n,n’二芐基乙二胺鹽、氯普魯卡因鹽、膽堿鹽、二乙醇胺鹽、乙二胺鹽、葡甲胺鹽、普魯卡因鹽、tris鹽、游離酸的鹽、游離堿的鹽、無機鹽、硫酸鹽、鹽酸鹽和氫溴酸鹽。除非另外指明,本申請中所述的劑量分別指右美沙芬化合物與奎尼丁的氫溴酸鹽與硫酸鹽的鹽類形式。基于該信息,本領域技術人員可計算活性成分的各自游離酸或游離堿的對應劑量。本領域的技術人員可計算右美沙芬的鹽類的分子量及右美沙芬的游離堿的分子量,及使用該比值計算游離堿以及鹽類的適當劑量。例如可給藥或使用劑量為15mg的右美沙芬氫溴酸鹽(具有分子式c18h25no.hbr.h2o)及9mg的硫酸奎尼丁(具有分子式(c20h24n2o2)2.h2so4.2h2o),其對應于約11mg的右美沙芬與7.5mg的奎尼丁。其他劑量例如包括23mg的右美沙芬氫溴酸鹽與9mg硫酸奎尼丁(對應于約17mg的右美沙芬與約7.5mg的奎尼丁);20mg的右美沙芬氫溴酸鹽與10mg硫酸奎尼丁(對應于約15mg的右美沙芬與8.3mg的奎尼丁);30mg的右美沙芬氫溴酸鹽與10mg硫酸奎尼丁(對應于約22mg的右美沙芬與8.3mg的奎尼丁)。可給藥劑量為24mgd6-氘化右美沙芬氫溴酸鹽(具有分子式c18h19d6no.hbr.h2o)和4.75mg硫酸奎尼丁(具有分子式(c20h24n2o2)2.h2so4.2h2o)(對應于約18mg右美沙芬和3.96mg奎尼丁)。d6-氘化右美沙芬的其它劑量包括,例如,34mgd6-右美沙芬氫溴酸鹽和4.75mg硫酸奎尼丁(對應于約25.18mgd6-右美沙芬和約3.96mg奎尼丁);18mgd6-右美沙芬氫溴酸鹽和4.9mg硫酸奎尼丁(對應于約13.33mgd6-右美沙芬和4.08mg奎尼丁);24mgd6-右美沙芬氫溴酸鹽和4.9mg硫酸奎尼丁(對應于約17.78mgd6-右美沙芬和4.08mg奎尼丁);28mgd6-右美沙芬氫溴酸鹽和4.9mg硫酸奎尼丁(對應于約20.74mgd6-右美沙芬和4.08mg奎尼丁);30mgd6-右美沙芬氫溴酸鹽和4.9mg硫酸奎尼丁(對應于約22.22mgd6-右美沙芬和4.08mg奎尼丁);34mgd6-右美沙芬氫溴酸鹽和4.9mg硫酸奎尼丁(對應于約25.18mgd6-右美沙芬和4.08mg奎尼丁)。如本文所述,術語“水合物”是指進一步包含通過非共價分子間力結合的化學計量或非化學計量的水的化合物。如本文所述,術語“溶劑合物”是指進一步包含通過非共價分子間力結合的化學計量或非化學計量的溶劑(如水、丙酮、乙醇、甲醇、二氯甲烷、2-丙醇等)的化合物。本發明的化合物(例如,下述式i化合物),可因為例如氘取代或其他原因,而含有一個非對稱碳原子。因此,本發明的化合物能以單獨對映異構體或二個對映異構體的混合物的形式存在。因此,本發明的化合物將包括外消旋混合物,也包括各個單獨的立體異構體,其基本上不含另一種可能的立體異構體。如本申請所用的術語“基本上不含其他立體異構體”,是指所存在的其他立體異構體少于25%;在一些實施方案中,所存在的其他立體異構體少于10%;在一些實施方案中,所存在的其他立體異構體少于5%;及在一些實施方案中,所存在的其他立體異構體少于2%,或所存在的其他立體異構體系少于“x”%(其中x為0至100的數字且包括0與100在內)。獲得或合成特定化合物的單獨對映異構體的方法是本領域眾所周知的,并且可根據實際情況而應用于最終化合物或起始原料或中間產物。如本申請所用的術語“穩定化合物”所指的化合物,是具有的穩定性足以促成其制造,及在一段充分的時間內維持該化合物的完整性,使其適用于本申請所詳述的目的(如配制成治療用產品、用于生產治療用化合物的中間體、可分離或可儲存的中間化合物;用于治療對于治療劑有反應的疾病或病癥)。“d”是指氘。“立體異構體”是指對映異構體和非對映異構體二者。在本說明書中,變量可泛指(如“各r”)或可特指(如r1或r2)。除非另有說明,當變量為泛指時,其意欲包括該特定變量的所有具體實施方案。如本申請所用的術語“包含”與“包括”、“含有”或“特征在于”同義,且為包容性或開放式的,及不排除其他未引述的元件或方法步驟。應理解用于表達說明書中所用成分、反應條件等的量的所有數值,在所有情況下皆用術語“約”來修飾。因此,除非另外說明,本申請所記載的數值參數為近似值,其可依所需性質而變化。就最低限度而言,且并非試圖在對于本申請主張優先權的任何申請中任何權利要求的范圍上限制等同原則的施用,各數值參數的解釋應鑒于有效數字的數目及常規的四舍五入法。治療化合物右美沙芬(dm)為可待因類似物左啡諾的非阿片樣物質d-異構體,且在過去約50年曾廣泛作為非處方(otc)鎮咳劑。右美沙芬的藥理學復雜,對于數種不同的受體具有結合親和力,而其主要活性針對中樞神經系統(cns)。右美沙芬因其作為弱的非競爭性n-甲基-d-天冬氨酸(nmda)受體拮抗劑的活性而眾所周知(ki=1500nm),(tortella等人trendspharmacolsci.1989;10(12):501–7;chouyc等人,brainres.1999;821(2):516–9;netzerr等人,eurjpharmacol.1993;238(2-3):209–16;jaffedb等人,neuroscilett.1989;105(1-2):227–32),且具有抗谷氨酸興奮性活性的相關潛力。右美沙芬還為有效的sigma-1激動劑(zhougz等人,eurjpharmacol.1991;206(4):261–9;mauricet等人,brainresbrainresrev.2001;37(1-3):116–32;cobosej等人,currneuropharmacol.2008;6(4):344–66),(ki=200nm),且以高親和力與5-羥色胺轉運子結合(sert;ki=40nm)。雖然右美沙芬對于去甲腎上腺素運載體的親和力僅為中等(ki=13μm),但其可有效抑制去甲腎上腺素的攝取(ki=240nm)(coddee等人,jpharmacolexpther.1995;274(3):1263–70)。右美沙芬為α3β4煙堿型乙酰膽堿受體的拮抗劑,據報導ic50值(產生50%抑制作用的濃度)為0.7μm(damaj等人,jpharmacolexpther.2005;312(2):780–5)。由于這些相互作用中的一種或多種的結果,右美沙芬降低鉀刺激的谷氨酸釋放作用(annelssj等人,brainres.1991;564(2):341–3),及調控單胺(5-羥色胺、去甲腎上腺素及多巴胺)神經傳遞作用(coddee等人,jpharmacolexpther.1995;274(3):1263–70;mauricet等人,pharmacolther.2009;124(2):195–206;mauricet等人,progneuropsychopharmacolbiolpsychiatry.1997;21(1):69–102)。右美沙芬對于α3β4煙堿型乙酰膽堿受體的拮抗作用(damajmi等人,jpharmacolexpther.2005;312(2):780–5)可應用在一些中樞神經系統運動障礙和成癮(silveraa等人,jamacadchildadolescpsychiatry.2001;40(9):1103–10)。當單獨給藥時,右美沙芬先在肝臟中迅速代謝成為右啡烷(dx),造成生物利用度過低,因而限制中樞神經系統的暴露。雖然與右啡烷相互作用的一些受體與右美沙芬的相同,但對于關鍵受體的親和力卻不同,其迅速進行葡糖苷酸綴合作用,進而大幅阻止其穿越血腦屏障,因而降低所開劑量對于中樞神經系統的效應(churchj等人,eurjpharmacol.1985;111(2):185–90;franklinph等人,molpharmacol.1992;41(1):134–46)。本發明提供式i的化合物,包括其藥學上可接受的鹽、溶劑合物和水合物:其中,r1選自ch3、ch2d、chd2和cd3;且r2選自ch3、ch2d、chd2和cd3。所有具有至少一個氘的式i的化合物稱為氘化右美沙芬。在一個實施方案中r1和r2都為cd3。該化合物也稱為d6-右美沙芬或d6-dm。在另一實施方案中,r1和r2中只有一個為cd3。在另一實施方案中,該化合物選自表1所示化合物的任一個。表1:式i的示例性化合物化合物編號r1r2100cd3ch3101cd3cd3102cd2hcd3103cd3cd2h104ch3cd3105ch2dch2d106ch2dcd3107cd3ch2d108ch3ch3在另一組實施方案中,上述或下列任一實施方案中的未指定為氘的任何原子,以其天然同位素豐度存在。在另一組的實施方案中,式i的化合物被分離或純化,例如,所存在的式i的化合物純度分別為所存在的式i的同位素體總量的至少50%重量(例如,至少55%,60%,65%,70%,75%,80%,85%,90%,95%,97%,98%,98.5%,99%,99.5%或99.9%)。因而,在一些實施方案中,包含式i的化合物的組合物可包括該化合物的同位素體的分布,條件是至少50重量%的同位素體為所述的化合物。在一些實施方案中,式i的化合物中所指定具有氘的任一位置,在式i的化合物所指定位置具有至少45%(例如,至少52.5%,至少60%,至少67.5%,至少75%,至少82.5%,至少90%,至少95%,至少97%,至少99%,或至少99.5%)的最低氘摻入。因而,在一些實施方案中,包含式i的化合物的組合物可包括該化合物的同位素體的分布,條件是至少45%的同位素體在所指定位置包括氘。在一些實施方案中,式i化合物“基本上不含”該化合物的其它同位素體,例如,存在少于50%、少于25%、少于10%、少于5%、少于2%、少于1%、或少于0.5%的其它同位素體。普通的合成化學家即可輕易完成式i的化合物的合成。相關程序及中間體例如公開于kimhc等人,bioorgmedchemlett2001,11:1651和newmanah等人,jmedchem1992,35:4135中。可使用對應的氘化型及任選地其他含有同位素的試劑和/或中間體,或引用本領域已知用于將同位素原子引入化學結構中的標準合成方案,從而進行這些方法,以合成本申請所述的化合物。氘化(d6)-右美沙芬(d6-dm)(圖1)為右美沙芬的一種氘化同位素,其中用氘置換位于特定位置上的6個氫原子。氘為氫的一種穩定、非放射性同位素,且普遍存在于環境中,包括普遍存在于水中。在醫學研究中經常使用穩定同位素,其在從新生兒到成人的各年齡層人的應用歷史悠久。氘最常以示蹤劑水平在pk與代謝研究中使用。相較于來自天然來源諸如水的每天暴露量,預計在氘化治療性藥物的長期給藥期間的預期暴露水平亦相當低。例如,來自30mg劑量的d6-右美沙芬的暴露量估計約相當于20毫升(0.7盎司)的水。這是基于水中氘的天然豐度為0.0156%,及假設所攝取的所有d6-右美沙芬(mw=277.43)劑量將被代謝成為d3-右啡烷(d3-dx),且釋出氘化水(mw=20.03)。后者的假設高估了所釋出的氘化水量,但提供了關于所消耗氘的對比量的一個概念。本發明者用氘化右美沙芬進行的藥理學研究顯示,氘化作用并未改變右美沙芬的基礎藥理學。pk與藥物代謝研究指出,d6-右美沙芬的代謝途徑與右美沙芬相同。通過氘的取代作用,最容易讓通過cyp2d6的代謝作用受到抑制。體外代謝研究亦指出,d6-右美沙芬與右美沙芬(通過不同物種,包括人)的代謝作用產生相同的代謝物,即相較于右美沙芬,并未辨識出d6-右美沙芬產生任何獨特的代謝物。組織分布研究顯示,來自14c-標記的d6-右美沙芬(14c-d6-dm)與來自14c-標記的右美沙芬(14c-dm)的放射性標記的分布類似。使用d6-右美沙芬進行的毒理學研究顯示,在相當的暴露下,d6-右美沙芬與右美沙芬的劑量限制性毒性(dlt)是相當的,且是基于與中樞神經系統效應相關聯的不良臨床體征的。在使用d6-右美沙芬/奎尼丁進行的一項為期13周的毒性研究中(該研究包括高劑量的右美沙芬/奎尼丁以供比較),所評估的毒性測量顯示d6-右美沙芬/奎尼丁與非氘化右美沙芬/奎尼丁所得的研究結果相似。示例性合成一種方便的合成式i化合物的方法替代了制備右美沙芬中使用的合成方法中的適當合適的氘化中間體和試劑。這些方法描述于例如,美國專利號7,973,049,其以其整體在此引入作為參考。式i的化合物可從以下所示的已知中間體x、xi和xii之一制備,且可從可易于由已知步驟得到的相關中間體制備。方案1顯示式i化合物的通用路徑。方案1顯示制備其中r1不為ch3的式i化合物的通用途徑。將hbr鹽10,在用nh4oh處理后,進行n-脫甲基化以得到11。使用氯甲酸乙酯將胺11酰化以提供氨基甲酸酯12,其然后使用bbr3進行o-脫甲基化以得到醇13。在堿的存在下,用適當氘化的碘甲烷處理化合物13,以得到醚14,其使用氘化鋁鋰(lad)還原以得到其中r2═cd3的式i化合物,或使用氫化鋁鋰(lah)還原以得到其中r2═ch3的化合物。對于其中r1為ch3的化合物,氨基甲酸酯12直接用lad處理以制備其中r2為cd3的化合物。如上所示的特定方法與化合物并非旨在限制。本文的方案中的化學結構所描述的變量,在此限定為與本申請的化合物化學式中對應位置的化學基團定義(部分、原子等)相稱,不論是否標識為相同的變量名稱(即r1或r2)與否。化合物結構中化學基團用于合成另一化合物的適宜性,落在本領域技術人員的知識范圍內。合成式i的化合物及它們的合成前體的其他方法,包括在本申請的方案中未明確顯示的途徑中的那些,屬于本領域中一般技術的化學家的手段之內。適于合成可適用化合物的合成化學轉化及保護基團方法(保護與去保護作用)是本領域已知的,且例如包括下列各者所述者:larockr,comprehensiveorganictransformations,vchpublishers(1989);greenetw等人,protectivegroupsinorganicsynthesis,3rded.,johnwileyandsons(1999);fieserl等人,fieserandfieser'sreagentsfororganicsynthesis,johnwileyandsons(1994);和paquettel,ed.,encyclopediaofreagentsfororganicsynthesis,johnwileyandsons(1995);及它們的后續版本。本發明所設想的取代基與變量的組合,是導致形成穩定化合物的那些。氘化右美沙芬和右美沙芬的類似物或衍生物應理解本發明的方法和組合中使用的右美沙芬化合物包括右美沙芬和氘化右美沙芬二者的類似物或衍生物。例如,在一個實施方案中,根據本發明的組合或方法包括氘化右美沙芬,且在另一實施方案中,該組合和方法包括氘化右美沙芬的類似物或衍生物。類似的,在另一實施方案中,根據本發明的組合或方法包括右美沙芬,且在另一實施方案中,該組合或方法包括右美沙芬的類似物或衍生物。術語“烷基”,如本文所述,是指任何無支鏈或支鏈、取代或未取代的飽和烴。烷基部分可為支鏈或直鏈。烷基可具有1至10個碳原子(每當在本申請中出現時,諸如“1至10”的數值范圍是指所給定范圍內的各整數;例如,“1至10個碳原子”是指該烷基可由1個碳原子、2個碳原子、3個碳原子等所組成,至多且包括由10個碳原子組成,但是本定義亦涵蓋未指定數值范圍的術語“烷基”)。術語“取代的”具有其通常含義,如見于相關領域的眾多現代專利中。參見,例如,美國專利no.6,509,331;6,506,787;6,500,825;5,922,683;5,886,210;5,874,443;和6,350,759;其均以其整體在此引入作為參考。具體地,“取代的”的定義與美國專利號6,509,331所提供的一樣寬泛,其所限定的術語“取代的烷基”是指烷基,其在一些實施方案中具有1至10個碳原子及其中具有1至5個取代基,且在一些實施方案中具有1至3個取代基,所述取代基選自烷氧基、取代的烷氧基、環烷基、取代的環烷基、環烯基、取代的環烯基、酰基、酰基氨基、酰氧基、氨基、取代的氨基、氨基酰基、氨基酰氧基、氧基酰基氨基、氰基、鹵素、羥基、羧基、羧基烷基、酮基、硫酮基、巰基、硫代烷氧基、取代的硫代烷氧基、芳基、芳基氧基、雜芳基、雜芳基氧基、雜環基、雜環基氧基、羥基氨基、烷氧基氨基、硝基、-so-烷基、-so-取代的烷基、-so-芳基、-so-雜芳基、-so2-烷基、-so2-取代的烷基、-so2-芳基和-so2-雜芳基。如上所列的其他專利也提供術語“取代的”的標準定義,其是本領域技術人員所充分理解的。術語“環烷基”是指任何非芳族烴環,在一些實施方案中,該環具有5至12個組成環的原子。術語“雜環”或“雜環的”是指任何非芳族烴環,其中在該環中具有至少一個雜原子如氧、硫或氮原子以及至少一個碳原子。如本申請所用的術語“烯基”,是指在二個碳之間含有雙鍵的任何無支鏈或支鏈、取代或未取代的不飽和烴。如本申請所用的術語“炔基”,是指在二個碳之間含有三鍵的任何無支鏈或支鏈、取代或未取代的不飽和烴。如本申請所用的術語“芳基”與“雜芳基”是指芳族烴環,在一些實施方案中該環具有5、6或7個原子,而在其他實施方案中該環具有6個原子。“雜芳基”是指芳族烴環,其中在該環中具有至少一個雜原子如氧、硫或氮原子以及具有至少一個碳原子。術語“雜環”或“雜環的”是指含有一或多個雜原子的任何環狀化合物。芳基、雜環及雜芳基可被任何取代基取代,包括上述及本領域所知的這些取代基。單獨出現且不帶有指定數字的取代基“r”,是指選自烷基、環烷基、芳基、雜芳基(經由環碳而鍵結)及雜脂環基(經由環碳而鍵結)的取代基。術語“氨基烷基”是指選自-rnr'r"、-rnhr'和–rnh2的取代基,其中r、r’及r”各自獨立地為本文所限定的r。如本申請所用的術語“鹵素原子”,是指元素周期表第七列的任何一個放射性穩定的原子,如氟、氯、溴或碘。術語“烷氧基”是指任何無支鏈或支鏈,取代或未取代的,飽和或不飽和的醚,例如c1-c6無支鏈飽和未取代的醚、甲氧基、和二甲基醚、二乙基醚、甲基-異丁基醚、和甲基-叔丁基醚。已發現數種右美沙芬的類似物可減緩或阻止右美沙芬的代謝。在一些實施方案中,可用體積較大的基團置換位于芳基環的2位的氫,即r1。如本文所述,術語“體積大的”或“體積較大的”是指錐角大于氫的取代基。合適的取代基包括但不限于c1-c10烷基、c2-c10烯基、c2-c10炔基、c6-c12芳基、c7-c13芳基烷基、c3-c10環烷基、c2-c10雜環、c3-c10雜環烷基、c3-c12雜芳基、c4-c12雜芳基烷基、烷基氨基和二烷基氨基,其中各氫任選被低級烷基、烷氧基或鹵素取代。不希望受限于任何特定的理論,據信當引入體積較大的基團時,會阻斷cyp2d6啟動將右美沙芬化合物轉化為右啡烷與其他代謝物的催化作用。因此,可阻止或大幅減少右美沙芬類似物(包括氘化類似物)的快速代謝作用。例如,叔丁基烷基借助其相對較大的錐角,可保護與氧鍵結的甲基,及阻止右美沙芬或氘化右美沙芬的o-去甲基作用。或者,若該大型基團含有堿性氮,該氮存在于距離甲氧基5至7埃處,則可通過抑制cyp2d6而阻止氧化作用。在2位具有體積大的基團的合適的類似物包括化合物(1-1)和(1-2),如下所示。在其它實施方案中,3位的甲氧基可被較大的基團or2取代。合適的取代基包括但不限于以下:r1選自氫、c1-c10烷基、c2-c10烯基、c2-c10炔基、c6-c12芳基、c7-c13芳基烷基、c3-c10環烷基、c2-c10雜環、c3-c10雜環烷基、c3-c12雜芳基、c4-c12雜芳基烷基、烷基氨基和二烷基氨基,其中各個氫任選取代有低級烷基、烷氧基或鹵素;且r2選自c2-c10烷基、c2-c10烯基、c2-c10炔基、c6-c12芳基、c7-c13芳基烷基、c3-c10環烷基、c2-c10雜環、c4-c10雜環烷基、c3-c12雜芳基、c4-c12雜芳基烷基、烷基氨基和二烷基氨基,其中各個氫任選被低級烷基、烷氧基或鹵素取代。當r1為氫,r2不能為氫或甲基以排除右美沙芬和右啡烷。在3位具有大體積的-or2基團的合適的類似物包括化合物(ii-1)-(ii-4),如下所示。在其它實施方案中,3位的甲氧基可被包含硫原子的較大的基團取代。合適的取代基包括但不限于以下:各r1獨立地選自氫、c1-c10烷基、c2-c10烯基、c2-c10炔基、c6-c12芳基、c7-c13芳基烷基、c3-c10環烷基、c2-c10雜環、c3-c10雜環烷基、c3-c12雜芳基、c4-c12雜芳基烷基、烷基氨基和二烷基氨基,其中各個氫任選被低級烷基、烷氧基或鹵素取代;且r2選自-sr1,在3-位具有含硫的大體積基團的合適的類似物包括化合物(iii-1)-(iii-3),如下所示。不希望受限于任何特定的理論,據信在3位引入含有氧原子或硫原子的體積較大的基團,可改善右美沙芬或氘化右美沙芬的半衰期(t1/2)。通過增加半衰期,可在右美沙芬類似物代謝成為右啡烷前,使其血中濃度提高達一段較長的時間。備選的取代基與取代作用亦在本發明的精神與范圍內。尤其,包括一或多個氘原子的取代基與取代作用(例如d6dm),落在本發明的范圍內。本領域的一般技術人員將知悉如何進行本發明的右美沙芬類似物的修飾作用,以提供氘化右美沙芬類似物。在本發明的范圍內亦包括newman等人于jmedchem.1992年10月30日;35(22):4135-42中所述的化合物。newman在驚厥作用的多種體外與體內模型中確定這些化合物展現出抗驚厥活性。cyp2d6抑制劑本發明設想右美沙芬化合物連同cyp2d6抑制劑諸如奎尼丁的使用。雖然奎尼丁最常用于共同給藥,但其它抗氧化劑,如inaba等人,drugmetabolismanddisposition.1985;13:443-447,forme-pfister等人,biochem.pharmacol.1988;37:3829-3835,和broly等人,biochem.pharmacol.1990;39:1045-1053中所述的那些,亦可與右美沙芬化合物共同給藥,以降低其代謝作用。如inaba等人所報導,其ki值(michaelis-menton抑制值)為50微摩爾或更低的cyp2d6抑制劑包括去甲替林、氯丙嗪、多潘立酮、氟哌啶醇、匹泮哌隆、拉貝洛爾、美托洛爾、氧烯洛爾、普萘洛爾、噻嗎洛爾、美西律、奎寧、苯海拉明、阿義馬林、洛貝林、罌粟堿和育亨賓。具有特別有效的抑制活性的化合物包括育亨賓、氟哌啶醇、阿義馬林、洛貝林和匹泮哌隆,其具有的ki值范圍為4至0.33μm。除了上述所報導的抗氧化劑外,亦發現elilillyandco.以商品名所銷售的氟西汀,在一些人中具有增加血中的右美沙芬濃度的效用。此外,下列化合物中的任一者可用于抑制cyp2d6:特比萘芬、西那卡塞、丁丙諾啡、丙米嗪、安非他酮、利托那韋、舍曲林、度洛西汀、硫利達嗪、甲氧氯普胺、帕羅西汀、或氟伏沙明。其他抗氧化劑的劑量將依抗氧化劑而異,并以個體為基礎而決定。意外地發現可用右美沙芬化合物與一定量的奎尼丁的組合來治療患有阿爾茨海默癥中的激越行為和/或攻擊行為的受試者,其中奎尼丁的量顯著低于先前認為提供顯著治療效果所需的最低量。通過cyp2d6抑制劑連同右美沙芬的共同給藥,可進一步避開右美沙芬或其氘化形式的代謝作用。奎尼丁是一種有效的cyp2d6抑制劑,且已進行過關于該項用途的具體研究(授予smith的美國專利5,206,248)。奎尼丁的化學結構如下:奎尼丁共同給藥至少具有二項不同的有益效應。首先,其大幅增加右美沙芬化合物在血液中的循環量。此外,其還產生更為一致及可預期的右美沙芬濃度。涉及右美沙芬或奎尼丁和右美沙芬共同給藥的研究,以及奎尼丁對于血漿濃度的影響的研究,描述于專利文獻(參見,例如,美國專利5,166,207,美國專利5,863,927,美國專利5,366,980,美國專利5,206,248,美國專利5,350,756和美國專利7,973,049)。奎尼丁給藥可將具有泛代謝者表型的個體轉變為不良代謝者表型(inaba等人,br.j.clin.pharmacol.1986;22:199-200)。當右美沙芬與奎尼丁共同給藥時,血液中的右美沙芬水平隨著右美沙芬劑量線性增加,但是當單獨給藥右美沙芬時,即使在高劑量時,在大部分的受試者中仍然無法檢測出右美沙芬(zhang等人,clin.pharmac.&therap.1992;51:647-55)。因而,在右美沙芬與奎尼丁的共同給藥后,在快速代謝者中所觀察到的血漿水平,與在不良代謝者中所觀察到的血漿水平類似。因此,醫師應謹慎看待在可能為不良代謝者的受試者中的奎尼丁的給藥。藥物組合物所公開方法與組合的特征之一,在于它們具有減少阿爾茨海默癥患者的激越行為和/或攻擊行為的功能。在一些情況下,在未采用鎮靜方式或以其他方式顯著干預意識或警覺性時,和/或不增加嚴重不良反應的風險的情況下,達到這種減少作用。如本申請所用的“顯著干預”是指在臨床水平上顯著(例如,它們將引起醫師或心理醫師的特別關注),或在個人或社會水平上顯著(諸如通過引發嗜睡,其嚴重程度足以損害個人駕駛車輛的能力)的不良事件。相反地,由非處方藥物如含有右美沙芬的止咳糖漿在建議劑量使用時可能引起的非常輕微的副作用類型,則不視為顯著干預。用于短期或長期管理阿爾茨海默癥受試者的激越行為和/或攻擊行為的與奎尼丁組合的右美沙芬化合物的治療劑量,可依下列因素而異,諸如病癥的具體原因、病癥的嚴重性及給藥途徑。劑量和/或給藥頻率亦可能依個體受試者的年齡、體重及反應而異。在一個實施方案中,右美沙芬化合物和奎尼丁以組合劑量給藥,或以獨立劑量給藥。該獨立劑量可基本上同時給藥。在一個實施方案中,右美沙芬化合物與奎尼丁的重量比為約1:1或更少。在一些實施方案中,該重量比為約1:1,1:0.95,1:0.9,1:0.85,1:0.8,1:0.75,1:0.7,1:0.65,1:0.6,1:0.55或1:0.5或更少。同樣,在某些實施方案中,所述劑量具有的右美沙芬化合物與奎尼丁的重量比少于約1:0.5,例如,約1:0.45,1:0.4,1:0.35,1:0.3,1:0.25,1:0.2,1:0.15,或1:0.1,1:0.09,1:0.08,1:0.07,1:0.06,1:0.05,1:0.04,1:0.03,1:0.02,或1:0.01,或更少。該重量比可為例如,約1:0.75,約1:0.68,約1:0.6,約1:0.56,約1:0.5,約1:0.44,約1:0.39,約1:0.38,約1:0.31,約1:0.30,約1:0.29,約1:0.28,約1:0.27,約1:0.26,約1:0.25,約1:0.24,約1:0.23,約1:0.22,約1:0.21,約1:0.20,約1:0.19,約1:0.18,約1:0.17,1:0.16,約1:0.15,約1:0.14,約1:0.13,約1:0.12,約1:0.11和約1:0.10。在一些實施方案中,右美沙芬游離堿與奎尼丁游離堿的重量比為約1:0.68,約1:0.56,約1:0.44,約1:0.38。在某些其它實施方案中,d6-氘化右美沙芬的游離堿與奎尼丁游離堿的重量比為約1:0.30,約1:0.22,約1:0.19,約1:0.18,約1:0.16和約1:0.15。在某些實施方案中,當右美沙芬化合物和奎尼丁以1:1或更少的重量比給藥時,任一次給藥少于50mg的奎尼丁。例如,在某些實施方案中,給藥的奎尼丁為約30mg、25mg或20mg或更少。在其它實施方案中,給藥的奎尼丁為約15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.0mg、或更少。在其它實施方案中,奎尼丁給藥約5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg、或更少。在一些實施方案中,重量比為1:1或更少的組合劑量(或同時給藥的獨立劑量)每天一次、每天兩次、每天三次、每天四次、或更頻繁給藥,以向受試者每天提供一定劑量水平,例如:每天60mg奎尼丁和60mg右美沙芬化合物,以兩份劑量提供,各劑量包含30mg奎尼丁和30mg右美沙芬化合物;每天50mg奎尼丁和50mg右美沙芬化合物,以兩份劑量提供,各劑量包含25mg奎尼丁和25mg右美沙芬化合物;每天40mg奎尼丁和40mg右美沙芬化合物,以兩份劑量提供,各劑量包含20mg奎尼丁和20mg右美沙芬化合物;每天30mg奎尼丁和30mg右美沙芬化合物,以兩份劑量提供,各劑量包含15mg奎尼丁和15mg右美沙芬化合物;或每天20mg奎尼丁和20mg右美沙芬化合物,以兩份劑量提供,各劑量包含10mg奎尼丁(即,約9mg奎尼丁游離堿)和10mg右美沙芬化合物。在一些實施方案中,可依照每天所給藥的劑量數目,調整組合劑量中右美沙芬化合物和奎尼丁的總量,以提供對受試者適宜的每天總劑量,同時將重量比維持在1:1以下。在一些實施方案中,用于治療阿爾茨海默癥受試者中的激越行為和/或攻擊行為的右美沙芬化合物與奎尼丁的組合的總每日劑量,為約10mg或更少至約200mg或更多的右美沙芬化合物,組合約0.05mg或更少至約60mg或更多的奎尼丁。在一些實施方案中,用于治療阿爾茨海默癥受試者的激越行為和/或攻擊行為的日劑量為約10mg至約90mg右美沙芬化合物組合約2.5mg至約60mg奎尼丁,為單一或分開的劑量。在一些實施方案中,右美沙芬化合物的總每日劑量為約15mg、16mg、17mg、18mg、19或20mg,組合約15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁。在一些實施方案中,用于治療阿爾茨海默癥受試者的激越行為和/或攻擊行為的日劑量為約20mg、21mg、22mg、23mg、24mg、25mg、26mg、27mg、28mg、29mg、或30mg右美沙芬化合物,組合約15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁;或約30mg、31mg、32mg、33mg、34mg、35mg、36mg、37mg、38mg、39mg、或40mg右美沙芬化合物,組合約15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁;或約40mg、41mg、42mg、43mg、44mg、45mg、46mg、47mg、48mg、49mg、或50mg右美沙芬化合物,組合約15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁;或約50mg、51mg、52mg、53mg、54mg、55mg、56mg、57mg、58mg、59mg、或60mg右美沙芬化合物,組合約15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁;或約60mg、61mg、62mg、63mg、64mg、65mg、66mg、67mg、68mg、69mg、或70mg右美沙芬化合物,組合約15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁;或約70mg、71mg、72mg、73mg、74mg、75mg、76mg、77mg、78mg、79或80mg右美沙芬化合物,組合約15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁;或約80mg、81mg、82mg、83mg、84mg、85mg、86mg、87mg、88mg、89mg、90mg右美沙芬化合物,組合約15mg、10mg、9.5mg、9.0mg、8.5mg、8.0mg、7.5mg、7.0mg、6.5mg、6.0mg、5.5mg、5.00mg、4.95mg、4.90mg、4.85mg、4.80mg、4.75mg、4.70mg、4.65mg、4.60mg、4.55mg、4.50mg、4.45mg、4.40mg、4.35mg、4.30mg、4.25mg、4.20mg、4.15mg、4.10mg、4.05mg、4.00mg、3.95mg、3.90mg、3.85mg、3.80mg、3.75mg、3.70mg、3.65mg、3.60mg、3.55mg、3.50mg、3.45mg、3.40mg、3.35mg、3.30mg、3.25mg、3.20mg、3.15mg、3.10mg、3.05mg、3.00mg、2.95mg、2.90mg、2.85mg、2.80mg、2.75mg、2.70mg、2.65mg、2.60mg、2.55mg、2.50mg、2.45mg、2.40mg、2.35mg、2.30mg、2.25mg、2.20mg、2.15mg、2.10mg、2.05mg、2.00mg、1.95mg、1.90mg、1.85mg、1.80mg、1.75mg、1.70mg、1.65mg、1.60mg、1.55mg、1.50mg、1.45mg、1.40mg、1.35mg、1.30mg、1.25mg、1.20mg、1.15mg、1.10mg、1.05mg、1.00mg、0.95mg、0.90mg、0.85mg、0.80mg、0.75mg、0.70mg、0.65mg、0.60mg、0.55mg、0.50mg、0.45mg、0.40mg、0.35mg、0.30mg、0.25mg、0.20mg、0.15mg、0.10mg、或0.05mg或更少的奎尼丁;其為單一或分開的劑量。在一些實施方案中,右美沙芬化合物和奎尼丁的日劑量為30mg右美沙芬氫溴酸鹽和30mg硫酸奎尼丁。其它劑量包括,例如,15mg右美沙芬氫溴酸鹽和9mg硫酸奎尼丁(對應于約11mg右美沙芬和約7.5mg奎尼丁);23mg右美沙芬氫溴酸鹽和9mg硫酸奎尼丁(對應于約17mg右美沙芬和約7.5mg奎尼丁);20mg右美沙芬氫溴酸鹽和10mg硫酸奎尼丁(對應于約15mg右美沙芬和8.3mg奎尼丁);30mg右美沙芬氫溴酸鹽和10mg硫酸奎尼丁(對應于約22mg右美沙芬和8.3mg奎尼丁)。可給藥或使用30mgd6-右美沙芬氫溴酸鹽(分子式為c18h19d6no.hbr.h2o)和30mg硫酸奎尼丁(分子式為(c20h24n2o2)2.h2so4.2h2o)的劑量(對應于約22.22mg右美沙芬和25mg奎尼丁)。d6-氘化右美沙芬的其它劑量包括,例如,24mgd6-右美沙芬氫溴酸鹽和4.75mg硫酸奎尼丁(對應于約18mgd6-右美沙芬和約3.96mg奎尼丁);34mgd6-右美沙芬氫溴酸鹽和4.75mg硫酸奎尼丁(對應于約25.18mgd6-右美沙芬和約3.96mg奎尼丁);18mgd6-右美沙芬氫溴酸鹽和4.9mg硫酸奎尼丁(對應于約13.33mgd6-右美沙芬和4.08mg奎尼丁);24mgd6-右美沙芬氫溴酸鹽和4.9mg硫酸奎尼丁(對應于約17.78mgd6-右美沙芬和4.08mg奎尼丁);28mgd6-右美沙芬氫溴酸鹽和4.9mg硫酸奎尼丁(對應于約20.74mgd6-右美沙芬和4.08mg奎尼丁);30mgd6-右美沙芬氫溴酸鹽和4.9mg硫酸奎尼丁(對應于約22.22mgd6-右美沙芬和4.08mg奎尼丁);34mgd6-右美沙芬氫溴酸鹽和4.9mg硫酸奎尼丁(對應于約25.18mgd6-右美沙芬和4.08mg奎尼丁)。在一些實施方案中,該治療以較低的日劑量起始,例如每天約18或30mg右美沙芬化合物組合約2.5至10mg奎尼丁,且增加至約90mg右美沙芬化合物組合約10至20mg或更高的奎尼丁,取決于受試者的總體響應。在一些實施方案中,嬰兒、孩童、超過65歲的個體及腎功能或肝功能受損的那些個體,最初接受較低劑量,其基于個體反應與血液水平所決定。一般而言,大部分的個體對于18至90mg右美沙芬化合物和4.75至20mg奎尼丁的每天劑量的耐受性良好。如本領域技術人員所顯而易見的,在一些情況下可給藥在所公開的這些范圍之外的劑量。而且,應注意到具一般技術的臨床醫師或主治醫師將根據個體反應而明白何時中斷、調整或終止治療。可采用任何適宜的給藥途徑,以向該受試者提供用于治療阿爾茨海默癥受試者的激越行為和/或攻擊行為的有效劑量的右美沙芬化合物與奎尼丁的組合。例如,可采用口服、直腸、經皮、腸胃外(皮下、肌內、靜脈內)、鞘內、局部、吸入式及類似形式的給藥。適宜的劑型包括片劑、糖錠、分散劑、懸浮劑、溶液、膠囊、貼劑等。通過可將這些化合物導入血流中的任何適宜方法,進行由本申請中所述化合物制備的藥物的給藥。在一些實施方案中,所述制劑可含有由活性化合物與本領域技術人員所知的藥學上可接受的載體或稀釋劑所組成的混合物。本文公開的藥物組合物包含右美沙芬化合物與cyp2d6抑制劑如奎尼丁的組合,或右美沙芬化合物和/或奎尼丁的藥學上可接受的鹽,作為活性成分,且還可包含藥學上可接受的載體,且任選地,其它治療成分。術語“藥學上可接受的鹽”或“其藥學上可接受的鹽”是指從藥學上可接受的、無毒的酸或堿制備的鹽。合適的藥學上可接受的鹽包括金屬鹽,例如,鋁、鋅的鹽;堿金屬鹽如鋰、鈉和鉀鹽;堿土金屬鹽如鈣和鎂鹽;有機鹽,例如,賴氨酸、n,n′-二芐基乙二胺、氯普魯卡因、膽堿、二乙醇胺、乙二胺、葡甲胺(n-甲基葡糖胺)、普魯卡因和tris鹽;游離酸和堿的鹽;無機鹽,例如,硫酸鹽、鹽酸鹽和氫溴酸鹽;和目前在藥學上廣泛使用及列于本領域技術人員眾所周知的來源(諸如themerckindex)的其他鹽類。可選擇任何適宜組分來制造本申請中所述的活性藥物的鹽,條件是其不具毒性及基本上不干擾所需活性。除了鹽類之外,亦可采用這些化合物的藥學上可接受的前體與衍生物。氘化右美沙芬和/或奎尼丁的藥學上可接受的酰胺、低級烷基酯及受保護的衍生物亦適用于本申請所公開的組合物與方法中。在某些實施例中,氘化右美沙芬以氘化右美沙芬氫溴酸鹽的形式給藥,右美沙芬以右美沙芬氫溴酸鹽的形式給藥,而奎尼丁以硫酸奎尼丁的形式給藥。所述組合物可以任何所需形式制備,例如,片劑、粉末、膠囊、可注射劑、懸浮劑、囊劑、扁囊劑、貼劑、溶液、酏劑和氣霧劑。載體如淀粉、糖、微晶纖維素、稀釋劑、成粒劑、潤滑劑、粘合劑、崩解劑等可用于口服固體制劑。在某些實施方案中,該組合物被制備為口服固體制劑(如粉末、膠囊和片劑)。在某些實施方案中,該組合物被制備為口服液體制劑。在一些實施方案中,該口服固體制劑為片劑。如果需要的話,片劑可通過標準水性或非水性技術涂覆。除了上述劑型,本文公開的化合物也可通過緩釋、延遲釋放或控制釋放組合物和/或遞送裝置給藥,例如,如美國專利號3,845,770;3,916,899;3,536,809;3,598,123;和4,008,719所述的那些。適用于口服給藥的藥物組合物可以獨立單元形式提供,諸如膠囊劑、扁囊劑、囊劑、貼劑、可注射劑、片劑及氣霧型噴劑,其中各含有預定量的活性成分,其作為粉末或顆粒的形式,或為在水性液體、非水性液體、水包油型乳化液或油包水型液態乳化液中的溶液或懸浮劑的形式。這些組合物可通過任一常規的制藥學方法制備,但大部分的這些方法通常包括將活性成分與構成一種或多種成分的載體結合的步驟。一般而言,這些組合物的制備通過將活性成分與液態載體、細分的固態載體或二者均勻且密切地混合,然后任選地使產物成型而具有所需的外觀。例如可通過任選地與一或多種附加成分一起進行壓制或模制,而制備片劑。可通過在適宜機器中壓制處于諸如粉末或顆粒的自由流動形式的活性成分,及任選地與粘合劑、潤滑劑、惰性稀釋劑、表面活性劑或分散劑混合,而制備壓制的片劑。可在適宜機器中,通過對用惰性液態稀釋劑潤濕的粉末狀化合物的混合物進行模制,而制成模制型片劑。在一些實施方案中,各片劑包含約30mg右美沙芬氫溴酸鹽和30mg硫酸奎尼丁。該片劑可包含,例如,15mg右美沙芬氫溴酸鹽和9mg硫酸奎尼丁(對應于約11mg右美沙芬和約7.5mg奎尼丁);23mg右美沙芬氫溴酸鹽和9mg硫酸奎尼丁(對應于約17mg右美沙芬和約7.5mg奎尼丁);20mg右美沙芬氫溴酸鹽和10mg硫酸奎尼丁(對應于約15mg右美沙芬和8.3mg奎尼丁);30mg右美沙芬氫溴酸鹽和10mg硫酸奎尼丁(對應于約22mg右美沙芬和8.3mg奎尼丁)。該片劑可包含30mgd6-右美沙芬氫溴酸鹽(分子式為c18h19d6no.hbr.h2o)和30mg硫酸奎尼丁(分子式為(c20h24n2o2)2.h2so4.2h2o)(對應于約22.22mg右美沙芬和25mg奎尼丁)。該片劑可包其它劑量,例如,24mgd6-右美沙芬氫溴酸鹽和4.75mg硫酸奎尼丁(對應于約18mgd6-右美沙芬和約3.96mg奎尼丁);34mgd6-右美沙芬氫溴酸鹽和4.75mg硫酸奎尼丁(對應于約25.18mgd6-右美沙芬和約3.96mg奎尼丁);18mgd6-右美沙芬氫溴酸鹽和4.9mg硫酸奎尼丁(對應于約13.33mgd6-右美沙芬和4.08mg奎尼丁);24mgd6-右美沙芬氫溴酸鹽和4.9mg硫酸奎尼丁(對應于17.78mgd6-右美沙芬和4.08mg奎尼丁);28mgd6-右美沙芬氫溴酸鹽和4.9mg硫酸奎尼丁(對應于約20.74mgd6-右美沙芬和4.08mg奎尼丁);30mgd6-右美沙芬氫溴酸鹽和4.9mg硫酸奎尼丁(對應于約22.22mgd6-右美沙芬和4.08mg奎尼丁);34mgd6-右美沙芬氫溴酸鹽和4.9mg硫酸奎尼丁(對應于約25.18mgd6-右美沙芬和4.08mg奎尼丁)。如本申請所用的“最低有效治療量”為,對于右美沙芬化合物從身體的迅速排除產生令人滿意的抑制程度的量,同時并未引發不良反應,或所引發的不良事件的程度與性質可接受。更具體而言,在一些實施方案中,有效治療量為,每天自約9、10、18、20、25或30mg至約90mg范圍內的右美沙芬化合物與低于約50mg的奎尼丁。在一些實施方案中,該有效治療量為,每天自約20或30mg至約90mg范圍內的右美沙芬化合物與約0.5mg至約30mg的奎尼丁。在一些實施方案中,該量基于右美沙芬化合物的血漿半衰期,以分開劑量給藥。例如,在一個實施方案中,氘化右美沙芬和奎尼丁按所指定的毫克增量的方式給藥,以達到以μg/ml血漿為單位的特定水平的氘化右美沙芬的靶濃度,其中氘化右美沙芬與奎尼丁的最大指定劑量是基于體重的。在一些實施方案中,該目標劑量每12小時給藥一次。在一些實施方案中,該目標劑量每天給藥一次。在一些實施方案中,將奎尼丁的水平降至最低,且減少或排除在高劑量奎尼丁時所觀察到的副作用,使得所提供的效益顯著優于含有右美沙芬化合物及更高水平的奎尼丁的組合物。在一些實施方案中,其它治療劑與右美沙芬化合物和奎尼丁組合給藥。例如,右美沙芬化合物和奎尼丁可與化合物組合給藥以治療抑郁癥或焦慮。在一些實施方案中,右美沙芬化合物和奎尼丁作為已知治療劑的佐劑以用于治療阿爾茨海默癥的癥狀。治療阿爾茨海默癥的癥狀的藥物包括,但不限于,膽堿酯酶抑制劑如多奈哌齊、利伐斯的明、加蘭他敏和他克林、美金剛和維生素e。實施例實施例1:阿爾茨海默癥臨床研究中的激越行為和攻擊行為進行臨床研究,以測定右美沙芬與奎尼丁的組合是否有效減少阿爾茨海默癥患者的激越行為和/或攻擊行為。該項研究為一項為期10周的隨機、雙模擬、安慰劑對照的多中心研究,其研究口服右美沙芬/奎尼丁在可能患有阿爾茨海默癥及臨床顯著的激越行為的個體中的療效。該項研究在美國境內的42個地點進行,其中包括阿爾茨海默癥的門診診所及協助生活與看護的機構。合格的參與者的年齡為50歲至90歲,且可能患有阿爾茨海默癥(2011nationalinstituteonaging—alzheimerassociationcriteria)及臨床顯著的激越行為,臨床顯著的激越行為定義為組織性不佳及漫無目的的心理運動性活動的一種狀態,其特征在于具有下列的至少一項:攻擊性言語(如尖叫、謾罵);攻擊性肢體行為(如毀壞物品、搶奪、打架);及非攻擊性肢體行為(如踱步、煩躁不安)。合格的參與者在篩選前的七天內出現激越行為(間歇性或持續性),且該激越行為癥狀的嚴重性足以干擾日常生活且需要藥物治療。合格的參與者在激越行為的病情嚴重程度的臨床總體印象量表(cgis)上的評分為≥4(病情中等嚴重),及簡易精神狀態檢查(mmse)的評分為8至28。容許使用穩定劑量的阿爾茨海默癥用藥(≥2個月;美金剛和/或乙酰基膽堿酯酶抑制劑)及抗抑郁劑、抗精神病藥物或安眠藥(≥1個月;包括短效苯并二氮雜□和非苯并二氮雜□);其劑量在整個研究期間維持穩定。當研究調查人員認為必要時,可在研究期間容許使用口服勞拉西泮(在7天期間內最高1.5mg/日且最多3天)以作為激越行為的“救援”藥物。剔除標準為非阿爾茨海默癥癡呆、并非阿爾茨海默癥繼發型的激越行為、在精神醫療機構住院治療、明顯抑郁癥(康奈爾(cornell)癡呆抑郁量表[csdd]≥10)、精神分裂癥、情感分裂性障礙或雙相情感障礙、重癥肌無力(因為這是奎尼丁的用藥禁忌)或臨床顯著/不穩定的全身性疾病;具有完全心臟傳導阻滯、qt間隔(qtc)延長的校正變化或尖端扭轉性心室搏動過速的病史;具有先天性qt延長的家族病史;在過去一年內有發生姿勢性或不明原因性暈厥的記錄;或在3年內有精神活性物質(substance)/酒精濫用的記錄。不允許使用第一代抗精神病藥、三環類與單胺氧化酶抑制劑型抗抑郁劑。為期10周的試驗具有二個連續的雙盲5周的階段(第一階段與第二階段)(圖2)。在第一階段中,按3:4(活性成分:安慰劑)的比例隨機分派參與者。第一階段中的隨機分派通過基線認知功能(mmse>15vs≥15)與激越行為嚴重性(cgis4-5vs6-7)進行分層;通過區組隨機分派確保在各層中的治療平衡。就第一階段的前7天(第1至7天)而言,活性成分治療組在早晨接受avp-923-20(20mg右美沙芬和10mg奎尼丁)及在晚上接受安慰劑;而安慰劑組則每天接受安慰劑二次。就第一階段的后2周(第8至21天)而言,avp-923組每天接受avp-923-20二次,而安慰劑組則每天接受安慰劑二次。在第22天,avp組的用藥劑量增加至每天給藥avp-923-30(30mg的右美沙芬與10mg的奎尼丁)二次。在第一階段剩余2周(第22至35天),avp組繼續每天接受avp-923-30二次,而接受安慰劑的參與者則繼續每天接受安慰劑二次。在第二階段中,凡在第一階段中接受avp-923的參與者繼續在為期5周的整個期間每天接受avp-923二次。在第一階段中接受安慰劑的參與者則在第一階段結束(第4次訪問)時分層為二個亞組,這依據其臨床反應,該反應根據病情嚴重程度的臨床總體印象(cgis)評分及其神經精神癥狀問卷(npi)的激越行為/攻擊行為領域評分評估。若參與者的激越行為cgis評分低于3分(輕度病情)及其npi激越行為/攻擊行為領域評分與基線相比下降25%或更多,則將其視為“有反應者”。未符合這些標準的參與者則視為“無反應者”。然后按1:1的比例將各安慰劑亞組(有反應者與無反應者)重新隨機分派接受avp-923或匹配的安慰劑。在第一階段期間接受安慰劑及在第二階段中重新隨機分派為avp-923的參與者,在研究的前7天(第二階段,第36至42天)在早晨接受avp-923-20及在晚上接受匹配的安慰劑。從第43天開始,參與者連續二周(第二階段,第43至56天)每天接受avp-923-20二次;及從第57天開始在剩余的2周期間(第二階段,第57至70天),參與者每天接受avp-923-30二次直到研究結束為止。參與者在篩選、基線(第1天)及在第8天、第22天、第36天、第43天、第57天及第70天(第2至7次訪問)參加了臨床訪問。包括篩選階段在內,各參與者參與本研究的時間長度約為14周。供測量血漿中的藥物水平的血液樣品在第36天(第4次訪問)及在第70天(第7次訪問)收集。供細胞色素p450-2d6(cyp2d6)基因型分析用的血液樣品在第1天(基線訪問)收集。研究者或贊助單位可在間發疾病、不良事件、與參與者的健康或幸福感等有關的其它原因的情況下,或在不合作、不遵從醫囑、違反程序或其他管理上的原因的情況下,中止參與者繼續參與研究。此外,當參與者在隨機分派后的任一時間所呈現的qtc間隔(bazett-校正的qt(qtcb)或fridericia-校正的qt(qtcf))大于500毫秒(除非是由于心室起搏)或其篩選心電圖(ecg)結果的qtc間隔變化大于60毫秒時,其退出研究。評估qtc數值的臨床顯著性并且記錄下來。要求在研究完成前退出的參與者回到診所來完成第7次訪問(研究結束時)的評估。若參與者在研究完成前退出或停止參與,則盡一切努力來記錄參與者的結果。如果參與者退出研究,若護理者和/或參與者的代表撤回對于未來信息披露的同意書,則不再進行進一步的評估,亦不再收集附加的數據。參與者與護理者已被告知,參與者應該大約每12小時±4小時(早晨與晚上)用水服用研究用藥。所提供的avp-923與安慰劑的膠囊具有相同外觀,并裝于有防兒童取用的蓋子的85cc的白色塑膠瓶中,一個瓶子有白色標簽供早晨給藥,一個瓶子有藍色標簽供晚上給藥。avp-923膠囊與安慰劑膠囊的組成示于表2。表2:成分(mg的量)avp-923-30avp-923-20安慰劑右美沙芬氫溴酸鹽usp,ep30.0020.000硫酸奎尼丁二水合物usp,ep10.0010.000交聯羧甲基纖維素鈉nf7.807.807.80微晶纖維素nf94.0094.0094.00膠體二氧化硅nf0.650.650.65乳糖一水合物nf116.90126.90156.90硬脂酸鎂nf0.650.650.65ep=歐洲藥典;usp=美國藥典;nf=國家藥品集參與者與護理者被告知要在第8天、第22天、第36天、第43天、第57天及第70天(第2至7次訪問)將任何未服用的研究用藥及空瓶帶到診所。就本研究而言,遵囑性定義為參與者服用至少80%的給定劑量。向護理者提供日志卡,及告知護理者每天記錄所服用的膠囊數量及服藥時間。在第8天、第22天、第36天、第43天、第57天及第70天(第2至7次訪問)或在提早終止參與研究的時間點上收集日志卡。功效主要療效終點為在激越行為/攻擊行為npi領域的改善。次要療效終點包括與下列各項的基線相比的變化:npi總評分(范圍:1–144);各npi領域評分;及包含激越行為/攻擊行為、異常的動作行為及易怒性/不穩定性領域加上焦慮(npi4a)或去抑制化行為(npi4d)的npi綜合評分。就各被認定為陽性的npi領域取得npi-護理者的困擾評分(npi-cds;0–5,從毫無困擾至非常困擾)。在第5周與第10周對以下進行評估,其提供了用以衡量臨床意義的量度:阿爾茨海默癥合作研究-變化的臨床總體印象評分(adcs-cgic;1–7,從顯著改善至明顯惡化)及由護理者評比的對于變化的患者總體印象(pgi-c)評分(1至7分,從改善許多至惡化許多)。其他的次要終點包括adcs-日常生活的活動清單(adcs-adl;0至54分,評分越高表示功能越好);csdd(0至38分,評分越高表示抑郁癥越嚴重);護理者壓力指數(csi;0至13分,評分越高表示壓力水平越高);生活品質-阿爾茨海默癥(qol-ad;13至52分,評分越高表示生活品質越好);及精神科用藥的變化/應急性使用勞拉西泮。使用mmse(0至30分,評分越低表示認知缺損越大)與阿爾茨海默癥評估量表-認知子量表(adas-cog;0至70分,評分越高表示認知缺損越大)來評估認知能力。安全性結果包括不良事件(ae)、生命體征、臨床實驗室檢驗結果及ecg結果。就心率的變異進行qt間隔結果的校正,并采用qtcf(qt/3√[rr])計算。在研究期間的下列時間點評估上述的療效參數:在基線及第1、3、5、6、8及10周評估csi及所有的npi領域;在基線及第5與第10周評估adcs-cgic激越行為、qol-ad(護理者)及adas-cog;在篩選時及在第5與第10周評估csdd與mmse;及在第5與第10周評估pgi-c。基于所公開的連續平行比較設計(spcd)方法(fava等人,psychother.psychosom.2003;72(3):115-127;chen等人,contemp.clin.trials.,2011;32(4):592-604),分析主要與次要療效終點,其采用普通最小二乘法(ols),按1:1的權重,分析來自兩個5周的階段的數據,且在第一階段中包括所有參與者而在第二階段中僅包括經重新隨機分派的安慰劑組無反應者(圖2)。事前設定主要研究終點分析;并未進行校正來解決次要終點的多重性。采用α=0.05顯著性水平的雙側檢驗,比較右美沙芬/奎尼丁組與安慰劑組。此外,采用以治療作為固定效應及基線作為協變量的協方差分析(ancova),來分別比較在各階段與訪問的治療組的平均值。最后,為模擬一項為期10周的平行臂設計(如圖2中所示),在為期10周的整個試驗期間在經隨機分派僅接受右美沙芬/奎尼丁(n=93)或僅接受安慰劑(n=66)的參與者(不論反應者的狀態)之間,就npi激越行為/攻擊行為評分進行事前設定的比較。使用第9.1版或更高版本(sasinstitute,cary,nc,usa)進行所有統計分析。鑒于采用spcd方法,及為了對于來自主要分析的發現提供保證,進行了主要終點的更多的探察性靈敏度分析。其中之一采用doros等人(doros等人,stat.med.2013;32(16):2767-2789)所述的重復測量模型(mmrm,預先設定的),以測試遺漏數據及排除在第二階段中經重新隨機分派的安慰劑組“有反應者”的潛在影響。該模型使用npi激越行為/攻擊行為領域中所有可取得的數據。采用三個獨立的模型,以估計治療效應,且包括在基線、在第一階段結束時及在第二階段結束時所收集的數據,其中通用模型容許納入中間訪問的數據。根據fda的建議,在研究揭盲之后,所進行的主要終點的第二靈敏度分析,其在spcd中使用似不相關回歸(sur)方法(doros等人,stat.med.2013;32(16):2767-2789;zellner等人,j.am.stat.assoc.1962;57(298):348-368;tamura和huang,clin.trials.2007;4(4):309-317),而非ols方法,以厘清遺漏數據的遺失是否可為非隨機性。除了上述之外,進行主要終點的預先設定的探察性分析,其采用主要分析所用的上述相同的spcd方法,但同時包括在第二階段中經重新隨機分派的安慰劑組有反應者與無反應者。在已發表的癡呆相關激越行為的治療研究中,npi激越行為/攻擊行為評分變化的標準差(sd)的估算值為3.1至5.2分(herrmann等人,cnsdrugs.2011;25(5):425-433;mintzer等人,am.j.geriatr.psychiatry.2007;15(11):918-931;herrmann等人,dement.geriatr.cogn.disord.2007;23(2):116-119)。假設標準差為5.0分,且基于顯著性水平為5%的來自獨立樣品平均值的一項雙側、二樣品的比較,計算196名參與者的樣本量以在檢測出2.5分的平均差異上提供90%檢驗力(power)。樣本量的計算基于平行設計,因為在治療阿爾茨海默癥患者的激越行為方面并無spcd試驗的先例。安全性分析組包括曾服用至少一個劑量的研究用藥所有參與者。針對療效的調整意向治療(mitt)分析組,包括在第一階段中具有基線后npi激越行為/攻擊行為評估的所有參與者。使用最后一次觀察來推算遺漏數據。在安全性分析組中納入了所有220名隨機參與者(126名女性及94名男性);在針對療效的mitt分析組包括了218名參與者,且194名(88.2%)完成了本研究(圖3)。在進入第二階段時,通過spcd及安慰劑組的重新隨機分派,總共有152名參與者接受右美沙芬/奎尼丁(93名從第一階段開始而另外的49名在第二階段中從安慰劑組重新隨機分派),且127名參與者接受安慰劑,使得右美沙芬/奎尼丁的暴露(1153名患者-周)約比安慰劑的暴露(911名患者-周)高約26.7%。接受右美沙芬/奎尼丁的參與者中有17名(11.2%)中途停止參與,而接受安慰劑的參與者中有9名(7.1%)中途停止參與,其中分別有8名(5.3%)與4名(3.1%)是由于不良事件(ae)。各治療組在參與者特征上取得良好的平衡,且示于表3與表4(mitt療效組)。在第二階段的重新隨機分派的組之間亦有良好的平衡。mittspcd經重新隨機分派的安慰劑組的特征示于表5。表3:各治療組的參與者特征。a隨機分派的安全性分析組;b用于療效分析的調整意向治療分析群組(安慰劑,n=125;右美沙芬/奎尼丁,n=93)。表4:基于第一階段隨機分派的調整意向治療(mitt)療效群體。“大量”代謝者包括“正常”代謝者與“正常或中等”代謝者。表5:調整意向治療(mitt)連續平行比較設計(spcd)的第二階段經重新隨機分派的安慰劑無反應者。“大量”代謝者包括“正常”代謝者與“正常或中等”代謝者。在mitt群體中的主要spcd分析中,相較于安慰劑,右美沙芬/奎尼丁顯著改善npi激越行為/攻擊行為評分(olsz-統計:-3.95;p<0.001)。各階段的結果亦顯示右美沙芬/奎尼丁優于安慰劑(表6)。在第一階段中,接受右美沙芬/奎尼丁者的npi激越行為/攻擊行為評分平均值(95%ci)從7.1(6.6,7.6)降至3.8(3.1,4.5),而接受安慰劑者從7.0(6.6,7.4)降至5.3(4.7,5.9)(p<0.001),最小二乘法(ls)的平均值(95%ci)治療差異為-1.5(-2.3,-0.7)。在第1周即注意到差別反應(-0.8[-1.5,-0.03];p=.04;圖4)。在第二階段(安慰劑無反應者經重新隨機分派接受右美沙芬/奎尼丁或安慰劑),接受右美沙芬/奎尼丁者的平均(95%ci)npi激越行為/攻擊行為評分從5.8(4.9,6.7)降至3.8(2.9,4.7),而接受安慰劑者從6.7(5.9,7.5)降至5.8(4.7,6.9)(p=0.02),ls平均(95%ci)治療差異為-1.6[-2.9,-0.3];圖5)。npi激越行為/攻擊行為領域的改善在第1周及在研究結束前的每個時間點上具有統計顯著性,除了第6周(在第二階段期間)之外。在為期10周的整個試驗期間,在經隨機分派僅接受右美沙芬/奎尼丁(n=93)或僅接受安慰劑(n=66)的參與者(不論其是否為有反應者狀態,模擬如圖2中所示的平行臂設計)之間,進行npi激越行為/攻擊行為評分的預先設定的比較,亦顯示右美沙芬/奎尼丁優于安慰劑(ls平均治療差異[95%ci]為-1.8[-2.8,-0.7];表6、圖6)。相較于安慰劑,對于右美沙芬/奎尼丁的響應似乎并未因疾病階段而有所不同。按基線mmse評分(>15vs≤15)與基線cgis(4或5vs.6或7)的分層隨機分派,在激越行為與認知功能方面產生了平衡的治療組。進行了用于評估這些因素的潛在影響的補充分析,而這些補充分析并未顯示在反應上有差異,雖然在這些分析中有些分層的數量小,且這項觀察將需要在較大型試驗中加以確認。表6:*治療差異:右美沙芬/奎尼丁-安慰劑;a第一階段:包括所有參與者并測量各結果從第一階段基線至第5周的變化;b第二階段:僅包括來自第一階段的經重新隨機分派的安慰劑無反應者,并測量所有結果從第二階段基線(第5周)至第10周的變化,除了pgi-c(原始的第一階段基線至第10周);c十周分析僅包括在整個參與研究期間皆維持其原有治療的參與者(即僅服用右美沙芬/奎尼丁或僅服用安慰劑,以模擬平行比較設計),并測量第一階段基線至第10周;d在基線、第1、3、5、6、8及10周進行評估;e在基線、第5與第10周進行評估;f在篩選時、第5與第10周進行評估;g在第5與第10周進行評估。hspcd(連續平行比較設計)分析是針對主要療效分析所指定的程序,且基于研究的各階段的npi激越行為/攻擊行為領域的50/50權重,將第一階段中所有患者及第二階段中經重新隨機分派的“安慰劑無反應者”的結果合并;i對于qol-ad(護理者)而言,由護理者評量患者的生活品質;各階段的p值基于協方差分析(ancova)分析;spcd分析的p值系基于普通最小二乘法(ols)。預先設定的次要結果的spcd分析(表6)顯示,右美沙芬/奎尼丁在總評量分數(pgi-c與cgic)、npi總評分、npi異常動作行為及易怒性/不穩定性領域、npi4a與4d總分、npi護理者的困擾(同時包括激越行為/攻擊行為領域及總體)、csi及csdd方面的改善明顯更好。相對于安慰劑而言,qol-ad、adcs-adl、mmse及adas-cog(探察性結果)的變化結果并不顯著。事后分析顯示,相較于未服用這些藥劑的參與者而言,右美沙芬/奎尼丁在伴隨服用乙酰膽堿酯酶抑制劑、美金剛、抗抑郁劑或抗精神病藥物的參與者中,產生類似的npi激越行為/攻擊行為評分的改善。在接受右美沙芬/奎尼丁及接受安慰劑的參與者中,分別在152名中有10名(6.6%)及在125名中有13名(10.4%)使用了勞拉西泮作為應急用藥。在為期10周的治療結束時,就adcs-cgic而言,僅用右美沙芬/奎尼丁治療的參與者(n=82)中有45.1%被判定為“有很大的改善”或“有極大的改善”,相比較,僅服用安慰劑的參與者(n=59)中有27.1%被如此判定。安全性與耐受性接受多種伴隨用藥的群體對于右美沙芬/奎尼丁的耐受性普遍良好,并未伴有認知功能損害。基于不良事件發生時所指派的治療,來歸屬治療后出現的不良事件(teae)。在用右美沙芬/奎尼丁或用安慰劑治療期間,參與者(安全性組)中,分別在152名中有93名(61.2%)及在127名中有55名(43.3%)報告發生teae。就右美沙芬/奎尼丁相對于安慰劑而言,最常發生的teae(>3%)分別為跌倒(8.6%vs3.9%)、腹瀉(5.9%vs3.1%)、尿道感染(5.3%vs3.9%)、頭暈(4.6%vs2.4%)及激越行為(3.3%vs4.7%)。12名(7.9%)接受右美沙芬/奎尼丁的參與者及6名(4.7%)接受安慰劑的參與者出現嚴重不良事件(sae)。接受右美沙芬/奎尼丁的參與者所出現的sae包括胸痛(n=2)、貧血、急性心肌梗塞(在給藥結束后2天發生)、心搏過緩、腎臟感染、股骨骨折、脫水、結腸癌、腦血管意外、攻擊行為及血尿(每種的n=1)。接受安慰劑的參與者所出現的sae包括特發性血小板減少性紫瘢、眩暈、肺炎、胃腸炎、挫傷、暫時性腦缺血及激越行為(每種的n=1)。接受右美沙芬/奎尼丁的參與者中有8名(5.3%)及接受安慰劑的參與者中有4名(3.1%)因為不良事件而停止治療,其中分別有4名(2.6%)與2名(1.6%)是因為sae。研究期間并無死亡事件發生。在接受右美沙芬/奎尼丁期間跌倒的13名參與者當中,9名已有既往的跌倒記錄。在兩種情況中,3名參與者在研究結束后2至4天跌倒,及1名參與者在接受勞拉西泮應急用藥后24小時內跌倒二次;在接受安慰劑期間跌倒的參與者并無既往的跌倒記錄。有二次的跌倒伴有嚴重不良事件(sae):接受右美沙芬/奎尼丁的參與者發生股骨骨折,而接受安慰劑的參與者發生挫傷。在ecg參數上并未在組別間觀察到具有臨床意義的差異。在最后一次訪問時,接受右美沙芬/奎尼丁的參與者(n=138)及接受安慰劑的參與者(n=60)的qtcf平均值(sd)分別為5.3(14.06)毫秒及-0.3(12.96)毫秒。接受avp923的參與者中有15名(10.3%)及接受安慰劑的參與者中有8名(6.7%)在任一次訪問時的qtcf變化≥30毫秒;一名接受安慰劑的參與者的qtcf變化>60毫秒。并無參與者的qtcf>500毫秒。表6及圖4、圖5與圖6中所呈現的數據清楚表示,相較于安慰劑,右美沙芬與奎尼丁的組合在治療可能患有阿爾茨海默癥的患者的激越行為與攻擊行為上顯著有效。此外,年長群體對于該組合的耐受性普遍良好,并未伴有認知功能損害、鎮靜作用或臨床上顯著的qtc延長作用。實施例2:研究用avp-786治療阿爾茨海默癥中激越行為的原理avp-786為氘化(d6)-右美沙芬氫溴酸鹽(d6-dm)和硫酸奎尼丁(q)的組合產物,氘化(d6)-右美沙芬氫溴酸鹽為中樞神經系統(cns)-活性成分,而硫酸奎尼丁經由細胞色素p450(cyp)肝同工酶2d6(cyp2d6)被用作d6-dm代謝的抑制劑。avp-786可提供對于治療阿爾茨海默癥受試者(ad)的激越行為的臨床效益。d6-dm與負責調節谷氨酸、單胺、sigma-1及煙堿型膽堿能通路的受體結合,這可能是中樞神經系統治療的關鍵。本發明人用d6-dm所進行的藥理學研究已經證實,氘化作用并未改變dm的基礎藥理。同時,藥代動力學(pk)與藥物代謝研究顯示,d6-dm的代謝是經由與dm相同的代謝途徑,但氘化作用導致通過cyp2d6的代謝速率降低。本發明人最近所進行的ii期研究達到了主要療效終點,且相較于接受安慰劑的患者,接受avp-923的患者顯示在激越行為上的明顯改善。本研究為一項為期10周的隨機、雙盲、安慰劑對照的二階段連續平行比較設計(spcd)的研究,其用于評估avp-923在220名阿爾茨海默癥患者中治療激越行為的療效、安全性及耐受性。由神經精神癥狀問卷(npi)的激越行為/攻擊行為領域的測量可見,相較于接受安慰劑的患者,接受avp-923的患者的激越行為顯著減少(p<0.001)。所研究的次要終點中的大部分(如npi-總分、npi-激越行為/攻擊行為領域護理者的困擾、對于變化的臨床總體印象[cgic]-激越行為、對于嚴重性的臨床總體印象[cgis]-激越行為及對于變化的患者總體印象[pgic])也是統計上顯著的。臨床醫師及患者/護理者對于變化的印象,均證實所觀察到的激越行為改善的臨床意義。如簡易精神狀態檢查(mmse)與阿爾茨海默癥評估量表-認知子量表(adas-cog)所測得,在認知方面觀察到數值上的有利反應,但均未達到統計顯著性。本發明人所進行的進一步研究已顯示,右美沙芬(dm)的d6-氘修飾作用降低了cyp2d6代謝作用的速率,使得與顯著較低劑量的奎尼丁(低于avp-923中所含奎尼丁的量的50%)的組合足以分別在avp-786與avp-923中達到d6-dm與dm的生物等效性。avp-786中的較低量的奎尼丁可減少與其他cyp2d6底物的相互作用,即使在cyp3a4抑制劑存在下亦限制奎尼丁的水平,且減少對于心臟復極與qtc間隔的影響。實施例3:用于評估avp-786(氘化[d6]-右美沙芬氫溴酸鹽[d6-dm]/硫酸奎尼丁[q])在治療阿爾茨海默型癡呆患者的激越行為上的療效、安全性及耐受性的3期、多中心、隨機、雙盲、安慰劑對照的研究本研究被設計用于評估avp-786在治療阿爾茨海默型癡呆患者的激越行為上的療效、安全性及耐受性。avp-786治療持續期的原理為期12周的治療期間被認為是評估療效的最佳治療持續期,且基于用avp-923所進行的研究12-avr-131的數據的審查(papakostasgi等人,amjpsychiatry.2012;169(12):1267-1274;marshallr,leigh-pembertonr,memisoglua,等人,opioidmodulation:anovelmechanismforthetreatmentofdepression:resultsofthealks5461phase2study.2004;2:5461)。在為期12周的整個研究期間,患者被指派接受相同的治療,同時容許在一段更長的時間評估治療反應。研究人群患者數目:將約有380名患者在美國約60個中心加入研究。病癥/疾病:出現阿爾茨海默型癡呆所繼發的激越行為的患者。可能患有阿爾茨海默癥的診斷將根據美國國家老年研究所(nia)-阿爾茨海默癥協會(aa)工作小組所發布的“2011diagnosticguidelinesforalzheimer’sdisease”(mckhanngm等人,alzheimersdement.2011;7(3):263-269)。激越行為的診斷將根據國際老年精神病學學會(ipa)的激越行為定義工作小組所制訂的有關認知障礙患者中激越行為的暫定共識定義(cummingsj等人,intpsychogeriatr.2014:1-11)。關鍵入選標準:在篩選時具有臨床上顯著的中度/重度激越行為且該行為在隨機分派前持續至少2周的患者,該激越行為干擾日常生活,且根據研究者的意見指示適用處方用藥。在篩選時及在基線的病情嚴重程度的臨床總體印象量表(cgis)的激越行為評分≥4(病情中等嚴重)方能參與研究。合格的患者必需有一名可靠的護理者,這名護理者能夠且樂意遵守研究程序,包括在研究期間不給予任何禁用的藥物。關鍵剔除標準:所患有的主要是非阿爾茨海默型癡呆(如血管型癡呆、額顳葉型癡呆、帕金森病、精神活性物質-誘導的癡呆)的患者,和所具有的激越行為并非阿爾茨海默癥繼發型(例如繼發于疼痛、其它精神性疾病或譫妄癥)的患者,將不符合參與資格。研究設計結構:這是一項iii期、多中心、隨機、雙盲、安慰劑對照的研究。持續期間:患者將參加這項研究達約16周;其中包括4周的篩選期及12周的治療期。研究治療:研究產品為avp-786(氘化[d6]-右美沙芬氫溴酸鹽[d6-dm]/硫酸奎尼丁[q])。將評估avp-786的二種劑量:d6-dm28mg/q4.9mg和d6-dm18mg/q4.9mg,此后分別稱作avp-786-28/4.9與avp-786-18/4.9。avp-786的組成:研究產品與安慰劑的二種劑量的定性與定量組成均列于以下表7。表7:ep–歐洲藥典;usp–美國藥典;nf–國家處方集對照:將使用外觀與研究用藥相同的安慰劑膠囊作為對照。隨機分派/分層:在研究中隨機分派合格的患者接受avp-786-28/4.9膠囊、avp-786-18/4.9膠囊或匹配的安慰劑膠囊。隨機分派將按神經精神癥狀問卷(npi)的激越行為/攻擊行為領域評分(≤6vs.>6)、跌倒風險的評估(正常/輕度vs.中度/重度)及伴隨使用抗精神病藥物(是vs.否)進行分層。給藥方案:在基線訪問時,隨機指派合格的患者接受avp-786或匹配的安慰劑膠囊。在研究的前7天,被隨機分派接受avp-786-28/4.9的患者將開始在每天早晨接受avp-786-18/4.9一次及在晚上接受安慰劑。從第8天起,患者將每天接受avp-786-18/4.9兩次,為期14天。從第22天起,在研究所剩下的9周期間,患者將每天接受avp-786-28/4.9兩次。在研究的前7天,被隨機分派接受avp-786-18/4.9的患者將開始在每天早晨接受avp-786-18/4.9一次及在晚上接受安慰劑。從第8天起,在研究所剩下的11周期間,患者將每天接受avp-786-18/4.9兩次。患者將有至少50%的機會在研究期間的某個時點接受avp-786。研究藥物將在整個研究中每天口服給藥兩次(bid,早上1個膠囊和晚上1個膠囊,相隔約12小時)。評價和訪問患者將在篩選、基線(第1天)和第8天(第1周)、第22天(第3周)、第43天(第6周)、第64天(第9周)和第85天(第12周)參加臨床訪問。將在第29天(第4周)和第71天(第10周)進行安全性電話隨訪。研究程序將在每次訪問時進行,如評價和訪問時間表(表8)所述。在整個研究中,盡可能由同一評估者進行評估。表8:評價和訪問時間表adas-cog-阿爾茨海默癥評估量表-認知子量表;adcs-cgic–對于變化的臨床總體印象;ae-不良事件;cgis-疾病嚴重程度的臨床總體印象;csdd-康奈爾癡呆抑郁癥量表;demqol-癡呆生活質量量表;ecg–心電圖;eq-5d-5l-euroqol5維5級;et-提前終止;gmhr–通用醫療健康評級;mmse–簡易精神狀態檢查;npi-神經精神病問卷;pgic-由護理者評定的變化的患者總體印象;pk-藥代動力學;rud-癡呆的資源利用;s-sts-sheehan自殺跟蹤量表;tug–計時起立行走;zbi–zarit負荷訪談1研究訪問有+/-3天的窗口,基線、訪問2和電話除外。基線、訪問2和電話有+3天的窗口。2應向患者/護理者打電話,以收集不良事件并查詢并用藥物的情況。3在研究完成前退出的患者提前終止訪問。4從研究早期終止或不進行延伸研究(研究15-avp-786-303)的患者將在最后一次給藥研究藥物后的30天接受安全性電話隨訪。5對于每個患者,將完成一個方案適格性表格。6體重應該僅在基線訪問時測量。7只應進行tug測試以進行訪問4和6的跌倒風險評估。8ecg在給藥前和給藥后進行。9只有npi的激越行為/攻擊行為領域應在篩選訪問時進行。其應在cgis之前進行。10代理人版本由護理者評定。非代理人版本僅由基線時mmse評分≥10的患者評定。11adas-cog只能由基線時mmse評分≥10的患者評定。12pgic由護理者評定。13應該從患者帶來的吸塑卡中給藥研究藥物。在檢查合格之后,應將吸塑卡和日志卡退回給患者/護理者。14篩查訪問時應進行甲狀腺功能試驗(tsh,和反射t3和t4,如果tsh異常的話)。15只對有生育能力的女性進行尿妊娠試驗。響應測量療效的主要量度:將采用神經精神癥狀問卷(npi)的激越行為/攻擊行為領域進行主要療效的評估。療效的次要量度:次要療效量度包括對于變化的臨床總體印象(cgic)-激越行為、npi-激越行為/攻擊行為領域的護理者的困擾評分、npi-異常的動作行為領域、zarit負荷訪談(zbi)、npi-易怒性/不穩定性領域、對于變化的患者總體印象(pgic,由護理者所評量)、癡呆生活品質(demqol)、康奈爾(cornell)癡呆抑郁量表(csdd)、癡呆的資源應用(rud)、總npi評分、cgis激越行為、阿爾茨海默癥評估量表-認知子量表(adas-cog)、一般醫療健康評級(gmhr)及euroqol5維5級(eq-5d-5l)。藥代動力學:將測量d6-dm、其代謝產物和q的血漿濃度。安全性與耐受性:通過所報告的不良事件(ae)、身體與神經系統檢查、生命體征、臨床實驗室評估、靜息12導聯心電圖(ecg)、sheehan自殺傾向追蹤量表(s-sts)、簡易精神狀態檢查(mmse)及計時起身行走(tug)測試,評估avp-786的安全性與耐受性。將針對具有生育能力的女性進行妊娠試驗。通用統計方法與分析類型療效分析:本研究的主要療效終點為從基線至第12周(第85天)的npi激越行為/攻擊行為領域評分的變化。通過在觀察的數據上采用一種以可能性為基礎的線性混合效應模型重復測量(mmrm),而估算治療效果。對于兩個主要的比較:avp-786-28/4.9vs.安慰劑和avp-786-18/4.9vs.安慰劑,將使用門控-保持程序來控制在雙側α=0.05處的總體i型誤差。次要功效終點包括以下功效測量的從基線到第12周(第85天)的變化:cgic激越行為、npi-激越行為/攻擊行為領域護理者的困擾評分、npi-異常運動行為領域、zbi、npi-易怒性/不穩定性領域、pgic、demqol、csdd、rud、總npi、cgis激越行為、adas-cog、gmhr和eq-5d-5l。安全性分析:將通過治療組總結安全性量度。樣品大小計算:假設avp-786-28/4.9(高劑量)相對于安慰劑的主要功效終點的雙變量正態分布,進行檢驗力計算。基于所完成的ii期研究的結果,假定治療差異為-2.1,標準偏差為4.7(效應大小為-0.45)。總累積退出率為20%。在avp-786-28/4.9相對于安慰劑的比較中,所計劃納入的380名患者產生約93%的檢驗力來拒絕無效假設,其中在雙側α=0.05水平具有類型一的錯誤率。為將總體i型誤差率控制在0.05的水平,關于低劑量avp-786-18/4.9的無效假設將僅在高劑量的無效假設被拒絕時被測試。實施例4:iii期、多中心、隨機、雙盲、安慰劑對照的研究,以評估avp-786(氘化[d6]-右美沙芬氫溴酸鹽[d6-dm]/硫酸奎尼丁[q])在治療患有阿爾茨海默型癡呆的患者的激越行為方面的療效、安全性和耐受性研究的目的是評估用于治療阿爾茨海默型癡呆患者的激越行為的avp-786相較于安慰劑的療效、安全性及耐受性。被開發用于治療慢性病癥的藥物需顯示持續的效應。專家與主管機關一般認為12周的治療持續期是用于評估供長期使用的化合物的急性與慢性效應及安全性的合理時間范圍。為確保耐受性,分配至研究治療(avp-786)的患者將被逐步暴露于更高劑量;從每天給藥低劑量(avp-786-18/4.9)一次持續一周開始,接著每天給藥低劑量二次,為期二周,然后在所剩下的9周研究期間每天給藥高劑量(avp-786-28/4.9)二次。此外,對于在高劑量出現耐受性問題的患者,將容許一次性地向下調定至低劑量。研究人群患者數目:將約有325名患者在美國約50個中心加入研究。病癥/疾病:出現阿爾茨海默型癡呆所繼發的激越行為的患者。可能患有阿爾茨海默癥的診斷將根據美國國家老年研究所(nia)-阿爾茨海默癥協會(aa)工作小組所發布的“2011diagnosticguidelinesforalzheimer’sdisease”(mckhanngm等人,alzheimersdement.2011;7(3):263-269)。激越行為的診斷將根據國際老年精神病學學會(ipa)的激越行為定義工作小組所制訂的患有認知障礙患者中激越行為的暫定共識定義(cummingsj等人,mintzerj,brodatyh等人agitationincognitivedisorders:internationalpsychogeriatricassociationprovisionalconsensusclinicalandresearchdefinition.intpsychogeriatr.2014:1-11)。關鍵入選標準:在篩選時具有臨床上顯著的中度/重度激越行為且該行為在隨機分派前持續至少2周的患者,該激越行為干擾日常生活,且根據研究者的意見指示適用處方用藥。在篩選時及在基線的病情嚴重程度的臨床總體印象量表(cgis)的激越行為評分≥4(病情中等嚴重)方能參與研究。合格的患者必需有一名可靠的護理者,這名護理者能夠且樂意遵守研究程序,包括在研究期間不給予任何禁用的藥物。關鍵剔除標準:所患有的主要是非阿爾茨海默型癡呆(如血管型癡呆、額顳葉型癡呆、帕金森病、精神活性物質-誘導的癡呆)的患者,和所具有的激越行為并非阿爾茨海默癥繼發型(例如繼發于疼痛、其它精神性疾病或譫妄癥)的患者,將不符合參與資格。研究設計結構:這是一項iii期、多中心、隨機、雙盲、安慰劑對照研究。持續期間:患者將參加這項研究達約16周;其中包括4周的篩選期及12周的治療期。研究治療:研究產品為avp-786(氘化[d6]-右美沙芬氫溴酸鹽[d6-dm]/硫酸奎尼丁[q])。將通過滴定(titration)評估avp-786的二種劑量:d6-dm28mg/q4.9mg和d6-dm18mg/q4.9mg,此后分別將其稱作avp-786-28/4.9與avp-786-18/4.9。avp-786的組成:研究產品與安慰劑的二種劑量的定性與定量組成列于以下表9。表9:ep–歐洲藥典;usp–美國藥典;nf–國家處方集對照:將使用外觀與研究用藥相同的安慰劑膠囊作為對照。隨機分派/分層:在研究中隨機分派合格的患者接受avp-786膠囊或匹配的安慰劑膠囊。隨機分派將按神經精神癥狀問卷(npi)的激越行為/攻擊行為領域評分(≤6vs.>6)、跌倒風險的評估(正常/輕度vs.中度/重度)及伴隨使用抗精神病藥物(是vs.否)進行分層。給藥方案:在基線訪問時,隨機指派合格的患者接受avp-786或匹配的安慰劑膠囊。研究藥物將在整個研究中每天口服給藥兩次(bid,早上1個膠囊和晚上1個膠囊,相隔約12小時)。在研究的前7天,被隨機分派接受avp-786的患者將在開始時每天早晨接受avp-786-18/4.9一次及在晚上接受安慰劑。從第8天起,患者將每天接受avp-786-18/4.9兩次,為期14天。從第22天起,在研究所剩下的9周期間,患者將每天接受avp-786-28/4.9兩次。如果研究者認為有必要,將在第3次訪問后直至第5次訪問及包括第5次訪問在內(亦即第23天至第64天),允許將劑量一次性向下調整至avp-786-18/4.9,且患者在剩下的研究時間將被維持在較低的研究藥物劑量。需要劑量調整的患者需要進行不定期的訪問以進行安全性評估。在研究期間的某個時間點,患者將有至少50%的機會接受avp-786。評價和訪問患者將在篩選、基線(第1天)和第8天(第1周)、第22天(第3周)、第43天(第6周)、第64天(第9周)和第85天(第12周)進行臨床訪問。將在第29天(第4周)和第71天(第10周)進行安全性電話隨訪。研究程序將在每次訪問時進行,如評價和訪問時間表(表10)所述。表10:評價和訪問時間表adas-cog-阿爾茨海默癥評估量表-認知子量表;adcs-cgic-對于變化的臨床總體印象;ae-不良事件;cgis-疾病嚴重程度的臨床總體印象;csdd-康奈爾癡呆抑郁癥量表;demqol-癡呆生活質量量表;ecg–心電圖;eq-5d-5l-euroqol5維5級;et-提前終止;gmhr–通用醫療健康評級;mmse–簡易精神狀態檢查;npi-神經精神病問卷;pgic-由護理者評定的變化的患者總體印象;pk-藥代動力學;rud-癡呆的資源利用;s-sts-sheehan自殺跟蹤量表;tug–計時起立行走;zbi–zarit負荷訪談1研究訪問有+/-3天的窗口,除了基線、訪問2和電話訪談除外。基線、訪問2和電話訪談有+3天的窗口。2應向患者/護理人員打電話,以收集不良事件并查詢并用藥物的情況。3在研究完成前退出的患者提前終止訪問。4從研究早期終止或不進行延伸研究(研究15-avp-786-303)的患者將在最后一次研究藥物給藥后30天接受安全性電話隨訪。5對于每個患者,將完成一個方案適格性表格。6體重應該僅在基線訪問時測量。7只應進行tug測試以進行訪問4和6的跌倒風險評估。8ecg在給藥前和給藥后進行。9只有npi的激越行為/攻擊行為領域應在篩選訪問時進行。其應在cgis之前進行。10代理人版本由護理者評定。非代理人版本僅由基線時mmse評分≥10的患者評定。11adas-cog只能由基線時mmse評分≥10的患者評定。12pgic由護理者評定。13應該從患者帶來的吸塑卡中給藥研究藥物。在檢查合格之后,應將吸塑卡和日志卡退回給患者/護理人員。14篩查訪問時應進行甲狀腺功能試驗(tsh,和反射t3和t4,如果tsh異常的話)。15只對有生育能力的女性進行尿妊娠試驗。16在第3次訪問(第3周)后直至第5次訪問(第9周)及包括第5次訪問(第9周)在內,即第23天至第64天,允許將劑量一次性向下調整。患者將需要回到診所進行一次未預先安排的訪問,以進行安全性評估。響應測量療效的主要量度:將采用神經精神癥狀問卷(npi)的激越行為/攻擊行為領域進行主要療效的評估。療效的次要量度:次要療效量度包括對于變化的臨床總體印象(cgic)-激越行為、npi-激越行為/攻擊行為領域的護理者的困擾評分、npi-異常的動作行為領域、zarit負荷訪談(zbi)、npi-易怒性/不穩定性領域、對于變化的患者總體印象(pgic,由護理者所評量)、癡呆生活品質(demqol)、康奈爾(cornell)癡呆抑郁量表(csdd)、癡呆的資源應用(rud)、總npi評分、cgis激越行為、阿爾茨海默癥評估量表-認知子量表(adas-cog)、一般醫療健康評級(gmhr)及euroqol5維5級(eq-5d-5l)。藥代動力學:將測量d6-dm、其代謝產物和q的血漿濃度。安全性與耐受性:通過所報告的不良事件(ae)、身體與神經系統檢查、生命體征、臨床實驗室評估、靜息12導聯心電圖(ecg)、sheehan自殺傾向追蹤量表(s-sts)、簡易精神狀態檢查(mmse)及計時起身行走(tug)測試,評估avp-786的安全性與耐受性。將針對具有生育能力的女性進行妊娠試驗。通用統計方法與分析類型分析群體:將使用三種分析群體;調整意向治療(mitt)、意向治療(itt)及安全性。mitt群體包括在研究中經隨機分派的所有患者(且有至少一次基線后療效評估),且其將用于所有的療效分析。mitt群體中的患者將被包括在治療組中,在其中不論所接受的治療為何,而對其進行隨機分派。itt群體包括研究中的所有經隨機分派的患者,且將用于探察性療效分析。安全性群體包括接受研究治療的所有患者,且將用于所有的安全性分析。患者將基于實際接受的治療而被包括在治療組中。療效分析:主要療效終點為從基線至第12周(第85天)的npi激越行為/攻擊行為領域評分的變化。通過采用線性混合效應模型重復測量(mmrm)而進行治療的比較。該模型將包括對于治療、訪問、治療與訪問的相互作用、基線與訪問的相互作用及基線協變量的固定效應,基線協變量包括基線數值及其他隨機分派分層因素。將采用非結構化協方差模型。次要療效終點包括下列療效量度從基線至第12周(第85天)的變化:cgic激越行為、npi-激越行為/攻擊行為領域的護理者困擾評分、npi-異常的動作行為領域、zbi、npi-易怒性/不穩定性領域、pgic、demqol、csdd、rud、總npi、cgis激越行為、adas-cog、gmhr及eq-5d-5l。安全性分析:安全性分析將由生物參數與不良事件的數據匯總所組成。安全性分析將按治療進行列表。樣本量的計算:假設主要療效終點的二變量的常態分布,進行檢驗力的計算。在一項已完成的ii期研究中,針對主要療效量度所觀察到的治療效應量在第一階段中為-0.51,而在第二階段中為-0.34。就該項為期12周的單一階段研究而言,假設治療效應量(avp-786vs.安慰劑)為-0.40。考慮到研究期間的退出率為20%,所計劃的325名患者(~163/組)的總樣本量將具有90%的檢驗力,其中在雙側α=0.05具有一型誤差。實施例5:avp-786(氘化[d6]右美沙芬氫溴酸鹽[d6-dm]/硫酸奎尼丁[q])的用于治療阿爾茨海默型癡呆患者的激越行為的安全性與療效的iii期多中心、長期、延伸研究研究的目的是評估用于治療阿爾茨海默型癡呆患者的激越行為的avp-786的長期安全性與療效維持性。研究人群患者數目:將約有550名患者在美國約110個中心加入研究。病癥/疾病:出現阿爾茨海默型癡呆所繼發的激越行為的患者。可能患有阿爾茨海默癥的診斷將根據美國國家老年研究所(nia)-阿爾茨海默癥協會(aa)工作小組所發布的“2011diagnosticguidelinesforalzheimer’sdisease”(mckhanngm等人,alzheimersdement.2011;7(3):263-269)。激越行為的診斷將根據國際老年精神病學學會(ipa)的激越行為定義工作小組所制訂的有關認知障礙患者中激越行為的暫定共識定義(cummingsj等人,mintzerj,brodatyh等人agitationincognitivedisorders:internationalpsychogeriatricassociationprovisionalconsensusclinicalandresearchdefinition.intpsychogeriatr.2014:1-11)。關鍵入選標準:患者已成功完成研究15-avp-786-301、15-avp-786-302或12-avr-131。合格的患者必需有一名可靠的護理者,這名護理者能夠且樂意遵守所有要求的研究程序,包括在研究期間不給予任何禁用的藥物。關鍵剔除標準:在離開研究15-avp-786-301與15-avp-786-302后,或就來自研究12-avr-131的患者而言在基線前的30天內,患者正在參與或已經參與其他介入型(藥物或裝置)的臨床研究。患者同時存在臨床顯著或不穩定的全身性疾病,其可混淆研究的安全性結果的解釋。研究設計結構:這是15-avp-786-301與15-avp-786-302iii期研究的一項iii期的多中心、長期、延伸研究,其亦允許納入來自ii期研究12-avr-131的患者。來自研究15-avp-786-301與15-avp-786-302的患者將在先前研究的最后一次訪問(第6次訪問,第85天)的3天內加入本研究。雖然所有加入的患者都將接受avp-786,但對于患者、研究者、研究工作人員以及贊助商將屏蔽所指派的治療劑量。持續時間:患者將參與該研究約52周。研究治療:研究產品為avp-786(氘化[d6]-右美沙芬氫溴酸鹽[d6-dm]/硫酸奎尼丁[q])。兩個劑量的avp-786將通過滴定評估:d6-dm28mg/q4.9mg和d6-dm18mg/q4.9mg,以下分別稱為avp-786-28/4.9和avp-786-18/4.9。avp-786的組成:二種劑量的研究產品的定性與定量組成列于以下表11。表11:ep–歐洲藥典;usp–美國藥典;nf–國家藥品集1.avp-786-18/4.9劑量的吸塑卡將含有avp-786安慰劑膠囊,供第1至7天的晚間給藥。對照:無治療指派:按照在先前研究(15-avp-786-301與15-avp-786-302)中所接受的最后一次治療及研究者對于劑量調整的評估,將按屏蔽方式,指派合格的患者接受avp-786-28/4.9或avp-786-18/4.9膠囊。將經由互動式網絡回饋系統(iwrs)分配研究藥物。在先前研究中接受安慰劑的患者及來自研究12-avr-131的患者,將在本研究中被指派接受avp-786-18/4.9。先前接受avp-786-18/4.9的患者若不需要劑量調整,將被指派接受相同劑量;或者若研究者認為有必要增加劑量,則指派接受avp-786-28/4.9。先前接受avp-786-28/4.9的患者將由研究者酌情決定繼續接受avp-786-28/4.9,或被指派接受較低劑量avp-786-18/4.9。給藥方案:在研究期間,將以口服方式每天給藥研究藥物二次(bid,在早晨服用一個膠囊及在晚上服用一個膠囊,間隔約12小時)。對于在先前研究中接受安慰劑的患者及來自研究12-avr-131的患者而言,第1至7天的晚間劑量將為avp-786安慰劑膠囊,且從第22天(第3周)起每天接受avp-786-28/4.9兩次,除非需要調整劑量。由研究者酌情決定,可基于安全性理由,在研究期間的任何時間將研究藥物的劑量向下逐步調整(titrate)。評估與訪問在研究中安排了8次訪問。患者將在基線(第1天)及第15天(第2周)、第43天(第6周)、第85天(第12周)、第169天(第24周)、第253天(第36周)、第337天(第48周)及第365天(第52周)參加門診訪問。將在第29天(第4周)、第127天(第18周)、第211天(第30周)及第295天(第42周)用電話進行安全性隨訪。由研究者酌情決定,需要調整劑量的患者可進行未預先安排的訪問,以進行安全性評估。將如評估與訪問時間表中所列,在各次訪問時進行研究程序(表12)。表12:adas-cog-阿爾茨海默癥評估量表-認知子量表;adcs-cgic–對于變化的臨床總體印象;ae-不良事件;cgis-疾病嚴重程度的臨床總體印象;csdd-康奈爾癡呆抑郁癥量表;demqol-癡呆生活質量量表;ecg–心電圖;eq-5d-5l-euroqol5維5級;et-提前終止;gmhr–通用醫療健康評級;mmse–簡易精神狀態檢查;npi-神經精神病問卷;pgic-由護理者評定的變化的患者總體印象;pk-藥代動力學;rud-癡呆的資源利用;s-sts-sheehan自殺跟蹤量表;tug–計時起立行走;zbi–zarit負荷訪談1基線訪問應在患者離開研究15-avp-786-301或15-avp-786-302的三天內進行。2第2次(第15天)與第3次(第43天)研究訪問及第29天的電話訪談有+/-3天的窗口。其他所有的研究訪問及電話訪談有+/-7天的窗口。3對于在研究結束前退出的患者進行提前終止的訪問。4就提早終止研究的患者而言,將在提前終止后的五天用電話聯絡患者/患者的護理者,以查詢該名患者的整體狀況。此外,所有患者將在接受最后一次劑量的30天后,接受一次后續電話隨訪。5對于從研究15-avp-786-301與15-avp-786-302轉入(rollingover)的患者而言,可在離開這些研究的訪問時簽署知情同意書。6應僅針對來自研究12-avr-131的患者進行程序。7在第5次與第8次訪問時應僅進行用于評估跌倒風險的tug測試。8將針對各患者填寫方案適格性表格,其包括對納入/剔除標準的審查。9患者將經由iwrs而被指派接受avp-786d6dm28mg/q4.9mg或d6dm18mg/q4.9mg。10僅在基線訪問時測量體重。11ecg應在給藥后2至3小時進行。12就來自研究12-avr-131的患者而言,ecg應在給藥前及給藥后進行。13在第4次、第6次及第7次訪問時應僅進行npi的激越行為/攻擊行為領域。其應在cgis前進行。14代理人版本由護理者進行評量。非代理人版本僅由在基線時的mmse評分≥10的患者進行評量。15adas-cog由在基線時的mmse評分≥10的患者進行評量。16pgic由護理者進行評量。17僅對于從研究12-avr-131入選的患者,還應在基線訪問時進行甲狀腺功能檢查(tsh,和反射t3和t4,如果tsh異常的話)。18僅針對具有生育能力的女性進行尿妊娠試驗。19研究藥物應從患者所帶來的吸塑卡給藥。在審查遵囑性后,應將吸塑包裝盒與日志卡歸還患者/護理者。響應測量安全性與耐受性:通過所報告的不良事件(ae)、身體與神經系統檢查、生命體征、臨床實驗室評估、靜息12導聯心電圖(ecg)、sheehan自殺傾向追蹤量表(s-sts)、簡易精神狀態檢查(mmse)、阿爾茨海默癥評估量表-認知子量表(adas-cog)及計時起身行走(tug)測試,評估avp-786的安全性與耐受性。將針對具有生育能力的女性進行妊娠試驗。療效:使用神經精神癥狀問卷(npi)、對于變化的臨床總體印象(cgic)-激越行為、病情嚴重程度的臨床總體印象量表(cgis)-激越行為、zarit負荷訪談(zbi)、對于變化的患者總體印象(pgic-由護理者進行評量)、癡呆生活品質(demqol)、康奈爾(cornell)癡呆抑郁量表(csdd)、癡呆的資源應用(rud)、總體健康狀況評比(gmhr)、euroqol5維5級(eq-5d-5l)及工具性日常生活活動(iadl)來評估療效。通用統計方法與分析類型分析群體:包括接受研究治療的所有患者的安全性群體將用于所有功效和安全性數據匯總。將呈現三個治療組的安全性和功效:avp-786-28/4.9、avp-786-18/4.9,和所有組合的患者。不進行治療比較。安全性分析:將使用描述性統計和/或頻率表格來總結安全性與耐受性的量度,其包括所報告的不良事件、生命體征、臨床實驗室評估、靜息12聯心電圖、s-sts、mmse、adas-cog及tug。療效分析:對于按訪問所觀察到的療效數據將提供概括統計。當適用時,將呈現所觀察到的原始數值和與基線相比的變化。樣本量的計算:550名參與患者的樣本量將提供足以符合法規要求的充分的研究藥物暴露。實施例6:在健康個體中的avp-786(氘化[d6]右美沙芬氫溴酸鹽[dm]/硫酸奎尼丁[q])與帕羅西汀之間及avp-786與度洛西汀之間的i期、單中心、開放標記、連續藥物相互作用研究本研究的主要目的為在健康個體中測定avp-786(d6-右美沙芬/奎尼丁)對于帕羅西汀的穩態藥代動力學的影響;在健康個體中測定avp-786對于度洛西汀的穩態藥代動力學的影響;和在健康個體中測定帕羅西汀與度洛西汀對于avp-786的穩態藥代動力學的影響。本研究的次要目的是評估在健康個體中將avp-786與帕羅西汀及度洛西汀同時給藥的安全性與耐受性。帕羅西汀與度洛西汀為抗抑郁劑,其可令人信服地給藥于阿爾茨海默癥患者。完成了調查d6-dm的藥代動力學、安全性及耐受性的二項研究。12-avr-132為i期隨機、雙盲、單劑量及多劑量研究,其評估在健康個體中單獨給藥或與q組合給藥不同口服劑量的avp786后,單劑量與多劑量avp786在血漿中的藥代動力學。13-avr-134為i期、單中心、隨機、開放標記研究,其在健康志愿者中評估avp-786的藥代動力學、安全性及耐受性。方法本研究以單中心進行,且由開放標記、連續設計所組成,以測定avp-786對于帕羅西汀與度洛西汀的藥代動力學的影響,并測定帕羅西汀與度洛西汀對于avp-786的藥代動力學的影響。56名受試者分別加入四個治療組中的一組:組1:n=14●帕羅西汀20mg,每天一次,第1–20天;●avp-786-30/4.75(d6-dm30mg/q4.75mg),bid第13天直到第20天早上。組2:n=14●avp-786-30/4.75(d6-dm30mg/q4.75mg),bid第1天直到第20天早上;●帕羅西汀20mg,每天一次,第9–20天。組3:n=14●度洛西汀20mg,bid第1天直到第13天早上;●avp-786-30/4.75(d6-dm30mg/q4.75mg),bid第6天直到第13天早上。組4:n=14●avp-786-30/4.75(d6-dm30mg/q4.75mg),bid第1天直到第13天早上;●度洛西汀20mg,bid第9天直到第13天早上。在入選(第1天)前的14天內,受試者參加在診所的的篩選訪問。如果合格的話,受試者在第1天加入至四個組中的一組(不同組別的第1天設定在不同的日期,以確保單位在這些日期有床位可供使用)。受試者每天回到診所以接受門診患者給藥,直到第二天(早晨)的pk采樣(不同治療組的該天的日期不相同)。在第二天(早晨)pk采樣后,受試者在次日進行(完整的)pk采樣前,在該晚即向診所報到。受試者留在住院單位直到最后一天的pk采樣(不同治療組的住院時間不同,其基于研究藥物達到穩定狀態所需的時間長度)。收集供pk評估用的樣品直至研究藥物的最后一次給藥后的36小時。視情況,在所有樣品中分析:d6-dm、d3-右啡烷(d3-dx)、q、帕羅西汀及度洛西汀。在研究期間,在所有個體中進行安全性評估,且其包括所報告的不良事件(ae)、心電圖(ecg)、實驗室評估、身體檢查及生命體征。使用哥倫比亞自殺嚴重程度評定量表(c-ssrs),進行研究期間的自殺意念與行為的前瞻性評估。受試者在研究藥物的最后一次給藥7-10天后,回來參加后續安全性訪問。計劃(及分析)的受試者數目組1:計劃n=14;參與n=14(安全性群體);分析n=11(pk群體)。組2:計劃n=14;參與n=14(安全性群體);分析n=14(pk群體)。組3:計劃n=14;參與n=14(安全性群體);分析n=14(pk群體)。組4:計劃n=14;參與n=14(安全性群體);分析n=11(pk群體)。診斷與納入標準年齡18至50歲及身體質量指數(bmi)為18–300kg/m2的健康成年男性與女性個體,且其所表現出的cyp2d6基因型賦予其泛代謝者(extensivemetabolizers)的概況。研究治療測試產品:avp-786-30/4.75(d6-dm30mg/q4.75mg)膠囊。帕羅西汀20mg片劑。度洛西汀20mg膠囊。受試者按照在以上方法中提供的研究時間表接受研究藥物。用240毫升的室溫溫度的水,口服給藥各劑量(由一個膠囊/片劑所組成)。在早晨劑量之前,禁食過夜(即至少8小時,不包括水),在晚間劑量前則禁食至少2小時。所有的給藥皆在給藥后進行至少2小時的禁食(不包括水)。評價標準安全性:在研究期間,在所有個體中進行安全性評估,且包括所報告的不良事件(ae)、心電圖(ecg)、實驗室評估、身體檢查及生命體征。使用哥倫比亞自殺嚴重程度評定量表(c-ssrs),進行研究期間的自殺意念與行為的前瞻性評估,按照fda的指南“suicidalideationandbehavior:prospectiveassessmentofoccurrenceinclinicaltrials”,將其作為安全性評估的一部分。藥代動力學:在以下時間點收集血樣(單一給藥為6ml且組合給藥為12ml)以測定血漿d6-dm、d3-dx、q、帕羅西汀和度洛西汀:在給藥前及在單一藥物給藥的最后一天的早晨劑量后的0.5、1、2、3、4、6、8及12小時。僅對于第1組,因為每天給藥帕羅西汀一次,在單一給藥的最后一天的24小時后(在第一次組合給藥前),進行附加樣品的取樣。在給藥前及在組合給藥的最后一天的早晨劑量后0.5、1、2、3、4、6、8、12、24及36小時。在第4天的早晨劑量之前(只有第2組與第4組)和在單一藥物給藥的最后一天與組合給藥的最后一天之前的2天中的任一天。非分室方法用于測定藥代動力學參數,包括auc0-12,auc0-24,cmax,tmax,kel,t1/2,cmin和tmin。統計方法安全性:按治療總結安全性變量,其包括不良事件發生率、生命體征、ecg參數及臨床實驗室結果。針對各受試者列出對于c-ssrs問卷的回應。針對回應異常的任何問題,提出個別受試者的概況。藥代動力學:對于d6-dm、d3-dx、q及帕羅西汀或度洛西汀(當適用時)的血漿濃度,對各時間點的描述性統計按照治療進行列表。在線性與半對數標度上,按治療繪制平均血漿濃度-時間曲線。此外,衍生獲得非分室pk參數。組合治療(第1組vs第2組,avp-786與帕羅西汀;第3組vs第4組,avp-786與度洛西汀)之間的比較,以cmax與auc0-12(帕羅西汀為auc0.24)的幾何平均比值形式呈現,其具有90%信賴區間。使用對數轉換數據測定點估計值及置信界限,然后轉換回原標度。使用關于受試者與治療的變量分析,進行分析。結果藥代動力學:帕羅西汀和avp-786相互作用:不同分析物按治療組的隨時間的平均多重劑量血漿濃度被示于圖7與圖8中。按治療與分析物的平均值(cv%)(tmax的#中值(范圍))(表13):表13:通過對數轉換的anova比較組合給藥相對于單一治療給藥(表14):表14:度洛西汀和avp-786相互作用:多種分析物按治療組隨時間的平均多重劑量血漿濃度示于圖9和10。按治療和分析物的平均(cv%)(tmax的#中值(范圍))(表15):表15:通過對數轉換的anova比較組合給藥相對于單一治療給藥(表16):表16:安全性:并無死亡事件。有一名受試者(受試者r112,帕羅西汀/avp-786)經歷二件并發的嚴重不良事件(sae):在每天接受20mg的帕羅西汀一次(第1天至第16天)及每天接受avp-786-30/4.75兩次(第13天至第16天)后發生低鉀血癥與低氯血癥。二者均被認為中度嚴重。該名受試者在第15天出現與直立性低血壓相關的頭暈,及在第16天出現雙腿肌肉無力與麻刺感覺。在第17天獲得的用于協助評估臨床癥狀的血液檢驗與心電圖發現了低鉀血癥、代謝性堿中毒及qtc延長。癥狀在補充液體與電解質后完全消除。基于本申請人對于這些sae的細節的醫學審查及一名心臟專科醫師的獨立評估,該臨床情況與帕羅西汀或avp-786的已知藥物效應并不一致。有四名參與者因下列不良事件而退出:自殺意念(受試者r107,在8劑量的帕羅西汀之后),低鉀血癥與低氯血癥(受試者r112,見上述),尿道感染(受試者r411,在12劑量的avp-786之后),和嘔吐(受試者r412,在9劑量的avp-786之后)。帕羅西汀和avp-786相互作用:在第1組與第2組中,14名受試者中有7名(50%)在接受帕羅西汀后(在12天給藥期間)、14名受試者中有9名(64%)在接受avp-786后(在8天給藥期間)、12名受試者中有10名(83%)在接受帕羅西汀/avp-786組合后(在8天給藥期間)及14名受試者中有13名(93%)在接受avp-786/帕羅西汀組合后(在12天給藥期間),報告了治療后出現不良事件。大部分的不良事件(115件不良事件中的104件即90%)被認與研究治療相關(可能或很可能)。最常見的相關不良事件為頭暈與姿勢性頭暈、頭痛、腹瀉、惡心、夢魘及注意力受到干擾。只有對接受帕羅西汀與avp-786組合的受試者報告過夢魘與注意力受到干擾的不良事件。相較于接受帕羅西汀或avp-786的單一治療,當受試者接受組合療法時所報告的頭暈發生率較高。注意到只有接受帕羅西汀或接受帕羅西汀與avp-786組合的受試者報告了頭痛與惡心,只接受avp-786的受試者并未如此報告。大部分的不良事件的嚴重性歸類為輕度,并無不良事件被歸類為嚴重。被認為與研究治療相關的中等嚴重的不良事件為自殺意念、低鉀血癥與低氯血癥及抑郁癥。度洛西汀和avp-786相互作用:在第3組與第4組中,14名個體中有6名(43%)在接受度洛西汀后(在5天給藥期間)、14名個體中有7名(50%)在接受avp-786后(在8天給藥期間)、14名個體中有7名(50%)在接受度洛西汀/avp-786組合后(在8天給藥期間)及11名個體中有5名(45%)在接受avp-786/度洛西汀組合后(在5天給藥期間),報告了治療后出現不良事件。大部分的不良事件(50件不良事件中的40件即80%)被認與研究的治療相關(可能或很可能)。最常見的相關不良事件為疲勞與肌肉緊張。相較于接受度洛西汀或avp-786的單一治療,當個體接受avp-786與度洛西汀組合時常見不良事件的發生率并沒有變得更高。注意到只有第4組中單獨接受avp-786的個體報告疲勞,而第2組中接受avp-786的個體并未如此報告。大部分的不良事件的嚴重性被歸類為輕度,有一件不良事件被歸類為嚴重。嚴重強度的不良事件為嘔吐(1名受試者,avp-786),其被認為有可能與研究治療相關。被認為與研究治療相關的中等嚴重性的不良事件為嘔吐、冒冷汗、頭痛、頭暈及下腹部疼痛。各組按嚴重性的不良事件匯總顯示,在治療之間并無差異。各治療之間,在通過臨床實驗室檢驗、生命體征及ecg檢查所評估的安全性方面并無明顯差異。結論相較于單一治療的多重劑量,avp-786與帕羅西汀或avp-786與度洛西汀的多重劑量組合在安全性評估方面并無臨床顯著的差異。相較于單獨給藥帕羅西汀,當帕羅西汀與avp-786共同給藥時,帕羅西汀的穩態全身性暴露顯著增加(至約150%)。相較于單獨給藥avp-786,當avp-786與帕羅西汀共同給藥時,avp-786分析物的穩態全身性暴露有顯著變化,其中d6-dm的全身性暴露增加為約二倍,而d3-dx明顯降低(至約75%),表明當avp-786與帕羅西汀組合給藥時,d6-dm代謝為d3-dx的代謝速率下降。在q的全身性暴露方面存在中等增加(至約130%)。相較于單獨給藥度洛西汀,當度洛西汀與avp-786共同給藥時,度洛西汀的穩態全身性暴露顯著增加(至約180%)。相較于單獨給藥avp-786,當avp-786與度洛西汀共同給藥時,在avp-786分析物的穩態全身性暴露方面并無顯著變化。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1