通過抗hLIF抗體靶向K?RAS介導的信號轉導通路和惡性腫瘤的制作方法
本申請要求于2014年9月10日提交的美國臨時申請第62/048,770號的優先權,出于所有目的,將其全部內容通過引用并入本文。
發明背景
胰腺癌是通常具有不良預后(即使在其早期階段被檢測到)的癌癥。據估計,對于所有階段的胰腺癌組合,只有6%的患者在診斷后存活五年。已知胰腺癌的最常見形式胰腺導管腺癌(PDAC)具有極差的預后。盡管對于經受手術切除的患者而言,存活時間有所改善,但是在手術切除是可行的時間內通常未診斷出PDAC。
癌基因K-Ras在諸如胰腺癌、肺癌和結腸直腸癌的癌癥中通常是突變的,其中在超過90%的PDAC中存在激活的K-Ras突變。然而,迄今為止,還沒有成功研發出直接封阻K-Ras功能并在臨床前模型中顯示功效的小分子抑制劑。
發明簡述
在一個方面,提供治療對象中的癌癥的方法。在一些實施方案中,所述方法包括向所述對象施用治療量的拮抗白血病抑制因子(LIF)的物質。
在一些實施方案中,所述癌癥為表達K-Ras的癌癥。在一些實施方案中,表達K-Ras的癌癥為表達野生型K-Ras的癌癥。在一些實施方案中,表達K-Ras的癌癥為表達突變型K-Ras的癌癥。
在一些實施方案中,所述癌癥為胰腺癌、結腸直腸癌或肺癌。在一些實施方案中,所述癌癥為胰腺癌(例如,胰腺導管腺癌)。
在一些實施方案中,拮抗LIF的物質為抗LIF抗體。在一些實施方案中,抗LIF抗體為單克隆抗體。在一些實施方案中,抗LIF抗體為選自Fab、F(ab’)2和Fv的抗體片段。
在一些實施方案中,口服、靜脈內或腹腔內施用拮抗LIF的物質。
在一些實施方案中,將拮抗LIF的物質與化療劑組合施用。在一些實施方案中,化療劑為核苷類似物。在一些實施方案中,化療劑為吉西他濱。在一些實施方案中,將拮抗LIF的物質和化療劑同時施用。在一些實施方案中,施用拮抗LIF的物質,然后依次施用化療劑。
在另一方面,提供治療癌癥的組合物和試劑盒。在一些實施方案中,組合物或試劑盒包含:
拮抗白血病抑制因子(LIF)的物質;和
化療劑。
在一些實施方案中,所述癌癥為表達K-Ras的癌癥。在一些實施方案中,表達K-Ras的癌癥為表達野生型K-Ras的癌癥。在一些實施方案中,表達K-Ras的癌癥為表達突變型K-Ras的癌癥。在一些實施方案中,所述癌癥為胰腺癌、結腸直腸癌或肺癌。在一些實施方案中,所述癌癥為胰腺癌(例如,胰腺導管腺癌)。
在一些實施方案中,化療劑為核苷類似物。在一些實施方案中,化療劑為吉西他濱。
在另一方面,提供用于治療癌癥的包含拮抗LIF的物質的組合物。在一些實施方案中,所述癌癥為表達K-Ras的癌癥(例如,表達野生型K-Ras的癌癥或表達突變型K-Ras的癌癥)。在一些實施方案中,所述癌癥為胰腺癌、結腸直腸癌或肺癌。在一些實施方案中,將包含拮抗LIF的物質的組合物與化療劑組合使用。在一些實施方案中,包含拮抗LIF的物質的組合物還包含化療劑。在一些實施方案中,化療劑為吉西他濱。
而在另一方面,提供包含拮抗LIF的物質的組合物在制備用于治療癌癥的藥物中的用途。在一些實施方案中,所述癌癥為表達K-Ras的癌癥(例如,表達野生型K-Ras的癌癥或表達突變型K-Ras的癌癥)。在一些實施方案中,所述癌癥為胰腺癌、結腸直腸癌或肺癌。在一些實施方案中,包含拮抗LIF的物質的組合物還包含化療劑。在一些實施方案中,化療劑為吉西他濱。
附圖簡述
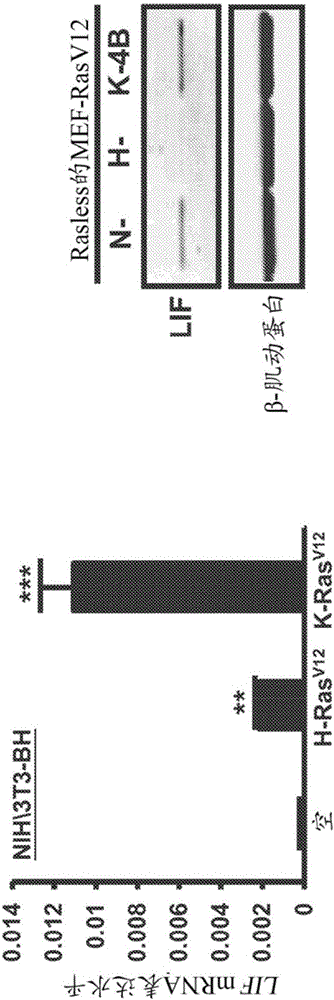
圖1.在胰腺癌中LIF-pSTAT3信號轉導受致癌K-Ras的調控。(A)微陣列分析(affymetrix Gene ST1.0)揭示,當與載體對照或H-RasV12-轉化的NIH/3T3細胞相比時,LIF在K-RasV12-轉化的NIH/3T3細胞中顯著未被調控,(N=3)。(B)qPCR(左圖)和蛋白印跡分析(右圖)證實,在K-RasV12-轉化的NIH/3T3細胞中LIF的mRNA和蛋白表達升高。(右圖)LIF表達增加指在K-RasV12-轉化的NIH/3T3細胞中STAT3的磷酸化水平增加。(在qPCR分析中N=3;**P<0.01;***P<0.001)。(C)qPCR分析提示,當與突變的B-Raf誘導的小鼠胰腺腫瘤相比時,突變的K-Ras驅動的小鼠胰腺癌具有較高的LIF表達。(N=3;**P<0.01)。(D)根據K-Ras突變狀態,胰腺癌組織和其它類型癌癥中的LIF/LIFR的表達。(E)已建立的胰腺癌細胞系中的LIF表達與具體的K-Ras突變同種型不相關。(F)通過shRNA敲低LIF阻抑了致癌K-Ras驅動的mPCAC中的球形成能力(N=8,***P<0.0001)。(G)在兩株不同的致癌K-Ras驅動的mPCAC系中,當與對照細胞相比時,LIF的敲低顯著降低了5FU處理后的復發集落形成效率。(H)在致癌K-Ras驅動的mPDAC中,LIF的敲低降低了大的轉移性脾臟損傷的形成并增加了平均存活時間。
圖2.在胰腺癌中LIF-pSTAT3信號轉導受致癌K-Ras的調控。(A-E)在胰腺癌細胞系中,LIF的表達水平受K-Ras的調控。(A)根據蛋白印跡,K-Ras表達敲低的PANC2.13顯示出降低的LIF和磷酸化-STAT3表達。K-Ras表達敲低的(B)PANC1.0和(C)PANC2.03顯示出mRNA水平的降低的LIF和磷酸化-STAT3表達。(N=3;*P<0.05;***P<0.001)。K-Ras表達敲低的(D)CaPanI和(E)HcG25顯示出mRNA水平的降低的LIF和磷酸化-STAT3表達。(N=3;**P<0.01;***P<0.001;****P<0.0001)。(F)LIF ELISA揭示,與對照細胞相比,K-Ras表達敲低的人胰腺癌細胞系在培養基中分泌顯著減少的LIF。(N=4;*P<0.05;****P<0.00001)。(G)蛋白印跡提示,K-Ras表達敲低從而LIF表達下調的胰腺癌細胞顯示出減少的磷酸化-STAT3水平。(H)磷酸化-STAT熒光素酶報告子分析提示,K-Ras表達敲低的胰腺癌細胞具有顯著降低的STAT3轉錄活性。(N=3;**P<0.01;***P<0.001)。
圖3.LIF在人胰腺癌生長/起始中發揮重要作用。(A)證實人胰腺癌細胞系中靶向人LIF的shRNA的敲低效力的蛋白印跡。(B)皮下異種移植模型中的PANC2.03的無瘤生存曲線提示,當與對象細胞相比時,LIF表達敲低的癌細胞具有顯著降低的腫瘤起始能力。(N=6)。(C)當與對照腫瘤相比時,LIF表達敲低的皮下異種移植的胰腺腫瘤以顯著緩慢的速率生長。(N=6;*P<0.01)。(D)LIF表達的敲低降低了原位模型中PANC1驅動的腫瘤中的腫瘤起始率。(N=4)。
圖4.在胰腺癌中LIF是抵抗吉西他濱處理所必需的。MTS((3-(4,5-二甲基噻唑-2-基)-5-(3-羧基甲氧基苯基)-2-(4-磺苯基)-2H-四唑)分析(其為評估細胞活力的比色分析)提示,當與對照細胞相比時,LIF的敲低使PANC2.03細胞對吉西他濱的處理敏感。(N=6)將介質處理(DMSO)用于標準化。
圖5.在胰腺癌細胞中LIF中和抗體阻止腫瘤起始并改善吉西他濱的治療功效。(A)抗hLIF抗體競爭分析的LIF ELISA證實了我們的靶抗體的中和能力。(B)將50,000個PANC2.03細胞皮下注入裸鼠以用于腫瘤起始分析。在接種腫瘤之前,以10mg/kg給予抗LIF AB(克隆D25.1.4)。所述處理一周進行三次。如所示,LIF抗體顯著阻止了腫瘤起始。(C)在藥物敏化分析中,首先將0.2x106個PANC2.03細胞皮下注入裸鼠。在接種后14天內形成腫瘤。將小鼠隨機分為4個不同組:對照、僅Ab、僅吉西他濱、以及組合。吉西他濱和LIF Ab的組合處理引起十分之八的腫瘤的完全消退,而對照IgG、單獨的LIF抗體(D25.1.4)或單獨的吉西他濱不引起腫瘤消退。(D)用(C)的處理模型,PANC2.03皮下腫瘤的腫瘤體積變化曲線。(E)吉西他濱和LIF Ab的組合處理顯著降低了腫瘤增殖率,而用吉西他濱單獨處理的腫瘤仍具有陽性生長率。腫瘤增殖率=(在后日的腫瘤體積-初始日的腫瘤體積)/初始日的腫瘤體積*100。(F)腫瘤體積的倍數變化提示,吉西他濱和LIF Ab的組合處理顯著降低了腫瘤增殖率,而用吉西他濱單獨處理的腫瘤仍具有陽性生長率。
圖6.LIF的表達在多種類型的癌癥中富集。(A-I)使用在線軟件OncomineTM(Invitrogen)分析不同的公開數據庫以確定與正常組織相比,多種類型癌癥的LIF表達水平。(A-B)TCGA結腸直腸癌數據集中LIF的表達。(C)D’Errico胃癌數據集中LIF的表達。(D)Wang胃癌數據集中LIF的表達。(E)Bredel腦癌數據集中LIF的表達。(F)Barretina細胞系數據集中LIF的表達。發現LIF的表達在胰腺癌中富集。(G)Garnett細胞系數據集中LIF的表達。發現LIF的表達在胰腺癌中富集。(H)Pei胰腺癌數據集中LIF的表達。(I)Garnett細胞系數據庫中LIF的表達。當與具有野生型K-Ras表達的癌細胞系相比時,在建立的具有突變的K-Ras的癌細胞系,中LIF在mRNA水平的表達顯著增加。
圖7.在化療敏感的癌癥中LIF在mRNA水平的表達顯著減少。(A-I)使用在線軟件OncomineTM(Invitrogen)分析具有化療敏感和耐化療的腫瘤標本的基團特性的不同公開數據庫,以確定LIF的表達水平。(A)Garnett細胞系數據集(耐阿糖胞苷和阿糖胞苷敏性腦和CNS癌癥細胞系)中LIF的表達。(B)Garnett細胞系數據集(耐伏立諾他和伏立諾他敏感性多癌細胞系)中LIF的表達。(C)Garnett細胞系數據集(耐AZD8055和AZD8055敏感性腦和CNS癌癥細胞系)中LIF的表達。(D)Garnett細胞系數據集(耐維甲酸和維甲酸敏感性腦和CNS癌癥細胞系)中LIF的表達。
發明詳述
I.介紹
本發明部分基于這樣的驚人發現:白血病抑制因子(LIF)(在人胰腺癌細胞系中高度表達的調控干細胞和STAT3的趨化因子)受致癌K-Ras的調控。不束縛于具體理論,據信,LIF通過用激活的K-Ras調控胰腺癌細胞的干細胞特性而作為K-Ras驅動的胰腺癌所必需的下游效應物發揮作用。
因此,在一個方面,本發明提供通過施用治療量的拮抗LIF的物質治療對象中的癌癥(如表達野生型K-Ras的癌癥或表達突變型K-Ras的癌癥)的方法。在另一方面,本發明還提供用于治療癌癥(如表達K-Ras的癌癥)的組合物和試劑盒,其包含任選地與化療劑組合的拮抗LIF的物質。
II.定義
本文使用的術語“K-Ras”指“Kirsten大鼠肉瘤病毒癌基因同源物”。由K-Ras基因編碼的蛋白是在細胞內信號轉導中起作用的小GTPase。人K-Ras的基因和蛋白序列在例如Genbank登錄號M54968.1和AAB414942.1中示出。見于人類癌癥中的一些常見K-Ras的基因和蛋白含有位于12號密碼子、密碼子、61號密碼子、146號密碼子和/或其它并發位點處的突變。K-Ras突變的非限制性實例包括位于以下密碼子處的突變:5號密碼子(例如,K5E)、9號密碼子(例如,V9I)、12號密碼子(例如,G12A、G12C、G12D、G12F、G12R、G12S、G12V、G12Y)、13號密碼子(例如,G13C、G13D、G13V)、14號密碼子(例如,V14I、V14L)、18號密碼子(例如,A18D)、19號密碼子(例如,L19F)、22號密碼子(例如,Q22K)、23號密碼子(例如,L23R)、24號密碼子(例如,I24N)、26號密碼子(例如,N26K)、33號密碼子(例如,D33E)、36號密碼子(例如,I36L、I36M)、57號密碼子(例如,D57N)、59號密碼子(例如,A59E、A59G、A59T)、61號密碼子(例如,Q61H、Q61K、Q61L、Q61R)、62號密碼子(例如,E62G、E62K)、63號密碼子(例如,E63K)、64號密碼子(例如,Y64D、Y64H、Y64N)、68號密碼子(例如,R68S)、74號密碼子(例如,T74P)、92號密碼子(例如,D92Y)、97號密碼子(例如,R97I)、110號密碼子(例如,P110H、P110S)、117號密碼子(例如,K117N)、118號密碼子(例如,C118S)、119號密碼子(例如,D119N)、135號密碼子(例如,R135T)、138號密碼子(例如,G138V)、140號密碼子(例如,P140H)、146號密碼子(例如,A146T、A146V)、147號密碼子(例如,K147N)、153號密碼子(例如,D153N)、156號密碼子(例如,F156L)、160號密碼子(例如,V160A)、164號密碼子(例如,R164Q)、171號密碼子(例如,I171M)、176號密碼子(例如,K176Q)、185號密碼子(例如,C185R、C185S)以及188號密碼子(例如,M188V)。
“表達K-Ras的癌癥”指具有可檢測的K-Ras(野生型或其突變形式)表達水平的癌癥。在一些實施方案中,當癌組織樣本中至少0.1%的細胞為K-Ras激活(例如,野生型K-Ras或者12號密碼子、13號密碼子、61號密碼子和/或其它密碼子處的K-Ras激活突變)陽性時,所述癌癥具有可檢測的表達水平。在一些實施方案中,癌癥具有可檢測的野生型K-Ras表達水平。在一些實施方案中,癌癥具有可檢測的突變型K-Ras表達水平。在一些實施方案中,表達K-Ras的癌癥中的K-Ras(例如,野生型K-Ras或突變型K-Ras)表達水平比對照(例如,不表達K-Ras的非病變細胞或組織,如正常的人外周淋巴細胞)中的K-Ras表達水平高至少5%、10%、20%、30%、40%、50%、75%、100%、150%或200%。
術語“癌癥”指特征為異常細胞不受控制的生長的疾病。該術語包括所有已知的癌癥和腫瘤病況(無論其特征為惡性、良性、軟組織還是實體的),以及所有階段和等級的癌癥(包括轉移前和轉移后的癌癥)。不同類型的癌癥的實例包括但不限于,消化和胃腸癌,如胃部癌癥(例如,胃癌)、結腸直腸癌、胃腸道間質瘤、胃腸道類癌瘤、結腸癌、直腸癌癥、肛門癌、膽管癌、小腸癌和食道癌;乳腺癌;肺癌;膽囊癌;肝癌;胰腺癌;闌尾癌;前列腺癌,卵巢癌;腎癌;中樞神經系統的癌癥;皮膚癌(例如,黑素瘤);淋巴瘤;神經膠質瘤;絨毛膜癌;頭頸癌;骨肉瘤;以及血癌。本文使用的“腫瘤”包含一個或多個癌性細胞。在一些實施方案中,所述癌癥為胰腺癌。
“白血病抑制因子(LIF)”指抑制細胞分化的白細胞介素6類細胞因子。人LIF的基因和蛋白序列在例如Genbank登錄號AK315310和AAC05174中示出。
“拮抗白血病抑制因子的物質”或“拮抗LIF的物質”是抑制、失活、降低、封阻或者下調LIF的表達或活性的任何物質。在一些實施方案中,如果相對于對照樣本(例如,接觸之前的生物樣本),物質將與所述物質接觸的生物樣本(例如,細胞或組織)中的LIF的表達或活性降低至少10%、15%、20%、25%、30%、40%、50%、60%、70%、80%、90%或更多,則其拮抗LIF。在一些實施方案中,所述物質為抗LIF抗體。
術語“物質”指天然存在的或合成的任何分子,例如,肽、蛋白、寡肽(例如,長度為約5至約25個氨基酸,例如長度為約5、10、15、20或25個氨基酸)、小的有機分子(例如,分子量小于約2500道爾頓,例如小于2000、小于1000或小于500道爾頓的有機分子)、環肽、模擬肽、抗體、多糖、脂質、脂肪酸、抑制性RNA(例如,siRNA或shRNA)、多核苷酸、寡核苷酸、適配子、藥物化合物或者其它化合物。
術語“抗體”指由免疫球蛋白基因或其功能性片段編碼的特異性結合并識別抗原的多肽。識別性免疫球蛋白基因包括κ、λ、α、γ、δ、ε和μ恒定區基因,以及無數的免疫球蛋白可變區基因。輕鏈分為κ或λ。重鏈分為γ、μ、α、δ或ε,其繼而分別限定了免疫球蛋白種類IgG、IgM、IgA、IgD和IgE。
示例性的免疫球蛋白(抗體)結構單元包含四聚體。各四聚體由兩對相同的多肽鏈組成,每對具有一條“輕”鏈(約25kDa)和一條“重”鏈(約50-70kDa)。每條鏈的N-端限定了約100至110個或更多個氨基酸的可變區,其主要負責抗原的識別。因此,術語“可變重鏈”、“VH”或“VH”指免疫球蛋白重鏈的可變區,包括Fv、scFv、dsFv或Fab;而術語“可變輕鏈”、“VL”或“VL”指免疫球蛋白輕鏈的可變區,包括Fv、scFv、dsFv或Fab。
抗體功能性片段的實例包括但不限于,完整的抗體分子、抗體片段或者能夠與靶抗原結合的免疫球蛋白肽的任何其它功能部分,所述抗體片段如Fv、單鏈Fv(scFv)、互補決定區(CDR)、VL(輕鏈可變區)、VH(重鏈可變區)、Fab、F(ab)2’及其任何組合(參見,例如,FUNDAMENTAL IMMUNOLOGY(Paul編著,第4版,2001)。如本領域技術人員所理解的,可以通過多種方法獲得各種抗體片段,例如,用酶(如胃蛋白酶)消化完整的抗體;或者從頭合成。通常以化學方法或通過使用重組DNA方法從頭合成抗體片段。因此,本文使用的術語抗體包括通過修飾完整抗體產生的抗體片段或使用重組DNA方法從頭合成的那些(例如,單鏈Fv)或者使用噬菌體展示文庫鑒定的那些(參見,例如McCafferty等人,(1990)Nature 348:552)。術語“抗體”還包括二價或雙特異性分子,雙功能抗體(diabody)、三功能抗體(triabody)和四功能抗體(tetrabody)。二價和雙特異性分子描述于例如Kostelny等人(1992)J.Immunol.148:1547;Pack和Pluckthun(1992)Biochemistry 31:1579;Hollinger等人(1993),PNAS.USA 90:6444;Gruber等人(1994)J Immunol.:5368;Zhu等人(1997)Protein Sci.6:781;Hu等人(1996)Cancer Res.56:3055;Adams等人(1993)Cancer Res.53:4026;以及McCartney等人(1995)Protein Eng.8:301。
“人源化”抗體為保留非人抗體的反應性同時在人中具有低免疫原性的抗體。這可以例如通過保留非人CDR區并用其人中的對應物替代抗體的剩余部分來實現。參見,例如,Morrison等人,PNAS USA,81:6851-6855(1984);Morrison和Oi,Adv.Immunol.,44:65-92(1988);Verhoeyen等人,Science,239:1534-1536(1988);Padlan,Molec.Immun.,28:489-498(1991);Padlan,Molec.Immun.,31(3):169-217(1994)。
“單鏈Fv(svFv)”或“單鏈抗體”指這樣的蛋白,其中scFv抗體的VH和VL區包含被折疊以產生類似于在雙鏈抗體中存在的抗原識別位點的單鏈。制備scFv抗體的方法已描述于例如,Ward等人,Exp Hematol.(5):660-4(1993);和Vaughan等人,Nat Biotechnol.14(3):309-14(1996)中。單鏈Fv(scFv)抗體任選地包含長度不超過50個氨基酸,通常不超過40個氨基酸,優選不超過30個氨基酸,以及更優選不超過20個氨基酸的肽接頭。在一些實施方案中,肽接頭為序列Gly-Gly-Gly-Gly-Ser的多聯體,例如,2、3、4、5或6個這樣的序列。然而,應理解,可以進行接頭內一些氨基酸的置換。例如,可將纈氨酸置換為甘氨酸。另外的肽接頭及其用途在本領域眾所周知。參見,例如,Huston等人,Proc.Nat’l Acad.Sci.USA 8:5879(1988);Bird等人,Science 242:4236(1988);Glockshuber等人,Biochemistry 29:1362(1990);美國專利第4,946,778號、美國專利第5,132,405號以及Stemmer等人,Biotechniques 14:256-265(1993)。
短語“與抗體特異性(或選擇性)結合”,當提及蛋白或肽時,指在異質蛋白群體和其它生物制品的存在下決定所述蛋白的存在的結合反應。因此,在指定的免疫分析條件下,指定的抗體與特定蛋白(例如,LIF或其部分)結合但不以顯著量與樣本中存在的其它蛋白結合。此類條件下與抗體的特異性結合可能需要針對其對特定蛋白的特異性而被選擇的抗體。例如,可以選擇針對LIF產生的抗體以獲得與所述蛋白特異性免疫反應但不與其它蛋白(除了多態變體(例如,與目的序列至少80%、85%、90%、95%或99%相同的蛋白)之外)特異性免疫反應的抗體。可以使用多種免疫分析模式來選擇與特定蛋白特異性免疫反應的抗體。例如,通常使用固相ELISA免疫分析、蛋白印跡或免疫組織化學來選擇與蛋白特異性免疫反應的單克隆抗體。對于可用于測定特異性免疫反應性的免疫分析模式和條件的描述參見,Harlow和Lane《抗體,實驗室手冊》(Antibodies,A Laboratory Manual),Cold Spring Harbor Publications,NY(1988)。通常,特異性或選擇性反應將為背景信號或噪聲的至少兩倍,以及更通常為背景的大于10至100倍。
術語“多肽”、“肽”和“蛋白”在本文可互換使用,指氨基酸殘基的聚合物。所述術語適用于其中的一個或多個氨基酸殘基為對應的天然存在氨基酸的人工化學模擬物的氨基酸聚合物,以及適用于天然存在的氨基酸聚合物和非天然存在的氨基酸聚合物。如本文所用,所述術語包括任何長度的氨基酸鏈,包括全長蛋白,其中氨基酸殘基通過共價肽鍵連接。
術語“氨基酸”指天然存在的氨基酸和合成的氨基酸,以及以與天然存在的氨基酸類似的方式起作用的氨基酸類似物和氨基酸模擬物。天然存在的氨基酸為由遺傳密碼編碼的那些,以及后來修飾的那些氨基酸,例如,羥脯氨酸、γ-羧基谷氨酸和O-磷酸絲氨酸。氨基酸類似物指與天然存在的氨基酸具有相同的基本化學結構(即,與氫、羧基、氨基和R基結合的α碳)的化合物,例如,高絲氨酸、正亮氨酸、甲硫氨酸亞砜、甲硫氨酸甲基锍。此類類似物具有修飾的R基(例如,正亮氨酸)或者修飾的肽骨架,但是保留了與天然存在的氨基酸相同的基本化學結構。“氨基酸模擬物”指這樣的化學化合物,其具有與氨基酸的一般化學結構不同的結構,但是以與天然存在的氨基酸類似的方式起作用。
在本文氨基酸可以通過其通常已知的三字母符號或通過由IUPAC-IUB生物化學命名委員會推薦的單字母符號來提及。同樣地,核苷酸可以通過其通常接受的單字母代碼來提及。
本文使用的術語“核酸”和“多核苷酸”可互換使用。術語“多核苷酸”的使用包括寡核苷酸(即,短的多核苷酸)。該術語還指脫氧核糖核苷酸、核糖核苷酸和天然存在的變體,并且還可以指合成的和/或非天然存在的核酸(即,其包含核酸類似物或修飾的骨架殘基或連接),如,例如但不限于,硫代磷酸酯(phosphorothioate)、氨基磷酸酯、甲基膦酸酯、手性-甲基膦酸酯、2-O-甲基核糖核苷酸、肽-核酸(PNA)等。除非另有說明,具體的核酸序列還隱含包括其保守修飾的變體(例如,簡并密碼子的置換)和互補序列以及明確指明的序列。具體地,可以通過產生一個或多個選定(或全部)密碼子的第三位被混合堿基和/或脫氧肌苷殘基置換的序列來實現簡并密碼子的置換(參見,例如,Batzer等人,Nucleic Acid Res.19:5081(1991);Ohtsuka等人,J.Biol.Chem.260:2605-2608(1985);以及Cassol等人(1992);Rossolini等人,Mol.Cell.Probes 8:91-98(1994))。
“生物樣本”包括血液和血液組分或產物(例如,血清、血漿、血小板、紅細胞等);痰或唾液;腎、肺、肝、心臟、腦、神經組織、甲狀腺、眼、骨骼肌、軟骨或骨組織;培養的細胞,例如,原代培養物,外植體和轉化的細胞、干細胞;糞便;尿等。此類生物樣本還包括組織切片,如活檢和尸檢樣本,以及用于組織學目的采集的冷凍切片。生物樣本通常獲自“對象”,即,真核生物,最優選哺乳動物,如靈長類,例如黑猩猩或人;奶牛;狗;貓;嚙齒類,例如豚鼠、大鼠或小鼠;兔;或鳥;爬行動物;或者魚。
物質(例如,拮抗LIF的物質)的“治療量”或“治療有效量”是預防、減輕、減緩或降低對象中癌癥(例如,表達K-Ras的癌癥)癥狀的嚴重性的量。
術語“施用(administer)”、“施用(administered)”或“施用(administering)”指將物質、化合物或組合物遞送至期望的生物作用位點的方法。這些方法包括但不限于,局部遞送、腸胃外遞送、靜脈內遞送、真皮內遞送、肌肉內遞送、結腸遞送、直腸遞送或腹膜內遞送。任選地與本文所描述的物質和方法一起使用的施用技術包括例如,如Goodman和Gilman,《治療學的藥理學基礎》(The Pharmacological Basis of Therapeutics),現行版;Pergamon;以及Remington’s Pharmaceutical Sciences)(現行版),Mack Publishing Co.,Easton,PA中所討論的。
III.治療癌癥的方法
在一個方面,提供治療或預防對象中的癌癥的方法。在一些實施方案中,所述方法包括向所述對象施用治療量的拮抗白血病抑制因子(LIF)的物質。在一些實施方案中,所述對象為人,例如,成年人或兒童。
在一些實施方案中,所述癌癥為表達K-Ras的癌癥,例如,表達或過表達野生型K-Ras的癌癥或者表達突變形式的K-Ras的癌癥。在一些實施方案中,表達K-Ras的癌癥為胰腺癌、結腸直腸癌或肺癌。在一些實施方案中,表達K-Ras的癌癥為胰腺癌,例如,胰腺導管腺癌。在一些實施方案中,所述方法還包括測量來自對象的樣本(例如,腫瘤組織樣本)中K-Ras的表達水平。在一些實施方案中,所述方法還包括測定在來自對象的樣本(例如,腫瘤組織樣本)中表達的K-Ras基因型。
在一些實施方案中,所述方法還包括:
檢測來自對象的樣本(例如,來自對象的腫瘤細胞或腫瘤組織樣本)中K-Ras的表達水平;
確定來自對象的樣本中K-Ras的表達水平是否高于對照(例如,不表達K-Ras的非病變細胞或組織,如正常的人外周淋巴細胞)中K-Ras的表達水平;以及
當來自對象的樣本中K-Ras的表達水平高于對照中K-Ras的表達水平時,向所述對象施用拮抗LIF的物質。
在一些實施方案中,所述癌癥不是表達或過表達K-Ras的癌癥。作為非限制性實例,在一些實施方案中,所述癌癥為不表達或不過表達K-Ras的胰腺癌(例如,胰腺導管腺癌)。
表達K-Ras的癌癥
在一些實施方案中,癌癥為表達可檢測水平的K-Ras的癌癥。在一些實施方案中,當癌組織樣本中至少0.1%的細胞為K-Ras激活(例如,野生型K-Ras或者位于12號密碼子、13號密碼子、61號密碼子和/或其它密碼子處的K-Ras激活突變)陽性時,癌癥具有可檢測的K-Ras表達水平。在一些實施方案中,癌癥具有可檢測的野生型K-Ras表達水平。在一些實施方案中,癌癥具有可檢測的突變型K-Ras表達水平。在一些實施方案中,K-Ras突變為位于以下的一處或多處密碼子的激活突變:5號密碼子(例如,K5E)、9號密碼子(例如,V9I)、12號密碼子(例如,G12A、G12C、G12D、G12F、G12R、G12S、G12V、G12Y)、13號密碼子(例如,G13C、G13D、G13V)、14號密碼子(例如,V14I、V14L)、18號密碼子(例如,A18D)、19號密碼子(例如,L19F)、22號密碼子(例如,Q22K)、23號密碼子(例如,L23R)、24號密碼子(例如,I24N)、26號密碼子(例如,N26K)、33號密碼子(例如,D33E)、36號密碼子(例如,I36L、I36M)、57號密碼子(例如,D57N)、59號密碼子(例如,A59E、A59G、A59T)、61號密碼子(例如,Q61H、Q61K、Q61L、Q61R)、62號密碼子(例如,E62G、E62K)、63號密碼子(例如,E63K)、64號密碼子(例如,Y64D、Y64H、Y64N)、68號密碼子(例如,R68S)、74號密碼子(例如,T74P)、92號密碼子(例如,D92Y)、97號密碼子(例如,R97I)、110號密碼子(例如,P110H、P110S)、117號密碼子(例如,K117N)、118號密碼子(例如,C118S)、119號密碼子(例如,D119N)、135號密碼子(例如,R135T)、138號密碼子(例如,G138V)、140號密碼子(例如,P140H)、146號密碼子(例如,A146T、A146V)、147號密碼子(例如,K147N)、153號密碼子(例如,D153N)、156號密碼子(例如,F156L)、160號密碼子(例如,V160A)、164號密碼子(例如,R164Q)、171號密碼子(例如,I171M)、176號密碼子(例如,K176Q)、185號密碼子(例如,C185R、C185S)和188號密碼子(例如,M188V)。在一些實施方案中,K-Ras突變是在氨基酸殘基G12處的突變(例如,G12C、G12V、G12D、G12A、G12S、G12R或G12F置換)。在一些實施方案中,K-Ras突變是在氨基酸殘基G13處的突變(例如,G13C或G13D置換)。在一些實施方案中,K-Ras突變是在氨基酸殘基Q61處的突變(例如,Q61H或Q61K置換)。在一些實施方案中,K-Ras突變是在氨基酸殘基A146處的突變(例如,A146T或A146V置換)。在一些實施方案中,表達可檢測水平的野生型或突變型K-Ras的癌癥為胰腺癌、肺癌或結腸直腸癌。
在一些實施方案中,所述癌癥為過表達K-Ras的癌癥。如本文所用,如果K-Ras(例如,野生型K-Ras或突變型K-Ras)的表達水平相對于閾值或對照樣本(例如,不表達K-Ras的無病變細胞或組織,如正常的人外周淋巴細胞,或者已知K-Ras的表達為陰性的來自對象的癌癥樣本)有所增加,則癌癥“過表達”K-Ras。在一些實施方案中,如果K-Ras(例如,野生型K-Ras或突變型K-Ras)的表達水平比閾值或對照樣本(例如,已知K-Ras的表達為陰性的癌癥)中的K-Ras表達水平高至少10%、20%、30%、40%、50%、75%、100%、150%或200%,則癌癥過表達K-Ras。在一些實施方案中,如果K-Ras(例如,野生型K-Ras或突變型K-Ras)的表達水平是相對于閾值或對照樣本(例如,已知K-Ras的表達為陰性的癌癥)中的K-Ras表達水平的至少2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或更多倍,則癌癥過表達K-Ras。在一些實施方案中,過表達野生型或突變型K-Ras的癌癥為胰腺癌、肺癌或結腸直腸癌。
可以根據本領域已知的方法測量癌癥中K-Ras的表達水平。在一些實施方案中,測量癌癥中K-Ras基因表達的水平。在一些實施方案中,測量癌癥中K-Ras蛋白表達的水平。可以測量來自對象的生物樣本中K-Ras基因或蛋白表達的水平或者K-Ras基因型的檢測。在一些實施方案中,生物樣本包括癌細胞(例如,獲自或源自腫瘤的細胞)。在一些實施方案中,生物樣本為腫瘤組織樣本。
可以使用本領域已知的多種免疫分析中的任一種測量K-Ras蛋白表達的水平。免疫分析技術和方案通常描述于Price和Newman,《免疫分析的原理和實踐》(Principles and Practice of Immunoassay),第2版,Grove’s Dictionaries,1997;和Gosling,《免疫分析:實用方法》(Immunoassays:A Practical Approach),Oxford University Press,2000。可以使用各種免疫分析技術,包括競爭性和非競爭性免疫分析(參見,例如,Self等人,Curr.Opin.Biotechnol.,7:60-65(1996))。術語免疫分析包括這樣的技術:其包括不限于,酶免疫分析(EIA),如酶放大免疫分析技術(EMIT)、酶聯免疫吸附分析(ELISA)、IgM抗體捕獲ELISA(MAC ELISA)和微粒子酶免疫分析(MEIA);毛細管電泳免疫分析(CEIA);放射免疫分析(RIA);免疫放射分析(IRMA);免疫熒光(IF);熒光偏振免疫分析(FPIA);以及化學發光分析(CL)。若需要,此類免疫分析可以是自動化的。免疫分析還可以與激光誘導熒光聯合使用(參見,例如,Schmalzing等人,Electrophoresis,18:2184-93(1997);Bao,J.Chromatogr.B.Biomed.Sci.,699:463-80(1997))。
可以直接或間接檢測抗體與蛋白(例如,K-Ras)的特異性免疫學結合。直接標記包括熒光或冷光標簽、金屬、染料、放射性核素等,所述標記被連接至抗體。可以使用用碘-125(125I)標記的抗體。使用對蛋白標志物具有特異性的化學發光抗體進行的化學發光分析適合于敏感、非放射性地蛋白水平檢測。被熒光染料標記的抗體也是合適的。熒光染料的實例包括不限于:DAPI、熒光素、Hoechst 33258、R-藻藍蛋白、B-藻紅蛋白、R-藻紅蛋白、羅丹明、德克薩斯紅和麗絲胺。間接標記包括本領域眾所周知的多種酶,如辣根過氧化物酶(HRP)、堿性磷酸酶(AP)、β-半乳糖苷酶、脲酶等。辣根過氧化物酶檢測系統可以例如與顯色底物四甲基聯苯胺(TMB)一起使用,在過氧化氫的存在下其產生于450nm下可檢測的可溶產物。堿性磷酸酶檢測系統可以與顯色底物對硝基苯磷酸酯一起使用,例如,其產生于405nm下容易檢測的可溶產物。類似地,β-半乳糖苷酶檢測系統可以與顯色底物鄰硝基苯-β-D-半乳糖苷(ONPG)一起使用,其產生于410nm下可檢測的可溶產物。脲酶檢測系統可以與諸如尿素-溴甲酚紫的底物(Sigma Immunochemicals;St.Louis,MO)一起使用。
可以使用例如下述來分析來自直接或間接標記的信號:使用分光光度計檢測來自顯色底物的顏色;使用輻射計數器檢測輻射,如使用γ計數器檢測125I;或者使用熒光計檢測某一波長的光的存在下的熒光。為了檢測酶聯抗體,可以使用分光光度計如EMAX酶標儀(Molecular Devices;Menlo Park,CA),根據生產商的說明書,進行定量分析。若需要,本發明的分析可以是自動化的或者機器進行的,并且可以同時檢測來自多個樣本的信號。在一些實施方案中,可以使用自動化的高含量成像系統對信號量進行定量。高含量的成像系統可以商購獲得(例如,ImageXpress,Molecular Devices Inc.,Sunnyvale,CA)。
抗體可以被固定在各種固體支持物上,如磁性或色譜基質顆粒、分析板的表面(例如,微量滴定孔)、固體基底材料片或膜(例如,塑料、尼龍、紙)等。可以通過將抗體或多種抗體以陣列形式包被在固體支持物上來制備分析條(assay strip)。然后可以將該條浸入測試樣本中,并通過洗滌和檢測步驟快速處理,以產生可測量的信號,如有色斑點。
可以使用常規技術來實現K-Ras核酸表達水平或K-Ras基因型的分析,所述技術如Southern分析、逆轉錄酶聚合酶鏈式反應(RT-PCR)或基于與目的編碼序列的一部分互補的核酸序列的雜交的任何其它方法(例如,條形斑點雜交),所述任何其它方法也在本發明的范圍內。可適用的PCR擴增技術描述于,例如,在前的Ausubel等人和Innis等人。通常的核酸雜交方法描述于Anderson,“Nucleic Acid hybridization,”BIOS Scientific Publishers,1999。也可由以微陣列排列的mRNA或cDNA序列進行多種核酸序列(例如,基因組DNA、mRNA或cDNA)的擴增或雜交。微陣列方法通常描述于Hardiman,“Microarrays Methods and Applications:Nuts&Bolts,”DNA Press,2003;以及Baldi等人,“DNA Microarrays and Gene Expression:From Experiments to Data Analysis and Modeling,”Cambridge University Press,2002。
也可以使用本領域已知的技術進行核酸表達水平或基因型的分析,所述技術包括但不限于微陣列、基于聚合酶鏈式反應(PCR)的分析、序列分析和電泳分析。基于PCR的分析的非限制性實例包括可獲自Applied Biosystems的等位基因鑒別分析。序列分析的非限制性實例包括Maxam-Gilbert測序、Sanger測序、毛細管陣列DNA測序、熱循環測序(Sears等人,Biotechniques,13:626-633(1992))、固相測序(Zimmerman等人,Methods Mol.Cell Biol.,3:39-42(1992))、質譜測序如基質輔助激光解吸/電離飛行時間質譜(MALDI-TOF/MS;Fu等人,Nat.Biotechnol.,16:381-384(1998))、焦磷酸測序(Ronaghi等人,Science,281:363-365(1998))以及雜交測序。(Chee等人,Science,274:610-614(1996);Drmanac等人,Science,260:1649-1652(1993);Drmanac等人,Nat.Biotechnol.,16:54-58(1998))。電泳分析的非限制性實例包括平板凝膠電泳(如瓊脂糖或聚丙烯酰胺凝膠電泳)、毛細管電泳和變性梯度凝膠電泳。在一些實施方案中,檢測核酸變體的方法包括,例如,來自Third Wave Technologies,Inc.的分析、限制性片段長度多態性(RFLP)分析、等位基因特異性寡核苷酸雜交、異源雙鏈泳動分析、單鏈構象多態(SSCP)分析、單核苷酸引物延伸(SNUPE)以及焦磷酸測序。
在本文所描述的分析中可以使用可檢測部分。可以使用各種可檢測部分,其中根據所需的敏感性、與抗體綴合的容易性、穩定性需求、以及可用的使用儀器和處置規定來選擇標記。合適的可檢測部分包括但不限于:放射性核素、熒光染料(例如,熒光素、異硫氰酸熒光素(FITC)、Oregon GreenTM、羅丹明、德克薩斯紅、四羅丹明異硫氰酸酯(TRITC)、Cy3、Cy5等)、熒光標志物(例如,綠色熒光蛋白(GFP)、藻紅蛋白等)、通過腫瘤相關蛋白酶激活的自淬滅熒光化合物、酶(例如,熒光素酶、辣根過氧化物酶、堿性磷酸酶等)、納米顆粒、生物素、地高辛配基(digoxigenin)等。
所述分析可以以多種物理形式進行。例如,可以使用微量滴定板或自動操作來促進大量測試樣本的處理。
可選地,為了檢測蛋白或核酸表達的水平,可以將抗體或核酸探針應用于固定于顯微鏡載片上的對象樣本。可以使用本領域已知的多種光或熒光顯微方法中的任一種來使所得抗體的染色或原位雜交模式可視化。
蛋白或核酸的分析也可以例如通過單獨的或者與質譜(例如,MALDI/MS、MALDI-TOF/MS、串聯MS等)組合的高壓液相色譜(HPLC)來實現。
測定K-Ras基因型的方法在本領域有描述。參見,例如,Kramer等人,Cell Oncol.31:161-167(2009);Chen等人,J.Chromatogr.A 1216:5147-5154(2009);Lamy等人,Modern Pathology 24:1090-1100(2011);Galbiati等人,PLoS ONE 8(3):359939(2013);以及WO 2010/048691。
拮抗LIF的物質
在一些實施方案中,向有需要的對象(例如,患有癌癥(例如,表達或過表達K-Ras的癌癥)的對象)施用治療量的拮抗LIF的物質。在一些實施方案中,拮抗LIF的物質為肽、蛋白、寡肽、環肽、模擬肽、抗體、多糖、脂質、脂肪酸、抑制性RNA(例如,siRNA、miRNA、或shRNA)、多核苷酸、寡核苷酸、適配子、小的有機分子或藥物化合物。所述物質可以是合成的或天然存在的。
抗LIF抗體
在一些實施方案中,所述物質為抗LIF抗體。在一些實施方案中,抗LIF抗體為單克隆抗體。在一些實施方案中,抗LIF抗體為諸如Fab、F(ab’)2和Fv的抗體片段。
在一些實施方案中,抗LIF抗體為由美國模式培養物保藏中心登錄號ATCC HB11074(克隆D25.1.4)、ATCC HB11076(克隆D3.14.1.)、ATCC HB11077(克隆D4.16.9)或ATCC HB11075(克隆D62.3.2)下保藏的雜交瘤細胞所產生的單克隆抗體,或者其人源化形式。抗LIF抗體和制備抗LIF抗體的方法描述于美國專利第5,654,157號和WO 2011/124566中,將其各自通過引用并入本文。在一些實施方案中,抗LIF抗體為這樣的抗體:其與由美國模式培養物保藏中心登錄號ATCC HB11074(克隆D25.1.4)、ATCC HB11076(克隆D3.14.1.)、ATCC HB11077(克隆D4.16.9)或ATCC HB11075(克隆D62.3.2)下保藏的雜交瘤細胞所產生的抗體競爭結合表位。在一些實施方案中,抗LIF抗體為與由美國模式培養物保藏中心登錄號ATCC HB11074(克隆D25.1.4)、ATCC HB11076(克隆D3.14.1.)、ATCC HB11077(克隆D4.16.9)或ATCC HB11075(克隆D62.3.2)下保藏的雜交瘤細胞所產生的抗體結合相同表位的抗體。在一些實施方案中,抗LIF抗體為與包含人LIF的氨基酸160至202的區域內的表位結合的抗體。
為了制備拮抗LIF的抗體(例如,重組抗體或單克隆抗體),可以使用本領域已知的許多技術。參見,例如,Kohler&Milstein,Nature 256:495-497(1975);Kozbor等人,Immunology Today 4:72(1983);Cole等人,Monoclonal Antibodies and Cancer Therapy中的77-96頁,Alan R.Liss,Inc.(1985);Coligan,《免疫學實驗指南》(Current Protocols in Immunology)(1991);Harlow&Lane,《抗體,實驗室手冊》(Antibodies,A Laboratory Manual)(1988);以及Goding,《單克隆抗體:原理和實踐》(Monoclonal Antibodies:Principles and Practice)(第2版.1986))。
編碼目的抗體的重鏈和輕鏈的基因可以克隆自細胞,例如,編碼單克隆抗體的基因可以克隆自雜交瘤并被用于產生重組單克隆抗體。編碼單克隆抗體的重鏈和輕鏈的基因文庫也可以制備自雜交瘤或血漿細胞。可選地,可以使用噬菌體或酵母展示技術來鑒定與選定抗原特異性結合的抗體和異質Fab片段(參見,例如,McCafferty等人,Nature 348:552-554(1990);Marks等人,Biotechnology 10:779-783(1992);Lou等人,(2010)PEDS 23:311)。重鏈和輕鏈基因產物的隨機組合產生具有不同抗原特異性的大的抗體庫(參見,例如,Kuby,《免疫學》(Immunology)(第3版,1997))。用于產生單鏈抗體或重組抗體的技術(美國專利4,946,778,美國專利第4,816,567號)也可適于產生抗體。抗體也可以被制備為雙特異性的,即,能夠識別兩種不同的抗原(參見,例如,WO 93/08829;Traunecker等人,EMBO J.10:3655-3659(1991);和Suresh等人,Methods in Enzymology 121:210(1986))。抗體也可以是異綴合物(heteroconjugate)(例如,兩種共價結合的抗體)或免疫毒素(參見,例如,美國專利第4,676,980號、WO 91/00360;和WO 92/200373)。
可以使用許多表達系統(包括原核和真核表達系統)產生抗體。在一些實施方案中,表達系統為哺乳動物細胞表達系統,如雜交瘤或CHO細胞表達系統。許多此類系統可以廣泛獲自商業供應商。在抗體包含VH和VL區的實施方案中,可以使用例如雙順反子表達單元中的或者在不同的啟動子控制下的單一載體來表達VH和VL區。在其它實施方案中,可以使用分別的載體來表達VH和VL區。本文所描述的VH或VL區可以任選地在N-端包含甲硫氨酸。
人源化或靈長類動物源化非人抗體的方法也是本領域已知的。通常,人源化抗體具有引入其內的來自非人來源的一個或多個氨基酸殘基。這些非人氨基酸殘基通常被稱為引入殘基,其通常取自引入可變結構域。人源化基本上可以遵循Winter和其同事的方法,通過用嚙齒類CDR或CDR序列替換對應的人抗體序列進行(參見,例如,Jones等人,Nature 321:522-525(1986);Riechmann等人,Nature 332:323-327(1988);Verhoeyen等人,Science 239:1534-1536(1988)以及Presta,Curr.Op.Struct.Biol.2:593-596(1992))。此類人源化抗體為嵌合抗體(美國專利第4,816,567號),其中基本上小于完整人可變結構域的可變結構域已被來自非人物種的對應序列替換。在實踐中,人源化抗體通常為這樣的人抗體:其中一些CDR殘基和可能的一些FR殘基被來自嚙齒類抗體中類似位置上的殘基替換。可以使用轉基因小鼠或其它生物體(如其它哺乳動物)來表達人源化或人抗體(參見,例如,美國專利第5,545,807號;第5,545,806號;第5,569,825號;第5,625,126號;第5,633,425號;第5,661,016號,Marks等人,Bio/Technology 10:779-783(1992);Lonberg等人,Nature 368:856-859(1994);Morrison,Nature 368:812-13(1994);Fishwild等人,Nature Biotechnology 14:845-51(1996);Neuberger,Nature Biotechnology 14:826(1996);以及Lonberg&Huszar,Intern.Rev.Immunol.13:65-93(1995))。
作為人源化的替代,可以產生人抗體。作為非限制性實例,可以產生轉基因動物(例如,小鼠),當免疫時,其能夠在缺乏內源免疫球蛋白產生的情況下產生人抗體的全庫。例如,已對下述進行了描述:嵌合和種系突變小鼠中抗體重鏈連接區(JH)基因的純合缺失導致內源抗體產生的完全抑制。人種系免疫球蛋白基因陣列在此類種系突變小鼠中的轉移將導致抗原激發時人抗體的產生。參見,例如,Jakobovits等人,Proc.Natl.Acad.Sci.USA,90:2551(1993);Jakobovits等人,Nature,362:255-258(1993);Bruggermann等人,Year in Immun.,7:33(1993);以及美國專利第5,591,669號、第5,589,369號和第5,545,807號。
在一些實施方案中,產生抗體片段(如Fab、Fab’、F(ab’)2、scFv或dAB)。已開發了用于產生抗體片段的多種技術。通常,這些片段經完整抗體的蛋白水解消化獲得(參見,例如,Morimoto等人,J.Biochem.Biophys.Meth.,24:107-117(1992);以及Brennan等人,Science,229:81(1985))。然而,這些片段目前可以使用重組宿主細胞直接產生。例如,可以從抗體噬菌體文庫分離抗體片段。可選地,Fab’-SH片段可以直接回收自大腸桿菌細胞并且經化學偶聯形成F(ab’)2片段(參見,例如,Carter等人,BioTechnology,10:163-167(1992))。根據其它方法,可以直接從重組宿主細胞培養物分離F(ab’)2片段。用于產生抗體片段的其它技術對本領域技術人員來說將是顯而易見的。在其它實施方案中,選擇的抗體為單鏈Fv片段(scFv)。參見,例如,PCT公開號WO 93/16185;以及美國專利第5,571,894號和第5,587,458號。抗體片段也可以是如例如美國專利第5,641,870號中所描述的線性抗體。
在一些實施方案中,抗體或抗體片段可以與其它分子(例如,聚乙二醇(聚乙二醇化)或血清白蛋白)綴合,以提供延長的體內半衰期。抗體片段的聚乙二醇化的實例提供于Knight等人Platelets 15:409,2004(對于阿昔單抗);Pedley等人,Br.J.Cancer 70:1126,1994(對于抗CEA抗體);Chapman等人,Nature Biotech.17:780,1999;以及Humphreys等人,Protein Eng.Des.20:227,2007)。
可以分析抗體或抗體片段中和LIF活性的能力。分析LIF活性抑制的方法是本領域已知的。作為非限制性實例,可以使用鼠白血病細胞系DA-1a,在細胞增殖分析中實施分析,以確定抗體或抗體片段是否中和LIF的活性。參見,Moreau等人,Nature 15:690-692(1988)。還可以對中和抗體的下述能力進行評價:在由致癌K-Ras驅動的小鼠胰腺癌細胞中封阻mLIF與LIFR結合的能力;減少胰腺腫瘤形成的能力和/或在免疫活性同系動物模型中改善胰腺腫瘤對吉西他濱的治療應答的能力。
其它LIF拮抗劑
根據本領域技術人員眾所周知的方法可以容易地鑒定LIF的其它拮抗劑。在一些實施方案中,可以通過對潛在拮抗劑與LIF競爭結合白血病抑制因子受體(LIFR)的能力進行篩選來鑒定LIF的拮抗劑。競爭性分析在本領域眾所周知。通常,競爭性結合分析使用標記的已知配體(例如,LIF),以篩選以與已知配體至少一樣多的親和性結合已知受體(例如,LIFR)的候選物的文庫(例如,化合物或肽文庫)。
在一些實施方案中,可以通過對潛在拮抗劑抑制LIF生物活性的能力進行篩選來鑒定LIF的拮抗劑(例如,在細胞增殖分析中)。分析LIF的拮抗劑的方法在本領域有描述,例如,Fairlie等人,Biochemistry 42:13193-13201(2003);Zhou等人,J.Endod 7:819-824(2011)。
篩選分析可在體外進行,如通過使用基于細胞的分析,或者在體內進行,如通過使用動物模型。在一些實施方案中,分析可被設計為通過使分析步驟自動化并向分析提供來自任何便利來源的化合物來篩選大的化學文庫,其通常并行運行(例如,在機械分析中的微滴定板上以微滴定模式進行)。作為LIF的潛在拮抗劑進行篩選的物質可以是小的有機分子、肽、模擬肽、類肽、蛋白、多肽、糖蛋白、寡糖或諸如抑制性RNA(例如,siRNA、反義RNA)的多核苷酸。
基本上,可以對任何化學化合物拮抗LIF的能力進行測試。在一些實施方案中,物質的分子量小于1,500道爾頓,以及在一些實例中,小于1,000、800、600、500或400道爾頓。相對小尺寸的物質可能是期望的,因為較小分子具有比具有較高分子量的物質更高的與良好藥代動力學特征兼容的物理化學特性(包括口服吸收)的可能性。
在一些實施方案中,高通量篩選方法涉及提供含有大量潛在治療性化合物(潛在的拮抗LIF的化合物)的組合文庫。可以在如本文所描述的一種或多種分析中篩選此類“組合化學文庫或肽文庫”,以鑒定呈現期望的特征活性的那些文庫成員(特定化學種類或亞類)。由此鑒定的化合物可以作為常規的“先導化合物”或者本身可以用作潛在的或實際的治療劑。
組合化學文庫是通過化學合成或生物合成、通過將大量化學“結構單元(building block)”(如試劑)組合所產生的各種化學化合物的集合。例如,通過將一組化學結構單元(氨基酸)以每一種可能的方式組合為指定化合物長度(即,多肽化合物中的氨基酸數目)來形成線性組合化學文庫,如多肽文庫。可以通過化學結構單元的此類組合混合來合成數百萬的化學化合物。
組合化學文庫的制備和篩選對本領域技術人員來說眾所周知(參見,例如,Beeler等人,Curr Opin Chem Biol.,9:277(2005);和Shang等人,Curr Opin Chem Biol.,9:248(2005))。在本發明中使用的文庫可以由氨基酸化合物、核酸化合物、碳水化合物或小的有機化合物組成。碳水化合物文庫已描述于例如Liang等人,Science,274:1520-1522(1996);以及美國專利第5,593,853號中。
示例性的氨基酸化合物文庫包括但不限于,肽文庫(參見,例如,美國專利第5,010,175號;第6,828,422號;和第6,844,161號;Furka,Int.J.Pept.Prot.Res.,37:487-493(1991);Houghton等人,Nature,354:84-88(1991);以及Eichler,Comb Chem High Throughput Screen.,8:135(2005))、類肽(PCT公開號WO 91/19735)、編碼肽(PCT公開號WO 93/20242)、隨機生物寡聚物(PCT公開號WO 92/00091)、聯乙烯多肽(vinylogous polypeptide)(Hagihara等人,J.Amer.Chem.Soc.,114:6568(1992))、具有β-D-葡萄糖骨架的非肽模擬肽(Hirschmann等人,J.Amer.Chem.Soc.,114:9217-9218(1992))、肽核酸文庫(參見,例如,美國專利第5,539,083號)、抗體文庫(參見,例如,美國專利第6,635,424號和第6,555,310號;PCT申請第PCT/US96/10287號;和Vaughn等人,Nature Biotechnology,14:309-314(1996))以及肽基膦酸酯(Campbell等人,J.Org.Chem.,59:658(1994))。
代表性的核酸化合物文庫包括但不限于,基因組DNA文庫、cDNA文庫、mRNA文庫、抑制性RNA(例如,RNAi,siRNA)文庫和反義RNA文庫。參見,例如,Ausubel編著的《分子生物學實驗指南》(Current Protocols in Molecular Biology),1987-2005,Wiley Interscience;和Sambrook和Russell,《分子克隆:實驗室手冊》(Molecular Cloning:A Laboratory Manual),2000,Cold Spring Harbor Laboratory Press。核酸文庫描述于例如美國專利第6,706,477號;第6,582,914號;和第6,573,098號。cDNA文庫描述于例如美國專利第6,846,655號;第6,841,347號;第6,828,098號;第6,808,906號;第6,623,965號;和第6,509,175號。RNA文庫(例如,核酶文庫、RNA干擾文庫或siRNA文庫)描述于例如Downward,Cell,121:813(2005)以及Akashi等人,Nat.Rev.Mol.Cell Biol.,6:413(2005)。反義RNA文庫描述于例如美國專利第6,586,180號和第6,518,017號。
代表性的小的有機分子文庫包括但不限于:多樣體(diversomer),如乙內酰脲、苯二氮卓和二肽(Hobbs等人,Proc.Nat.Acad.Sci.USA,90:6909-6913(1993));小化合物文庫的類似有機合成物(Chen等人,J.Amer.Chem.Soc.,116:2661(1994));寡氨基甲酸酯(oligocarbamate)(Cho等人,Science,261:1303(1993));苯二氮卓(例如,美國專利第5,288,514號;和Baum,C&EN,Jan 18,第33頁(1993));類異戊二烯(例如,美國專利第5,569,588號);噻唑啉二酮(thiazolidinone)和間噻唑酮(metathiazanone)(例如,美國專利第5,549,974號);吡咯烷(例如,美國專利第5,525,735號和第5,519,134號);嗎啉代化合物(例如,美國專利第5,506,337號);四環苯并咪唑(例如,美國專利第6,515,122號);dihydrobenzpyran(例如,美國專利第6,790,965號);胺類(例如,美國專利第6,750,344號);苯基化合物(例如,美國專利第6,740,712號);吡咯類(例如,美國專利第6,683,191號);吡啶甲酰胺或磺酰胺(例如,美國專利第6,677,452號);2-氨基苯并噁唑(例如,美國專利第6,660,858號);異吲哚、isooxyindole或isooxyquinoline(例如,美國專利第6,667,406號);噁唑烷酮類(例如,美國專利第6,562,844號);以及羥胺(例如,美國專利第6,541,276號)。
制備組合文庫的裝置可商購獲得。參見,例如,來自Advanced Chem.Tech(Louisville,KY)的357MPS和390MPS、來自Rainin Instruments(Woburn,MA)的Symphony、來自Applied Biosystems(Foster City,CA)的433A以及來自Millipore(Bedford,MA)的9050Plus。
可以進一步測試最初被鑒定為拮抗LIF活性的物質以驗證表觀活性。優選地,用合適的基于細胞的模型或動物模型進行此類研究。此類方法的基本模式涉及向作為模型的動物施用在最初篩選期間鑒定的先導化合物,然后確定LIF的活性實際上是否被拮抗。驗證研究中采用的動物模型通常是任何種類的哺乳動物。合適的動物的具體實例包括但不限于,靈長類(例如,黑猩猩、猴等)和嚙齒類(例如,小鼠、大鼠、豚鼠、兔子等)。
施用以及組合療法
治療劑(例如,拮抗LIF的物質)的施用途徑可以是口服施用、腹腔內施用、經皮施用、皮下施用、通過靜脈內或者肌肉內注射施用、通過吸入施用、局部施用、病灶內施用、輸注;脂質體介導的遞送;局部施用、鞘內施用、齦袋施用、直腸施用、支氣管內施用、鼻部施用、透粘膜施用、腸道施用、眼部或耳部遞送或者本領域已知的任何其它方法。在一些實施方案中,口服施用、靜脈內施用或者腹腔內施用拮抗LIF的物質。
在一些實施方案中,以治療有效量或劑量施用拮抗LIF的物質。可以使用下述每日劑量范圍:約0.01mg/kg至約500mg/kg,或者約0.1mg/kg至約200mg/kg,或者約1mg/kg至約100mg/kg,或者約10mg/kg至約50mg/kg。然而,劑量可以根據一些因素而改變,包括所選的施用途徑、組合物劑型、患者應答、病況的嚴重性、對象的體重以及處方醫師的判斷。根據個體患者的需要,劑量可以隨時間增加或降低。在某些情況下,最初給予患者低劑量,然后增加至患者可耐受的有效劑量。有效量的確定完全在本領域技術人員的能力內。
在一些實施方案中,將拮抗LIF的物質與第二治療劑組合施用。在一些實施方案中,第二治療劑是化療劑。在一些實施方案中,化療劑是烷化劑(例如,環磷酰胺、異環磷酰胺、苯丁酸氮芥、白消安、美法侖、氮芥、烏拉莫司汀、塞替派、亞硝基脲或替莫唑胺)、蒽環類藥物(例如,多柔比星、阿霉素、柔紅霉素、表柔比星或米托蒽醌)、細胞支架干擾物(例如,紫杉醇或多西紫杉醇)、組蛋白脫乙酰酶抑制劑(例如,伏立諾他或羅米地辛)、拓撲異構酶的抑制劑(例如,伊立替康、拓撲替康、安吖啶、依托泊苷或替尼泊苷)、激酶抑制劑(例如,硼替佐米、埃羅替尼、吉非替尼、伊馬替尼、維羅非尼(vemurafenib)或維莫德吉(vismodegib))、核苷類似物或前體類似物(例如,阿扎胞苷、硫唑嘌呤、卡培他濱、阿糖胞苷、氟尿嘧啶、吉西他濱、羥基脲、巰嘌呤、甲氨蝶呤或硫鳥嘌呤)、肽抗生素(例如,放線菌素或博來霉素)、基于鉑的藥劑(例如,順鉑、奧沙利鉑(oxaloplatin)或卡鉑)或者植物生物堿(例如,長春新堿、長春堿、長春瑞濱、長春地辛、鬼臼毒素、紫杉醇或多西紫杉醇)。在一些實施方案中,化療劑是核苷類似物。在一些實施方案中,化療劑是吉西他濱。
可以一起施用或者分開施用、同時施用或者在不同的時間施用共施用的治療劑(例如,拮抗LIF的物質,以及如本文所述的第二治療劑)。當施用時,視需要,可以每天單獨施用治療劑一次、二次、三次、四次或者更多或更少次。在一些實施方案中,每天施用一次所施用的治療劑。在一些實施方案中,在同一時間或者同時施用所施用的治療劑,例如以混合物的形式。在一些實施方案中,以持續釋放制劑的形式施用治療劑中的一種或多種。
在一些實施方案中,將拮抗LIF的物質與第二治療劑同時施用。在一些實施方案中,首先施用拮抗LIF的物質,例如在施用第二治療劑(例如,化療劑)之前約1、2、3、4、5、6、7、8、9、10、15、20、25、30、40、50、60、70、80、90、100天或者更多天施用。在一些實施方案中,首先施用第二治療劑(例如,化療劑),例如在施用拮抗LIF的物質之前約1、2、3、4、5、6、7、8、9、10、15、20、25、30、40、50、60、70、80、90、100天或者更多天施用。
在一些實施方案中,在延長的時段內,向對象施用拮抗LIF的物質(以及任選地如本文所述的第二治療劑,例如化療劑),例如,持續至少30、40、50、60、70、80、90、100、150、200、250、300、350天或更久。
IV.組合物和試劑盒
另一方面,提供用于治療或預防對象中的癌癥(例如,表達或過表達K-Ras的癌癥)的組合物和試劑盒。
在一些實施方案中,提供包含拮抗LIF的物質的藥物組合物,其用于向患有癌癥(例如,表達或過表達野生型K-Ras或突變型K-Ras的癌癥)的對象施用。在一些實施方案中,拮抗LIF的物質(例如,抗LIF抗體)如以上第III部分中所述。在一些實施方案中,通過用合適的藥學可接受的載體或稀釋劑來配制而將拮抗LIF的物質與第二治療劑(例如,如本文所述的化療劑)的組合共同或者分別配制為藥物組合物,并且其可被配制為固體、半固體、液體或氣體形式的制劑,如片劑、膠囊、丸劑、粉劑、顆粒劑、糖錠劑、凝膠、膏劑、軟膏、溶液、栓劑、注射劑、吸入劑以及氣霧劑。
制備用于本發明的制劑的指導見于,例如,以上Remington:The Science and Practice of Pharmacy,第21版,2006;Martindale:The Complete Drug Reference,Sweetman,2005,London:Pharmaceutical Press;Niazi,Handbook of Pharmaceutical Manufacturing Formulations,2004,CRC Press;以及Gibson,Pharmaceutical Preformulation and Formulation:A Practical Guide from Candidate Drug Selection to Commercial Dosage Form,2001,Interpharm Press,在此將其通過引用并入本文。可以以本領域技術人員已知的方式,即通過常規的混合、溶解、粒化、糖錠制備、水飛、乳化、包封、截留或凍干法來制備本文所述的藥物組合物。下述方法和賦形劑僅是示例性的,并且絕非限制性的。
在一些實施方案中,將拮抗LIF的物質(以及任選地如本文所述的第二治療劑,例如化療劑)制備為以持續釋放制劑、控釋制劑、延長釋放制劑、定時釋放制劑或延遲釋放制劑的形式遞送,例如,以含有治療劑的固體疏水聚合物的半滲透基質的形式遞送。已建立不同類型的持續釋放材料,并且其為本領域技術人員所熟知。當前延長釋放制劑包括薄膜衣片、多顆粒或顆粒系統、使用親水或親脂材料的基質技術以及含有成孔賦形劑的基于蠟的片劑(參見,例如,Huang等人,Drug Dev.Ind.Pharm.29:79(2003);Pearnchob等人,Drug Dev.Ind.Pharm.29:925(2003);Maggi等人,Eur.J.Pharm.Biopharm.55:99(2003);Khanvilkar等人,Drug Dev.Ind.Pharm.228:601(2002);以及Schmidt等人,Int.J.Pharm.216:9(2001))。基于持續釋放遞送系統的設計,其可以在數小時或數天的進程內,例如在4、6、8、10、12、16、20、24小時或更久釋放化合物。通常,可以使用天然存在的或合成的聚合物來制備持續釋放制劑,所述聚合物例如,聚合的乙烯基吡咯烷酮,如聚乙烯吡咯烷酮(PVP);羧乙烯基親水聚合物;疏水性和/或親水性水膠體(hydrocolloid),如甲基纖維素、乙基纖維素、羥丙基纖維素和羥丙基甲基纖維素;以及羧聚亞甲基。
也可利用天然成分來制備持續釋放或延長釋放制劑,所述天然成分如礦物質,包括二氧化鈦、二氧化硅、氧化鋅和粘土(參見,美國專利6,638,521,將其通過引用并入本文)。示例性的延長釋放制劑包括美國專利第6,635,680號;第6,624,200號;第6,613,361號;第6,613,358號;第6,596,308號;第6,589,563號;第6,562,375號;第6,548,084號;第6,541,020號;第6,537,579號;第6,528,080號以及第6,524,621號中所述的那些,在此將以上美國專利各自通過引用并入本文。示例性的控釋制劑包括美國專利第6,607,751號;第6,599,529號;第6,569,463號;第6,565,883號;第6,482,440號;第6,403,597號;第6,319,919號;第6,150,354號;第6,080,736號;第5,672,356號;第5,472,704號;第5,445,829號;第5,312,817號以及第5,296,483號中所述的那些,在此將以上美國專利各自通過引用并入本文。本領域技術人員將容易地識別其它適用的持續釋放制劑。
對于口服施用而言,可以通過與本領域熟知的藥學可接受的載體組合容易地配制拮抗LIF的物質(以及任選地如本文所述的第二治療劑,例如化療劑)。此類載體使得化合物可被配制為片劑、丸劑、糖錠劑、膠囊、乳狀液、親脂和親水性懸液、液體、凝膠、糖漿、膏劑、懸液等,以被待治療的患者口服攝取。可以通過下述獲得用于口服使用的藥物制劑:將化合物與固體賦形劑混合,任選地研磨得到的混合物,并且如果需要在添加合適的助劑之后處理顆粒混合物,以獲得片劑或糖錠劑核心(dragee core)。合適的賦形劑包括,例如,填充劑,如糖,包括乳糖、蔗糖、甘露醇或山梨醇;纖維素制劑,如例如,玉米淀粉、小麥淀粉、米淀粉、馬鈴薯淀粉、明膠、黃蓍膠、甲基纖維素、羥丙基甲基纖維素、羧甲基纖維素鈉和/或聚乙烯吡咯烷酮(PVP)。如果需要,可以添加崩解劑,如交聯的聚乙烯吡咯烷酮、瓊脂或者海藻酸或其鹽,如海藻酸鈉。
可將拮抗LIF的物質(以及任選地如本文所述的第二治療劑,例如化療劑)配制為通過注射腸胃外施用,所述注射例如通過彈丸注射或連續輸注。對于注射而言,可以通過在水性或非水性溶劑中溶解、懸浮或乳化化合物而將其配制為制劑,所述水性或非水性溶劑,如植物油或其它類似的油、合成的脂肪酸甘油酯、高級脂肪酸酯或丙二醇;以及如果需要,含有常規的添加劑,如增溶劑、等滲劑、懸浮劑、乳化劑、穩定劑和防腐劑。在一些實施方案中,可在水溶液,優選生理上可兼容的緩沖液,如漢克斯液、林格氏液或生理鹽水緩沖液中配制化合物。用于注射的制劑可以以單位劑型存在,例如,存在于安瓿或者存在于多劑量容器中,含有添加的防腐劑。組合物可以采取如下形式:油性或水性介質中的懸液、溶液或乳狀液,并且可以包含配制劑(formulatory agent),如懸浮劑、穩定劑和/或分散劑。
可以通過透粘膜或者經皮方式全身施用拮抗LIF的物質(以及任選地如本文所述的第二治療劑,例如化療劑)。對于透粘膜或者經皮施用而言,在制劑中使用適于待滲透的屏障的滲透劑。對于局部施用而言,將物質配制為軟膏、霜劑、藥膏、粉劑和凝膠。在一個實施方案中,經皮遞送劑可以是DMSO。經皮遞送系統可以包括,例如貼劑。對于透粘膜施用而言,在制劑中使用適于待滲透的屏障的滲透劑。此類滲透劑在本領域通常是已知的。示例性的經皮遞送制劑包括美國專利第6,589,549號;第6,544,548號;第6,517,864號;第6,512,010號;第6,465,006號;第6,379,696號;第6,312,717號以及第6,310,177號中所述的那些,在此,將上述美國專利各自通過引用并入本文。
在一些實施方案中,藥物組合物包含可接受的載體和/或賦形劑。藥學可接受的載體包括生理上可兼容的并且優選不干擾或者以其它方式抑制治療劑的活性的任何溶劑、分散介質或包衣。在一些實施方案中,載體適于靜脈內施用、肌肉內施用、口服施用、腹腔內施用、經皮施用、局部施用或者皮下施用。藥學可接受的載體可以包含一種或多種生理上可接受的化合物,所述組合物發揮例如穩定組合物或者增加或降低活性劑的吸收的作用。生理上可接受的組合物可以包括,例如碳水化合物,如葡萄糖、蔗糖或葡聚糖;抗氧化劑,如抗壞血酸或谷胱甘肽;螯合劑;低分子量蛋白;減少活性劑的清除或水解的組合物;或者賦形劑或其它穩定劑和/或緩沖劑。其它藥學可接受的載體及其制劑眾所周知,并且通常描述于,例如,Remington:The Science and Practice of Pharmacy,第21版,Philadelphia,PA.Lippincott Williams&Wilkins,2005中。各藥學可接受的賦形劑在本領域眾所周知,并且可見于,例如Handbook of Pharmaceutical Excipients(第5版,Ed.Rowe等人,Pharmaceutical Press,Washington,D.C.)。
在一些實施方案中,提供用于向患有癌癥(例如,表達或過表達野生型K-Ras或突變型K-Ras的癌癥)的對象施用的試劑盒。在一些實施方案中,試劑盒包含:
拮抗白血病抑制因子(LIF)的物質;以及
第二治療劑。
在一些實施方案中,拮抗LIF的物質(例如抗LIF抗體)如以上第III部分所述。在一些實施方案中,第二治療劑是化療劑。在一些實施方案中,化療劑是烷化劑、蒽環類藥物、細胞支架干擾物、組蛋白脫乙酰酶抑制劑、拓撲異構酶抑制劑、激酶抑制劑、核苷類似物或前體類似物、肽抗生素、基于鉑的物質或者植物生物堿。在一些實施方案中,化療劑是核苷類似物。在一些實施方案中,化療劑是吉西他濱。
在一些實施方案中,試劑盒還可以包括說明性材料,其含有實踐本發明的方法的指導(即,方案)(例如使用試劑盒治療癌癥的說明)。盡管說明性材料通過包括書面材料和打印材料,但是它們不限于此。本發明考慮能夠存儲此類說明并將其傳訊給終端用戶的任何介質。此類介質包括但不限于電子存儲介質(例如,磁盤、錄音帶、膠卷、芯片)、光學介質(例如,CD ROM)等。此類介質可以包含提供此類說明性材料的網站地址。
V.實施例
提供下述實施例以闡述但不限制所保護的發明。
實施例1:靶向白血病抑制因子(LIF)以消除表達致癌K-Ras的胰腺細胞
K-Ras的激活突變出現在超過90%的胰腺癌中,但是難以發展靶向致癌K-Ras的有效方法。因此,鑒定K-Ras介導的惡性腫瘤的必需因子可能提供封阻該“無藥可靶向的(undruggable)”癌基因的替代方法。具有高度序列同源性以及共同的下游效應物和上游影響物組的Ras的三種同種型(N-Ras、H-Ras和K-Ras)長期以來被假設是功能上冗余的。然而,小鼠中的K-Ras(非N-Ras或H-Ras)缺陷導致胚胎致死,提示K-Ras可能是干細胞的功能所需的(Koera等人,Oncogene 15:1151-1159(1997))。已在大量的人類惡性腫瘤(包括胰腺腺癌(PADC))中鑒定了癌癥干細胞(CSC),所述癌癥干細胞與正常干細胞共有某些類似的基因表達特征和生物學功能(Sampieri和Fodde,Semin Cancer Biol 22:187-193(2012))。由于它們的自我更新、腫瘤起始、化學抗性和轉移特性,CSC被假設為治療失敗的原因。盡管K-Ras激活在胰腺癌變中具有推定的作用,但是致癌K-Ras在胰腺CSC中的作用尚未被令人信服地證實。在初步研究中,我們發現,與H-Ras不同,致癌K-Ras在轉化的小鼠成纖維細胞和胰腺癌細胞中引起CSC樣特性(數據未示出)。
信號傳導與轉錄激活因子3(STAT3)是干細胞自我更新、癌細胞存活和轉移的關鍵調節子。大多數PDAC顯示STAT3的組成型激活。在Pdx1-Cre;LSL-KRASG12D轉基因小鼠模型中,STAT3的損失減少了胰腺腫瘤的形成和發展,這暗示其作為致癌K-Ras誘導的胰腺癌的治療靶標的潛能(Corcoran等人,Cancer Res 71:5020-5029(2011))。然而,迄今為止報道的大多數STAT3抑制劑呈現有限的臨床功效。因此,需要抑制STAT3的可選方法作為潛在的抗胰腺癌療法。
通過RasV12轉化的NIH3T3細胞中的全基因組表達分析,我們將鑒定了白血病抑制因子(LIF)(干細胞調節性趨化因子和STAT3激活劑),鑒定為明顯不受K-Ras調控的因子,但是并非明顯不受H-Ras調控的因子(圖1A)。而且,與由致癌B-Raf誘導的LIF表達相比,致癌K-Ras誘導的小鼠PDAC顯示增加的LIF表達(圖1C)。進一步的研究表明,在胰腺癌細胞中,K-Ras介導的干細胞特性(包括球形成能力和耐藥性)需要LIF(圖1F-1G)。在同系動物模型中,原位移植有已敲低LIF的K-Ras驅動的mPDAC的小鼠顯示出較高的存活可能性,以及受損的脾臟轉移(圖1H)。
基于這些初步數據,我們假設LIF在具有激活的K-Ras的胰腺癌細胞的干細胞特性中發揮重要作用。因此,LIF代表了根除K-Ras-驅動的胰腺癌的新治療靶標。為了測試該假設,我們通過在由突變K-Ras驅動的小鼠胰腺癌細胞中經小發夾RNA敲低LIF來驗證作為K-Ras驅動的胰腺癌的治療靶標的LIF(FVB背景;LSC-K-RasG12D;p53F/+,pDXCRE)。通過定量PCR和蛋白印跡分析證實敲低效率。在多種人胰腺癌系中,通過shRNA敲低K-Ras抑制了LIF的蛋白表達(圖2A-2E)。此外,LIF ELISA揭示,與對照細胞相比,K-Ras表達敲低的人胰腺癌細胞系在培養基中分泌顯著減少的LIF(圖2F)。
通過蛋白印跡并使用STAT3響應的熒光素酶分析來檢驗STAT3的水平和磷酸化。蛋白印跡分析和磷酸化-STAT熒光素酶報告子分析指示,K-Ras的表達敲低從而LIF的表達下調的胰腺癌細胞具有降低的磷酸化-STAT3水平(圖2G)和顯著降低的STAT3轉錄活性(圖2H)。
為了進一步驗證LIF-LIFR信號轉導作為潛在的臨床治療靶標發揮作用,在具有活性K-Ras突變的人胰腺癌細胞系中,也經小發夾RNA敲低LIF(圖3A)。如圖3B所示,皮下異種移植模型中的PANC2.03的無瘤生存曲線提示,當與對象細胞相比時,LIF表達敲低的癌細胞具有顯著降低的腫瘤起始能力。此外,當與對照腫瘤相比時,LIF表達敲低的皮下異種移植物中的胰腺腫瘤以顯著較慢的速率生長(圖3C)。此外,LIF表達的敲低降低了原位模型中PANC1驅動的腫瘤中的腫瘤起始速率(圖3D)。
在胰腺癌細胞中分析對吉西他濱的應答。如圖4中所示,MTS分析提示,當與對照細胞相比時,LIF的敲低使PANC2.03細胞對吉西他濱的處理敏感。還在小鼠模型中測試了LIF中和抗體的效果。如圖5B中所示,在接種腫瘤之前,將抗LIF抗體注入裸鼠時,其顯著阻止了腫瘤起始。在藥物敏化分析中,將PANC2.03細胞皮下注入裸鼠以形成腫瘤,然后用抗LIF抗體、吉西他濱或者抗LIF抗體和吉西他濱的組合處理小鼠。吉西他濱和抗LIF抗體的組合處理引起十分之八的腫瘤的完全消退,而單獨的抗LIF抗體或單獨的吉西他濱不引起腫瘤消退(圖5C)。此外,吉西他濱和抗LIF抗體的組合處理顯著降低了腫瘤增殖率,而用吉西他濱單獨處理的腫瘤仍具有陽性生長率(圖5E-5F)。
我們使用在線軟件OncomineTM(Invitrogen)分析不同的公開的數據集(如在圖6A-I中所示)。OncomineTM是在線數據庫,其收集了大量公開的全基因組微陣列數據。收集的數據由其它研究組檢查并公布。有趣的是,在多個微陣列平臺和公開的數據庫中,我們發現,人LIF在不同類型的癌癥(包括結腸癌和胰腺癌)中過表達。而且,如圖6I所示,當與具有野生型K-Ras表達的癌癥細胞系相比時,在建立的具有突變的K-Ras的癌癥細胞系中,LIF在mRNA水平的表達顯著增加。這些結果提示LIF作為癌基因在不同類型的人類癌癥尤其是K-Ras驅動的腫瘤中的潛在作用。
我們還使用OncomineTM來分析在化療敏感和耐化療的癌癥中LIF在mRNA水平的表達。OncomineTM提供了一些數據集,其具有化療敏感和耐化療的腫瘤樣品的基因特性。有趣的是,如在圖7A-D中所示,當與化療敏感的腫瘤相比時,LIF的表達在耐不同化療處理的腫瘤中更高,這暗示LIF在耐化療的癌癥中可能發揮重要作用。因此,用中和抗體靶向LIF可以使腫瘤細胞對常規的化療處理重新敏感。
盡管出于清楚理解的目的,已通過說明和實例在一定程度上詳細描述了前述發明,但是本領域技術人員將理解,可以在所附權利要求的范圍內進行某些改變和修改。此外,將本文提供的各參考文獻通過引用整體并入,其程度如同將各參考文獻通過引用單獨并入。
- 還沒有人留言評論。精彩留言會獲得點贊!