醫用敷料的制作方法
發明領域
本發明涉及醫用敷料。
發明背景
由損傷或疾病引起的創傷可以通過使用繃帶或創傷敷料處理從而通過防止感染和來自創傷的泄露而促進愈合。許多已知的創傷敷料包括自粘附粘合劑,也稱為壓敏膠(psa),其目的是粘附至創傷和/或創傷周圍的皮膚,并由此將敷料固定在所需位置。多種粘合劑被用于將醫療產品附著在皮膚上,這之中被這些術語涵蓋的最常見的一些是丙烯酸類粘合劑、有機硅系粘合劑和熱熔粘合劑。
為了確保醫療器材如創傷敷料在使用一段時間之后保持在相同位置,可以使用具有強粘附性的粘合劑例如丙烯酸類粘合劑。然而,在醫療器材要直接附著在皮膚上的情況下,當這樣的醫療器材要從皮膚移除時,例如由于皮膚剝離,丙烯酸系粘合劑增加疼痛的風險和對皮膚的損害。
與丙烯酸類粘合劑相反,有機硅系粘合劑在本領域已知是對皮膚非常溫和的。這是因為有機硅系粘合劑通常相對柔軟并且因此它可以良好地遵循皮膚輪廓,導致在粘合劑和皮膚之間的大接觸表面積。因此,盡管在有機硅系粘合劑的每個接觸點中的實際粘附力小于丙烯酸類粘合劑的粘附力,但是利用有機硅系粘合劑實現的大接觸表面積對皮膚提供高的總體粘附性,同時是皮膚友好的,即當有機硅系粘合劑從皮膚移除時,由于在每個接觸點中的低粘附力所致,極少的皮膚細胞被移除,由此可以避免上述的皮膚剝離的問題。
對于一些類型的創傷,如例如嚴重燒傷和慢性創傷,特別需要使用包括抗微生物劑的創傷敷料,由此消除或降低創傷感染的風險。為此目的,已經開發了多種類型的抗微生物敷料。已被探索用于創傷敷料的抗微生物劑的實例包括常規殺菌劑、抗生素、抗微生物肽,或具有抗微生物性的金屬劑。例如,含銀化合物,如銀鹽,常用于抗微生物創傷敷料。
wo2008057155公開了用于暫時將醫療器材粘附至生物基材如皮膚的硅凝膠形成組合物。所述公開內容教導了硅凝膠組合物,其包含活性劑,例如抗生素、抗菌劑、抗真菌劑、抗炎劑、激素、抗癌劑、組胺阻斷劑、β阻斷劑、維生素、鎮靜劑、止痛劑、蛋白水解酶和肽,其可以結合到組合物中。然而,活性劑從疏水性粘附基質,即硅凝膠形成組成的釋放通常受限制,因為活性劑結合到組合物中。
wo2011/129759公開了一種抗微生物硅凝膠粘合劑(和包括這樣的硅凝膠粘合劑的層的創傷敷料),其包含至少一種銀鹽和至少一種親水性組分,其中所述親水性組分有利于在粘合劑層中吸收濕氣并由此提供銀從該粘附基質的改進釋放。
然而,本領域仍然需要提供改進的粘附性醫用敷料。
發明概述
鑒于現有技術的上述和其他缺陷,本發明的總體目的是提供粘附性醫用敷料,特別是提供能夠實現化合物如抗微生物化合物的瞬間釋放和持續釋放,同時維持化合物在敷料中的存在的粘附性醫用敷料。
根據本發明的第一方面,這些和其他目的通過一種醫用敷料實現,所述醫用敷料包括包含第一化合物的基材,所述基材具有第一表面,其中所述醫用敷料還包括具有面向皮膚的表面的粘合劑層以將醫用敷料粘附至皮膚表面,其中所述面向皮膚的表面的至少一部分包括包含第二化合物的涂層。
本發明基于這樣的認識,即一種或多種活性化合物的改善的釋放和/或來自粘附性醫用敷料的改善生物學活性(例如抗微生物和/或創傷愈合活性)可以通過組合包含第一化合物的內基材與具有面向皮膚的表面的粘合劑層實現,所述面向皮膚的表面包括包含第二化合物的涂層,該涂層用于在使用期間與創傷直接接觸和/或包圍皮膚表面。由此,粘合劑層上的涂層提供第二化合物的快速釋放同時內基材提供第一化合物的較慢釋放以確保其釋放在所需時間段內維持和/或來自其的生物(例如抗微生物)活性在內基材內維持。
在本發明的實施方案中,基材的第一表面面向粘合劑層,并且粘合劑層的面向皮膚的表面背向基材的第一表面。
在本發明的實施方案中,粘合劑層可以包含有機硅系粘合劑。本發明的發明人已意識到,有機硅系粘合劑是特別適合的,因為化合物可以被包含在其上的涂層中而沒有實質性地影響粘合劑層的粘合性,同時化合物可以容易地從其釋放。
在本申請的上下文中,術語“涂層”應被理解為在表面上的至少一個連續層,或者多個點或層,或者在表面上的不連續覆蓋,例如分布在表面的區域上的多個粒子。
在本發明的實施方案中,在粘合劑層的面向皮膚的表面的至少一部分上的包含第二化合物的涂層可以包含分布在面向皮膚的表面的至少一部分上的第二化合物的多個粒子,其中各個粒子的第一部分可以滲入到粘合劑層中,同時該粒子的第二部分可以從粘合劑層突出。
在本發明的實施方案中,在粘合劑層上的包含第二化合物的涂層可以例如是薄膜涂層,所述薄膜涂層包含第二化合物和薄膜形成化合物或載體化合物(例如聚合物化合物)的組合物。
在本發明的實施方案中,基材可以包含吸收劑材料。例如,吸收劑材料可以是聚合物泡沫如親水性聚氨酯泡沫、無紡材料、纖維材料如纖維親水性聚合物材料、凝膠形成纖維、水凝膠、含水膠體的基質、機織和針織纖維,或其組合。由此,醫用敷料能夠吸收并保持來自創傷的滲出物。
如本文中使用的,術語“親水的”是指材料的水滲透性或分子的水吸引性。在具有孔隙的材料(如,例如,開放小孔泡沫)或具有通孔的材料的上下文中,如果材料吸水,則這樣的材料是“親水的”。在沒有孔隙或任何通孔的材料的上下文中,如果它不抗拒水流入或流過該材料,則這樣的材料被認為是“親水的”。例如,材料的親水性可以使用在材料上施加壓力持續至少60分鐘、至少90分鐘或至少24小時的多至一英寸高的水柱測試。“抗拒”意指在這樣的試驗中水進入或通過泡沫的任何流動低于試驗的檢測限。
在本發明的實施方案中,基材可以包括親水性聚氨酯泡沫材料的層。例如,親水性泡沫可以是開放小孔多孔泡沫如親水性聚氨酯泡沫。該泡沫可以例如是由包含基于以下各項的預聚物的組合物制備的聚氨酯泡沫:六亞甲基二異氰酸酯(hdi)、甲苯二異氰酸酯(tdi)或二苯甲烷二異氰酸酯(mdi)。
在本發明的實施方案中,粘合劑層可以是在基材的第一表面的至少一部分上的涂層,由此促進將敷料應用至皮膚表面,例如創傷部位,并且將醫用敷料的基材固定至所需位置,例如,使得基材粘附至并覆蓋創傷。通過在粘合劑層的面向皮膚的表面上提供包含第二化合物,如例如抗微生物化合物或創傷愈合化合物的涂層,第二化合物的釋放可以被控制并限制至所需應用區域。
在本發明的實施方案中,醫用敷料可以還包括夾在基材的第一表面和粘合劑層之間的穿孔膜層,其中粘合劑層是在穿孔膜層的未穿孔部分上的涂層。例如,穿孔膜層的頂表面可以附著至基材的第一表面,其中粘合劑層可以涂覆在穿孔膜的未穿孔部分的底表面上,并且其中穿孔膜層的頂表面與其底表面相反或背向其底表面。
因此,基材的第一表面可以通過穿孔膜層的開口暴露,由此促進來自創傷的滲出物和創傷流體的吸收,和/或促進第一化合物從基材通過開口至創傷的釋放。
如本文中使用的,術語“附著”應被理解為一個物理元件與另一個物理元件接觸,例如,第一個層與相鄰的第二個層接觸。例如,在本發明的實施方案中,術語“附著”可以意指一個層借助于附著層之間的粘合劑粘附或層壓至另一個層,備選地兩個層可以在其間沒有直接粘合手段的情況下“附著”,例如,一個層可以置于另一個層的頂部,其中這些層通過包封這些“附著”層的另外的包圍層而保持在一起。
在本發明的實施方案中,第一化合物可以分布或結合到基材內。
在本發明的實施方案中,第一化合物可以是在基材中的固體分散體。第一化合物可以是基材中的基本上均質的固體分散體。例如,第一化合物可以是基材中的分子分散體或部分分子分散體。“分子分散體”應被理解為化合物的分離分子,并且“部分分子分散體”應被理解為多個分離分子以及分子的多個分離簇,例如晶體或粒子。
在本發明的實施方案中,基材可以用第一化合物浸漬。例如,基材可以是具有開放小孔結構的泡沫,其中第一化合物可以作為該泡沫的小孔壁上的涂層存在。例如,基材可以用含有第一化合物的溶液或分散液浸泡。
在本發明的實施方案中,基材的第一表面可以包括包含第一化合物的涂層。在涂層存在于多孔材料(例如泡沫)上的情況下,涂層可以,至少在一定程度上,滲入到該材料的總體表面下方,例如涂層可以覆蓋泡沫結構中的開口或孔隙中的壁的至少一部分。例如,在本發明的實施方案中,第一化合物可以在基材的第一表面上僅作為涂層存在,或者第一化合物可以作為基材的第一表面上的涂層和分布在基材內二者存在,由此可以實現第一化合物的濃度梯度,其中第一化合物可以在基材的第一表面上以較高濃度存在,因此進一步促進自其的釋放,同時在基材塊體中的較低濃度提供可以緩慢釋放至創傷和/或在基材內發揮其活性(例如抗微生物活性)的第一化合物的來源(battery)。
在本發明的實施方案中,基材可以包括相同或不同材料的多個層。例如,基材可以包括吸收性泡沫材料的創傷面向層、中間纖維凝膠形成層和頂部無紡層,其中中間層可以夾在創傷面向層和頂部層之間。由此醫用敷料的液體吸收性可以如所需地改變。此外,第一化合物可以與基材的全部或僅所選層結合從而實現從基材的所需釋放和/或在基材內的所需活性。
在本發明的實施方案中,第一化合物和/或第二化合物可以是抗微生物化合物。
在本發明的實施方案中,醫用敷料是抗微生物敷料。
在本發明的實施方案中,第一化合物和第二化合物可以獨立地選自由以下各項組成的組:銀化合物如銀鹽和金屬銀,雙胍鹽如聚六亞甲基雙胍(phmb)或其任何鹽,或聚六甲基胍(phmg)或其任何鹽,或氯己定或其任何鹽,碘,水楊酸或其任何鹽,乙酰水楊酸或其任何鹽,季銨鹽如芐索氯銨,聚維酮碘,乳鐵蛋白,木糖醇,抗微生物肽如人陽離子性抗微生物蛋白18(稱為hcap18或ll37),冰片,堿式沒食子酸鉍,抗真菌藥物,以及抗生素如慶大霉素,鏈霉素。
在本發明的實施方案中,第一化合物和第二化合物可以獨立地選自由以下各項組成的組:銀化合物包括例如銀鹽和金屬銀;雙胍鹽如phmb或其任何鹽,或phmg或其任何鹽;氯己定或其任何鹽;和碘。
例如,第一化合物和/或第二化合物可以是銀鹽如硫酸銀(ag2so4),亞硫酸銀(ag2so3),硝酸銀(agno3),碳酸銀(agco3),磷酸銀(ag3po4),氯化銀(agcl),磷酸鋯氫鈉銀(silversodiumhydrogenzirconiumphosphate)(
例如,第一化合物和/或第二化合物可以是銀化合物,例如銀鹽或金屬銀。
在本發明的實施方案中,第一化合物可以在醫用敷料的區域以第一濃度存在并且第二化合物可以在醫用敷料的區域以第二濃度存在,其中第一和第二濃度可以不同。例如,第一化合物的濃度可以為約5至3000μg/cm2,并且其中第二化合物的濃度可以為約1至2500μg/cm2。通過改變第一和第二化合物的濃度,敷料的釋放曲線可以對于不同應用,即不同類型的創傷進行調整。
在本發明的實施方案中,第一化合物可以在醫用敷料的區域以第一濃度存在并且第二化合物可以在醫用敷料的區域以第二濃度存在,其中所述第一濃度可以高于所述第二濃度。
如本文中使用的,術語“約”或“大約”是指,例如,這樣的數值或百分比,其通常包括落入在該數值的任一方向(正或負)的5%、10%或20%范圍內的數值,除非另有說明或從上下文另外明顯的(除了其中這樣的數值將是物理上不可能的,例如超過可能值的100%或者落在可能值的0%以下)。
在本發明的實施方案中,粘合劑層可以包含結合在粘合劑層內的第三化合物,其中第三化合物可以與第一和/或第二化合物相同。例如,第三化合物可以是粘合劑層中的固體分散體。
在本發明的實施方案中,醫用敷料可以包括在其第二表面上的附著至基材的蒸汽透過性傳輸層,該第二表面與基材的第一表面相反。傳輸層可以典型地是水透過性的。
根據本發明的第二方面,這些和其他目的通過制造醫用敷料的方法實現,所述方法包括以下步驟:
提供包含第一化合物的基材;提供粘合劑層;和在粘合劑層上提供包含第二化合物的涂層。在本發明的實施方案中,粘合劑層可以包含有機硅系粘合劑。
根據本發明的第三方面,以上提及的和其他的目的通過根據上述方法制造的醫用敷料實現。
根據本發明的第四方面,以上提及的和其他的目的通過根據本發明的醫用敷料用于治療和/或預防創傷的用途實現。例如,根據本發明的醫用敷料可以用于治療燒傷、傷疤、細菌感染、病毒感染、真菌感染和/或用于創傷愈合。
根據本發明的第五方面,以上提及的和其他的目的通過治療創傷的方法實現,所述方法包括將根據本發明的醫用敷料提供到創傷上和/或包圍皮膚表面的步驟。
附圖簡述
參考顯示本發明的示例性實施方案的附圖,現在將更詳細地顯示本發明的這些和其他方面,其中:
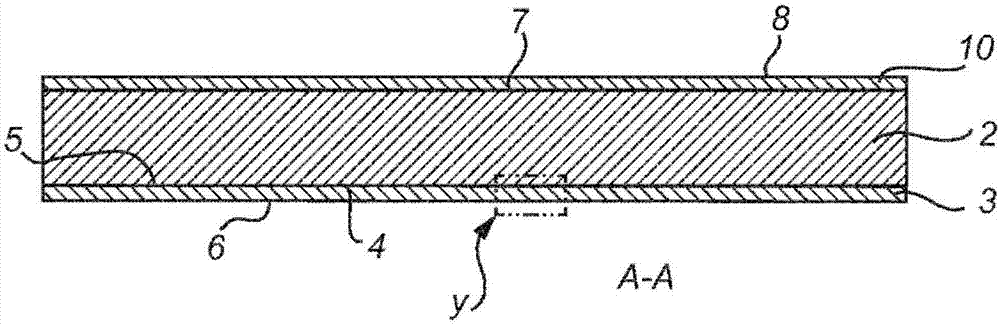
圖1a是根據本發明的醫用敷料的一個實施方案的示意性透視圖;
圖1b是沿著圖1a中的線a-a的剖視圖;
圖1c是圖1b中切出的y的放大剖視圖;
圖2a是根據本發明的醫用敷料的一個實施方案的示意性透視圖;
圖2b是沿著圖2a中的線a’-a’的剖視圖;
圖2c是圖2b中切出的y’的放大剖視圖;和
圖3a-b顯示來自利用根據本發明的醫用敷料的實施方案的抗微生物活性試驗的結果。
發明示例性實施方案描述
在以下描述中,參考所附示意性附圖描述本發明的示例性實施方案。
圖1a-c舉例說明了根據本發明的醫用敷料1的一個示例性實施方案。醫用敷料1包括包含第一化合物的基材2,其中醫用敷料1還包括具有面向皮膚的表面6的粘合劑層3以將醫用敷料1粘附至皮膚表面(當醫用敷料處于使用時),并且其中面向皮膚的表面6的至少一部分包括包含第二化合物的涂層9。在圖1a-c所示的實施方案中,粘合劑層3是在基材2的第一表面4上的涂層,其中粘合劑層3的面向皮膚的表面6背向基材2的第一表面4。圖1a-c的醫用敷料還包括蒸汽透過性傳輸層10,其中蒸汽透過性傳輸層10覆蓋基材2的第二表面7,該第二表面7與基材2的第一表面4相反。蒸汽透過性傳輸層10可以,例如,借助于連續或不連續膠層(例如丙烯酸系粘合劑)或通過熱層壓而附著至第二表面7。
圖2a-c舉例說明了根據本發明的醫用敷料20的一個示例性實施方案。醫用敷料20包括包含第一化合物的基材2,其中醫用敷料20還包括夾在基材2的第一表面4和粘合劑層3之間的穿孔膜層11,并且其中粘合劑層3是在穿孔膜層11的未穿孔部分12上的涂層。如圖2b中所示,穿孔膜層11的頂表面17可以附著至基材2的第一表面4,其中粘合劑層3涂布在穿孔膜層11的未穿孔部分12的底表面18上,并且其中頂表面17和底表面18相對于彼此是相反的。因此,基材2的第一表面4可以通過穿孔膜層11的開口14暴露,由此促進來自創傷的滲出物和創傷流體的吸收,和/或促進第一化合物從基材2通過開口14釋放至創傷。
此外,粘合劑層3的面向皮膚的層6的至少一部分包括包含第二化合物的涂層9,當醫用敷料處于使用時,該涂層9意圖直接接觸創傷和/或包圍皮膚表面。由此,促進第二化合物快速釋放至皮膚表面(當敷料被使用時),同時保持粘合劑層3的粘合性。
如圖2-c中例示的,醫用敷料20可以還包括覆蓋基材2的第二表面7的蒸汽透過性傳輸層10。該透過性傳輸層10可以是塑料薄膜,例如,包含聚氨酯、聚乙烯或聚丙烯或者由其構成。蒸汽透過性傳輸層10可以是具有在10-100μm,例如,10-80μm如10-50μm范圍內的厚度的聚氨酯膜。
在圖2a-b所示的實施方案中,穿孔層11和蒸汽透過性傳輸層10二者延伸到基材2的周邊之外,并且延伸到基材之外的穿孔層11和蒸汽透過性傳輸層10的相應部分附著至彼此,由此形成包圍基材2的邊界部分15。穿孔層11可以借助于連續或不連續膠層(在圖2a-b中未顯示)附著至基材2的第一表面4和/或附著至蒸汽透過性傳輸層10。
例如,在本發明的一個實施方案中,在基材2周邊之外的穿孔層11附著至蒸汽透過性傳輸層10(利用例如丙烯酸系粘合劑)而面向基材2的第一表面4的穿孔層11沒有層壓(借助于例如膠或熱)至第一表面4,因此基材2可以關于穿孔層11是活動的,如果基材在使用中膨脹則這可能例如是期望的。類似地,在本發明的實施方案中,基材2的第二表面7可以活動地附著至蒸汽透過性傳輸層10,即,這些層沒有借助于例如膠或熱層壓而是通過包圍層壓的邊界部分15而保持在一起。
此外,穿孔層11可以包括任何所需尺寸和形狀的多個開口14(或通孔)。所述形狀和尺寸可以適于實現第一化合物從基材2的所需吸收和/或釋放。例如,開口14可以尤其是圓形的、直縫、矩形或方形的。在本發明的實施方案中,穿孔層11中的開口14的尺寸和/或形狀是不同的。例如,在本發明的實施方案中,在敷料20的邊界部分15之中,延伸到基材2的周邊之外的穿孔層11的部分可以包括較少量的開口或較小的開口(未顯示),或者是不具有開口的連續薄膜(未顯示),由此增大在邊界部分15中的穿孔層11的未穿孔部分12的表面積,并由此增大醫用敷料20的保持能力,因為在未穿孔部分12上的粘合劑層3的總面積相應增大。
在本發明的實施方案中,穿孔層可以包括基本上對應于基材的第一表面的面積的開口,其中將穿孔層定位以使基材的第一表面與穿孔層中的開口重合,由此當醫用敷料處于使用時基本上全部的基材的第一表面可以與創傷接觸(實施方案在附圖中未顯示)。
在本發明的實施方案中,穿孔層11可以是具有在10-150μm范圍內的厚度的塑料薄膜。例如,穿孔膜11可以為聚氨酯、聚丙烯或聚乙烯。
在本發明的實施方案中,穿孔層11可以是具有在10-150μm,例如,10-100μm或10-80μm如10-50μm范圍內,例如25μm的厚度的聚氨酯膜。
在本發明的實施方案中,粘合劑層可以與基材的周邊部分相鄰地布置,從而粘合劑層延伸遠離基材的周邊部分。例如,醫用敷料可以是島狀敷料,其中粘合劑層包圍基材的周邊部分。
例如,在本發明的實施方案中,醫用敷料可以包括蒸汽透過性傳輸層,其覆蓋基材的第二表面并且此外延伸到基材的周邊部分之外以限定蒸汽透過性傳輸層的邊界部分。在本發明的這些實施方案中,粘合劑層可以是蒸汽透過性傳輸層的面向皮膚的邊界部分上的涂層(實施方案在附圖中未顯示)。
在本發明的實施方案中,基材2可以典型地包括吸收劑材料。例如,這樣的吸收劑材料可以選自由以下各項組成的組:聚合物泡沫如親水性聚氨酯泡沫,無紡材料,纖維材料如纖維親水性聚合物材料,凝膠形成纖維,水凝膠,含水膠體的基質,機織和針織纖維。
在本發明的實施方案中,基材2可以包括親水性聚氨酯泡沫的層,例如,由包含基于以下的預聚物的組合物制備的聚氨酯泡沫:六亞甲基二異氰酸酯(hdi),甲苯二異氰酸酯(tdi)或二苯甲烷二異氰酸酯(mdi)。
例如,在本發明的實施方案中,基材2可以是親水性聚氨酯泡沫。
在本發明的實施方案中,第一化合物可以分布在基材2內。例如,第一化合物可以基本上均勻地分布在基材2內,即在整個基材2中具有均勻的材料組成。例如,第一化合物可以是在基材2中的基本上均勻的固體分散體,如分子分散體或部分分子分散體。
在本發明的實施方案中,第一化合物可以化學地結合至基材2的結構或內部表面(例如孔隙)。例如,在第一化合物是離子鹽的情況下,第一化合物可以結合至基材2的帶電荷內部表面。例如,基材可以包括具有帶電側基的纖維素纖維,例如羧甲基纖維素(cmc),其中第一化合物可以通過離子鍵結合至纖維素纖維。
在本發明的實施方案中,第一化合物可以通過在制備基材中包括第一化合物而結合到基材中。例如,基材可以是泡沫,其中在發泡步驟之前將第一化合物添加至預聚物(例如根據在ep1964580中公開的方法),由此第一化合物可以結合到基材的結構內,例如化學地結合到泡沫基材的孔壁內。
在本發明的實施方案中,第一化合物可以浸漬在基材2中,例如,第一化合物可以是在基材2的內部表面上的涂層。例如,在基材是泡沫基材的情況下,第一化合物可以是在該泡沫的內部孔隙表面上的涂層。
在本發明的實施方案中,基材2的第一表面4可以包括包含第一化合物的涂層。
在本發明的實施方案中,基材2的第一表面4可以包括包含第一化合物的涂層,其中所述涂層還可以包括載體或薄膜形成化合物。例如,載體或薄膜形成化合物可以是聚合物材料如聚乙烯吡咯烷酮(pvp)、羧甲基纖維素(cmc)、羥乙基纖維素(hec)、聚乙烯醇(pva)和/或羥丙基纖維素(hpc)。載體或薄膜形成化合物可以用于進步改變和控制第一化合物的釋放。
在本發明的實施方案中,第一化合物可以是在基材2的芯內的基本上均勻的固體分散體,并且其中基材2的第一表面4可以包括包含第一化合物的涂層。因此,可以實現在基材內的第一化合物的不同濃度,并且由此可以如所需地改變第一化合物的釋放和/或活性。例如,通過將第一化合物的涂層添加至基材2的第一表面4,在該基材中已經分布了第一化合物,可以在第一表面4處實現第一化合物的第一濃度并且可以在基材2的芯內實現第一化合物的第二濃度,由此可以通過改變第一濃度控制第一化合物從基材2的釋放并且可以通過改變第二濃度確保基材內的第一化合物的活性(例如抗微生物活性)。
在本發明的實施方案中,包含第二化合物的涂層可以為粒子(例如晶體或沉淀物)的形式,其中各個粒子9的至少一部分滲入到粘合劑層3中,同時該粒子的第二部分從粘合劑層3在其面向皮膚的表面6的上方往外突出。因此,由于包含第二化合物的涂層在粘合劑層3上和/或從粘合劑層3往外突出,所以促進第二化合物從粘合劑層3的面向皮膚的表面6的釋放。
在本發明的實施方案中,如圖1c中所示,粘合劑層3可以包括靠近面向皮膚的表面6的皮膚部分22(其包括粘合劑層3的粘合材料),和靠近與面向皮膚的表面4相對的粘合劑層3的非面向皮膚的表面5的非皮膚部分23(其包括粘合材料),其中基材部分23基本上不含第二化合物。
在本發明的實施方案中,在粘合劑層3的面向皮膚的表面6上的包含第二化合物的涂層9可以是薄膜涂層,該薄膜涂層還包含薄膜形成化合物或載體化合物如,例如pvp、cmc、hec、pva和/或hpc。例如,在這樣的薄膜涂層中,第二化合物可以封閉在薄膜形成化合物或載體化合物的基質中。由此,可以通過選擇具有所需性質的薄膜形成化合物或載體化合物,即通過選擇例如在水溶液(例如創傷流體)中具有更大或更小溶解度的薄膜形成化合物或載體化合物進一步控制第二化合物的釋放,第二化學(化合物)的釋放可以如所需地改變。
在本發明的實施方案中,粘合劑層3可以包含有機硅系粘合劑、丙烯酸類粘合劑或壓敏膠(psa)熱熔粘合劑。
在本發明的實施方案中,粘合劑層3可以是具有20至300g/m2,例如50至200g/m2如80至150g/m2的涂層重量的涂層。
在本發明的實施方案中,粘合劑層3可以是有機硅系粘合劑。例如,有機硅系粘合劑可以是軟硅凝膠粘合劑,該粘合劑已知的是其有利的皮膚友好性質,因為尤其是當軟硅凝膠粘合劑的粘合劑層從皮膚表面移除時沒有或很少皮膚被剝離掉。術語“硅凝膠”是指包括包含低分子量的有機硅的交聯網絡的硅凝膠。例如,合適的軟硅凝膠粘合劑可以由加成固化的rtv(室溫硫化)有機硅體系組成,其在混合后交聯并形成自粘合彈性體。商購可得rtv加成固化的有機硅體系的一個實例是作為雙組分體系的wackersilgel612,其中所形成的彈性體的柔軟度和粘附程度可以通過將兩個組分的比例a∶b從1.0∶0.7改變至1.0∶1.3而改變。有機硅系粘合劑的其他實例尤其包括來自nusiitechnology,carpinteria,ga,usa的nusilmed-6340、nusilmed3-6300和nusiimed12-6300,以及來自dowcorningcorporation,midland,usa的dowcoming7-9800。在本發明的實施方案中,第一化合物和第二化合物可以獨立地選自由以下各項組成的組:銀化合物,包括例如銀鹽和金屬銀,雙胍鹽如聚六亞甲基雙胍(phmb)或其任何鹽,或聚六甲基胍(phmg)或其任何鹽,或者氯己定或其任何鹽,碘,水楊酸或其任何鹽,乙酰水楊酸或其任何鹽,季銨鹽如芐索氯銨,聚維酮碘,乳鐵蛋白,木糖醇,抗微生物肽如ll37肽,冰片,堿式沒食子酸鉍,抗真菌藥物,以及抗生素如慶大霉素,鏈霉素。
在本發明的實施方案中,第一化合物和第二化合物可以獨立地選自由以下各項組成的組:銀化合物,包括例如銀鹽和金屬銀;phmb或其任何鹽;phmg或其任何鹽;氯己定或其任何鹽;和碘。
例如,第一化合物和/或第二化合物可以是銀鹽如硫酸銀(ag2so4)、亞硫酸銀(ag2so3)、硝酸銀(agno3)、碳酸銀(agco3)、磷酸銀(ag3po4)、氯化銀(agcl)、磷酸鋯氫鈉銀(
例如,在本發明的實施方案中,第一化合物可以是銀化合物,例如銀鹽或金屬銀,其中第二化合物可以是phmb或其任何鹽。備選地,第一化合物可以是phmb或其任何鹽并且第二化合物可以是銀化合物或者第一和第二(化合物)二者可以是phmb或其任何鹽,或者第一和第二(化合物)二者可以是銀化合物。備選地,氯己定或其任何鹽可以與銀化合物組合。
在本發明的實施方案中,第一化合物可以在醫用敷料的區域以第一濃度存在并且第二化合物可以在醫用敷料的區域以第二濃度存在,其中該第一和第二濃度可以不同。例如,所述第一濃度可以典型地高于所述第二濃度。
在本發明的實施方案中,第一化合物的濃度可以為約5至3000μg/cm2,并且其中第二化合物的濃度可以為約1至2500μg/cm2。例如,第一化合物的濃度可以為約50至2000μg/cm2,并且其中第二化合物的濃度可以為約1至150μg/cm2。例如,第一化合物的濃度可以為約1000至2500μg/cm2,并且其中第二化合物的濃度可以為約1至300μg/cm2。例如,第一化合物的濃度可以為約1500至2000μg/cm2,并且其中第二化合物的濃度可以為約1至100μg/cm2。例如,第一化合物的濃度可以為約50至200μg/cm2如95μg/cm2,并且其中第二化合物的濃度可以為約5至49μg/cm2如20μg/cm2。
對于大多數創傷護理應用,期望將較大量的第一化合物結合到基材中,并且將較少量的第二化合物結合在表面涂層中。
例如,第一和第二濃度之間的比率可以在1∶5至1∶100,例如1∶10至1∶50的范圍內。
這允許用于第一和第二化合物的強初始作用和持續作用二者。第一和第二化合物的釋放可以在所需的時間段內維持并且這些化合物的生物活性可以在所需時間段內維持。
不同類型的創傷對敷料施加不同要求。對于在深創傷(由例如手術所致)上的應用,可能有利的是提供第二化合物的更突出的初始釋放以促進早期愈合并避免創傷部位處的腫脹。對于感染預防或傷疤修復目的來說,可能期望較慢的釋放。
通過改變第一和第二化合物的濃度,敷料的釋放曲線可以對于不同應用進行調整。這允許第一和第二化合物的更加受控的釋放。
根據本發明的敷料允許通過提供第二化合物的快速初始釋放,同時提供第一化合物從基材內的較慢釋放而實現的協同作用。這允許更加受控的釋放曲線,并且由此允許強的初始作用以及持續作用。
在本發明的實施方案中,第一化合物和/或第二化合物可以是創傷愈合化合物,其中第一化合物和/或第二化合物可以選自由以下各項組成的組:edaravone(3-甲基-1-苯基-2-吡唑啉-5-酮);以下各項的全蛋白或肽:成釉蛋白,纖連蛋白,玻連蛋白,纖維蛋白原;精氨酰甘氨酰天冬氨酸(rgd)肽;β葡聚糖(bg)(例如可溶性bg或燕麥bg),生長因子如血小板源性生長因子(pdgf),表皮生長因子(egf),成纖維細胞生長因子(fgf);細胞因子如轉化生長因子(tgf)β1,tgfβ3,白介素(il)-10;脫細胞動物組織;以及羊膜組織。
在本發明的實施方案中,第一化合物可以是選自由以下各項組成的組中的抗微生物化合物:銀化合物,包括例如銀鹽和金屬銀;phmb或其任何鹽;phmg或其任何鹽,氯己定或其任何鹽;以及碘,其中第二化合物可以是選自由以下各項組成的組中的創傷愈合化合物:edaravone(3-甲基-1-苯基-2-吡唑啉-5-酮);以下各項的全蛋白或肽:成釉蛋白,纖連蛋白,玻連蛋白,纖維蛋白原;精氨酰甘氨酰天冬氨酸(rgd)肽;β葡聚糖(bg)(例如可溶性bg或燕麥bg),生長因子如血小板源性生長因子(pdgf),表皮生長因子(egf),成纖維細胞生長因子(fgf);細胞因子如轉化生長因子(tgf)β1,tgfβ3,白介素(il)-10;脫細胞動物組織;以及羊膜組織。
在本發明的實施方案中,如例如以上參考圖1a-c和圖2a-c所討論的,粘合劑層3可以包含分布在粘合劑層3內的第三化合物,其中第三化合物可以與第一和/或第二化合物相同。在本發明的實施方案中,第三化合物可以是在粘合劑層3中的固體分散體。
因此,所述化合物可以進一步分布在敷料1、20的層或材料內或之上,由此可以如所需地進一步改變性質,例如釋放性質和/或生物(例如抗微生物或創傷愈合)活性。
本發明還涉及一種制備醫用敷料的方法,所述方法包括以下步驟:
-提供包含第一化合物的基材2;
-提供粘合劑層3;和
-在粘合劑層3上提供包含第二化合物的涂層9。
在本發明的實施方案中,提供包含第一化合物的基材2的步驟可以包括用第一化合物在溶劑中的溶液或懸浮液浸漬基材2并且隨后干燥經浸漬的基材2。備選地,或另外地,提供包含第一化合物的基材2的步驟可以包括將第一化合物添加至制備所述基材的步驟。
在本發明的實施方案中,提供粘合劑層3的步驟可以包括在基材的第一表面4上或在穿孔膜層11(例如聚氨酯膜)的未穿孔部分12上涂布粘合劑組合物的步驟。例如,在粘合劑層是有機硅系粘合劑的情況下,涂布的步驟典型地隨后是固化有機硅組合物以獲得固化的有機硅系粘合劑層的步驟。例如,提供粘合劑層的步驟可以包括在穿孔聚氨酯膜的未穿孔部分的第二表面18上首先添加然后固化有機硅組合物,并且隨后將穿孔的聚氨酯膜附著至基材以使該穿孔聚氨酯膜的第一表面17面向基材的第一表面4,并且其中該穿孔聚氨酯膜的第一表面17與其第二表面18相反。
在本發明的實施方案中,提供具有包含第二化合物的涂層9的粘合劑層3的步驟可以包括將固體例如粉末形式的第二化合物添加至粘合劑層3的面向皮膚的表面6,備選地,第二化合物可以溶解或分散在合適溶劑例如水或有機溶劑如醇中,因此可以將第二化合物的溶液或懸浮液施加至粘合劑層3,在這種情況下所述方法典型地包括另外的干燥步驟,例如蒸發液體。在本發明的實施方案中,第二化合物的液體混合物(例如溶液或懸浮液)可以還包括膜形成化合物或載體化合物(如以上討論的),由此可以獲得包含第二化合物和薄膜形成化合物的薄膜涂層。第二化合物的液體混合物(例如溶液或懸浮液)可以借助于例如海綿涂抹器、刷子或棍棒、或輥,或者通過鏟子鋪展,或者通過脫模片釋放施加,或者該液體混合物可以為噴霧、摩絲(mousse)、氣溶膠或可以直接施加至表面的泡沫的形式。例如,第二化合物的液體混合物(例如溶液或懸浮液)可以典型地通過將該液體混合物噴霧到粘合劑層3的面向皮膚的表面6上而施加至粘合劑層3。在本發明的實施方案中,在第二化合物溶解或分散在溶劑中的情況下,溶劑的粘度可以配置成由此控制第二化合物滲入粘合劑層3的面向皮膚的表面6中的水平。例如,第二化合物的液體混合物(例如溶液或懸浮液)的粘度可以典型地具有相對較低的粘度,如例如在0.65至500mpas的范圍內。
在本發明的特征、實施方案或方面依照markush組進行描述的情況下,本領域技術人員將認識到,本發明由此還依照該markush組的任何個體成員或成員的子組進行描述。本領域技術人員將進一步認識到,本發明由此還依照markush組的個體成員或成員的子組的任意組合進行描述。
另外地,應注意在本發明的方面和/或實施方案之一的上下文中描述的實施方案和特征加以必要的變通也適用于本發明的所有其他方面和/或實施方案。
另外地,根據對附圖、公開內容和所附權利要求書的學習,在實施所要求保護的發明中,本領域技術人員可以理解和實現對所公開實施方案的改變。在權利要求書中,詞匯″包括或包含(comprising)″不排除其他要素或步驟,并且不定冠詞″一個″或″一種″不排除復數指代。某些量度在相互不同的從屬權利要求中限定的單純事實不表明這些量度的組合不可以更有利地使用。
本發明的優點已在實驗中得到證實。
實施例
本發明的示例性實施方案的制備
使用的材料:
lyofoamtmmax(批次603092),其是親水性聚氨酯泡沫產品,可商購得自
在泡沫樣品上涂布有機硅粘合劑的方法基于在wo97/42985中公開的方法(參見例如第9頁)。將聚氨酯膜穿孔的方法基于在ep1960164中公開的方法。除非另有說明,以下公開的所有制備步驟在室溫(25℃)進行。
實施例1
制備硫酸銀的水溶液(4.1g/l)。隨后將該溶液基本上均勻地噴霧(利用任何合適涂布設備或例如噴霧器)到lyofoamtmmax(20x15cm)的泡沫表面上。噴霧的總量為28.3μl/cm2。隨后,將聚乙烯(pe)薄膜(20x15cm)施加至泡沫的銀涂布表面以使整個泡沫表面用pe薄膜覆蓋,并將鋼輥施加到該pe薄膜上以擠壓下方泡沫并由此用硫酸銀的水溶液浸漬泡沫的主體。之后移除pe薄膜,并將lyofoamtmmax產品在室溫干燥至少24小時以得到包含約116μg/cm2硫酸銀的銀浸漬的lyofoamtmmax樣品。
將未固化有機硅混合物(wackersilgel612,比率a∶b=1.2∶1)的層(厚度0.125mm)施加至pe涂布的紙(25x25cm)。隨后,將銀浸漬的(約116μg/cm2)lyofoamtmmax樣品(20x15cm)施加至未固化有機硅混合物的層,以使lyofoamtmmax的泡沫側與未固化有機硅混合物接觸,然后將這些層(即pe涂布的紙、有機硅、泡沫層)傳輸通過烤箱(90℃)。有機硅混合物在其通過烤箱中固化(總固化時間大約2min)從而在泡沫材料的下側上得到固化的硅凝膠層。移除pe涂布的紙并添加pe薄膜(20x15cm)以覆蓋該固化的有機硅粘合劑層。
實施例2
將lyofoamtmmax產品(20x15cm,未進行銀浸漬)用如實施例1中所述的固化的硅凝膠粘合劑的層涂布。制備硫酸銀的水溶液(7.70g/l)并隨后基本上均勻地噴霧(利用任何合適涂布設備或例如噴霧器)到該固化的有機硅層上,并將樣品在室溫干燥至少24h。噴霧的總量為15.0μl/cm2,得到在有機硅層上的硫酸銀的總量為約116μg/cm2。
實施例3
如實施例1中所述制備包括固化硅凝膠的層的泡沫樣品,不同在于將濃度為3.50g/l的硫酸銀的水溶液噴霧(總量27.3μl/cm2)到泡沫表面上,由此得到銀浸漬的lyofoamtmmax樣品,其中在泡沫體中含有的硫酸銀的總量為約96μg/cm2。
如實施例2中所述,隨后將固化的硅凝膠層用硫酸銀涂布,不同在于使用濃度為3.0g/l的硫酸銀的水溶液并且噴霧的總量為7.5μl/cm2,得到在有機硅層上的硫酸銀的總量為約22μg/cm2,并且因此在最終產品中的硫酸銀的總量為約118μg/cm2。
實施例4
如實施例1中所述,將lyofoamtmmax的樣品(20x15cm)進行浸漬,以獲得包含約116μg/cm2硫酸銀的銀浸漬的lyofoamtmmax樣品。
移除在
然后將現在在一側上具有丙烯酸類粘合劑(具有脫模層)并且在相對側上具有有機硅粘合劑(具有pe薄膜脫模層)的pu薄膜使用如在ep1960164(參見[0008])中所述的超聲裝置穿孔,其中使pu薄膜和脫模層的層壓體通過超聲裝置的咬口(nip),該超聲裝置包括超聲變幅桿和設置有突起圖案的對輥(參見ep1960164中的圖1)。將該層壓體插入通過超聲裝置,以使pe薄膜面向對輥。調節從超聲裝置發射的能量以使在各個突起的區域中發生pu薄膜的局部熔融,由此將該層壓體的聚氨酯膜穿孔,使得形成直徑為約1.5mm的多個通孔。隨后移除脫模層(在丙烯酸類粘合劑層上)并將穿孔的薄膜層壓體(切成20x15cm)附著至所制備的lyofoamtmmax(包含約116μg/cm2硫酸銀)的泡沫表面。因此最終產品中的硫酸銀的總量為約116μg/cm2。
實施例5
移除在
實施例6
將lyofoamtmmax的樣品(20x15cm)如實施例1中所述進行浸漬,不同在于將濃度為3.50g/l的硫酸銀的水溶液噴霧(總量27.3μl/cm2)到泡沫表面上,由此得到銀浸漬的lyofoamtmmax樣品,其中在泡沫體中含有的硫酸銀的總量為約96μg/cm2。如實施例5中所述制備穿孔的薄膜層壓體,不同在于使用濃度為3.0g/l的硫酸銀的水溶液并且噴霧的總量為7.5μl/cm2,得到在有機硅層上的硫酸銀的總量為約22μg/cm2,并且因此在最終產品中的硫酸銀的總量為約118μg/cm2。
實施例7
根據實施例4制備產品,不同在于使用非銀浸漬的lyofoamtmmax(20x15cm)。因此在實施例7產品中的硫酸銀的總量為0μg/cm2。
抗微生物活性試驗
抗微生物作用通過直接接觸法確定,改進的iso20743:2007(e)紡織品-抗菌終產品的抗菌活性的確定(modifiediso20743:2007(e)textiles-determinationofantibacterialactivityofantibacterialfinishedproducts)。該iso方法關于試驗介質和試驗有機物進行了改進以模擬創傷類狀況。原則上,將接種試驗介質添加至材料或產品的片,其吸收試驗介質。將接種的片溫育特定時間,然后通過使用中和緩沖液洗出剩余試驗有機物來確定存活試驗有機物的數量。通過系列稀釋并鋪板到瓊脂板上在中和緩沖液中確定活菌數。
方法描述
針對銅綠假單胞菌(pseudomonasaeruginosa)atcc15442(銅綠假單胞菌(p.aeruginosa))和金黃色葡萄球菌(staphylococcusaureus)atcc6538(金黃色葡萄球菌(s.aureus))確定實施例1-3和實施例4-6的抗微生物作用。包括lyofoamtmmax(
將試驗有機物(大約109cfu/ml)在胰蛋白酶大豆肉湯(tsb;acumedia)中的過夜培養物使用蛋白胨水(pw;0.85%nacl,具有0.1%蛋白胨,peptonebacteriologicalneutralised(oxoid))稀釋至107cfu/ml,然后使用模擬創傷流體(swf;以比例1∶1混合的胎牛血清(hyclone)和pw)進一步稀釋至大約5×106cfu/ml,從而形成用于實驗樣品的接種物。
對試驗樣品(包括實施例1-3和4-6,以及陰性對照樣品(lyofoamtmmax和實施例7))一式三份地測試每種有機物。將實施例1-3和4-6以及陰性樣品的圓形片
為了確定開始接種物水平,將另外的三份陰性對照樣品,即lyofoamtmmax和實施例7接種并直接轉移至單獨的含有100ml室溫d/e的250ml扣蓋容器。通過在pw中的十倍系列稀釋以及鋪板到petrifilmtm有氧計數板(3m)上并溫育48h,然后對菌落計數,在d/e中確定活菌數的數量。結果表示為每陰性對照樣品的活菌數的平均值(logcfu/樣品)。
在溫育(在35℃±2℃,持續24小時)之后,將試驗樣品轉移至單獨的含有100ml室溫dey-engley中和緩沖液(d/e,bectondickinson)的250ml扣蓋容器。將這些容器劇烈地振蕩至少60秒以確保存活的試驗有機物被洗掉。通過在pw中的十倍系列稀釋以及鋪板到petrifilmtm有氧計數板(3m)上并溫育48h,然后對菌落計數,在d/e中確定活菌數的數量。結果表示為每陰性對照樣品的活菌數的平均值(logcfu/樣品)。
結果與討論
制備和對抗微生物效力進行測試的實施例中的銀含量提供在下表1中。實施例1至3(如上所述)包含直接涂布在親水性泡沫(lyofoamtmmax)的第一表面上的有機硅粘合劑,而實施例5至8(如上所述)包含涂布在穿孔塑料薄膜上的有機硅粘合劑,該塑料薄膜附著至親水性泡沫的第一表面。
表1
圖3a和圖3b分別提供來自針對銅綠假單胞菌(p.aeruginosa)和金黃色葡萄球菌(s.aureus)的抗微生物活性試驗的結果。如可以在所附兩幅圖中看到的,根據本發明的示例性實施方案,即實施例3和實施例6,二者都包括在硅凝膠粘合劑上的銀鹽(ag2so4)涂層以及包括在泡沫基材中的銀鹽,相比于在0h測量的起始接種物水平,顯示在24h之后活菌數顯著減少,大約3logcfu/樣品,而對于實施例1、2、4和5,其各自僅在泡沫基材中具有銀鹽或作為硅凝膠粘合劑上的涂層,在24h之后不顯示活菌數的減少或甚至顯示活菌數增加。事實上,這些試驗樣品實施例1、2、4和5顯示與對照樣品lyofoamtmmax和實施例7(不包含銀鹽)類似的結果。應當注意,在所有實施例1、2、3以及4、5和6中的銀鹽的總濃度保持在約相同的總水平(即116-118μg/cm2)。因此,這些結果確實是非常令人驚訝的,并且明顯地例示了通過本發明實現的技術效果。不受理論束縛,據信在發明實施例3和6,與實施例1、2、4、5之間在抗微生物活性方面的顯著差異是由于這樣的事實所致,即試驗有機物在測試期間接觸足夠量的銀鹽;而不管該試驗有機物最后處于粘合劑硅凝膠上或泡沫基材中。這對于以下臨床情形有代表性,其中敷料的表面上以及其周邊的微生物將受到粘合劑硅凝膠上的銀鹽影響,同時由泡沫基材吸收的創傷滲出物中的微生物將通過其中存在的銀鹽減少。應進一步注意,所述方法的檢測限為大約2.0logcfu/試驗樣品。起始接種物水平(依照iso20743,在0h僅對于陰性對照樣品測量)在針對金黃色葡萄球菌(s.aureus)的抗微生物試驗中為5.9logcfu/試驗樣品(圖3a)以及在針對銅綠假單胞菌(p.aeruginosa)的抗微生物試驗中為6.2logcfu/試驗樣品(圖3b)。
粘附實驗
粘附實驗的目的是確定粘合劑有機硅層的粘合性是否受鹽涂層影響。為此,采用兩個試驗:粘合試驗a(在鋼表面上)和粘合試驗b(在人造皮膚表面上)。兩個試驗都基于astmd3330/d3330m-04,方法f,具有以下偏離:(i)在軋光后的靜置時間為30±5min,而在以上標準中,使用1分鐘的最大值,(ii)與以上標準中的25和75mm相比,在20至120mm之間測量平均加載;和(iii)對于實驗b,輥重量為445g,而在以上標準中,輥重量為2040g。
試驗a-通用試驗程序:將鋼板(根據astma666-94a;pstc附件b2.6;適用于滑件)使用無絨吸收劑材料和丙酮清潔,并在室溫干燥10min。所述清潔重復三次。將粘合試驗產品(25x220mm)施加至清潔的鋼板同時沒有將其向該板壓靠。將試片軋光(calendar)(機械軋光機;輥重量2040±45g),一次往復。在測試之前將樣品靜置30±5分鐘。將細繩從滑件連接至十字頭。該細繩使得滑件在十字頭垂直移動時以相同速度水平地移動。這確保將試片從基材剝離的角度保持在90°。將鋼板放入滑件中,并且試驗產品的一端小心地從鋼板分層然后與紙一起在上部夾子中夾緊以避免滑動。開啟拉伸試驗機,并測量將試片從基材剝離所需的平均力。
試驗b-通用試驗程序:將雙面膠帶施加到鋼板上(根據astma666-94a;pstc附件b2.6),使得在膠帶下方沒有氣泡。將皮膚基材(mitex膜5μm,得自millipore)小心地施加到膠帶上以避免皮膚基材和膠帶之間的氣泡(應戴上棉手套)。將皮膚基材覆蓋以避免在將其向膠帶擠壓時弄臟。將粘合試驗產品(25x220mm;在末端具有紙條以避免抓握弄臟)施加到基材上,并將樣本機械地軋光(輥重量445g;或使用具有橡膠表面的手動軋光機,重量185g),一次往復。將樣品靜置30±5分鐘,并隨后將鋼板放入滑件并將試驗產品固定至上部手柄。將細繩從滑件連接至十字頭。開啟拉伸試驗機并測量從基材剝離有機硅條所需的平均力。
結果與討論
通過噴霧具有不同量的氯化鈉(nacl)的商購產品
表2
- 還沒有人留言評論。精彩留言會獲得點贊!