表達免疫應答刺激細胞因子以吸引和/或激活免疫細胞的基因修飾間充質干細胞的制作方法
本發明涉及基因修飾間充質干細胞(MSC),以及它們作為治療腫瘤的藥物的用途,所述MSC包含一種或多種外源核酸分子,其中所述外源核酸分子包括可操作地連接于啟動子或啟動子/增強子組合的、編碼一種或多種免疫應答刺激細胞因子或免疫應答調節細胞因子的區域。本發明進一步涉及包含至少一種外源核酸分子的基因修飾間充質干細胞,所述外源核酸分子包括編碼例如誘導T細胞增殖和/或分化的免疫刺激分子的區域。
本發明涵蓋MSC作為治療腫瘤和/或腫瘤疾病的藥物的用途,例如通過調節腫瘤微環境以吸引免疫效應細胞和促進所述免疫效應細胞的激活和/或記憶表型的過繼。本發明的一個方面涉及所述MSC在抗腫瘤治療中的用途,所述抗腫瘤治療包括聯合施用所述間充質干細胞與免疫治療,所述免疫治療例如檢查點抑制劑(包括例如抗CTLA-4、PD-1、PD-L1和其他免疫共刺激分子的抗體),免疫細胞例如T細胞(如具有人工T細胞受體的T細胞,例如嵌合抗原受體(CAR-T)或外源T細胞受體(TCR)轉導的細胞),NK細胞或巨噬細胞/單核細胞,或活性免疫治療藥物,例如腫瘤抗原、來源于患者的腫瘤物質和旨在激活和/或指導免疫應答對抗腫瘤或腫瘤特征的其他治療藥物。
背景技術:
間充質干細胞(MSC)是存在于骨髓和其他組織中的非造血起源的細胞。MSC一般被認為是多能成體祖細胞,其具有分化為有限數目的細胞譜系如成骨細胞、軟骨細胞和脂肪細胞的能力。基于直接分化為這些末期表型的能力,已經對MSC作為治療實體的用途進行了研究,包括MSC促進或提高骨修復和用于修復軟骨缺損的用途(Vilquin和Rosset,再生醫學(Regenerative Medicine)2006:1,4,p 589以及Veronesi等人,干細胞和發育(Stem Cells and Development)2013;22,p 181)。已經描述了用于許多治療性適應癥的MSC的分離和培養,并且這代表了針對治療炎癥相關障礙的有前途的方法(例如WO 2010/119039)。
已知MSC展示了施用于患者后的免疫逃逸特性。已經顯示MSC展示了在移植同種異體供體材料情況下有利的免疫調節作用(Le Blanc等人,Lancet2004:363,p 1439),從而減少了潛在致病的同種異體反應性和排斥。MSC治療還可以在創傷愈合中起治療作用。可以經由全身注射進行MSC的治療遞送,然后MSC歸巢并移入于損傷的部位(Kidd等人,干細胞(Stem Cells)2009:27,p 2614)。還已知MSC展示了關于在體內向腫瘤歸巢的遷移特性。
使用基因修飾MSC的基于MSC的細胞治療能夠使治療性基因產品遞送至患者體內感興趣的特定區域。例如,已經顯示MSC遷移至炎癥區域如腫瘤,從而在局部發揮治療影響。MSC典型地具有免疫調節作用,引起在感興趣的區域中的免疫抑制,從而調節或減少炎癥以促進恢復。然而,本發明利用MSC作為細胞載體,用于遞送用于刺激免疫應答的免疫調節效應物,從而利用MSC靶向于炎癥區域,尤其是腫瘤的獨特的歸巢能力,從而基于適當的免疫應答的激活,發揮局部治療作用。
通過針對腫瘤組織的免疫應答的適當激活或加強,可以阻止腫瘤生長。然而,在癌癥治療領域需要用于局部增強這樣的免疫應答,而不啟動不想要的全身性副作用的手段。存在許多用于治療癌癥的藥物在不引起顯著不想要的副作用(例如發燒、肝酶水平升高或全身炎癥,如細胞因子風暴,可能會導致死亡)的情況下不能被全身施用。用于避免這樣的副作用的一種選擇是施用顯著減少劑量的這樣的藥物,這雖然在減少副作用中是有效的,但是通常在靶位點產生不足的藥物水平并且產生不足的治療益處。
技術實現要素:
鑒于現有技術,基于本發明的技術問題是提供用于癌癥免疫治療的新策略。具體地,基于本發明的問題是提供用于局部刺激針對受試者的腫瘤組織的免疫應答的合適手段。基于本發明的進一步問題是提供用于施用有效劑量的治療劑如免疫調節劑或免疫刺激劑的手段,其在靶組織提供有效的局部作用和減少水平的不想要的副作用。
通過獨立權利要求的特征解決這個問題。通過從屬權利要求提供了本發明的優選實施方式。
因此,本發明涉及在腫瘤治療中用作藥物的基因修飾間充質干細胞,其中所述MSC包含一種或多種外源核酸分子,其中所述外源核酸分子包括編碼一種或多種免疫應答刺激細胞因子的區域,所述編碼一種或多種免疫應答刺激細胞因子的區域可操作地連接于啟動子或啟動子/增強子組合,其中所述治療包括聯合施用所述間充質干細胞與抗腫瘤免疫治療。
聯合施用可涉及在所述免疫治療之前、期間和/或之后,同時和/或有順序地施用所述間充質干細胞。聯合施用還應包括聯合治療方案,該聯合治療方案包括治療的任一種治療性組分的多次施用。本文提供了聯合施用的進一步實施方式。
因此,除了用于治療具有腫瘤的受試者的方法或治療腫瘤和/或腫瘤疾病的方法之外,本發明涵蓋本文描述的MSC的醫學用途,尤其是用于治療癌癥。
本發明還涵蓋本文描述的基因修飾間充質干細胞,其本身不依賴于它們的特定醫學用途。
本發明使得能夠刺激參與抗腫瘤免疫應答的細胞,從而局部激活、支持和/或加強抗腫瘤免疫應答。如本文描述的MSC由于它們的天然的或工程化的在體內歸巢至炎癥區域的能力而遷移至腫瘤組織。歸巢和/或移入腫瘤組織(腫瘤基質)導致免疫刺激細胞因子的局部表達,從而使得局部腫瘤環境中免疫細胞的量和/或活性提高,從而使患者的免疫系統能夠攻擊腫瘤細胞,并且還提供對聯合免疫治療的支持。
本發明使得能夠施用經由移植的MSC表達的有效和治療相關劑量的一種或多種免疫刺激細胞因子,同時避免顯著的副作用,所述副作用在沒有適當靶向劑的情況下是全身施用細胞因子中固有的。因此,本發明涉及利用作為靶向劑的MSC和/或載體,所述載體用于在炎癥區域,優選在腫瘤組織內和接近于腫瘤組織處,局部遞送免疫調節信號,優選免疫刺激信號。
免疫治療的成功開發和臨床使用中的關鍵限制是通過建立免疫抑制的腫瘤微環境,腫瘤逃逸和抑制對抗腫瘤細胞的天然免疫應答的能力。該現象被稱為腫瘤介導的免疫抑制,并且該現象在很大程度上是通過由存在于腫瘤中的顯示調節性表型的免疫細胞(例如調節性T細胞(TReg)和單核細胞衍生抑制細胞(MDSC))分泌抗炎性細胞因子所介導的。因此,本發明提供了改變腫瘤微環境的手段,使腫瘤微環境成為促炎的,促進存在于腫瘤中的免疫細胞的激活和外部免疫細胞的募集和激活,從而促進免疫系統對抗腫瘤的廣泛激活;和/或提高抗腫瘤免疫治療性治療的有效性的手段。
在一種實施方式中,在免疫治療性治療之前,可以施用如本文描述的MSC以修改腫瘤微環境和使得腫瘤微環境有利于和有助于免疫治療。
本發明利用MSC作為用于遞送用于模擬免疫應答的免疫調節效應物的細胞載體,從而利用MSC靶向炎癥區域(尤其是腫瘤)的獨特歸巢能力,從而基于適當的免疫應答的激活發揮局部治療作用(其中所述免疫應答優選涉及宿主(受試者)的天然免疫應答),從而提高免疫治療劑的有效性和治療作用,所述免疫治療劑如雙特異性抗體、過繼免疫治療劑、抗腫瘤疫苗和/或檢查點抑制劑。
MSC響應于促炎信號(例如,轉化生長因子β(TGF-b),吲哚胺2,3-雙加氧酶)能夠表達不同的抗炎因子。對于TGF-b,已經顯示了它能提高激活的T細胞的存活率,因為它保護細胞免受所謂的“激活誘導的細胞死亡”。驚人地,MSC中促炎細胞因子的表達允許旁觀T細胞(bystander T cells)的靶向激活和持續激活,而不誘導T細胞中的激活誘導的細胞死亡(AICD)。本文描述的細胞的這種特性是由于抗炎因子(例如TGF-b)的存在,所述抗炎因子也由MSC表達,并且防止AICD。表達抗炎因子的MSC與促炎轉基因細胞因子的組合產生預料不到的技術效果,這在刺激抗腫瘤的免疫應答中是有利的。
驚人地,用一種或多種如本文描述的免疫應答刺激細胞因子修飾的MSC顯示所述細胞因子在體外和體內的預料不到的良好表達和分泌。基于固有應答或和免疫治療,技術人員不會預料到這些特定的細胞因子可以以足夠的量表達,并且以足夠的量從細胞中輸出以誘導或提高希望的局部免疫應答。
本發明還涵蓋經由本文描述的基于MSC的方法,在腫瘤中表達免疫激活細胞因子和/或趨化因子的組合,目的是吸引免疫效應細胞和輔助細胞、誘導免疫激活、促進記憶免疫細胞的成熟和/或抑制抑制性免疫細胞和/或調節性免疫細胞的出現和存留。
在一種實施方式中,使用了細胞因子的組合,以促進免疫應答的不同分支的激活,包括固有免疫應答和適應性免疫應答、效應細胞、輔助細胞和/或抗原提呈細胞。
預期細胞因子如TNF-α會激活免疫系統的多個方面,然而該作用可能缺少對腫瘤應答必要的特異性。
另一方面,IL-2、IL-7、IL-15和IL-21特異性地激活使對抗腫瘤細胞的特異性應答增強的細胞毒性淋巴細胞如T細胞和NK細胞。同樣地,IL-12會激活細胞毒性淋巴細胞,還有單核細胞和輔助細胞。
IL-12與例如IL-2、IL-7、IL-15和/或IL-21的組合會具有如下作用:(i)激活腫瘤定向的細胞毒性細胞,(ii)激活輔助細胞,所述輔助細胞增強細胞毒性細胞的激活,和/或(iii)激活單核細胞,所述單核細胞可以發展對抗腫瘤的附加免疫應答。因此,細胞因子的組合產生協同效應,正如在天然免疫應答中所見,以及在本發明中,該細胞因子的組合大大提高了治療效果。驚人的結果是,在使用基于MSC的轉基因方法中,天然免疫應答可以以增強的方式實際上交叉(mirrored)或類似地應用。
因此,本發明基于如下的驚人發現:通過提供在一種或多種MSC中編碼免疫應答刺激細胞因子的轉基因的組合,可以獲得更有效的局部和安全的抗腫瘤應答。MSC載體中多種細胞因子的組合引起導致局部抗腫瘤應答(包括免疫應答的多個分支)的獨特的免疫刺激因子的局部表達和分泌,而不誘導如對腫瘤患者全身施用細胞因子時所觀察到的全身毒性。
此外,MSC的獨特特性,即歸巢和移入腫瘤組織,引起治療性細胞因子的持續表達,以保持免疫應答用于治療作用。在一種實施方式中,誘導型啟動子的使用使得局部和腫瘤特異性細胞因子表達成為可能,所述誘導型因子優選接近于腫瘤組織處表達或在腫瘤組織內表達或在發炎組織中表達,在該區域中的腫瘤(因此優選是炎性)隨后減少后,所述局部和腫瘤特異性細胞因子表達隨后減少。
本發明還涉及基因修飾間充質干細胞(MSC),其中所述MSC包含一種或多種外源核酸分子,其中所述外源核酸分子包括編碼兩種或更多種免疫應答刺激細胞因子的區域,所述編碼兩種或更多種免疫應答刺激細胞因子的區域可操作地連接于一個或多個啟動子或啟動子/增強子組合。
在優選的實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,外源核酸包括編碼兩種或更多種免疫應答刺激細胞因子的區域,所述編碼兩種或更多種免疫應答刺激細胞因子的區域可操作地連接于一個或多個啟動子或啟動子/增強子組合,其中細胞因子選自由IL-2、IL-7、IL-12、IL-15、IL21、IFNγ和IFNβ組成的組。
在優選的實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,兩種或更多種免疫應答刺激細胞因子至少包括IL-12,以及IL-2、IL-7、IL-15和/或IL-21中的一種或多種。
在優選的實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,兩種或更多種免疫應答刺激細胞因子至少包括IL-7和IL-21。
在優選的實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,兩種或更多種免疫應答刺激細胞因子包括至少一種趨化因子和至少一種免疫應答刺激細胞因子,所述免疫應答刺激細胞因子選自由IL-2、IL-7、IL-12、IL-15、IL21、IFNγ和IFNβ組成的組。
本發明在某些實施方式中涵蓋了如本文描述的細胞中的細胞因子轉基因的組合,尤其是本文公開的單獨的細胞因子或趨化因子的任何給定的特定組合,優選是IL-2、IL-7、IL-12、IL-15、IL21、IFNγ、IFNβ、CD28、趨化因子(C-C基序)配體1、2、4、17、19、22、23(CCL1、CCL2、CCL4、CCL17、CCL19、CCL22、CCL23)、基質細胞衍生因子1(SDF-1)中的兩種或更多種的任何給定的特定組合。
通過在由固有免疫系統或由聯合免疫治療產生的抗腫瘤免疫應答中局部免疫系統刺激的驚人和有利的構思,,將由兩種或更多種免疫應答刺激細胞因子限定的MSC和包括施用由一種或多種免疫應答刺激細胞因子限定的MSC與其他抗腫瘤免疫治療的組合的腫瘤治療方法聯系起來。出人意料的是,在刺激抗腫瘤應答中編碼轉基因免疫刺激細胞因子的MSC可以用作有效的抗腫瘤佐劑。相關的現有技術僅教導了使用MSC載體用于局部施用(轉基因)細胞毒性劑,具有直接效果。然而,使用編碼(可能是多種)轉基因免疫刺激細胞因子的MSC,或這樣的MSC與抗腫瘤免疫治療的組合來加強局部抗腫瘤免疫應答,代表本發明的特別的技術特征。
驚人地,用如本文描述的多種細胞因子修飾的MSC顯示出所述細胞因子在體外和體內的不可預料的良好表達和分泌。基于固有應答或和免疫治療,技術人員不會預料到這些特定細胞因子可以以足夠的量表達,并且以足夠的量從細胞中輸出以誘導或提高希望的局部免疫應答。
因此本發明涉及用作腫瘤治療中的藥物的本文描述的基因修飾間充質干細胞,所述間充質干細胞包含一種或多種外源核酸分子,其中所述外源核酸分子包括編碼兩種或更多種免疫應答刺激細胞因子的區域。本文公開的任何特征還應用于包括用于至少兩種或更多種免疫應答刺激細胞因子的轉基因物質的MSC,所述特征為關于治療或醫學施用或施加MSC的方法,或它們與本文描述的抗腫瘤免疫治療劑的聯合施用的特征。
本發明提供了在受試者中局部刺激對抗腫瘤組織的免疫應答的適當手段。這包括患者的天然免疫應答和旨在使免疫應答針對腫瘤的免疫治療性治療(例如檢查點抑制劑、抗腫瘤抗原的CART和其他腫瘤免疫治療)。免疫應答的這樣的支持或誘導在不同的臨床環境下可以是有利的,以便啟動和保持免疫應答,以及逃避腫瘤介導的常常阻止這種激活的免疫抑制。
本發明的細胞可以用于提高活性和/或增加已經存在于受試者中的內源免疫細胞的量。可供選擇地或另外地,可以與本發明的MSC聯合施用(例如同時地或順序地)額外的免疫細胞(自體的或同種異體的)以便提高希望的治療性免疫應答。
可以使用本領域技術人員已知的技術進行本文描述的基因修飾MSC的構建。
在一種實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,外源核酸包括病毒載體序列,例如病毒表達構建體形式的病毒載體序列。
在一種實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,外源核酸是非病毒表達構建體。
如本文所使用的,“核酸”是指任何核酸分子,包括但不限于DNA、RNA和其雜交體或修飾的變體。“外源核酸”和“外源基因元件”涉及引入細胞的任何核酸,其不是細胞“原始”或“天然”基因組的組件。外源核酸可以整合于或不整合于靶標間充質干細胞的遺傳物質中,或涉及穩定轉導的核酸。
本發明涵蓋了任何給定的基因遞送方法,并且所述基因遞送方法優選涉及病毒或非病毒載體,以及轉染的生物或化學方法,或其組合。該方法可以在使用的系統中產生穩定或瞬時基因表達。
基因修飾的病毒已經廣泛應用于將基因遞送至干細胞。可以使用腺病毒,或RNA病毒如慢病毒,或其他反轉錄病毒。腺病毒在基因治療和細胞工程領域中已經被用于產生一系列用于基因轉移的載體。通過刪除E1基因(病毒復制所需)產生具有4kb克隆能力的載體,來生產初代腺病毒載體。另外刪除E3(負責宿主免疫應答)允許8kb克隆能力。通過E2和/或E4刪除產生進一步的代次。本發明涵蓋任何給定的腺病毒載體的使用,例如根據上文描述的腺病毒載體。
慢病毒是病毒的反轉錄病毒家族的成員(M.Scherr等人,使用慢病毒載體將基因轉移至造血干細胞(Gene transfer into hematopoietic stem cells using lentiviral vectors).Curr Gene Ther.2002Feb;2(1):45-55)。通過刪除除了LTR和順式作用包裝信號以外的整個病毒序列產生慢病毒載體。獲得的載體具有約8kb的克隆能力。這些載體與反轉錄病毒載體的一個區別特征是它們轉導分裂細胞和非分裂細胞以及終末分化細胞的能力。
還可以采用非病毒方法,如以下供選擇的策略,其包括:通過使用基于核酸酶的基因編輯的靶向基因整合法人常規質粒轉移和應用,整合酶或轉座酶技術。這些表示用于載體轉化的方法,所述方法具有有效并且通常在它們的整合中是位點特異性的優勢。將載體導入細胞的物理方法是技術人員已知的。一個例子涉及電穿孔,其依賴于使用通過克服它的電容在膜上產生瞬時孔的短時高電壓的電脈沖。該方法的一個優勢是可以將它用于在大多數細胞類型中穩定和瞬時基因表達。可供選擇的方法涉及使用脂質體或蛋白轉導域。適當的方法對技術人員是已知的,并且不意欲作為本發明的限制性實施方式。
本發明涵蓋使用多于一種病毒或病毒和其他基因編輯事件或基因修飾,包括使用mRNA、siRNA、miRNA或其他基因修飾,以便控制基因表達任何給定的相關因素。在本發明的某些實施方式中,免疫應答刺激細胞因子涉及多種細胞因子和/或趨化因子或其組合。
在一種實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,啟動子或啟動子/增強子組合產生外源核酸的組成性表達。因為在全身施用后或局部施用后的受試者體內,MSC的對腫瘤有利的歸巢特性,使用用于表達一種或多種免疫應答刺激細胞因子的組成型啟動子是優選的。
在一種實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,啟動子是EF1α啟動子,例如EF1αS啟動子。
在一種實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,啟動子是PGK啟動子。
在一種實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,啟動子是CMV或SV40病毒啟動子。
在一種實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,啟動子是GAG啟動子。
在一種實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,啟動子是UBC啟動子。
在一種實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,當基因修飾間充質干細胞與腫瘤組織或腫瘤基質組織接近時,表達免疫應答刺激細胞因子。
考慮到間充質干細胞可以顯示選擇性遷移至正常以及病態情況下的不同的組織微環境,本發明涵蓋組織特異性啟動子、或與特定疾病微環境關聯的其他啟動子、或在募集的干細胞中由啟動的分化途徑誘導的啟動子的使用,并且所述使用可以用于驅動治療性基因的選擇性表達,如本文描述的細胞因子,具體地在限定的生物背景下。
在優選的實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,所述細胞在施用后分化時誘導啟動子或啟動子/增強子組合。施用后分化的一個例子是內皮分化,其中MSC可以移入并且隨后分化為在腫瘤組織中或接近于腫瘤組織處的內皮細胞或內皮樣細胞,從而使刺激性細胞因子能夠以局部方式表達。
募集到其他組織環境(niches)而沒有經歷疾病區域(腫瘤環境)的干細胞不應表達治療性基因。該方法允許對治療性基因在限定的微環境中的選擇性表達進行顯著程度的潛在控制,從而減少與全身施用促炎細胞因子相關的已知毒性發生的可能性,并且該方法已經被成功地應用于在新血管生成(neovascularization)期間調節治療性基因表達。WO 2008/150368和WO 2010/119039公開了這樣的基因修飾的可能方法,據此將這些專利公開全文并入。
在一種實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,啟動子是Tie2啟動子。
在炎癥或新血管生成的情況下,選擇性地調節可以引入的啟動子。就這一點而言,已經針對內皮特異性表達研究了Tie2啟動子、Flkl啟動子和內含子增強子、內皮素-1啟動子和內皮素原-1(pre-proendothelin-1)啟動子(Huss,R,von Luttichau,I,Lechner,S,Notohamiprodjo,M,Seliger,C,Nelson,P(2004)[在創傷愈合和組織再生中趨化因子指導移植成體干細胞的歸巢(Chemokine directed homing of transplanted adult stem cells in wound healing and tissue regeneration)].Verh Dtsch Ges Pathol 88:170-173)。
本發明的另一種實施方式提供了包含啟動子或啟動子/增強子組合的間充質干細胞,所述啟動子或啟動子/增強子組合可由炎性介質誘導以及控制刺激性細胞因子(免疫應答刺激細胞因子)的轉錄。這些炎性介質可以由腫瘤基質組織釋放,使得當干細胞與腫瘤基質組織接近時,誘導細胞毒性蛋白在間充質干細胞中的表達。炎性介質可以是例如細胞因子、如TNFα或IFNγ。特別地,啟動子可以是RANTES啟動子,其尤其可以由TNFOC或IFNγ誘導(Nelson PJ,Kim HT,Manning WC等人.RANTES趨化因子基因的基因組結構和轉錄調節(Genomic organization and transcriptional regulation of the RANTES chemokine gene).J Immunol 1993;151(5):2601-12;von Luettichau I,Nelson PJ,Pattison JM等人.病態的和正常的人體組織中RANTES趨化因子的表達(RANTES chemokine expression in diseased and normal human tissues).Cytokine 1996;8(l):89-98;Nelson PJ,Pattison JM,Krensky AM.RANTES的基因表達(Gene expression of RANTES).Methods Enzymol 1997;287:148-62;Duell EJ,Casella DP,Burk RD等人.促炎基因TNF-A、RANTES和CCR5中的炎癥、基因多態性和胰腺癌的風險(Inflammation,genetic polymorphisms in proinflammatory genes TNF-A,RANTES,and CCR5,and risk of pancreatic adenocarcinoma).Cancer Epidemiol Biomarkers Prev 2006;15(4):726-31;Marfaing-Koka,A.,等人,由內皮細胞調節RANTES趨化因子的產生(Regulation of the production of the RANTES chemokine by endothelial cells).IFNγ與TNFα的協同誘導和IL-4和IL-13的抑制(Synergistic induction by IFN-gamma plus TNF-alpha and inhibition by IL-4and IL-13).Journal of Immunology,1995.154(4):p.1870-8)。
在一種實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,啟動子是RANTES啟動子。“RANTES”啟動子在本領域也被稱為“CCL5”啟動子。
由促炎介質誘導的啟動子的另外的例子是NF-kB應答元件,以及一般地為可以由TNF誘導的啟動子。
此外,抗炎性介質(例如TGF-β)激活的啟動子可以用于實現細胞毒性蛋白在間充質干細胞中的靶向表達。例子是含有Smad-結合元件的啟動子。使用由炎性介質誘導的啟動子使得能夠選擇性治療尚未經歷血管生成的腫瘤。
此外,癌組織中激活的或由癌細胞釋放的信號激活的啟動子可以用于本發明以實現編碼的細胞因子在患者的有關部位中選擇性表達,以避免不想要的全身作用。在癌癥中上調的啟動子的一個例子是HSP70啟動子。HSP70蛋白是主要的應激誘導型熱休克蛋白,它是在人腫瘤和腫瘤細胞系中豐富和優先表達的伴侶蛋白。由于HSP70保護細胞免受大范圍的凋亡和壞死刺激的能力,已經假設HSP70可以為腫瘤細胞提供存活優勢(Rohde等人,Genes Dev.Mar 1,2005;19(5):570–582;Nylandsted等人.,Ann N Y Acad Sci.2000;926:122-5;Ramp等人,Histol Histopathol.2007Oct;22(10):1099-107;Ricaniadis等人,Eur J Surg Oncol.2001Feb;27(1):88-93)。因此,HSP70啟動子是選擇性表達本發明涵蓋的治療性細胞因子的一種選擇。HSP70啟動子的更多信息可以獲得自Wu等人,Proc.Natl.Acad.Sci.USA,Vol.83,pp.629-633,1986。
“腫瘤特異性”啟動子的使用,或在炎性或“癌癥樣”條件下優先表達或誘導的啟動子的使用可以顯示與關于減少不想要的全身作用的MSC歸巢特性組合的協同作用。本發明的MSC向炎性組織遷移,尤其是向腫瘤組織遷移,從而提供了避免編碼的細胞因子在患者體內全身表達的有效手段。使用用于表達優先在炎癥條件下表達或在腫瘤組織中存在的條件下表達的細胞因子的啟動子進一步以協同方式增強了全身表達的減少,從而以基于MSC的方式施用本文描述的細胞因子提供了驚人的益處。
在一種實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,免疫應答刺激細胞因子保持或提高了腫瘤組織內的或接近腫瘤組織的免疫細胞的活性、存活率和/或數目。
如本領域已知的,免疫應答刺激細胞因子要被理解為直接或間接引起或產生免疫應答的誘導、激活和/或增強的任何細胞因子,所述免疫應答優選地針對抗原,例如腫瘤抗原。特別地,本發明的免疫應答刺激細胞因子優選被認為是引起對治療腫瘤疾病有利的免疫應答的誘導、激活和/或增強的細胞因子。
如本文使用的,術語免疫應答調控細胞因子或免疫應答相關的細胞因子可以相互交換地使用,并且涉及參與、調控、控制和/或調節由于免疫細胞分化、成熟和激活引起的包括抗腫瘤活性的免疫應答和/或炎性反應。
細胞因子是起細胞之間介質的作用的不同組的非抗體蛋白質。目前,細胞因子在臨床上被用作用于治療各種疾病的生物應答調節劑。術語細胞因子是用于描述一大組蛋白質的通用術語。特定類型的細胞因子可以包括:單核因子,也就是由單核吞噬細胞產生的細胞因子;淋巴因子,也就是由激活的淋巴細胞,特別是Th細胞產生的細胞因子;白細胞介素,也就是在白細胞之間起介質作用的細胞因子;以及趨化因子,也就是主要負責白細胞遷移的小的細胞因子。細胞因子信號傳導是靈活的,并且可以誘導保護應答和損傷應答。它們可以產生級聯反應,或提高或抑制其他細胞因子的產生。盡管細胞因子具有各種角色,技術人員知道可以將哪種細胞因子看作刺激免疫應答的細胞因子,并且因此將其應用于如本文描述的腫瘤疾病的治療中。
細胞因子具有調節免疫應答的能力,并且通常被腫瘤利用以允許腫瘤生長和操縱免疫應答。這些免疫調節作用允許細胞因子被用作藥物以驅使對抗腫瘤的免疫應答。
可以將以下細胞因子稱為免疫應答刺激細胞因子或免疫應答調節細胞因子。
在抗腫瘤治療中常用的兩組細胞因子是干擾素和白細胞介素。
干擾素是由通常參與抗病毒應答的免疫系統產生的細胞因子,而且還顯示了在治療癌癥中的有效性。存在三組干擾素(IFN):I型(IFNα和IFNβ)、II型(IFNγ)和相對新發現的III型(IFNλ)。IFNα被應用于毛細胞白血病、AIDS相關的卡波濟氏肉瘤、濾泡性淋巴瘤、慢性粒細胞白血病和黑色素瘤的治療。I型和II型IFN已經被廣泛研究,并且雖然兩種類型促進免疫系統的抗腫瘤作用,但是到目前為止僅I型IFN顯示了在癌癥治療中在臨床上是有效的。已經檢測了IFNλ在動物模型中的抗腫瘤作用,并且顯示了希望。
在優選的實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,免疫應答刺激細胞因子是IFNα。
在優選的實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,免疫應答刺激細胞因子是IFNγ。
在優選的實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,免疫應答刺激細胞因子是IFNβ。
根據本發明的某些實施方式,免疫應答刺激細胞因子或免疫應答調節細胞因子優選是參與T細胞調節或具有對T細胞的效應功能的細胞因子(T細胞調節細胞因子)。這些細胞因子展示了關于誘導促炎微環境的希望的特性,從而促進對抗腫瘤的免疫系統的激活和/或提高抗腫瘤免疫治療性治療的效果。這樣的細胞因子可能能夠吸引免疫效應細胞如T細胞,以及促進記憶免疫細胞的成熟。這些細胞因子的例子是IFNγ、IL-2、IL-12、IL-23、IL-15和IL-21(參考凱利的風濕病學教科書(Kelley's Textbook of Rheumatology);Firestein等人,8th ed.(ISBN 978-1-4160-3285-4),p367“細胞因子(Cytokines)”)。
本文提到的特定分子優選涉及哺乳動物分子,優選是人類分子,原因是對人受試者施用的適用性。例如,本文提到的細胞因子和/或趨化因子優選涉及人類序列,如技術人員可以不過分費力地獲得的,例如從序列數據庫如由美國國家生物技術信息中心(National Center for Biotechnology Information,NCBI)維護的序列數據庫獲得。
蛋白序列或編碼蛋白的核酸序列與通常已知的序列對比可以是修飾的,例如通過進行例如蛋白序列中的保守氨基酸置換或通過利用遺傳密碼的簡并性以改變編碼序列而不改變編碼的蛋白序列。正如技術人員所認識到的,生物分子的序列可以經由標準技術改變(突變),從而與已知的原始序列對比改善或保持它們的特性。因此,本發明的范圍涵蓋了保持已知序列的基本特性或功能上類似于已知序列的任何修飾的細胞因子序列。
在優選的實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,免疫應答刺激細胞因子是IL-2。
白細胞介素-2是可以提高免疫系統的抗腫瘤活性的細胞因子的例子,并且因此可以被用作癌癥的治療劑。白細胞介素-2被用于治療惡性黑色素瘤(商品名,)和腎細胞癌。在正常生理條件下,白細胞介素-2促進效應T細胞(產生免疫應答的細胞)和T調節細胞(抑制免疫應答的細胞),但是它在治療癌癥中的確切機制是未知的。最近的研究表明IL-2表達在癌癥治療中的有利作用。IL-2已經與過繼免疫治療如CART治療聯合使用,以促進T細胞的激活。然而,IL-2的全身施用帶來了廣泛免疫激活的風險,所述的廣泛免疫激活帶來了與CART治療相關的毒性。
在優選的實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,免疫應答刺激細胞因子是IL-7。
白細胞介素-7(IL-7)是由骨髓和胸腺中的基質細胞分泌的造血生長因子。IL-7刺激多能造血干細胞分化為淋巴樣祖細胞。在臨床前的動物研究和最近的用于各種惡性腫瘤和HIV感染期間的人類臨床試驗中檢測了作為免疫治療劑的IL-7(Fry TJ,Mackall CL(2002年6月).“白細胞介素-7:從實驗臺到臨床(Interleukin-7:from bench to clinic)”.Blood 99(11):3892–904)。
在優選的實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,免疫應答刺激細胞因子是IL-15。
白細胞介素15(IL-15)是與IL-2具有結構相似性的細胞因子。與IL-2一樣,IL-15結合于由IL-2/IL-15受體β鏈(CD122)和共同的γ鏈(γ-C,CD132)組成的復合物,并且通過所述復合物發信號。IL-15誘導天然殺傷細胞的細胞增殖;該天然殺傷細胞為固有免疫系統的細胞,其首要作用是殺傷病毒感染細胞或癌細胞。IL-15在臨床前模型中已經顯示提高CD8+T細胞的抗腫瘤免疫性(Klebanoff CA等人.Proc.Natl.Acad.Sci.U.S.A.101(7):1969–74)。
在優選的實施方式中,如本文描述的基因修飾間充質干細胞的特征在于,免疫應答刺激細胞因子是IL-21。
白細胞介素21(IL-21)是對免疫系統細胞具有有效調節作用的細胞因子,所述免疫系統細胞包括可以破壞病毒感染細胞或癌細胞的天然殺傷(NK)細胞和細胞毒性T細胞。IL-21已被批準用于轉移性黑色素瘤(MM)和腎細胞癌(RCC)患者的I期和II期臨床試驗(H,Skak K,Tissue Antigens74(6):467–79)。IL-21已經顯示對于伴有類似感冒癥狀作為副作用的施用是安全的。劑量限制性毒性包括低數量的淋巴細胞、嗜中性粒細胞和血小板,以及低的肝毒性。
白細胞介素12(IL-12)是由樹突細胞、巨噬細胞和人B類淋巴母細胞(NC-37)響應于抗原刺激而天然產生的白細胞介素。IL-12參與初始T細胞分化為Th1細胞。它被稱為T細胞刺激因子,能夠刺激T細胞的生長和功能,從而落入本發明的構思中。已知IL-12刺激干擾素γ(IFN-γ)和腫瘤壞死因子α(TNF-α)從T細胞和天然殺傷(NK)細胞中產生,并且減少IL-4介導的IFN-γ的抑制。IL-12還具有已知的抗血管生成活性。IL-12通過提高IFN-γ的產生起作用,這轉而提高了趨化因子CXCL10的產生。
白細胞介素12(IL-12)通過調節炎性應答、對感染的固有抗性和適應性免疫,尤其關于對抗癌細胞的免疫應答,在免疫的固有分支和適應性分支之間的相互作用中起作用(Colombo等人,細胞因子生長因子(Cytokine Growth Factor)Rev.2002Apr;13(2):155-68)。IL-12對于對許多病原體和對可移植或化學誘導的腫瘤的抗性是需要的。已知重組IL-12治療對可移植的腫瘤,對化學誘導的腫瘤和基因修飾小鼠中自發產生的腫瘤顯示抗腫瘤作用。因為這種能力,IL-12在癌癥中具有有效的佐劑活性。
然而直到目前,在臨床試驗中觀察到過度的臨床毒性和中度的臨床應答,因此需要使毒性最小化而不影響IL-12的抗腫瘤作用的新方法和施用方案。IL-12到目前為止在以對受試者無毒的劑量經由全身施用所測試的腫瘤中,沒有顯示出具有實質活性。
因此,本發明涉及如本文描述的MSC和其醫學用途,其中外源核酸編碼IL-12。有助于IL-12的位點特異性表達的基于MSC的方法代表了有助于避免在IL-12全身施用中固有的毒性的新穎且有利的方法。
本發明經由在本文描述的MSC中表達免疫刺激因子使得驚人的和有利的抗腫瘤活性成為可能。由MSC表達如本文描述的刺激性細胞因子支持抗腫瘤免疫應答,并且引起腫瘤尺寸和/或生長的減小,以及顯示了由全身施用本領域已知的這樣的細胞因子產生的副作用的顯著減小和/或避免。副作用如惡心和嘔吐、口腔或唇部潰瘍、腹瀉、困倦、過敏反應、發熱或發冷、蕁麻疹、瘙癢、頭痛、咳嗽、呼吸短促,或臉部、舌或喉部腫脹,可以通過本文描述的基于MSC的治療來避免。
因此,本發明提供了減少細胞因子治療的副作用的手段,以及細胞因子與免疫治療的共同使用,這通過使局部的(或局部限制的)腫瘤特異性作用成為可能,優選通過細胞的全身施用實現,但是以組織特異性方式,經由在合適的組織特異性條件下使用包含并表達所述細胞因子的MSC的細胞治療發揮作用。
因此本發明涉及用作本文描述的藥物的基因修飾間充質干細胞,其中外源核酸包含編碼兩種或更多種免疫應答刺激細胞因子的區域,所述編碼兩種或更多種免疫應答刺激細胞因子的區域可操作地連接于一個或多個啟動子或啟動子/增強子組合,其中細胞因子選自由IL-2、IL-7、IL-12、IL-15、IL21、IFNγ和IFNβ組成的組。
因此本發明涉及用作本文描述的藥物的基因修飾間充質干細胞,其中外源核酸包含編碼兩種或更多種免疫應答刺激細胞因子的區域,所述編碼兩種或更多種免疫應答刺激細胞因子的區域可操作地連接于一個或多個啟動子或啟動子/增強子組合,其中所述細胞因子至少包括IL-7和IL-21、IL-12和IL-2、IL-15和IL-12、IL-7和IL-12、或IL-21和IL-12。
本發明還涉及包含外源核酸分子的基因修飾間充質干細胞,其中所述外源核酸分子包括編碼誘導T細胞增殖和/或分化(和/或成熟為記憶細胞和避免腫瘤介導的免疫抑制)的免疫刺激分子的區域,該區域可操作地連接于啟動子或啟動子/增強子組合。
誘導T細胞增殖和/或分化的免疫刺激分子可以是如本文描述的細胞因子或其他免疫刺激分子,如趨化因子或細胞因子和趨化因子的組合。組合可以是優選的以確保免疫細胞被趨化因子適當地吸引,被適當地激活(通過引起激活的適當的細胞因子),以及針對記憶表型(通過促進記憶效應免疫細胞成熟的適當的細胞因子)。
在優選的實施方式中,基因修飾間充質干細胞的特征在于,誘導T細胞增殖和/或分化的免疫刺激分子是CD28。CD28(分化群28)是表達于T細胞上的提供對T細胞的激活所需要的共刺激信號的蛋白質之一。還發現了CD28刺激嗜酸性粒細胞,其中CD28與抗CD28抗體的結合引起IL-2、IL4、IL-13和IFNγ的釋放。
在優選的實施方式中,基因修飾間充質干細胞的特征在于,免疫應答刺激細胞因子是趨化因子。
本發明還涉及用作本文描述的藥物的基因修飾間充質干細胞,其中外源核酸包括編碼兩種或更多種免疫應答刺激細胞因子的區域,所述編碼兩種或更多種免疫應答刺激細胞因子的區域可操作地連接于一個或多個啟動子或啟動子/增強子組合,其中至少一種免疫應答刺激細胞因子是趨化因子。
本發明還涉及用作本文描述的藥物的基因修飾間充質干細胞,其中外源核酸包括編碼兩種或更多種免疫應答刺激細胞因子的區域,所述編碼兩種或更多種免疫應答刺激細胞因子的區域可操作地連接于一個或多個啟動子或啟動子/增強子組合,其中至少一種免疫應答刺激細胞因子是趨化因子,以及至少一種免疫應答刺激細胞因子選自由IL-2、IL-7、IL-12、IL-15、IL21、IFNγ和IFNβ組成的組。
在一種實施方式中,基因修飾間充質干細胞的特征在于,免疫應答刺激細胞因子是炎性趨化因子。
在一種實施方式中,基因修飾間充質干細胞的特征在于,免疫應答刺激細胞因子是具有用于吸引T細胞的趨化特性的趨化因子,例如CCL1、CCL2和/或CCL17。
趨化因子是指由細胞分泌的細胞因子(信號傳導蛋白)的亞組。趨化因子具有在附近的應答細胞中誘導指向趨化性的能力,它們是趨化細胞因子。根據共同結構特征如小的尺寸(尺寸典型為約8~10千道爾頓)和在對形成其三維形態關鍵的保守位置中存在4個半胱氨酸殘基將蛋白分類為趨化因子。在供選擇的定義下,細胞因子是已知的,如細胞因子的SIS家族、細胞因子的SIG家族、細胞因子的SCY家族、血小板因子-4超家族或間分泌(intercrines)。趨化因子被分類為四個主要亞族:CXC、CC、CX3C和XC。所有這些蛋白均通過與G蛋白偶聯膜受體(稱為趨化因子受體)相互作用發揮它們的生物作用,所述趨化因子受體選擇性地發現于它們的靶細胞的表面上。
趨化因子的主要作用是起化學引誘物的作用,以誘導免疫細胞或指導免疫細胞遷移。由趨化因子吸引的細胞循著增加趨化因子濃度的信號朝向趨化因子的來源。在免疫監視的過程中,某些趨化因子控制免疫系統的細胞,比如指導淋巴細胞到達淋巴結,因此它們能夠通過與存在于這些組織中的抗原提呈細胞相互作用篩選病原的入侵。某些趨化因子在發育中具有作用;它們促進血管生成(新血管的生長),或指導細胞到達提供對細胞成熟關鍵的特定信號的組織。其他趨化因子是炎性的并且響應于細菌感染、病毒和導致身體損傷的試劑如痛風中出現的二氧化硅或尿酸鹽結晶,從多種細胞中釋放。通常由促炎細胞因子如白細胞介素1刺激它們的釋放。炎性細胞因子主要起對白細胞的化學引誘物的作用,將來自血液的單核細胞、嗜中性粒細胞和其他效應細胞募集至感染或組織損傷的部位。某些炎性趨化因子激活細胞以起始免疫應答或促進創傷愈合。
趨化因子通常被認為是促炎或體內穩態的。在免疫應答期間可以誘導促炎細胞因子以將免疫系統的細胞募集至感染的部位或其他免疫靶標如腫瘤,然而體內穩態的細胞因子參與在組織保持或發育的過程中控制細胞的遷移。炎性細胞因子和趨化因子典型地在病理條件下形成(在促炎刺激下,如IL-1、TNF-α、LPS或病毒),以及主動地參與到吸引免疫細胞至炎癥部位的炎性應答中。
因此,本發明涉及本文描述的間充質干細胞,其中外源核酸編碼炎性趨化因子。這樣的趨化因子對技術人員是已知的。炎性趨化因子的例子涉及CXCL-8、CCL2、CCL3、CCL4、CCL5、CCL11和CXCL10、CXCL1、CXCL2。
在本發明的一種實施方式中,趨化因子能夠誘導T細胞(T淋巴細胞)遷移至表達趨化因子的MSC的部位。參與到將T淋巴細胞募集至炎癥部位的趨化因子的例子是CCL2、CCL1、CCL22和CCL17。這些趨化因子是已知的T細胞引誘物,并且因此可以被用于吸引內源患者的T細胞或提高過繼免疫治療劑(例如CART)歸巢至腫瘤。腫瘤中過繼免疫治療劑的歸巢是許多這樣的治療的已知缺陷,因此本發明帶來了顯著提高過繼免疫治療劑如CART的歸巢以及隨后的治療效果的潛力。
在某些實施方式中,趨化因子是CXC趨化因子,優選是CXCL13。
CXC趨化因子涉及其中CXC趨化因子(或α-趨化因子)的兩個N末端半胱氨酸被一個氨基酸(在該名稱中以“X”表示)分開的趨化因子。典型地存在兩類CXC趨化因子,一類是在CXC基序的第一個半胱氨酸之前緊接谷氨酸-亮氨酸-精氨酸基序(ELR基序)(ELR陽性),以及一類是不具有ELR基序(ELR陰性)。ELR陽性CXC趨化因子的例子是白細胞介素8(IL-8),其誘導嗜中性粒細胞離開血流并且進入周圍組織。ELR陰性趨化因子的例子是CXCL13,其顯示了對淋巴細胞的化學引誘物特性。
在本發明的一種實施方式中,趨化因子是CX3CL1,其屬于稱為CX3C趨化因子的趨化因子組。CX3C趨化因子涉及在兩個半胱氨酸之間具有三個氨基酸的趨化因子。CX3CL1被分泌并限制于表達它的細胞的表面,從而起到化學引誘物和粘附分子的作用。
在本發明的某些實施方式中,趨化因子選自由以下組成的組:基質細胞衍生因子1(SDF-1;CXCL12)、趨化因子(C-C基序)配體23(CCL23;巨噬細胞炎性蛋白3(MIP-3))、趨化因子(C-C基序)配體19(CCL19;EBI1;ELC或巨噬細胞炎性蛋白3-β(MIP-3-β))和趨化因子(C-C基序)配體4(CCL4;巨噬細胞炎性蛋白1-β(MIP-1-β))。
基質細胞衍生因子1也被稱為C-X-C基序趨化因子12(CXCL12)。基質細胞衍生因子1-α和基質細胞衍生因子1-β是屬于趨化因子家族的小細胞因子,是激活白細胞的成員,以及通常由促炎刺激物如脂多糖、TNF或IL1誘導。趨化因子被表征為存在形成2個二硫鍵的4個保守半胱氨酸。它們可以被分為2個亞家族。在CC亞家族中,半胱氨酸殘基是彼此相鄰的。在CXC亞家族中,它們被介于中間的氨基酸所分開。SDF1蛋白屬于后一組。SDF-1是通過交替拼接相同的基因以兩種形式,即SDF-1α/CXCL12a和SDF-1β/CXCL12b產生。因此,本發明涉及本文描述的MSC,其中外源核酸編碼SDF-1趨化因子,如SDF-1α/CXCL12a和/或SDF-1β/CXCL12b。
趨化因子(C-C基序)配體23(CCL23)是屬于CC趨化因子家族的細胞因子,也被稱為巨噬細胞炎性蛋白3(MIP-3)和髓系祖細胞(Myeloid progenitor)抑制因子1(MPIF-1)。CCL23主要表達于肺和肝臟組織中,然而其也在骨髓和胎盤中被發現。CCL23針對休眠T細胞和單核細胞是趨化性的。
趨化因子(C-C基序)配體19(CCL19)是屬于CC趨化因子家族的細胞因子,也被稱為EBI1配體趨化因子(ELC)和巨噬細胞炎性蛋白3-β(MIP-3-β)。CCL19在胸腺和淋巴結中豐富表達,在氣管和結腸中具有中等水平,以及在胃、小腸、肺、腎和脾臟中具有低水平。已知CCL19在T細胞在胸腺中的運輸和在將T細胞和B細胞遷移至次級淋巴器官中起重要作用。
CCL4,也被稱為巨噬細胞炎性蛋白1-β(MIP-1-β),是對CCR5受體具有特異性的CC趨化因子。它是對天然殺傷細胞、單核細胞和各種其他免疫細胞的化學引誘物。
所有免疫治療依賴于免疫應答的局部和適時激活,并且這轉而大大依賴于效應細胞的存在以發揮其功能。在腫瘤學的情況下,該功能導致腫瘤細胞的殺傷。然而,在許多情況下,僅不足量的免疫效應細胞被吸引至腫瘤,并且免疫治療的效果降低。
本文描述的趨化因子能夠展示對于在對抗腫瘤疾病的免疫應答中有利的T細胞募集特性。在基于MSC的表達和分子的遞送的情況下使用這樣的趨化因子能夠使關于位點特異性T細胞募集的驚人益處,以及減少與非靶向作用相關的副作用成為可能,所述非靶向作用由這樣的細胞因子/趨化因子的全身施用所導致。
在本發明的另一方面,基因修飾間充質干細胞用作本文描述的藥物的用途的特征在于,所述治療包括所述間充質干細胞與檢查點抑制劑的聯合施用。
正常地,由免疫系統破壞潛在癌性的細胞。所有癌細胞經歷將其與其鄰近細胞區別開的變化,最明顯的變化是能夠不受抑制地繁殖。癌細胞使用避免常規免疫系統控制的機制。檢查點蛋白已經被顯示為通過向免疫系統傳達潛在癌性的細胞將不被破壞而起作用。可能存在信號傳導細胞是癌性的其他分子,但是如果在細胞表面存在足夠的檢查點蛋白,免疫系統可能忽視癌性信號。
已經被研究作為癌癥治療靶標的配體受體相互作用是跨膜程序性死亡1蛋白(PD-1;也稱為CD279)和它的配體PD-1配體1(PD-L1)之間的相互作用。在正常生理下,細胞表面上的PD-L1結合于免疫細胞表面上的PD1,抑制免疫細胞的活性。由此看來癌細胞表面上的PD-L1的上調可以允許它們通過抑制可能另外攻擊腫瘤細胞的T細胞而逃逸宿主免疫系統。結合于PD-1或PD-L1并因此阻斷相互作用的抗體可以使T細胞攻擊腫瘤。
檢查點抑制劑(也被稱為免疫檢查點調節劑,或CPM)被設計為減輕檢查點蛋白的效力。雖然它們可能具有各種作用機制,但是如果是有效的,它們能夠使免疫系統識別癌細胞的表面上的其他分子。
在一種實施方式中,如本文描述的基因修飾間充質干細胞的醫學用途的特征在于,檢查點抑制劑與所述MSC的聯合施用,所述檢查點抑制劑優選為PD-L1和/或PD-1抑制劑。例子包括:納武單抗(Nivolumab)(BMS-936558、MDX-1106、ONO-4538),一種完全人免疫球蛋白G4(IgG4)單克隆PD-1抗體;蘭博利珠單抗(Lambrolizumab)(MK-3475),一種人源化單克隆IgG4PD-1抗體;和BMS-936559,一種完全人IgG4PD-L1抗體。
在一種實施方式中,如本文描述的基因修飾間充質干細胞的醫學用途的特征在于,檢查點抑制劑與所述MSC的聯合施用,所述檢查點抑制劑優選為CTLA-4抑制劑。例子包括曲美母單抗(Tremelimumab)(Pfizer,NY,USA)和伊匹單抗(ipilimumab),兩種抗CTLA-4的完全人單克隆抗體。
表達誘導T細胞增殖和/或分化的免疫應答刺激細胞因子和/或免疫刺激分子的MSC與檢查點抑制劑一起聯合施用引起關于希望的抗癌作用的協同作用。細胞因子或其他免疫刺激物提供對抗癌組織的T細胞應答的局部增強,同時檢查點抑制劑也使T細胞能夠更有效地攻擊和破壞癌組織。這兩種藥劑的作用是以協同方式聯合,導致技術效果大于單獨考慮時這兩個方面的總和。
在進一步的實施方式中,本發明涉及用作本文描述的藥物的基因修飾間充質干細胞,其中免疫治療包括腫瘤抗原的施用。
本發明用于提高癌癥疫苗的治療效果。癌癥疫苗指揮免疫系統增強對體內癌細胞的攻擊。它們激活免疫系統以攻擊已經存在的疾病,而不是像用于防止感染的疫苗一樣防止疾病。某些癌癥治療疫苗是由癌細胞、細胞的部分或純抗原制成的。有時,將患者自身的免疫細胞如T細胞或抗原提呈細胞移出并且在實驗室中暴露于這些物質以制造疫苗。一旦準備好疫苗,將其注入體內以介導對抗癌細胞的免疫應答。疫苗通常與幫助更進一步加強免疫應答的稱為佐劑的其他物質或細胞聯合。癌癥疫苗引起免疫系統攻擊具有一個或多個特異性抗原的細胞。細胞適應性免疫應答的激活引起免疫學記憶,因此,希望在給予疫苗后,疫苗可以繼續長時間工作。在許多情況下,腫瘤介導的免疫抑制阻礙了癌癥疫苗的效果和免疫激活。期望癌癥疫苗與所述間充質干細胞的聯合以去除或降低免疫抑制,或不管任何持續免疫抑制而促進免疫激活。
因此,如本文描述的MSC可以被認為是免疫治療劑本身,或作為用于共同施用的免疫治療劑或藥劑的佐劑。
本發明的進一步的方面涉及用作如本文描述的藥物的基因修飾間充質干細胞,其中所述治療包括所述間充質干細胞與免疫細胞的聯合施用。本發明涵蓋了,由于適當的趨化因子的表達,在施用免疫細胞(例如CART)前施用基因修飾MSC會提供CART和其他免疫效應細胞的趨化性。刺激細胞因子的表達會僅僅局部地,優選在腫瘤內或接近于腫瘤處提高T細胞的激活,并且隨后導致記憶效應細胞表型,從而延長治療的療效。
通過參與免疫應答的大量不同類型的細胞的復雜相互作用和活性,安排對病原體和癌組織的應答。如本文使用的免疫細胞可以涉及如以下過程的情況中所描述的任何如下的細胞類型:固有免疫應答是第一道防線,并且在病原體暴露或暴露于“外來”或癌性物質之后不久發生。這通過吞噬細胞(如嗜中性粒細胞和巨噬細胞)、細胞毒性天然殺傷(NK)細胞和粒細胞進行。隨后的適應性免疫應答包括抗原特異性防御機制,并且可能需要幾天以發展。在適應性免疫中具有關鍵作用的細胞類型是包括巨噬細胞和樹突細胞的抗原提呈細胞。包括T細胞亞集、B細胞和巨噬細胞的各種細胞類型的抗原依賴性刺激都在宿主防御中起關鍵作用。如本文描述的免疫細胞涉及參與受試者的免疫應答的生物細胞。免疫細胞優選選自T細胞、B細胞、樹突細胞、粒細胞、固有淋巴樣細胞(ILC)、巨核細胞、單核細胞/巨噬細胞、天然殺傷(NK)細胞、血小板、紅細胞(RBC)和/或胸腺細胞。
由其獲得間充質干細胞和/或免疫細胞的受試者可以與細胞培養后所要施用的受試者是相同的。因此,這樣的細胞可以被認為是自體的。然而,細胞可以獲得自與預期患者不同的受試者,因此被認為是同種異體的。如本文使用的,相對于受試者,如果細胞或任何其前體細胞來自相同物種的另一受試者,則該細胞是“同種異體的”。如本文使用的,就受試者而言,如果細胞或任何其前體細胞來自相同的受試者,則該細胞是“自體的”。在優選的實施方式中,免疫細胞對醫學治療的受試者是自體的。
在優選的實施方式中,免疫細胞是T細胞。在其他實施方式中,免疫細胞是包括人工T細胞受體(如嵌合抗原受體(CART))的T細胞,其中所述T細胞受體特異性結合于腫瘤抗原(Lee,DW等人,Clin Cancer Res;2012;18(10);2780–90)。在進一步的實施方式中,免疫細胞是巨噬細胞,優選是M1巨噬細胞和/或單核細胞。
單核細胞是一類白細胞(白細胞(leukocyte))。它們是所有白細胞中最大的。它們是包括所有哺乳動物(包括人類)的脊椎動物的固有免疫系統的一部分。單核細胞通過骨髓由稱為成單核細胞的前體產生,所述成單核細胞是由造血干細胞分化的雙能(bipotent)細胞。單核細胞在血液中循環大約1至3天,然后典型地移動入遍及全身的組織中。它們構成了血液中3%~8%的白細胞。在組織中,單核細胞在不同的解剖學位置成熟為不同類型的巨噬細胞。
巨噬細胞(macrophage),有時稱為巨噬細胞(macrophagocyte),是通過組織中的單核細胞分化產生的細胞。單核細胞和巨噬細胞是吞噬細胞。巨噬細胞在非特異性防御(固有免疫)中起作用,以及幫助啟動脊椎動物的特異性防御機制(適應性免疫)。主要表達殺傷表型的巨噬細胞被稱為M1巨噬細胞,而參與組織修復的巨噬細胞被稱為M2巨噬細胞。巨噬細胞的作用是作為靜止細胞或移動細胞吞噬或吞入然后消化細胞碎片和病原體。它們還刺激淋巴細胞和其他免疫細胞以應答病原體。它們是通過破壞和攝取攻擊外來物質、感染性微生物和癌細胞的專門的吞噬細胞。
因此,在一種實施方式中,本發明涉及癌癥免疫治療和包括過繼細胞轉移的方法,其涵蓋了用于攻擊癌細胞的基于T細胞的細胞毒性應答。
癌癥免疫治療試圖刺激免疫系統以排斥和破壞腫瘤。首先,免疫療法治療涉及細胞因子如白細胞介素的施用。然后,因為靜脈和全身施用細胞因子的不良作用,使用從血液提取淋巴細胞,并且在體外針對腫瘤抗原擴增這些細胞,然后將所述細胞與適當的刺激性細胞因子注射來嘗試供選擇的方法。然后所述細胞特異性地靶向并破壞針對它們所產生的腫瘤表達抗原。盡管有這些方法,用于用細胞因子適當刺激這樣的細胞的方法不足以有效地產生令人信服的腫瘤減小。顯著的副作用也由所需要的大量細胞因子產生。
免疫治療的這些之前嘗試的一種方法涉及使患者自身的免疫細胞工程化以識別和攻擊他們的腫瘤。而且雖然這種稱為過繼細胞轉移(ACT)的方法目前被限制于臨床試驗,但是使用這些工程化的免疫細胞的治療已經對患有晚期癌癥的患者產生了治療應答。
因此,本發明涵蓋與施用本文描述的MSC聯合的過繼細胞轉移。本發明涵蓋了,由于適當的細胞因子的表達,在施用免疫細胞(CART)前施用基因修飾MSC會提高CART和在過繼細胞轉移期間施用的其他免疫效應細胞的趨化性。刺激細胞因子的表達會僅僅局部地優選在腫瘤內或接近于腫瘤處提高T細胞的激活,隨后導致記憶效應細胞表型,從而延長治療的療效。
過繼細胞轉移使用基于T細胞的細胞毒性應答來攻擊癌細胞。在體外產生對患者的癌細胞具有天然或基因工程化的反應性的T細胞,然后轉移回至癌癥患者。使用自體腫瘤浸潤淋巴細胞作為對患有轉移性黑色素瘤的患者有效的治療。這可以通過取患者的腫瘤中發現的T細胞,培養所述T細胞以攻擊癌細胞來實現。這些T細胞可以被稱為腫瘤浸潤淋巴細胞(TIL)。可以使用高濃度的IL-2、抗CD3和異常反應性飼養細胞刺激這樣的T細胞以在體外擴增。習慣上,然后將這些T細胞轉移回至患者,同時外源施用IL-2以進一步加強它們的抗癌活性。
在一種實施方式中本發明涵蓋經由如本文描述的基因修飾MSC施用用IL-2。通過該方法,避免了全身施用IL-2的副作用,同時保持和/或提高了T細胞轉移的有利作用。對于單獨的IL-12、IL-7、IL-21和/或IL-15或其組合,獲得相似的效果以實現免疫學記憶的激活和建立。
因此,本發明提供了用于產生局部和組織特異性細胞因子以刺激抗腫瘤免疫應答,優選由細胞毒性T細胞和/或NK細胞介導的抗腫瘤免疫應答的新方法。
人工T細胞受體(也稱為嵌合T細胞受體、嵌合免疫受體、嵌合抗原受體(CAR))是將任意的特異性移入免疫效應細胞上的工程化受體。典型地,這些受體用于將單克隆抗體的特異性移入T細胞上;通過反轉錄病毒載體促進所述受體的編碼序列的轉移。
在一種實施方式中,可以通過用含有T細胞受體(TCR)基因拷貝的病毒感染患者的細胞來制備基因工程化T細胞,所述T細胞受體(TCR)基因是專門識別腫瘤抗原的。病毒不能在細胞中復制,然而可以整合到人基因組中。這是有利的,因為新的TCR基因在T細胞中保持穩定。將患者自身的T細胞暴露于這些病毒,然后非特異性地擴增或使用基因工程化的TCR刺激。然后將細胞轉移回至患者中,并且準備對腫瘤具有免疫應答。第二代和第三代CAR典型地由單克隆抗體的片段組成,稱為單鏈可變區片段(scFv),其存在于T細胞膜的外部,并且連接于T細胞內側的刺激部分。scFv部分引導細胞至靶抗原。一旦T細胞結合于它的靶抗原,刺激分子為T細胞提供必要的信號以成為完全活性的T細胞。在該完全活性狀態下,T細胞可以更有效地增殖,以及可以攻擊癌細胞。
表達誘導T細胞增殖和/或分化的免疫應答刺激細胞因子和/或免疫刺激因子的MSC與免疫細胞,優選為T細胞如本文描述的那些一起聯合施用,以及任選地與檢查點抑制劑的進一步聯合施用,導致關于希望的抗癌作用的協同作用。檢查點抑制劑可以與表達刺激性細胞因子的MSC組合,以提高另外施用的免疫細胞的抗腫瘤作用,從而在抗腫瘤治療中產生與預料不到的效果相關的因素的組合。
在進一步的實施方式中,本發明涉及用作如本文所述的藥物的基因修飾間充質干細胞,其中免疫治療包括來源于患者的腫瘤物質的施用。
在進一步的實施方式中,本發明涉及用作如本文所述的藥物的基因修飾間充質干細胞,其中免疫治療包括靶向于腫瘤特異性抗原的抗體或抗體片段的施用。
例如,抗體依賴性細胞介導的細胞毒性(ADCC)是細胞介導的免疫防御機制,由此,免疫系統的效應細胞主動地裂解靶細胞如癌細胞,所述靶細胞的膜表面抗原被特異性抗體結合。這是作為體液免疫應答的部件的抗體可以用于限制和控制癌生長的機制之一。之前的報道已經表明ADCC是包括曲妥單抗和利妥昔單抗的治療性單克隆抗體對抗腫瘤的重要作用機制。本發明涵蓋了如本文描述的MSC與抗腫瘤抗體治療的聯合施用。
例如,可以施用同時靶向于腫瘤特異性抗原和T細胞上的CD3分子的雙特異性抗體作為抗腫瘤免疫治療。
具體實施方式
免疫系統的重要作用是鑒別和消除腫瘤。腫瘤的轉化癌細胞表達在正常細胞上沒有發現的抗原。對于免疫系統來說,這些抗原表現出是外來的,并且它們的出現導致免疫細胞攻擊轉化的腫瘤細胞。由腫瘤表達的抗原具有幾種來源。某些抗原來源于致癌病毒如導致宮頸癌的人乳頭瘤病毒,而其他抗原是有機體自身的蛋白,所述蛋白在正常細胞種以低水平存在,但是在腫瘤細胞中達到高水平。一個例子是稱為酪氨酸酶的酶,當該酶以高水平表達時使某些皮膚細胞(例如黑色素細胞)轉化為稱為黑色素瘤的腫瘤。腫瘤抗原的第三種可能的來源是對調節細胞增長和存活通常重要的蛋白,其通常突變為稱為癌基因的癌癥誘導分子。
免疫系統對腫瘤的主要應答是使用殺傷T細胞破壞異常細胞,有時伴隨輔助T細胞的協助。腫瘤抗原以與病毒抗原相似的方式提呈給MHC I類分子。這允許殺傷T細胞識別腫瘤細胞為異常的細胞。NK細胞也以相似的方式殺傷腫瘤細胞,尤其是如果腫瘤細胞在該NK細胞表面上具有比正常細胞少的MHC I類分子;這是腫瘤的常見現象。某些腫瘤細胞還釋放抑制免疫應答的產物;例如通過分泌抑制巨噬細胞和淋巴細胞的活性的細胞因子TGF-β。
因此,本發明提供了通過由如本文描述的基因修飾MSC表達免疫刺激細胞因子來支持抗腫瘤免疫反應的方法。
在本發明的情況下,免疫治療被理解為涵蓋使用免疫系統治療癌癥的任何治療劑。免疫治療利用了如下事實:癌細胞在其表面上具有可以被免疫系統檢測到的微妙不同的分子。這些分子被稱為癌癥抗原,是最常見的蛋白質,而且包括如碳水化合物的分子。免疫治療在攻擊腫瘤細胞中通過使用這些抗原作為靶標激發或增強免疫系統。
免疫治療涵蓋但不限于細胞治療和抗體治療。
細胞治療典型地涉及施用從患者的血液或從患者的腫瘤中分離的免疫細胞。將針對要治療的腫瘤的免疫細胞激活、培養,以及轉移回患者的免疫細胞攻擊癌癥的位置。可以以該方式使用的細胞類型不限于天然殺傷細胞、淋巴因子激活的殺傷細胞、細胞毒性T細胞和樹突細胞。樹突細胞治療通過引起樹突細胞提呈腫瘤抗原來激發抗腫瘤應答。樹突細胞將抗原提呈至淋巴細胞,這激活了淋巴細胞并且使其致敏以殺傷提呈該抗原的其他細胞。
抗體是由免疫系統產生的結合于細胞表面上的靶抗原的蛋白質。結合于癌癥抗原的抗體可以用于治療癌癥。細胞表面受體是用于抗體治療的常見靶標,并且包括例如CD20、CD274和CD279。一旦結合于癌癥抗原,抗體可以誘導抗體依賴性細胞介導的細胞毒性,激活補體系統,或防止受體與其配體相互作用,所有這些都可以導致細胞死亡。多種抗體被批準用于治療癌癥,包括阿倫單抗(Alemtuzumab)、伊匹單抗、納武單抗、奧法木單抗(Ofatumumab)和利妥昔單抗。
抗體依賴性細胞介導的細胞毒性(ADCC)是通過免疫系統攻擊的機制,其需要抗體結合于靶細胞表面的抗體。抗體由可以通過免疫細胞經由其Fc表面受體檢測到的結合區(Fab)和Fc區組成。在包括天然殺傷細胞的許多免疫系統細胞上發現了Fc受體。當天然殺傷細胞遭遇抗體包覆的細胞時,后者的Fc區與天然殺傷細胞的Fc受體相互作用,導致穿孔素和顆粒酶B的釋放。這兩種化學物質編程腫瘤細胞中的細胞死亡(凋亡)。有效抗體包括利妥昔單抗、奧法木單抗和阿倫單抗。
補體系統包括在抗體結合于細胞表面后引起細胞死亡的血液蛋白。通常地,系統處理外來病原體,但是可以用癌癥中的治療性抗體激活。如果抗體是嵌合的、人源化的或人的,就可以觸發系統;只要它含有IgG1的Fc區。補體可以通過膜攻擊復合體的激活,其被稱為補體依賴性細胞毒性;增強抗體依賴性細胞介導的細胞毒性;以及CR3依賴性細胞毒性引起細胞死亡。當抗體結合于癌細胞表面、C1復合體結合于這些抗體、隨后在癌細胞膜上形成蛋白孔時,補體依賴性細胞毒性會發生。
可以通過優選細胞的或基于抗體的抗腫瘤免疫療法靶向于腫瘤相關抗原或腫瘤特異性抗原,所述腫瘤相關抗原或腫瘤特異性抗原包括但不限于唯一地或主要地由腫瘤細胞表達并且可以被免疫治療靶向的、技術人員已知的或可以由技術人員鑒別的抗原。作為非限制性的例子,腫瘤相關抗原或腫瘤特異性抗原涵蓋在由于突變導致具有異常結構的腫瘤細胞中產生的蛋白質,如原癌基因、ras和p53基因的異常產物;或與腫瘤細胞相關的其他蛋白,如組織分化抗原、分化群(通常縮寫為CD)細胞表面分子、突變蛋白抗原、致癌病毒抗原、癌-睪丸抗原(cancer-testis antigens)和血管或基質特異性抗原。糖蛋白、糖脂、碳水化合物或生長因子受體也可以被認為是作為抗腫瘤免疫治療靶標的腫瘤相關抗原或腫瘤特異性抗原。
本發明的MSC能夠通過它們的來源于免疫應答刺激轉基因細胞因子的獨特特性和MSC固有的抗炎特性支持和/或增強本文描述的免疫治療。
如本文描述的,“腫瘤”應該包括但不限于前列腺瘤、胰腺瘤、鱗狀細胞癌、乳腺瘤、黑色素瘤、基底細胞癌、肝細胞癌、膽管細胞癌、睪丸癌、成神經細胞瘤、膠質瘤或惡性星形細胞瘤如多形性成膠質細胞瘤(glioblastma multiforme)、結腸直腸瘤、子宮內膜癌、肺癌、卵巢瘤、宮頸瘤、骨肉瘤、橫紋肌/平滑肌肉瘤、滑膜肉瘤、血管肉瘤、艾文氏肉瘤/PNET和惡性淋巴瘤。這些包括原發腫瘤以及轉移腫瘤(血管化的和非血管化的)。
本文公開的“間充質干細胞”可以產生循環系統和淋巴系統中的結締組織、骨、軟骨和細胞。在間充質中發現間充質干細胞,所述間充質是由寬松包裹的梭形或星形非專門化細胞組成的胚胎中胚層的一部分。如本文使用的,間充質干細胞包括但不限于CD34陰性干細胞。
在本發明的一種實施方式中,間充質干細胞是塑料粘著性細胞(plastic-adherent cells),在某些實施方式中定義為多能間充質干細胞,并且還包括CD34陰性細胞。為了避免任何疑問,術語間充質干細胞涵蓋多能間充質基質細胞,該多能間充質基質細胞也包括間充質細胞、MSC和它們的前體的亞群,所述亞群由能夠在體內分化為多種細胞類型的多能(multipotent)或多能(pluripotent)自我更新細胞組成。
如本文使用的,CD34陰性細胞應該是指在其表面缺少CD34的細胞或僅表達可以忽略水平的CD34的細胞。CD34陰性細胞和分離這樣的細胞的方法,例如描述于Lange C.等人,“在無動物血清的培養基中快速和安全地擴增人間充質基質細胞用于移植和再生醫學(Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine)”.J.Cell Physiol.2007,Apr.25中。
可以通過許多指標將間充質干細胞與造血干細胞(HSC)區別開。例如已知HSC在培養物中漂浮并且不黏著于塑料表面。相反,間充質干細胞黏著于塑料表面。本發明的CD34陰性的間充質干細胞在培養物中是粘附的。
本文描述的基因修飾的細胞可以根據其以固體、液體還是噴霧形式施用,以及對于這樣的施用途徑其作為注射劑是否需要無菌,包括不同類型的載體。本發明可以靜脈內、皮內、動脈內、腹腔內、病變內、顱內、關節腔內、前列腺內、胸腔內、氣管內、鼻內、玻璃體內、陰道內、直腸內、總體地(topically)、瘤內、肌內、腹腔內、皮下、結膜下、小泡內(intravesicularlly)、粘膜、心包內、臍帶內、眼內、經口、總體地(topically)、局部地(locally),吸入(例如霧化吸入)、注射、輸注、持續輸注、局部灌注直接洗滌靶細胞,經由導管、經由灌洗,以膏狀、以脂質組合物(例如脂質體),或通過如本領域技術人員已知的其他方法或上述的任意組合施用(見例如,雷明頓的藥物科學(Remington's Pharmaceutical Sciences),18th Ed.Mack Printing Company,1990,通過引用在此并入)。
本發明涵蓋了通過將治療有效數目的細胞引入受試者的血流來治療患者。如本文使用,將細胞“引入受試者的血流”應包括但不限于將這樣的細胞通過注射引入受試者的靜脈或動脈之一。這樣的施用也可以進行例如一次、多次和/或在一個或多個延長的時間段內。單次注射是優選的,但是在某些情況下經過一段時間(例如每季度、每半年或每年)重復注射是必要的。這樣的施用也優選使用CD34-陰性細胞和藥學上可接受的載體的混合物進行。藥學上可接受的載體對本領域技術人員是熟知的,其包括但不限于0.01-0.1M和優選0.05M磷酸鹽緩沖液或0.8%鹽水,以及通常使用的專用深低溫保存培養基。
可以局部地進行施用,例如通過注入患者體內接近于腫瘤疾病的區域。MSC顯示向癌組織遷移。無論如何,局部施用如本文描述的細胞會在其作用部位導致高水平的細胞。
此外,這樣的藥學上可接受的載體可以是水溶液或非水溶液、懸浮液和乳液,最優選是水溶液。含水載體包括水、酒精/水溶液、乳液和懸浮液,包括鹽水和緩沖介質。非胃腸載體包括氯化鈉溶液、林格氏葡萄糖、葡萄糖和氯化鈉、乳酸林格氏液和固定油。靜脈內載體包括流體營養補充劑、電解質補充劑如林格氏葡萄糖、基于林格氏葡萄糖的載體等。通常可以在例如雷明頓:藥學的科學與實踐(Remington:The Science and Practice of Pharmacy),20th Ed.,p.808,Lippincott Williams S-Wilkins(2000)中找到通常用于靜脈內施用的流體。還可以存在防腐劑和其他添加劑,例如抗微生物劑、抗氧化劑、螯合劑、惰性氣體等。
如本文使用的,“治療有效數目的細胞”包括但不限于以下的量和量的范圍:(i)約1×102至約1×108個細胞/kg體重;(ii)約1×103至約1×107個細胞/kg體重;(iii)約1×104至約1×106個細胞/kg體重;(iv)約1×104至約1×105個細胞/kg體重;(v)約1×105至約1×106個細胞/kg體重;(vi)約5×104至約0.5×105個細胞/kg體重;(vii)約1×103個細胞/kg體重;(viii)約1×104個細胞/kg體重;(ix)約5×104個細胞/kg體重;(x)約1×105個細胞/kg體重;(xi)約5×105個細胞/kg體重;(xii)約1×106個細胞/kg體重;以及(xiii)約1×107個細胞/kg體重。人體重預期包括但不限于約5kg、10kg、15kg、30kg、50kg、約60kg;約70kg;約80kg、約90kg;約100kg、約120kg和約150kg。這些數目基于臨床前的動物實驗和人體試驗以及來自CD34+造血干細胞移植的標準方案。單核細胞(包括CD34+細胞)通常含有1:23000至1:300000的CD34陰性細胞。
如本文使用的,“治療”患有疾病的受試者應該是指減慢、停止或逆轉疾病進程。在優選的實施方式中,治療患有疾病的受試者是指理想地使疾病進程逆轉至消除疾病本身的點。如本文使用的,改善疾病和治療疾病是等價的。本發明的治療也可以或供選擇地涉及所述細胞的預防性施用。這樣的預防性施用可以涉及防止任何給定的醫學疾病,或防止所述疾病的發展,由此防止或預防將不在所有條件下狹義地被解釋為絕對的防止。防止或預防可能還涉及減少受試者發展出任何給定的醫學病癥的風險,優選對于處于所述病癥的風險中的受試者。
聯合施用涵蓋同時治療,共同治療(co-treatment)或聯合治療,并且包括施用MSC與免疫治療劑如檢查點抑制劑和/或免疫細胞的單獨制劑,據此,治療可以在彼此間的幾分鐘內發生,與彼此發生在同一小時內,在同一天,在同一周內或在同一個月內。術語“聯合施用”還涵蓋有順序地施用組合劑(例如MSC、免疫細胞和/或檢查點抑制劑)的任何給定的組合。還使用了包含一種或多種所述MSC與另一種免疫治療劑如檢查點抑制劑和/或免疫細胞的組合藥物,以共同施用單次施用或單次劑量的各種組分。
通過幾分鐘至幾周的間隔,聯合免疫治療可以在用基因修飾的干細胞治療之前或之后。在將其他免疫治療劑和基因修飾干細胞單獨施用于感興趣的部位的實施方式中,通常會確保在每次遞送的時間之間主要的時間段沒有過期,以使得藥劑和基因修飾的干細胞仍然能夠在治療部位發揮有利的聯合作用。在這樣的情況下,預期將會使兩種形式的細胞在以下時間內接觸:在彼此間的約12-24小時內,以及更優選在彼此間的約6-12小時內,最優選具有僅約12小時的延遲時間。然而在某些情況下,顯著延長治療的時期可能是希望的,其中在各自施用之間經過幾天(2、3、4、5、6或7)至幾周(1、2、3、4、5、6、7或8)。
如本文使用的術語“基質”是指組織或器官(或腺體、組織或其他結構)的支持性骨架,通常由胞外基質(ECM)和基質細胞組成。基質與由該器官的關鍵功能元件組成的實質(parenchyma)不同。與表皮(皮膚的最頂層)相鄰的(真皮層中的)基質細胞釋放促進細胞分裂的生長因子。基質由非惡性的宿主細胞組成。基質提供了胞外基質,在所述胞外基質上腫瘤可以生長并保持存在或將它們自身從免疫環境分離。
如本文使用的,術語“腫瘤微環境”涉及任何給定的腫瘤所存在的細胞環境,包括腫瘤基質、周圍的血管、免疫細胞、成纖維細胞、其他細胞、信號傳導分子和ECM。
如本文使用的,“細胞遷移”或“歸巢”意圖是指細胞朝向特定的化學或物理信號的移動。細胞通常響應于特定的外部信號而遷移,包括化學信號和機械信號。如本文描述的MSC能夠歸巢至腫瘤組織或其他炎癥信號。
趨化性是關于應答于化學刺激的細胞遷移的一個例子。體外趨化性測定如博伊登室測定(Boyden chamber assays)可以用于確定在任何給定的細胞中是否有細胞遷移。
例如,可以純化和分析感興趣的細胞。使用板可以進行趨化性測定(例如根據Falk等人,1980J.Immuno.Methods 33:239-247),在所述板中將特定的化學信號關于有興趣的細胞和遷移的細胞放置,然后收集并且分析。例如,博伊登室測定需要使用通過過濾器分離的室,用作準確確定趨化行為的工具。這些室的先鋒類型由Boyden構建(Boyden(1962)"多形核白細胞上的抗原和抗體的混合物的趨化作用(The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes)".J Exp Med 115(3):453)。將運動細胞置于上室,同時將含有測試物質的流體過填充至下室。要研究的運動細胞的尺寸決定過濾器的孔徑;選擇允許活性遷移的直徑是必要的。對于在體內條件下建模,幾種方案優選用胞外基質分子(膠原蛋白、彈性蛋白等)覆蓋過濾器。通過發展多孔室(例如NeuroProbe),增加測量的有效性,其中可平行評價24、96、384個樣本。該變體的優勢是在相同的條件下測試多個平行樣本。
如本文使用的“移入”是指將移植的(grafted)或移植的(transplanted)組織或細胞并入宿主體內的過程。移入也涉及將移植的細胞整合至宿主組織以及它們的存活和在某些條件下分化為非干細胞狀態。
用于評價MSC的移入和由此MSC在一定程度上的遷移和生物分布的技術可以涵蓋體內或體外方法。體內方法的例子包括生物發光,由此轉導細胞以表達熒光素酶,然后可以通過它們的熒光素代謝將細胞成像,導致光發射;熒光,由此使細胞負載熒光染料或轉導以表達然后可以成像的熒光報告分子;放射性核素標記,其中使細胞負載放射性核素并用閃爍照相法(scintigraphy)、正電子放射斷層造影術(PET)或單光子發射計算機斷層造影術(SPECT)以及磁共振成像(MRI)定位,其中用MRI掃描儀追蹤負載有順磁性化合物(例如氧化鐵納米顆粒)的細胞。評價生物分布的體外方法包括定量PCR、流式細胞術和組織學方法。組織學方法包括追蹤熒光標記的細胞;對例如Y染色體和人特異性ALU序列原位雜交;和對物種特異性的或基因引入的蛋白(如細菌β-半乳糖苷酶)的組織化學染色。這些免疫組織化學方法用于辨別移入位置,但是有必要切除組織。對于進一步回顧這些方法和它們的應用,見Kean等人,MSC:遞送的路徑和移入細胞靶向策略以及免疫調節(MSCs:Delivery Routes and Engraftment,Cell-Targeting Strategies,and Immune Modulation),Stem Cells International,Volume 2013(2013)。
祖細胞或多能細胞,如本發明的間充質干細胞,可以被描述為基因遞送載體,基本上能夠使治療性基因產物在受試者體內的特定組織或區域內定位和表達。這樣的治療性細胞提供了為其他治療難治的疾病提供細胞治療的能力。對于每種類型的治療性細胞,最終目標是相同的:細胞應該表達特異性的全部基因,優選編碼治療性基因產物的外源核酸,由此修改細胞一致性以表達所述基因產物,以及提供治療性作用,如免疫刺激作用。當本發明的細胞在體外擴增時,其表現出包括多代間充質(基質)細胞后代的異源群體,其缺少多數分化標記如CD34的表達。這些群體可能保留了沿著間充質譜系和非間充質譜系的終末分化和成熟的有限的增殖潛力和應答性。
如本文使用的“誘導型表達”或“條件性表達”涉及基因表達的狀態、多重狀態或系統,其中感興趣的基因如免疫刺激細胞因子優選是不表達的,或在某些實施方式中,以可忽略的或相對低的水平表達,除非細胞中存在允許基因表達的一種或多種分子(誘導劑)或其他一組條件。誘導型啟動子可以涉及在特定的生物條件下以相對高水平表達的天然存在的啟動子,或涉及包括任何給定的誘導型元件的其他合成啟動子。誘導型啟動子可以是指通過特定組織或微環境或存在于特定組織或微環境中的生物信號的組合所誘導的啟動子,或指由外部因素,例如通過施用小的藥物分子或其他外部施加的信號誘導的啟動子。
如本文使用的,接近組織包括例如在組織的50mm、10mm、5mm、1mm之內,在組織的0.5mm之內和在組織的0.25mm之內。
本文描述的細胞因子可以涉及與本文所稱的細胞因子對應的任何哺乳動物細胞因子。優選地,細胞因子涉及人細胞因子或小鼠細胞因子。
考慮到干細胞可以顯示在正常以及病態環境下對不同組織微環境的選擇性遷移,本發明涵蓋了與在募集的干細胞中啟動的分化途徑聯系的組織特異性啟動子的使用,并且所述組織特異性啟動子理論上可以用于在限定的生物環境下僅驅動選擇性表達治療性基因。募集至其他組織部位但是沒有經歷分化的相同程序的干細胞不應表達治療性基因。該方法使得顯著程度地控制治療性基因在限定的微環境內選擇性表達,以及該方法已經成功應用于在新血管生成期間調節治療性基因表達。WO 2008/150368和WO 2010/119039中公開了這樣的基因修飾的可能方法,據此將其全文并入。
附圖說明
為了描述本發明的具體實施方式,通過證明本發明的實踐實施提供了以下附圖,而不限制對本發明的范圍或本文描述的構思。
附圖簡述:
圖1:在體外表達細胞因子的基因修飾的人MSC。
圖2:本發明的優選的病毒表達構建體。
圖3:用病毒表達構建體轉導的細胞的胞內FACS分選。
圖4:轉基因細胞因子的ELISA檢測。
附圖詳述:
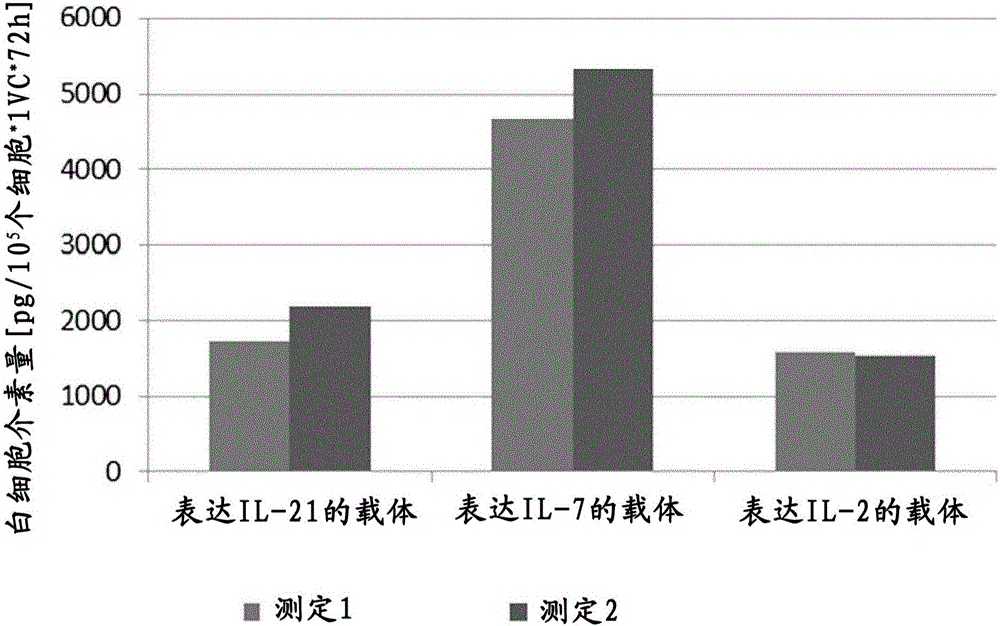
圖1:在體外表達細胞因子的基因修飾的人MSC:用表達圖中所示細胞因子和pac嘌呤霉素抗性基因的反轉錄病毒載體轉導原代人MSC(MOI為0.25)。轉導后,使用嘌呤霉素選擇轉導的MSC,并且通過qPCR確定每個細胞的平均載體拷貝數。然后將選擇的細胞接種用于ELISA測定(人IL-2Thermo Scientific公司(賽默飛世爾科技公司)EH2IL2,人IL-7Thermo Scientific公司EHIL7,人IL-21Thermo Scientific公司EHIL21)。接種后72小時,接種1×105個細胞,收集上清,隨后測試。以1×105個細胞和一個載體拷貝數歸一化生成的數據。
圖2:本發明的優選的病毒表達構建體。將構建體克隆至γ-反轉錄病毒骨架(pSERS11,EP2019134A1)。通過延長因子短(pEFS)啟動子驅動所有構建體。存在被P2A分開的兩種白細胞介素。IL-12的α-鏈和β-鏈必須被T2A分開。使用人白細胞介素序列(IL-2:基因庫(GenBank):DQ861285.1,IL-7:基因庫:EF064721.1,IL-12α:基因庫:AF101062.1,IL-12β:NCBI參考序列:NM_002187.2,IL-15:基因庫:AY720442.1,IL-21:基因庫:BC066260.1)。pac基因和oPRE序列位于IRES序列之后。在構建體的5’端和3’端是LTR。骨架含有LTR,其位于構建體的5’端和3’端。構建體5’端處的LTR含有SV40增強子、RSV啟動子、R區和U5區。構建體的3’端處的LTR缺失U3區、R區、U5區和多聚腺苷酸(PolyA)信號。骨架含有細菌部分:lacZ啟動子、復制起點、bla基因和LacZ基因(pUC19)。
圖3:用病毒表達構建體轉導的細胞的胞內FACS分選。通過轉染293T細胞產生編碼指定載體的病毒顆粒。以0.25的MOI轉導原代人MSC。用嘌呤霉素(Sigma Aldrich,P9620-10ML,10mg/mL,終濃度:3μg/mL)選擇轉導的細胞。通過ic-FACS分析選擇的細胞。為了增強對表達的細胞因子的檢測,用GolgiPlug(BD,555029)處理細胞16h以富集蛋白。根據制造商說明,使用(BD,554722)使細胞透性化;然后使用對HA-Tag特異性的抗體(Miltenyi,130-092-257)對細胞因子染色(每次染色1.33μL)。通過流式細胞術(FC500,美國貝克曼庫爾特有限公司(Beckman coulter))分析細胞。
3A:未轉導的細胞
3B:包括IL7和IL21的構建體,重復1
3C:包括IL7和IL21的構建體,重復2
3D:包括IL2和IL12的構建體,重復1
3E:包括IL2和IL12的構建體,重復2
3F:包括IL15和IL121的構建體,重復1
3G:包括IL15和IL12的構建體,重復2
3H:包括IL7和IL12的構建體,重復1
3I:包括IL7和IL12的構建體,重復2
3J:包括IL21和IL12的構建體,重復1
3K:包括IL21和IL12的構建體,重復2
圖4:轉基因細胞因子的ELISA檢測。用所指示的載體轉導人MSC。細胞是嘌呤嘧啶選擇的細胞,以及1×105個細胞接種于6孔板。72h后收集上清,并通過ELISA分析。將生成的數據歸一化為1×105個細胞和載體拷貝數。根據制造商說明,使用ELISA試劑盒:人IL-2(Thermo Scientific公司,EH2IL2),人IL-7(Thermo Scientific公司,EHIL),人IL-15(BioLegend,431707),人IL-21(Thermo Scientific公司,EHIL21)。
實施例
為了描述本發明的實際實施方式和在某些情況下的優選實施方式,通過證明本發明的實踐實施提供了以下實施例,而不限制對本發明的范圍或本文描述的構思。
實驗模型:
根據Lange C.等人(“在無動物血清的培養基中快速和安全地擴增人間充質基質細胞用于移植和再生醫學(Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine)”,J.Cell Physiol.2007,Apr.25)或Soleimani(“用于分離和培養來自小鼠骨髓的間充質干細胞的方案(A protocol for isolation and culture of mesenchymal stem cells from mouse bone marrow)”,Nat Protoc.2009;4(1):102-6)。
在細胞培養物中,細胞貼附和連續生長。可以用包含編碼細胞因子的基因序列的反轉錄病毒載體或慢病毒載體轉化MSC。根據標準方案使病毒構建體工程化,并且產生該病毒構建體,所述病毒構建體表達編碼IL-2、IL-7、IL-15、IL-21、IL-12、IFNγ、IFNβ、SDF-1、CCL23、CCL19、CCL1、CCL2、CCL17、CCL22和/或CCL4和其組合的基因。
選擇并進一步培養轉化的細胞后,收獲以用于施用。所有載體可以包括例如抗生素抗性基因,如嘌呤霉素抗性基因。因此,嘌呤霉素可以以0.1-10μg/ml或優選3-5μg/ml的濃度,用于選擇轉染的細胞。在注射入小鼠或其他受試者之前,使細胞從培養瓶脫離,用PBS洗滌兩次,以及重懸于PBS或其他適當的緩沖液中。
可以在內源性小鼠乳腺癌模型(如WO2008150368中描述的)或原位胰腺癌模型(如WO2010119039中描述的)中進行適當的實驗。在平行實驗中,使用含或不含從同系受試者分離的T細胞的各種工程化的MSC,和/或檢查點抑制劑,注射具有生長中的腫瘤的小鼠。五天后,可以將動物處死并且檢測腫瘤。初步結果表明與適當的對照相比,前述處理的受試者中腫瘤尺寸/生長減小。
人間充質干細胞的制備:
在本實施例中,通過塑料吸附性從骨髓中分離人MSC,并且在生長培養基例如含有FBS的DMEM中培養所述人MSC,如Pittinger,M.F.(2008)來自成人骨髓的間充質干細胞(mesenchymal stem cells from adult bone marrow),在D.J.Prockop,D.G.Phinney,B.A.Bunnell,分子生物學449中的方法(Methods in Molecular Biology 449),間充質干細胞(mesenchymal stem cells),Totowa:Humana Press)中描述的。
用于表達細胞因子和趨化因子的載體的產生:
使用如Julia Lodge,Peter Lund,Steve Minchin(2007)基因克隆(Gene Cloning),New York:Tylor and Francis Group中描述的標準克隆技術,構建由啟動子和用于免疫刺激因子或支持免疫應答的因子的基因(例如cDNA)組成的轉基因表達盒。啟動子可以是組成型啟動子如CMV啟動子或PGK啟動子,或誘導型啟動子如Tie2、RANTES或HSP70啟動子。
編碼免疫刺激因子或支持免疫應答的因子的基因的例子是IL-2、IL-7、IL-15、IL-21、IL-12、IFNγ、IFNβ、SDF-1、CCL23、CCL19、CCL1、CCL2、CCL17、CCL22和/或CCL4(Strengell等人,M,The Journal of Immunology,2003,170:5464–5469;Borish等人,J Allergy Clin Immunol.2003Feb;111(2Suppl):S460-7)。基因可以或不可以與標簽序列(例如,標記蛋白/肽,如血細胞凝集素標簽或HIS標簽)融合,以使得隨后容易檢測表達(Hinrik Garoff,1985,細胞生物學年度綜述(Annual Review of Cell Biology),Vol.1:403-445)。
然后,通過標準克隆技術將轉基因插入適當的載體系統(例如慢病毒載體或γ-反轉錄病毒載體)。適當的載體例如由Baum(EP 1757703A2)所描述。載體可以包括或可以不包括由啟動子和選擇性標記基因(細胞表面標記或抗性基因,例如用于賦予嘌呤霉素抗性的pac基因)組成的第二轉基因盒以在隨后的過程中允許富集基因修飾的細胞(David P.Clark,Nanette J.Pazdernik,2009,生物科技:應用基因革命(Biotechnology:Applying the Genetic Revolution),London:Elsevier)。
根據本發明的優選的構建體示于圖2中。
間充質干細胞的基因修飾:
如Murray等人,1999,人基因治療(Human Gene Therapy).10(11):1743-1752和Davis等人,2004Biophysical Journal Volume 86 1234–1242描述的使用修飾物進行轉導。詳細地:
用聚L-賴氨酸(PLL)(例如Sigma-Aldrich,P4707-50ML)包被6孔細胞培養板(例如Corning):用PBS將PLL溶液(0.01%)稀釋至終濃度為0.0001%~0.001%。將2ml稀釋的PLL用于每孔。在室溫下溫育板至少2h。在溫育之后,用PBS小心地洗滌板。
將終體積為2ml的病毒載體上清添加至每個PLL包被的孔。顆粒數目應在2×103~1×106每孔,這會導致感染復數為0.25~10。將已裝載的板以2000×g,在4℃下離心30min。然后,將上清棄去,并每孔接種1×105個間充質干細胞。在37℃,5%CO2下溫育板用于進一步使用。
MSC中轉基因表達的分析:
流式細胞術:
為了顯示免疫刺激因子在MSC中表達,進行細胞內流式細胞術測定。轉導后3天,將MSC培養基更換為每1ml培養基中含有1μl BD Golgi Plug(目錄號555029)的培養基,以富集轉導細胞的高爾基體中的表達的因子。將細胞在37℃下溫育16h,然后針對因子的表達將細胞免疫染色。收獲MSC,并根據制造商的說明,使用BD Cytofix/Cytoperm細胞透性化/固定溶液(Becton Dickinson,554722)使MSC透性化以允許靶蛋白的胞內染色。用藻紅蛋白(PE)(Milteny,120-002-687)標記的血細胞凝集素標簽特異性抗體用于檢測表達的因子。將2×105個MSC用100μl抗體(用Perm/洗滌溶液,Becton Dickinson,554723以1:75稀釋)染色。供選擇地,根據制造商的說明,可以使用直接針對因子的抗體(例如用PE標記的抗-IL2抗體,ebiosience公司12-7029-41)。將細胞用PBS洗滌以及重懸于PBS中。然后在FC500流式細胞儀(Beckman Coulter)上分析細胞。
圖3顯示了細胞因子轉基因的表達。
ELISA:
將轉導的MSC接種于6孔板(1×105個MSC每孔)。通過嘌呤霉素選擇富集攜帶pac嘌呤霉素抗性基因的轉導的MSC。為此,將嘌呤霉素(3μg/ml培養基)添加至培養基,在37℃和5%CO2下將細胞培養5天,每2天更換培養基以從培養物中去除未轉導的細胞。然后將無嘌呤霉素的培養基用于培養。在6孔板中以限定的細胞數目1×105個細胞每孔重接種MSC并溫育48小時。收集培養基,并根據制造商的說明,將所述培養基用于免疫因子特異性ELISA以定量(例如IL-7ELISA:Thermo Scientific公司,EHIL7;IL-15ELISA:Thermo Scientific公司,EHIL15)。
圖4顯示了細胞因子轉基因的表達。
通過ELISA監測T細胞和巨噬細胞的體外激活:
如Ivan J.Fuss,Marjorie E.Kanof,Phillip D.Smith,Heddy Zola,2009Curr.Protoc.Immunol.85:7.1.1-7.1.8描述的,使用聚蔗糖梯度離心從人血液中分離外周血單核細胞(PBMC)。為了評價在體外的MSC中表達的因子的免疫刺激作用,進行共培養測定。將1~5×105個PBMC與0.2~1×105個轉導的MSC、未轉導的MSC(對照)或無MSC一起接種于12孔板的孔中。進行在培養物中T細胞的非特異性次最優刺激,模擬T細胞受體的銜接:因此,在細胞接種之前,用刺激性抗CD3抗體(例如OKT3,Janssen-Cilag)包被板的孔。抗體溶液應該具有0.5-0.1μg/mL的濃度。供選擇地,可以以20μg/ml的濃度將PHA添加至共培養物(Ngoumou等人,Cytokine 25(2004)172-178)。在37℃和5%CO2下溫育孔2~5天,之后分析。
與具有未轉導的MSC的孔或不具有MSC的孔相比,用免疫刺激因子轉導的MSC引起培養的T細胞的激活增高。通過測量培養物中INFγ濃度,評價T細胞的激活狀態,因為這些細胞因子指示T細胞激活(Boehm等人,Annu Rev Immunol.1997;15:749-95.)。為了評價單核細胞的激活狀態,收集培養基,以及確定腫瘤壞死因子α(TNFα)的釋放。收集培養基,以及根據制造商說明將所述培養基用于IFNγ或TNFα特異性ELISA以定量(例如ELISA:IFNγ,Thermo Scientific公司,EHIFNG;TNFαELISA:Thermo Scientific公司,EH3TNFA)。
通過流式細胞術監測T細胞和巨噬細胞的體外激活:
如Ivan J.Fuss,Marjorie E.Kanof,Phillip D.Smith,Heddy Zola,2009Curr.Protoc.Immunol.85:7.1.1-7.1.8描述的,使用聚蔗糖梯度離心從人血液中分離外周血單核細胞(PBMC)。為了評價在體外的MSC中表達的因子的免疫刺激作用,進行共培養測定。將1~5×105個PBMC與0.2~1×105個轉導的MSC、未轉導的MSC(對照)或無MSC一起接種于12孔板的孔中。進行在培養物中T細胞的非特異性次最優刺激,模擬T細胞受體的銜接:因此,在細胞接種之前,用刺激性抗CD3抗體(例如OKT3,Janssen-Cilag)包被板的孔。抗體溶液應該具有0.5-0.1μg/mL的濃度。供選擇地,可以以20μg/ml的濃度將PHA添加至共培養物(Ngoumou等人,Cytokine 25(2004)172-178)。在37℃和5%CO2下溫育孔2~5天,之后分析。
與具有未轉導的MSC的孔或不具有MSC的孔相比,用免疫刺激因子轉導的MSC引起培養的T細胞和巨噬細胞的激活增高。通過胞內流式細胞術評價T細胞和巨噬細胞的激活狀態。在收獲細胞前24h,用每1ml培養基中含有1μl BD Golgi Plug(目錄號555029)的培養基處理細胞。然后收獲細胞,并且根據制造商說明,用對T細胞特異性的熒光團標記抗體(例如抗CD4,ebioscience公司17-0048或抗CD8,ebioscience公司9017-0087)或對巨噬細胞/單核細胞特異性的熒光團標記抗體(抗CD14,ebioscience公司,9017-0149)對細胞染色。然后,根據制造商說明,使用BD Cytofix/Cytoperm細胞透性化/固定溶液(Becton Dickinson,554722)透性化細胞,以允許IFNg(ebioscience公司,11-7319)或TNFa(ebioscience公司,11-7349)的胞內染色。根據制造商的說明使用抗體。然后使用FC500流式細胞儀(Beckman Coulter)分析細胞。
在動物模型中監測施用MSC的抗腫瘤作用:
在免疫缺陷小鼠(例如SCID小鼠)中,使來自人腫瘤細胞系的腫瘤生長2周,并且經由例如尾靜脈,靜脈內施用工程化MSC。然后,靜脈內施用PBMC。然后,將腫瘤尺寸與未處理的動物或僅用MSC處理的動物或僅用PBMC處理的動物的腫瘤尺寸比較。
在另一實驗中,在免疫缺陷小鼠(例如SCID小鼠)中,使來自人腫瘤細胞系的腫瘤與工程化的MSC的組合生長2周,并且靜脈內施用PBMC。然后,將腫瘤尺寸與未處理的動物或僅用MSC處理的動物或僅用PBMC處理的動物的腫瘤尺寸比較。
然而,可以不使用PBMC,而使用純化的細胞毒性T淋巴細胞(CTL)或攜帶CAR的CART細胞進行以上實驗,所述CAR針對腫瘤上存在的腫瘤抗原。同樣地,可以與MSC和PBMC、或MSC和CTL、或MSC和CART,一起使用檢查點抑制劑(例如抗PD-1或抗PD-L1抗體)。
通過使針對這些細胞因子反應性的抗體,組織學分析來自以上實驗的腫瘤以評價MSC表達細胞因子和細胞因子組合的量。使用蘇木精和曙紅染料(H&E),評價腫瘤通過PBMC、CTL和CART浸潤的程度。可以通過使用抗CD3抗體的免疫組織化學法評價腫瘤通過T細胞的浸潤程度。可以通過使用抗CD19抗體的免疫組織化學法評價腫瘤通過單核細胞浸潤的程度。可以通過使用抗CD69抗體以及IFNγ的免疫組織化學法,評價腫瘤中浸潤的T細胞的激活程度。
為了證實以上實驗,以不同類型的腫瘤重復這些實驗,所述腫瘤使用不同的人腫瘤細胞系和CART生長,所述CART具有針對與各自腫瘤相關抗原的特異性。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 抗PD-L1納米抗體及其編碼序列和用途的制造方法與工藝
- 用于HPV?相關病癥的新方法、生物試驗和生物標記物與制造工藝
- 用于去除血液中的促炎介質以及粒細胞和單核細胞的系統的制造方法與工藝
- 活化人CD40的抗體和針對人PD?L1的抗體的組合療法的制造方法與工藝
- 免疫原性組合產品的制造方法與工藝
- 白介素2的超級激動劑、部分激動劑和拮抗劑的制造方法與工藝
- 表達免疫應答刺激細胞因子以吸引和/或激活免疫細胞的基因修飾間充質干細胞的制造方法與工藝
- 一種研究北蟲草多糖對機體的體液免疫應答和細胞免疫應答反應的方法與制造工藝
- 金黃色葡萄球菌腸毒素C2的核酸適配體C203及其篩選方法和應用與制造工藝
- 一種干擾乙肝病毒復制的siRNA、其構建方法及應用與制造工藝