二甲雙胍的緩釋制劑及其制備方法與流程
本發明涉及一種包含二甲雙胍的胃內滯留型緩釋制劑及其制備方法。
背景技術:
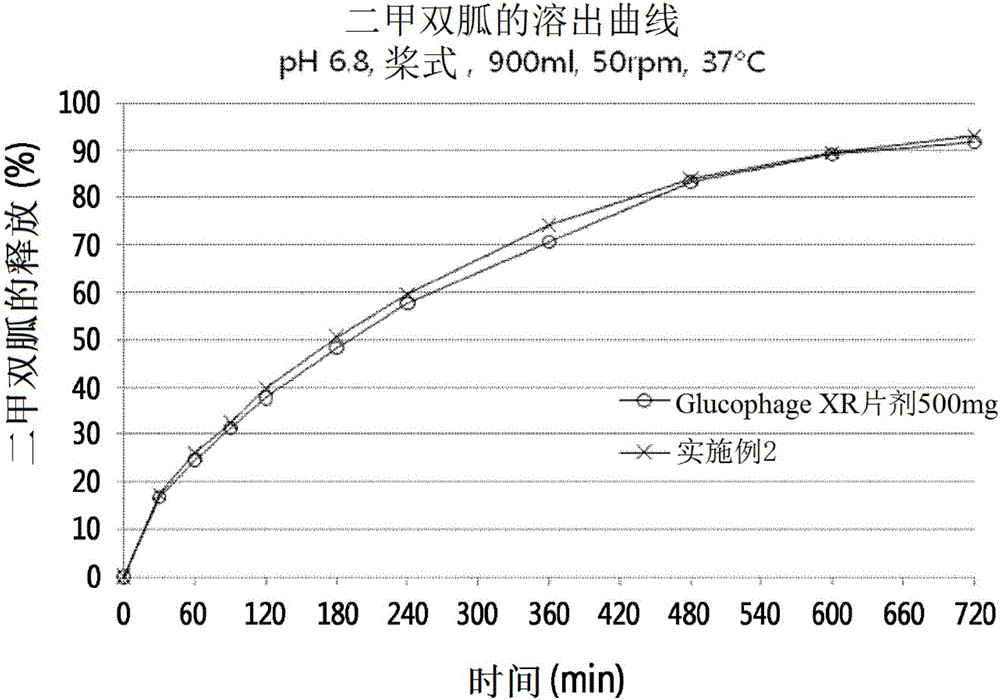
:二甲雙胍是針對非胰島素依賴性糖尿病的治療劑,并且化學上具有雙胍結構。二甲雙胍控制胃腸道中的葡萄糖生成并且提高肌肉中的葡萄糖利用率,因此已經用于預防和治療糖尿病。此外,二甲雙胍具有能夠改善脂質代謝從而防止體重增加的優點,并且能夠用于預防和治療糖尿病并發癥(例如心血管疾病等)的發生和惡化。然而,由于二甲雙胍的高水溶性,當將二甲雙胍配制成片劑時,由于其快速釋放可能導致血糖水平的過度下降,從而導致胃腸道疾病。此外,作為快速釋放片劑,二甲雙胍通常每天以多達500mg至850mg給藥兩次或三次(每日最大量為2550mg),因此由于其快速釋放而導致的血糖水平的快速變化可能加重不良反應和對二甲雙胍的耐藥性。此外,由于二甲雙胍在血液中具有2小時至6小時的短半衰期,因此期望將二甲雙胍作為每日一次的緩釋制劑給藥以改善治療效果以及改善患者依從性。對于每日一次給藥的傳統緩釋二甲雙胍制劑,盡管它們可能通過藥學上公知的技術實現了均勻的控釋,但是存在緩釋所需的載體量太高的問題,從商業角度來看,它們難以應用于實際生產。國際公開號WO1999/47125公開了一種基于使用半透膜的滲透原理的緩釋技術,但是該方法的問題在于難以制備均勻的半透膜,并且根據胃內條件可能存在藥物釋放的變化。國際公開號WO1999/47128公開了一種使用離子聚合物和非離子聚合物的胃內滯留延長的雙相控釋制劑技術。然而,該方法需要大量的緩釋劑,因此使得制劑的尺寸更大,從而給藥的方便性惡化。國際公開號WO2002/36100公開了一種用于控釋制劑的技術,其通過對緩釋膜包覆的片劑進行激光鉆孔來控制藥物釋放。然而,由于需要使用昂貴的裝置,該方法具有很小的工業價值。此外,國際公開號WO2003/28704公開了一種通過控制制劑的水含量來實現緩釋的緩釋制劑的技術,但是該方法的問題在于難以建立加工條件以提供恒定量的水。同時,已經對緩慢釋放藥物從而從改善藥物依從性方面降低藥物給藥頻率的緩釋制劑進行了許多研究。然而,不管延長的藥物釋放如何,一些藥物(例如,具有窄吸收窗的那些藥物例如二甲雙胍)的藥物功效可能不會持久。當給藥后藥物吸收部位限于上腸道時,如果藥物在通過上腸道之后釋放將很難獲得所需的藥物作用。因此,重要的是控制藥物通過上腸道的時間,為此,研究集中在胃內滯留型緩釋制劑上。胃內滯留型緩釋制劑可以根據胃內滯留的方法大致分為三類:即“生物粘附系統”,其中藥物粘附在體內并在胃內滯留;“浮力系統”,其中使用發泡劑降低制劑的密度,從而使藥物在胃內漂浮;和“膨脹系統”,其中藥物在胃內顯著膨脹,使得藥物不能通過幽門。其中,膨脹系統通常是最商業化的,并且其配方應該包含一定量的具有高分子量和高粘度的可膨脹聚合物。通常,用于緩釋的可膨脹劑是親水和高粘性的,具有三維網絡結構(其中它們在物理或化學上致密結合),因此當它們與水溶液接觸時,它們在短時間內膨脹并形成水合凝膠,從而防止藥物的立即釋放。因此,使用可膨脹劑的胃內滯留型緩釋制劑應當在短時間內膨脹,以獲得足以防止通過尺寸為1.2±0.7cm的幽門的尺寸。單獨使用可膨脹聚合物,可以實現由快速水凝膠形成導致的目標膨脹速度。然而,由于高的單位劑量和高的二甲雙胍溶解度,需要大量的膨脹劑,導致片劑大小的增加。韓國專利No.10-0791844、No.10-0858848和No.10-1043816公開了通過同時使用可膨脹聚合物與水不溶性試劑而使用少量試劑有效地控制藥物釋放的方法。兩種試劑的組合使用能夠控制藥物釋放的速度,但是可膨脹聚合物的水凝膠形成的速度被疏水性水不溶性試劑降低,從而降低初始膨脹率。技術實現要素:技術問題因此,本發明人在努力開發能夠有效控制二甲雙胍釋放的胃內滯留型緩釋制劑(一種親水性藥物,其吸收位點由于其狹窄的吸收窗而限于上腸道)時,發現了一種包含緩釋顆粒材料和能夠使用最小量的聚合物確保活性成分穩定釋放的超級崩解劑的緩釋制劑,所述緩釋顆粒材料包括含有二甲雙胍或其藥學上可接受的鹽和可膨脹聚合物的顆粒以及包覆在顆粒表面上的水不溶性聚合物膜。本發明通過減小制劑尺寸而改善給藥的方便性,并且同時控制片劑制劑的潤濕性,從而完成本發明。技術方案本發明提供一種二甲雙胍的胃內滯留型緩釋制劑及其制備方法,其吸收位點由于其狹窄的吸收窗而限于上腸道,其能夠使用最小量的聚合物確保用于活性成分的穩定釋放和吸收的胃滯留時間,由于其小尺寸而能夠改善給藥的方便性,并且能夠控制其片劑制劑的潤濕性以快速膨脹。有益效果根據本發明的二甲雙胍的胃內滯留型緩釋制劑通過用水不溶性聚合物包覆含有可膨脹聚合物的顆粒材料而能夠使用最少量的聚合物有效地控制藥物釋放,并且也能夠防止由可膨脹聚合物結構的氧化或降解而導致的粘度下降。如此制備的緩釋顆粒材料可能通過在可膨脹聚合物的外表面上形成水不溶性聚合物膜而導致聚合物的水合延緩。為了彌補這一點,將超級崩解劑與緩釋顆粒材料混合以控制制劑的潤濕性。因此,本發明具有提供胃內滯留型緩釋制劑的效果,其通過減少二甲雙胍的緩釋所需的緩釋劑的量而提高了給藥的方便性,并且控制潤濕性以能夠使得該制劑快速膨脹(盡管其片劑的尺寸小)。附圖說明圖1是示出對本發明的實施例2中制備的二甲雙胍鹽酸鹽緩釋制劑和500mgGlucophageXR片劑的釋放實驗結果的曲線圖。圖2是示出對本發明的實施例3中制備的二甲雙胍鹽酸鹽緩釋制劑和500mgGlucophageXR片劑的釋放實驗結果的曲線圖。圖3是示出對本發明的實施例4中制備的二甲雙胍鹽酸鹽緩釋制劑和500mgGlucophageXR片劑的釋放實驗結果的曲線圖。具體實施方式為了實現上述目的,一方面,本發明提供了一種緩釋制劑,包括:緩釋顆粒材料,該緩釋顆粒材料包括含有二甲雙胍或其藥學上可接受的鹽和可膨脹聚合物的顆粒,以及含有涂布在顆粒表面上的水不溶性聚合物的包衣層;和超級崩解劑。如本文所用,術語“緩釋顆粒材料”是指包含二甲雙胍或其藥學上可接受的鹽的組合物,其能夠防止快速釋放并允許其連續釋放。為了緩釋,將二甲雙胍或其藥學上可接受的鹽與可膨脹聚合物一起制粒,然后用水不溶性聚合物膜包覆單個顆粒。如本文所用,術語“二甲雙胍”是指用于預防或治療非胰島素依賴性糖尿病的化合物,其化學名稱為N,N-二甲基亞胺基二甲酰亞胺二酰胺(N,N-dimethylimidodicarbonimidicdiamide)(下面的式1)。[式1]二甲雙胍可以通過從自然資源分離、通過在從自然資源獲得后通過化學修飾制造、或者容易地根據本領域技術人員已知的方法的化學合成來使用。或者,可購買市售的二甲雙胍來使用。優選地,在本發明的緩釋制劑中可以包含250mg至1000mg的量二甲雙胍或其藥學上可接受的鹽。如本文所用,術語“藥學上可接受的鹽”是指與任何有機或無機酸或堿形成的鹽,其不會對要給藥的生物體造成嚴重刺激,或損害化學品的生物活性和物理性質。藥學上可接受的鹽可以包括能夠形成含有藥學上可接受的陰離子的無毒酸加成鹽的酸加成鹽,例如,無機酸如鹽酸、硫酸、硝酸、磷酸、氫溴酸和氫碘酸;有機碳酸如酒石酸、甲酸、檸檬酸、乙酸、三氯乙酸、三氟乙酸、琥珀酸、葡糖酸、苯甲酸、乳酸、富馬酸、馬來酸和水楊酸;磺酸如甲磺酸、乙磺酸、苯磺酸和對甲苯磺酸等。此外,藥學上可接受的鹽還可以包括由鋰、鈉、鉀、鈣、鎂等形成的金屬鹽或堿土金屬鹽;氨基酸鹽如賴氨酸、精氨酸、胍等;有機鹽如二環己胺、N-甲基-D-葡糖胺、三(羥甲基)甲胺、二乙醇胺、膽堿和三乙胺等。優選地,二甲雙胍的藥學上可接受的鹽可以包括二甲雙胍鹽酸鹽、乙酸鹽、琥珀酸鹽、延胡索酸鹽、甲磺酸鹽、苯磺酸鹽、甲苯磺酸鹽等,但不限于此。如本文所用,術語“可膨脹聚合物”是指在水溶液中變得膨脹,從而能夠控制藥物釋放的藥學上可接受的聚合物。在本發明中,可膨脹聚合物與二甲雙胍或其藥學上可接受的鹽一起形成顆粒,并顯現其緩釋特性。能用于本發明的可膨脹聚合物可以包括選自由羥丙甲纖維素、羥乙基纖維素、羥丙基纖維素、聚環氧乙烷、角叉菜膠、天然樹膠、瓜爾膠、黃蓍膠、阿拉伯樹膠、刺槐豆膠、黃原膠、聚乙烯醇和聚乙烯吡咯烷酮所組成的組中的至少一種,優選為羥丙甲纖維素或聚環氧乙烷,但不限于此,只要其是能夠根據本發明的目的控制釋放的藥學上可接受的可膨脹聚合物即可。優選地,可膨脹聚合物的粘度為100cps以上。優選地,基于給定制劑的總重量,所包含的可膨脹聚合物的量可以為10重量%至40重量%。當所包含的可膨脹聚合物的量小于10重量%時,難以實現藥物釋放的有效控制,而當所包含的可膨脹聚合物的量大于40重量%時,片劑的尺寸變得太大而不能給藥,因此不適當。本發明的包含二甲雙胍或其藥學上可接受的鹽和可膨脹聚合物的顆粒通過用水不溶性聚合物包覆外表面而形成。如本文所用,術語“水不溶性聚合物”是指水不溶性的或難溶于水的能夠控制藥物釋放的藥學上可接受的聚合物。此外,本發明的水不溶性聚合物的目的是防止二甲雙胍或其藥學上可接受的鹽的釋放,并且還防止具有高分子量的可膨脹聚合物通過氧化被降解而粘度降低。也就是說,根據本發明的制劑被形成為使得由于水不溶性聚合物膜包覆而能夠防止可膨脹聚合物與水、熱、光等的物理接觸和化學反應。可用于本發明的水不溶性聚合物可以選自由甲基丙烯酸共聚物、乙基纖維素、羥丙基甲基纖維素鄰苯二甲酸酯、羥丙基甲基纖維素醋酸酯琥珀酸酯、醋酸鄰苯二甲酸纖維素、脂肪酸、脂肪酸酯、脂肪酸醇和蠟所組成的組中的至少一種,并優選為甲基丙烯酸共聚物或乙基纖維素,但不限于此,只要其是能夠根據本發明的目的控制釋放的藥學上可接受的水不溶性聚合物即可。優選地,基于制劑的總重量,可以包含的根據本發明的水不溶性聚合物的量為1重量%至20重量%。當聚合物含量超過20重量%時,將增加可膨脹聚合物膜的厚度和緩慢水合,因此不適于控制藥物的初始釋放。根據本發明的示例性實施方式,與通過用水不溶性聚合物包覆二甲雙胍鹽酸鹽然后通過將二甲雙胍鹽酸鹽顆粒與親水性可膨脹聚合物混合制得的緩釋制劑(比較例5)相比,通過用水不溶性聚合物膜將二甲雙胍鹽酸鹽和可膨脹聚合物一起包覆制備的緩釋制劑(實施例1)以較低的釋放速率顯示出更有效的控釋曲線(表5)。該結果是因為,在比較例5的制劑中,水快速滲透到片劑內部,從而降低了水不溶性包衣膜的效果。本發明的緩釋制劑包含緩釋顆粒材料和超級崩解劑。如本文所用,術語“超級崩解劑”通常是指在低濃度(2%至4%)表現出崩解效果的材料,但是根據其用途,其可以指作為水不溶性膠凝劑的能夠在暴露于水時通過形成延緩藥物擴散的粘性混合物來膨脹和控制藥物釋放的材料。超級崩解劑用于促進制劑的崩解或破裂,因此使用超級崩解劑的制劑變得快速崩解。因此,超級崩解劑不適合用于需要在長時間內緩慢釋放藥物的緩釋制劑。然而,本發明的緩釋制劑通過將超級崩解劑與緩釋顆粒材料混合而制備,使得其能夠持續釋放藥物,同時在緩釋顆粒材料的初始階段能夠確保藥物的初始膨脹。也就是說,在本發明的緩釋顆粒材料中,在可膨脹聚合物的外部形成水不溶性聚合物膜,從而有效地控制藥物的釋放,同時通過經由可膨脹聚合物顆粒混合的超級崩解劑來促進或加速可膨脹聚合物的初始膨脹,解決了由于水不溶性聚合物膜導致的水合時間延緩問題。用于本發明的超級崩解劑優選為選自由交聯羧甲基纖維素鈉、羥基乙酸淀粉鈉和交聚維酮所組成的組中的至少一種,但不限于此,只要它們是根據本發明的目的所使用的藥學上可接受的添加劑即可。優選地,可以包含的本發明的超級崩解劑的量為0.5重量%至5重量%。當超級崩解劑含量超過5重量%時,不可控制給定制劑的潤濕性,并且其也不適于控制藥物的初始釋放。根據本發明的示例性實施方式,與實施例1中不使用制備的超級崩解劑的緩釋制劑相比,通過將超級崩解劑例如交聯羧甲基纖維素鈉或交聚維酮與通過用水不溶性聚合物膜將二甲雙胍鹽酸鹽和可膨脹的聚合物一起包覆而制得的緩釋顆粒材料混合所制備的緩釋制劑(實施例2至實施例5)顯示出釋放速率略微降低或不變(表7),但進一步促進了制劑的初始膨脹。因為實施例中制備的片劑的質量相當于500mg的GlucophageXR片劑(具有超過1000mg的片劑質量)的約80%,所以它們的初始體積存在差異。然而,由于高膨脹率,與500mgGlucophageXR片劑相比,自2小時時間點以后,片劑開始膨脹至相似或更大的體積(表8),因此它們可以在使用較少量的聚合物的同時確保活性成分穩定釋放和吸收所需的足夠的胃內滯留時間,并且由于其小尺寸而改善給藥的方便性。此外,本發明的緩釋制劑還可以包括在外表面上的薄膜層。例如,膜層可以為遮蔽膜層、防濕膜層或葡萄糖膜層等。優選地,外膜層由水溶性材料形成,并且用于水溶性薄膜層的材料可以為羥丙甲纖維素、羥丙基纖維素、羥乙基纖維素、醋酸鄰苯二甲酸纖維素、乙基纖維素、甲基纖維素、聚甲基丙烯酸酯、聚乙烯醇-聚乙二醇接枝共聚物(BASF,德國)、聚乙烯醇(Colorcon,USA)或其組合,但不限于此。此外,在不損害本發明的效果的范圍內,本發明的緩釋制劑可以通過進一步使用本領域常規使用的添加劑來制備,例如稀釋劑、粘合劑、潤滑劑、pH調節劑、消泡劑、溶解助劑、抗氧化劑等。本發明的緩釋制劑可以制備為各種制劑類型,例如片劑(例如平片劑、薄膜包衣片劑、單層片劑、雙層片劑、多層片劑或有芯片劑)、粉末劑、顆粒劑、膠囊劑等。由此制備的本發明的緩釋制劑能夠通過在體內給藥期間連續釋放二甲雙胍成分而根據藥物活性成分提供適當的釋放特征。此外,胃內滯留型緩釋制劑被設計成使得通過減少二甲雙胍的緩釋所需的緩釋劑的含量來改善給藥的方便性,而制劑的潤濕性被調節成使得制劑通過包含可膨脹聚合物和超級崩解劑而變得快速膨脹。因此,本發明的緩釋制劑能夠有效地用于預防和治療糖尿病和糖尿病并發癥。另一方面,本發明提供了一種制備緩釋制劑的方法,包括:(a)制備包含二甲雙胍或其藥學上可接受的鹽和可膨脹聚合物的顆粒;(b)制備緩釋顆粒材料,其中,通過用水不溶性聚合物包覆顆粒以在其上形成包衣層;和(c)通過將緩釋顆粒材料與超級崩解劑混合來制備制劑。此外,本發明的方法還可以包括在緩釋制劑的外表面上形成膜層。如本文所用,術語“二甲雙胍”、“可膨脹聚合物”、“水不溶性聚合物”、“緩釋顆粒材料”、“超級崩解劑”、“藥學上可接受的鹽”和“膜層”與上述相同。本發明實施例在下文中,將參考以下實施例更詳細地描述本發明。然而,這些實施例僅用于說明的目的,而本發明不受這些實施例的限制。比較例1至比較例4:驗證可膨脹聚合物對釋放的延緩效果為了制備胃內滯留型緩釋制劑,將可有效緩釋親水性藥物的可膨脹聚合物與二甲雙胍鹽酸鹽混合,壓片,并測試其釋放速率和膨脹程度。(1)使用各種可膨脹聚合物制備二甲雙胍鹽酸鹽樣品為了根據可膨脹聚合物的種類制備二甲雙胍顆粒材料,將根據表1中所示的組成量出的成分通過20目篩,混合,并然后以25±5kp的硬度壓片,以得到白色片劑(720mg/單位)。表1比較例1比較例2比較例3比較例4二甲雙胍鹽酸鹽500mg500mg500mg500mg膠態二氧化硅10mg10mg10mg10mg聚環氧乙烷200mg---羥丙甲纖維素-200mg--海藻酸鈉--200mg-黃原膠---200mg硬脂酸鎂10mg10mg10mg10mg總重量720mg720mg720mg720mg(2)二甲雙胍藥物的釋放根據USP中描述的釋放方法(方法II),在37℃、50rpm下,在900mL磷酸鹽緩沖液(pH6.8)的釋放溶液中測試比較例1至比較例4中制備的制劑,并在預定時間收集釋放后溶液并通過HPLC分析它們各自的釋放速率。結果示于下表2中。用于HPLC的條件如下。-柱:PhenomenexLuna(C18,250mm×4.6mm,5μm)-檢測器:分光光度檢測器(228nm)-流動相:NaH2PO4:純水:ACN(1g:1L:1L)的混合溶液,其中,用磷酸將pH調節至3.0-流速:1.0mL/min-柱溫:30℃-分析時間:5分鐘表2作為結果,如表2所示,其中使用較高粘度的可膨脹聚合物、聚環氧乙烷(WSR301;Colorcon,USA)和羥丙甲纖維素(HypromelloseShin-EtSu,JAPAN)的比較例1和2顯示出對二甲雙胍藥物釋放的更有效的控制。當根據時間比較兩種聚合物之間的藥物釋放速率時,比較例1的初始釋放速率較低,但比較例2的后期階段的釋放速率較低。聚環氧乙烷由于其較高的親水性,在水相中與水相互作用良好。因此,水快速滲透到片劑中并引起凝膠化,從而有效地控制初始釋放速率。然而,隨著時間的推移,快速膠凝的片劑經歷交聯的弱化,因此導致顆粒之間的松散結構。因此,在后期階段的釋放速率看上去相對不能很好地控制。相反地,羥丙甲纖維素在水溶液中緩慢膠凝,因此初始釋放控制是不令人滿意的。然而,一旦形成水凝膠,其具有致密的網狀結構,因此看上去在后期階段可有效地控制釋放速率。(3)膨脹度試驗為了選擇適于胃內滯留型緩釋制劑的可膨脹聚合物,檢測了比較例1至比較例4中制備的片劑的膨脹率。為了測量膨脹率,將比較例1至比較例4中制備的片劑完全浸泡在蒸餾水中,并在2小時、4小時、6小時和12小時測量其體積。對于體積測量,將10mL蒸餾水加入到20mL量筒中,然后裝入兩個膨脹片劑,并測量刻度的增加。結果示于表3中。表3根據表3中所示的膨脹率的試驗結果,顯示出有效控制二甲雙胍的藥物釋放的比較例1和2的樣品在6小時內顯示出至少4倍的膨脹率。此外,雖然胃內滯留型緩釋制劑在短時間內膨脹并且變得比幽門更大從而不從其通過并滯留在胃中是重要的,但是胃內滯留緩釋制劑保持其形狀一段時間也是必要的,而在試驗中使用的所有片劑顯示出保持其形狀至少12小時。比較例5至比較例7、實施例1:驗證由于水不溶性包衣引起的釋放延緩效果在比較例1至比較例4中,驗證了能夠使用可膨脹聚合物控制藥物釋放,并且也驗證了可膨脹聚合物具有適于胃內滯留型緩釋制劑的膨脹率。然而,由于需要使用小劑量有效地控制藥物釋放,以提供需要大的每日劑量的二甲雙胍制劑的給藥方便,嘗試了使用各種緩釋劑的復雜釋放機制。因此,為了選擇經由水不溶性包衣與可膨脹聚合物一起來有效持續釋放藥物的賦形劑,根據下述方法制備樣品并然后進行釋放試驗。(1)根據水不溶性包衣制備二甲雙胍鹽酸鹽樣品為了控制二甲雙胍鹽酸鹽藥物的釋放速率并將其在血液中的濃度保持在恒定水平,根據表4中所示的組成來制備顆粒,并以25±5kp的硬度壓片,得到白色片劑(770mg/單位)。具體地,在比較例5中,通過將胺基甲基丙烯酸共聚物(RSPO;Evonik,USA)溶解在異丙醇、丙酮和純水的混合溶劑中而制備的結合溶液加入到二甲雙胍鹽酸鹽和膠態二氧化硅(200;Evonik,USA)的混合物中以制備顆粒。將如此制備的顆粒通過20目篩,與聚環氧乙烷和硬脂酸鎂混合,得到比較例5的二甲雙胍鹽酸鹽顆粒。在比較實施例6中,通過將使乙基纖維素(Colorcon,USA)溶解在乙醇和二氯甲烷的混合溶劑中而制備的結合溶液加入到二甲雙胍鹽酸鹽和膠態二氧化硅的混合物中以制備顆粒。篩選和混合過程以與比較例5相同的方式進行。在比較例7中,通過將使十六醇(C90;Croda,USA)溶解在乙醇和純水的混合溶劑中而制備的結合溶液加入到二甲雙胍鹽酸鹽和膠態二氧化硅的混合物中以制備顆粒。篩選和混合過程以與比較例5相同的方式進行。在實施例1中,如在比較例5中,使用通過將胺基甲基丙烯酸共聚物溶解在異丙醇、丙酮和純水的混合溶劑中而制備的結合溶液。然而,將結合溶液加入到二甲雙胍鹽酸鹽、膠態二氧化硅和聚環氧乙烷的混合物中以進行造粒。也就是說,通過用水不溶性聚合物將可膨脹聚合物和二甲雙胍鹽酸鹽一起包覆以得到顆粒。將如此制備的顆粒通過20目篩并與硬脂酸鎂混合以得到緩釋制劑。表4(2)二甲雙胍的釋放通過與比較例1至比較例4中使用的相同的釋放試驗方法對上述制備的制劑進行測試和分析,結果示于表5中。表5作為結果,如表5所示,與比較例1至比較例4中僅使用可膨脹聚合物制備的片劑的釋放速率相比,包含用水不溶性聚合物(50mg/單位片劑)包覆的顆粒材料的片劑傾向于表現出更加受控制的藥物釋放。特別地,與具有相同量藥物的比較例5的片劑相比,通過用水不溶性聚合物將可膨脹聚合物和二甲雙胍鹽酸鹽一起包覆制備的實施例1的片劑由于制備方法的差異而顯示出較低的釋放速率。這是因為,盡管水不溶性膜控制藥物的釋放,但是當根據比較例5的方法在隨后的混合中使用親水性可膨脹聚合物時,水快速滲透到片劑內部,從而導致水不溶性包衣膜的效果降低。因此,實施例1的方法(其中通過將可膨脹聚合物和二甲雙胍鹽酸鹽混合來制備水不溶性膜以有效控制藥物釋放)優選作為應用藥物釋放的雙重控制機理來制備緩釋制劑的方法。實施例2至實施例4:使用超級崩解劑的效果在實施例1中,為了通過控制二甲雙胍鹽酸鹽釋放速率來保持血液中的二甲雙胍鹽酸鹽藥物的濃度恒定,用水不溶性聚合物將可膨脹聚合物和二甲雙胍鹽酸鹽一起包覆,從而制備二甲雙胍鹽酸鹽顆粒。根據實施例1的緩釋顆粒材料通過在可膨脹聚合物的外部形成水不溶性聚合物膜而能夠有效地控制藥物釋放,但是因此其延緩了可膨脹聚合物的水合。為了彌補這個問題,通過將超級崩解劑混合到緩釋顆粒材料中來調節制劑的潤濕性,從而改善初始藥物膨脹。(1)根據超級崩解劑的量制備二甲雙胍鹽酸鹽樣品制備實施例2至實施例5中的制劑,使得首先以與實施例1相同的方式制備顆粒,然后在隨后的混合中,根據表6中所示的組成將顆粒與交聯羧甲基纖維素鈉或交聚維酮和硬脂酸鎂混合。表6(2)二甲雙胍的釋放通過與比較例1至比較例5中使用的相同的釋放試驗方法對上述制備的制劑進行測試和分析,結果示于表7中。表7作為結果,如表7所示,驗證了通過用作超級崩解劑的交聯羧甲基纖維素鈉和交聯聚維酮的作用,釋放速率略有降低或不變。(3)膨脹度試驗通過與比較例1至比較例5中使用的相同的膨脹試驗方法測試和分析上述制備的制劑,結果示于表8中。表8根據表8中所示的膨脹率的試驗結果,使用交聯羧甲基纖維素鈉或交聚維酮作為超級崩解劑的膨脹率彼此相似,并且體積膨脹率隨其量的增加而增加。因為實施例中制備的片劑的質量相當于500mg的GlucophageXR片劑(其片劑質量為超過1000mg)的質量的約80%,所以這些片劑的初始體積存在差異。然而,由于其高膨脹率,自2小時時間點之后,顯示它們已膨脹至與GlucophageXR片劑相似或比其更大的體積。根據前述內容,本發明所屬領域的技術人員應當能夠理解,在不改變本發明的技術概念或本質特征的情況下,本發明可以以其它具體形式實施。在這點上,本文公開的示例性實施方式僅用于說明性目的,而不應被解釋為限制本發明的范圍。相反地,本發明旨在不僅涵蓋示例性實施方式,而且涵蓋可以包括在由所附權利要求限定的本發明的精神和范圍內的各種替代、修改、等同方案和其它實施方式。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1