改進的熱穩定噴霧干燥輪狀病毒疫苗制劑及其制備方法與流程
本發明涉及改進的熱穩定噴霧干燥輪狀病毒疫苗制劑及其制備方法。本發明還公開了改進的噴霧干燥方法以獲得熱穩定的(熱穩定)輪狀病毒疫苗制劑。本發明的疫苗制劑具有改善的熱穩定性、易用性、易于運輸和可負擔性(affordability)特征,其具有顯著更好的機會在發展中國家和低收入國家的疫苗接種計劃中成功采用。
背景技術:
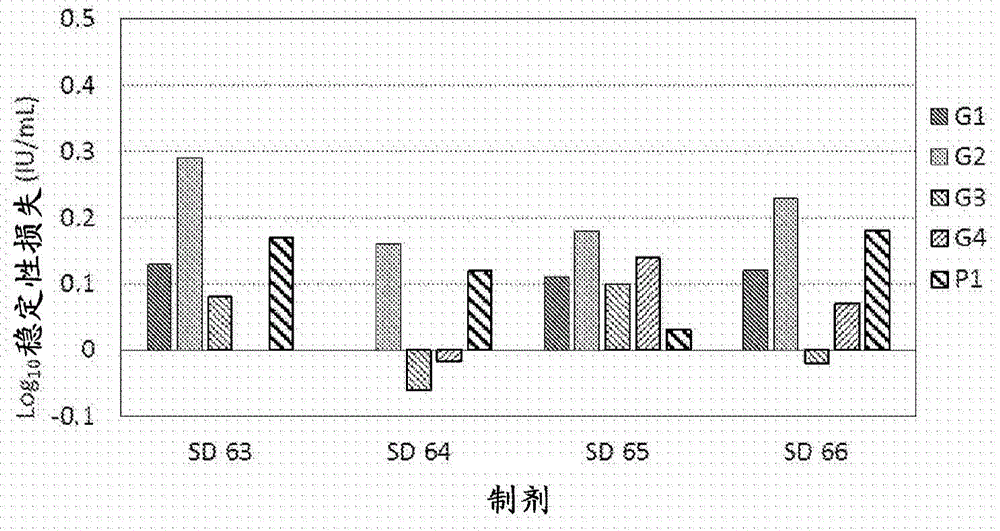
:已經確定輪狀病毒是嬰兒和幼兒嚴重腹瀉的主要原因。據估計,每年全球60萬5歲以下的兒童死于輪狀病毒腹瀉,另有200萬兒童住院。其中90%的死亡發生在發展中國家。輪狀病毒具有高度傳染性和抗性,無論水質和可用的衛生條件如何,世界上幾乎每個兒童都有感染的風險。輪狀病毒疫苗通常施用于兒童以保護他們免于輪狀病毒感染。2009年6月5日,世界衛生組織(WorldHealthOrganization,WHO)建議將輪狀病毒疫苗納入所有國家免疫接種計劃。輪狀病毒疫苗計劃(RotavirusVaccineProgram)和加速疫苗引入倡議(AcceleratedVaccineIntroductionInitiative)已經在發展中國家人群中運作以研究輪狀病毒疫苗,從而協助發展中國家將輪狀病毒疫苗引入常規免疫接種計劃。這些伙伴關系由國際非政府組織PATH、WHO、美國疾病控制和預防中心以及全球疫苗和免疫接種聯盟牽頭。國際研究數據表明,目前輪狀病毒疫苗對重癥輪狀病毒胃腸炎(rotavirusgastroenteritis,RVGE)具有85%至95%的效力。然而,當將其用在大多數輪狀病毒導致死亡發生的發展中國家中,以及在獲得治療方面受到限制時,仍存在問題。一個主要原因是,這些國家既沒有準備也沒有嚴格遵守兒童的免疫接種時間表,盡管事實上世界上幾乎每個兒童都將在五歲之前遭受輪狀病毒感染。其主要原因是主要與當前疫苗的程序適應性(programmaticsuitability)和成本有關。程序適應性是WHO為疫苗進行資格預審所開發的一個新過程。資格預審過程包括審查生產過程和質量控制程序,審查臨床數據,測試批次的一致性,以及WHO和國家監管機構對制造設施的聯合訪問。一旦評估完成并且如果疫苗對于購買原則上被認為是可接受的,則被認為是預先具有資格的并被公布在WHO網站上。現有的疫苗僅在特定溫度下穩定有限的持續時間。本領域公知的是,疫苗必須在保持在2℃至8℃的冷藏溫度下儲存和運輸。此外,還公知的是,疫苗必須在從冷藏中取出時立即施用。目前批準的疫苗在2℃至8℃下穩定達24至36個月。研究表明,如果一種目前WHO批準的輪狀病毒疫苗Rotateq無意中被暴露或儲存在高于8℃的溫度下,則其最多在9℃至25℃下暴露48小時或在26℃至30℃下暴露僅12小時內保持效力。事實上,如果這種疫苗暴露于高于30℃的溫度,或者如果上述時間已經過去,則該疫苗必須被丟棄,因為它已損失其效力。有限的數據表明,如果疫苗無意中暴露于低于0℃的溫度,則仍保持疫苗的效力。這使得輪狀病毒疫苗的嚴格冷鏈儲存和運輸成為必要,這在發展中地區和低收入地區是特別成問題,那里維持疫苗效力和功效所需的冷鏈不完善、負擔過重或不存在,從而導致大量疫苗被浪費,并且在最壞的情景下危及潛在接受者的生命。據報道,浪費高達25%至50%。國際專利申請號WO2009042202公開了用于保存輪狀病毒的制劑。這個發明提供了用于穩定液體和干燥制劑中的病毒的制劑和方法。特別地,提供了包含穩定輪狀病毒生存力的Zn2+陽離子的制劑。疫苗接種方法包括中和胃內容物和施用該發明的疫苗制劑。美國專利申請號US20120308526公開了聲波低壓噴霧干燥法。該發明提供了在低壓下從振動噴嘴噴霧干燥藥物粉末的方法。該方法可以有效地噴霧干燥厚或粘稠的溶液或混懸液,以提供小的均勻顆粒。該發明包括通過從振動噴嘴低壓噴霧的方法制備的干顆粒組合物。除了熱穩定以外,從程序的角度來看疫苗合適也是重要的。疫苗應容易地制備成其最終形式,在冷鏈中占據小體積,并且在使用后易于處置。包括冷凍干燥疫苗以及噴霧干燥的候選疫苗之大多數現有固體形式的疫苗包裝在單獨的容器/組件中,并且需要注射器和小瓶以及用于重構和施用的其他復雜和昂貴的機構。這在疫苗的施用中造成困難,并且也大大增加了使冷鏈負擔過重的疫苗足跡(footprint)。這也進而增加了運輸和分配挑戰、用于儲存的物流,并且易于導致潛在致命的重構錯誤例如緩沖劑/疫苗錯配、污染、錯誤體積施用或通過錯誤途徑施用等。很明顯,初級包裝對上述程序方面有最大的影響。正在開發和測試用于疫苗施用的許多遞送裝置。為了使這些多樣且有前景的遞送裝置與疫苗成功匹配,關鍵是設計提供最大包裝靈活性的疫苗制劑。常用的穩定化小瓶凍干法產生疫苗餅,其在藥物遞送裝置中提供最小量的包裝靈活性。即使在藥物遞送裝置(例如雙室注射器和藥筒裝置)中進行凍干過程,然而由于裝置以及加工成本,其成本也極高。對于在低收入地區廣泛采用的疫苗來說,保持加工和包裝疫苗的低成本至關重要。對疫苗價格有影響的另一組分是用于制劑中的穩定劑和賦形劑。從管理和安全的角度來看,使用的賦形劑和穩定劑應該既不含動物來源的物質也不含有動物組分,這也是至關重要的。事實上,在一些國家,出于文化和宗教原因也不希望如此。因此,為了解決上述問題,需要一種熱穩定的、劃算的疫苗,其在解決運送疫苗的物流方面將是疫苗接種計劃的一個巨大優勢,所述疫苗在室溫下保持其效力,并且是低收入和發展中世界國家可以負擔得起的。發明目的本發明的主要目的是提供改進的熱穩定噴霧干燥的輪狀病毒疫苗制劑。本發明的另一個目的是提供獲得改進的熱穩定噴霧干燥輪狀病毒疫苗制劑的噴霧干燥方法。本發明的另一個目的是提供改進的噴霧干燥方法以獲得改進的熱穩定噴霧干燥輪狀病毒疫苗制劑,所述方法使用雙流體噴嘴(two-fluidnozzle)以通過所述噴嘴霧化流體。本發明的另一個目的是提供改進的熱穩定噴霧干燥輪狀病毒疫苗制劑,其使在升高的溫度下的效力損失消除或顯著最小化,持續更長的時間段,從而減少對冷藏和冷鏈維持的依賴。本發明的另一個目的是提供制備改進的熱穩定噴霧干燥輪狀病毒疫苗制劑的方法,所述制劑包含選自牛、恒河猴(rhesus)、人、綿羊(ovine)、恒河猴/人重配株(reassortant)或牛/人重配株的活輪狀病毒毒株。本發明的另一個目的是提供制備改進的熱穩定噴霧干燥輪狀病毒疫苗制劑的方法,所述制劑包含單價或多價輪狀病毒血清型混合物中的輪狀病毒毒株。本發明的另一個目的是制備改進的熱穩定噴霧干燥的基于粉末或顆粒的輪狀病毒疫苗制劑。本發明的另一個目的是制備改進的熱穩定噴霧干燥輪狀病毒疫苗制劑,其具有用于通過經口遞送裝置填充和施用的理想性質。本發明的另一個目的是制備改進的熱穩定的噴霧干燥的基于粉末或顆粒的輪狀病毒疫苗制劑,并將其與摻和劑(blendingagent)共混以賦予其用于通過經口遞送裝置填充和施用的理想性質。本發明的另一個目的是提供劃算的方法來制備可被低收入和發展中世界國家負擔得起的劃算的改進的熱穩定輪狀病毒疫苗制劑。技術實現要素:因此,本發明涉及改進的熱穩定噴霧干燥輪狀病毒疫苗制劑。本發明還提供了噴霧干燥方法以獲得改進的熱穩定噴霧干燥輪狀病毒疫苗制劑。所述方法用于從含有不同血清型的液體輪狀病毒疫苗中單獨或組合地除去水部分(含水輪狀病毒疫苗不穩定性的主要來源之一),以形成脫水的穩定顆粒。通過使用噴霧干燥方法,用制劑成分的穩定相互作用代替去穩定化的水相互作用來完成脫水,從而提供通過劃算的方法制備的更加熱穩定的疫苗。改進的熱穩定噴霧干燥輪狀病毒疫苗制劑可包含在單價或多價輪狀病毒血清型混合物中選自牛、恒河猴、人、綿羊、恒河猴/人重配株或牛/人重配株的活輪狀病毒毒株。本發明涉及使用雙流體噴嘴噴霧干燥方法的噴霧干燥方法的用途,其用于在適當壓力、流速、干燥溫度和加壓霧化氣體下使用霧化氣體將通過噴嘴的流體霧化。所述干燥和加壓氣體選自氮、氬、CO2或空氣、或其組合。由此獲得的熱穩定輪狀病毒疫苗制劑具有在發展中地區和低收入地區經常遇到的高溫下保留效力的潛力(所述地區存在大多數輪狀病毒負擔),并且具有部分或完全消除疫苗冷鏈依賴性的潛力。因此,本發明公開了改進的熱穩定輪狀病毒疫苗制劑,其具有更強的熱穩定性、減少的足跡、低成本的運輸和易于使用的特征。附圖說明圖1描繪了當以1×劑和10×劑噴霧干燥時先導制劑(leadformulation)SD62的累積效力損失。圖2描繪了DoE共混的10×批次方法加上8周的穩定性損失。圖3描繪了共混和未共混的粉末樣品的水分含量比較。圖4描繪了DoE批次(未共混,10×輪狀病毒疫苗制劑)的玻璃化轉變溫度。圖5A描繪了在先導制劑SD64中于4℃下儲存指定時間量的5種輪狀病毒噴霧干燥的血清型的效力變化。圖5B描繪了在先導制劑SD64中于37℃下儲存指定時間量的5種輪狀病毒噴霧干燥的血清型的效力變化。圖6A描繪了SD66在4℃下保留效力24周。圖6B描繪了SD66在37℃下保留其效力24周。圖7A描繪了SD64可重復性批次的加工損失(processloss)比較。圖7B描繪了SD66可重復性批次的加工損失比較。圖8描繪了當在4℃和37℃下孵育時SD66可重復地保留效力16周。圖9A和圖9B描繪了SD64和SD66分別在45℃下保留效力2周和4周。帶有舉例說明和附圖的本發明具體實施方式為了消除現有技術中的上述缺點,本發明提供了改進的熱穩定噴霧干燥輪狀病毒疫苗制劑。更具體地,本發明提供了改進的噴霧干燥方法以獲得所述輪狀病毒疫苗制劑。更具體地,本發明公開了通過噴霧干燥方法制備的多價熱穩定的輪狀病毒疫苗,以使得所述疫苗具有改善的熱穩定性、易用性、易于運輸和可負擔性特征,其具有顯著更好的機會在發展中國家和低收入國家的疫苗接種計劃中采用。為了合理地實現噴霧干燥方法和制劑,其最好地支持方法產率、熱穩定性和隨后直至施用的對疫苗處理,已經利用了實驗篩選策略的部分因子設計(fractionalfactorialdesign)以從賦形劑/穩定劑及其組合中針對其賦予單個以及多種血清型熱穩定性的能力方面進行選擇。所述熱穩定噴霧干燥輪狀病毒疫苗制劑獲自包含由美國食品和藥物管理局(UnitedStatesFoodandDrugAdministration,USFDA)定義的“通常認為安全的”(GenerallyRegardedAsSafe,GRAS)之賦形劑和穩定劑的液體疫苗制劑(進料),并且在噴霧干燥期間和之后以及由在噴霧干燥(進料)之前和噴霧干燥粉末重構之后獲得的液態中,向包含單價和多價血清型的輪狀病毒疫苗提供熱穩定性。所述賦形劑和穩定劑選自-(a)糖類,例如麥芽糖糊精、蔗糖、乳糖、山梨糖醇、甘露糖醇和海藻糖;(b)二價離子蛋白質結構穩定劑如Zn(II)和Ca(II);(c)緩沖劑,例如4-(2-羥乙基)-1-哌嗪乙磺酸(HEPES)、Tris、磷酸鹽或組氨酸;(d)鹽,例如氯化鈉(NaCl);(e)填充劑,例如低粒度糖球/藥物球(NPS)、麥芽糖糊精、山梨糖醇、甘露糖醇、葡聚糖或乳糖;(f)活化劑,例如精氨酸、谷氨酸、谷氨酸鈉;(g)分散劑,例如吐溫(Tween)20和吐溫80;以及(h)表面活性劑,例如十二烷基硫酸鈉(SDS)、聚乙二醇(PEG)400、PEG-300、PEG-400和PEG-600、普朗尼克(Pluronic)68和F127。在一個優選的實施方案中,使用液體疫苗進料形成所述噴霧干燥疫苗的制劑,所述液體疫苗進料包含:輪狀病毒血清型,1%至15%(w/v)蔗糖或海藻糖、或其組合;10mM至100mMpH緩沖組分或其組合,pH范圍為6.0至8.0;0.001%至0.08%的表面活性劑,0.1mM至5mM的二價陽離子和0.5%至10%的填充劑。本發明的輪狀病毒疫苗制劑包含所施用范圍為每劑8.18×106至2.0×106的至少一種輪狀病毒血清型,所述至少一種賦形劑的范圍為1%至15%(w/v),所述至少一種緩沖劑的范圍為10mM至100mM,所述至少一種表面活性劑的范圍為0.001%至0.08%且pH為6-8。選擇賦形劑和穩定劑(特別是緩沖劑)以允許二價離子如Zn(II)和Ca(II)的最大溶解度,其主要是最大過程穩定性所需的并且還在輪狀病毒于升高的溫度下經延長的時間段的儲存穩定性中起作用。還選擇賦形劑及其組合以產生粉末,其特征在于玻璃化轉變溫度(glasstransitiontemperature,Tg)高于疫苗的預期儲存溫度。高于預期儲存溫度的制劑的Tg表明,那些制劑在低于Tg的升高溫度下的儲存期間將保持剛性玻璃態。本發明的穩健性(robustness)取決于由許多報告關鍵質量屬性的分析測定對其的評價和驗證。優化用于噴霧干燥方法的關鍵方法參數(criticalprocessparameter,CPP)以產生關鍵質量屬性,例如現有技術中已知的影響配制的疫苗之穩定性和性能的效力、產率、水分等。因此,在本發明中,監測的對實驗設計的響應包括通過基于“定量逆轉錄酶聚合酶鏈式反應”(ReverseTranscriptasePolymeraseChainReaction,RTPCR)的多價定量效力測定所測量的效力、使用KarlFisher或重量法測定水分含量、包括玻璃化轉變溫度、流動和固結性質的熱性質以及噴霧干燥材料的目視觀察。參數(如入口溫度、吸氣、固體含量百分比)已被評估為CPP,以研究它們對臨界質量屬性(如水分、產率、粒度和出口溫度)的影響。為了優化CPP,在表1中示出了代表最終制劑并因此可用于過程優化的無病毒安慰劑制劑組成的一個實例。表1:用于噴霧干燥過程優化的安慰劑制劑的組成。賦形劑組成蔗糖1.765M檸檬酸鈉235mM磷酸鈉118mMpH6.2水qs50mL本發明還公開了使用組合了加壓霧化氣體和液體形式的疫苗制劑(以下稱為液體疫苗制劑(進料))的“雙流體噴嘴”(二元噴嘴)完成的噴霧干燥方法。所述雙流體噴嘴噴霧干燥方法使用在4bar至7bar的壓力范圍和0℃至20℃溫度范圍下的加壓霧化氣體。用于霧化的干燥和加壓氣體選自純度不小于95%(v/v)的氮、氬、CO2,或空氣,且水分含量不大于2%。干燥氣體處于這樣的壓力,其允許氣體對于特定規模的操作和設備(例如BuchiB290高級模型)以25Nm3/小時至35Nm3/小時,優選30Nm3/小時的速率流動,并且在0℃至200℃的溫度范圍以及35℃至60℃的出口溫度范圍下進行。所述噴霧干燥過程還包括使用“雙流體噴嘴”以通過噴嘴霧化流體,其中對于特定規模的操作和設備(例如BuchiB290高級模型),將噴嘴孔從直徑0.7mm調節至1.2mm,優選1mm,以調節在以D90約30μm為特征的粒度下的產率>60%。此外,調整所述二元噴嘴以調節噴霧羽流(sprayplume),從而產生與干燥氣體的最大產物接觸和最小損失,從而導致高產物產率。所述噴霧干燥方法使用范圍為10.00g/100mL至25.00g/100mL,優選約21g/100mL的液體進料固體含量,用于最佳干燥和產率,并且對于特定的操作規模,所述液體疫苗制劑(進料)以0.3mL/分鐘至10.0mL/分鐘的流速進料。在表2中給出了優化的方法參數的一個實例。表2:優化的方法參數,其支持最大產率和最小水分含量。使用上述優化的參數和所述組成的噴霧干燥方法產生噴霧干燥粉末,通過防止加工中的損失,特別是通過防止設備死體積中的材料損失,提高粉末產率至>60%。具有上述優化參數的所述加壓霧化氣體如氮或氬以及所述組成產生具有殘留水分含量<2%的噴霧干燥粉末,從而與使用殘留水分含量>2%的環境或除濕空氣相比,其防止與水的存在相關的疫苗降解途徑。重要的是避免在加工和儲存過程中疫苗抗原的損失或使其保持最小以使與抗原過量填充相關的疫苗的成本最小化。因此,方法和制劑的一個關鍵標準是當在37℃下儲存并分析至少4周時,可重復地證明可接受的效力損失[在本發明中小于Log10=[0.5]],從而滿足世界衛生組織指示VVM30標準的最高熱穩定性。為了節約加工成本,必須減少加工特定量材料所需的時間量。因此,以高10倍(10×)滴度的批次進行噴霧干燥,并用摻和劑進一步稀釋回收的濃縮粉末10次,可以將加工時間減少10倍,并提高該過程的生產量。因此,在一個實施方案中,用于噴霧干燥的輪狀病毒血清型包含范圍為約1×104至1×109IU/mL的血清型的一種或組合,并與填充劑和/或緩沖劑共混。通過允許選擇具有不同物理化學性質的摻和劑,另外的共混過程有機會改造粉末性質,以適合于在不同的易于使用的容器封閉件中精確和可重復的稱重和填充。因此,在一個實施方案中,使用具有精確填充操作所需的理想粉末流動性質的摻和劑來改善噴霧干燥粉末的流動性質。可用于所述粉末改造的摻和劑的實例包括糖和糖醇,如各種大小和級別的環糊精、麥芽糖糊精、右旋糖、葡萄糖、甘露糖醇淀粉、山梨糖醇、麥芽糖醇、木糖醇和乳糖。本發明改進的熱穩定噴霧干燥輪狀病毒疫苗制劑包含具有單價和多價輪狀病毒毒株的單個或多種輪狀病毒血清型,其適當地包裝為單劑量或多劑量。易于使用的包裝的實例包括提供有疫苗粉末和用于重構的稀釋劑的小袋(sachet)、雙室小瓶,其中噴霧干燥的輪狀病毒疫苗和具有易碎密封件的雙室袋/單個容器封閉件(其可以被手指在稀釋劑/緩沖室上擠壓時破裂)允許固體噴霧干燥的輪狀病毒疫苗和稀釋劑混合。使用易于使用的包裝提高了疫苗施用的方便性以及降低了多組分疫苗的開放操作/重構的風險。重構錯誤包括緩沖劑/疫苗錯配、錯誤的體積、污染等。此外,它們具有減少疫苗足跡的潛力,從而減輕傳統多組分初級包裝選擇(例如用于每個組件以及相關聯的注射器和適配器的單獨小瓶)所面臨的運輸以及分配挑戰。由此獲得的熱穩定噴霧干燥的輪狀病毒疫苗粉末也可以配制成可迅速分散的片劑劑型。在一個優選的實施方案中,液體五價進料制劑的噴霧干燥在每種輪狀病毒血清型(即G1、G2、G3、G4和P1)的更高病毒滴度下進行,優選10倍量,而不會不利地影響過程中的效力。在一個特別優選的實施方案中,對于五種血清型(即G1、G2、G3、G4和P1)的混合物,以更高的病毒滴度進行液體五價進料制劑的噴霧干燥。當以1倍(1×)劑水平噴霧干燥,或以10×劑滴度水平從噴霧干燥粉末獲得共混的疫苗制劑時,由此獲得的熱穩定噴霧干燥輪狀病毒疫苗(不論血清型及其組合)在2℃-8℃下經至少24個月不超過效力損失,并且當在合適體積的含水稀釋劑中重構并在2℃-8℃下孵育24小時時,也不超過Log10[0.5]的效力損失,從而促進施用用于活動設定(campaignsetting)的多劑量重構疫苗并減少浪費。還希望程序性地使粉末狀疫苗容易地溶解在稀釋劑中用于使用以促進在更少的時間內免疫接種更多的對象。因此,在一個優選實施方案中,將噴霧干燥粉末的全部粉末劑量溶解于水或水溶液中不超過60秒。經口施用疫苗在胃酸中存活至關重要。通過在噴霧干燥的疫苗中并入酸中和能力(AcidNeutralizationCapacity,ANC)作為緩沖劑/抗酸劑粉末,通過中和胃酸在經口施用后保護疫苗免受胃酸的損害。緩沖/抗酸組分選自HEPES、檸檬酸鹽、組氨酸、碳酸鈣、碳酸鈉、碳酸鉀、碳酸氫鈉、碳酸氫鈣、碳酸氫鉀、氫氧化鋁或氫氧化鎂、或其組合。在另一個優選的實施方案中,所述噴霧干燥的輪狀病毒粉末與緩沖劑和/或填充劑共混,從而產生范圍為2.0mEq/g至5.0mEq/g粉末的酸中和能力。因此,本發明提供了熱穩定、易于使用、易于運輸和可負擔的噴霧干燥輪狀病毒疫苗,其將影響發展中國家數百萬兒童的健康。本領域技術人員還將認識到該方法和制劑對其他病毒的適用性,所述其他病毒包括但不限于麻疹病毒、腮腺炎病毒、風疹病毒、腺病毒、流感病毒、呼吸道合胞病毒、脊髓灰質炎病毒、單純皰疹病毒、EB病毒(Epstein-Barvirus)。類似地,所述方法和制劑適用于細菌,所述細菌包括但不限于分枝桿菌屬(Mycobacterium)、肺炎球菌屬(Pneumococcus)、沙門氏菌屬(Salmonella)、志賀氏菌屬(Shigella)、利斯特氏菌屬(Listeria)、大腸桿菌(E.Coli)、鏈球菌屬(Streptococcus)、假單胞菌屬(Pseudomonas)、葡萄球菌屬(Staphylococcus)和弧菌屬(Vibrio)。以下實施例舉例說明但不限制本發明的范圍。實施例1:噴霧干燥對輪狀病毒血清型穩定性的作用已經制備了含有5種人-牛輪狀病毒血清型G1、G2、G3、G4和P1的一種示例性先導制劑SD62(表3),對于每種血清型具有0.818×107的病毒滴度。表3:針對含有輪狀病毒血清型G1、G2、G3、G4和P1的輪狀病毒疫苗制劑的噴霧干燥熱穩定性評價DoE制劑的組成。用0.1NHCI或NaOH將進料溶液的pH調節至6.2。在70℃-75℃的入口溫度、43℃-48℃的出口溫度、吸氣器在70-75%操作下進行噴霧干燥。進料速率保持在0.4-1.0mL/分鐘,且進料固體為17-20.45%g/mL,噴霧氣流為30Nm3/小時,霧化壓力為5bar。所用的噴霧噴嘴是Buchi雙流體(0.7mm),用于收集粉末的旋風分離器是BuchiHP。在低RH(<5%)條件下進行對所收集粉末的回收。a)研究1:使用MettlerToledo鹵素天平或/和KarlFischer滴定儀測試所回收噴霧干燥粉末的瞬時水分含量,并且發現水分含量<2.0%。b)研究2:將經回收的噴霧干燥粉末以150mg/mL的濃度用MilliQ水重構,并且與液體對照(儲存在-70℃)相比測試加工損失,并且已經發現產生的損失統計學上等于零。c)研究3:將剩余的經回收噴霧干燥粉末密封在玻璃小瓶中,并在37℃/75%RH下在穩定室中儲存至少4周。這些樣品已經以150mg/mL的濃度重構并測試穩定性損失,并且已經發現在1×劑下產生不超過Log10[0.5]IU/mL的損失(圖1的實心條)。實施例2:在高病毒滴度下噴霧干燥輪狀病毒血清型,以及隨后共混對噴霧干燥的輪狀病毒粉末之效力的作用以8.18×107(10×劑)IU/ml的高病毒滴度制備含有5種人-牛輪狀病毒血清型G1、G2、G3、G4和P1的示例性先導制劑SD62組合物。用0.1NHCl或NaOH將進料溶液的pH調節至6.2。噴霧干燥和樣品加工如實施例1中所述進行。a)研究1:將所回收的噴霧干燥粉末與填充劑和/或緩沖劑麥芽糖糊精(DE4-7)共混,以產生如實施例1所述的等于1.0×劑的病毒層(tier)。根據表4所示的組成制備填充劑和/或緩沖劑。表4:用于先導制劑SD62的填充劑和/或緩沖劑的組成噴霧干燥的粉末(10×)10%麥芽糖糊精83.97%HEPES3.84%組氨酸2.00%氯化鈣0.19%b)研究2:使用MettlerToledo鹵素天平或/和KarlFischer滴定儀測試所回收未共混和共混的噴霧干燥粉末的瞬時水分含量,并且發現水分含量<2.0%。c)研究3:將濃度為150mg/mL所回收的共混噴霧干燥粉末以及液體對照(儲存在-70℃)重構并測試加工損失,并且已經發現產生的損失與零沒有統計學上的差異。d)研究4:將所回收的共混噴霧干燥粉末密封在玻璃小瓶中,并在穩定室中在37℃175%RH下儲存至少4周。這些樣品已經以150mg/mL的濃度重構并測試穩定性損失。已經發現所有樣品在150mg中不小于2×106的10×劑下產生的損失不超過Log10[0.5]IU/mL(圖1條紋條)。實施例3糖、緩沖劑和陽離子對噴霧干燥輪狀病毒血清型之熱穩定的作用示例組成的先導制劑SD62已經在不同濃度的成分下進一步修飾和測試,以產生示例性的五價制劑SD63、SD64、SD65和SD66(表3)。含有5種人-牛輪狀病毒血清型G1、G2、G3、G4和P1的這些制劑已經以8.18×107(10×劑)IU/ml的病毒滴度制備。如實施例1中所述進行噴霧干燥。如實施例2和表4所述,將所回收的噴霧干燥粉末與填充劑和/或緩沖劑共混以產生等于1.0×劑的病毒層。a)研究1:將濃度為150mg/mL所回收的未共混和共混的噴霧干燥粉末以及液體對照(儲存在-70℃)重構并測試加工損失,并且已經發現產生的損失與零沒有統計學上的差異。e)研究2:將所回收的未共混和共混的噴霧干燥粉末密封在玻璃小瓶中,并在穩定室中在37℃/75%RH下儲存至少4周。將這些濃度為150mg/mL的樣品重構并測試穩定性損失(圖2)。b)研究3:使用KarlFischer滴定儀測試所回收的未共混和共混的噴霧干燥粉末的瞬時水分含量(圖3)。噴霧干燥的樣品的特征在于水分含量小于2.0%,而共混樣品的水分含量為0.44%至0.95%。c)研究4:使用差示掃描量熱法(DifferentialScanningCalorimetry,DSC)測試20mg所回收的未共混噴霧干燥粉末的玻璃化轉變溫度(Tg)。噴霧干燥粉末的Tg報告為中點溫度和粒度分布(圖4)。d)研究5:使用MalvernMastersizer3000測定分散在合適反溶劑中的未共混對照(單獨的麥芽糖糊精)和共混的粉末混合物的粒度分布(particlesizedistribution,PSD)。潛在批次的D90、D50和D10值示于表5中。表5:未共混和共混的示例性制劑的粒度分布及其與麥芽糖糊精填充劑的比較實施例4噴霧干燥參數對噴霧干燥的示例性先導制劑之粉末性質的作用。研究1:測定先導制劑的流動和固結性質:已經以8.18×107(10×劑)IU/mL的病毒滴度噴霧干燥含有5種人-牛輪狀病毒血清型的示例性先導制劑SD64。用0.1NHCl或NaOH將進料溶液的pH調節至6.2。噴霧干燥如實施例1中所述進行。如實施例2和表4所述,將所回收的噴霧干燥粉末與填充劑和/或緩沖劑共混以產生等于1.0×劑的病毒層。將5.16g粉末轉移到50mL量筒以測量所占據的堆體積并計算堆密度。此外,按照USP敲擊(tap)量筒,直到單獨組敲擊的振實體積(tappedvolume)的體積差異小于2%。測量振實體積以計算振實密度。已經導出了諸如卡爾(Carr’s)/固結系數和豪斯納比率(Hausner’sratio)的固結性質,其值示于表6中。這些值表示在USP中分類的粉末的平順(fair)至可通過的流動特征。表6:先導制劑SD64的流動特征研究2:測定先導制劑SD64中的溶解時間:以8.18×107(10×劑)IU/ml的病毒滴度噴霧干燥含有5種人-牛輪狀病毒血清型的示例性先導制劑SD64。用0.1NHCl或NaOH將進料溶液的pH調節至6.2。噴霧干燥如實施例1中所述進行。如實施例2和表4所述,將所回收的噴霧干燥粉末與填充劑和/或緩沖劑共混以產生等于1.0×劑的病毒層。在大致的低RH(<5%)氮環境下,將共混的噴霧干燥粉末在小瓶中精確稱重。向這種粉末添加水成為150mg/2mL至200mg/2mL的濃度,并手動搖動小瓶以觀察溶解。將添加水至溶液中沒有可見顆粒的點之間經過的時間被記錄溶解時間。先導制劑SD64的溶解速率示于表7中。表7:在SD64中噴霧干燥粉末在水中的溶解速率實施例5:在示例性先導制劑SD64中輪狀病毒血清型的噴霧干燥對重構后效力的作用以8.18×107(10×劑)IU/mL的病毒滴度噴霧干燥含有5種人-牛輪狀病毒血清型的示例性先導制劑SD64。用0.1NHCI或NaOH將進料溶液的pH調節至6.2。噴霧干燥如實施例1中所述進行。如實施例2和表4所述,將所回收的噴霧干燥粉末與填充劑和/或緩沖劑共混以產生等于1.0×劑的病毒層。將150mg共混粉末溶解在2mL水中,并在穩定室中在37℃/75%RH和2-8℃下儲存至少24小時。先導制劑在不同溫度下24小時的效力損失示于表8中。表8:噴霧干燥的輪狀病毒血清型在不同溫度下24小時的效力損失。血清型在2-8℃下24小時的LOG損失在37℃下24小時的LOG損失G10.09±0.070.33±0.16G30.17±0.090.70±0.17實施例6:測定示例性先導制劑SD64的酸中和能力(ANC)以8.18×107(10×劑)IU/mL的病毒滴度噴霧干燥含有5種人-牛輪狀病毒血清型的示例性先導制劑SD64。用0.1NHCl或NaOH將進料溶液的pH調節至6.2。噴霧干燥如實施例1中所述進行。如實施例2和表4所述,將所回收的噴霧干燥粉末與填充劑和/或緩沖劑共混以產生等于1.0×劑的病毒層。共混的噴霧干燥粉末的酸中和能力(ANC)根據USP測定。簡言之,將150mg共混粉末溶解在70mL水中,并將溶液攪拌1分鐘。然后向該樣品溶液添加30mL1NHCl,并再次將溶液攪拌正好15分鐘,并且不超過額外5分鐘的時間段。用0.5NNaOH滴定過量的HCl以達到3.5的穩定(10-15秒)pH。粉末所消耗的酸的毫當量數通過下式計算:總mEq=(30×NHCl)-VNaOH-NNaOH)。計算ANC并且結果示于表9中。表9:組合物號SD64的ANC。實施例7:測定延伸的縱向(longitudinal)熱穩定性用實施例2中概述的方法制備示例性制劑SD64和SD66,并測試病毒滴度的過程和穩定性損失,并且已經發現統計學上沒有加工損失并且在4℃和37℃下其效力分別保留20周(圖5A和5B)至24周(圖6A和6B)。實施例8:噴霧干燥方法的可重復性對示例性先導制劑SD64和SD66進行了可重復性試驗,其中樣品如實施例7中所述制備。比較了來自所述三個試驗的加工損失的結果,即N=1、2、3(圖7A和7B)。圖8中總結了在37℃下在三個批次中SD66中可重復的效力保留至少16周的結果。實施例9:在示例性噴霧干燥制劑組合物SD64和SD66中高溫對輪狀病毒效力的作用已經在45℃下測試了示例性先導制劑SD64和SD66的穩定性損失,以確定它們在“受控溫度鏈”運輸中的適合性,其中疫苗在免疫供應的最后一英里中在冷鏈外運輸,潛在地將疫苗暴露于>40℃的溫度下。以8.18×107(10×劑)IU/ml的病毒滴度制備含有5種人-牛輪狀病毒血清型的SD64和SD66制劑。用0.1NHCl或NaOH將進料溶液的pH調節至6.2。噴霧干燥如實施例1中所述進行。如實施例2和表4所述,將所回收的噴霧干燥粉末與填充劑和/或緩沖劑共混以產生等于1.0×劑的病毒層。使用MettlerToledo鹵素天平和/或KarlFischer滴定儀測試所回收的未共混和共混的噴霧干燥粉末的瞬時水分含量(圖4)。將濃度為150mg/mL所回收的未共混和共混的噴霧干燥粉末以及液體對照儲存在-70℃。將所回收的未共混和共混的噴霧干燥粉末密封在玻璃小瓶中,并在穩定室中在45℃/75%RH和2-8℃下儲存至少2周。濃度為150mg/mL的SD64和SD66樣品已經重構并測試效力損失(圖9A和圖9B),并發現表現出低于Log10=[0.5]的效力損失。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1