外用皮質類固醇組合物的制作方法
本發明涉及水性外用皮質類固醇組合物。
背景技術:
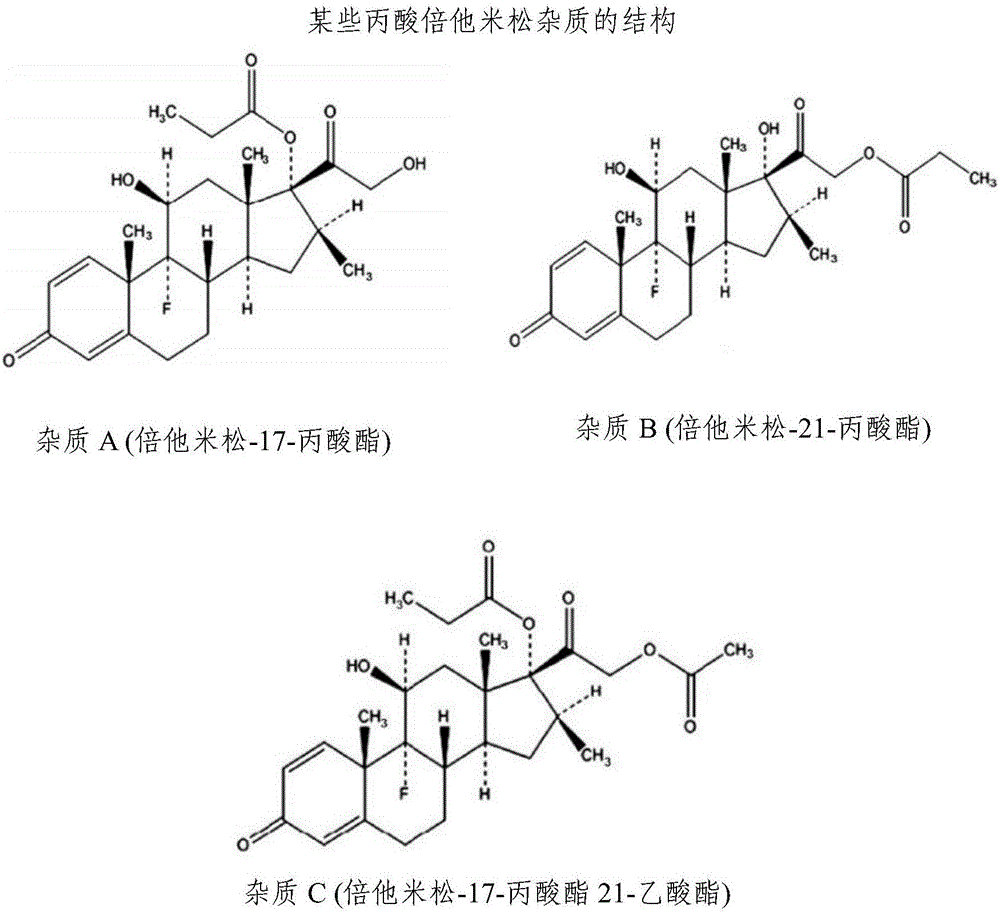
:局部藥物遞送系統是治療各種局部皮膚病的理想選擇。外用劑型例如軟膏劑、霜劑、凝膠劑、噴霧劑等可用于將活性劑遞送到皮膚的患病區域。炎性皮膚疾病常見于所有年齡組、種族和性別的人,并且這些疾病的特征在于皮膚的炎癥和刺激。炎癥性皮膚病的診斷和治療在皮膚病學的實踐中仍然具有挑戰性。牛皮癬是炎性皮膚病之一。它是一種慢性丘疹鱗屑性皮膚疾病,通過皮膚上出現的紅色鱗狀斑表現出來。它通常影響肘、膝蓋和頭皮。雖然許多治療選擇可用于治療牛皮癬,例如局部治療、光療和全身治療,但外用皮質類固醇是治療牛皮癬的首選。光療和全身治療是次選,當外用皮質類固醇治療牛皮癬失敗時,通常優選光療和全身治療。皮質類固醇廣泛用于臨床實踐。特別地,外用皮質類固醇已經用于治療各種皮膚病,例如牛皮癬、皮炎等。皮質類固醇化學上分為氫化可的松類、丙酮化合物類、倍他米松類等。它們也基于其在血管收縮試驗(VCA)或稱為皮膚褪色試驗中的效力分類。如美國食品及藥物管理局(FDA)行業指南,VCA通常用于獲得局部施用的皮質類固醇的效力并且確定局部施用的皮質類固醇的生物等效性。因此,皮質類固醇可以通過VCA分類為超效(1級)、高效(2級)、中上效力(3級)、中等效力(4級)、中下效力(5級)、低效(6級)和最低效(7級)。具有采用名稱“二丙酸倍他米松”的藥物化合物屬于超效(1級)和/或高效(2級),其化學名稱為9-氟-11(β),17,21-三羥基-16(β)-甲基孕甾-1,4-二烯-3,20-二酮17,21-二丙酸酯,并且由結構式I表示:二丙酸倍他米松是白色至乳白色粉末。它幾乎不溶于水,微溶于乙醇,并且易溶于丙酮和氯仿。外用倍他米松劑型例如氣霧劑泡沫、霜劑、軟膏劑、凝膠劑和洗滌制劑都是可商購的。存在二丙酸倍他米松與卡泊三醇水合物以及與克霉唑的組合制劑。二丙酸倍他米松是作為市售產品的包含0.05%倍他米松化合物的DIPROLENE和中的活性成分,每天一次或兩次施用于受影響的皮膚區域。一些外用皮質類固醇作為閉合劑型施用,其導致角質層水合,從而改善皮質類固醇藥物進入皮膚層的滲透性。軟膏劑型由于軟膏基質的閉塞性質而具有更大的吸收,然而,這對個體產生油膩的感覺。此外,有必要將這樣的制劑涂擦到目標部位上以改善活性劑到表皮的滲透,這一動作本身產生刺激。此外,醇的存在引起對個體皮膚的刺激/刺痛,并且基于溶液的外用組合物在活性劑滲透表皮之前具有蒸發的傾向。市場上的含推進劑的外用氣霧劑組合物的價格相對高于它們的對應物。角質層(SC)是包括死亡細胞的皮膚的第一層,并且提供了藥物透過皮膚層的經皮吸收的速率限制步驟。只有少數藥物具有穿透角質層所需的生理化學性質。經皮吸收涉及藥物分子在濃度梯度的影響下從皮膚表面進入角質層,藥物分子隨后擴散透過角質層和下面的表皮,透過真皮。載體在外用組合物中的性質對試劑在皮膚層中通過角質層的釋放和遞送速率具有深遠的影響。用于遞送藥物的載體可有助于產品的功效和穩定性。通常水性載體由于其無刺激性、優異的耐受性和無毒性質而在外用劑型中為優選。這里的一個重要方面是大多數皮質類固醇藥物在水性載體中特別難溶并且導致不穩定性。外用組合物中的另一個重要方面是內含促進活性劑滲透或擴散透過皮膚層的物質,即“皮膚滲透促進劑”。皮膚滲透促進劑對于活性物質滲入皮膚層是必要的。可獲得各種類型的皮膚滲透促進劑,例如脂肪酸及其酯、吡咯烷酮、亞砜、二醇、甘油酯等。然而,已知皮膚滲透促進劑對不同的活性劑表現不同。常規地,外用皮質類固醇產品可以作為霜劑、洗劑和軟膏劑獲得。美國專利第3,892,856號描述了溶解在聚乙二醇中并乳化到油性基質中的皮質類固醇的應用。美國專利第3,934,013號描述了包括至少兩種皮質類固醇、丙二醇、脂肪醇和水的外用藥物組合物。專利權人將“脂肪醇成分”描述為具有16-24個碳原子的任何脂肪醇,優選為飽和的一元伯醇,例如鯨蠟醇、硬脂醇或山崳醇。美國專利第4,343,798號公開了包括C5-C12脂肪酸與皮質類固醇組合的外用抗菌/抗炎組合物。PCT申請WO2011/026076公開了包括作為活性劑的類固醇的藥學上的外用可噴霧組合物。美國專利第6,126,920號和第7,078,058號公開了具有快速斷裂發泡劑、推進劑和緩沖劑的戊酸倍他米松氣霧劑,其中存在乙醇。美國專利第5,369,131號公開了液體機械地發泡的藥物組合物,其不含推進劑,用于局部施用。美國專利申請公開第2008/0102039號公開了包含丙二醇的噴霧發泡劑組合物。美國專利第5,958,379號公開了可作為液滴噴霧的藥物組合物,在小于4秒的時間內形成制劑。美國專利申請公開第2006/0239929號公開了用于治療牛皮癬的可噴霧組合物,其包括作為活性劑的氯倍他索以及乙醇。對于個體依從的外用制劑存在未滿足的需要,盡管其能有效地治療皮膚病例如牛皮癬,并且其在所需的作用部位提供活性劑的改善遞送,減少不方便和刺激,增加個體的易用性和更長的作用持續時間。外用噴霧組合物由于個體接受和方便施用于皮膚區域,總是優于任何其他外用劑型。外用皮質類固醇廣泛地被批準用于各種皮膚病,外用皮質類固醇已知具有溶解性問題,使得皮質類固醇不溶于水或水性溶劑。丙二醇是包含皮質類固醇的外用組合物中必需的溶劑和/或助溶劑。溶解皮質類固醇并作為助溶劑以促進皮質類固醇在外用組合物中的溶解性是眾所周知的。此外,丙二醇是已知的作為皮質類固醇的更好的皮膚滲透促進劑。丙二醇用于超過100種經批準的包含皮質類固醇的外用組合物中。另一方面,丙二醇對個體的皮膚引起顯著的過敏和皮膚刺激。本申請的水性外用噴霧組合物被配制成實現與市售產品相同或更好的功效,并克服外用劑型的使用中的個體依從性方面的缺點。技術實現要素:本申請的一個方面涉及水性外用噴霧組合物,其包括:a)皮質類固醇;b)至少一種脂肪醇;c)至少一種藥學上和/或皮膚學上可接受的賦形劑;和d)水。本申請的另一方面涉及包括作為活性劑的皮質類固醇的水性外用噴霧組合物用于預防、改善或治療牛皮癬、皮質類固醇響應性皮膚病、紅斑、接觸敏感性反應以及其他相關疾病或病癥的用途。本申請的另一方面涉及治療皮膚疾病的方法,其包括每天一次或兩次向個體的受影響的皮膚區域施用包含倍他米松化合物的水性外用噴霧組合物,其中組合物施用至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28或長達29天,其提供的下丘腦-垂體-腎上腺(HPA)軸抑制顯著低于倍他米松洗劑(0.05%)提供的或與倍他米松洗劑(0.05%)提供的相當。本申請的另一方面涉及治療皮膚疾病的方法,其包括每天一次或兩次向個體的受影響的皮膚區域施用包含倍他米松化合物的水性外用噴霧組合物,其中組合物施用至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28或長達29天。在另一方面,基于基本上沒有下丘腦-垂體-腎上腺軸抑制的病癥的嚴重程度,本申請的水性外用噴霧組合物可以施用超過1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28或長達29天。本申請的一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,其包括每天一次或兩次向個體的受影響的皮膚區域施用包括倍他米松化合物的外用噴霧組合物,其中組合物施用至少1天、長達15天、或長達29天,其提供的HPA-軸抑制低于倍他米松洗劑(0.05%)提供的或與倍他米松洗劑(0.05%)提供的相當。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,其包括每天一次或兩次向個體的受影響的皮膚區域施用包含倍他米松化合物的外用噴霧組合物,其中基于基本上沒有HPA-軸抑制的病癥的嚴重程度,組合物可以施用長達29天。在另一個實施方案中,當每天兩次向個體施用15天或29天時,本申請的包括倍他米松化合物的外用噴霧組合物提供小于約400pg/ml的倍他米松-17、21-丙酸酯、倍他米松-17-丙酸酯和倍他米松堿的“平均峰值濃度”(各個產品的“平均峰值濃度”值的總和)。在另一方面,“平均峰值濃度”在約5pg/ml至約30pg/ml、約5pg/ml至約50pg/ml、5pg/ml至約75pg/ml、約5pg/ml至約100pg/ml、約10pg/ml至約300pg/ml、約10pg/ml至約150pg/ml、約10pg/ml至約275pg、約20pg/ml至約90pg/ml、約30pg/ml至約125pg/ml、約50pg/ml至約290pg/ml、約20pg/ml至約250pg/ml、約50pg/ml至約200pg/ml的范圍內。在上述實施方案的一個方面,“平均峰值濃度”小于約100pg/ml、小于約150pg/ml、小于約250pg/ml、小于約300pg/ml。在另一方面,“平均峰值濃度”是不可測量的(<5pg/ml)。在另一方面,本申請的水性外用噴霧組合物包括:a)倍他米松化合物;b)油醇;c)至少一種藥學上和/或皮膚學上可接受的賦形劑;和d)水。本申請的另一方面涉及制備水性外用噴霧組合物的方法,其包括:a)加熱包含乳化劑和水不混溶物質的混合物以獲得油相;b)任選地,將抗氧化劑、防腐劑或兩者與a)的油相混合;c)將活性劑與滲透促進劑混合;d)將c)的材料與a)或b)的混合物混合;e)將聚合物溶解在水中以形成水相;和f)將d)的油相與e)的水相混合以形成乳劑。附圖說明圖1顯示了某些丙酸倍他米松雜質的結構。圖2顯示了在二丙酸倍他米松噴霧的刺激性斑貼試驗研究中,與其他載體相比較的示例性組合物6的平均刺激分數。圖3顯示了示例性組合物1-6保留在各個皮膚層中的倍他米松的量。圖4顯示了與受體水平相比,示例性組合物1-6保留在皮膚層中的倍他米松的百分比。圖5顯示了示例性組合物1-6通過受體水平滲透的倍他米松的量。發明詳述本文所用的術語“穩定的”是指活性劑在外用組合物中的物理穩定性和/或化學穩定性,其中在組合物于25℃和60%的相對濕度(RH),或30℃和65%的RH,或40℃和75%的RH下儲存持續時間例如3、6、12、18或24個月的穩定性研究期間,藥物測定值和/或雜質含量的變化小于約10%。本文所用的術語“不含一種推進劑”或“不含多種推進劑”表示組合物不使用任何常用的氣霧劑推進劑如氟氯烴、烴、壓縮氣體等遞送。如本文所用,“峰值濃度”是指單個個體的最大血漿濃度。如本文所用,“平均峰值濃度”是指平均最大血漿濃度,“中值峰值濃度”是指中值最大血漿濃度。本文所用的術語“基本上不含”表示所提及的指定物質以不超過總組合物的10重量%的量存在、或以不超過總組合物的約9重量%的量存在、或以不超過總組合物的約8重量%的量存在,或以不超過總組合物的約7重量%的量存在,或以不超過總組合物的約6重量%的量存在,或以不超過總組合物的約5重量%的量存在,或以不超過總組合物的約4重量%的量存在,或以不超過總組合物的約3重量%的量存在,或以不超過總組合物的約2重量%的量存在、或以不超過總組合物的約1重量%的量存在,或以總組合物的約0重量%的量存在,或完全不含指定物質(即)0%。本文所用的術語“基本上不起泡”表示當噴霧到受影響的皮膚區域時,外用噴霧組合物以大于90%的量形成霧或液滴。優選地,當噴霧到受影響的皮膚區域時,外用噴霧組合物以大于95%的量形成霧或液滴。本文所用的術語“基本上無刺激性”表示本申請的水性外用噴霧組合物不引起試驗部位的紅斑、丘疹、明確的水腫、小皰疹,以及不引起任何明顯的強烈反應,強烈反應是即使在半封閉條件下擴散超出測試部位。術語“基本上沒有下丘腦-垂體-腎上腺(HPA)軸抑制”是指HPA軸活性的相對保留,但不需要絕對保留100%的活性。在一些實施方案中,“基本上沒有HPA軸抑制”是指小于約0.1%、0.5%、1%、2%、3%、4%、5%、6%、7%、8%、9%或10%的活性抑制。在一些實施方案中,該術語是指抑制0%,即保留100%的活性。本文所用的術語“約”當指特定值或量時,意在包括指定值或量的在一些實施方案中±10%的變化,在一些實施方案中±5%的變化,在一些實施方案中±1%的變化,在一些實施方案中±0.5%的變化,以及在一些實施方案中±0.1%的變化。“皮膚透過促進劑”或“皮膚滲透促進劑”或“滲透促進劑”是用于提高藥物通過皮膚或粘膜的滲透率的組分,例如通過暫時減弱皮膚或膜的不滲透性。滲透促進劑也稱為“促進劑”和“吸收促進劑”。許多滲透促進劑都可以使用。已經發現,脂肪醇降低滲透滯后時間,從而增強向表皮和真皮中的遞送。在本申請的一個方面,皮膚滲透促進劑沒有任何限制,選自C5-C44脂肪醇,優選C5-C20脂肪醇。這些脂肪醇屬于長鏈飽和脂肪醇、不飽和鏈脂肪醇、支鏈醇或其組合。“潤膚劑”是軟化和舒緩皮膚的物質。它們用于矯正皮膚的干燥和結垢。各種潤膚劑包括但不限于:天然來源的油,例如杏仁油、椰子油、橄欖油、棕櫚油、花生油等;脂肪酸,例如月桂酸、肉豆蔻酸、棕櫚酸以及硬脂酸;脂肪酸的一元醇酯,例如月桂酸乙酯、月桂酸異丙酯、肉豆蔻酸乙酯、肉豆蔻酸正丙酯、肉豆蔻酸異丙酯、棕櫚酸乙酯、棕櫚酸異丙酯、棕櫚酸甲酯、硬脂酸甲酯、硬脂酸乙酯、硬脂酸異丙酯、硬脂酸丁酯、硬脂酸異丁酯、硬脂酸戊酯和硬脂酸異戊酯;礦物油及其任何組合。本文所用的術語“水性”表示外用噴霧組合物的載體在組合物中包含大部分水。在一個方面,本文使用的術語“水性”表示外用噴霧組合物包含基于組合物總重量的至少約60%w/w、或至少約70%w/w、或至少約75%w/w的水。在一個方面,水性外用噴霧組合物包括:a)倍他米松化合物;b)油相,其包括:i)至少包含油醇的脂肪醇和ii)乳化劑;和c)包含水的水相;其中油相和水相之間的重量比為約1:1.5至約1:4;并且組合物是皮膚貯庫型(depot)組合物。在一個方面,油相和水相之間的重量比為從約1:1.5至約1:4。在一個具體的方面,油相與水相之間的重量比選自約1:1.5或約1:1.6或約1:1.7或約1:1.8或約1:1.9或約1:2或約1:2.1或約1:2.2或約1:2.3或約1:2.4或約1:2.5或約1:2.6或約1:2.7或約1:2.8或約1:2.9或約1:3或約1:3.1或約1:3.2或約1:3.3或約1:3.4或約1:3.5或約1:3.6或約1:3.7或約1:3.8或約1:3.9或約1:4。術語“載體”表示天然或合成的有機或無機成分,活性成分與其組合以促進組合物的施用。在本上下文中,術語“載體”和“介質”可互換使用。術語“載體”包括但不限于水、丙酮,單獨或與諸如硅酮流體的材料組合。載體的量為組合物總重量的約5%至約99%。在一個方面,本申請的載體包含水。在一個方面,除了水之外,載體還可以包含水不混溶物質,例如任何藥學上和/或皮膚病學上可接受的天然脂肪酸類的脂肪酯,動物或植物的甘油三酯,中鏈甘油三酯,甘油單酯、甘油二酯和/或甘油三酯的混合物,蠟,氫化植物油,及其混合物。術語“防腐劑”是指加入到產品中以防止通過微生物生長或通過不期望的化學變化而分解的天然的或合成的化學品。防腐劑可以刻意地摻入組合物中用于防止潛在有害微生物的生長。盡管微生物傾向于在水相中生長,但微生物也可以存在于疏水相或油相中。用于本申請的組合物的合適的防腐劑包括但不限于:對羥基苯甲酸甲酯、對羥基苯甲酸丙酯、芐醇、氯甲酚、苯扎氯銨、西曲氯銨、依地酸鈉、硼酸及其任何混合物。防腐劑的量為組合物總重量的約0.25%至約25%。術語“倍他米松化合物”表示但不限于:倍他米松、二丙酸倍他米松(betamathasonedipropionate)、戊酸倍他米松、乙酸倍他米松、苯甲酸倍他米松、二丙酸倍他米松、倍他米松磷酸鈉、戊酸倍他米松、倍他米松磷酸鈉、倍他米松-17-丙酸酯、倍他米松-21-丙酸酯和倍他米松-17-丙酸酯21-乙酸酯和/或其混合物。除非另有說明,倍他米松化合物意在包括其異構體、其代謝物、其鹽、其酯、其衍生物或其前藥。術語“倍他米松”表示二丙酸倍他米松(倍他米松-17,21-二丙酸酯)、倍他米松-17-丙酸酯、倍他米松-21-丙酸酯、倍他米松堿和/或其混合物。術語“皮質類固醇”表示選自以下的化合物:二丙酸阿氯米松,安西奈德,二丙酸倍氯米松,倍他米松,苯甲酸倍他米松,二丙酸倍他米松,倍他米松磷酸鈉,戊酸倍他米松,倍他米松-17-單丙酸酯,倍他米松-21-單丙酸酯,布地奈德,丙酸氯倍他索,丁酸氯倍他松,新戊酸氯可托龍(clocortolonepivalate),地奈德,去羥米松,地塞米松,醋酸地塞米松,地塞米松煙酸酯,地塞米松丙酸酯,地塞米松磷酸鈉,地塞米松戊酸酯,二氟拉松雙乙酸酯,雙氟可龍戊酸酯,氟氫縮松,新戊酸氟米松,醋酸氟輕松(fluocinoloneacetonide),氟輕松醋酸酯,氟可丁丁酯,丙酸氟替卡松,哈西奈德,丙酸鹵倍他索,鹵甲松一水合物,氫化可的松,氫化可的松磷酸鈉,氫化可的松琥珀酸鈉,氫化可的松-17-丁酸酯-21-丙酸酯,醋丙氫可的松,醋酸氫化可的松,戊酸氫化可的松,丁酸氫化可的松,丁酸丙酸氫化可的松,甲基強的松龍,醋酸甲潑尼龍,醋丙甲潑尼龍,糠酸莫米他松,潑尼松龍,潑尼松龍磷酸鈉,醋酸潑尼松龍,潑尼松龍-17-戊酸-21-乙酸酯,曲安奈德,曲安西龍醋酸酯,曲安西龍雙醋酸酯和潑尼卡酯。除非另有說明,皮質類固醇或特定化合物的列舉旨在包括特定化合物或其任何鹽、酯、異構體、代謝物、綴合物、衍生物或前藥。倍他米松-17-丙酸酯、倍他米松-21-丙酸酯和倍他米松是母體藥物倍他米松二丙酸酯的代謝物。“溶劑”是指有助于藥物在組合物中溶解的組分。溶劑用于維持藥物在組合物中的溶液。一些溶劑也可以增強藥物的經皮滲透和/或作為濕潤劑。對于皮質類固醇藥物,溶劑可以包括與水不混溶的物質,例如天然脂肪酸類的脂肪酯,動物或植物的甘油三酯,中鏈甘油三酯,甘油單酯、甘油二酯和/或甘油三酯的混合物,蠟,氫化植物油,及其混合物。一些具體實例包括蓖麻油、羊毛脂油、具有10-18個碳原子的三異鯨蠟醇檸檬酸甘油三酯、辛酸/癸酸甘油三酯、椰子油、玉米油、棉籽油、亞麻籽油、貂油、橄欖油、棕櫚油、葵花油、堅果油、飽和石蠟油、輕質或重礦物油、植物油、甘油酯等,和/或它們的混合物。本文所用的術語“施用劑量”是指外用噴霧裝置的一次驅動中分配到個體皮膚的外用噴霧組合物的量。例如,如果施用劑量為約170mg,其含有約0.064%w/w的二丙酸倍他米松(約0.108mg),那么在皮膚層中的倍他米松的保留百分比為0.108mg二丙酸倍他米松的約0.1%至約10%。本文使用的術語“皮膚貯庫型”是指與相同藥物的全身性暴露相比,所施用藥物的皮膚保留性更高的外用組合物。本文所用的術語“皮膚層”包括哺乳動物皮膚的角質層、表皮和真皮。本文所用的術語“全身性暴露”包括任何局部施用的藥物進入哺乳動物的體循環中的趨勢,從而引起全身性副作用,例如本領域普通技術人員將認識到的,皮質類固醇引起的下丘腦-垂體-腎上腺(HPA)軸抑制的全身性副作用。術語“乳化制劑”、“表面活性劑”和“乳化劑”可互換使用。本申請的各個方面涉及包含皮質類固醇的水性外用噴霧組合物。本申請的其他方面涉及包含倍他米松化合物的水性外用噴霧組合物。本申請另外的方面涉及包含二丙酸倍他米松的水性外用噴霧組合物。本發明的一個方面涉及水性外用噴霧組合物,其包括:a)皮質類固醇;b)至少一種脂肪醇;c)至少一種藥學上和/或皮膚病學上可接受的賦形劑;和d)水。本發明的一個方面涉及水性外用噴霧組合物,其包括:a)倍他米松化合物;b)至少一種脂肪醇;c)至少一種藥學上和/或皮膚病學上可接受的賦形劑;和d)水。在一個方面,上述組合物中的脂肪醇用作皮膚滲透促進劑或皮膚透過促進劑。在另一方面,脂肪醇為C5-C20脂肪醇。在另一方面,這些脂肪醇選自飽和脂肪醇、不飽和脂肪醇、支鏈脂肪醇及其混合物。在另一方面,脂肪醇選自但不限于下組:反油醇,亞油醇,亞麻醇,己醇,月桂醇,硬脂醇,鯨蠟硬脂醇,山崳醇,油醇,2-庚基-1-十一烷醇,1,17-十七癸二醇及其組合。在另一方面,組合物為水包油乳液。在另一方面,所述組合物基本上不含(C1-C4)醇。在另一方面,所述組合物不含推進劑。在另一方面,本申請的組合物是對皮膚無刺激性的、無毒的和良好耐受的。在另一方面,皮質類固醇選自:倍他米松,氯倍他索,鹵倍他索,氯可托龍,地奈德,曲安西龍,莫米松,阿氯米松和氫化可的松。皮質類固醇可以其酸或堿形式、其鹽形式、其酯形式、其異構體形式或前藥形式存在。在另一方面,存在于本申請的組合物中的皮質類固醇為倍他米松化合物,或其鹽、酯、異構體、衍生物或前藥。在另一方面,倍他米松化合物選自下組:苯甲酸倍他米松、二丙酸倍他米松、倍他米松磷酸鈉、戊酸倍他米松及其組合。在另一方面,倍他米松化合物為二丙酸倍他米松的形式。在另一方面,存在于本申請的組合物中的皮質類固醇為糠酸莫米他松。在另一方面,存在于本申請的組合物中的皮質類固醇為戊酸倍他米松。在另一方面,存在于本申請的組合物中的皮質類固醇為曲安奈德。在另一方面,存在于本申請的組合物中的皮質類固醇為二丙酸阿氯米松。本申請的一個方面涉及包含皮質類固醇的水性外用噴霧組合物用于預防、改善或治療牛皮癬、皮質類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的用途。本發明的一個方面涉及包含皮質類固醇的水性外用噴霧組合物用于預防、改善或治療中度至重度斑塊狀銀屑病的用途。本發明的一個方面涉及包含皮質類固醇的水性外用噴霧組合物用于預防、改善或治療中度斑塊狀銀屑病的用途。本申請的一個方面涉及外用噴霧組合物,其包括:a)倍他米松化合物;b)至少一種脂肪醇,其包括:約0.1%w/w至約10%w/w范圍內的油醇;c)約0.01%w/w至約1%w/w范圍內的聚合物;d)乳化劑;e)水和f)至少一種藥學上可接受的賦形劑;其中組合物是水性乳液;基本上不含推進劑、二醇類和醇類;該組合物是非發泡的,并且該組合物具有可傾倒液體,如約100cps至約1000cps的稠度和粘度。本申請的一個方面涉及包含倍他米松化合物的水性外用噴霧組合物用于預防、改善或治療牛皮癬、皮質類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的用途。在另一方面,倍他米松化合物為二丙酸倍他米松。本申請的一個方面涉及包含倍他米松化合物的水性外用噴霧組合物用于預防、改善或治療中度至重度斑塊狀銀屑病的用途。在另一方面,倍他米松化合物為二丙酸倍他米松。本申請的一個方面涉及包含倍他米松化合物的水性外用噴霧組合物用于預防、改善或治療中度斑塊狀銀屑病的用途。在另一方面,倍他米松化合物為二丙酸倍他米松。在另一方面,倍他米松化合物在本申請的組合物中的濃度為基于組合物的總重量的約0.01%至約10%、或約0.025%至約5%、或約0.025%至約0.5%。本申請的具體方面涉及包含倍他米松化合物的水性外用噴霧組合物,倍他米松化合物的量相當于產品的約0.025重量%至約0.1重量%。本申請的另一方面涉及包含倍他米松化合物的水性外用噴霧組合物,倍他米松化合物的量相當于組合物的約0.05重量%。在另一方面,倍他米松化合物為二丙酸倍他米松。在本申請的另一方面,二丙酸倍他米松的重量為約0.643g。在本申請的另一方面,0.643g二丙酸倍他米松相當于0.5mg倍他米松。在本申請的另一方面,脂肪醇以基于組合物的總重量的約0.001%至約15%的量存在。本發明的一個方面涉及水性外用噴霧組合物,其包括:皮質類固醇、皮膚滲透促進劑、乳化劑、聚合物、水和水不混溶物質,其中皮膚滲透促進劑以基于組合物的總重量的約0.001%至約15%的量存在。在另一方面,皮膚滲透促進劑以基于組合物的總重量的約0.05%至約12%、尤其是約3%至約10%的量存在。在本申請的另一方面,水性外用噴霧組合物包括:a)二丙酸倍他米松;b)油醇;c)至少一種藥學上和/或皮膚學上可接受的賦形劑;和d)水。在本申請的另一方面,一種水性外用噴霧組合物,其包括:a)二丙酸倍他米松;b)至少一種脂肪醇;c)至少一種藥學上和/或皮膚學上可接受的賦形劑;和d)水,其中所述脂肪醇選自:反油醇、亞油醇、亞麻醇、己醇、月桂醇、硬脂醇、鯨蠟硬脂醇、山崳醇、油醇、2-庚基-1-十一烷醇、1,17-十七烷二醇及其混合物,并且其中所述外用噴霧組合物基本上不含(C1-C4)醇且不含推進劑。在另一方面,組合物還包含乳化劑。在另一方面,組合物不形成任何膜層。在另一方面,組合物為水包油乳液。在另一方面,上述組合物基本上不含(C1-C4)醇。在另一方面,所述組合物不含推進劑。本申請的另一方面涉及制備本申請的外用噴霧組合物的方法,其包括:a)加熱包含乳化劑和水不混溶性物質的混合物以獲得油相;b)任選地,將抗氧化劑、防腐劑或兩者與a)的油相混合;c)將活性劑與滲透促進劑混合;d)將c)的材料與a)或b)的混合物混合;e)將聚合物溶解在水中以形成水相;和f)將d)的油相與e)的水相混合以形成乳液。在另一方面,本申請的水性外用噴霧組合物是基本上對皮膚無刺激的、無毒的和良好耐受的,從而提供高度的個體依從性,并且可用于預防、改善或治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關的疾病或病癥。在另一方面,本申請的組合物涉及皮質類固醇的持續釋放,用于更好的皮膚滲透和個體舒適性。在另一方面,本申請的組合物涉及倍他米松化合物的持續釋放,用于更好的皮膚滲透和個體舒適性。在另一方面,本申請的組合物涉及二丙酸倍他米松的持續釋放,用于更好的皮膚滲透和個體舒適性。在一方面,本申請提供了使用包含至少一種作為活性劑的皮質類固醇的不含推進劑的外用噴霧組合物的方法,其中該方法包括將藥學上和/或皮膚病學上有效量的噴霧組合物直接施用于有需要的個體的皮膚的患處上。在另一方面,本申請提供了使用包含倍他米松化合物的不含推進劑的外用噴霧組合物的方法,其中該方法包括將藥學上和/或皮膚病學上有效量的噴霧組合物直接施用于有需要的個體的皮膚的患處上。在另一方面,本申請提供了使用包含二丙酸倍他米松的不含推進劑的外用噴霧組合物的方法,其中該方法包括將藥學上和/或皮膚病學上有效量的噴霧組合物直接施用于有需要的個體的皮膚的患處上。在另一方面,本申請的外用噴霧組合物用于治療牛皮癬,并且還可以在施用于皮膚的部位提供保濕和/或舒緩作用。在另一方面,組合物可降低在斑塊狀銀屑病中伴隨皮膚積聚的干燥。在另一方面,本申請的組合物可以直接應用于牛皮癬損傷或皮膚病,并且可以幫助減少炎癥、去除積聚的積垢、減少皮膚周轉(turnover)和/或清除受影響的皮膚的斑塊。使用血管收縮測定(VCA)來測量外用皮質類固醇的皮膚學效力,并且通過USFDA獲得外用皮質類固醇的體內生物等效性是推薦的方法(參考:Guidanceforindustry;Topicaldermatologicalcorticosteroids:invivoBioequivalence(行業指導;局部皮膚糖皮質激素:體內生物等效性);日期:1995年6月2日)。在體內進行VCA研究,并且通過兩種方法基于皮膚的漂白效果獲得結果,一種是色差計法,另一種是視覺評估法。評估效力通常考慮VCA,然而,VCA研究的結果取決于藥物在角質層和表皮中的濃度。脂肪醇在長鏈烴(C5-C44)中含有至少一個伯醇基團并且衍生自天然來源以及由脂肪酸合成制得。脂肪醇廣泛用于化妝品和制藥工業中,用于制備外用藥物組合物和化妝品制劑如頭發護理產品、護發素等。脂肪醇用作潤膚劑、皮膚滲透促進劑、乳化劑和增稠劑。除了伯醇基團之外,不飽和脂肪醇還包含在鏈中的至少一個烯基,此外,它們在鏈中的烯基處具有“Z”(順式)和“E”(反式)構型。脂肪醇的物理和化學性質根據鏈的長度和/或鏈中烯基的存在與否變化很大。脂肪醇的選擇和可用性主要取決于活性劑的選擇,因為已知脂肪醇由于活性劑的化學性質而與不同的活性劑起不同作用。在另一方面,脂肪醇在長鏈烴(C5-C20)中含有至少一個伯醇基團。在本發明的一個方面,皮膚滲透促進劑選自下組:反油醇、亞油醇、亞麻醇、己醇、月桂醇、硬脂醇、鯨蠟硬脂醇、山崳醇、油醇、2-庚基-1-十一烷醇、1,17-十七烷二醇及其混合物。在本申請的另一方面,皮膚滲透促進劑是支鏈脂肪醇,其選自2-甲基-1-戊醇,2-乙基己醇,2-丙基庚醇,2-丁基-辛醇,2-戊基-1-壬醇,2-己基-1-癸醇,1,6-己二醇,1,7-庚二醇,1,8-辛二醇,1,9-壬二醇,1,10-癸二醇,1,11-十一烷二醇,1,12-十二烷二醇,1,13-十三烷二醇,1,14-十四烷二醇,1,15-十五烷二醇,1,16-十六烷二醇,1,17-十七烷二醇,1,18-十八烷二醇及其混合物。在另一方面,皮膚滲透促進劑選自不飽和脂肪醇。在另一方面,皮膚滲透促進劑選自在脂肪醇鏈中具有至少一個不飽和鍵并具有“Z”構型的不飽和脂肪醇。在另一方面,油醇是本申請上下文中的皮膚滲透促進劑。在另一方面,本申請的組合物包含一種或多種可用于治療牛皮癬和相關病理狀況的額外的活性劑,包括合成、半合成或天然獲得的活性劑。本申請的組合物可以通過向有需要的個體施用藥學和/或皮膚病學有效量的噴霧組合物來用于預防、改善或治療皮膚疾病和病癥。本申請的組合物還可與其他療法例如光療聯合使用。在另一方面,本申請的組合物易于水洗并可從施用部位去除。在另一方面,當通過噴霧施用到皮膚上時,本申請的組合物對皮膚基本上是非閉塞的,并且在施用部位不形成任何膜層/殘留物。在另一方面,本申請的組合物基本上不含丙二醇。在另一方面,本申請的組合物基本上不含(C1-C4)醇和/或丙二醇,使得存在的任何量不會引起顯著的皮膚刺激或賦予組合物任何不希望的屬性。在另一方面,本申請的組合物基本上不起泡,不含丙二醇并且不含推進劑。在另一方面,本申請的組合物基本上不含二醇。本申請的二醇是亞烷基或聚亞烷基二醇。實例包括(C1-C6)亞烷基和聚亞烷基二醇,例如乙二醇、聚乙二醇(2-20個單體)、丙二醇、二丙二醇、丁二醇、戊二醇和己二醇。它們可以是或不是氧乙烯化的(2-50個EO)。另外示例性的為乙二醇醚,例如由Gattefosse以商標TranscutolHP銷售的乙氧基二甘醇或二甘醇單乙醚、由Gattefosse以商標Lauroglycol銷售的丙二醇月桂酸酯,由Uniqema以商標Estol1526銷售的丙二醇二辛酸酯二癸酸酯、以及丙二醇二壬酸酯。在另一方面,本申請的組合物即使在閉塞狀態下也不引起顯著的皮膚刺激。本申請的水性外用噴霧組合物基本上不含丙二醇并且在40℃下穩定至少約6個月或在25℃下穩定至少24個月。在另一方面,水性外用噴霧組合物在40℃下穩定至少約6個月或在25℃下穩定至少24個月。在一個方面,所述水性外用噴霧組合物包括:a)倍他米松化合物;b)油醇;c)至少一種乳化劑;d)至少一種藥學上可接受的賦形劑;和水;其中所述組合物是皮膚貯庫型組合物,并且在40℃下穩定至少約6個月或在25℃下穩定至少24個月。在另一方面,本申請的組合物在施用部位不形成膜。在另一方面,本申請的水性外用噴霧組合物可以施用超過1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27或28天,而不引起下丘腦-垂體-腎上腺(HPA)軸抑制。在另一方面,本申請的水性外用噴霧組合物可以施用長達29天,而不引起下丘腦-垂體-腎上腺(HPA)軸抑制。在一些實施方案中,該方法包括每天一次或兩次向個體的受影響的皮膚區域施用包含倍他米松化合物的水性外用噴霧組合物,其中基于疾病狀況的嚴重性,組合物施用長達29天,基本上沒有下丘腦-垂體-腎上腺(HPA)軸抑制。本申請的一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括每日一次或兩次向個體的受影響的皮膚區域施用包含倍他米松化合物的外用噴霧組合物,其中組合物至少施用一天,其提供的HPA-軸抑制低于倍他米松洗劑(0.05%)提供的或與倍他米松洗劑(0.05%)提供的相當。本申請的一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括每日一次或兩次向個體的受影響的皮膚區域施用包含倍他米松化合物的外用噴霧組合物,其中組合物至少施用長達15天,其提供的HPA-軸抑制低于倍他米松洗劑(0.05%)提供的或與倍他米松洗劑(0.05%)提供的相當。本申請的一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括每日一次或兩次向個體的受影響的皮膚區域施用包含倍他米松化合物的外用噴霧組合物,其中組合物至少施用長達29天,其提供的HPA-軸抑制低于倍他米松洗劑(0.05%)提供的或與倍他米松洗劑(0.05%)提供的相當。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括每日一次或兩次向個體的受影響的皮膚區域施用包含倍他米松化合物的外用噴霧組合物,其中基于疾病狀況的嚴重性,組合物可以施用長達29天,基本上沒有HPA軸抑制。在本申請的一個方面,皮膚病為中度至重度斑塊狀銀屑病。在本申請的一個方面,皮膚病為中度斑塊狀銀屑病。本申請的另一方面提供用于以噴霧形式將組合物局部遞送到皮膚上的分配裝置。在另一方面,本申請提供了裝填有組合物的裝置,其包括容器、分配器和封蓋。本申請的另一方面涉及包含無推進劑的外用組合物的分配裝置,其中裝置包括容器、泵分配器、汲取管,計量閥和驅動器,并且其中泵分配器能夠通過汲取管將組合物分配到計量閥中,并且通過裝配有孔口的驅動器,使得組合物以基本上一致的噴霧的形式持續釋放。本申請的一個方面涉及包含無推進劑的外用組合物的分配裝置,該裝置包括其中填充有組合物的袋系統或袋的容器,任選地裝配有汲取管和裝配有閥的驅動器,容器填充有圍繞小袋或袋的氣體,例如氮氣或壓縮空氣。將組合物引入系統可以進一步增加系統的壓力,其能夠將組合物從小袋或袋分配到裝配有閥的驅動器中,使得組合物在以噴霧形式驅動時釋放。在另一方面,本申請的外用可噴霧組合物的優點包括對施用部位的無刺激性、施用的方便性、長期有用性、織物不著色,并且不具有強烈或討厭的氣味。這有助于有需要的個體保持藥物的定期施用,因此避免皮質類固醇組合物施用的突然停止,其繼而防止疾病狀況的侵襲性復發。在另一個實施方案中,當每天兩次向個體施用15天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約400pg/ml的倍他米松-17,21-丙酸酯、倍他米松-17-丙酸酯和倍他米松堿的“平均峰值濃度”(各個產品的“平均峰值濃度”值的總和)。在另一方面,“平均峰值濃度”在約10pg/ml至約300pg/ml的范圍內。在上述實施方案的一個方面,“平均峰值濃度”在約10pg/ml至約275pg/ml的范圍內。在另一個實施方案中,當每天兩次向個體施用29天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約400pg/ml的倍他米松-17,21-丙酸酯、倍他米松-17-丙酸酯和倍他米松堿的“平均峰值濃度”(個體的平均峰值濃度值的總和產品)。在另一方面,“平均峰值濃度”在約10pg/ml至約300pg/ml的范圍內。在上述實施方案的一個方面,“平均峰值濃度”在約50pg/ml至約290pg/ml的范圍內。在另一個實施方案中,當每天兩次向個體施用15天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約300pg/ml的倍他米松堿的“平均峰值濃度”。在上述實施方案的一個方面,“平均峰值濃度”在約20pg/ml至約250pg/ml的范圍內。在另一方面,“平均峰值濃度”在約50pg/ml至約200pg/ml的范圍內。在另一個實施方案中,當每天兩次向個體施用29天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約150pg/ml的倍他米松堿的“平均峰值濃度”。在上述實施方案的一個方面,“平均峰值濃度”在約5pg/ml至約100pg/ml的范圍內。在另一方面,“平均峰值濃度”在約20pg/ml至約90pg/ml的范圍內。在另一個實施方案中,當每天兩次向個體施用15天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約300pg/ml的倍他米松-17-丙酸酯的“平均峰值濃度”。在上述實施方案的一個方面,“平均峰值濃度”在約20pg/ml至約250pg/ml的范圍內。在另一方面,“平均峰值濃度”在約50pg/ml至約200pg/ml的范圍內。在另一個實施方案中,當每天兩次向個體施用29天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約200pg/ml的倍他米松-17-二丙酸酯的“平均峰值濃度”。在上述實施方案的一個方面,“平均峰值濃度”在約10pg/ml至約150pg/ml的范圍內。在另一方面,“平均峰值濃度”在約30pg/ml至約125pg/ml的范圍內。在另一個實施方案中,當每天兩次向個體施用15天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約100pg/ml的倍他米松-17,21-二丙酸酯的“平均峰值濃度”。在上述實施方案的一個方面,“平均峰值濃度”在約5pg/ml至約75pg/ml的范圍內。在另一方面,“平均峰值濃度”在約5pg/ml至約50pg/ml的范圍內。在另一方面,“平均峰值濃度”在5pg/ml至約30pg/ml的范圍內。在另一方面,“平均峰值濃度”是不可測量的(<5pg/ml)在另一個實施方案中,當每天兩次向個體施用15天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約1000pg/ml的倍他米松堿的“峰值濃度”。在一個方面,峰值濃度小于約900pg/ml。在另一方面,“峰值濃度”在約5pg/ml至約850pg/ml的范圍內。在另一方面,“峰值濃度”在約5pg/ml至約800pg/ml的范圍內。在另一個實施方案中,當每天兩次向個體施用29天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約500pg/ml的倍他米松堿的“峰值濃度”。在一個方面,峰值濃度小于約400pg/ml。在另一方面,“峰值濃度”在約5pg/ml至約400pg/ml的范圍內。在另一方面,“峰值濃度”在約5pg/ml至約300pg/ml的范圍內。在另一方面,“峰值濃度”在約5pg/ml至約250pg/ml的范圍內。在另一個實施方案中,當每天兩次向個體施用15天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約700pg/ml的倍他米松-17-二丙酸酯的“峰值濃度”。在一個方面,“峰值濃度”在約5pg/ml至約600pg/ml的范圍內。在另一方面,“峰值濃度”在約6pg/ml至約550pg/ml的范圍內。在另一個實施方案中,當每天兩次向個體施用29天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約500pg/ml的倍他米松-17-二丙酸酯的“峰值濃度”。在一個方面,“峰值濃度”在約5pg/ml至約400pg/ml的范圍內。在另一方面,“峰值濃度”在約6pg/ml至約350pg/ml的范圍內。在另一個實施方案中,當每天兩次向個體施用15天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約100pg/ml的倍他米松-17,21-二丙酸酯的“峰值濃度”。在一個方面,“峰值濃度”小于約75pg/ml。在另一方面,“峰值濃度”在約5pg/ml至約75pg/ml的范圍內。在另一方面,“峰值濃度”是不可測量的(<5pg/ml)。在另一個實施方案中,當每天兩次向個體施用15天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約100pg/ml的倍他米松堿的“中值峰值濃度”。在上述實施方案的一個方面,“中值峰值濃度”在約20pg/ml至約80pg/ml的范圍內。在另一方面,“中值峰值濃度”在約20pg/ml至約65pg/ml的范圍內。在另一個實施方案中,當每天兩次向個體施用29天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約100pg/ml的倍他米松堿的“中值峰值濃度”。在上述實施方案的一個方面,“中值峰值濃度”在約15pg/ml至約75pg/ml的范圍內。在另一方面,“中值峰值濃度”在約20pg/ml至約65pg/ml的范圍內。在另一個實施方案中,當每天兩次向個體施用15天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約200pg/ml的倍他米松-17-二丙酸酯的“中值峰值濃度”。在上述實施方案的一個方面,“中值峰值濃度”在約10pg/ml至約150pg/ml的范圍內。在另一方面,“中值峰值濃度”在約20pg/ml至約100pg/ml的范圍內。在另一個實施方案中,當每天兩次向個體施用29天時,本申請的包含倍他米松化合物的外用噴霧組合物提供小于約200pg/ml的倍他米松-17-二丙酸酯的“中值峰值濃度”。在上述實施方案的一個方面,“中值峰值濃度”在約10pg/ml至約150pg/ml的范圍內。在另一方面,“中值峰值濃度”在約20pg/ml至約100pg/ml的范圍內。在另一個實施方案中,與每日兩次施用15天相比,當向個體施用29天時,本申請的包含倍他米松化合物的外用噴霧組合物提供較低的倍他米松堿的“平均峰值濃度”。在另一個實施方案中,當每天兩次向個體施用15天時,與倍他米松洗劑(0.05%)相比,本申請的包含倍他米松化合物的外用噴霧組合物提供較低的倍他米松-17-丙酸酯的“中值峰值濃度”。在另一個實施方案中,當每天兩次向個體施用15天時,與倍他米松洗劑(0.05%)相比,本申請的包含倍他米松化合物的外用噴霧組合物提供較低的倍他米松-17,21-丙酸酯的“中值峰值濃度”。在另一個實施方案中,當每天兩次向個體施用15天時,與倍他米松洗劑(0.05%)相比,本申請的包含倍他米松化合物的外用噴霧組合物提供較低的倍他米松堿的“中值峰值濃度”。在另一個實施方案中,與每天兩次在最大使用條件下向患有中度至重度斑塊狀銀屑病的個體施用15天的倍他米松洗劑(0.05%)相比,當每天兩次施用15天時,本申請的包含倍他米松化合物的外用噴霧組合物不提供更大的HPA軸抑制。在另一個實施方案中,與每天兩次在最大使用條件下向患有中度至重度斑塊狀銀屑病的個體施用15天的倍他米松洗劑(0.05%)相比,當每天兩次施用29天時,本申請的包含倍他米松化合物的外用噴霧組合物不提供更大的HPA軸抑制。本申請的一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,其包括施用包含倍他米松化合物的外用噴霧組合物,當每天兩次向個體施用15天時,其提供小于約400pg/ml的倍他米松-17,21-丙酸酯、倍他米松-17-丙酸酯和倍他米松堿的“平均峰值濃度”(各個產品的“平均峰值濃度”值的總和)。在另一方面,“平均峰值濃度”在約10pg/ml至約300pg/ml的范圍內。在上述實施方案的一個方面,“平均峰值濃度”在約10pg/ml至約275pg/ml的范圍內。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合物的外用噴霧組合物,當每天兩次向個體施用29天時,其提供小于約400pg/ml的倍他米松-17,21-丙酸酯、倍他米松-17-丙酸酯和倍他米松堿的“平均峰值濃度”(各個產品的“平均峰值濃度”值的總和)。在另一方面,“平均峰值濃度”在約10pg/ml至約300pg/ml的范圍內。在上述實施方案的一個方面,“平均峰值濃度”在約50pg/ml至約290pg/ml的范圍內。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合物的外用噴霧組合物,當每天兩次向個體施用15天時,其提供小于約300pg/ml的倍他米松堿的“平均峰值濃度”。在上述實施方案的一個方面,“平均峰值濃度”在約20pg/ml至約250pg/ml的范圍內。在另一方面,“平均峰值濃度”在約50pg/ml至約200pg/ml的范圍內。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合的外用噴霧組合物,當每天兩次向個體施用29天時,其提供小于約150pg/ml的倍他米松堿的“平均峰值濃度”。在上述實施方案的一個方面,“平均峰值濃度”在約5pg/ml至約100pg/ml的范圍內。在另一方面,“平均峰值濃度”在約20pg/ml至約90pg/ml的范圍內。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合物的外用噴霧組合物,當每天兩次向個體施用15天時,其提供小于約300pg/ml的倍他米松-17-二丙酸酯的“平均峰值濃度”。在上述實施方案的一個方面,“平均峰值濃度”在約20pg/ml至約250pg/ml的范圍內。在另一方面,“平均峰值濃度”在約50pg/ml至約200pg/ml的范圍內。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合的外用噴霧組合物,當每天兩次向個體施用29天時,其提供小于約200pg/ml的倍他米松-17-二丙酸酯的“平均峰值濃度”。在上述實施方案的一個方面,“平均峰值濃度”在約10pg/ml至約150pg/ml的范圍內。在另一方面,“平均峰值濃度”在約30pg/ml至約125pg/ml的范圍內。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合物,當每天兩次向個體施用15天時,其提供小于約100pg/ml的倍他米松-17,21-二丙酸酯的“平均峰值濃度”。在上述實施方案的一個方面,“平均峰值濃度”在約5pg/ml至約75pg/ml的范圍內。在另一方面,“平均峰值濃度”在約5pg/ml至約50pg/ml的范圍內。在另一方面,“平均峰值濃度”在5pg/ml至約30pg/ml的范圍內。在另一方面,“平均峰值濃度”是不可測量的(<5pg/ml)。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合的外用噴霧組合物,當每天兩次向個體施用15天時,其提供小于約1000pg/ml的倍他米松堿的“峰值濃度”。在一個方面,“峰值濃度”小于約900pg/ml。在另一方面,“峰值濃度”在約5pg/ml至約850pg/ml的范圍內。在另一方面,“峰值濃度”在約5pg/ml至約800pg/ml的范圍內。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合物的外用噴霧組合物,當每天兩次向個體施用29天時,其提供小于約500pg/ml的倍他米松堿的“峰值濃度”。在一個方面,峰值濃度小于約400pg/ml。在另一方面,“峰值濃度”在約5pg/ml至約400pg/ml的范圍內。在另一方面,“峰值濃度”在約5pg/ml至約300pg/ml的范圍內。在另一方面,“峰值濃度”在約5pg/ml至約250pg/ml的范圍內。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合的外用噴霧組合物,當每天兩次向個體施用15天時,其提供小于約700pg/ml的倍他米松-17-二丙酸酯的“峰值濃度”。在一個方面,“峰值濃度”在約5pg/ml至約600pg/ml的范圍內。在另一方面,“峰值濃度”在約6pg/ml至約550pg/ml的范圍內。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合的外用噴霧組合物,當每天兩次向個體施用29天時,其提供小于約500pg/ml的倍他米松-17-二丙酸酯的“峰值濃度”。在一個方面,“峰值濃度”在約5pg/ml至約400pg/ml的范圍內。在另一方面,“峰值濃度”在約6pg/ml至約350pg/ml的范圍內。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合的外用噴霧組合物,當每天兩次向個體施用15天時,其提供小于約100pg/ml的倍他米松-17,21-二丙酸酯的“峰值濃度”。在一個方面,“峰值濃度”小于約75pg/ml。在另一方面,“峰值濃度”在約5pg/ml至約75pg/ml的范圍內。在另一方面,“峰值濃度”是不可測量的(<5pg/ml)。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合物的外用噴霧組合物,當每天兩次向個體施用15天時,其提供小于約100pg/ml的倍他米松堿的“中值峰值濃度”。在上述實施方案的一個方面,“中值峰值濃度”在約20pg/ml至約80pg/ml的范圍內。在另一方面,“中值峰值濃度”在約20pg/ml至約65pg/ml的范圍內。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合物的外用噴霧組合物,當每天兩次向個體施用29天時,其提供小于約100pg/ml的倍他米松堿的“中值峰值濃度”。在上述實施方案的一個方面,“中值峰值濃度”在約15pg/ml至約75pg/ml的范圍內。在另一方面,“中值峰值濃度”在約20pg/ml至約65pg/ml的范圍內。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合的外用噴霧組合物,當每天兩次向個體施用15天時,其提供小于約200pg/ml的倍他米松-17-二丙酸酯的“中值峰值濃度”。在上述實施方案的一個方面,“中值峰值濃度”在約10pg/ml至約150pg/ml的范圍內。在另一方面,“中值峰值濃度”在約20pg/ml至約100pg/ml的范圍內。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合的外用噴霧組合物,當每天兩次向個體施用29天時,其提供小于約200pg/ml的倍他米松-17-二丙酸酯的“中值峰值濃度”。在上述實施方案的一個方面,“中值峰值濃度”在約10pg/ml至約150pg/ml的范圍內。在另一方面,“中值峰值濃度”在約20pg/ml至約100pg/ml的范圍內。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合的外用噴霧組合物,與每日兩次施用15天相比,當向個體施用29天時,其提供較低的倍他米松堿的“平均峰值濃度”。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合的外用噴霧組合物,當每天兩次向個體施用15天時,與倍他米松洗劑(0.05%)相比,其提供較低的倍他米松-17-丙酸酯的“中值峰值濃度”。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合的外用噴霧組合物,當每天兩次向個體施用15天時,與倍他米松洗劑(0.05%)相比,其提供較低的二丙酸倍他米松-17,21-丙酸酯的“中值峰值濃度”。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合的外用噴霧組合物,當每天兩次向個體施用15天時,與倍他米松洗劑(0.05%)相比,其提供較低的倍他米松堿的“中值峰值濃度”。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合的外用噴霧組合物,與每天兩次在最大使用條件下向患有中度至重度斑塊狀銀屑病的個體施用15天的倍他米松洗劑(0.05%)相比,當每天兩次施用15天時,其不提供更大的HPA軸抑制。本申請的另一個實施方案涉及治療皮膚疾病或病癥例如牛皮癬、類固醇響應性皮膚病、紅斑、接觸敏感性反應和其他相關疾病或病癥的方法,包括施用包含倍他米松化合物的外用噴霧組合物,與每天兩次在最大使用條件下向患有中度至重度斑塊狀銀屑病的個體施用15天的倍他米松洗劑(0.05%)相比,當每天兩次施用29天時,其不提供更大的HPA軸抑制。在本申請的一個方面,所述皮膚病為中度至重度斑塊狀銀屑病。在本申請的一個方面,所述皮膚疾病為中度斑塊狀銀屑病。在上述實施方案的一個方面,倍他米松化合物為二丙酸倍他米松。在上述實施方案的一個方面,倍他米松化合物為二丙酸倍他米松。在另一方面,存在于外用組合物中的皮質類固醇為二丙酸倍他米松,其通常以約0.001mg/kg體重至約0.5mg/kg體重的劑量施用于有需要的個體。在另一方面,本申請的組合物可以為溶液、懸浮液、乳液、洗劑、微乳液、納米乳液、乳膠劑、凝膠等形式。在實施方案中,組合物可以為乳液的形式。乳液可以為水包油型乳液或油包水型乳液的形式。水性乳液,例如水包油乳液,通常具有比其他乳液類型低的粘度,并表現出明顯的儲存穩定性。通常,當施用于皮膚時,水包油乳液具有更好的皮膚感覺特性,因為這些給出類似于水性材料的感覺。當油相作為液滴分散在水性連續相中時,這被稱為“水包油”型乳液。當水相作為液滴分散在油性連續相中時,這被稱為“油包水”型乳液。在一個方面,疏水相占組合物的約0.5重量%至約90重量%。乳液形式的組合物可以是微乳液或納米乳液。在實施方案中,分散相液滴的平均尺寸小于約500μm。在一個方面,分散相液滴的平均尺寸小于約2000nm。在一個方面,分散相液滴的D90在約1μm至約10μm的范圍內。在另一方面,本申請的組合物被配制為包含油相或疏水相、水相或親水相和乳化劑的乳液。在另一方面,本申請的組合物包括藥學上和/或皮膚病學上可接受的賦形劑,包括但不限于一種或多種載體、乳化劑、助乳化劑、透過或滲透促進劑、溶劑、助溶劑、潤膚劑、抗氧化劑、防腐劑、緩沖劑、膠凝劑或增稠劑、聚合物、表面活性劑、舒緩劑、pH調節劑、增溶劑、濕潤劑、潤膚劑、保濕劑、油性基質等。用于本申請的合適的聚合物的實例包括但不限于:卡波姆、聚乙二醇、丙烯酸酯聚合物、甲基丙烯酸酯聚合物、聚乙烯吡咯烷酮、基于甲基丙烯酸丁酯和甲基丙烯酸甲酯聚維酮的共聚物、乙酸乙烯酯、聚乙酸乙烯酯、纖維素、樹膠、藻酸鹽、鄰苯二甲酸乙酸纖維素、乙酸丁酸纖維素、羥丙基甲基纖維素鄰苯二甲酸酯等。實例包括產品、PEG400、100、RSPO、RLPO、ND40、基于甲基丙烯酸丁酯和甲基丙烯酸甲酯的共聚物(B),烷基纖維素例如乙基纖維素和甲基纖維素,羥烷基纖維素例如羥乙基纖維素和羥丙基纖維素,羥烷基烷基纖維素例如羥丙基甲基纖維素和羥丁基甲基纖維素,樹膠例如黃原膠、黃蓍膠、瓜爾膠、刺槐豆膠、阿拉伯樹膠等。可用的其他聚合物包括:聚酰胺、聚碳酸酯、聚亞烷基、聚亞烷基二醇、聚亞烷基氧化物、聚亞烷基對苯二甲酸酯、聚乙烯醇、聚乙烯醚、聚乙烯酯、聚鹵乙烯、聚乙交酯、聚硅氧烷、聚氨酯及其共聚物、纖維素醚、纖維素酯、硝基纖維素、丙烯酸酯和甲基丙烯酸酯的聚合物、乙酸纖維素、丙酸纖維素、乙酸丁酸纖維素、鄰苯二甲酸乙酸纖維素、羧乙基纖維素、三乙酸纖維素、硫酸纖維素鈉鹽、聚(乙基丙烯酸甲酯)、聚(甲基丙烯酸乙酯)、聚(甲基丙烯酸丁酯)、聚(甲基丙烯酸異丁酯)、聚(甲基丙烯酸己酯)、聚(甲基丙烯酸異癸酯)、聚(甲基丙烯酸月桂酯)、聚(甲基丙烯酸苯酯)、聚(丙烯酸甲酯)、聚(丙烯酸異丙酯)、聚(丙烯酸異丁酯)、聚(丙烯酸十八烷基酯)、聚乙烯、聚丙烯、聚(乙二醇)、聚(環氧乙烷)、聚(乙烯對苯二甲酸酯)、聚(乙烯醇)、聚(乙酸乙烯酯)、聚(氯乙烯)、聚苯乙烯等,包括其任何混合物。其他有用的聚合物包括:合成的聚合物,例如乳酸和乙醇酸的聚合物、聚酸酐、聚(原酸酯)、聚氨酯、聚(丁酸)、聚(戊酸)、聚(己內酯)、聚(羥基丁酸酯)、聚(丙交酯-共-乙交酯)、聚(丙交酯-共-己內酯),以及天然聚合物例如藻酸鹽和其他多糖,包括但不限于:阿拉伯聚糖、果聚糖、巖藻聚糖、半乳聚糖、半乳糖醛酸、葡聚糖、甘露聚糖、木聚糖(例如菊粉)、果聚糖(levan)、巖藻依聚糖、角叉菜膠、半乳卡羅聚糖(galatocarolose)、果膠酸、果膠、直鏈淀粉、支鏈淀粉、糖原、支鏈淀粉、纖維素、葡聚糖、石臍素、殼多糖、瓊脂糖、角質素、軟骨素、皮膚素、透明質酸、藻酸、黃原膠、淀粉和各種其他天然均聚物和雜聚物,例如含有一種或多種醛糖、酮糖、酸或胺、赤蘚糖、蘇糖、核糖、阿拉伯糖、木糖、來蘇糖、阿洛糖、阿卓糖、葡萄糖、甘露糖、古洛糖、艾杜糖、半乳糖、塔羅糖、赤蘚酮糖、核酮糖、木酮糖、阿洛酮糖、果糖、山梨糖、塔格糖、甘露醇、山梨醇、乳糖、蔗糖、海藻糖、麥芽糖、纖維二糖、甘氨酸、絲氨酸、蘇氨酸、半胱氨酸、酪氨酸、天冬酰胺、谷氨酰胺、天冬氨酸、谷氨酸、賴氨酸、精氨酸、組氨酸、葡萄糖醛酸、葡糖酸、葡糖二酸、半乳糖醛酸、甘露糖醛酸、葡糖胺、半乳糖胺和神經氨酸,及其天然存在的衍生物,包括右旋糖酐和纖維素、膠原、白蛋白和其他親水蛋白、玉米蛋白和其他醇溶谷蛋白和疏水蛋白,其共聚物或混合物。在另外的方面,聚合物的量在組合物總重量的約0.001%w/w至約45%w/w的范圍內。在一個方面,聚合物的量在組合物總重量的約0.01%w/w至約5%w/w的范圍內。在一個方面,基于組合物的總重量,聚合物的量在約0.1%w/w的范圍內。在一個方面,基于組合物的總重量,聚合物的量小于約0.1%w/w。在一個方面,基于組合物的總重量,聚合物的量為約0.05%w/w。合適的乳化劑的實例包括但不限于:椰油酰兩性基二乙酸二鈉、氧乙烯化甘油椰油酸酯(7EO)、PEG30二聚羥基硬脂酸酯(CithrolDPHS)、聚甘油-3二異硬脂酸酯、PEG-20十六碳烯基琥珀酸酯、PEG-15硬脂基醚、Polyoxyl20硬脂基醚(CetostearylEther)、聚丙二醇(PPG)-硬脂基醚如PPG-11硬脂基醚和PPG-15硬脂基醚、聚氧化丙烯硬脂基醚(ArlamolE)、蓖麻油酸單乙醇酰胺單磺基琥珀酸鹽、含60個環氧乙烷單元的氫化蓖麻油酸甘油三酯,例如由BASF以商標RH60或RH40(聚氧乙烯40氫化蓖麻油)出售的產品,聚合物例如環氧乙烷和環氧丙烷的嵌段共聚物的泊洛沙姆,以及在室溫下(也即是說,溫度范圍約20-35℃)為非固體脂肪物質例如芝麻油、甜杏仁油、杏石油、向日葵油、棕櫚酸辛氧基甘油酯(或2-乙基己基甘油醚棕櫚酸酯)、辛氧基甘油基山崳酸酯(或2-乙基己基甘油基醚山崳酸酯)、己二酸二辛酯和支鏈二元醇的酒石酸酯。山梨醇脂肪酸酯是山梨醇及其單酐和二酸酐與脂肪酸的偏酯的一系列混合物。山梨醇酯包括以20、Arlacel40、Arlacel60、Arlacel80、Arlacel83、Arlacel85、Arlacel987、ArlacelC、PEG-6硬脂酸酯和甘油硬脂酸酯和PEG-32硬脂酸酯(63)和PEG-6硬脂酸酯和PEG-32硬脂酸酯(1500)銷售的產品,及其任何混合物。硬脂酸的聚乙二醇醚是可以在乳液中使用的另一組乳化劑。硬脂酸聚乙二醇醚的實例為硬脂醇聚醚-2、硬脂醇聚醚-4、硬脂醇聚醚-6、硬脂醇聚醚-7、硬脂醇聚醚-10、硬脂醇聚醚-11、硬脂醇聚醚-13、硬脂醇聚醚-15、硬脂醇聚醚-20、硬脂醇的聚乙二醇醚(硬脂醇聚醚21)及其任何混合物。其他乳化劑包括月桂基硫酸鈉、鯨蠟基三烷基溴化銨、聚氧乙烯失水山梨醇脂肪酸酯或其任何混合物。在一方面,乳化劑選自非離子型表面活性劑。非離子乳化劑包括那些可廣泛定義為長鏈醇例如C8-30醇與糖或淀粉聚合物即糖苷的縮合產物。多種糖包括但不限于葡萄糖、果糖、甘露糖和半乳糖,各種長鏈醇包括但不限于癸醇、鯨蠟醇、硬脂醇、月桂醇、肉豆蔻醇、油醇等。其他有用的非離子乳化劑包括環氧烷烴與脂肪酸的縮合產物,例如脂肪酸的烷烴氧化酯。其他非離子型表面活性劑是環氧烷烴與兩摩爾脂肪酸的縮合產物,例如脂肪酸的烷烴氧化酯。乳化劑還可包括本領域已知的多種陽離子、陰離子、兩性離子、兩性表面活性劑和非離子型表面活性劑及其組合中的任一種。陰離子乳化劑的非限制性實例包括烷基羥乙基磺酸鹽,烷基和烷基醚硫酸鹽及其鹽,烷基和烷基醚磷酸鹽及其鹽,烷基甲基牛磺酸鈉鹽和脂肪酸的皂(例如堿金屬鹽和鈉或鉀鹽)。兩性乳化劑和兩性離子乳化劑的實例包括那些廣泛描述為脂肪族仲胺和叔胺的衍生物,其中脂肪族基團可以是直鏈或支鏈的,其中脂肪族取代基之一含有約8至約22個碳原子,并且一個含有陰離子水增溶基團,例如羧基、磺酸根、硫酸根、磷酸根或膦酸根。具體實例包括烷基亞氨基乙酸酯、亞氨基二鏈烷酸酯和氨基鏈烷酸酯、咪唑啉和銨衍生物。其他合適的兩性乳化劑和兩性離子乳化劑包括甜菜堿、磺基甜菜堿、羥基磺基甜菜堿、烷基肌氨酸鹽和烷酰基肌氨酸鹽。硅樹脂乳化劑通常是有機改性的有機聚硅氧烷,有時稱為硅樹脂表面活性劑。有用的硅樹脂乳化劑包括二甲基硅氧烷共聚醇。這些材料是聚二甲基硅氧烷,其已被改性以包括聚醚側鏈,例如聚氧化乙烯鏈、聚氧化丙烯鏈、這些鏈的混合物,以及包含衍生自環氧乙烷和環氧丙烷的部分的聚醚鏈。乳化劑的量為組合物總重量的約0.25%至約45%。助乳化劑或輔助乳化劑包括聚氧甘油酯,例如油酰基聚乙二醇甘油酯(M1944CS)、亞油酰基聚乙二醇甘油酯(M2125CS)、辛酰己酰基聚乙二醇甘油酯鯨蠟醇(和)鯨蠟醇聚醚-20(和)硬脂醇聚醚-20(EmulcireTM61WL2659)、硬脂酸甘油酯(和)PEG-75硬脂酸酯(64)或其任何混合物。在一方面,本申請的乳化劑可以作為皮膚滲透促進劑。在一方面,組合物還包含一種或多種抗氧化劑、防腐劑、濕潤劑或增塑劑。抗氧化劑是抑制氧化或抑制由氧或過氧化物促進的反應的物質。抗氧化劑,特別是脂溶性抗氧化劑,可以被吸收到細胞膜中以中和氧自由基,從而保護膜。本申請的組合物的合適的抗氧化劑包括但不限于抗壞血酸(維生素C)、谷胱甘肽、硫辛酸、尿酸、胡蘿卜素、α-生育酚(維生素E)、泛醇、丁基化羥基苯甲醚、丁基化羥基甲苯、苯甲酸鈉、沒食子酸丙酯(PG、E310)和叔丁基對苯二酚。抗氧化劑的量為組合物總重量的約0.01%至約20%。上述一些賦形劑物質在制劑中可以具有多于一種功能。例如,物質可以是溶劑和滲透促進劑,或者溶劑和載體兩者。上述材料的分類不應被解釋為以任何方式限定或限制。組合物可以直接施用到受影響的皮膚區域上,例如銀屑病斑塊或皮膚病。可噴霧組合物在被噴霧時在受影響的區域上形成液滴/霧,并且在實施方案中,可以提供活性劑在延長的持續時間內的釋放。添加脂肪醇可能使可噴霧組合物積聚更多的粘度,然而本申請的水性外用噴霧組合物是低粘度的可噴霧組合物,并且本申請的水性外用噴霧組合物包含至少一種脂肪醇,基于組合物的總重量,其在約5%w/w的范圍內。本申請的水性乳液的粘度通常在約0.01-15帕斯卡秒,“Pa·s”(10-15,000厘泊,“cP”)、約0.1-1.5Pa·s(100-1,500cP)、或約0.2-1Pa·s(200-1,000cP)的范圍內變化。在一個方面,本申請的外用噴霧組合物具有可傾倒的液體,例如當通過Brookfield粘度計DVII+Pro、軸LV3在100rpm測量時為約100cP至約1000cP的稠度和粘度。本申請的外用噴霧組合物包括:a)至少一種倍他米松化合物;b)至少一種選自下組的脂肪醇:反油醇,亞油醇,亞麻醇,己醇,月桂醇,硬脂醇,鯨蠟硬脂醇,山萮醇,油醇,2-庚基-1-十一烷醇,1,17-十七烷二醇及其混合物;c)至少一種乳化劑;d)至少一種藥學上和/或皮膚學上可接受的賦形劑;和e)水;其中所述組合物在如實施例3所述的體外經皮吸收和滲透研究中提供更多的倍他米松在皮膚層中的保留和低百分比的倍他米松滲入受體水平。在另一方面,本申請的外用噴霧組合物在如實施例3中所述的體外經皮吸收和滲透研究中提供低于(施用劑量的)約10%的倍他米松的滲透通過受體水平。在另一方面,滲透到受體水平的倍他米松的百分比小于施用劑量的約5%。在另一方面,本申請的組合物包括:a)倍他米松化合物,其以相當于總組合物的約0.05重量%的量存在;b)油醇;c)至少一種乳化劑;d)至少一種藥學上和/或皮膚學上可接受的賦形劑;和e)水;在如實施例3所述的體外經皮吸收和滲透研究中提供低于(施用劑量的)約2%的倍他米松的滲透通過受體水平。在另一方面,本申請的組合物包括:a)倍他米松化合物,其以相當于總組合物的約0.05重量%的量存在;b)油醇;c)至少一種乳化劑;d)至少一種藥學上和/或皮膚學上可接受的賦形劑;和e)水;在如實施例3所述的體外經皮吸收和滲透研究中提供(施用劑量的)約3%至約8%的倍他米松保留在真皮和表皮水平。在另一方面,本申請的外用噴霧組合物提供每次驅動約50mg至約230mg的輸出、或提供每次驅動約160mg至約190mg的輸出。在另一方面,本申請的外用噴霧組合物在如實施例3所述的體外經皮吸收和滲透研究中提供倍他米松在皮膚層中的施用劑量的約0.1%至約20%的保留。在另一方面,所述組合物在如實施例3所述的體外經皮吸收和滲透研究中提供倍他米松在皮膚層中的施用劑量的約0.1%至約10%的保留。在另一方面,用于外用組合物的脂肪醇提供倍他米松的較高的倍他米松皮膚層保留和較低的倍他米松滲透通過受體水平的濃度。脂肪醇的這種傾向提供皮膚貯庫型組合物。在另一方面,用于本申請的組合物中的油醇在如實施例3所述的體外經皮吸收和滲透研究中提供約50的皮膚保留率。進一步參考實施例3中描述的表4。使用下式計算皮膚保留率:皮膚保留率=皮膚層中的總倍他米松/受體中的總倍他米松。在一方面,本申請的水性外用噴霧組合物是水包油乳液,并具有不連續的油相和連續的水相。在一方面,本申請的水性外用噴霧組合物包括:a)倍他米松化合物;b)油醇;c)至少一種乳化劑;和d)水;其中組合物是水包油乳液,并且包括:在油相中的倍他米松化合物,并且水相基本上不含倍他米松化合物。在一個具體方面,本申請的水性外用噴霧組合物包括:a)油相,其包括:i)倍他米松化合物,ii)油醇和iii)至少一種乳化劑;b)包含水的水相和c)至少一種藥學上和/或皮膚學上可接受的賦形劑。在一方面,本申請的水性外用噴霧組合物包括:a)二丙酸倍他米松;b)油醇;c)至少一種乳化劑;和d)水;其中組合物是水包油乳液,并且在油相中包含二丙酸倍他米松,并且水相基本上不含二丙酸倍他米松。在一方面,本申請的水性外用噴霧組合物包括:a)二丙酸倍他米松;b)油相,其包括:i)至少一種包含油醇的脂肪醇和ii)乳化劑;和c)包含水的水相;其中組合物在油相中包含二丙酸倍他米松,并且水相基本上不含二丙酸倍他米松。在另一方面,用于包裝的封閉件由聚合的物質例如高密度聚乙烯(HDPE)、低密度聚乙烯(LDPE)或樹脂制成。具體地,這些封閉件以蓋子的形式裝配到容器上以助于對分配器單元提供支撐和/或將容器的內容物與外部環境隔離。各種容器材料包括但不限于鍍錫鋼、鋁、不銹鋼、塑料和玻璃。分配器的一個實例是包含泵的單元,該泵可適于裝配在任何類型的容器上,例如通過與容器上的螺紋匹配的螺紋或其配件發揮凸輪作用的自鎖接頭,彎曲直到一部分滑過另一部分上的凸起唇緣,防止它們分離。該泵能夠通過從驅動器延伸到容器中的汲取管分配本申請的可噴霧組合物,并且連接到止回閥,該止回閥以噴霧的形式從驅動器的孔中釋放組合物。該閥可以是計量閥。可以使用的各種類型的閥包括但不限于:連續噴霧閥和計量閥。驅動器允許容易地打開和關閉閥,并且是包裝的組成部分。這也有助于產生所需類型的產品排放。各種類型的驅動器包括但不限于:噴霧驅動器、泡沫驅動器、固體流驅動器和特殊驅動器。在另一方面,分配裝置可以是包括容器的裝置,容器中具有容納產品的袋系統或袋,任選地裝配有汲取管和裝配有閥的驅動器,其中容器填充有圍繞小袋或袋的氮氣或壓縮空氣。容器可以由鋁或錫板制成,包含產品的袋系統或袋可以由聚乙烯(PE)、聚丙烯(PP)、聚對苯二甲酸乙二醇酯(PET)和鋁的層制成。將組合物引入系統中進一步增加了系統的壓力,其能夠將組合物從小袋分配到裝配有閥的驅動器中,使得組合物在驅動時以基本一致的噴霧的形式持續釋放。小袋可以在其中具有與驅動器閥連通的汲取管,以控制噴射速率和減小液滴尺寸。在另一方面,用于分配本申請的組合物的分配裝置以使得每次分配基本上一致的劑量的方式提供噴霧速率和噴霧圖案,其明顯地覆蓋所需要的皮膚受影響區域,其中組合物噴射在上面。該泵用于將組合物均勻地遞送到皮膚上。以指定的噴霧速率(例如但不限于約20mg/驅動至約500mg/驅動,或約100mg/驅動至約200mg/驅動)覆蓋皮膚的所需區域并產生非常精細的均勻液滴。該裝置提供可再現的噴霧圖案,例如圓形,取決于與施用部位的距離,通常覆蓋約0.1cm2至約10cm2的面積。對于新泵來說,可能需要大約2-6次啟動驅動以可再現地分配組合物。在一個具體方面,每次驅動泵時,分配約160μL的制劑。裝置經常提供液滴的可再現分布,其中約90%的液滴具有約1μm至約500μm的范圍的尺寸。孔口的尺寸設置成控制分配產品的液滴尺寸。孔口尺寸還影響提供一致特征的噴霧圖案。在另一方面,可用于治療牛皮癬的組合物可包裝在裝配有附設的噴霧泵封口的瓶中,其可由個體或護理者機械驅動,以將組合物施用于受影響的皮膚(即,泵型噴霧閉合)。在另一方面,本申請的噴霧組合物可以以比可應用霜劑和軟膏劑基本上更容易和更精確的方式施用。使用噴霧施用,僅需要噴霧給定體積,而半固體產品(例如霜劑)的施用需要使乳膏量或軟膏量容易獲得和可目視估測。此外,在大的表面區域上使用本發明的噴霧組合物可以更容易地避免蹭臟和弄臟衣服。對于噴霧組合物,與霜劑和軟膏劑產品相反,不需要鋪展和摩擦,因為通過液體的蒸發或蒸發在體表上形成的層已經具有活性劑的理想的精細分散;因此本申請的噴霧組合物的局部施用不會發生“壓痛”。在一個方面,本申請的水性乳液可噴霧組合物還允許在施用區域(即,肘、膝、頭皮和背部)僅通過噴霧接觸的方法施用藥物。本申請的水性乳液可噴霧組合物對于僅通過噴霧接觸的施用區域(即,肘、膝、頭皮和背部)是自給藥的。在一方面,治療過敏性皮炎、脂溢性皮炎、濕疹、中度至重度斑塊狀銀屑病、紅斑痤瘡、痤瘡、類固醇響應性皮膚病、紅斑、接觸敏感性反應及其組合的方法,該方法包括將藥學和/或皮膚病學有效量的外用噴霧組合物直接施用到有需要的個體的皮膚的患處上。在一個方面,治療過敏性皮炎、脂溢性皮炎、濕疹、中度至重度斑塊性銀屑病、紅斑痤瘡、痤瘡、類固醇響應性皮膚病、紅斑、接觸敏感性反應及其組合的方法,其包括以下步驟:提供具有包含倍他米松化合物的外用噴霧組合物的裝置;以及將所述組合物的噴霧直接遞送到有需要的個體的皮膚的患處上,其中該方法提供廣角全錐型噴霧圖案的噴霧特性,噴霧圖案具有約35mm至約60mm的第一軸、約35mm至約55mm的第二軸,以及第一軸與第二軸之間的比率為約1至約1.5。在一個方面,從個體的皮膚到裝置的施用距離為約20mm至約60mm,并且對于個體皮膚噴霧角度為約50度至約70度。在一個方面,施用外用噴霧組合物的方法包括以下步驟:提供具有包含皮質類固醇的外用噴霧組合物的裝置;以及將所述組合物的噴霧直接遞送到有需要的個體的皮膚的患處上,其中裝置每次沖程遞送約65mg至約210mg的噴霧組合物,其中噴霧計數為約230次至約270次沖程以清空裝置中的組合物。在一個方面,本申請的組合物的局部施用在皮膚上形成貯庫而不形成閉塞膜,從而延長活性劑作用的持續時間同時允許皮膚的“呼吸”。本申請的另一方面還提供了用于制備可以填充到合適的分配裝置中的組合物的方法。在實施方案中,方法包括:a)制備包含活性劑和一種或多種合適的賦形劑的組合物,和b)將所需量的組合物填充到分配裝置中。在另一方面,制備包含作為活性劑的倍他米松化合物和賦形劑的外用組合物的方法包括:a)加熱包含乳化劑和溶劑的混合物以獲得油相;b)任選地,將抗氧化劑和/或防腐劑混入a)的油相中;c)將皮質類固醇與滲透促進劑混合;d)將c)的材料與a)或b)的材料混合;e)將聚合物溶解在水相中;f)將d)的油相與e)的水相緩慢混合并持續混合;和g)將f)的混合物均質化,然后冷卻。在另一方面,上述方法中的倍他米松化合物選自二丙酸倍他米松。在另一方面,本申請的組合物的pH值范圍為約3至約7、或約3.5至約6。在另一方面,乳液的油相是乳化劑和溶劑的混合物。在另一方面,本申請的丙酸倍他米松組合物可以含有任何一種或多種雜質,例如含量不超過約5%的雜質A(倍他米松-17-丙酸酯)、含量不超過約2%的雜質B(倍他米松-21-丙酸酯)、含量不超過約1%的雜質C(倍他米松-17-丙酸酯21-乙酸酯)、以及含量不超過約1.0%的單一的未知雜質(這些雜質具有圖1所示的結構)和任何其他藥物相關雜質,其含量使得任何這樣的雜質基本上不會不利地影響組合物的安全性。雜質A和B主要在制劑的穩定性研究期間觀察到,雜質C通常是來自藥物合成的與工藝有關的雜質。上述雜質限制表示為組合物中標示藥物含量的百分比。在另一方面,本申請的二丙酸倍他米松組合物可以包含一種或多種未知雜質。二丙酸倍他米松的這種雜質之一是烯醇醛雜質(雜質D)。烯醇醛是已知的在其D-環上具有1,3-二羥基丙酮側鏈的皮質類固醇的降解產物,例如倍他米松、地塞米松、倍氯米松等。烯醇醛雜質由這些皮質類固醇通過從側鏈酸催化β消除水形成,烯醇醛也可以在堿性條件下由這些皮質類固醇的相應的17,21-二酯形成。倍他米松烯醇醛的E-異構體各種條件例如組合物的pH和儲存條件影響烯醇醛的形成,并且已知烯醇醛以兩種不同的同分異構體E-異構體和Z-異構體存在。然而,E和Z異構體之間的比例可以根據諸如制劑的pH、介質和溫度的條件而不同。已經發現通過升高溫度可增加E-異構體的形成。在另一方面,本申請的丙酸倍他米松組合物可以包含標示藥物含量的約0.001%至約1.3%的量的雜質D。令人驚奇的是,在本申請的一個方面,在25℃下至少6個月內、或在25℃下至少12個月內、或在25℃下至少18個月內或在25℃下至少24個月內,烯醇醛雜質可良好地控制為低于1%。在一方面,當在2-8℃下儲存時,本申請的外用噴霧組合物在至少12個月內基本上不含烯醇醛雜質。在另一方面,上述外用噴霧組合物包含二丙酸倍他米松和油醇。提供以下實施例以說明本申請的某些具體方面和實施方案,并且不應被解釋為以任何方式限制本申請的范圍。以下實施例可以包括代表在與本發明相關的開發和實驗過程中的各個時間收集的數據的數據匯編。具體實施方式實施例1:示例性組合物及其制備在實施例中,所用的活性劑二丙酸倍他米松具有粒度分布,其中一半粒子具有小于約50μm的粒度,90%的粒子具有小于約300μm的粒度。示例性倍他米松噴霧組合物:制造方法:i.藥物溶液制備:在持續攪拌下將二丙酸倍他米松和丁基化羥基甲苯溶解在油醇中;ii.油相制備:將山梨糖醇單硬脂酸酯、聚乙二醇20鯨蠟硬脂基醚、鯨蠟硬脂醇和礦物油在不銹鋼容器中加熱至70±2℃。將對羥基苯甲酸丙酯加入油相中;iii.在攪拌下將在步驟1中制備的藥物溶液緩慢加入油相中。不銹鋼容器的溫度低于70±2℃;iv.水相制備:將水和對羥基苯甲酸甲酯均質化并加入一定量的羥乙基纖維素以制備水相;v.將油相和水相均質化。在2400rpm下持續均質化10分鐘;vi.然后,使用水冷套在250rpm的攪拌下將容器冷卻至30℃±2℃,并使其冷卻至環境溫度。另外的示例性組合物:實施例2:示例性組合物6的穩定性測試將填充到密閉容器中的制備的制劑暴露于穩定性測試條件:25℃和60%相對濕度(RH)、30℃和65%RH、以及40℃和75%RH下兩個月。所有樣品保持為無相分離的灰白色同質乳液。藥物測定值在標示藥物含量的90%-110%的指定范圍內。在各個儲存點的研究結果顯示在表1中,其中的值是標示藥物含量的百分比。表1:穩定性研究的結果ND=沒有檢測到實施例3:示例性組合物1-16的局部吸收和滲透測試對外用噴霧組合物(組合物1-16)進行篩選,以使用垂直擴散池(Franz型)通過有限給藥法將藥物滲透到不同的皮膚層中并滲透到受體相中。方法和材料:有十六個治療組(每組n=9個池)。每組具有來自3個不同供體(55歲或更年輕;3個供體×3次重復)的3個皮膚樣品。所有測試組合物儲存在室溫下。皮膚模型:在本研究中使用人尸體皮膚。切取的人類尸體皮膚組織的平均厚度為約350-450μm。供體組織在擴散池中均勻分配。體外經皮吸收和滲透研究:使用垂直擴散池(Franz型)篩選組合物1-16的外用噴霧組合物。將皮膚樣品安裝在單獨的擴散池上。該配置中每個池具有0.503cm2(直徑8mm)的擴散面積。每個單個池是靜態Franz池類型。受體室裝有3.0ml的添加有0.01%硫酸慶大霉素的4%BSA水溶液,將其劇烈且連續地混合。溫度設定在32±0.2℃。在給藥前,將池在32℃孵育1小時。在孵育期結束時,將來自受體流體的樣品作為t=0樣品。將在32℃預孵育的新批次受體液體引入HTS池中的受體室。組合物以約2.5mg/池的水平給予,其相當于5mg/cm2,并且使用容積式移液管應用它們。通過計算每種組合物的密度計算給藥體積。以0小時、2小時、6小時、10小時、12小時或24小時的時間間隔收集樣品,并在分析前儲存在冷凍箱中。通過對0、2、6、10、12或24小時收集的樣品分析皮膚滲透,并且在24小時后進行全質量平衡研究。從以下皮膚位置分析二丙酸倍他米松及其代謝物的全質量平衡研究量:皮膚表面(未吸收的和/或未穿透的),角質層(來自膠帶剝離)和表皮(與真皮分離,然后通過溶劑萃取),真皮(與表皮分離,然后通過溶劑萃取)。用沾有1×PBS的棉簽將組織表面擦拭三次,以除去未吸收的和未滲透的API即二丙酸倍他米松及其代謝物。使用標準膠帶剝離法除去角質(SC)層。去除角質層后,剩余的組織用1×PBS潤濕,機械分離表皮和真皮層。采用用于以下分析物的定性方法LC-MS/MS分析所有收集的樣品:二丙酸倍他米松、倍他米松-17-丙酸酯、倍他米松-21-丙酸酯和倍他米松堿。表2:保留在皮膚層中的倍他米松示例性組合物角質層(ng)表皮(ng)真皮(ng)合計(ng)組合物15.4017.0914.2236.71組合物211.1115.234.8731.21組合物336.8342.5533.81113.19組合物42.021.890.794.70組合物517.577.436.3831.39組合物633.0018.3414.1165.45組合物782.65198.1140.52321.28組合物878.76244.1457.68380.59組合物978.61162.9267.49309.01組合物1070.48199.2149.78319.47組合物1176.09182.9186.33345.32組合物1273.29206.1554.89334.32組合物13108.23197.9653.02359.21組合物14141.82165.2068.15375.17組合物15184.39133.52106.10424.01組合物16236.1498.1787.07421.39表3:保留在皮膚層中的倍他米松的百分比和受體水平表4:皮膚保留率范圍(n=9個池)示例性組合物最小值最大值組合物11.48.4組合物20.78.3組合物31.113.7組合物40.97.3組合物50.749.6組合物61.547.7組合物70.210.5組合物81.310.4組合物90.910.0組合物100.624.1組合物110.43.9組合物125.782.1組合物132.881.5組合物140.73.8組合物150.310.1組合物161.15.0實施例4:二丙酸倍他米松噴霧的刺激性斑貼試驗研究總計招募四十(40)名受試者,其中三十四(34)名已完成研究。這是對在健康志愿者的半閉塞條件下重復施用于皮膚時的刺激潛力的隨機、雙盲、單中心、載體對照的、受試者體內比較斑貼試驗研究:i.二丙酸倍他米松噴霧(示例性組合物6),ii.載體噴霧(不含組合物6的活性劑),iii.載體洗劑(異丙醇,羥丙基纖維素,磷酸二氫鈉一水合物,丙二醇,磷酸,氫氧化鈉和水,即倍他米松洗劑(0.05%)的載體),iv.十二烷基硫酸鈉(SLS)(0.2%),和v.生理鹽水(0.9%)。所有受試者在背部的隨機分配的相鄰部位接受每種研究產品對完整皮膚的施用。評估者和受試者都是盲法的,并且在斑貼測試部位不知道研究產品的身份。使用2cm×2cm的貼片在半閉塞貼片條件下施用研究產品。將產品施用于背部的肩胛下區域的任一側。使用視覺評分法評估紅斑、水腫和其他皮膚刺激跡象的程度以在臨床上評估施用部位的皮膚反應評估。在21天的時間內進行總共21個貼片施用。記錄每種組合物的刺激分數。結論:在載體洗劑部位和0.2%SLS部位觀察到比二丙酸倍他米松噴霧部位、載體噴霧部位和無菌生理鹽水(0.9%)部位明顯更多的刺激。在載體洗劑部位和SLS(0.2%)部位之間的刺激沒有顯著差異,在二丙酸倍他米松噴霧部位和載體噴霧部位之間、二丙酸倍他米松噴霧部位和無菌生理鹽水(0.9%)部位的刺激沒有顯著差異。在本研究中使用的超常條件下,在半閉塞下連續暴露21天,二丙酸倍他米松噴霧(組合物6)及其載體噴霧(無活性劑的組合物6)沒有產生顯著刺激的證據。相比之下,載體洗劑(用于倍他米松洗劑的載體增加0.05%)產生輕度刺激,在載體洗劑部位和SLS(已知的輕度刺激物)(0.2%)部位之間沒有顯著的刺激差異。實施例5:示例性組合物6的噴霧特性噴霧圖案表征在適當的目標即薄層色譜(TLC)板上沖擊之后的噴霧。在本研究中使用具有硅膠60、F254(熒光指示劑)、250μm厚層的玻璃的TLC板作為目標,并且用合適的緊固件夾持TLC板。在研究中使用自動空氣壓力驅動裝置以使噴霧驅動自動化。MarkMax泵(1-10)用于在噴霧圖案研究中泵送組合物。從噴嘴到TLC板的噴射距離為40mm。噴霧器(容器為a2ozHDPE瓶)裝載示例性組合物,組合物密度為0.9081g/ml,KernALJ220-4NM用于測量每次沖程的輸出。在灌注之前將組合物搖動三次,并且將泵10X灌入罩中以確保完整的沖程。噴霧器和具有緊固件的TLC板在40mm距離處被置于合適的位置。選擇驅動配置(profile),泵輸出為0.16ml;驅動/返回速度為100mm/s;驅動/返回加速度為5700mm/s2;初始延遲為0ms;保持時間為100ms;最終延遲為0ms,并且驅動間延遲為0ms。噴霧后,將TLC板從緊固件上取下,并在254nmUV光下觀察噴霧圖案,并且使用合適的相機在紫外光下拍攝照片(例如,數碼相機),并且確定噴霧圖案的最小和最大直徑。將該試驗重復28天(每天2次),并在日常試驗之間將組合物以水平和垂直位置儲存在室溫下。實施例6:用于評價二丙酸倍他米松在油/水相中的分布的示例性組合物6的分數溶解度研究進行分數溶解度研究以評估水包油乳液組合物中的二丙酸倍他米松分布。精確稱量約3.1g示例性組合物6,并轉移到15ml離心管中。將約3.1g氯化鈉加入到含有該組合物的相同離心管中并充分搖動。將來自TKA水純化系統的10ml水加入到離心管中,并充分搖動2分鐘以破乳。將離心管裝入離心機中并在15℃下以10000rpm離心組合物5分鐘。離心后,觀察到兩個不同的層。基于體積推斷上層為油相(描述為白霜),下層為水層(描述為澄清無色液體)。將下層注入HPLC中并采用用于測定的HPLC標準測試程序進行分析,未觀察到二丙酸倍他米松峰。將上層小心地轉移到100ml容量瓶中,按照用于測定的HPLC標準測試程序進行藥物含量測定。觀察到上層(即油相)中二丙酸倍他米松的測定為約100.3%。實施例7:下丘腦-垂體-腎上腺(HPA)軸抑制研究在最大使用條件下,在患有中度至重度斑塊狀銀屑病的受試者中評估噴霧組合物6抑制HPA軸的潛力。將75名受試者隨機分為治療15天的組合物6(n=23)、治療29天的組合物6(n=25)或治療15天的倍他米松洗劑(0.05%)(n=27)。每天施用治療兩次。受試者有20%至50%的體表面積被處理以實現最大使用接觸。目標劑量為每天至少5g至7g。使用指定為正常刺激后皮質醇水平為≥18μg/dL的ACTH刺激試驗測試HPA軸功能。在用組合物6(15天和29天)或倍他米松洗劑(0.05%)(15天)治療患有中度至重度銀屑病的受試者中,在促腎上腺皮質激素(ACTH)刺激之前和之后測定血漿皮質醇。所有治療組中治療性突發不良事件(TEAE)的發生率相似(25.9%至32%)。在任何治療組中沒有報道由于TEAE導致的嚴重的TEAE或研究中止。在所有治療組中以相似的發生率報道了施用部位瘙癢:(在15天治療組中的組合物6、在29天治療組中的組合物6和在15天治療組中的倍他米松洗劑(0.05%)分別為4%、7.4%和4.5%)。在29天治療組中的組合物6中,僅報道了一名受試者的施用部位的額外TEAE灼燒/刺痛(編碼為施用部位疼痛)(3.7%)。在68名可評價的受試者中,在用組合物6每日兩次治療15天后的24名受試者中的5名(20.8%)以及在用倍他米松洗劑(0.05%)每日兩次治療15天后的20名受試者中的5名(25.0%)中鑒定出提示腎上腺抑制的異常ACTH刺激試驗結果。在用組合物6每日兩次治療29天后,沒有受試者(24名中的0名)具有異常ACTH刺激試驗結果。15天治療組中的組合物6和15天治療組中的倍他米松洗劑(0.05%)之間的HPA軸抑制的發生率相似,分別為20.8%和25.0%(表5)。對于在29天治療組中的組合物6未觀察到HPA軸抑制。表5:治療結束時ACTH刺激試驗的總結(具有數據的安全性群體-受試者)在大多數受試者中檢測到二丙酸倍他米松代謝物,即倍他米松-17-丙酸酯和倍他米松堿。與15天治療組中的組合物6相比,29天治療組的組合物6中的受試者具有較低的倍他米松-17-丙酸酯和倍他米松堿血漿濃度的“中值峰值濃度”(表-6)。表6:用組合物6治療15天組和29天組后的倍他米松-17-丙酸酯和倍他米松堿的中值最大血漿濃度(“中值峰值濃度”,以pg/mL計)。數據表示最大血漿濃度的中值(“中值峰值濃度”)(最小值,最大值)表7:用組合物6治療15天組和29天組后的倍他米松-17-丙酸酯和倍他米松堿的平均最大血漿濃度(“平均峰值濃度”,以pg/ml計):數據表示最大血漿濃度的平均值(“平均峰值濃度”)(最小值,最大值)。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1