非侵入性劑施用器的制作方法
本發明涉及將劑應用至靶部位。在優選的形式中,發明利用超聲能量將包含在其中具有多個微型結構的劑載體主體中的劑非侵入性地輸送至靶部位。在此優選的形式中,在靶部位處,劑向靶部位中的滲透能夠通過超聲促滲機構(sonophoretic mechanism)實現或增強。
背景技術:
WO 2007/143796公開了利用裝置將分子和/或顆粒遞送至靶部位的方法,所述方法包括產生用于增強分子和/或顆粒滲透至靶組織中的超聲。
WO 2007/143796的裝置包括裝載有分子和/或顆粒諸如藥物或墨等的導電聚合凝膠材料。將電場施加至導電聚合物凝膠使束縛在聚合物凝膠基質中的分子或顆粒基本上釋放,并且最終,此分子或顆粒通過超聲輸送通過此聚合物凝膠至靶組織表面。在靶組織表面,分子和/或顆粒到組織中的滲透能夠通過超聲促滲機構實現或增強。
關于此遞送機構的一個難點是聚合物凝膠的結構可隨時間降解(諸如由于水分的損失),其導致分子和/或顆粒經超聲的擴散降低。此外,凝膠是差的超聲傳送介質(transmitter),其降低了超聲促滲過程的效率。另外,適當地將施用器裝載小體積的裝載有分子和/或顆粒的聚合凝膠是費時且不易的。
鑒于這些問題,正探尋用于將劑遞送至靶組織的改進的裝置和機構。
在說明書中引用任何現有技術不被認為、并且不應被認為承認或任何形式暗示:此現有技術在澳洲或任何其它管轄區形成了部分公知常識,或此現有技術可以被合理地預期確定、理解和視為相關,或被本領域技術人員與其它現有技術結合。
技術實現要素:
在發明的一個方面,提供了用于非侵入性地將劑遞送至生物組織的劑載體。可以通過一種或多種形式向組織遞送劑。遞送的形式可以通過引起劑經劑載體輸送的輸送刺激(stimulus)或刺激(stimuli)表征。在優選的形式中,輸送刺激也增強或允許劑滲透至組織中。發明優選的形式僅利用超聲作為輸送刺激。
在優選的形式中,劑載體包括被配置以在劑載體主體內保持劑的劑載體主體。劑載體主體具有用于接合治療中的組織的組織接觸表面,其中輸送刺激的應用引起劑通過劑載體主體向組織接觸表面的輸送。
待遞送的劑可以包括以任意組合的一種或多種分子或顆粒或一種或多種分子和顆粒。劑可以是流體或可以在流體介質中攜帶,例如通過溶解、懸浮或分散在流體介質中,諸如水、油、乳劑、凝膠或類似物。給出僅一些實例,劑可以包括蛋白質、疫苗、核酸、單克隆抗體、納米顆粒或分子機器(molecular machine)。在優選的實施方式中,劑是藥物或藥物組合物。藥物或藥物組合物的一種或多種活性藥物成分可無限制地為以下的任一種:合成化合物;天然存在的化合物;或生物藥物。將藥物或藥物組合物遞送至生物組織的目的可以是為了任何所期望的臨床原因,包括:治療、治愈或減輕疾病、狀況、或病癥;減弱、改善、或消除特定疾病、狀況、或病癥的一種或多種癥狀;預防或延遲一種或多種疾病、狀況、或病癥或其癥狀的發病;診斷疾病、狀況、或病癥,或任何意圖影響身體結構或任何功能的劑。在其它實施方式中,劑可以是用于化妝品目的諸如用于清潔、美化、提升吸引力、或改變身體外觀的劑。劑也可為用于制作人或機械可感知材料(makings)的標記劑,例如墨或其它。其它類型的劑也可被使用。
輸送刺激是用于通過劑載體將劑移動至組織接觸表面的驅動力,并且可增強和/或允許劑從組織接觸表面滲透至組織中。
在一些實施方式中,組織可為任何人或動物生物組織,其包括黏膜、皮膚和牙齒。優選地,組織是眼組織或口腔黏膜。在一些實施方式中,組織是任何植物組織。
在一方面,提供包括用于非侵入性地接合治療中的組織的組織接觸表面的劑載體主體,該組織接觸表面被至少部分地通過多個突出物限定。突出物可與形成劑載體主體的部分的一個或多個儲存器流體連通。各個劑儲存器可包括在劑載體主體內形成的空隙(void)。突出物可從空隙的內部向外延伸并且在所述組織接觸表面終止。空隙可由外圍結構形成,其中至少部分所述外圍結構可在組織接觸表面終止。
在一些實施方式中,外圍結構與突出物在共同平面終止。在其它實施方式中,至少一些所述限定組織接觸表面的突出物從空隙向外延伸超過外圍結構。在一些實施方式中,突出物可在一個平面終止并且外圍結構可短于該平面終止以便突出物延伸超過外圍結構。
劑載體主體可進一步包括一條或多條微通道,所述微通道至少部分地延伸通過劑載體主體至組織接觸表面,使得能夠將劑輸送至組織表面。微通道可延伸通過劑載體主體以流體連接至劑儲存器。
這些方面的劑載體主體可以包括疊層,包括組織接觸層——其包括組織接觸表面——和至少一個其它層。組織接觸層優選地具有延伸穿過其以限定主體中微通道的至少一部分的孔。在一些實施方式中,多個層具有在其中形成的孔以使能夠將劑從一層輸送至下一層。優選地,多個層的一層中形成的孔與相鄰層中的孔對齊,以便多個層中的多個孔協作形成微通道。在一些實施方式中,從第一層至組織接觸層(tissue-containing layer)孔的直徑減小并且數量增加。微通道可隨它們的長度具有不同的橫截面。
在一些實施方式中,用于儲存劑的儲存器至少部分地(和任選全部地)在劑載體主體中形成。
微通道和/或劑儲存器(一個或多個)和/或突出物由劑載體主體內的內部暴露表面限定。優選地,這些內部暴露表面被配置以具有預定的親水、疏水、和/或導電性質。在這種情況下,至少部分的內部暴露表面可以被改性或處理以配置它們的親水、疏水、和/或導電性質。
劑載體主體可包括能夠用劑裝載劑載體主體和/或儲存器(一個或多個)的端口(port)。
劑載體主體可以進一步包括可操作的產生輸送刺激的刺激發生器。刺激發生器優選地包括超聲換能器。
在一些實施方式中,劑載體優選地包括本發明所描述的任意類型的外殼,其被配置以機械地支持劑載體主體。外殼可以包括被配置安裝于施用器裝置(device)的安裝布置(arrangement)。安裝布置優選地能夠選擇性的將劑載體附接至施用器裝置和從施用器裝置移除,以便劑載體可以被替換.
劑載體外殼也可包括凹槽或其中形成的其它安裝構造(formation),用于接收劑載體主體。在一些實施方式中,劑載體主體可以選擇性的附接至凹槽或安裝構造或從凹槽或安裝構造移除,以便劑載體主體可以被替換。
劑載體可以包括能夠用劑裝載劑載體主體和/或儲存器(一個或多個)的端口。
劑載體可以進一步包括可操作地產生輸送刺激的刺激發生器。刺激發生器優選地包括超聲換能器。至少部分的刺激發生器可以作為劑載體主體的部分形成。
在優選的實施方式中,劑載體或劑載體主體作為施用器裝置的部分是適合于一次性使用的可消耗的施用器末端。
在發明的另一方面,提供了包含劑載體和/或劑載體主體的非侵入性施用器裝置,如本發明所述。
劑載體或劑載體主體可被直接或間接地耦接至手柄單元以便于施用器裝置的手持操作。手柄單元優選地包括被配置以與劑載體和/或劑載體主體的互補安裝布置協作的安裝布置。
手柄單元可包括超聲發生器以產生傳送至附接的劑載體和/或劑載體主體的超聲波。
優選地,劑載體是適合于一次性使用的可消耗的施用器末端。
劑載體優選地包括包含用于非侵入性地接合治療中的組織的組織接觸表面的劑載體主體,組織接觸表面被多個突出物至少部分地限定。
劑載體可包括用于運載所述劑的一個或多個劑儲存器,其中所述突出物與形成劑載體的部分的一個或多個儲存器流體連通。每一個劑儲存器可部分地(或整體地)包含劑載體主體內形成的空隙。
本文還公開了從本發明所述的劑載體分配劑的方法。方法包括將劑容納于劑載體內,所述劑載體包括固體劑載體主體。方法可以進一步包括將劑載體主體的組織接觸表面與生物組織的組織表面接合。方法可以進一步包括從劑載體分配劑至組織表面——通過施加至少一種輸送刺激以引起劑穿過劑載體主體輸送至組織表面。
在一些形式中,方法進一步包括經劑載體對組織施加輸送刺激,以增強或允許劑滲透至生物組織中。
將劑容納于劑載體內可以包括將至少一些劑容納于載體主體內。
在優選的實施方式中,劑載體主體終止于其多個突出物中的組織接觸表面處。在這種情況下,劑載體主體的組織接觸表面與生物組織的組織表面的接合包括使生物組織的組織表面與劑載體主體的突出物接合。此接合優選地不涉及生物組織的任何層與突出物的機械滲透。
在發明的另一方面,提供了從如先前所述的劑載體、劑載體主體、或施用器裝置分配劑的方法,方法包含:使劑載體的組織接觸表面與組織表面接觸;和從劑載體主體分配劑至組織表面以及到靶組織中。
在以上方法任一種的一些實施方式中,分配劑的步驟包括產生用于將劑輸送至組織接觸表面的超聲波。甚至更優選地,方法包括傳播超聲波穿過(through)劑載體至組織。這通過超聲促滲幫助遞送劑穿過組織。
在以上方法任一種的一些實施方式中,分配劑的步驟可以包括施加電壓越過(across)劑載體主體以引起劑輸送至組織接觸表面。電壓也可以提供通過離子電滲療法將劑輸送至組織中并且穿過組織。甚至更優選地,方法包括使電流傳播穿過劑載體至組織。
在本發明另一方面中,提供了從如本發明所述的劑載體、劑載體主體或劑施用器裝置分配劑的方法。方法包括將劑載體主體的組織接觸表面與組織表面接觸;以及從劑載體將劑分配至組織表面。分配劑的步驟優選地包括產生超聲波以引起或促進劑輸送至組織接觸表面。方法可以包括將超聲波施加至組織表面以非侵入性地引起或促進將劑通過超聲促滲劑滲透至組織中并且穿過組織。
方法進一步包括將超聲波穿過劑載體或劑載體主體傳播至組織。
在本發明另一方面中,提供了將劑裝載至如本發明所述的劑載體、劑載體主體、劑施用器裝置的任一個中的方法。方法包括將劑載體主體暴露于劑以能夠用所述劑填充儲存器或與所述儲存器流體連通的微通道兩者中的任一個。
方法可以包括將負壓施加至劑載體或劑載體主體以將劑吸至微通道或與微通道流體連通的劑儲存器中。方法可以包括將正壓施加至劑載體或劑載體主體以將劑注入至微通道或與微通道流體連通的劑儲存器中。
用劑填充微通道或劑儲存器的步驟可以包括將超聲能量施加至劑載體或劑載體主體以將劑吸至劑載體或劑載體主體中。
在一些實施方式中,當劑載體與劑接觸時,劑載體主體中的空隙和/或微通道憑借毛細作用力進行裝載。
在本發明另一方面中,提供了將劑遞送至生物組織的方法,其包括:利用本文所述方面或實施方式的任一個的劑載體、劑載體主體或施用器施加所述劑,其中超聲是輸送刺激;和配置應用的操作參數以增強或引起所述劑遞送至此組織內選定的深度。被配置的操作參數可包括(但不限于)以下的任一種或多種:
應用壓力;
超聲頻率;
超聲功率水平;
超聲波形;
超聲應用時間;
超聲應用占空因素(duty cycle);和
超聲方向。
優選地,選擇操作參數以將選擇的一定量劑遞送至組織內選擇的深度。方法可涉及將劑遞送至或越過以下組織或組織層的任一個或多個:
黏膜(mucous membrane);
上皮
上皮下膜(sub-epithelium)
黏膜(mucosa);
黏膜下層
黏膜維管結構
角膜;
角膜上皮
鮑曼氏膜
角膜基質
角膜內皮
結膜;
Tenon氏筋膜;
鞏膜外層;
鞏膜;
脈絡膜;
脈絡膜血管層;
布魯赫氏膜;
視網膜色素上皮;
神經視網膜;
視網膜血管;
內限膜;和
玻璃體。
如本文使用的,除了上下文另有要求,術語“包括(comprise)”和多種此類術語,諸如“包含(comprising)”、“包括(comprises)”和“包括(comprised)”不意圖排除其它事物、添加物、組分、整數或步驟。同樣,如本文所使用的,除了存在表達相反的詞,在詞語‘包括(include)’或‘諸如’或類似表達后指定任何事物不限制其它被包括的事物。
附圖說明
本發明進一步的方面和在前段落中所述方面的進一步實施方式通過以下描述、通過實例給出和參考附圖將會是顯而易見的。在附圖中:
圖1A顯示根據一個實施方式的被應用至組織表面的施用器裝置的示意性橫截面框圖,并且提供一個示例性施用器裝置的全部部件的說明。
圖1B顯示圖1A中所示實施方式的和先前在申請人的澳大利亞專利申請2013901606中所述的劑載體主體的更詳細的橫截面視圖。
圖1C顯示與圖1B的劑載體主體相似的包括超聲換能器的劑載體主體。
圖2提供施用器裝置的手柄組件的實施方式的橫截面框圖以及它的基本組成部分。
圖3是穿過采用一次性使用施用器末端的形式的、包括先前在申請人的澳大利亞專利申請2013901606中所述類型的劑載體主體的劑載體的橫截面視圖。如所要意識到的,如本文大體所述的,以及如圖8A至10或23至30A的任一個中所示例的任何劑載體主體可被用作替代選擇。
圖4A、4B、和4C提供具有不同微通道,和或先前在申請人的澳大利亞專利申請2013901606中所述的儲存器布置的單層劑載體主體的多個實施方式的說明。
圖4D提供單層劑載體主體的第一表面和組織接觸表面的實施方式的說明。
圖4E、4F、4G、和4H提供具有不同微通道和儲存器布置的多層劑載體主體的多個實施方式的說明。
圖4I提供劑載體主體的第一層的第一表面和第二表面,和劑載體主體的第二層的第一表面和組織接觸表面的圖4H中所示實施方式的說明。
圖4J提供劑載體主體的劑儲存器接觸層的進一步實例實施方式的說明,所述劑載體主體可以儲存額外的劑并在使用過程中其在耗盡劑時補充微通道。
圖5A、5B和5C提供劑載體主體的多個實施方式的說明,所述劑載體主體的每一個具有不同配置的表面接觸層。
圖5D提供延伸自圖5B和5C中所示的劑載體的微型突出物的兩個示例性類型的說明。
圖6提供具有堆疊的層布置和劑填充端口的劑載體主體的實施方式的說明。
圖7A和7B提供具有堆疊的層結構的劑載體主體中的孔和由孔限定的通道的實施方式的說明。
圖7C至7E提供由微制造工藝生產的孔和微通道的放大圖像。
圖8A和8B是根據本發明的方面的劑載體主體的替代實施方式的示意圖,并且分別示例了其平面圖和透視圖。
圖8C和8D是具有穿過其形成的微通道的劑載體主體層的替代實施方式的示意圖,并且分別示例了其平面圖和透視圖。
圖8E和8F是具有在其中形成的儲存器的劑載體主體層的替代實施方式的示意圖,并且分別示例了其平面圖和透視圖。
圖8G和8H是由圖8E和8F的劑載體主體層與圖8C和8D的劑載體主體層堆疊而形成的劑載體主體的示意圖,并且分別示例了未填充和填充配置的劑載體主體。
圖9A是圖8A至8H的任一個的劑載體主體的一部分的電子顯微照片。
圖9B是圖8A至8H的任一個的劑載體主體的單一突出物的電子顯微照片。
圖10示例一系列四個掩模設計,每一個都適合于形成本發明的實施方式中各自的劑載體主體(或其層)。
圖11A至11C提供其中在劑載體中于劑載體主體外部的位置提供劑儲存器的多個實施方式的說明。如將要意識到的,如本文大體所述的,以及如圖8A至10或23至30A的任一個中所示例的任何劑載體主體可以與此實施方式一起使用。
圖12A至12E示例可以在本發明的實施方式中使用的裝載(charging)或再裝載(recharging)方法的多個實施方式中的步驟。如將要意識到的,如本文大體所述的,以及如圖8A至10或23至30A的任一個中所示例的任何劑載體主體可與此實施方式一起使用。
圖13A和13B示例穿過根據一個實施方式的劑載體的分解圖和橫截面視圖。劑載體可以被用于運載如本文大體所述的,以及如圖8A至10或23至30A的任一個中所示例的任何劑載體主體。
圖14顯示用于評價唇遞送后24小時FPV-HIV-GFP疫苗的攝取的圖,說明由箭頭所指示的右上方象限中檢測到的包含疫苗的熒光GFP抗原的I-Ad APC MHC-II細胞。每個點代表一個細胞。
圖15示例用于評價唇遞送后24小時由不同樹突狀細胞亞群攝取的抗原募集至各自的引流淋巴結的圖。被確認為MHC-11+的樹突狀細胞和CD11b+(左邊兩列)或CD11c+(右邊兩列)的比例在右上方象限中(即箭頭)顯示。
圖16示例用于評價唇遞送后24小時在包含疫苗的熒光GFP抗原的宮頸淋巴結、縱膈淋巴結和腸系膜淋巴結I-Ad APC MHC-II細胞中FPV-HIV-GFP疫苗的攝取的圖,所述細胞在箭頭所指示的右上方象限中被檢測。
圖17包含共有所進行的實驗的以下階段的照片。所示例的階段包括:用即待給予的劑裝載微芯片(左上)、超聲系統設置(右上)和唇遞送至小鼠(下方照片)。
圖18示例能夠利用IFN-γ胞內染色評價HIV特異性脾CD8T細胞的量級的圖。利用細胞Quest Pro或FlowJo檢驗分析FACS數據。方框指出在唇/i.m.接種疫苗(上方3只小鼠)、i.n./i.m.接種疫苗(中間2只小鼠)和僅加強接種疫苗(下方3只小鼠)后表達IFN-γ的HIV特異性脾CD8T細胞的百分比。
圖19示例能夠利用四聚體染色評價HIV特異性脾CD8T細胞的圖。利用細胞Quest Pro或FlowJo檢驗分析FACS數據。方框指出在不同疫苗遞送途徑——唇/i.m.(上方三只小鼠)、i.n./i.m.(中間兩只小鼠)和僅加強(下方兩只小鼠)后HIV特異性脾CD8T細胞的百分比。
圖20顯示說明用圖10的四個不同微芯片觀察到的HIV特異性脾CD8T細胞應答的圖。數據表示通過四聚體染色測量的HIV特異性CD8T細胞數目(數據表示來自每個組的一只小鼠)。
圖21示例能夠利用四聚體染色評價HIV特異性脾CD8T細胞應答的圖。利用細胞quest Pro軟件分析FACS數據。圖表示每組三個動物微芯片1(上方)&2(中間)相對于口服遞送(下方)的初免-加強(prime-boost)免疫數據。右上象限(箭頭)指示在每種疫苗策略后觀察到的HIV特異性CD8T細胞的%。
圖22示例能夠利用IFN-γ細胞內細胞因子染色評價HIV特異性CD8T細胞應答的量級的圖。利用細胞quest Pro軟件分析FACS數據。圖表示每組三個動物微芯片1(上方)&2(中間)相對于口服遞送(下方)的初免-加強免疫數據。右上象限(紅色箭頭)指示表達IFN-γ的HIV特異性CD8T細胞的%。
圖23示例用于生產各種劑載體主體(或其層)的一系列掩模設計。
圖24至28示例各種實施方式的劑載體主體和其區域的一系列電子顯微照片。
圖29至30A圖解地示例根據本發明的實施方式的兩種混合劑載體主體。
圖31A至31D示例在可與本發明的實施方式一起使用的具有不同末端的五種類型的施用器的操作過程中的位移(nm)和速率(m/s)的圖。
圖32示例當在一定范圍的驅動電壓上以選定的頻率驅動時MP4和AMO1施用器的末端位移。
具體實施方式
在以下說明書中,出于解釋的目的,提出多個具體細節以便提供本發明的透徹理解。但是,顯而易見地,本發明可在沒有這些具體細節的情況下實踐。在其它情況下,熟知的結構和裝置以框圖形式顯示,以便避免不必要的掩蓋。
本說明書遵循以下大綱:
1.綜述
2.總則和微通道實施方式
3.基于突出物的實施方式
4.混合和替代實施方式
5.裝載和應用實例
6.試驗結果
7.參考文獻
1.綜述
本實施方式的背景
在不利用皮下注射、攝食(ingestion)或外科手術的情況下,將藥物——包括大于約500道爾頓的大分子和親水藥物——遞送至身體長期以來一直是醫學上的期望目標。
為了獲得這個(“藥物遞送裝置”),大量利用各種技術的藥物遞送裝置已被開發,但是還不能夠將廣泛的藥物以安全、實用、可預見和有效的方式非侵入性地遞送至身體。有史以來,經皮給藥途徑一直是非侵入性藥物遞送應用的主要焦點。
非攝食地將藥物遞送至身體的優點包括繞過由胃腸道的酸性和或堿性區域和胃腸道中的酶導致的藥物降解和避免其由肝酶導致的新陳代謝,以及去除了藥物的消化不良副作用。非皮下注射地將大分子或親水藥物遞送至身體的優點包括降低或消除疼痛、局部創傷和副作用,增加患者依從性,和減少針污染、疾病傳播和針誤用的發生率。非需要引入植入的裝置的外科手術地將藥物遞送至身體具有優點,包括減少或消除疼痛、局部創傷和副作用以及消除任何麻醉風險。
藥物遞送裝置可被應用于皮膚用于靶向應用和作為系統性藥物遞送的入口兩者。經皮輸送親水分子和/或大于約500道爾頓的分子的主要屏障是上皮的最外層——角質層,其厚度一般為10–20μm。角質層是非存活細胞層,其由高度交聯的嵌入在皮膚脂質連續基質中的角化細胞構成。藥物遞送裝置需要克服這些天然半滲透屏障來遞送藥物。用于皮膚的藥物遞送裝置通常使用微針和/或離子電滲療法作為向此類組織遞送藥物的主要手段。
藥物遞送裝置的另一個應用部位(不常用作系統性藥物遞送的入口)是黏膜。跨黏膜輸送親水分子和大分子的主要屏障是上皮層。用于跨黏膜遞送的藥物遞送裝置通常使用鼻噴入法、吸入劑和/或離子電滲療法作為遞送藥物的主要手段。
以下技術(單獨或任意組合的)目前被應用于藥物遞送裝置中:
離子電滲療法
利用被稱為離子電滲療法的方法將劑遞送至身體的藥物遞送裝置通過產生施加電極而產生的電流而操作,所述電極生成并且維持裝置和靶組織之間的電位差。待遞送的藥物的離子形式以電流被輸送并且從而實現進入靶組織。利用離子電滲療法將劑遞送至身體的裝置通常具有包含其中浸潤裝置內的電極的流體的藥物連續層。應用時間趨向于很長,在多種情況下為數小時。
可以利用離子電滲療法遞送至身體的劑必需是親水的并且具有電荷。離子電滲療法不能遞送中性分子和/或顆粒——包括大的蛋白質和疫苗。
微針
微針是用于刺穿組織的一個或多個層的分立式突出物。根據它們的應用,微針可以是部分或全部空心或實心的。用于藥物遞送裝置中的微針通常充當:1)當與一定的外部刺激結合時可以增加組織內滲透性的結構;2)并入了溶解至組織中的劑的結構;3)用于將劑注射至組織中的空心導管;和/或4)設計以刮去表面組織或暴露內部組織的結構。微針通常用粘合劑并入至應用于皮膚的膜片(patch)中或機械地接合。微針也可包含增強劑滲透穿過組織的化合物,或在用滲透促進劑化合物預處理后施加至組織。
超聲促滲(sonophoresis)
利用被稱為超聲促滲的方法將劑遞送至身體的藥物遞送裝置通過對組織應用超聲而操作,所述超聲增加了組織的滲透性并且向劑提供了動能。通過超聲增加組織的滲透性產生于大量的包括以下任意一個或多個的現象:1)由氣泡的產生和振動而產生的氣穴現象;2)來自傳遞性輸送誘導引起的溫度增加的熱效應;或3)由于由超聲誘發的壓力變化的應力產生的機械效應。已經發現對于超聲促滲而言低頻超聲——一般在20-200kHz的范圍內,但優選地在100kHz以下——比較高頻的超聲更有效。超聲促滲輸送穿過皮膚的主要方法需要足以產生氣穴現象的能量。
利用超聲促滲將劑遞送至身體的藥物遞送裝置通常具有包含其中浸潤超聲源或緊鄰布置的劑的流體層。這些裝置有時也包括各種類型的微針,其中微針被浸在此類流體中。在各個前述裝置中,由于流體比固體材料使超聲的能量衰減更多,并且超聲作用于其上的流體的體積相對于其中或其周圍的固體結構是大的,所以超聲能量在波陣面到達組織表面時被相當大地衰減。此超聲波陣面被部分地從組織表面反射回至流體層中,其進一步擾亂了超聲的效率,導致需要施加更多能量至該流體。這些技術具有一些潛在的缺點,諸如,依據功率值施加至組織的超聲可以引起由氣穴現象和熱效應導致的局部損傷。來自超聲能量的損傷組織的閥值取決于多個因素,包括組織的類型、組織的厚度、組織的健康狀況和組織是否完好無損的。例如,相比于眼睛上的黏膜,皮膚能夠耐受更大的施加于其的超聲能量。另外,根據功率值,施加至劑的超聲可引起劑或其中的分子斷裂或變性,或以其它方式被氣穴現象、熱效應或機械效應損害。已知對超聲氣穴現象、機械力或高于40攝氏度的溫度具有低耐受性的劑包括疫苗、蛋白質和其它生物劑。
實施方式的綜述
總而言之,本發明的優選實施方式利用低功率的低頻超聲來輸送劑——其包含在其中具有微型結構的劑載體主體內,用于非侵入性地將劑遞送至組織。
如將意識到的,超聲將在一種或多種頻帶上或在具有數個帶的頻譜上應用。優選地,帶(一個或多個)對應于包括劑載體主體的施用器裝置的共振頻率,和任選地一個或多個共振頻率的諧波。在本發明的一些形式中,應用的超聲具有低頻率,在20kHz至100kHz之間,最優選地超聲能量的頻率是在20kHz和40kHz之間。其特別優選地用于黏膜、眼睛和其它精細組織。但是,在其它實施方式中,施用器裝置可具有低于此的共振頻率,并且本文描述的裝置可用劑載體主體的末端上的大約10kHz的初級共振頻率進行操作。在測試中,適合用于本發明的實施方式的施用器已經以下面頻帶中的任意一個或多個的頻率進行操作:集中在或約10kHz;20kHz、22kHz、28kHz、28.19kHz、和38kHz的帶和/或20-25kHz、25-30kHz、38-40kHz、40-45kHz、40至60kHz、40-80kHz、140-160kHz的頻率帶。
對于其它組織,諸如皮膚,超聲頻率可在這些范圍之外。
在本發明的優選的形式中,使用的超聲能量相對低,一般在0.05至3.5Wcm-2的范圍內。在一些應用中,可需要更高強度的超聲能量。在這些情況中,可能需要脈沖或以其它方式控制超聲能量的占空因素以阻止組織損壞(例如由于熱效應)和/或阻止對劑的破壞。
應用于施用器的超聲能量引起組織接觸表面的往復運動。在典型的實施方式中,組織接觸表面與其平均位置的位移可在約100nm和2200nm之間。實施方式可在位移大于200nm的情況下操作。實施方式可在位移小于2100nm的情況下操作。實施方式可在位移大于400nm的情況下操作。實驗中使用的實施方式在位移小于500nm,以及更具體地小于400nm,的情況下操作。
圖31A示例在具有兩個類型的末端組件的兩個類型的施用器(MP1和MP4)(例如劑載體“末端組件1”和“末端組件2”)在0和200kHz之間的頻率范圍的操作期間的位移(nm)和速率(m/s)的圖。
圖31B示例在可用于根據實施方式的施用器中、不具有末端組件的三個類型的手柄單元:AMO1(型號Sov37706);AMO2(型號Sov39302)和ALCON1(型號Turbo Sonic-375)(例如劑載體)在0和200kHz之間的頻率范圍的操作期間的位移(nm)和速率(m/s)的圖。
圖31C示例在具有第二類型的末端組件的三個手柄單元AMO1;AMO2和ALCON1(例如劑載體)在0和200kHz之間的頻率范圍操作期間的位移(nm)和速率(m/s)的圖。
圖31D示例在具有第三類型的末端組件的三個類型的施用器AMO1;AMO2和ALCON1(例如劑載體)在0和200kHz之間的頻率范圍的操作期間的位移(nm)和速率(m/s)的圖。
圖32示例當在一定范圍的驅動電壓上以選定的頻率驅動時MP4和AMO1施用器的末端位移。在50至400V之間的峰至峰輸入電壓的范圍上以22kH z通過RF放大器驅動MP4系統。在相同的電壓范圍以28.19kHz驅動AMO1。
利用來自德國Polytec儀器的激光多普勒振動儀模型MSA400進行裝置的研究。
可見,通過選擇操作的頻率(或頻帶),期望的振動參數可被選擇。這些參數將根據所使用的特定劑載體而改變。在優選的實施方式中,這些裝置將以對應如圖中所示的運動中的一個或多個峰的頻帶進行操作。
在典型的實施方式中,組織接觸表面的運動速率可在約0.01m/s和0.4m/s之間。實施方式可以大于0.03m/s的速率操作。實施方式可以小于0.36m/s的速率操作。實施方式可以大于0.06m/s的速率操作。實驗中所用的實施方式在位移小于0.05m/s的情況下操作。
本發明的實施方式可有利地被用于將劑遞送至精細組織,諸如黏膜(包括結膜、口腔黏膜和唇黏膜)、角膜和外眼皮。
實施方式中的超聲能量和/或頻率參數可被增加或減少——由于多種原因,包括控制劑滲透至組織中的深度。舉例而言,與用于遞送劑至位于上皮表面下方的富血管毛細血管床和更深的結締組織層的能量和/或頻率參數相比,用于遞送劑至黏膜的上皮表面細胞的超聲能量和/或頻率參數可以更低。
想要的是,劑載體主體不穿透組織表面的任何層。雖然在利用本發明實施方式時可能發生一些表面細胞損傷,但是其并不是意圖和不是被依賴以便實現將劑遞送至靶組織。盡可能保持完好無損的組織表面可用于更精確地控制劑滲透至組織層中的深度。
本文描述的劑載體主體內的各種微型結構,在其它事物中,其目的是在劑載體主體和組織表面之間進行直接接觸以傳播超聲能量,從而最小化劑載體主體內以及劑載體主體和靶組織之間的任何連續層流體的程度(extent)(其傾向于使超聲波衰減)。
申請人的澳大利亞專利申請2013901606中第一次描述的一組實施方式包括具有形成多個被剛性壁圍繞的、用于遞送各種劑的微通道的微結構的劑載體主體。當橫向測量遞送方向時微通道一般橫跨約25至100μm的范圍、可具有約0.5mm至2mm之間的長度。可以使用任意合適的橫截面和/或縱向幾何結構。
在使用中,每個通道在通道內的流體柱中包含劑并且超聲能量被直接應用于各個流體柱和圍繞流體柱的壁。產生的超聲波本質上是縱向的,即,其沿著通道傳播。在一些實施方式中,通過利用微米級結構的微結構,沖擊流體柱的波陣面被集中在各個微通道內,因此減少了超聲的衰減。通過裝置(并且最優選地劑載體主體)與組織表面的直接接觸以便不允許它們之間的流體空間存在,而使超聲波在組織表面的反射最小化。這在超聲的影響下進一步協助分子沿著超聲波陣面前進路徑有效地向靶組織移動。在劑載體主體中(并且具體地是在限定微通道的壁中)同樣實施超聲波。由于其不會如流體那么大的衰減超聲能量,所以它們有效地將超聲促滲力直接傳輸至靶組織。
在優選的實施方式中,裝置的組織接觸表面不通過流體連續層而與組織分開。劑載體主體的組織接觸表面存在具有固體主體和流體劑的面積的表面(即微通道的開口),在一些實施方式中,近似于固體-流體“棋盤”樣陣列。此布置可促進裝置的超聲促滲能力——因為固體壁的表面直接接觸組織。在此實施方式中,裝置結構可被概念化為大量單獨的緊密擠滿并連接在一起的微米級超聲促滲遞送裝置。
另一組新實施方式包括由微米級突出物形成的多個微型結構,其一起限定劑載體主體的組織接觸表面。這些突出物接觸靶組織和圍繞其的待遞送劑。在優選的形式中,劑載體主體具有外圍結構(典型地壁),其圍繞突出物并且在使用時容納劑。相對于由微通道構成的劑載體主體,此實施方式在劑載體主體內具有的微結構與流體的比例較低。優選地,這些實施方式維持超聲源和靶組織之間通過突出物(以及也可能是外圍結構)的直接接觸。縱向上定向的超聲波在突出物和流體之間進行傳導。突出物的作用是促進藥物向靶組織的輸送。來自突出物之間的臨近空間中的流體的波形干擾由于突出物的存在而降到最低,其至少起到阻止波形傳播的作用。
另一組新實施方式存在混合裝置,具有至少一個具有多種微米級突出物的區域和至少一個具有由剛性壁圍繞的微通道的其它區域。典型地,具有由剛性壁圍繞的微通道的一個區域或多個區域將形成接連(bounding)具有微米級突出物的區域的外圍結構的部分。
發明者已知的可以利用超聲促滲遞送至身體的分子包括1)具有任意種類的電荷或具有中性(包括整體中性)電荷的分子和2)小分子或大分子(包括約150,000道爾頓的單克隆抗體)和3)親水或疏水或親脂性分子。
發明的各個方面的數個示例性實施方式參考用于通過輸送模式(優選地其僅利用超聲波)將劑非侵入性地遞送至靶組織表面部位的示例性施用器裝置進行描述。在這些示例性實施方式中,在靶組織表面部位,將劑滲透至靶組織表面部位中能夠通過超聲促滲機構實現或通過超聲促滲機構增強。優選地,靶組織表面部位是黏膜,其包括但不限于,結膜、陰道、尿道、內耳、氣管和支氣管黏膜、直腸、口腔、和鼻組織。靶組織表面也可以包括角膜。2.總則和微通道實施方式
系統包括優選地是手持式和用于將劑遞送至靶組織的施用器裝置。施用器裝置的優選形式包括耦接至施用器末端的手柄。施用器末端包括具有在其中形成的微通道的劑載體主體,通過所述微通道劑被從施用器末端內遞送至靶組織表面。劑載體主體可被集成于施用器末端內,或可為可附接至施用器末端的單獨組件(諸如盒)。
施用器末端可包括容納劑的儲存器。儲存器可形成劑載體主體的部件,或可以是與劑載體主體流體連通的單獨組件。
形成手柄或施用器末端的部分的超聲換能器產生超聲能量(波),其使劑移動通過劑載體主體中的微通道、穿過在劑載體主體的組織接觸表面處的微通道端孔外出并到靶組織表面上。超聲波同樣通過超聲促滲增強和/或允許劑攝取至靶組織中。
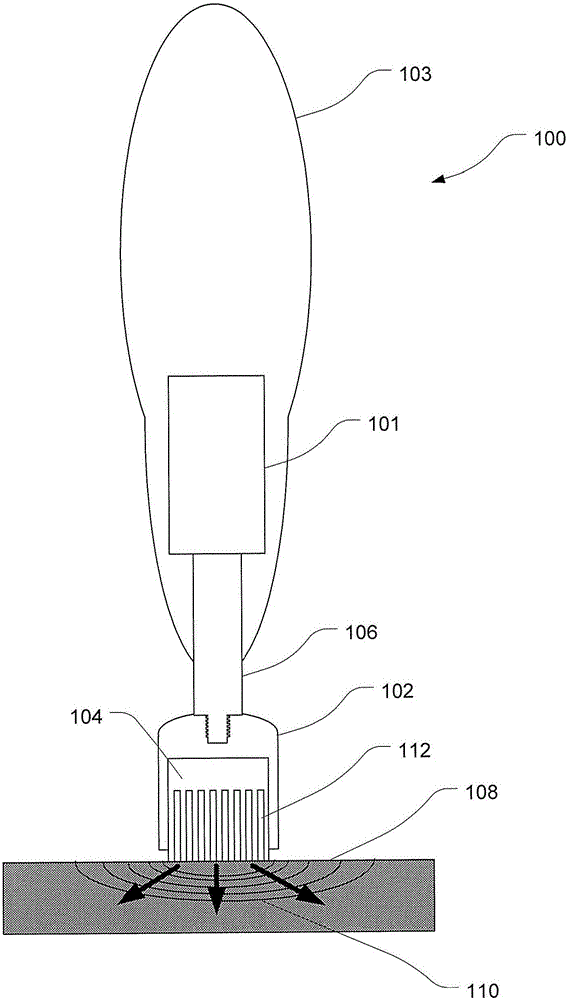
圖1A是示例可與本文描述的任何劑載體或劑載體主體一起使用的根據本發明的施用器裝置的第一實施方式的高度示意圖。在這個實例中,施用器裝置100包括耦接至施用器手柄103的施用器末端102(全部裝置未示出)。施用器手柄103包括超聲發生器101。施用器末端102被連接至手柄103以便超聲能量通過耦接桿106從換能器101傳送至施用器末端。如將會意識到的,超聲的應用通常會根據以上綜述中所列舉的參數。施用器末端102的組織接觸表面與靶組織表面108接觸。超聲發生器被隨后激活,其導致超聲波110通過耦接桿106穿過施用器末端102和劑載體主體104傳播并且進入到靶組織108中。在此實施方式中,劑被儲存在劑載體主體104中并且通過已裝配在劑載體主體104內的微通道112被輸送至靶組織表面108。超聲波輔助劑通過微通道112從劑載體主體104輸送至靶組織表面108。超聲波同樣通過超聲促滲對組織超微結構的作用增強和/或允許劑滲透至靶組織108中。
在這個實例中,劑載體主體104可為本文廣泛描述的和如圖8A至10或23至30A的任一個中所例證的任何類型。但是,為了示例劑載體主體的操作原理,圖1B提供了先前在申請人的澳大利亞專利申請2013901606中所述的類型、應用于組織表面108的1A的劑載體主體104的更詳細的視圖。劑載體主體104具有組織接觸表面114。在這個實例中,其包括有裝配在劑載體主體104內的從劑載體主體104的內部內延伸到組織接觸表面114的微通道112。微通道112在組織接觸表面114終止于孔116。劑被從劑載體主體104、通過通道112提供,其中劑通過組織接觸表面114中的孔116外出,并至組織表面108上。作為替代選項,劑載體主體104可為本文一般描述的以及如圖8A至10或23至30A的任一個中所例證的任何類型。
在這個實例中,超聲110被產生并且通過劑載體主體104傳導。這使儲存在通道112內的劑118從通道112釋放并且到組織表面108上。劑滲透至組織108中通過超聲的使用而被增強和/或允許,所述超聲提供了對組織的超聲促滲作用。
在圖1A的實施方式中,施用器手柄103具有超聲換能器101,其產生通過耦接桿106傳輸穿過施用器末端102至劑載體主體104的超聲波110。但是,在可選的實施方式中,施用器末端102可以被裝配以包括在其結構內——能夠自身產生超聲波而不需要外部超聲換能器的系統。圖1C示例其中劑載體主體104額外包括超聲換能器124的可選實施方式。
優選地,通道112的內表面(一個或多個)被功能化。通道112的內表面113可用具有疏水或親水性質或兩個部分的組合的化合物或分子進行功能化。可選地,通道112的表面113可通過將通道的表面與被吸附至通道表面的小分子接觸被功能化,暴露具有期望物理和/或化學性質的特定官能團。小分子可通過化學吸附作用或物理吸附作用被吸附至通道的內表面。可選地,或除了改變水/油親和力,微通道和/或劑儲存器的內表面可通過使它們變得導電而被功能化。
圖2提供施用器裝置的手柄組件200的實施方式的示例,其可與本文一般描述的、以及如圖8A至10或23至30A的任一個中所例證的任何類型的劑載體主體一起使用的。手柄組件200包括主外殼202,其包括超聲換能器204。換能器通過電池206(或可選地通過外部電源)供電并且被配置以產生超聲波并將它們傳送至終止于連接器210中的耦接桿208。連接器210可以為任何類型諸如螺紋或卡扣式組裝件或類似物,其使手柄組件200能夠與劑載體接合(通過直接或間接接合)。
圖3是可與圖2的手柄組件200一起使用的施用器末端300的橫截面示意圖。施用器末端300包括具有第一端302和第二端303的外殼301。第一端302包括安裝機構305諸如卡扣式組裝件或螺紋或類似物,其使之與手柄組件200的連接器210機械地連接。施用器末端300在其第二端303上進一步包括凹槽304,其被布置以接收劑載體主體104或本文一般描述的、以及如圖8A至10或23至30A的任一個中所例證的任何類型的劑載體主體。在使用中,施用器末端300被配置以通過應用超聲波將劑運載至劑載體主體104的組織接觸表面306并且按需將其遞送至正在被治療的組織。在一些實施方式中,施用器末端300可以包括劑儲存器,其可與劑載體主體104中形成的微通道流體地接觸。
圖4A、4B、4C、和4D提供單層劑載體主體的各種實施方式的示例,并且圖4E、4F、4G、4H提供其中劑載體主體由堆疊的劑載體層產生的各種實施方式的示例。
劑載體主體400由固體材料的層(一個或多個)形成并且具有可為各種幾何形狀和尺寸的若干或網絡狀的微通道。這些微通道可以被用于儲存或保持劑并且也可用于從劑載體主體400內將劑遞送至劑載體主體400的組織接觸表面406。微通道可以通過微加工技術而產生。舉例而言,在其中劑載體主體400由硅形成的實施方式中,微通道可以通過石印、蝕刻和/或其它方法而形成。在由金屬、塑料或聚合物制備的實施方式中,微通道可以通過其它技術產生,包括利用各種類型和波長的激光以及鑄造和擠出技術。這些微加工技術的使用是尤其可取的——因為它們提供保持劑體積精確度的優點、可預見的微流體的益處以及進一步允許改良諸如針對暴露的組織接觸表面和內襯劑載體主體400的微米級腔402的內壁的任一個或兩者的特別表面化學處理。這些益處可以被用于,諸如,進一步增強劑裝載、保持和遞送至靶組織。
組織接觸表面406具有一系列開口、開窗(fenestrations)或孔404。多種形狀和尺寸的孔可以在大約10至100μm,但其它實施方式可具有的孔尺寸大至1000μm。微通道402自組織接觸表面406中的孔404延伸至少部分地穿過劑載體主體400。微通道402可以被用于保持劑和將劑輸送至組織表面。
孔404可具有圖案外觀并呈現一系列的幾何圖形,諸如:密堆積六角結構、具有各種密度的陣列正方形、混合多邊形馬賽克、螺旋、線等。想要的幾何圖形被物理地蝕刻至劑載體主體400中以便產生用于保持和/或輸送劑的微通道402的陣列。微通道可為多種形狀諸如圓柱形、錐形等。
劑載體主體400內的微通道402的壁和/或其它內表面可被處理以便:它們具有可為性質上彼此相同或相反的親水或疏水特性和/或組織接觸表面406的孔404之間的面積。劑載體主體400內的微通道402的壁和/或其它內表面可被處理以便它們傳導電荷或可以產生局部電場——其可具有彼此相同或相反的極性——和/或組織接觸表面406的孔404之間的面積。
劑載體主體400可以由一整塊材料形成。但是,在可選實施方式中,劑載體主體可包括堆疊的多個層。利用微加工固體材料作為單一層或多層以產生允許改進的聲波傳輸的劑載體主體并且因此通過超聲改進地將劑遞送至靶組織部位。
劑載體主體404內的微通道402和/或其它內表面的尺寸和內襯特性,和包含劑載體的層的尺寸和數目將被定制以適合于劑和靶組織,并且將隨著劑性質、劑量和配方要求、超聲能量和熱產生、以及使用持續時間的結果而變化。
圖4B顯示與圖4A的實施方式相似的另一個實施方式——除了微通道402’通過內部連接通道408而互相連接。除了通道402’此結構還提供一些劑儲存水平。
圖4C表示進一步的實施方式,其中單層劑載體主體400”具有微通道402”,其在微通道402”的一端作為孔404”終止于組織接觸表面406”中,并且在其另一端連接至劑儲存器410。
圖4D提供圖4A至4C的任一個中所示的單層劑載體主體的表面視圖。劑載體主體400”具有第一表面411和第二表面412,所述第二表面412為組織接觸表面。如上所述,微通道從劑載體主體400內(延伸自儲存器410或連接通道408,如果存在)延伸并且作為孔404終止于組織接觸表面412中。
在可選的實施方式中,劑載體主體具有堆疊的層結構并且包括至少兩層。更優選地,在應用于正在被治療的組織之前,一個或多個層具有在其內形成并且與用于容納劑的微通道流體連通的額外的微儲存器體積。微儲存器體積可為單一體積或多個小體積,例如每個所述微儲存器體積與一個或一組微通道相連(contiguous)。離組織接觸層最遠的層中可存在單一大儲存器體積,其與通道流體地連接。可選地,可存在多個微儲存器體積,并且每個微儲存器體積流體連通。
圖4E、4F、和4G分別對應于圖4A、4B、和4C——除了劑載體主體413包括第一層414、414’、414”和第二層416、416’、416”。相對于圖4A、4B、和4C單一層實施方式,第一層414、414’、414”被一般地描述——除了不具有組織接觸表面422,當層被堆疊在一起時,第一層具有包括限定延伸穿過第一和第二層的微通道的部分的孔或盲孔的界面表面415。第二層416、416’、416”包括接觸第一層414、414’、414”的界面表面415的第一表面420和具有由微通道424形成的孔426的組織接觸表面422。可見,微通道424延伸自第一層內;穿過第二層416、416’、416”;并且作為孔426終止在第二層416、416’、416”的組織接觸表面422。以此方式,第一層414、414’、414”和第二層416、416’、416”中的孔被對齊以形成微通道424,以便第一層414、414’、414”和第二層416、416’、416”被連接而允許系統中的流體連續性。
圖4H示例雙堆疊層劑載體主體413的進一步替代實施方式,其中第一層414”’包含開放式劑儲存器425,其直接提供劑至第二層416”’的微通道中。
圖4I提供圖4H中所示的雙層劑413”載體的各個層的表面視圖。第一層414”具有第一表面430和第二表面432。第二層416”具有第一表面和第二表面(其相同并總體如434所示)。劑儲存器425由第一層414”中形成的部分地延伸至其中的凹槽形成。第一層414”的第二表面432被對齊并且被安置在第二層416”的界面表面上,以便大體上第二層中形成的所有微通道424與第一層414”中的劑儲存器425流體地連接。
圖4J提供劑載體主體中形成的劑儲存器的進一步實施方式的示例,在使用過程中所述劑儲存器可以儲存額外的劑并且在它們耗盡劑時補充微通道。儲存器可連接至如諸如圖4G中所示的相同劑載體主體層中的微通道或連接至如諸如圖4H中所示的劑載體主體中的連續層中的微通道。劑載體主體438包括由兩個圓環形的儲存器體積440和442形成的儲存器并且包括延伸穿過端口446的導管444。當真空被施加至端口446,或端口446被用劑注入時,負壓或正壓分別被施加于儲存器440、442。此類型的層以疊層布置以形成劑載體主體,第一層覆在其相鄰層上以便相鄰層中的任何孔流體地連接至儲存器體積以允許劑通過微通道行進穿過該層并且至組織接觸表面。
劑載體主體448是另一個實施方式,其中儲存器由若干彼此均流體地連接的同心環組成。應該理解,層內劑儲存器體積的其它布置是可能的而不脫離本發明。
通常,劑載體主體的較低或中間層中的孔延伸穿過該層的整個厚度并且隨后流體連接地與其它層中的孔結合,形成延伸自劑載體的表面接觸層中的組織接觸表面的微通道。應該理解,在某些情況下,孔僅中途地(pathway)延伸至特定層中;這可以是如諸如圖4E–4G中所示的第一層的情況。
如之前所述,優選地,微通道的內表面(一個或多個)和劑載體諸如那些劑儲存器的其它內表面可被功能化。
在圖5A、5B和5C中所示的實施方式中,劑載體主體包括六層,其包括在彼此覆蓋表面接觸層的頂部上堆疊的表面組織接觸層和5個層。
圖5A顯示具有六個堆疊層501.1、501.2、501.3、501.4、501.5、501.6的劑載體主體500的實施方式。劑載體主體的第一端是在層501.6上的接觸正在被治療的組織的表面組織接觸表面502。此層的頂部上存在多個另外的層以及最頂層501.1。在此實施方式中,用于容納和遞送劑(未顯示)的劑儲存器和微通道可延伸穿過劑載體500的一些或所有的層501.1-501.6。在一些實施方式中,通道從層501.6中的組織接觸表面502延伸,穿過中間層501.5至501.2,并且在最頂層501.1中終止。
圖5B顯示圖5A中所示的實施方式的可選實施方式——六堆疊層劑載體主體505。在此實施方式中,表面組織接觸層501.6包括若干微型突出物506,其在此實例中是微型管。圖5C顯示進一步可選的劑載體主體510,其具有相似的整體布置但其中微型突出物506’是微針。微型突出物是空心的,并且包括在其中形成的通道,所述通道形成用于遞送劑小通道系統的部分。
微突出物諸如微針和微型管可以通過由蝕刻組織接觸層501.6的組織接觸表面502組成的二次加工產生,以便孔之間的面積大部分被移除。這使圍繞所需突出物的每個孔的壁圍繞每個孔。微針和微型管可以為任意想要的形狀。諸如,圖5D顯示微型突出物為具有圓柱形形狀(微型管510)和其它微型突出物為具有截頭圓錐形狀(微針508)。在其它實施方式中(未示出),表面502組織接觸層501.6可被提供有其它表面處理,或表面接合結構,諸如鋸齒狀結構、漣漪、環或類似物,以幫助劑載體主體與靶組織接合(interface)。
在優選的實施方式中,每個層的形狀是圓盤形或圓柱形。優選地,層的厚度為約0.3mm至約1.0mm,和甚至更優選地,每個層的厚度為約0.5mm。優選地,每個層的直徑為約3mm至約10mm,和甚至更優選地,直徑為約5mm。厚度尺寸和直徑尺寸可在層之間變化。雖然劑載體主體的層和整體形狀已在圖3中被描述為圓盤形或圓柱形的橫截面形狀,但是其它形狀可以在不脫離本發明范圍的情況下使用,例如矩形、正方形、或其它多邊形、卵形等。另外,雖然優選地,劑載體主體的整體形狀為恒定的橫截面,但是劑載體主體的整體形狀可以隨其長度而改變,例如,劑載體主體可以被塑形為平截頭體(不論圓錐形或其它錐體),或棱柱等。整體形狀和/或劑載體和劑載體主體的組件的形狀可以被改變以便使裝置的效率最大化——其取決于輸送形式或所利用的輸送形式的組合。
圖6提供具有帶有堆疊布置的劑載體主體601的劑載體600的示例。堆疊包括最底層602、四個中間層604、最頂層606。最底層602具有延伸以形成組織接觸表面610的微型管608。劑載體600額外包括端口612。在此實施方式中,端口612是第一層606的部分。端口612與劑載體主體601中形成的微通道連接——優選地通過第一層606中的劑儲存器體積,以便流體可以在其之間流動。端口612被配置以連接至真空線或壓力注射器,以便負壓或正壓可以分別被應用至端口612。這允許劑從外部源裝載至劑載體中。在將真空應用于端口612時,劑通過組織接觸表面610中的微型管中的孔,穿過微通道被吸至劑載體主體601的疊層中,以填充微通道和儲存器體積。可選地,劑可以通過端口612被注入至劑載體中。利用任一方法,劑載體可以用劑填充。
圖6也顯示應用于端口612的閉合或密封614,和應用在表面接觸層610上的閉合或密封616。密封616將表面接觸層610的表面密封以維持無菌性和微通道內產生的任何真空。類似地,針對相似的目的,密封614將端口612密封。優選地,此密封層是塑料膜。
圖6的實施方式也包括附加層618和超聲換能器620。層618可為簡易隔離層,其用于覆蓋頂層中的開窗(如果微通道全程地延伸穿過頂層)以防止流體外出和/或防止釋放所包含的真空。
輸送形式可利用電場來輸送帶電的劑。利用施用器裝置中的內部電池或通過外部電源通過將電壓施加至劑載體中的電極可以提供電場。在優選的形式中,電極位于在施用器裝置內,同樣連接至施用器裝置電源的第二外部電極可以以這樣的方式定位:靶組織有效地成為極性與內部電極的極性相反的電極。電極的極性可以被選擇以便內部電極具有與劑上的電荷相同的極性。兩個電極之間建立的電壓將帶電的劑輸送穿過劑載體至組織接觸表面,并且通過離子電滲療法可以增強和/或允許將帶電劑輸送至組織中。本發明的實施方式可以利用交替地或同時地組合使用的超聲波和電流的多重遞送形式。因此,層618可以被額外修飾以包括,或可選地為,充當電極的材料。電極可以帶正電荷或負電荷并被用于產生靜態或動態電場。在其中鄰近劑載體層的頂部表面不具有孔并且鄰近劑載體層由不導電材料制成的情況下,電極和包含在微通道或儲存器內的離子或帶電劑之間不直接接觸,但是,具有與電極上存在的極性相同的極性的離子和帶電劑將被排斥。如果鄰近劑載體層由導電材料制成并且鄰近劑載體層不具有孔,則存在包含在微通道或儲存器內的離子或帶電劑所建立的電導率。此方案在功能上等價于其中鄰近劑載體層的表面具有孔(并且不取決于鄰近劑載體層的導電性)和電極與包含在微通道或儲存器內的離子或帶電劑直接接觸的情況,其中極性與層618相反的另外的電極可以被安置在靶組織上或鄰近安置于靶組織。為了完成電路,被安置在靶組織上或鄰近安置于靶組織的電極可與劑載體;施用器手柄;或應用裝置的其它組件(未顯示)連接。所施加的電壓可以提供這樣的能量,其是使帶電劑具有與層618的電極相同的極性以在包含于劑載體主體601的微通道的流體中流動從而遷移穿過劑載體、從孔出來至組織表面以通過離子電滲療法被遞送至組織中所需要的。
這提供了可選的實施方式,憑借其劑載體能夠產生電壓以促進電流流動以輸送帶電劑穿過劑載體并且從孔出來至組織。
在一些實施方式中,劑載體主體包括(如同層618),或本身為電極,以促進將帶電劑輸送穿過劑載體并且從孔出來至靶組織。電極可鄰近地位于疊層,或可為在疊層內集成的電極層(如同層618)。
在以上實施方式中,超聲能量和/或電壓提供將劑移動穿過劑載體至其組織接觸表面所需要的能量,其中超聲促滲和/或離子電滲療法能夠使劑被遞送至靶組織中。
如將會意識到的,在以上實施方式中,包括組織接觸表面例如422、422’、422”、502、610的層可以為包括由多個突出物(諸如圖8A至10和23至28的任一項中所述的突出物)至少部分地限定的組織接觸表面的層。
圖7A和7B提供形成根據本發明的實施方式的劑載體主體的疊層中的孔和由孔限定的通道的實施方式的示例。圖7A提供包括兩層——702和704——的疊層700的示例。層702是比層704離組織接觸表面更遠的層。層702包括多個孔706;層704包括多個孔,其被布置為孔708集群。這些層704、702彼此臨近地布置在疊層700中,以便層704中每個孔708集群與層702中的孔706對齊。相比于層702中的孔,層704中的孔更多且更小。在裝置裝配期間為了促進層對齊,每個層702、704可以被提供有限定層的對齊的基準點或結構707、707’。隨后,層可以用所布置的其各自的基準點707、707’以預定的方式(例如彼此對齊)進行對齊,以實現各自層702、704中的孔的正確對齊,從而形成延伸穿過疊層700的多個層的微通道。
圖7B提供劑載體主體的不同疊層中的不同尺寸的孔之間的變化和對齊的進一步示例。孔706’是孔706的放大版本。孔706’覆蓋下一鄰近疊層中的孔708的第一集群(虛線中所示)。孔708’是孔708的放大版本。孔708’覆蓋下一鄰近疊層中孔710的對應集群(虛線中所示)。類似地,孔710’是孔710的放大版本。孔710’覆蓋下一鄰近疊層中的孔712的對應集群(虛線中所示)。孔712’是孔712的放大版本如此反復直到最后層。
多層可以被這樣布置:從最頂層開始,穿過中間層,至表面接觸層,孔的尺寸減小并且孔的數目可增加。每個隨后的層包括與鄰近隨后層中的孔對齊的孔集群。諸如,第一層(其可為最頂層或中間層的上一層)具有若干孔。此第一層覆蓋第二層,其中第二層具有在第一層中的孔的下方布置的孔集群。此第二層可覆蓋第三層并且第二層中的每個孔集群中的每個孔覆蓋第三層中的進一步更小孔集群(額外的層也可以此方式提供)。
通道限定了劑穿過劑載體主體至組織表面的流動路徑。最初,通道通過第一有孔層(first hole possessing layer)中的孔的直徑進行限定。隨后,層具有與此第一有孔層中的孔對齊的孔集群。因此,從第一有孔層開始,穿過隨后的層,通道被多次分叉為多個分支。將會理解,這些多個分支均形成通道的部分。
圖7C、7D、和7E顯示由微制造工藝產生的微通道的放大圖像詳細實例。圖7C和7D(7D顯示7C的更大放大倍率)顯示其中孔具有正方形橫截面的層。圖7E顯示包括具有正方形和六邊形橫截面的孔的層。
3.基于突出物的實施方式
以下系列的實施方式包括由微米級突出物形成的多個微結構,其一起限定了劑載體主體的組織接觸表面。這些微型結構接觸靶組織并且待遞送劑圍繞它們。在優選的形式中,劑載體主體具有圍繞突出物并且包含使用中的劑的外圍結構(典型地為壁)。相比由微通道構成的劑載體主體,此實施方式具有劑載體主體內微結構比流體的更低比例。優選地,這些實施方式通過突出物和同樣可能的外圍結構保持超聲源和靶組織之間的直接接觸。如將會理解的,超聲的應用通常會與以上綜述中所列的參數一致。
更具體地,圖8A至10和23至30A示例利用包括用于接合治療中的組織的組織接觸表面的劑載體主體的若干實施方式,組織接觸表面至少部分地由多個突出物限定。突出物優選地從空隙的內部向外延伸和在所述組織接觸表面終止。空隙可由外圍結構形成,其中至少部分所述外圍結構可在組織接觸表面終止。
在一些實施方式中,外圍結構與突出物在共同平面終止。在其它實施方式中,限定組織接觸表面的至少一些所述突出物從空隙向外延伸超過外圍結構。在一些實施方式中,突出物可在一個平面終止并且外圍結構可短于該平面終止以便突出物延伸超過外圍結構。
在此類實施方式中,應該注意,優選的實施方式的突出物并不起到微針的作用。不像微針,優選實施方式的突出物不意圖穿透組織的任何層。突出物的作用包括通過在表面上應用導致摩擦力的壓力來接合靶組織。這有助于安置裝置(例如在黏膜光滑面上)和增強超聲促滲效果。
如將會理解的,這些圖中所例證的劑載體主體可以被用于替代任何本文所示例的劑載體主體,例如劑載體主體104、810、902、903、903’、903”、903”’、903””和1302,或與本文所述的任何劑載體,例如,劑載體300、800、800’和900、900’、900”、900”’、900””一起使用。
在優選地實施方式中,突出物包括以下性質:
它們不具有針狀末端,也就是說,它們不變窄至一點以便它們的末端的寬度不減小至接近零。
橫截面相對不變——至少在它們的末端附近,并且最優選地沿它們的全長。在大多情況中,朝向其末端的寬度將不會變窄大于20%,并且優選地小于10%。
它們一般具有大于10μm的末端寬度。因此突出物的規模通常也區別于微針的規模。
它們不會進入靶組織的完好無損的上皮表面。
當裝置被放置與組織接觸時,它們有助于通過它們施加的摩擦力使裝置穩定。這對傾向于具有由于局部黏液分泌引起的低摩擦表面的黏膜尤其有利。
它們通常具有(跨越它們的最短橫截面寬度)1:1至10:1之間的高寬比。當更大的高寬比可被使用時,難以獲得它們可以經受得住處理、裝載和應用超聲能量而不損壞的可接受強度。如將要理解的,橫截面形狀會大大地影響它們的強度并且將因此而被選擇。
在優選的實施方式中,突出物占據大于5%的體積——圍繞著它們其中劑被攜載。此比例需要足夠高以便毛細作用力或其它力在對抗重力或由普通操作引起的其它力的情況下將劑保持在劑載體主體內。在與水樣劑一起使用的實施方式中,一般具有大于5%和最優選大于10%的預測密度。同樣應該領會的,隨著劑變稠例如蛋白質富集劑,突出物的密度,或它們的尺寸和/或壁表面積可以被降低。
圖8A至8G示例包括一起限定劑載體主體的組織接觸表面的多個突出物的劑載體主體和劑載體主體層的可選實施方式的示意圖。
在此實施方式中,劑載體主體750可以被用于通過輸送刺激將劑遞送至組織。劑載體主體750包括用于接合治療中的組織的組織接觸表面752。在此實例中,組織接觸表面至少部分地被多個突出物754限定。
突出物754可為任意形狀,但在本實例中通常是圓柱形。優選地,突出物沿其高度具有恒定橫截面形狀。突出物754從劑載體主體750內形成的空隙756的內部向外延伸。外端758至少部分地限定劑載體主體750的組織接觸表面。
空隙756由外圍結構760形成,其在此情況下采取該形式或外圍壁或邊緣。邊緣760也限定組織接觸表面752的部分。
外圍結構760在此實施方式中與突出物在共同平面終止,以限定平面組織接觸表面752。但是,在其它實施方式中,至少一些所述突出物754可以延伸超過,和/或短于外圍結構停止以便組織接觸表面752不是平面的。在一些實施方式中,突出物754可全部延伸超過外圍結構760。
空隙754充當儲存器來容納劑載體主體750內的劑。但是不像先前的實施方式,此儲存器位于劑載體主體的組織接觸表面側。
突出物754位于在儲存器內以便它們與儲存器中的劑流體連通。這使突出物754作用在劑載體主體750內的劑上并且將輸送刺激傳送至劑中,然而在以上實施方式中,微通道的壁作用在劑載體主體內的劑上。
此類實施方式相比以上描述的實施方式通常具有更大的用于容納劑的體積。通過具有更大的填充體積,空氣滯留的可能性也可被減小。這些改進的填充性質可給予某些實施方式改進的填充準確性和可重復性,其有助于增加劑量準確性——這在醫療應用中可以是重要的。此外,由于所保持的空氣空間減少的抑制,改進的填充可導致更好的超聲能量傳輸。
優選地,空隙754的內表面(一個或多個)被功能化。空隙754和突出物752的內表面可用具有疏水或親水性質或兩部分的組合的化合物或分子功能化。可選地,空隙754和突出物752的表面可通過將通道的表面與被吸附至通道的表面、暴露具有期望物理和/或化學性質的特定官能團的小分子接觸而被功能化。小分子可通過化學吸附作用或物理吸附作用被吸附至通道的內表面。可選地,或除了改變水/油親和力,微通道和/或劑儲存器的內表面可通過使它們變得導電而功能化。在優選的形式中,當劑載體與劑接觸時,通過毛細作用力進行劑載體主體的裝載。
圖8C和8D顯示劑載體主體層750’。通常,劑載體主體層750’與劑載體主體750相同,并且同樣特征被同樣編號。但是,劑載體主體層750’額外地包括延伸通過其的一個或多個微通道762。如先前實施方式,微通道762延伸通過劑載體主體層以便儲存器756可被流體地連接至鄰近劑載體主體層。在這個實例中,使用四個微通道。
圖8E和8F是具有在其中形成的儲存器的劑載體主體層的示意圖。劑載體主體層764通常是圓柱形形狀并且包括限定其中的儲存器體積770的外圍壁766。在使用中,劑載體主體層764被堆疊在劑載體主體層750’上以便壁766的外邊緣768接觸劑載體主體層750’的背面,以便關閉儲存器體積770。劑載體主體層750’中的微通道762允許儲存器體積770內的劑進入儲存器756中用于分配。
圖8G和8H是由圖8E和8F的劑載體主體層形成的劑載體主體與圖8C和8D的劑載體主體層堆疊以形成劑載體主體780的示意圖。劑載體主體780包括包含組織接觸層750’的疊層,其包括組織接觸表面752和一個其它層764。更多層也可被堆疊以形成劑載體主體。
在圖8H中,劑載體主體780顯示填充有劑。在此配置下,劑被填充至組織接觸表面752。
圖9A是顯示圖8A至8H中示意性示出的類型的劑載體主體(或其層)的部分的電子顯微照片。圖9A顯示作為突出物754操作的三個柱狀物782的部分。表面784是柱狀物782從其延伸的空隙756的基底。圖9B是顯示另一個柱狀物786的靠近部分的電子顯微照片。可見,這些實施方式從其各自的規模來看,柱狀物782和786為約200微米寬和類似的高度。但是在其它實施方式中,可使用不同的高度和寬度。
圖10示例系列四個掩模設計,均適合于形成各自的劑載體主體(或其層)。掩模被用于形成劑載體的組織接觸表面的突出物和外圍結構的微加工工藝。突出物將以圖案進行布置,在此實例中為規則陣列。
在圖10中,每個裝置(裝置1至4)的掩模包括用于限定正方形外圍壁的第一掩模部分792。裝置1包括以5×5陣列布置的25個掩模部分794的陣列,以產生5×5陣列的突出物。裝置2包括以4×4陣列布置的16個掩模部分794的陣列,以產生4×4陣列的突出物。裝置3包括以3×3陣列布置的9個掩模部分794的陣列,以產生3×3陣列的突出物。裝置4同樣包括以4×4陣列布置的16個掩模部分794的陣列,以產生4×4陣列的突出物。可見,裝置4的突出物相比裝置2的突出物被間隔開得更寬。本發明的實施方式中的突出物的高度可以被選擇以產生具有期望體積的空隙。在一些實施方式中,突出物的高度可以大于200μm。在一些形式中,它們的高度可以小于1mm。在一些實施方式中,突出物的高度可以大于300μm。在一些形式中,它們的高度可以小于800μm。在一些實施方式中,突出物的高度可以大于400μm。在一些形式中,它們的高度可以小于700μm。在一些實施方式中,突出物的高度可以大于500μm。在一些形式中,它們的高度可以小于600μm。在一些實施方式中,可以使用大于1mm或小于200μm的高度。
圖23示例用于產生各種劑載體主體(或其層)的掩模設計的系列(a)到(g)。圖(a)至(e)是具有圓突出物794的實施方式,而圖(f)和(g)具有十字形平面圖的突出物794。實施方式匯總于下面表中。
應該理解,這些實施方式沒有以任何方式詳盡并且很多具有不同突出物大小、間隔、橫截面形狀的可選實施方式可以被設計。同樣需要注意,當這些實施方式被包含在參考數字792所指定的正方形邊緣內時,可以使用其它形狀。另外,突出物的陣列不必是規則陣列或具有均一密度或芯片分布。實施方式中所使用的所有突出物794不需要具有相同橫截面形狀。
實例(f)和(g)具有十字形突出物794。十字形突出物具有這樣優點:相比于圓形突出物,它們具有增大的壁表面積,但是具有減小的橫截面面積,因此使劑儲存體積最大化。在每個臂充當支持橫向延伸臂的支撐物的情況下,十字形突出物的幾何結構同樣具有相對好的機械性質。
圖24至28示例劑載體主體和其區域的一系列電子顯微照片。圖24(a)至(c)顯示第一實施方式。此實施方式具有4×4陣列的自空隙784延伸向上的十字形突出物782。空隙784被外圍壁785所圍繞,如先前實施方式所示。在使用時,待遞送劑通過利用空隙784作為儲存器被保持在劑載體主體中。可見,突出物782在它們的全部高度上是十字形的橫截面形狀——雖然它們的寬度改變。所述改變——特別在它們的末端附近——是相對小的,以便形成劑載體主體的組織接觸表面的最頂部表面大體上是平的。在此實施方式中,外圍壁785約為半毫米高,并且最具體地為484.89μm。突出物具有大體上形同的長度。橫剖面的寬度在此實施方式中為31.11μm。其與標稱截面比較,如由50μm的掩模限定并且表示突出物錐化將近40%。但是,可見,突出物不是鋒利如微針——盡管朝向頂部少許變薄。此平的表面和多個密集填實的突出物防止由于這些實施方式的機械損傷或穿透表面。
圖24(d)是同樣具有通常由正方形外圍邊緣785圍繞的十字形突出物782的進一步實施方式。在這個實例中,突出物以3×3圖案布置。
圖25(a)至(e)是具有圓形橫截面的數個實施方式的電子顯微照片。相同特征被相同編碼并且將不被詳細描述。但是,如所觀察到的,盡管突出物782朝向它們的末端變窄,但是末端是平的并且不尖如微針。同樣在此實施方式中,突出物為約半毫米高(525.25μm,如圖(b)中所示)。如圖25中所示,突出物的末端的直徑為184.02μm。
圖26(a)至(d)是具有十字形(a)和圓形橫截面(b)至(d)的數個額外實施方式的的電子顯微照片。在這個實例中,突出物782的側面相比先前實施方式更垂直。也就是說,它們的側面錐化小于先前實施方式。這在圖(a)至(c)中最明顯。
圖27(a)至(d)是具有具有圓形橫截面的突出物的數個額外實施方式的電子顯微照片。同樣在這些實例中,突出物782的側面相比先前實施方式更垂直。外圍壁和突出物的高度再次為約半毫米。兩個最終的實施方式在圖28(a)和(b)中顯示。這些實例分別為4×4陣列和5×5陣列。
在此顯微照片中,突出物在它們的底部也錐化。錐化是制造過程中所使用的蝕刻工藝的結果,并且很大程度上是無意的。但是,在一些實施方式中,此錐化可以成為優點——因此其增加了其中容納劑的空隙的體積。
4混合和替代實施方式
圖29和30示例劑載體主體的兩個混合實施方式。在圖29中,劑載體主體104包括圍繞邊緣785中的其外圍邊緣布置的多個微通道112。其同樣具有形成于中央空隙784內的突出物782的陣列。
圖30和30A示例可選實施方式,其可以被視為基于突出物的實施方式,但具有紋理或輪廓邊緣。在此情況下,劑載體主體具有蜂窩狀(castellated)的外圍邊緣785。邊緣785具有自外圍邊緣至空隙784延伸穿過邊緣785的一系列通道或開窗785A。空隙784同樣包含3×3陣列的突出物782。為了更好的示例布置,在圖30A中提供了沿著線30A-30A的橫截面。
具有多個劑載體主體的或許以諸如陣列的圖案布置的劑載體也可以被提供。
5.裝載和應用實例
圖11A、11B、和11C示例實施方式,其中劑儲存器被提供在劑載體內作為劑載體主體的單獨組件。
圖11A示例根據本發明的進一步實施方式的施用器的部分。在此圖中,示例了附接至用于將施用器末端800耦接至手持式劑施用器裝置的手柄部分的耦接桿802的施用器末端800的實施方式。施用器末端800包括形成于末端的外殼803內的劑儲存器804。外殼803同樣包括用于接收劑載體主體的凹槽區域806。劑儲存器804包括端口808。端口808可被配置用于多種不同用途。在某些實施方式中,端口808可被用于將劑注入劑儲存器804。在其它實施方式中,端口808可被用于將真空施加至劑儲存器804以將劑吸至儲存器804中。
圖11B提供具有插入至凹槽區域806(由于存在劑載體主體810而未顯示)中的劑載體主體810的施用器末端800’。如將從圖11A中的說明理解的,劑儲存器804’可通過施加至端口808’的抽吸用劑填充,憑借其劑經由其微通道被吸引穿過劑載體主體810,用于儲存/容納在儲存器804中。或者,端口808’可被用于將劑直接注入劑儲存器804’,隨后其用劑填充儲存器804’和劑載體810中的微通道兩者。
圖11C提供大體如上所述的施用器末端800”的進一步實施方式,并且因此對應的特征已被相同編號,其具有附加的秒號以指示實施方式的改變。施用器末端800”被連接至耦接桿802”。其包括劑儲存器804”和堆疊的劑載體主體810”。在其它方面,其與先前實例相同。
圖12A、12B、12C、12D、和12E提供用劑和/或有助于裝載的其它物質裝載劑載體、通過系統對劑的保持和遞送的機構、改變和方法的示例。
大體上在圖12A至12E中所示的裝載機構同樣可被單獨使用或組合使用,如用于內襯劑載體或其腔的表面的方法,其在裝載劑前具有親水或疏水部分,或在裝載劑前具有可以傳導電荷和/或參與產生或傳播電場的部分。
圖12A提供用劑裝載劑載體的方法的實施方式的示例。在此實施方式中,包含劑載體主體902的施用器末端900通過其耦接桿908被連接至手持式施用器裝置(未顯示)。劑載體主體902被至少部分地浸入包含劑906的容器904中。由施用器裝置的超聲換能器產生的超聲振動通過耦接桿908被耦接至施用器末端900,并且通過其,至劑載體主體902。振動將空氣從微通道排出并且至少部分地用劑906填充劑載體主體902內的微通道和/或劑儲存器。
圖12B提供用劑裝載劑載體的方法的另一個實施方式的示例。在此實施方式中,劑載體是可移動的施用器末端900’。施用器末端900’和/或分離的劑載體主體903被至少部分地浸入包含劑906’的容器904’中。由外源910產生的超聲振動被施加至容器904’,其將空氣從包含在施用器末端900’(未顯示)和/或分離的劑載體主體903中的劑載體的微通道和/或劑儲存器排出,并且至少部分地用劑906’填充施用器末端900’和/或分離的劑載體主體903內的劑載體的微通道和/或劑儲存器。在其它實施方式中,裝載可通過簡單浸入劑載體或劑載體主體完成,而不需要施加超聲振動。
圖12C提供真空室912的示例。真空被施加在端口914以將室912的空氣和容納在施用器末端900”或分離的劑載體主體903’內的劑載體的微通道和/或劑儲存器內的空氣移除。當完成真空時,控制劑進入端口916的閥被打開以便儲存在室917中的劑通過劑進入端口916被吸至室912中并且被進入施用器末端900”和/或分離的劑載體主體903’中的劑載體主體902”中的微通道和/或劑儲存器。通過劑載體(一個或多個)的組織接觸表面中的孔使劑進入。一旦被劑填充,施用器末端900”和/或分離的劑載體主體903’被從包含流體的劑移除并且密封層可被施加在裸露的表面上。
圖12D提供方法的另一個實施方式,其中真空被用于用劑906”’填充劑載體主體903”’。劑906”’被容納在容器904”’內。劑載體903”’被安置在容器904”’內并且至少部分地淹沒以便劑載體主體903’”的組織接觸表面920的孔在劑溶液906”’中。真空被施加至端口918以將劑溶液向上吸穿過劑載體903”’中的微通道以便微通道和/或劑儲存器用劑溶液906”’被至少部分地填充。
在用劑填裝載載體主體的方法的可選實施方式中,劑可以被直接注入至端口中以便劑載體中(即在微通道和/或劑儲存器中)的空氣被排出和被劑替換。
圖12E提供比圖12D中的方法簡單方法——除了具有劑載體主體902”’的施用器末端900””即將被用劑裝載。施用器末端900””以橫截面被示例,以實例施用器末端包括其外殼內的儲存器921,其與劑載體主體902”’內形成的任何儲存器分離。施用器末端900””包括提供儲存器921入口的真空端口922。如上所述,真空被施加在將劑溶液向上吸穿過劑載體主體902’”中的微通道的真空端口922以便劑載體主體902”’或施用器末端900””外殼中的微通道和/或劑儲存器被至少部分地用劑溶液906””填充。
在用劑裝載具有劑載體的劑載體或施用器末端的方法的可選實施方式中,劑可以被直接地注入至端口中以便劑載體中(例如微通道和/或劑儲存器中)的空氣被排出和被劑替換。
如將要理解的,以上描述的裝載技術可以與基于本文所述的或設計的劑載體主體的適合的微通道、混合或突出物一起使用。但是,允許直接進入劑儲存器的劑載體主體或劑載體可通過直接地將劑安置在儲存器中(例如,通過將劑移液至儲存器上)進行裝載。此機構的一個實例被用于以下描述的實驗中。在這個實例中,劑被移液至基于突出物的劑載體主體的劑載體主體的組織接觸表面上的空隙中。以類似的方式,劑可被移液至劑載體主體的背面上的儲存器,用于通過微通道遞送至組織接觸表面。
劑載體可作為空的劑載體或作為用劑填充的裝載劑的載體被提供。其中空的劑載體被提供,最終用戶在使用前將需要用劑裝載劑載體。
本發明同樣涉及用劑裝載劑載體和將劑從劑載體排出的方法。
從劑載體排出劑或將劑分配至組織表面的方法包括將劑載體施加至組織表面和將劑從劑載體分配至組織表面。優選地,分配劑的過程包括將超聲波施加至組織表面以促進通過超聲促滲將劑滲透至組織中。
如將從上述內容理解的,劑載體或劑載體主體自身可以為可從施用器裝置分離的部件。在優選的形式中,劑載體或劑載體主體是可移除或可互換的一次性使用部件。這有助于醫療用途所要求的無菌性和促進在其它事物中患者之間的手持式施用器裝置的清潔和無菌。優選地,在劑載體是可替換的情況下,實施方式的固體物理性質促進劑載體的安裝和處理。而且,用于包含劑的劑載體主體的固體材料的使用促進將劑裝載至劑載體中;包裝、處理預裝載有劑的劑載體主體。重要地,用于劑載體主體的固體材料的使用促進被用于移動劑穿過劑載體的超聲波的傳播,并且增強和/或允許劑通過超聲促滲進入至靶組織中。
圖13A和13B示例一個實施方式劑載體。施用器末端1300大體上來說與圖1中所示的劑載體末端102相當。在這個實例中,劑載體1300采取具有可移除和可互換的劑載體主體的施用器末端的形式。
劑載體1300包括以下主要組件:劑載體主體1302、和包括末端主體1304和劑載體主體保持蓋1306的末端外殼1303。
劑載體主體1302在平面視圖中大體上是直線的,并且在這個實例中其是正方形的。劑載體主體1302可按照以上給出的實例或本文描述的方面的任一項進行制備。劑載體主體1302具有組織接觸表面1304。
末端主體1304用于將劑載體1300連接至劑施用器裝置和以超聲能量的形式將傳輸刺激傳導至劑載體主體1302。為了實現它,末端主體1304在其第一端上被提供有螺紋形式的安裝機構1305。安裝機構1305被用于制備與手柄組件的對應連接器的機械連接。末端主體1304的第二端被塑形以作為喇叭狀操作,從而通過配合表面1307將超聲能量傳導至劑載體主體1302。
劑載體主體保持蓋1306用于保持劑載體主體1302以及與配合表面1307接觸而將其容納。劑載體主體保持蓋1306具有在其中形成的孔徑1310,在使用中劑載體主體1302的組織接觸表面1308通過所述孔徑1310被暴露。利用螺紋劑載體主體保持蓋1306被安裝至末端主體1304。
如將會理解的,在此系統中可以進行多種形態學和機械學的變化。諸如包括劑載體主體的組件的形狀,和其關聯組織接觸表面可被改變。當劑載體主體由半導體材料制成和其制造過程最方便地輸出正方形組件時,本正方形實施方式尤其方便。末端主體的形狀可以被改變以最優化超聲能量的傳輸——如果超聲能量被用作輸送刺激。通過其暴露劑載體主體的組織接觸表面的孔徑的形狀可以被改變。在一些情況下,其可與劑載體主體的組織接觸表面的形狀不同。
劑載體保持蓋與末端主體接合的方法可以被廣泛改變以利用任何方便的類型的機構。在這個實例中,通過螺紋接合,但是劑載體保持蓋可以被按壓安裝至末端主體上,或與按扣或卡扣式組裝件接合,以給出非詳盡的清單或替代物。類似地,劑載體主體的安裝機構可以被改變以利用任何已知的連接機構。
具有多個劑載體主體的或許以諸如陣列的布置的圖案劑載體同樣可以被提供。
6.試驗結果和處理方法學
在本發明的進一步方面中,提供了將劑遞送至活組織(例如動物,植物或人)的方法。可以認為,通過選擇性地選擇本發明所述的非侵入性劑施用器的操作參數,可以控制被遞送至組織內選定的深度的劑的量。
控制的參數可包括以下一個或多個:
應用壓力;
超聲頻率;
超聲波形;
超聲方向;
超聲功率水平;
超聲應用時間;和
超聲占空因素。
在特別優選的形式中,可以選擇系統參數來控制將劑遞送至靶組織中期望的深度。將設定系統參數以便經上皮將劑主要地遞送至角膜基質中的實例將會發生。有利地,這表示將藥物、疫苗或其它劑遞送至其中已知最有效的選定組織深度的機會。
在此方面,本發明以一種形式提供控制利用本文所述的方面或實施方式的任一個的劑載體、劑載體主體或施用器而被遞送至組織內的選定深度的劑的量的方法。
實驗測試
利用小鼠實施了一系列實驗以確定是否劑可以利用本發明的實施方式被成功遞送至組織。每個情況下的輸送刺激僅為超聲能量。在本實驗中,疫苗病毒利用本發明的實施方式僅利用超聲能量地給予,應用至唇內側以確定是否劑存在于免疫系統,并且可誘導免疫反應。研究人員注意到,在試驗2中,在獲得系統性免疫反應所需要的期間內通過應用裝置的唇黏膜沒有發生損傷。
6.1試驗總結
試驗1
利用兩種劑載體主體(在此討論中被命名為“微芯片”)用圖7c中示例的本發明實施方式接種小鼠,總計約2-5×106空斑形成單位(pfu)的基于熒光標記的重組痘病毒載體的HIV疫苗每只鼠。
在免疫的和未免疫的小鼠中,攝取疫苗抗原的抗原提呈細胞的比例(0.025-0.068對0.025-0.022),和募集至引流淋巴結的樹突狀細胞的比例(0.25-0.54對0.22-0.49)分別是相似的(圖1和2)。重要的結論是僅利用兩種微芯片沒有引起免疫反應。
試驗2
利用每只小鼠初免三個微芯片實施利用表達HIV抗原的重組痘病毒的完全異源初免-加強接種,并且將應答與鼻內(i.n.)初免的小鼠(陽性對照),和未用任何疫苗初免的小鼠(陰性對照)對比。在初免接種后兩周所有小鼠被給予肌肉內(i.m.)增強接種。
由不同接種途徑誘發的系統性免疫反應(血室中的應答)的量級通過確定脾中HIV特異性CD8T細胞的百分比進行評價。利用本發明的實施方式接種的小鼠中的一只產生超過陽性對照的免疫反應,從而證明概念的驗證。
試驗3
在進一步的試驗中,利用圖10中示例的本發明實施方式實施初步的初免-加強接種實驗。利用每只鼠根據每個實施方式(約2-5×106pfu)的FPV-HIV的三個微芯片用唇遞送系統對小鼠進行初免,隨后肌肉內增強接種。HIV特異性CD8T細胞的百分比被用于評估誘導的免疫反應的量級。數據表明執行的微芯片1(1%的細胞)和2(0.6%)略好于微芯片3和4(0.5%)。同樣應該注意,在裝載和遞送期間微芯片1和2相比微芯片3和4進行的更加有效。
試驗4
利用圖10的微芯片1和2執行完全初免-加強接種實驗。在此實驗中,每個接種組小鼠中的一只產生超過鼻內陽性對照的免疫反應,而每個組中的其它兩只小鼠具有類似于口服疫苗陰性對照組的應答。
表1總結了實驗參數和每個實驗的結果。
表1:在原始微芯片和微芯片1和2上實施的初免-增強接種試驗的總結
a(x3)–指的是被給予每只鼠的疫苗的微芯片數目,因此“x3”意為施加了三個微芯片;
Mc–是“微芯片”的縮寫,我們用于指定每個測試中所使用的類型;
b劑量——被表示為初免疫苗的空斑形成單位(pfu)——表達HIV抗原的雞痘病毒(FPV-HIV)被提供。接種遞送的途徑如下所示:
“Lip”指的是給予利用本發明的實施方式施加至患者的唇的組織而完成;
“i.n.”指的是鼻內遞送;
“oral”指的是直接地遞送至口中
c增強疫苗是表達HIV抗原的牛痘病毒(VV-HIV),并且在所有情況下,利用肌肉內(i.m.)途徑進行遞送
d在兩種情況下研究了系統性免疫反應。M#代表小鼠編號。
6.2試驗細節
試驗1
目的:確定利用圖7c的實施方式的唇遞送系統是否誘導引流淋巴結(LN)中的抗原攝取,接種后24小時監測抗原抗原呈遞和免疫細胞募集如下:
1.在給予若干熒光標記的疫苗、表達HIV抗原和綠色熒光蛋白的重組雞痘病毒(FPV-HIV-GFP)的微芯片后,在宮頸、縱膈和/或腸系膜淋巴結中監測疫苗抗原的攝取;
2.評價抗原提呈細胞(APC)是否被募集至這些LN,通過特征細胞表面標記的染色確定這些部位上的樹突狀細胞(DC)和巨噬細胞的相對數目。
方法:
1.用FPV-HIV-GFP免疫小鼠并且在接種后24小時評價應答。在這些試驗中,小鼠被保持為:
a)未免疫對照(圖14和15),或
b)僅用FPV-HIV接種的對照(即無GFP熒光抗原,圖16)。
用兩個微芯片接種小鼠,一個接種至左唇和一個接種至右唇(約5×106pfu每只鼠)。
2.在24h,不同的引流淋巴結被收獲、合并,并且在完全培養基中制備單細胞懸浮液(Ranasinghe等,2011;Ranasinghe等,2006;Ranasinghe等,2007;Ranasinghe等,2013)。
3.1×106細胞被等分試樣(aliquoted)并且用不同細胞表面標記染色。[用針對I-Ad APC細胞表面標記的抗體染色抗原提呈MHC-II細胞、針對細胞表面標記CD11b-PE和CD11c-PerCP的抗體被用于鑒定DC(圖15)和針對細胞表面標記F4/80-PE Cy7的抗體被用于鑒定巨噬細胞(數據未顯示)](Ranasinghe等2103)。
4.利用流式細胞分析(FACS)基于細胞表面上表達的熒光標記細胞表面標記分析不同細胞亞群。這些試驗被重復三次,結合結果在圖14至16中顯示。
5.在這些試驗中,單色對照(SS)和熒光扣除(FMO)對照也被用于設置門控(gating)并且進行不同細胞亞群的正確分析。
結果和結論:
圖14至16以圖形方式示例試驗的結果。在這方面,圖14顯示用于評價唇遞送后24h FPV-HIV-GFP疫苗的攝取的圖,示例了在由箭頭所指示的右上方象限中檢測的包含疫苗的熒光GFP抗原的I-Ad APC MHC-II細胞。注意,在此和其它FACS圖中,每個點代表一個細胞。
圖15示例用于評價唇遞送后24h抗原被不同樹突狀細胞亞群攝取至各自引流淋巴結的募集的圖。樹突狀細胞(被確認為MHC-11+)和CD11b+(左邊兩列)或CD11c+(右邊兩列)的比例在右上方象限中(指箭頭)指出。
圖16示例用于評價唇遞送后24h宮頸、縱膈和腸系膜淋巴結中的FPV-HIV-GFP疫苗的攝取的圖(重復試驗3)。包含疫苗的熒光GFP抗原的I-Ad APC MHC-II細胞在由箭頭所指示的右上方象限中被檢測。(注意,上方三個圖顯示門控策略)。
可見,接收FPVHIV-GFP疫苗的小鼠和對照之間檢測的抗原攝取和呈遞(圖14&16)或募集至引流淋巴結的DC亞群(圖15)沒有差異。數據指出:
i)以每只小鼠兩個微芯片的劑量(劑量~2-5×106pfu)的疫苗遞送沒有效果。
ii)因此,為了獲得任意免疫結果,在隨后的初免-加強接種實驗中使用最少3芯片或更多每只小鼠。
實驗2
在接下來的實驗中,進行了利用初免-加強接種用如實驗1相同的微芯片唇遞送效果評價。
目的:測試唇初免、隨后肌肉內(i.m.)增強接種是否可以誘導比鼻內初免(i.n.)/i.m.增強接種策略有效的HIV特異性CD8T細胞免疫,其利用:
1.HIV gag-特異性四聚體染色。
2.HIV特異性CD8T細胞中的IFN-γ的胞內細胞因子染色(ICS)。
方法:
圖17是顯示所進行的實驗的以下階段的照片。所示例的階段包括:裝載微芯片(左上)、超聲系統設置(右上)和唇遞送至小鼠(下方照片)。實驗方法如下進行。
1)用FPV-HIV初免接種
a.將疫苗(~600-800μl儲液)超聲處理(即輸出:30%;每周期10秒進行3周期),以常規i.n.遞送。300-400μl/孔的超聲處理的病毒被添加至48孔板的兩個孔中。
b.將微芯片浸泡于48孔板中的FPV-HIV(5×108PFU/ml)(圖17左上)。假設,每個微芯片可以吸收和排出5μl,因此計算每個微芯片的劑量為2.5×106pfu。
c.每孔六個微芯片被沒有任何重疊地淹沒在流體中,并且在冰上溫育30分鐘(圖17左上)。
d.取出一個微芯片以測試芯片是否被裝載有病毒——通過將裝載的微芯片放在含有PBS的孔中。如果微芯片漂浮則意味著芯片未被裝載,但如果其下沉則認為被裝載。
e.對照:陽性對照,兩只小鼠被i.n.免疫(20l/小鼠1×107pfu)以及兩只小鼠被僅用i.m.加強(1×107pfu)接種以單獨測試其效果。
f.測試組:三只小鼠被免疫用于如下唇/i.m.組。微芯片被安裝至遞送施用器(與圖1中示例的施用器相似),其被連接至電源。超聲凝膠被用在臂和微芯片之間以便更好的接觸)。打開電源。
g.微芯片被牢固地按在麻醉小鼠的內唇區域上。(圖17下方)
h.打開輸出開關,施加超聲能量30秒,以將病毒遞送至唇區域中。在此時間點,儀器設置為換能器驅動電壓V=95-160;P=2800-3200mW。
i.檢查病毒是否已經被從微芯片遞送,芯片如先前被放在PBS中。如果芯片漂浮則表明病毒被成功從芯片排出。80%的時間芯片漂浮表明疫苗被排出。如果兩個微芯片未被正確地遞送疫苗,則將丟棄小鼠并且免疫新小鼠。
j.重復進行每只小鼠3個微芯片,每次使用一個新的芯片。
2)利用107PFU VV-HIV肌肉內增強接種
a.在FPV-HIV初免接種后兩周進行增強接種
b.在900μl的PBS中為9只小鼠制備增強疫苗,總共9×107PFU。
c.病毒被如FPV-HIV一樣的精確地進行超聲處理。
d.利用鼻錐用異氟醚麻醉小鼠并且i.m.遞送50μl的VV-HIV每四頭肌。
3)制備用于分析的脾樣本
增強接種后7-14天,從每只鼠收獲脾,并如Ranasinghe等(2006)中所描述的制備單細胞懸浮液。
根據如下表2和3中的方案,利用來自每只鼠的4×106脾細胞用四聚體染色和胞內細胞因子染色來評價HIV特異性CD8T細胞應答的量級:
a.如(Ranasinghe等,2011;Ranasinghe等,2006;Ranasinghe等,2007;Ranasinghe等,2013)中所描述的進行四聚體染色
·細胞在室溫下用KdGag197-205-APC四聚體和FACS緩沖液中的抗-CD8αFITC染色45min。
·洗滌細胞并固定在0.5%PFA中,隨后利用FACS分析。
b.同樣如(Ranasinghe等,2011;Ranasinghe等,2006;Ranasinghe等,2007;Ranasinghe等,2013)所描述的進行針對IFN-γ的胞內細胞因子染色(ICS)。
·細胞用KdGag197-205肽刺激過夜,在37℃+5%CO2下持續1h。
·將Brefeldin A添加至每個孔并且在37℃進一步溫育5小時。
·細胞在4℃被用FACS緩沖液中的抗-CD8αFITC表面染色25min。
·利用來自eBioscience的IC/fix和IC/perm固定/透化細胞
·隨后細胞在4℃用抗-IFN-γ胞內染色25min(表2)
οIC Perm中的陽性染色–抗IFN-γAPC
ο單色對照和FMO對照。
表2:四聚體染色方案。
表3:IcS方案。
SS=單色對照,FMO=熒光扣除
結果和結論:
圖18顯示示例利用IFN-γ胞內染色評價HIV特異性脾CD8T細胞的量級的圖。利用細胞Quest Pro或FlowJo檢驗分析FACS數據。方框表示在唇/i.m.(上方3只小鼠)、i.n./i.m.(中間2只小鼠)和僅加強(下方3只小鼠)接種后,表達IFN-γ的HIV特異性脾CD8T細胞的百分比。圖19示例能夠利用四聚體染色評價HIV特異性脾CD8T細胞的圖。如上材料和方法中所述染色細胞。利用細胞Quest Pro或FlowJo檢驗分析FACS數據。方框表示在不同疫苗遞送途徑:唇/i.m.(上方三只小鼠)、i.n./i.m.(中部兩只小鼠)和僅加強(下方兩只小鼠)后的HIV特異性脾CD8T細胞的百分比。
HIV特異性四聚體(圖18)和IFN-γ染色(圖19)數據指出不同于i.n./i.m.遞送策略——其給出了高度一致的結果(圖18-8.94-9.33%的范圍),唇/i.m.遞送策略沒有產生一致的結果(圖19–1.03-15.1%的范圍)。然而明顯地,這是由于在唇遞送期間小鼠的初免的不一致性(注意:同樣參見唇/i.m.與僅i.m.加強比較),一只小鼠(小鼠1)顯示超過i.n./i.m.遞送策略的免疫反應的免疫反應,指出利用本發明的實施方式的的應答是可能的。
數據也揭示3×唇或4×唇微芯片遞送比5×唇微芯片遞送更有效(數據未顯示)。這些實驗進行兩次并且發現實驗(實驗4&5)之間的數據非常相似。數據用一個實驗代表。
實驗3:
進行進一步實驗以測試初免-加強接種策略,從而評價利用圖10中示例的本發明四個基于突出物的實施方式的唇遞送的效力。
目的:利用HIV gag-特異性四聚體染色測試相比于圖7c的微芯片這些微芯片是否可以裝載并且將疫苗更有效地遞送至唇(圖20)。
1)用FPV-HIV初免接種
a.如之前,疫苗被超聲處理并且300-400ml每孔添加至48孔板中。
b.微芯片被連接至裝置,隨后利用移液器將5-7μl疫苗裝載至微芯片的組織接觸表面上并且立即遞送至小鼠的唇。不像圖7c的微芯片,這些改進的微芯片不被浸在FPV-HIV中30min。
c.對照:對于陽性對照,兩只小鼠被i.n.免疫(20ml/小鼠);對于陰性對照,兩只小鼠被口服免疫和兩只小鼠被保持為僅i.m.加強的對照,以測試僅i.m.接種的效果。(類似于圖5)
2)i.m.增強接種和利用四聚體染色評價免疫反應
a)如試驗2中所描述的準確地進行這些。
結果和結論:
1)不像圖7c的微芯片,直接將疫苗移液至芯片上,使其極其簡單確定新微芯片是否被適當地裝載。類似地,一旦進行接種,微芯片被安置在一片組織上以確定疫苗是否已經被適當地排出。如果微芯片是干的則意味著疫苗被遞送。我們也通過在顯微鏡下可視化空的、裝載和使用的微芯片測試以上裝載。
2)觀察到,微芯片1&2(圖10頂部)相比微芯片3和4(圖10下方)更加有效地裝載和排出疫苗(無泄漏)。即便裝載更加有效,但再打開輸出開關前,只要裝置保持緊靠唇,則疫苗泄漏出微芯片3(尤其)和4,使其更多為口服遞送。
3)初步的HIV特異性四聚體數據進一步確認微芯片1表現好于3&4。因此,決定用圖10的微芯片1和2重復初免-加強接種實驗,包括口服初免/i.m.增強免疫策略作為對照以證實以下實驗4中的數據。
實驗4
在此試驗中,利用微芯片1&2的利用3×唇/i.m.接種策略的接種以與先前試驗類似的方式進行測試。
目的:測試3×唇/i.m.接種策略相比1×口服/i.m.初免-增強接種的效力,其利用:
a)HIV gag-特異性四聚體染色(圖21)和
b)IFN-γ的胞內細胞因子染色(ICS)(圖22)
方法:
如實驗3中用3只小鼠每組進行精確地接種和分析。還進行1×口服初免/i.m.增強接種作為額外對照,以評價初免是否與口服遞送或唇遞送有關(口服劑量=5×106FPV-HIV)。增強接種后14天利用四聚體染色和胞內IFN-γ染色測量脾中HIV特異性CD8T細胞應答。試驗被進行兩次。
結果和結論:
圖21示例能夠利用四聚體染色評價HIV特異性脾CD8T細胞應答的圖。利用細胞quest Pro軟件分析FACS數據。圖表示每組三個動物微芯片1(上方)&2(中間)初免-加強免疫數據對比口服遞送(下方)。右上象限(紅色箭頭)指示以下各個疫苗策略所觀察到的HIV特異性CD8T細胞的%。
圖22示例能夠利用IFN-γ細胞內細胞因子染色評價HIV特異性CD8T細胞應答的量級的圖。利用細胞quest Pro軟件分析FACS數據。圖表示每組三個動物微芯片1(上方)&2(中間)初免-加強免疫數據對比口服遞送(下方)。右上象限(紅色箭頭)指示表達IFN-γ的HIV特異性CD8T細胞的%。
可見,微芯片1-小鼠2和微芯片2-小鼠3(紅色箭頭)觀察到的HIV特異性脾CD8T細胞應答相比于口服遞送(下方3只小鼠圖21&22)大大升高,這些結果清晰地指示所觀察到的應答歸因于唇攝取而不是口服攝取。
數據表明如果遞送是統一/一致的,則微芯片1和2可以在血室中誘導良好的HIV特異性CD8T細胞免疫。
用根據圖10制作的微芯片檢測的陽性應答與用試驗1和2中使用的圖7c的微芯片檢測的陽性應答非常相似。但是,它們表現出更加容易的裝載。
來自實驗的數據暗示如果可以達到統一/一致,則唇遞送可以比口服或鼻內遞送更有效。
討論
發明者已知能夠利用超聲促滲被遞送至身體的分子包括1)任何種類的電荷或具有中性(包括整體中性)電荷的分子和2)小分子或大分子(包括約149,000道爾頓的單克隆抗體3)親水或疏水或親脂性的分子。
7.參考文獻:
參考文獻:RANASINGHE,C.,EYERS,F.,STAMBAS,J.,BOYLE,D.B.,RAMSHAW,I.A.&RAMSAY,A.J
2011.A comparative analysis of HIV-specific mucosal/systemic T cell immunity and avidity following rDNA/rFPV and poxvirus-poxvirus prime boost immunisations.Vaccine,29,3008-20
RANASINGHE,C.,MEDVECZKY,J.C.,WOLTRING,D.,GAO,K.,THOMSON,S.,COUPAR,B
E.H.,BOYLE,D.B.,RAMSAY,A.J.&I.A.,R.2006.Evaluation of fowlpox-vaccinia virus prime-boost vaccine strategies for high-level mucosal and systemic Immunity against HIV-1.Vaccine,24,5881-5895
RANASINGHE,C.,TRIVEDI,S.,STAMBAS,J.&JACKSON,R.J.2013.Unique IL-13Ralpha2-based HIV-1vaccine strategy to enhance mucosal immunity,CD8(+)T-cell avidity and protective immunity.Mucosal Immunol,6,1068-80
RANASINGHE,C.,TURNER,S.J.,MCARTHUR,C.,SUTHERLAND,D.B.,KIM,J.H.,DOHERTY,P.C.&RAMSHAW,I.A.2007.Mucosal HIV-1pox virus prime-boost immunization Induces high-avidity CD8+T cells with regime-dependent cytokine/granzyme B profiles.J Immunol.,178,2370-9
應該理解,在此說明書中公開和限定的發明延伸至兩個或多個文本或附圖所提到或證明的單獨特征的所有可替代的組合。所有這些不同的組合組成了本發明的各種可替代的方面。
- 還沒有人留言評論。精彩留言會獲得點贊!