可生物吸收支架的制作方法
相關申請的交叉引用
本申請主張于2014年6月2日遞交的美國臨時申請62/006,603的優先權,該臨時申請的全部內容通過引入并入本文。
本發明大體涉及用于形成或產生可植入患者中的器械(諸如醫療器械)的制造方法。更具體地,本發明涉及用于形成或產生管狀基材的方法和工藝,所述管狀基材可被進一步加工成具有適于植入患者中的各種幾何形狀的醫療器械。
背景技術:
近年來,用在與身體組織或流體(特別是血液)接觸的可植入器械中的人造材料(特別是由聚合物形成的材料)的應用越來越關注。上述器械的一些實例為人造心臟瓣膜、支架和人造血管。一些由金屬制造的醫療器械(諸如可植入支架)在植入后存在破裂或破壞的問題。此外,某些由聚合物制成的其他可植入器械具有諸如為了防止或抑制破裂或破壞而增加壁厚的問題。然而,為了治療動脈疾病特別希望具有減小壁厚的支架。
因為一些聚合物植入物諸如支架通過諸如擠出或注塑等工藝制造,所以上述方法通常通過本身弱的材料啟動來開始工藝。在聚合物支架的實例中,所得支架具有不精確的幾何公差以及降低的壁厚,這些可能使這些支架易于脆性斷裂。
易于脆性斷裂的支架通常不太好,因為其用于血管內輸送的折疊(collapse)能力有限,以及用于在脈管內布置或定位的膨脹能力有限。此外,上述聚合物支架還具有降低的強度水平。脆性斷裂在支架中特別成問題,因為將支架布置到輸送氣球上或者布置到輸送鞘內會向構成支架的材料施加相當大的壓縮作用力。由脆性材料制成的支架可能斷裂或者在未破壞的情況下可能具有非常有限的折疊或膨脹能力。因此,對于在脈管中可靠地膨脹、變形并保持其位置的支架來說,希望一定程度的延展性。
因此,希望制造具有一層或更多層的聚合物基材,這種聚合物基材,特別在被用作植入患者體內的生物相容性和/或可生物吸收聚合物支架時,保持其機械強度并且充分延展,以防止或抑制脆性斷裂。
技術實現要素:
本文所述的多種澆鑄工藝可被用于開發具有相對高的幾何精度水平和機械強度水平的基材(例如圓筒形基材、橢圓形基材、菱形基材等)。然后,利用任意工藝(例如高速激光源、機械加工等)可以將這些聚合物基材加工成具有各種用于植入患者(諸如外周或冠狀脈管系統)的幾何形狀的器械,諸如支架。
上述澆鑄工藝的實例是利用浸涂工藝。利用浸涂制造具有上述所需特性的聚合物基材會導致基材能夠保留原料的固有性質。這從而導致基材具有相對高的徑向強度、延展性和相關疲勞特性,這些特性通過任何額外的植入制造工藝得以保留。此外,浸涂聚合物基材還允許制造具有多層的基材。
聚合物的分子量通常是決定聚合物的機械性質的因素之一。隨著聚合物分子量的增加,通常存在由脆性破壞到延展破壞的轉變。延展性材料還具有相對較高的疲勞壽命。型芯可被用于澆鑄或浸涂聚合物基材。
在浸涂聚合物基材時,可以選擇一種或更多種具有高分子量的生物相容性和/或可生物吸收性聚合物以在型芯上成形。所述一種或更多種聚合物可以在一個或更多個相應容器中溶于相容的溶劑中,結果適當的溶液可被置于型芯之下。因為可以形成具有一層或更多層(彼此重疊)的基材,所以基材可被形成具有第一層的第一聚合物、第二層的第二聚合物等等,這取決于所需基材的結構和性質。因此,根據要在基材上形成的所需層,可以將各種溶液和容器在浸涂操作期間置于型芯之下,從而可將型芯順序浸入適當的聚合物溶液中。
可以控制諸如型芯浸漬次數、浸入的順序和方向、在溶液中每次浸漬的持續時間以及每次浸漬之間的延遲時間,或者各次浸漬間的干燥或固化時間以及型芯浸入溶液中和/或從溶液中抽取的速率的多個參數,以導致所需機械特性。與擠出或注塑形成的聚合物基材相比,經由浸涂工藝形成可以導致聚合物基材具有顯著更薄的壁厚,同時在基材中保持增加的強度水平。
各次浸漬間的浸漬時間以及干燥時間可以是相同的,或者它們可以根據所得基材的所需性質所確定的而發生變化。此外,在各次浸漬之間或在最終浸漬之后,可以將基材置于烘箱中或在環境溫度下干燥,從而獲得預定的晶體水平(例如20%至40%)和非晶聚合物結構水平(例如60%至80%)。在浸涂工藝期間,彼此重疊的各層彼此緊密粘附并且壁厚和各聚合物的機械性質在各層中得以保持,而對所用聚合物的分子量和/或結晶結構沒有限制。
浸涂可被用來使各層間取向(例如通過浸入導致線性取向;通過旋轉型芯導致徑向取向等待),從而進一步增強所形成基材的機械性質。因為徑向強度是支架設計的必要屬性,所以可以對所形成的基材進行后處理以賦予上述屬性。通常,聚合物支架具有壁相對較厚以補償徑向強度不足的缺點,這反過來降低了柔韌性,阻礙了通行并且植入之后即刻減小了動脈內腔面積。后處理也可以幫助防止材料蠕變和回縮(蠕變是,在應力下、通常在高溫下,在樣品上發生的時間依賴性永久變形),這些通常都是與聚合物支架相關的問題。
對于后處理,可以對基材施加預定量的作用力,其中這種作用力可由大量不同的方法產生。一種方法是利用置于基材中的可膨脹壓力容器。另一種方法是通過編織結構,例如由超彈性體或形狀記憶合金(如niti合金)制成的編織物,以增大尺寸并且對基材的內表面施加所需程度的作用力。
另一種方法可以通過在基材內腔中應用加壓的惰性氣體(諸如氮氣)來施加膨脹作用力。可以將完成的基材置于內徑比澆鑄圓筒要大的成型管內。將澆鑄圓筒的末端或末梢部分夾緊或以其他方式閉合,然后將壓力源連接到該澆鑄圓筒的近端。整個裝置可被置于會向澆鑄圓筒的一段或者向澆鑄圓筒的一部分施加熱量的噴嘴上方。澆鑄圓筒的直徑增加因而可以使澆鑄圓筒的分子取向重新排列,從而使其徑向強度增加。在直徑增大了之后,可以冷卻澆鑄圓筒。
一旦對聚合物基材的加工已經完成,就可以對基材進行進一步成形或機械加工,從而產生各種器械。一個實例包括,通過如下由澆鑄圓筒形成的支架:沿著澆鑄圓筒的長度切割,從而產生用于在患者脈管系統中輸送和鋪展的壓實的支架。另一個實例包括,機械加工多個部分,從而產生利于支架的壓縮和膨脹的格子結構或骨架結構。
在其他變化方式中,在形成支架時,基材可以如本文所述通過如下形成:將型芯至少浸漬到第一聚合物溶液中首先形成具有第一直徑的基材,使得至少第一層的生物相容性聚合物基材形成在所述型芯之上,并且具有由所述型芯所限定的第一直徑。在形成基材時,可以控制多個參數,諸如控制型芯浸漬到第一聚合物溶液中的次數、控制型芯每次浸漬的持續時間以及型芯每次浸漬間的延遲時間。隨著基材初始形成了,可以將基材的第一直徑減小至更小的第二直徑并將該基材加工形成被配置用于在脈管中輸送和鋪展的可膨脹支架骨架,其中所述支架骨架保留所述聚合物的一個或更多個機械性質,結果在施加負荷時所述支架骨架顯示延展性。
隨著支架骨架形成并被熱固定為具有初始直徑,可以將該支架骨架減小至第二輸送直徑,并將其放置在用于患者體內的血管內輸送的輸送導管上,使具有第二直徑的支架定位在脈管內的目標場所處;利用膨脹氣球或其他機構使支架在目標場所膨脹至比第二直徑要大(可能比初始直徑要小)的第三直徑;然后使支架在目標場所自膨脹至與脈管進一步接觸,結果該支架隨著時間自膨脹返回其初始直徑,或者自膨脹直到其被脈管壁限制無法進一步膨脹。
由于用于最終形成基材的獨特的加工方法(如本文所述),由基材加工的支架骨架可顯示出特定的機械特性,這取決于支架幾何形狀是如何構造的。這樣的支架骨架通常可以包括:多個周向支撐元件,其關于縱向軸線對準并且可以從低外形(lowprofile)徑向膨脹至膨脹外形;多個聯接元件,其以交替的方式與周向支撐元件聯接,使得聯接元件對準縱向軸線,其中,支架骨架由可生物吸收的聚合物構成,并且顯示出1.0-1.5n/mm的徑向強度、2%-5%的回縮率和0.5-1.5n的支架保持力。
用于形成基材(支架骨架由其加工制成)的可生物吸收聚合物的特征在于分子量為從259,000g/mol至2,120,000g/mol并且結晶度為20%至40%。具有這樣的特性,支架骨架可以形成為具有150μm(或在其他變型中為80μm、90μm或120μm)的壁厚和18mm的長度。支架骨架也可以形成為具有特定幾何尺寸,其與材料特性結合起來可以產生本文所討論的機械性能。
附圖說明
圖1示出不同分子量下的聚乳酸(plla)的應力-應變圖以及示出脆性斷裂至延展破壞的相應應力-應變數值。
圖2a示出浸涂機的實例,該浸涂機被用于形成沿著型芯形成的具有一層或更多層的聚合物基材。
圖2b和2c示出浸涂裝置的另一實例,這些裝置具有一個或更多個可鉸接的連接件以調節型芯的浸漬方向。
圖3a至3c各自示出沿著型芯形成的多層聚合物基材的一部分和所得基材的實例的局部剖視側視圖和端視圖。
圖4a示出通過浸涂工藝形成的各種聚合物基材樣品的所得應力-應變圖以及所得示出延展破壞的圖。
圖4b示出通過浸涂形成的另一樣品的應力-應變圖以及結合一層baso4的樣品的應力-應變圖。
圖4c示出形成有其他plla層的其他樣品的應力-應變圖。
圖4d示出plla8.28基材的詳細端面圖,該基材具有結合到該基材中的baso4層。
圖5a和5b示出經歷塑性變形的浸涂形成聚合物基材的示例的立體圖以及所得高伸長率。
圖6示出另一形成過程的示例,其中可以使所形成的聚合物基材在成型或成形管中膨脹,從而使該基材周向取向。
圖7示出另一形成過程的示例,其中可以使所形成的聚合物基材旋轉以產生周向取向的應力值,從而增大該基材的徑向強度。
圖8示出“y”形型芯的側視圖,該型芯被用于經由浸涂工藝形成雙叉支架。
圖9示出另一“y”形型芯的側視圖,該型芯被用于形成雙叉支架,其中各個二級分支構件彼此成角度。
圖10示出另一型芯的側視圖,該型芯限定用于形成具有帶角度的進出孔的支架的突出或凸起。
圖11示出另一型芯的側視圖,該型芯可被用于形成沿其長度逐漸縮小的支架。
圖12示出另一型芯的側視圖,該型芯限定用于形成具有可變壁厚的基材的凹陷或特征。
圖13示出一個壓實支架片實例的立體圖,該支架可以采用形成的聚合物基材形成。
圖14示出另一支架實例的側視圖,該支架通過任意工藝由所得聚合物基材加工形成。
圖15和16a分別示出支架設計的實例,這些實例被優化以利用所形成聚合物基材的固有性質。
圖16b進一步詳細地示出圍繞其膨脹結構的中心線張開的支架式樣。
圖17a至17f示出由聚合物基材形成的支架通過氣球膨脹輸送并開始鋪展,然后使該支架的直徑進一步自膨脹至其初始熱固定直徑的整個過程的側視圖。
具體實施方式
在由聚合物材料(諸如生物相容性和/或可生物降解聚合物)制造可植入器械中,可以利用本文所述的多種澆鑄工藝來開發具有相對高的幾何精度水平和機械強度水平的基材(例如圓筒形基材)。然后,利用任意工藝(例如高速激光源、機械加工等)可以將這些聚合物基材加工成具有各種用于植入患者(諸如外周或冠狀脈管系統)的幾何形狀的器械,諸如支架。
上述澆鑄工藝的實例是利用浸涂工藝。利用浸涂制造具有上述所需特性的聚合物基材會導致基材能夠保留原料的固有性質。這從而導致基材具有相對高的徑向強度,這個特性通過任何額外的植入制造工藝大部分得以保留。此外,浸涂聚合物基材還允許制造具有多層的基材。這些多層可由相同或類似的材料形成,或者它們可以被多樣化以包括任意個數的附加試劑,諸如一種或更多種用于治療脈管的藥物,如下詳述。此外,利用基材中的多層的多樣性允許控制各單層的其他參數、條件或范圍,諸如改變各層間的降解速率,同時在原料降解最少的情況下以高水平保持聚合物的固有分子量和機械強度。
因為通過澆鑄或浸涂工藝原料的分子量和機械強度得以保留,所以可以形成能夠制造具有低壁厚(這對于治療血管疾病來說是非常想要的)的器械的基材。此外,這些工藝可以制造在厚度、同軸度、直徑等方面具有精確幾何公差的結構。
一個機械性質,特別對于例如由聚合物基材形成的聚合物支架通常成問題的機械性質,是當器械在患者體內受到應力時經由該器械的脆性斷裂的破壞。通常希望聚合物支架在所施加的負荷下顯示延展破壞而非脆性斷裂,尤其在如上所述聚合物支架由膨脹氣球或限制鞘輸送并鋪展期間希望這樣。延展百分率(%)通常是在斷裂時已由材料維持的塑性變形度的量度。在斷裂時,經歷非常少或不經歷塑性變形的材料是脆的。
聚合物的分子量通常是決定聚合物的機械性質的因素之一。隨著聚合物分子量的增加,通常存在由脆性破壞到延展破壞的轉變。示例表示在應力-應變圖10中,該圖表示由分子量的增加所引起的不同機械性質。聚乳酸(plla)2.4樣品的應力-應變曲線12顯示在高拉伸應力水平下具有相對低拉伸應變百分率的破壞點18,這表示脆性破壞。較之plla2.4具有相對較高分子量的樣品plla4.3顯示應力-應變曲線14,其在屈服開始之后具有塑性破壞區20并且顯示在相對較高拉伸應變百分率下具有相對較低拉伸應力值的破壞點22,這表示延展度。屈服在材料開始偏離應力-應變曲線的線性部分并經歷彈性-塑性轉變時發生。
較之plla4.3具有還要更高分子量的樣品plla8.4顯示應力-應變曲線16,其在屈服開始之后具有較長的塑性破壞區24。破壞點26在相對較高的拉伸應變百分率下也具有相對較低的拉伸應力值,這表示延展度。因此,顯示相對高延展度的高強度管狀材料可以利用具有相對高分子量(例如plla8.4、具有8.28iv的plla等)的聚合物來制造。這種管狀材料可以通過任意機械加工工藝來進行加工,從而形成諸如支架的可植入器械,這些器械顯示與本文所述澆鑄或浸涂工藝相關的應力-應變曲線。所得器械可以進行相對高水平的應變,而不會斷裂。
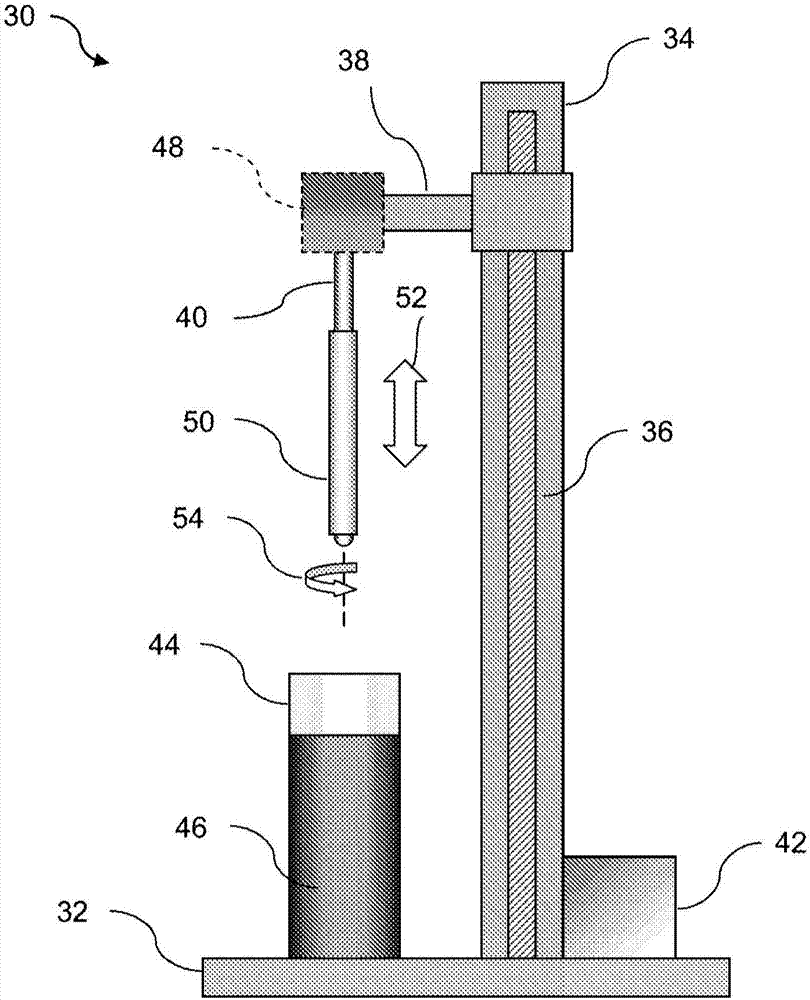
可被用于澆鑄或浸涂聚合物基材的型芯的示例表示在圖2a的側視圖中。通常,浸涂裝置30可以是會根據本文中的說明支持聚合物基材制造的任意結構。基座32可以支撐用于安放驅動柱36和托臂38的柱子34。馬達42可以垂直地沿著柱子34驅使驅動柱36,從而相應地使托臂38移動。型芯40可以附裝到容器44上方的托臂38上,該容器44可以裝滿聚合物溶液46(例如plla、pla、plga等),從而型芯40可以經由線性運動52浸入其中。一種或多種聚合物可以在一個或更多個相應的容器中溶于可相容的溶劑中,結果適當的溶液可被置于型芯40之下。可選的馬達48可以沿著托臂38或沿著裝置30的其他構件安裝,以使型芯40和沿著型芯40形成的基材50發生可選旋轉運動54,從而在浸涂工藝期間增加基材50的周向強度,以下進一步詳述。
裝置30可以單獨地放在減震臺上或隔震臺上,從而確保容器44中的液體表面保持完全靜止,以便采用每次沉積沿著型芯40和/或基材50形成的聚合物材料具有均勻的厚度。整個裝置30或者僅僅一部分裝置(諸如型芯40和聚合物溶液)可被置于諸如氮氣環境的惰性環境中,同時保持非常低的相對濕度(rh)(例如低于30%rh)和適當的浸漬溫度(例如比容器44中的溶劑的沸點低至少20℃),從而確保浸涂基材的各層之間適當結合。還可以沿著托臂38安裝多個型芯或將它們直接安裝到柱子34上。
可以利用各種干燥方法,例如在可控環境中的對流、紅外或者其他常規干燥技術,其中通常需要在可控環境中的技術,因為高溫、高濕度水平可以導致水解,從而在干燥期間影響基材的結晶度水平和機械性質。例如,pla8.4基材具有介于例如20%至40%之間、或者更具體介于27%至35%之間的結晶度水平,其在拉伸測試期間通常顯示良好的延展性。如果基材具有接近60%的結晶度(其通常是樹脂的結晶度),那么該基材通常顯示脆性破壞。
通常可以使用對流干燥來將基材均勻加熱并干燥至殘余溶劑水平例如小于100ppm,同時可以使用真空干燥和/或紅外干燥來縮短或減少10或至多40天的典型干燥時間,這取決于所用聚合物類型。可以使用紅外干燥,在高于內層干燥溫度的溫度下來干燥表面層,其中內層可以包含熱敏性藥物。在這種情況下,內層中的藥物免于在基質中降解。此外,如果使用具有不同玻璃化轉變溫度的不同聚合物,那么紅外干燥可以防止或抑制內層免于熱降解,而對于上述組合基材來說對流干燥可能不太好。通常,干燥溫度可以在比玻璃化轉變溫度低或高5℃至10℃。
型芯40可被制成適當的尺寸,并且限定橫截面幾何形狀,從而使基材50具有適當的形狀和尺寸。型芯40通常可以具有圓形橫截面,但是如果需要可以利用各種幾何形狀。在一個實例中,型芯40可以限定直徑在1mm至20mm范圍內的圓形幾何形狀,從而形成具有相應內徑的聚合物基材。此外,型芯40通常可由適于耐受浸涂工藝的各種材料制成,例如不銹鋼、銅、鋁、銀、黃銅、鎳、鈦等。浸入聚合物溶液中的型芯40的長度可選受例如50cm長度的限制,這樣確保了沿著型芯40的浸漬長度形成聚合物的均勻涂層,從而限制了在涂層工藝期間的重力效應。型芯40還可以由聚合物材料制成,所述聚合物材料是光滑的、堅固的,具有良好的尺寸穩定性,并且對于浸涂所用聚合物溶液具有化學耐受性,例如為含氟聚合物、聚縮醛、聚酯、聚酰胺、聚丙烯酸酯等。
或者,型芯40可由形狀記憶材料(諸如形狀記憶聚合物smp或形狀記憶合金)形成,從而通過在浸漬期間在型芯40中產生均勻管狀形式的臨時形狀來協助從型芯40取下基材50。附加地和/或可選地,smp層可被用作浸涂基材50的層。在干燥后,基材50和型芯40可以經受5至10℃的溫度變化t>tg,從而促使在型芯40中產生小于5%的微小變形,以協助基材50的取出,并且/或者使smp層分層,以進一步協助取出基材50。型芯40可以由各種形狀記憶合金(例如鎳-鈦)和各種smp構成,所述smp可以包括例如物理交聯的聚合物或化學交聯的聚合物等。物理交聯的聚合物的實例可以包括,具有離子或介晶組分的聚酰胺,其通過預聚物方法制成。還可以使用的其他嵌段共聚物可以包括,例如聚對苯二甲酸乙二醇酯(pet)和聚氧乙烯(peo)的嵌段共聚物、含有聚苯乙烯和聚(1,4-丁二烯)的嵌段共聚物、由聚(2-甲基-2-噁唑啉)和聚(四氫呋喃)制成的aba型三嵌段共聚物等等。
此外,型芯40可被制成其上形成有聚合物溶液的光滑表面。在其他變化方式中,型芯40可以限定被諸如聚四氟乙烯的材料涂布的表面,從而增強在其上形成的聚合物基材的取下。在其他變化方式中,型芯40可被配置以在其表面上(例如在整個長度上或者僅在其一部分表面上)限定任何個數的圖案,這些圖案可以在浸涂工藝期間被模制轉印到經浸涂基材管的第一層涂層的內表面上。這些圖案可以形成凸起或凹陷部分,以形成諸如棋盤格狀圖案、交叉陰影圖案、多坑圖案等的各種圖案,在器械植入患者中(例如植入3至9個月)這些圖案可以增強與周圍組織的內皮化。
型芯40浸入聚合物溶液46中的方向也可以在基材50的各層間發生變化或改變。在形成長度在例如1cm至40cm范圍內或更長的基材時,可以將基材50從型芯40上取下,并以相反方向重新布置到型芯40上,然后繼續浸漬工藝。或者,在浸漬工藝期間或之前,可以使型芯40相對于托臂38和/或聚合物溶液46成角度。
這也可以通過利用圖2b和2c中所示的浸漬裝置以其他變化方式完成,從而每次浸漬在所形成基材50的整個長度上獲得均勻的壁厚。例如,以第一浸漬方向形成1至3個涂層后,可以采用與第一浸漬方向相反的第二方向(例如使型芯40與第一浸漬方向成至多180°)浸漬型芯40從而在初始層上形成其他層。這在一個實例中通過使用一個或更多個連接型芯40和托臂38的所示樞轉連接件56、58來實現。如圖2b所示,為了涂布初始基材50層,所述一個或更多個連接件56、58可以使型芯40保持在相對于溶液46的第一垂直位置。然后,可以驅動連接件56、58,從而使型芯40由其第一垂直位置重新裝配至與該第一垂直位置相反的第二垂直位置,如圖2c中的方向59所指明的。隨著型芯40重新定位的完成,可以通過如下重新開始浸漬工藝:與型芯40和基材50一起浸漬整個連接裝置。以這種方法,既不需要取出型芯,也不需要取出基材,從而減少了污染風險。連接件56、58可以包含任意個數的以機械方式或電動機械方式樞轉的和/或旋轉的結構,如本領域所知曉的。
以不同方向浸漬型芯40和基材50還可以使被涂層從其近端到其遠端具有均勻的厚度,從而有助于補償在涂布工藝期間的重力效應。這些評價往往是說明性的,因而并不意欲以任何方式造成限定。連接件56、58上的任何過量的浸涂層可以通過將其破壞而簡單地從型芯40中取下。交替的浸漬方向還導致聚合物交替取向,這樣可以增強浸涂管狀基材50在軸向方向上的拉伸強度。
采用浸涂裝置30,可以選擇一種或更多種高分子量生物相容性和/或可生物吸收性聚合物用于在型芯40上的成形。可被用于形成聚合物基材的聚合物實例可以包括,但不限于,聚乙烯、聚碳酸酯、聚酰胺、聚酯酰胺、聚醚醚酮、聚縮醛、聚縮酮、聚氨酯、聚烯烴或聚對苯二甲酸乙二醇酯,和可降解聚合物,例如聚丙交酯(pla),包括聚-l-丙交酯(plla)、聚(dl-丙交酯)、聚乙交酯(pga)、聚(丙交酯-共-乙交酯)(plga)或聚己內酯、己內酯、聚二氧雜環己酮、聚酸酐、聚原碳酸酯、聚磷腈、殼質、殼聚糖、聚(氨基酸)和聚原酯、及其共聚物、三元共聚物、組合和混合物。
適當聚合物的其他實例可以包括合成聚合物,例如低聚物、均聚物和共聚物,丙烯酸類,諸如由如下聚合而成的那些聚合物:丙烯酸甲酯、甲基丙烯酸甲酯、丙烯酸、甲基丙烯酸、丙烯酰胺、丙烯酸羥乙酯、甲基丙烯酸羥乙酯、丙烯酸甘油酯、甲基丙烯酸甘油酯、甲基丙烯酰胺、乙基丙烯酰胺;乙烯類,諸如苯乙烯、氯乙烯、乙烯基吡咯烷酮、聚乙烯醇、醋酸乙烯酯;由乙烯、丙烯和四氟乙烯形成的聚合物。其他實例可以包括尼龍,諸如聚己內酰胺、聚月桂基內酰胺、聚六亞甲基己二酰胺、聚六亞甲基十二烷基二酰胺,還包括聚氨酯、聚碳酸酯、聚酰胺、聚砜、聚(對苯二甲酸乙二醇酯)、聚乳酸、聚乙醇酸、聚二甲基硅氧烷和聚醚酮。
可用于浸涂工藝的可生物降解聚合物的實例是,聚丙交酯(pla),聚乙交酯(pga)、聚(丙交酯-共-乙交酯)(plga)、聚(ε-己內酯)、聚二氧雜環己酮、聚酸酐、三亞甲基碳酸酯、聚(β-羥基丁酸酯)、聚(g-谷氨酸乙酯)、聚(dth亞氨基碳酸酯)、聚(雙酚a亞氨基碳酸酯)、聚(原酯)、聚氰基丙烯酸酯和聚磷腈、及其共聚物、三元共聚物、組合和混合物。還具有大量由天然原料衍生的可生物降解聚合物,諸如經修飾的多糖(纖維素、殼質、殼聚糖、右旋糖苷)或經修飾的蛋白質(纖維蛋白、酪蛋白)。
適當聚合物的其他實例可以包括合成聚合物,例如低聚物、均聚物和共聚物,丙烯酸類,諸如由如下聚合而成的那些聚合物:丙烯酸甲酯、甲基丙烯酸甲酯、丙烯酸、甲基丙烯酸、丙烯酰胺、丙烯酸羥乙酯、甲基丙烯酸羥乙酯、丙烯酸甘油酯、甲基丙烯酸甘油酯、甲基丙烯酰胺、乙基丙烯酰胺;乙烯類,諸如苯乙烯、氯乙烯、乙烯基吡咯烷酮、聚乙烯醇、醋酸乙烯酯;由乙烯、丙烯和四氟乙烯形成的聚合物。其他實例可以包括尼龍,諸如聚己內酰胺、聚月桂基內酰胺、聚六亞甲基己二酰胺、聚六亞甲基十二烷基二酰胺,還包括聚氨酯、聚碳酸酯、聚酰胺、聚砜、聚(對苯二甲酸乙二醇酯)、聚縮醛、聚縮酮、聚二甲基硅氧烷和聚醚酮。
可被用于形成基材的這些聚合物實例并非意欲限制或窮舉,僅意欲說明可以使用的可能聚合物。因為可以形成具有一層或更多層(彼此重疊)的基材,所以基材可被形成具有第一層的第一聚合物、第二層的第二聚合物等等,這取決于所需基材的結構和性質。因此,根據要在基材上形成的所需層,可以將各種溶液和容器在浸涂操作期間置于型芯40之下,從而可將型芯40順序浸入適當的聚合物溶液中。
根據需要的所形成基材的壁厚,可以將型芯40浸入適當的溶液中,這由型芯40的浸漬次數、在溶液中每次浸漬的持續時間以及每次浸漬之間的延遲時間或者浸漬之間的干燥或固化時間來決定。此外,還可以將諸如型芯40進入聚合物溶液的浸入速度和/或離開聚合物溶液的抽取速度的參數控制在例如5mm/min至1000mm/min的范圍內。與擠出的聚合物基材相比,經由浸涂工藝形成可以導致聚合物基材具有一半的壁厚,同時基材保持增加的強度水平。例如,為了形成壁厚例如200μm的基材(由多層聚乳酸的構成),可以將型芯40浸入聚合物溶液中例如2至20次,其中浸漬時間在例如15秒(或更短)至240分鐘(或更長)的范圍內。此外,基材和型芯40在每次浸漬之間可選被干燥或固化一段時間,在例如15秒(或更短)至60分鐘(或更長)的范圍內。這些數值意欲說明,并非意欲以任何方式進行限制。
除了利用分子量相對較高的材料以外,為了進一步提高材料的延展性可以考慮的另一參數是其結晶度,結晶度至聚合物中的結構有序程度。上述聚合物可以包含結晶區和非結晶區的混合物,其中降低聚合物中結晶區的百分率可以進一步提高材料的延展性。可以將不僅具有相對高分子量而且具有相對低結晶百分率的聚合物材料用在本文所述方法中,以形成所需要的管狀基材。
下表1示出了各種聚合物材料(例如pllaiv8.28和pdlla96/4)的實例,來說明材料的分子量及其各自結晶百分率的比較關系。還給出了玻璃化轉變溫度tg,以及熔融溫度tm。示出了pllaiv8.28實例,表明原料樹脂和管子形式具有相同的分子量mw,1.70x106克/mol。然而,pllaiv8.28樹脂的結晶百分率為61.90%,而相應管子形式為38.40%。同樣對于pdlla96/4,樹脂形式和管子形式都具有9.80x105克/mol的分子量mw,然而結晶百分率分別為46.20%和20.90%。
表1.各種聚合物材料及其各自的結晶百分率
當通過本文所述方法浸涂樹脂以形成管狀基材時,干燥過程以及加工步驟幫助聚合物從原料到整個加工至基材和支架的形成都保持相對高的分子量。此外,干燥工藝特別利于形成所需結晶百分率,如上所述。此外,每層以及整個結構中的分子量和結晶百分率(它們限定基材的強度)都是均勻的,從而產生了具有各向同性性質的基材。
所得基材以及由該基材形成的支架通常在所有方向上都具有等同的強度。例如,所得支架可以顯示與該支架的軸向強度或切向強度相同的徑向強度。這個特點允許基材和支架能應付在任意角度由周圍組織所賦予的負荷。這在諸如下肢股淺動脈(sfa)的外周脈管中可能是特別需要的,其中植入支架需要能夠抵抗復雜的、多軸向的負荷條件。因為管狀聚合物結構中的強度通常是有方向的并且在支架的情況下,所以徑向強度通常高于軸向和切向方向的相對強度。因此,起始聚合物分子量的保持幫助支架在所有方向都具有等同的強度。
各向同性性質不能通過諸如注塑、擠出和吹塑的工藝實現。注塑和擠出工藝引起軸向強度,而吹塑工藝引起周向取向。結果,利用這些工藝制造的支架具有優先的軸向取向強度。在一些支架設計中,各向同性材料的特性是有利的,因為這種材料的變形更加可以預期并且由這種基材產生的假體在負荷條件下具有更均勻的應力分布。
除了材料的結晶度以外,各次浸漬間的浸漬時間以及干燥時間可以是相同的,或者它們可以通過所得基材的所需性質來確定發生變化。此外,在各次浸漬之間或在最終浸漬之后,可以將基材置于烘箱中或在環境溫度下干燥,從而獲得預定的晶體水平(例如20%至40%)和非晶聚合物結構水平(例如60%至80%)。在浸涂工藝期間,彼此重疊的各層彼此緊密粘附并且各聚合物的機械性質在各層中得以保持,而對所用聚合物的分子量沒有限制。浸涂工藝還允許操作員來控制管狀結構的分子量和結晶度,這些管狀結構是所得假體的基礎。根據所選擇的分子量和結晶度組合,所得假體能夠提供較高徑向強度(例如,在20%壓縮下10n/1cm長度),能夠抵抗相當大的應變而未斷裂(例如150%應變),并且在生理學條件下能夠顯示較長的疲勞壽命(例如在徑向脈沖負荷下1千萬次循環)。
材料干燥條件的改變也可以被控制,從而實現所需材料參數。聚合物可以在各個聚合物的玻璃化轉變溫度下或者在高于各個聚合物的玻璃化轉變溫度(例如比玻璃化轉變溫度tg高10至20℃)下進行干燥,以從聚合物中有效去除任意殘留的溶劑,從而達到小于100ppm(例如介于20至100ppm)的殘余水平。干燥時,聚合物基材的布置是可被控制以影響管子參數(諸如幾何形狀)的另一因素。例如,可以將聚合物基材保持在干燥位置,使得該基材管保持相對于地面垂直,從而該管的同心度得以保持。如上所述,聚合物管子可以在烘箱中在玻璃化轉變溫度下或者在高于玻璃化轉變溫度下干燥一段時間,例如從10天至30天或更長。然而,干燥時間長(例如大于40天)可能導致聚合物材料熱降解。
附加地和/或可選地,在基材的干燥期間可能在聚合物中引起形狀記憶效應。例如,可以在聚合物管件中引起形狀記憶效應,從而以浸涂工藝期間形成的直徑設定管子形狀。這個示例是通過如下形成聚合物管子:以5mm的外徑進行本文所述的浸涂工藝,然后使基材經受比其玻璃化轉變溫度tg要高的溫度。在升高的溫度下,基材可以被拉長,例如長度從5cm至7cm;而其外徑由5mm縮小至3mm。當然,這些實例僅僅是說明性的,初始直徑通常可以在例如3mm至10mm的范圍內,減小的直徑通常在例如1.5mm至5mm的范圍內,只要減小的直徑小于初始直徑即可。
一旦被拉長了并且直徑縮小了,就可以進行淬火或冷卻使基材的溫度低于tg水平,例如比其tg低約20℃,從而使聚合物基材轉變回玻璃態。這有效地使基材的初始直徑具有自膨脹的形狀記憶效應。當使這種管子(或由管狀基材形成的支架)壓縮或膨脹至更小或更大直徑,然后暴露于升高的溫度時,隨著時間該管子(或支架)可以回復其初始5mm直徑。這種后加工還可用于使基材在諸如激光切割(例如當形成用于植入患者的支架或其他器械時)的工藝后發生自膨脹,這種激光切割工藝中,基材管子通常被加熱至其玻璃化轉變溫度tg。
具有多層的基材的實例表示在圖3a和3b中,其示出了沿著型芯40形成的多層聚合物基材的一部分和所得基材的實例的局部剖視側視圖。可以沿著型芯40形成基材50中由第一聚合物(例如聚(l-丙交酯))形成的第一層60。在第一層60形成后,可選的聚合物(例如聚(l-丙交酯-共-乙交酯))的第二層62可以形成在第一層60上。另一可選的聚合物(例如聚(d,l-丙交酯-共-乙交酯))的第三層64可以形成在第二層62上,從而形成限定內腔66的所得基材,該基材可被進一步加工形成任意器械,諸如支架。各層中的一層或更多層可被形成以特定速率降解或者洗脫任意藥物或試劑。
這個實例表示在圖3c的剖視端視圖中,其示出了如上所述具有三層60、62、64(彼此疊加)的示例性基材。在這個實例中,第一層60可以具有分子量mn1,第二層62可以具有分子量mn2,第三層64可以具有分子量mn3。可以形成由該管子制造的支架,使得相對分子量為mn1>mn2>mn3,從而沿著管子的厚度實現優先的層-層降解,其中該支架當在患者體內鋪展時降解從內部第一層60開始,最終降解到中間第二層62,最后到外部第三層64。或者,可以這樣制造支架,其中相對分子量是mn1<mn2<mn3,從而實現從外部第三層64開始并向著內部第一層60降解的層-層降解。這個實例意欲說明,少于三層或多于三層都可用在其他實例中。附加地,如果需要,各層的分子量在其他實例中也可以變化,從而使降解速率沿著不同層發生變化。
例如,還可以設計不同層的分子量,例如當外部第一層(具有最低的分子量mn1)降解至某一水平時,形成了大量低聚物或單體,并且由于這些低分子量降解產物擴散到各層中而使各層的降解速率加速。通過選擇用于形成這個外部層組合物的不同聚合物,可以設計引起其他層發生上述加速降解所需要的時間。例如,任意層(諸如外部層或內部層)可以是50%pla/50%pga的共聚物,其中pga的降解速率比pla的降解速率更快。因此,由這種共聚物形成的層可以使pga降解得比pla更快,這返回來促進了pla本身的降解。可供選擇地或附加地,一個層諸如外部層可由上述共聚物形成,其中外部層中pga的降解不僅可以加速外部層,也可以加速內部層。還可以實現其他變化,這取決于所需降解速率和不同層間的降解次序。
此外,各層中的任意一層或多層可被形成以賦予基材50特定的機械性質,結果所得基材50的復合機械性質可被具體調節或設計。此外,盡管在該實施例中表示三層,但是可以使用任意個數的層,這取決于基材50的所需機械性質。
此外,在形成聚合物基材時多層可以彼此重疊,所以基材中的指定各層可被指定用于特殊功能。例如,在被用于制造聚合物支架的基材中,可以將一層或更多層設計為承重層,從而為支架提供結構完整性;同時其他各層可被分配用于藥物加載或洗脫。那些被指定用于結構支撐的各層可以由高分子量聚合物(例如plla或本文所述的任意其他適當聚合物)形成,從而通過省略任何藥物來提供高強度,這是因為某些藥物試劑可以不利地影響聚合物的機械性質。那些被指定用于藥物加載的各層可以置于結構層之中、之上或之間。
利用層特異性基材的示例可以包括,結合一個或更多個可被用于減少與假體內層的血液反應(諸如血栓形成)風險的生物有益層。具有代表性的生物有益材料包括,但不限于,聚醚(諸如聚(乙二醇)),共聚(醚-酯)(例如peo/pla),聚亞烷基氧(諸如聚(亞乙基氧)、聚(亞丙基氧)),聚(醚酯),聚草酸亞烷基酯,聚磷腈,磷酰膽堿,膽堿,聚(阿司匹林),下述單體的聚合物和共聚物:含羥基單體,諸如甲基丙烯酸羥乙酯(hema)、甲基丙烯酸羥丙酯(hpma)、羥丙基甲基丙烯酰胺,聚(乙二醇)丙烯酸酯(pega)、peg甲基丙烯酸酯、2-甲基丙烯酰氧乙基磷酰膽堿(mpc)和n-乙烯基吡咯烷酮(vp),含有羧酸的單體,諸如甲基丙烯酸(ma)、丙烯酸(aa),烷氧基甲基丙烯酸酯,烷氧基丙烯酸酯和3-三甲基硅烷基丙基甲基丙烯酸酯(tmspma),聚(苯乙烯-異戊二烯-苯乙烯)-peg(sis-peg),聚苯乙烯-peg,聚丁二烯-peg,聚己內酯-peg(pcl-peg),pla-peg,聚(甲基丙烯酸甲酯)-peg(pmma-peg),聚二甲基硅氧烷-共-peg(pdms-peg),聚(偏氟乙烯)-peg(pvdf-peg),pluronictm表面活性劑(聚亞丙基氧-共-聚乙二醇),聚(四亞甲基二醇),羥基官能聚(乙烯基吡咯烷酮),諸如纖維蛋白、纖維蛋白原、纖維素、淀粉、膠原蛋白、葡聚糖、糊精、透明質酸的分子,透明質酸的片段和衍生物,肝素,肝素的片段和衍生物,葡糖苷聚糖(gag),gag衍生物,多糖,彈性蛋白,殼聚糖,海藻酸,硅酮,polyactive,及其組合。在一些實施方式中,本文所述涂層可以不包括上述聚合物中任意一種。術語polyactive指具有柔性聚(乙二醇)和聚(對苯二甲酸丁二醇酯)片段的嵌段共聚物(pegt/pbt)。polyactive意欲包括具有peg和pbt片段的ab、aba、bab共聚物(例如聚(乙二醇)-嵌段-聚(對苯二甲酸丁二醇酯)-嵌段-聚(乙二醇)(peg-pbt-peg)。
在另一變化方式中,生物有益材料可以是聚醚,諸如聚(乙二醇)(peg)或聚亞烷基氧。可被用于吸引內皮細胞的生物有益聚合物還被涂作這個第一層。這些聚合物,諸如no生成聚合物,可以利用如下策略合成:(1)分散非共價結合小分子,其中二醇二氮烯鎓(diazeniumdiolate)基連接到小分子量化合物中的胺上;(2)使二醇二氮烯鎓基共價結合到懸掛的聚合物側鏈上;和(3)使二醇二氮烯鎓基直接共價結合到聚合物主鏈上。上述聚合物可以使用二乙基胺(dea/n2o2)和二醇二氮烯鎓化的精胺作為混入聚(乙二醇)(peg)和聚己內酯中的非共價結合物質,將二亞丙基三胺接枝到多糖上,并且通過用no處理聚乙烯亞胺(pei),從而形成直接共價連接到聚合物主鏈上的二醇二氮烯鎓no供體,以及4)已經被用于開發釋放no聚合物的no-供體為s-亞硝基硫醇(rsno)(frostetal.,biomaterials,2005,26(14),第1685頁)。
在另一實例中,相對高分子量plla的“骨架”層,即向假體提供結構強度的那層,可以與一層或更多層其他類型的聚合物材料層耦合,所述其他類型的聚合物材料諸如為聚-ε-己內酯(pcl)或pcl共聚物。骨架層可以提供強度,而pcl層向假體提供總體延展性。各層的組合會提供具有高強度和延展性的結構。當然,各種材料也可以進行其他組合,這取決于所需要得到的特性。例如,另一實例可以包括這樣的假體,這種假體具有由pcl或其他彈性聚合物制成的具有相對高摩擦系數的內層。在這種假體被最終壓接在血管內輸送氣球上的情況下,這個相對高摩擦的內層可以防止或抑制假體相對充氣球橫向移動,從而增大了在輸送器械上的支架保持力。
附加地,可以在各層中加載有不同藥物的多層。由多層的藥物釋放方式和速率至少部分取決于基材材料的降解速率。例如,相對快速降解的聚合物可以使它們的藥物以逐層釋放,因為每個連續層會降解以使鄰近的下層暴露。在其他變化方式中,藥物釋放通常可以經由擴散和降解的組合由多層基質中發生。在一個實例中,在植入后,第一層可以例如在頭30至40天洗脫第一藥物。一旦第一層已經耗盡或降解了,如果需要,那么具有第二藥物的下部第二層接下來可以釋放這種藥物30至40天等。在圖3b的實例中,對于由基材50制造的支架(或其他可植入器械),層64可以包含第一藥物用于釋放,而層62可以包含第二藥物用于在層64耗盡或降解后釋放。下層60可以省略任何藥物試劑,從而為整個結構提供未受損害的結構支撐。
在其他實例中,并非使各連續層洗脫各自的藥物,而是各層62,64(還可選層60)可以經由擴散和降解的組合同時或以不同速率洗脫各自的藥物。盡管在該實施例中表示三層,但是可以使用具有任何適用組合藥物的任意層來輸送。此外,每種藥物由各層的釋放動力學可以通過改變含藥層的配方以各種方式發生變化。
可以加載到基材50的某些層中的藥物或試劑的示例可以包括一種或多種抗增生試劑、抗腫瘤試劑、抗原試劑、抗發炎試劑、抗再狹窄試劑。治療試劑還可以包括抗脂質試劑、抗分裂試劑、金屬蛋白酶抑制劑和抗硬化試劑。治療試劑還可以包括多肽、酶、射線同位素或用于各種治療選擇的試劑。這個藥物或試劑列表是說明性的,但并不意欲限制。
類似地,某些其他層可以加載不透輻射物質,諸如鉑、金等,以使支架在成像設備(諸如熒光成像)下可見。不透輻射物質(如鎢、鉑、金等)可以與聚合物溶液混合并被浸涂到基材上,結果不透輻射物質在基材上形成亞微米厚的薄層。不透輻射的物質由此可被包埋在會在降解的最終階段中降解的層中,或者被包埋在結構層中以便支架在植入器械完全降解或損失其機械強度之前的使用壽命內在成像設備下可見。不透輻射的標記層還可以被浸涂在基材50的一端或兩端,例如從各端起至多0.5mm。此外,當要沿著基材50長度的任何部分形成任意形式的不透輻射物質時,可以沿著基質50中近端與遠端之間的一部分通過旋轉型芯40以徑向方向噴涂或澆鑄不透輻射物質。具有不透輻射標記物的聚合物環也可以形成作為基材50結構的一部分。
在機械性質的延展性和保持力的實驗實例中,得到iv8.4的plla(高分子量),并且利用本文所述的浸涂工藝制造管狀基材。樣品被形成具有5mm的直徑和200μm的壁厚,并且由6層plla8.4構成。型芯浸漬到聚合物溶液中6次,然后將基材在烘箱中干燥并固化,從而得到60%的結晶結構。使管狀基材的至少兩個樣品進行拉伸測試,由應力-應變測試得到應力-應變圖70,如圖4a所示。
如圖70所示,plla8.4的第一個樣品產生具有塑性破壞區域76的應力-應變曲線72,其中,破壞前,應變百分率在相對恒定的應力值下增加,這表明良好的樣品延展度。plla8.4的第二樣品也產生具有相對較大塑性破壞區域78的應力應變曲線74,這也表明良好的樣品延展度。
聚合物支架以及由這種基材制成的其他可植入器械因此可以保留來自浸涂聚合物材料的材料性質。例如,所得支架可以具有如下機械性質:在徑向、扭轉方向和/或軸向方向具有相對高的延展百分率。這個的實例是這樣的支架,該支架當被置于外部負荷下能夠經歷5%至70%的直徑減小,而沒有任何塑性變形。上述支架在20%變形下還顯示例如0.1n至5n/cm長度的高徑向強度。這種支架也可被構造成當被暴露于正常體溫下時自膨脹。
支架還可以顯示其他特有的機械性質,這些機械性質與如本文所述形成的基材諸如高延展性和高強度的聚合物基材相一致。這種基材(以及加工成的支架)可以顯示額外的特性,諸如當被置于壓縮負荷下時直徑的減小百分率介于5%至70%之間,而沒有斷裂形成;以及當被置于軸向負荷下時軸向長度的減小百分率介于10%至50%之間,而沒有斷裂形成。由于相對高的延展性,所以基材或支架還適于圍繞約1cm曲率半徑彎曲至多180°,而沒有斷裂形成或破壞。此外,支架當在脈管中鋪展時還可以例如通過可膨脹血管內氣球膨脹至多5%至80%以恢復直徑,而沒有斷裂形成或破壞。
這些數值意欲說明可以如何配置聚合物管狀基材和所得支架以得到具有某些機械性質的器械的實例。此外,根據所需結構,還可以通過如下針對各種結構定位件在患者體內的特殊要求設計某些管子和支架:改變聚合物和/或共聚物共混物,以調節諸如強度、延展性、降解速率等的各種性質。
圖4b表示采用其他聚合物由應力-應變測試得到的其他結果圖71。plla8.28的樣品利用本文所述方法形成,并進行測試,從而形成具有破壞點73’的應力-應變曲線73。還形成plla8.28的其他樣品并對其進行測試,各樣品具有額外的baso4層,從而使管狀基材具有不透射線性。具有baso4層的第一個plla8.28樣品產生具有破壞點77’的應力-應變曲線77。具有baso4層的第二個plla8.28樣品也產生具有破壞點79’的應力-應變曲線79,這表明較之第一個樣品采用略微較高的拉伸應力水平拉伸應變更大。具有baso4層的第三個plla8.28樣品產生具有破壞點81’的應力-應變曲線81,其也大于第二個樣品的拉伸應變,但未明顯高于所述拉伸應力水平。包含baso4因此可以改善聚合物基材的彈性模量值。plla8.28的樣品在材料破壞時通常具有100n至300n的負荷,這產生了1000至30000mpa的彈性模量值以及在破壞時產生10%至300%的伸長百分率。
還形成96/4pdlla的樣品并對其進行測試,從而產生具有破壞點75’的應力-應變曲線75,這顯示相對較低百分率的伸長特性,即脆性斷裂。破壞時所得負荷為100n至300n,其中彈性模量介于1000至3000mpa之間,這與plla8.28樣品類似。但是,破壞時的伸長百分率介于10%至40%之間。
在機械性質的延展性和保持力的另一實驗實例中,得到iv8.28的plla(高分子量),并且利用本文所述的浸涂工藝制造管狀基材。樣品被形成具有5mm的直徑和200μm的壁厚,并且由8層plla8.28構成。型芯浸漬到聚合物溶液中8次,然后將基材在烘箱中干燥或固化,從而得到20%至35%的結晶結構。使管狀基材的至少四個樣品進行拉伸測試,由應力-應變測試得到應力-應變圖91,如圖4c所示。以下表2表示所得到的四個樣品的應力-應變參數以及平均結果(avg.)和偏差值(dev.)。
表2.plla8.28的應力-應變結果
plla8.28的樣品當被置于73至77mpa的應力負荷下在破壞時通常導致97%至123%的伸長百分率。如圖4c的圖表所示,plla8.28的第一個樣品(表2中的樣品no.1)產生具有塑性破壞區93’的應力應變曲線93,其中破壞前應變百分率在相對恒定的應力值下增加,這表明了良好的樣品延展度。plla8.28的第二個樣品(表2中的樣品no.2)也產生具有相對較小塑性破壞區95’的應力-應變曲線95,這也表明了良好的樣品延展度。還示出了具有其他樣品(表2中的樣品no.3和no.4),這些樣品具有相應的應力-應變曲線97,99和以及它們相應的塑性破壞區97’,99’。
圖4d表示經由本文所述方法形成有多層浸涂層的plla8.28基材83的詳細端視圖的示例,該圖在掃描電子顯微鏡下觀測。這個變化具有摻入基材中的baso4層85。如上所述,可選將一層或更多層baso4摻入基材83中,從而改善所形成基材的彈性模量,并且提供不透射線性。此外,彼此重疊的各層在本文所述浸漬工藝期間由于干燥工藝而熔合形成單一的內聚層而非多個單層。這導致一元結構,從而進一步防止或者抑制在各單層之間出現分層。
圖5a和5b表示在拉伸測試系統80上進行應力-應變測試的樣品之一的立體圖。聚合物基材樣品86如上所述被形成在型芯上從而形成管狀結構,并被固定到測試平臺82、84。隨著測試平臺82、84施加拉伸負荷,基材樣品86被拉伸直到破壞。被拉伸的伸長區域88顯示相對高的伸長百分率,這表明與擠出聚合物基材相比塑性變形相對較高。因為經由上述浸涂形成的聚合物基材的直徑通過塑性變形可能會減小而不會破壞,所以可以由單一直徑的基材管子制造若干不同的支架直徑。
浸涂可被用來使各層間取向(例如通過浸入導致線性取向;通過旋轉型芯導致徑向取向等等),從而進一步增強所形成基材的機械性質。因為徑向強度是支架設計的必要屬性,所以可以對所形成的基材進行后處理以賦予上述屬性。通常,聚合物支架存在具有相對較厚的壁以補償徑向強度不足的問題,這反過來降低了柔韌性,阻礙了通行(navigation)并且在植入之后即刻減小了動脈內腔面積。后處理也可以幫助防止材料蠕變和回縮(蠕變是,在應力下、通常在高溫下,在樣品上發生的時間依賴性永久變形),這些通常都是與聚合物支架相關的問題。通過使用在例如259,000g/mol至2,120,000g/mol范圍內的相對高分子量并且控制諸如速度和溫度的浸漬參數以及干燥條件,浸漬的基材將具有如下所需性質:(1)高徑向強度;(2)延展性;(3)韌性;和(4)各向同性。
為了進一步增強聚合物基材的徑向強度或周向強度,可以在浸涂步驟完成之后(或接近完成)之后對基材應用多個額外工藝。非晶形或部分非晶形聚合物當通過特定溫度(被稱為玻璃化轉變溫度tg)變化時通常經歷由柔韌的、彈性狀態(在較高溫度下)到易碎的玻璃態(在較低溫度下)的變化。對于特定聚合物而言,玻璃化轉變溫度將變化,這取決于側鏈的尺寸和柔性,以及主鏈連接鍵的柔韌性和結合到聚合物主鏈上的官能團的尺寸。低于tg,聚合物將保持一些柔韌性并且可以變形成新的形狀。然而,當聚合物變形時溫度比tg低得越多,使其成型所需要的作用力就越大。
此外,當聚合物處于玻璃化轉變溫度時,可以控制其分子結構,從而以所需方向形成取向。誘導聚合物鏈排列或取向會改善該材料的機械性質和行為。在聚合物處于柔順的、彈性狀態時,通常通過施加作用力來賦予分子取向。在引起充分取向之后,降低聚合物的溫度以防取向的反轉、消失。
在一個實例中,可以將聚合物基材加熱至等于或高于該聚合物tg的溫度,從而提高該基材的整個長度或所選擇部分的溫度。例如,對于由plla制造的基材而言,可以將該基材加熱至60至70℃的溫度。一旦基材已經達到足夠高的溫度結果足夠多的其分子已經發生移動,就可以在基材內部或者沿著部分基材施加作用力長達固定增加的直徑所必需的時間段,從而使其直徑由第一直徑d1增大至第二增大直徑d2。在這個固定時間段內,作用力的施加引起在圓周方向上的分子取向,以使聚合物鏈的分子取向排列,從而增強了其機械性質。然后,重新成形的基材可以例如通過將管子通過冷環境(通常為干燥空氣或惰性氣體)來冷卻至通常低于tg的較低溫度,從而保持直徑d2下的形狀并且防止分子取向消失。
對基材施加的作用力可由大量不同的方法產生。一種方法是利用置于基材中的可膨脹壓力容器。另一種方法是通過編織結構,例如由超彈性體或形狀記憶合金(如niti合金)制成的編織物,以增大尺寸并且對基材的內表面施加所需程度的作用力。
另一種方法可以通過在基材內腔中應用加壓的惰性氣體(諸如氮氣)來施加膨脹作用力,如圖6所示,從而在基材中賦予周向取向。可以將完整的基材(例如澆鑄圓筒94)置于內徑比該澆鑄圓筒94要大的成型管90內。成型管90可由玻璃、高拋光金屬或聚合物制造。此外,可以制造具有緊密公差的成型管90,從而允許對澆鑄圓筒94進行精密定徑。
將澆鑄圓筒94的末端或末梢部分夾緊96或以其他方式閉合,然后將壓力源連接到該澆鑄圓筒94的近端98。整個裝置可被置于會向澆鑄圓筒94的一段或者向澆鑄圓筒94的一部分施加熱量104的噴嘴102上方。可以將加壓的惰性氣體100(例如被加壓至10至400psi)引入澆鑄圓筒94中,從而使其直徑(例如2mm)增大至成型管90的內徑(例如4mm)。澆鑄圓筒94的直徑增加因而可以使澆鑄圓筒94的分子取向重新排列,從而使其徑向強度增加,并且在澆鑄圓筒94中賦予周向取向。部分92以夸張的方式表示了澆鑄圓筒94相對于成型管90的內表面的徑向膨脹,從而說明徑向膨脹和周向強度的獲得。在直徑增大之后,可以如上所述冷卻澆鑄圓筒94。
一旦基材已經形成并且其直徑被減小至較小的第二直徑,就可以如上所述加工支架。或者,支架可以在初次形成之后由基材進行加工。然后支架本身的直徑可被減小至第二減小直徑。
在任一種情況下,一旦支架已被形成其第二減小直徑,就可以將該支架輸送至患者脈管內的目標場所。輸送可以利用已知技術采用布置在例如用于血管內輸送的充氣氣球上具有減小的第二輸送直徑的支架在血管內實現。一旦充氣導管和支架已經鄰近脈管的目標區域,那么就可以使支架開始膨脹至與脈管的內表面接觸。
隨著支架以大于所述第二輸送直徑的第三直徑膨脹至與脈管壁接觸,就可以將充氣球從支架中取出。隨著預定的時間段和給定的支架的結構特征,該支架然后還可以進一步膨脹至與脈管壁接觸,從而確保布置和定位。
因為諸如plla的熱塑性聚合物當被加熱至通常變軟,所以澆鑄圓筒94或一部分澆鑄圓筒94可以在惰性環境(例如氮氣環境)中被加熱,從而使其降解最小化。
后加工澆鑄圓筒110的另一種方法可以在用于在形成的基材上引起周向取向的圖8實例中見到。如圖所示,具有澆鑄圓筒110的型芯112在浸涂后立即被重新定向為水平位置,然后使聚合物固化。可以如旋轉運動116所示以預定速度例如1至300rpm旋轉型芯,同時利用噴嘴102加熱該圓筒110。型芯112還可選通過裝置30的馬達48旋轉,從而發生如圖2所示的旋轉運動54。型芯112還可以沿著線性方向114移動,以加熱圓筒的一段或者一段中的一部分。如上所述,這種后加工可以在惰性環境中完成。
在其他變化方式中,型芯本身被制造成除圓筒形狀之外的其他結構,從而將這些結構直接賦予在其上形成的基材上。實例表示在圖8的側視圖中,其表示由細長的主支撐構件113(根據需要,具有圓形、橢圓形或任意其他橫截面積)以及以一定角度從主支撐構件113突出的第二分支支撐構件115組成的雙叉“y”形型芯111。型芯111可被制造成單個的整體件,或者由若干單獨部分制造,這些單獨部分可被組裝和拆解(de-assemble),以協助制造基材或者將形成的基材從型芯111取出。可以利用多方向浸漬工藝(諸如在旋轉的同時三維浸漬)以及多方向固化(諸如在旋轉的同時三維固化)來形成并保持基材在型芯111的長段上的均勻壁厚,從而形成完整的、均勻的雙叉基材、以及隨后形成雙叉支架骨架。
另一個變化方式表示在圖9的側視圖中,其表示具有細長的主支撐構件117的雙叉“y”形型芯111’,該主支撐構件117以分叉形式分成至少兩個第二分支支撐構件119、121,這些分支支撐構件彼此之間以及相對于主支撐構件117形成角度。上述型芯111’可由單個的整體件形成,或者由單獨部分形成,這些單獨部分彼此連接,從而形成基材或者從型芯111’取出基材。
另一個變化方式表示在圖10的側視圖中,其表示具有主支撐構件123以及相對于主支撐構件123以一定角度伸出的凸起125的型芯。凸起125可以剛剛伸出超過支撐構件123,從而形成具有圍繞凸起125形成的入口的基材和支架骨架。所形成的具有上述入口的支架通常用于通向從主脈管延伸的側分支脈管。
在如圖11所示用于直接形成具有另一結構的基材(和支架骨架)的另一變化方式中,可以利用具有細長體的錐形型芯127(其由窄端129至寬端131漸變),接著形成錐形支架假體,這種錐形支架假體可以沿著脈管植入,這樣漸變是為了防止脈管的過度拉伸并且使任何損失最小化。如果需要,可以沿著型芯127調節漸變的長度和角度,從而形成適于特定解剖的基材。另一變化方式包括,如本文所述將金屬支架(諸如不銹鋼或nitinol支架)浸涂到聚合物溶液中,其中該溶液摻有一種或更多種藥物或不透射線試劑,諸如pt/ir、金、或鎢等。聚合物涂層可被用于輸送或洗脫藥物,或者該涂層可被用于增強支架的不透射線性,同時被涂支架能夠通過其金屬結構而保持徑向作用力。
如上所述,用于基材和支架制造的另一個方法是形成如圖12的側視圖中所示具有可變壁厚的基材。在這個變化方式中,可以利用具有一個或更多個直徑或表面特征的浸漬型芯133。直徑或特征的變化可以通過如下產生:沿著型芯133的表面形成一個或多個的凹陷或特征137,例如峰和谷。這些凹陷或特征137可以均勻地或任意地沿著型芯133設置。利用本文地方法在型芯133上形成的聚合物基材135因而可被形成具有相應的沿其長度在內表面上限定的特征。因此,具有可變壁厚結構的所得支架可以提供增加的縱向柔性,同時保持其他所需要的支架特征,諸如徑向強度等于或大于現有血管內支架。
浸漬工藝不需要高溫。該操作通常在環境溫度下或低于環境溫度下進行。在這樣的溫度下,藥物試劑可以分布在聚合物基質上而沒有往往會使大部分藥物變性的熱效應。還可以通過惰性浸漬環境以及在非常低的溫度下真空干燥來保護藥物免于氧化。
或者以及如上所述,可以形成具有圖案的型芯表面,該圖案被配置用于在聚合物基材的內層中形成孔或空洞(例如圓柱形或矩形)。所形成的孔或空洞可以形成例如具有10-100μl的體積。這些結構起到倉庫的作用,并且可以用于通過如下容納用于輸送到患者中的各種物質(例如藥物分子、多肽、生物試劑等):將基材浸涂到含有要被引入孔或空洞中的材料的儲液中,其中該溶液具有在1.0×10-3至50×10-3pa·s范圍內的相對低粘附。填充孔或空洞還可以通過如下實現:沿著基材將洗脫材料直接注射到孔或空洞中。這樣做,可以將對溫度敏感的藥物、多肽、生物試劑等直接結合到基材和/或支架中,用于從植入的假體中釋放。在一些變化方式中,植入的假體可選包含至少一種生物上活潑的試劑(生物活性試劑)。所述至少一種生物活性試劑可以包括能夠為患者施加治療、預防或診斷效果的任何物質。
合適的生物活性劑的示例包括,但不限于,合成的無機和有機化合物、蛋白質和多肽、多糖以及具有治療、預防和診斷活性的其他糖類、脂類和dna和rna的核酸序列。核酸序列包括基因,反義分子(其結合到互補dna上以抑制轉錄)和核酶。其他生物活性劑的其他示例包括抗體、受體配體、酶、粘附肽、凝血因子、抑制劑或血塊溶解試劑(如鏈激酶和組織纖溶酶原激活劑)、免疫抗原、激素和生長因子、低聚核苷酸(諸如反義低聚核苷酸)、核酶和用在基因治療中的逆轉錄酶病毒載體。可以設計生物活性劑,例如,為了抑制血管平滑肌細胞的活性。它們可以針對平滑肌細胞的異常或不適當遷移和/或增殖的抑制,從而抑制再狹窄。
在其他變化方式中,可選與一個或多個本文所述的其他變化方式組合,可植入假體可以包含至少一個生物活性試劑,它們選自抗增生物質、抗腫瘤物質、抗分裂物質、抗發炎物質、抗血小板物質、抗凝物質、抗纖維蛋白物質、抗凝血酶物質、抗生素物質、抗過敏物質和抗氧化物質。
抗增生試劑可以天然蛋白型試劑,如細胞毒素或合成分子。抗增生物質物質的示例包括,但不僅限于,放線菌素d或其衍生物和類似物(美國sigma-aldrich公司制造,或可得自merck的cosmegen)(放線菌素d的同義詞包括更生霉素、放線菌素iv、放線菌素i1的,放線菌素x1和放線菌素c1);所有的紫杉醇類毒素,諸如紫杉酚(taxol)、多西紫杉醇、紫杉醇(paclitaxel)及其衍生物;所有莫司類(olimus)藥物,諸如大環內酯類抗生素、雷帕霉素(rapamycin)、依維莫司(everolimus)、雷帕霉素的結構衍生物和功能類似物、依維莫司的結構衍生物和功能類似物、fkbp-12介導的mtor抑制劑、biolimus、吡非尼酮(perfenidone)、其前藥、其聯合藥物及其組合。雷帕霉素衍生物的示例包括但不限于,40-o-(2-羥基)乙基雷帕霉素(來自諾華的商品依維莫司)、40-o-(2-乙氧基)乙基雷帕霉素(biolimus)、40-o-(3-羥基)丙基-雷帕霉素、40-o-[2-(2-羥基)乙氧基]乙基-雷帕霉素、40-o-四唑-雷帕霉素,40-表-(n1-四唑基)-雷帕霉素(佐他莫司(zotarolimus),由abbott實驗室制造)、biolimusa9(biosensorsinternational,新加坡)、ap23572(ariadpharmaceuticals)、其前藥、其聯合藥物及其組合。
抗發炎藥可以是甾體消炎藥、非甾體消炎藥(nsaid)或其組合。抗發炎藥物的示例包括,但不限于阿氯酚酸(alclofenac)、阿氯米松(alclometasone)二丙酸鹽、阿爾孕酮(algestone)丙酮化物、α-淀粉酶(α-amylase)、安西法爾(amcinafal)、安西非特(amcinafide)、氨基苯酰基苯乙酸鈉(amfenacsodium)、鹽酸氨普立糖(amiprilose)、阿那白滯素(anakinra)、阿尼羅酸(anirolac)、阿尼扎芬(anitrazafen)、阿扎丙宗(apazone)、巴柳氮(balsalazide)二鈉、芐達酸(bendazac)、苯噁洛芬(benoxaprofen)、鹽酸芐達明(benzydamine)、菠蘿蛋白酶(bromelains)、溴哌莫(broperamole)、布地縮松(budesonide)、卡布洛芬(carprofen)、環洛芬(cicloprofen)、辛噴他宗(cintazone)、克利洛芬(cliprofen)、氯倍他索(clobetasol)、丙酸氯倍他索(clobetasol)、丁酸氯倍他松(clobetasone)、氯苯吡咯酸(clopirac)、丙酸氯硫卡松(cloticasone)、乙酸可米松(cormethasone)鹽、去氧可的松(cortodoxone)、地夫可特(deflazacort)、地萘德(desonide)、去羥米松(desoximetasone)、地塞米松(dexamethasone)、乙酸地塞米松、地塞米松二丙酸鹽、雙氯酚酸(diclofenac)鉀、雙氯芬酸鈉、二氟拉松(diflorasone)二乙酸鹽、二氟米酮(diflumidone)鈉、二氟尼柳(diflunisal)、二氟潑尼酯(difluprednate)、雙酞嗪酮(diftalone)、二甲基亞砜、羥西萘德(drocinonide)、甲地松(endrysone)、恩莫單抗(enlimomab)、依諾利康(enolicam)鈉、依匹唑(epirizole)、依托度酸(etodolac)、依托芬那酯(etofenamate)、聯苯乙酸(felbinac)、非那莫(fenamole)、芬布芬(fenbufen)、芬氯酸(fenclofenac)、苯克洛酸(fenclorac)、芬度柳(fendosal)、苯吡二酮(fenpipalone)、芬替酸(fentiazac)、夫拉扎酮(flazalone)、氟扎可特(fluazacort)、氟芬那酸、氟咪唑(flumizole)、乙酸氟尼縮松(flunisolide)、氟胺煙酸(flunixin)、氟胺煙酸甲葡胺、氟可丁(fluocortin)丁基、乙酸氟米龍(fluorometholone)、苯氟喹酮(fluquazone)、氟比洛芬(fiurbiprofen)、炔氟聯苯(fluretofen)、丙酸氟地松(fluticasone)、呋喃洛芬(furaprofen)、呋羅布芬(furobufen)、哈西縮松(halcinonide)、丙酸鹵貝他索(halobetasol)、乙酸鹵潑尼松(halopredone)、異丁芬酸(ibufenac)、布洛芬(ibuprofen)、布洛芬鋁、布洛芬吡啶甲醇、伊洛達普(ilonidap)、消炎痛(indomethacin)、消炎痛鈉、吲哚布洛芬(indoprofen)、吲哚克索(indoxole)、吲四唑(intrazole)、鹽酸異氟潑尼龍(isoflupredone)、氧卓乙酸(isoxepac)、異噁噻酰胺(isoxicam)、酮基布洛芬(ketoprofen)、鹽酸洛非咪唑(lofemizole)、氯諾昔康(lomoxicam)、依碳氯替潑諾(loteprednoletabonate)、甲氯芬那酸鈉(meclofenamatesodium)、甲氯芬那酸酸、甲二氯松(meclorisone)二丁酸煙、甲滅酸(mefenamicacid)、馬沙拉嗪(mesalamine)、美西拉宗(meseclazone)、磺庚甲潑尼龍、momiflumate、萘普酮(nabumetone)、萘普生(naproxen)、萘普生鈉、甲基萘丙醇(naproxol)、腈胺唑酮(nimazone)、奧沙拉嗪(olsalazine)鈉、奧古蛋白(orgotein)、奧帕諾辛(orpanoxin)、奧沙丙嗪(oxaprozin)、羥基保泰松(oxyphenbutazone)、鹽酸瑞尼托林(paranyline)、木聚硫鈉(pentosanpolysulfatesodium)、甘油保泰松鈉(phenbutazonesodiumglycerate)、甲苯吡啶酮(pirfenidone)、吡咯昔康(piroxicam)、肉桂酸吡咯昔康、吡咯昔康酮胺(piroxicamolamine)、吡洛芬(pirprofen)、強的松龍(prednazate)、普利非酮(prifelone)、普羅度酸(prodolicacid)、普羅喹宗(proquazone)、普羅沙唑(proxazole)、檸檬酸普羅沙唑、雙甲丙酰龍(rimexolone)、氯馬扎利(romazarit)、水楊酸膽堿硫酸鎂(salcolex)、沙那西定(salnacedin)、雙水楊酯(salsalate)、血根氯銨、司克拉宗(seclazone)、絲炎痛(sermetacin)、舒多昔康(sudoxicam)、舒林酸(sulindac)、舒洛芬(suprofen)、他美辛(talmetacin)、他尼氟酯(talniflumate)、醋柳酞酯(talosalate)、替布費龍(tebufelone)、替尼達普(tenidap)、替尼達普鈉、騰諾息卡(tenoxicam)、氧喹苯胺(tesicam)、芐叉異喹酮(tesimide)、四氫甲引胺(tetrydamine)、硫平酸(tiopinac)、巰氫可的松(tixocortol)戊酸酯、托美汀(tolmetin)、托美汀鈉、三氯氟松(triclonide)、三氟氨酯(triflumidate)、齊多美辛(zidometacin)、佐美酸(zomepirac)鈉、阿司匹林(乙酰基水楊酸)、水楊酸、皮質類固醇類、糖皮質激素、他克莫司(tacrolimus)、吡美莫司(pimecorlimus)、其前藥、其聯合藥物及其組合。
另外,消炎劑可以是促炎信號分子的生物抑制劑。抗炎生物試劑包括上述生物炎癥信號分子的抗體。
此外,生物活性劑可以是除抗增生試劑或抗發炎試劑以外的其他試劑。生物活性劑可以具有任何治療試劑、預防試劑或診斷試劑。在一些實施,這種試劑可用于與抗增生試劑或抗發炎試劑組合。這些生物活性試劑也可以具有抗增生或抗發炎性質,或者可以具有諸如抗腫瘤、抗分裂、抗發炎物質、抑制細胞(cystostatic)、抗血小板、抗凝、抗纖維蛋白、抗凝血酶、抗生素、抗過敏和抗氧化性質的性質。
抗腫瘤物和/或抗分裂物的示例包括但不限于,紫杉醇(例如,
抗血小板試劑、抗凝試劑、抗纖維蛋白試劑和抗凝血酶試劑也可以具有化療或抗增生性質,其實例包括但不限于,肝素鈉、低分子量肝素、類肝素(heparinoids)、水蛭素(hirudin)、阿加曲班(argatroban)、毛喉素(forskolin)、伐哌前列素(vapiprost)、環前列腺素和環前列腺素類似物、葡聚糖、d-苯-丙-精氨酸-氯甲基甲酮(合成抗凝血酶)、潘生丁(dipyridamole),糖蛋白iib/iiia血小板膜受體拮抗劑抗體、重組水蛭素、如angiomax(來自biogen)的凝血酶抑制劑、鈣通道阻滯劑(如硝苯地平nifedipine)、秋水仙素(colchicine)、成纖維細胞生長因子(fgf)拮抗劑、魚油(如歐米茄3-脂肪酸)、組胺拮抗劑、洛伐他汀(降膽固醇藥物,抑制hmg-coa還原酶,來自merck的
抑制細胞物質的實例包括,但不限于,血管肽素(angiopeptin)、血管緊張素轉換酶抑制劑如卡托普利(captopril)(如
抗過敏物質的示例包括但不限于,吡嘧司特鉀。抗氧化物質的示例包括但不限于,4-氨基-2,2,6,6-四甲基哌啶-1-氧(4-氨基-tmepo)。其他生物活性試劑包括,抗感染試劑,如抗病毒試劑;止痛藥和止痛藥的組合;厭食試劑(anorexic);抗寄生蟲藥;抗痛風藥(antiarthritics),平喘藥;抗驚厥;抗抑郁藥;抗利尿劑;止瀉藥;抗組胺藥、抗偏頭痛(antimigrain)制劑;止吐;抗帕金森綜合征藥物;止癢;抗精神病藥物;退熱藥;抗痙攣;抗膽堿藥物;擬交感神經藥(sympathomimetics);黃嘌呤衍生物;心血管制劑包括鈣通道阻滯劑和β-阻滯劑,諸如心得樂(pindolol)和抗心律失常藥;抗高血壓藥物;利尿劑;血管擴張劑,包括冠狀動脈血管擴張劑;周邊和腦血管擴張劑;中樞神經系統興奮劑;咳嗽和感冒制劑,包括減充血劑;安眠藥;免疫抑制劑;肌肉松弛劑;擬副交感神經藥(parasympatholytics);興奮劑;鎮靜劑;止痛劑;天然衍生的或基因工程脂蛋白;和再狹窄減輕劑。
可以使用的其他生物活性試劑包括α-干擾素、基因工程上皮細胞,他克莫司(tacrolimus)和地塞米松(dexamethasone)。
在與血液接觸的可植入器械中,“促愈”藥物或試劑指具有如下性質的藥物和試劑,它們促進或增強動脈內腔重新內皮化,從而促進血管組織愈合。可植入器械(例如支架)含有促愈藥物或試劑的那部分可以吸引、結合并最終被內皮細胞(例如內皮祖細胞)封裝。細胞的這種吸引、結合和封裝將減少或防止由于機械性質損耗而引起的血栓或血栓癥的形成,如果支架未被充分封裝,則可能發生上述機械性質損耗。增強的再內皮化可以促進以比支架的機械形式的損耗更快的速度內皮化。
促愈藥物或試劑可以分散在可生物吸收聚合物基材或骨架的主體上。促愈藥物或試劑還可以分散在可植入器械(例如支架)表面的可生物吸收聚合物涂層上。
“內皮祖細胞”指在骨髓中制造的原始細胞,其可以進入血液,并且進入血管損傷的區域,以幫助修復。內皮祖細胞在成人外周血液中循環,并通過細胞因子、生長因子和缺血條件由骨髓中調動起來。血管損傷通過血管再生術和血管生成機制修復。使內皮祖細胞循環會促進受損血管主要通過血管生成機制修復。
在一些實施方式中,促愈藥物或試劑可以是內皮細胞(edc)結合試劑。在某些實施例中,edc結合劑可以是蛋白質、多肽或抗體,它們可以是例如,1型膠原、被稱作單鏈片段的23肽片段(scfva5)、結膜蛋白血管內皮(ve)-鈣黏蛋白(cadherin)及其組合中的之一。1型膠原蛋白當被結合到骨橋蛋白時已顯示通過細胞凋亡路徑的下調促進內皮細胞的粘附和調節生存能力。s.m.martin等人j.biomed.mater.res.,70a:10-19(2004)。利用scfva5,可以選擇性靶向內皮細胞(用于靶向輸送免疫脂質體)。t.volkel等人的biochimicaetbiophysicaacta,1663:158-166(2004)。已經顯示結膜蛋白血管內皮(ve)-鈣黏蛋白結合到內皮細胞并且下調內皮細胞的凋亡。r.spagnuolo等人blood,103:3005-3012(2004)。
在特定實施方式中,edc結合試劑可以是骨橋蛋白的活性片段(asp-val-asp-val-pro-asp-gly-asp-ser-leu-ala-tyr-gly(seqidno:1))。其他edc結合試劑包括但不限于,epc(上皮細胞)抗體、pgd多肽序列、rgd模擬物及其組合。
在進一步的實施方式中,促愈藥物或試劑可以是吸引或結合內皮祖細胞的物質或試劑。吸引并結合內皮祖細胞的代表性物質或試劑包括抗體,如cd-34、cd-133和vegf2型受體。吸引并結合內皮祖細胞的試劑可以包括,具有一氧化氮供體基團的聚合物。
上述生物活性試劑作為實例列舉,但并不意味著限制。當前可以得到或者未來可以開發的其他生物活性試劑同樣可用。
在更具體的實施方式中,可選與一個或多個本文所述的其他變化方式組合,本發明的可植入器械包含至少一個生物活性試劑,它們選自紫杉醇、多西紫杉醇、雌二醇、一氧化氮供體、超氧化物歧化酶、超氧化物歧化酶模擬物、4-氨基-2,2,6,6-四甲基哌啶-1-氧(4-氨基-tempo)、他克莫司、地塞米松、地塞米松乙酸酯、雷帕霉素、雷帕霉素衍生物、40-o-(2-羥基)乙基雷帕霉素(依維莫司)、40-o-(2-乙氧基)乙基雷帕霉素(biolimus)、40-o-(3-羥基)丙基-雷帕霉素、40-o-[2-(2-羥基)乙氧基]乙基-雷帕霉素、40-o-四唑-雷帕霉素,40-表-(n1-四唑基)-雷帕霉素(佐他莫司)、biolimusa9(biosensorsinternational,新加坡)、ap23572(ariadpharmaceuticals)、吡美莫司(pimecrolimus)、甲磺酸伊馬替尼(imatinibmesylate)、米哚妥林(midostaurin)、氯倍他索(clobetasol)、祖細胞捕獲抗體、促愈藥物、其前藥、其聯合藥物及其組合。在具體實施方式中,生物活性試劑是依維莫司。在另一具體實施方式中,生物活性試劑氯倍他索。
可替代的一類藥物可以是用于增加脂質輸送的p-para-激動劑,示例包括非諾貝特(fenofibrate)。
在一些實施方式中,可選與一個或多個本文所述的其他實施方式組合,所述至少一種生物活性試劑具體可能不是本文所述生物活性藥物或試劑中的一種或更多種。
具有一個或更多個孔或空穴的上述假體也可用于治療、預防或改善處于下流脈管中的任何醫學病癥,其中所述脈管太窄,不允許任何器械通過。通過摻入可控釋放的各種試劑,這些治療試劑可被輸送到病灶,從而為提供區域療法治療,這種治療實施不會產生對于系統治療可以觀察到的副作用。一些示例性治療包括,輸送腫瘤化療藥物,用于慢性腎小球腎炎的抗炎劑,用于心臟小血管病變、小血管動脈病變、周邊動脈小血管病變、外周肺管病變的血液凝塊抑制劑。
一旦對聚合物基材的加工已經完成,就可以對基材進行進一步成形或機械加工,從而產生各種器械。一個實例表示在圖13的立體圖中,示出了壓實支架120。可以通過如下由澆鑄圓筒形成支架120:沿著澆鑄圓筒的長度切割,從而產生重疊部分122。然后,可以將支架120壓實成用于鋪展的小型結構,然后在患者的脈管系統中膨脹。另一個實例表示在圖14所示支架124的側視圖中,其可以通過如下形成:機械加工多個被去除的部分,從而產生格子結構或骨架結構,這些結構利于支架124的壓縮和膨脹以用于輸送和鋪展。
除了上述支架124的設計以外,還可以使用其他支架設計,這些設計與通過所得聚合物基材提供的物理和機械特征特別協調。上述支架設計可以被力學優化,以利用通過物理材料所提供的延展特性和強度特征,從而導致支架在卷曲工藝期間能夠經歷10%至80%機械應變。例如,由固化的基材形成的支架的起始直徑開始可以為例如5mm,并且以例如2至2.8mm的卷曲直徑終止。進一步卷曲至甚至更小的直徑可以使材料應變增大100%以上。
此外,對于一定范圍的變形,優化的支架設計可以通過如下具有相對高的疲勞壽命:在任何塑性變形開始之前利用基材所具有的線性彈性性質。可以根據所選擇的生理學條件和材料調節支架設計,結果當支架經歷由例如生理學條件所引起的變形時,支架具有的材料應變值在所選擇材料的彈性變形的范圍內。
一些優化的支架設計的實例表示在圖15和16的側視圖中,這些設計利用所形成的聚合物基材的固有材料性質。利用具有本文所述相對高分子量以及例如20%至40%結晶度的材料(諸如plla)對上述設計進行特殊優化,從而形成支架。正如以上所討論的,上述支架可以用在患者體內經受較高動態作用力的區域中,諸如sfa。正如所討論的,高分子量plla的彈性回縮率在例如0%至4%的范圍內,并且所述支架設計通常可以經歷引起小于5%的軸向模式、徑向模式和彎曲模式的材料應變的生理學條件。
支架設計還可以使各種基材材料具有相對高水平的各種模式(徑向、軸向、彎曲等)變形,同時仍處于例如150%的材料應變限制內。上述高應變情況的示例,包括由于運動和外部作用力而引起的支架壓碎(crushing)、縮短、拉伸和彎曲。支架設計因此允許通過將材料應變保持在材料的最終應變以下使支架經受上述運動,而沒有斷裂。
如圖15的側視圖所示,支架141可以包括多個波浪形周向支撐元件143,這些元件經由一個或更多個連接或聯接元件145彼此聯接。盡管采用六個支撐元件143表示,但是支撐元件143的個數可以變化,這取決于要植入的整個支架141的所需長度。支撐元件143可以形成波浪形波紋,它們通過一個或更多個(例如三個)連接或聯接元件145聯接,這些連接或聯接元件145相對于支架141所限定的縱軸彼此間以平行、均勻、周向隔離方式排列。聯接元件145沿其長度可以結合或限定彎形或弓形部分147,其中部分147限定的半徑小于通過支撐元件143的波浪形部分所限定的半徑。在支架141具有賦予到該支架141上的縱向作用力的情況下,這些彎形或弓形部分147可以起到釋放應力的作用。
另一個變化方式表示在圖16a的側視圖中,其類似地表示一個或更多個波浪形周向支撐元件149(例如六個支撐元件149),這些元件類似地經由一個或更多個連接或聯接元件151連接。在這個實例中,兩個連接或聯接元件151沿著支撐元件149的圓周彼此對接,從而連接或結合相鄰的支撐元件。各個相鄰支撐元件149還可以通過以其他圖案排列的連接或聯接元件151聯接,從而提供沿其長度具有足夠高柔韌性的整個支架。
圖16a的支架骨架在圖16b的張開圖進一步示出,以進一步詳細地示出處于膨脹構造的支架圖案。由于用于最終形成基材的獨特的加工方法(如本文所述),由基材加工的支架可以顯示出特定的機械性質,這取決于支架幾何形狀是如何構造的。可用于形成支架的各種加工方法和裝置在本文中得以描述并在下者中被進一步描述:美國專利8,206,635;美國專利8,206,636;于2012年5月21日遞交的美國專利申請13/476,853(美國公布2012/0232643a1);以及于2009年8月13日遞交的美國專利申請12/541,095(美國公布2010/0042202a1),以上專利文獻中的每一者的全部內容通過引用并入本文并且用于本文中的任何目的。
這種支架是可生物吸收的,同時在鋪展期間或在植入患者體內時使用時保持所需的機械性能。支架可以形成為具有例如80μm、90μm、120μm或150μm或者在例如70μm至200μm之間的任何范圍內的壁厚。在支架形成為具有150μm的壁厚的情況下,與聚合物的性質相結合的特定支架尺寸可提供顯著的機械性能,諸如徑向強度、回縮率和支架保持力。
例如,相應形成的(如本文所述)并且壁厚為20μm至1mm(例如,150μm)、支架長度為6mm至300mm(例如,18mm)的聚合物支架可以形成為在其外徑處在支架的外表面上具有3mm2至3000mm2(例如,36.2mm2)的近似表面積。因此,支架的近似總表面積可以為20mm2至12,000mm2,例如139mm2。
對于壁厚為120μm的支架實施例,這種支架在特定區域處可具有與圖16b所示的那些相同或略微不同的尺寸,以補償壁厚的減小,同時保持特定的機械性能。對于壁厚為80μm或90μm(或其間的范圍)的支架實施例,尺寸也可以與圖16b中所示的那些相同或略微不同,以補償壁厚減小的差異。
支架可以形成為具有由本文所述的聚合物基材形成的150μm的壁厚和18mm的長度。因此,這種支架可以形成為具有多個周向支撐元件149和連接或聯接元件151,該連接或聯接元件以交替的方式在相鄰的支撐元件149之間延伸。示出了多個周向支撐元件149和連接或聯接元件151的示例性子集,以示出特定的支架尺寸。
支架圖案示出了圍繞沿支架縱向延伸的中心線cl張開的支架。示出了幾個示例性的周向支撐元件149a、149b、149c、149d以及連接或聯接元件,諸如與支撐元件149a和149b相連的聯接元件151a、與支撐元件149b和149c相連的聯接元件151b和151c、以及與支撐元件149c和149d相連的聯接元件151d。每個周向支撐元件可以形成為具有t1(0.0005英寸至0.1英寸,例如0.006英寸)的寬度,而在周向支撐元件之間延伸的每個聯接元件可以形成為具有t2(0.0005英寸至0.08英寸,例如0.005英寸)的寬度,如圖所示。
聯接元件可以彼此平行地對準并且相對于支架的中心線cl平行地對準。聯接元件還可以以d1的距離(0.004英寸至1.5英寸,例如0.136英寸)彼此間隔開,如當支架展平時所測量的或者當支架正常鋪展并膨脹以用于植入時沿周向所測量的(顯示為聯接元件151b與151c之間的張開距離或周向距離)。聯接元件還可以形成為具有一長度,該長度使相鄰的周向支撐元件以d2的距離(0.004英寸到1.5英寸,例如0.040英寸)彼此間隔開(顯示為支撐元件149b與149c之間的縱向距離)。
每個周向支撐元件可以形成為具有正弦或波狀波浪圖案,其關于中心線cl彼此相鄰地對準,使得聯接元件從一個支撐元件(例如,支撐元件149a)的槽延伸到相鄰支撐元件(例如,支撐元件149b)的槽。支撐元件的槽(聯接元件于此處延伸)的近端部分可以形成半徑r1(0.0001英寸至0.75英寸,例如0.012英寸),而支撐元件的脊部也可以形成半徑r2(0.0005英寸至0.5英寸,例如0.012英寸)(如沿支撐元件149b所示)以及在支撐元件的相鄰部分之間形成的角度a1(15度至179度,例如120度)。
在聯接元件從第一支撐元件向近端延伸的情況下,聯接元件可以簡單地從槽上突出,但是在聯接元件與相鄰的支撐元件接合的地方,槽可以沿著近端部分和槽的遠端部分形成半徑r4(0.0001英寸至0.75英寸,例如0.008英寸),在該近端部分處元件相接合,該遠端部分朝遠端彎曲,以與聯接元件接合。這可以被看出,例如,在聯接元件151b從支撐元件149b的近端縱向延伸以形成半徑r5(0.0001英寸至0.75英寸,例如0.005英寸)的位置處,如支撐元件149b與聯接元件151b之間所示。聯接元件151a從支撐元件149a的槽向近端突出并且與支撐元件149b的對應槽接合,其中,槽形成向遠端彎曲的半徑r3(0.0001英寸至0.75英寸,例如0.006英寸)。因此,槽的近端部分可以在向近端彎曲的半徑r4之間限定向遠端彎曲的半徑r3。位于聯接元件兩側的向近端彎曲的半徑r4之間的距離限定距離d3(0.0005英寸到0.75英寸,例如0.022英寸)。
由于由本文所述的聚合物基材形成的這些支架尺寸,因此結合使得這種支架能夠具有特別理想的機械性質。例如,這種支架可以顯示出介于1.0-1.5n/mm之間的徑向強度以及2%-5%的回縮率和0.5-1.5n的支架保持力。此外,支架的疲勞壽命也可以顯著地改善,例如,相比于常規的聚合物支架增加了高達150百萬周期(或1500%)。這些值(例如,徑向強度、回縮率、支架保持力、疲勞壽命、分子量等)明確地適用于本文所述的具有不同壁厚或其它尺寸的任何支架實施例。例如,這些值適用于具有例如80μm、90μm、120μm或150μm或者介于例如70μm至200μm之間的范圍內的壁厚的支架實施例。
圖17a至17f表示由聚合物基材形成的支架130如何輸送并鋪展從而確保在脈管中膨脹的另一實例的側視圖。圖17a表示示例性支架130的側視圖,該支架從所形成的聚合物支架加工或切下,具有初始直徑d1。如上所述,基材可以在基材的玻璃化轉變溫度tg之下、附近或之上進行熱處理,以固定這個初始直徑d1,然后對基材進行加工以制造支架130,結果支架130具有相應的直徑d1。然后,支架130的直徑可以減小至比初始直徑d1要小的第二輸送直徑d2,結果如圖17b所述支架130可以被布置在例如輸送導管132的充氣氣球134上。具有減小到直徑d2的支架130可以自約束,結果支架130保持其減小的直徑d2而無需外鞘,但是可選利用外鞘。附加地,因為如上所述的加工和支架材料的所得材料特性,支架130可以由初始直徑d1降低至輸送直徑d2,而沒有斷裂或材料破壞。
隨著支架130被布置在輸送導管132上,它可以在脈管136中以血管內方式前進直到達到輸送場所,如圖17c所示。充氣球134可以被充氣從而使支架130的直徑膨脹至接觸脈管內部,例如膨脹至中間直徑d3,該直徑小于支架的初始直徑d1但是大于輸送直徑d2。因為上述固有材料特征,支架130可以膨脹至這個中間直徑d3,如圖17d所示,而沒有任何斷裂或破壞。此外,膨脹至中間直徑d3可以允許支架130可靠地接觸脈管壁,同時允許取出輸送導管132,如圖17e所示。
一旦支架130已經膨脹至某一中間直徑d3并靠緊脈管壁,那么就可以允許支架130進一步自膨脹一段時間,從而進一步抵靠接觸脈管壁,結果支架130可靠地順應組織。這種自膨脹特征最終允許支架膨脹返回初始直徑(已被熱固定)如圖17f所示,或者支架130已經在脈管直徑的范圍內完全自膨脹。
這些實施例是為了說明可以形成的各種器械的類型,和可以由也包括在本公開范圍內的聚合物基材形成的各種其他器械的類型。
以上討論的本發明的應用并不局限于在身體某些區域中的某些過程、治療或替換,還可以包括任意其他過程、治療和身體的區域。對用于實施本發明的上述方法和器械進行修改以及對本發明的各方面進行修改對本領域普通技術人員來說是顯而易見的,它們包括在本公開的范圍內。此外,還預計到各實例間各方面的各種組合,它們也被認為在本公開的范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!