皮膚外用劑和皮膚刺激降低劑的制作方法
本發明涉及皮膚外用劑。進而,本發明涉及通過皮膚外用劑的組合使用而能夠降低皮膚刺激的皮膚刺激降低劑。
背景技術:
以往,作為給藥系統(Drug Delivery System)、用于標記特定的生物體組織的分子成像用探針,報道了很多對藥物、熒光色素進行負載、包封或結合的聚合物納米顆粒。
例如,專利文獻1中記載了:作為靜脈內直接給藥的藥物輸送系統和分子成像探針,包含具有10個以上肌氨酸單元的親水性多肽鏈、和作為必要構成單元含有5個以上氨基酸單元或羥基酸單元的疏水性分子鏈的兩親性嵌段聚合物。
另外,專利文獻2中記載了:作為靜脈內直接給藥的分子成像探針,由包含具有20個以上的肌氨酸單元的親水性嵌段鏈和具有10個以上的乳酸單元的疏水性嵌段鏈的兩親性嵌段聚合物、以及至少具有10個以上的乳酸單元和標記基團的標記聚合物這2種聚合物構成的分子聚集體。
另一方面,出于提高生理活性成分在皮膚中的活性等目的,提出了使生理活性成分包封在聚甲基丙烯酸甲酯(PMMA)的納米顆粒中的經皮吸收外用劑(專利文獻3)。另外,作為與該經皮吸收外用劑一樣地在皮膚中發揮作用的目的,也提出了將氨甲環酸封入PLGA納米顆粒中作為經皮吸收外用劑(專利文獻4)。
然而,專利文獻3所述的外用劑中,PMMA并非為生物降解性聚合物材料,所以在作為醫藥品、化妝品等長時間重復使用時,擔心PMMA殘留于皮膚而產生不良影響。另外,在減小顆粒尺寸時有可能變得難以封入藥物。
專利文獻4所述的外用劑由于能夠封入PLGA納米顆粒中的氨甲環酸是微量的,所以在送達深于皮膚層(真皮)的部分時需要給予大量的制劑。另外,在使用的藥物伴隨皮膚刺激之類的情況時,則擔心無法完全封入藥物載體中的藥物可能會對皮膚產生不良影響等的問題。
現有技術文獻
專利文獻
專利文獻1:日本特開2008-024816號公報
專利文獻2:國際公開第2009/148121號
專利文獻3:日本特開2002-308728號公報
專利文獻4:日本特開2010-180145號公報
技術實現要素:
發明要解決的問題
本發明要解決的課題在于提供即使含有對皮膚刺激強且難以進行經皮給藥的藥物,也能夠降低該藥物對皮膚的刺激、安全性高且具有優異的藥理效果的皮膚外用劑。
用于解決問題的方案
因此,本發明人等進行了深入廣泛的研究,結果發現通過組合使用含有特定的兩親性嵌段共聚物的納米尺寸的分子聚集體和藥物,從而得到即使含有對皮膚刺激強且難以進行經皮給藥的藥物,也能夠降低該藥物對皮膚的刺激、安全性高且具有優異的藥理效果的皮膚外用劑,因而完成了本發明。
即,本發明提供一種皮膚外用劑,其含有藥物和納米尺寸的分子聚集體,前述分子聚集體含有具有源自肌氨酸的結構單元的親水性嵌段鏈和具有源自羥基酸的結構單元的疏水性嵌段鏈的兩親性嵌段共聚物(以下也簡稱為兩親性嵌段共聚物)。
另外,本發明是為了降低由含有藥物的皮膚外用劑中的前述藥物導致的皮膚刺激而使用的皮膚刺激降低劑,提供為了形成納米尺寸的分子聚集體而使用的、包含具有源自肌氨酸的結構單元的親水性嵌段鏈和具有源自羥基酸的結構單元的疏水性嵌段鏈的兩親性嵌段共聚物的皮膚刺激降低劑。
發明的效果
本發明的皮膚外用劑即使含有對皮膚刺激強且難以進行經皮給藥的藥物,也能夠降低該藥物對皮膚的刺激、安全性高且具有優異的藥理效果。另外,本發明的皮膚外用劑的皮膚透過性也高。
附圖說明
圖1是表示匹伐他汀所致的皮膚刺激性試驗的結果的圖。
圖2是表示匹伐他汀的皮膚透過試驗的結果的圖。
圖3是表示匹伐他汀的皮膚透過試驗的結果的圖。
圖4-1是表示適用皮膚外用劑后的總膽固醇量的圖。
圖4-2是表示適用皮膚外用劑后的HDL膽固醇量的圖。
圖4-3是表示適用皮膚外用劑后的LDL膽固醇量的圖。
圖4-4是表示適用皮膚外用劑后的磷脂量的圖。
圖5是表示用三維皮膚模型的匹伐他汀所致的刺激性試驗的結果的圖。
圖6是表示用三維皮膚模型的匹伐他汀的透過試驗的結果的圖。
圖7-1是表示用三維皮膚模型的卡巴拉汀所致的刺激性試驗的結果的圖。
圖7-2是表示用三維皮膚模型的卡巴拉汀所致的刺激性試驗的結果的圖。
圖8是表示用三維皮膚模型的卡巴拉汀的透過試驗的結果的圖。
圖9是表示用三維皮膚模型的美金剛所致的刺激性試驗的結果的圖。
圖10是表示用三維皮膚模型的美金剛所致的刺激性試驗和IL-1α產生量的測定結果的圖。
具體實施方式
本發明的皮膚外用劑含有藥物和納米尺寸的分子聚集體,該分子聚集體包含具有源自肌氨酸的結構單元的親水性嵌段鏈和具有源自羥基酸的結構單元的疏水性嵌段鏈的兩親性嵌段共聚物。
<(A-1)兩親性嵌段共聚物>
(親水性嵌段鏈)
兩親性嵌段共聚物中所含的親水性嵌段鏈具有源自肌氨酸的結構單元。通過該結構單元來提高親水性嵌段鏈的親水性和柔軟性。需要說明的是,親水性嵌段鏈中的源自肌氨酸的結構單元可以全部連續,也可為不連續的。
在此,在本說明書中,“親水性嵌段鏈”是指與兩親性嵌段共聚物中所含的疏水性嵌段鏈相比,親水性相對高,且兩親性嵌段共聚物在溶劑中進行自組裝,具有可形成自聚集體(優選為顆粒狀的自聚集體)的親水性的物質。
作為親水性嵌段鏈,從皮膚刺激性降低、皮膚透過性和藥理效果的觀點、從使分子聚集體易于控制成如膠束、泡囊這種形狀、適度的大小的觀點出發,優選具有20個以上源自肌氨酸的結構單元。源自所述肌氨酸的結構單元的個數更優選為30個以上、進一步優選為40個以上、另外,優選為500個以下、更優選為200個以下、進一步優選為150個以下、特別優選為100個以下。
具體而言,上述源自肌氨酸的結構單元如下述式(1)所示。
作為源自肌氨酸的結構單元的含量,親水性嵌段鏈中優選為50~100摩爾%、更優選為65~100摩爾%、進一步優選為80~100摩爾%、特別優選為90~100摩爾%。
親水性嵌段鏈也可含有糖鏈、聚醚鏈等,但優選為多肽鏈。作為親水性嵌段鏈中所含的除了源自肌氨酸的結構單元以外的結構單元,可列舉出源自除了肌氨酸以外的氨基酸(包含親水性氨基酸及其它氨基酸)的結構單元。
在此,本說明書中“氨基酸”為L體、D體、DL體均可,天然氨基酸、非天然氨基酸以及通過它們的修飾和/或化學改變的衍生物,且也包含α-、β-、γ-氨基酸。
上述氨基酸中優選為親水性氨基酸。具體而言,可列舉出絲氨酸、蘇氨酸、賴氨酸、天冬氨酸、谷氨酸等。
(疏水性嵌段鏈)
兩親性嵌段共聚物中所含的疏水性嵌段鏈具有源自羥基酸的結構單元。疏水性嵌段鏈中的源自羥基酸的結構單元可以全部連續,也可為不連續的。
在此,在本說明書中,“疏水性嵌段鏈”是指與兩親性嵌段共聚物中所含的親水性嵌段鏈相比,疏水性相對高,且兩親性嵌段共聚物在溶劑中進行自組裝,具有可形成自聚集體(優選為顆粒狀的自聚集體)的疏水性的物質。
另外,作為疏水性嵌段鏈,從皮膚刺激性降低、皮膚透過性和藥理效果的觀點、從使分子聚集體易于控制成如膠束、泡囊這種形狀、適度的大小的觀點出發,優選具有10個以上源自羥基酸的結構單元。所述源自羥基酸的結構單元的個數更優選為15個以上、進一步優選為20個以上、另外,優選為100個以下、更優選為80個以下、進一步優選為60個以下、特別優選為50個以下。
作為上述羥基酸,優選為脂肪族羥基酸。作為脂肪族羥基酸,可列舉出乳酸、乙醇酸、羥基異丁酸等,可以單獨使用這些當中的1種或組合使用2種以上。
這些當中,從對于低沸點溶劑的溶解性、生物適應性和穩定性提高的觀點出發,特別優選為乳酸。該乳酸為L-乳酸、D-乳酸、DL-乳酸均可,疏水性嵌段鏈可以由這些當中的單種構成也可以由多種構成。
作為上述源自羥基酸的結構單元的適合的具體例,可列舉出由下述式(2)所示的例子。
〔式(2)中,R1表示氫原子或甲基,R2表示單鍵或亞甲基。〕
式(2)中,作為R1與R2的組合,優選的是:R1為氫原子或甲基、R2為單鍵的組合,R1為甲基、R2為亞甲基的組合,從對于低沸點溶劑的溶解性、生物適應性和穩定性提高的觀點出發,特別優選R1為甲基,特別優選R2為單鍵的組合。
作為源自羥基酸的結構單元的含量,疏水性嵌段鏈中優選為50~100摩爾%、更優選為65~100摩爾%、進一步優選為80~100摩爾%、特別優選為90~100摩爾%。
作為疏水性嵌段鏈中所含的源自羥基酸的結構單元以外的結構單元,可列舉出源自氨基酸(包含疏水性氨基酸及其它氨基酸)的結構單元。
疏水性氨基酸的多數具有脂肪族側鏈、芳香族側鏈等。作為天然的疏水性氨基酸,可列舉出丙氨酸、纈氨酸、亮氨酸、異亮氨酸、脯氨酸、蛋氨酸、色氨酸等。作為非天然的疏水性氨基酸衍生物,可列舉出谷氨酸甲酯、谷氨酸芐酯、天冬氨酸甲酯、天冬氨酸乙酯、天冬氨酸芐基酯等。
作為本發明中使用的兩親性嵌段共聚物中、親水性嵌段鏈和疏水性嵌段鏈的含有比例〔親水性嵌段鏈:疏水性嵌段鏈〕,從皮膚刺激性降低、皮膚透過性和藥理效果的觀點出發,結構單元數之比優選為10:1~1:1、更優選為6:1~1.5:1、特別優選為5:1~1.6:1。
另外,作為本發明中使用的兩親性嵌段共聚物的適合的具體例,可列舉出由下述式(3)所示的例子。
〔式(3)中,R3表示碳數1~6的2價的烴基,m表示20~200的整數,n表示10~100的整數表示,R1和R2與前述相同意義。〕
式(3)中,作為R3所示的2價的烴基,優選為亞烷基。亞烷基可以是直鏈狀也可以是支鏈狀。作為亞烷基的具體例,可列舉出亞甲基、亞乙基、三亞甲基、亞丙基(丙烷-1,2-二基)、四亞甲基、五亞甲基、六亞甲基等。
上述2價的烴基的碳數優選為2~5、更優選為2或3、進一步優選為2。
m表示20~200的整數,優選為30~150的整數、更優選為40~100的整數。n表示10~100的整數,優選為15~80的整數、更優選為20~60的整數、特別優選為20~50的整數。
需要說明的是,n個R1可以相同也可以不同,n個R2可以相同也可以不同。
本發明中使用的兩親性嵌段共聚物的數均分子量(Mn)沒有特別限定,優選為3000~14000、更優選為3000~9000。兩親性嵌段共聚物的重均分子量(Mw)沒有特別限定,優選為3000~14000、更優選為3000~9000。
兩親性嵌段共聚物的分子量分布(Mw/Mn)優選為1.5以下。
需要說明的是,各結構單元的含量通過13C-NMR、1H-NMR等進行測定既可。
<(A-2)疏水性聚合物>
本發明中使用的分子聚集體除了兩親性嵌段共聚物也可含有疏水性聚合物。
作為上述疏水性聚合物(以下也簡稱為疏水性聚合物。),從生物適應性、穩定性、生物降解性的觀點、對于低沸點溶劑的溶解性的觀點出發,優選為具有源自羥基酸的結構單元的疏水性聚合物。
疏水性聚合物具有源自羥基酸的結構單元時,作為源自羥基酸的結構單元的個數,從與兩親性嵌段聚合物的親和性的觀點以及從使分子聚集體易于控制成如膠束、泡囊這種形狀、適度的大小的觀點出發,優選為10個以上、更優選為15個以上、進一步優選為20個以上,另外,優選為200個以下、更優選為160個以下、進一步優選為100個以下。
上述個數優選為不超過兩親性嵌段聚合物中的疏水性嵌段鏈中所含的結構單元數2倍的個數。
作為上述羥基酸,優選為脂肪族羥基酸。作為脂肪族羥基酸,可列舉出乳酸、乙醇酸、羥基異丁酸等,可以單獨使用這些當中的1種或組合使用2種以上。
這些當中,從對于低沸點溶劑的溶解性、生物適應性和穩定性提高的觀點出發,特別優選為乳酸。該乳酸為L-乳酸、D-乳酸、DL-乳酸均可,疏水性聚合物可以由這些當中的單種構成也可以由多種構成。所述乳酸中,從易于控制平均粒徑的觀點和穩定性的觀點出發,兩親性嵌段聚合物中的疏水性嵌段鏈含有源自L-乳酸的結構單元時優選為L-乳酸、兩親性嵌段聚合物中的疏水性嵌段鏈含有源自D-乳酸的結構單元時優選為D-乳酸。
疏水性聚合物含有源自羥基酸的結構單元時,作為所述結構單元的含量,疏水性聚合物中優選為50~100摩爾%、更優選為65~100摩爾%、進一步優選為80~100摩爾%、特別優選為90~100摩爾%。
需要說明的是,疏水性聚合物也可含有源自上述疏水性氨基酸的結構單元等。
上述疏水性聚合物的數均分子量(Mn)沒有特別限定,優選為700~6000、更優選為1000~4000。
上述疏水性聚合物的重均分子量(Mw)沒有特別限定,優選為700~6000、更優選為1000~4000。
上述疏水性聚合物的分子量分布(Mw/Mn)優選為1.5以下。
使用疏水性聚合物時,從易于控制分子聚集體的疏水核心部的體積、分子聚集體的大小的觀點出發,兩親性嵌段共聚物與疏水性聚合物的含量的摩爾比〔(A-1):(A-2)〕優選為10:1~1:10。
<(B)藥物>
本發明的皮膚外用劑中所含的藥物沒有特別限定。本發明的皮膚外用劑通過組合使用含有上述兩親性嵌段共聚物的分子聚集體和藥物,從而降低藥物對皮膚的刺激,即使在使用皮膚刺激性高的物質作為藥物時也能夠安全地進行經皮給藥。
因此,作為藥物,具體而言,能夠適合使用報道有引起接觸性皮炎的藥物等。這些藥物可以單獨使用或在多種組合中使用。
作為報道有引起接觸性皮炎的藥物,可列舉出例如他汀類。作為他汀類,可列舉出美伐他汀、辛伐他汀、氟伐他汀、洛伐他汀、阿托伐他汀、匹伐他汀、瑞舒伐他汀、普伐他汀、它們的藥學上可接受的鹽。在此,作為該藥學上可接受的鹽,可列舉出鈉鹽等堿金屬鹽;鈣鹽等堿土金屬鹽;銨鹽;烷基銨鹽。由于本發明的皮膚外用劑的皮膚透過性高且容易移動至血中等,所以能夠充分發揮他汀類所具備的藥理作用。
這些當中,作為他汀類,優選為脂溶性他汀類、它們的藥學上可接受的鹽。作為脂溶性他汀類,可列舉出美伐他汀、辛伐他汀、氟伐他汀、洛伐他汀、阿托伐他汀、匹伐他汀、瑞舒伐他汀、它們的藥學上可接受的鹽。
作為其它的報道有引起接觸性皮炎的藥物,例如,可列舉出:硫酸新霉素、慶大霉素、卡那霉素、鹽酸土霉素、磷酸克林霉素、硫酸多粘菌素B、桿菌肽、紅霉素、氯霉素、梭鏈孢酸鈉、磺胺嘧啶銀等抗生素;
克霉唑、鹽酸奈康唑、盧立康唑、硝酸硫康唑、聯苯芐唑、蘭諾康唑、鹽酸阿莫羅芬、鹽酸特比萘芬、鹽酸布替萘芬、托萘酯等抗真菌藥;
乙酰水楊酸、丁苯羥酸、布洛芬、布洛芬吡甲酯、烏芬那酯、雙氯芬酸鈉、吲哚美辛、酮洛芬、洛索洛芬、舒洛芬、噻洛芬、萘普生、氟比洛芬、吡羅昔康等非甾體性抗炎藥;
鹽酸普魯卡因、氨基苯甲酸乙酯、鹽酸地布卡因、鹽酸利多卡因、鹽酸托哌酮等局部麻醉藥;
鹽酸苯海拉明、克羅米通、L-薄荷醇、水楊酸乙二醇酯、水楊酸甲酯等止癢藥;
醋酸氫化可的松、氫化可的松、強的松龍、曲安奈德、哈西奈德、氟齊胺、安西奈德、氟西奈德、地塞米松、丁酸氫化可的松、丁酸丙酸氫化可的松、地潑羅酮丙酯、潑尼松龍醋酸戊酸酯、丙酸氯倍他索、乙酸倍他松、戊酸倍他米松、戊酸地塞米松、戊酸二氟可龍、二丙酸倍他米松、倍他米松丁酸丙酸酯、丙酸倍氯米松、二丙酸地塞米松、特戊酸氟米松、阿氯米松、莫米松糠酸酯、二氟孕甾丁酯、醋酸雙氟拉松等甾體性抗炎藥;
鹽酸去氧腎上腺素、鹽酸地匹福林、硫酸阿托品、富馬酸酮替芬、色甘酸鈉、氨來占諾、妥布霉素、硫酸地貝卡星、硫酸西索米星、馬來酸噻嗎洛爾、尼普地羅、鹽酸苯呋洛爾、鹽酸左卡巴斯汀等滴眼藥;
氯化溶菌酶、曲弗明等潰瘍治療藥;
鹽酸多奈哌齊、美金剛鹽酸鹽、卡巴拉汀、酒石酸卡巴拉汀、氫溴酸加蘭他敏等阿爾茨海默氏癡呆治療藥;
氯霉素、卡馬西平、苯巴比妥、苯妥英、乙替唑侖、硝西泮、艾地苯醌、鹽酸米安色林等抗痙攣藥;
水合氯醛、乙酰水楊酸、托芬那酸、布可隆等解熱鎮痛藥;
鹽酸美西律、甲磺酸多沙唑嗪、雙嘧達莫、硝酸異山梨酯等循環系統治療藥;
磷酸雙氫可待因、茶堿等呼吸器藥;
鹽酸噻氯匹定、貝前列素鈉、利馬前列素等血液·體液疾病治療藥;
鹽酸奧昔布寧等尿頻治療藥。
這些當中,作為其它的報道有引起接觸性皮炎的藥物,優選為阿爾茨海默氏癡呆治療藥、尿頻治療藥。
<皮膚外用劑的形態>
本發明的皮膚外用劑含有具有上述兩親性嵌段共聚物的納米尺寸的分子聚集體和上述藥物。本發明的皮膚外用劑的劑型沒有特別限定,可列舉出:外用液劑、洗劑、補劑、擦劑、乳劑、凝膠劑、軟膏劑、乳膏劑、泥膏劑、硬膏劑、濕布劑、巴布劑、膏藥、膠帶劑、儲層型貼劑、噴霧劑、氣霧劑、泡劑、化妝水、膜劑等。
皮膚外用劑含有藥物和分子聚集體是指在皮膚外用劑中存在藥物和分子聚集體,根據需要上述兩親性嵌段共聚物在含有上述疏水性聚合物的分子聚集體的聚合物納米顆粒中也可含有上述藥物。需要說明的是,該“含有”包括包封和負載的概念。分子聚集體含有藥物時,分子聚集體本身具有作為藥物的作用和作為皮膚刺激降低劑的作用兩方面。
作為含有藥物和分子聚集體的形態,除了分子聚集體含有藥物的形態以外,可列舉出分子聚集體和藥物在混合狀態下存在(同時存在)的形態、皮膚外用劑包括含有分子聚集體的區域和含有藥物的區域的形態。這些形態中,分子聚集體作為皮膚刺激降低劑發揮作用。
作為皮膚外用劑包括分子聚集體含有區域和藥物含有區域的形態,例如,可列舉出在基材上具備藥物含有層的皮膚貼劑中,在藥物含有層上的皮膚粘貼面側具備含有分子聚集體的層。這種皮膚粘貼外用劑在基材上依次具備作為藥物含有區域的藥物含有層、用于降低皮膚刺激的作為分子聚集體含有區域的分子聚集體含有層。
將分子聚集體用作皮膚刺激降低劑時,通過涂布等使分子聚集體與表皮接觸后,在其上適用藥物,從而能夠得到降低對皮膚刺激的效果。
藥物的含量相對于皮膚外用劑總量例如為0.0001~50質量%左右。從皮膚刺激性降低、皮膚透過性和藥理效果的觀點出發,藥物的含量相對于皮膚外用劑總量,優選為0.001~30質量%、更優選為0.01~15質量%、進一步優選為0.05~10質量%、更優選為0.1~5質量%。特別是,從皮膚透過性和藥理效果的觀點出發,更優選為0.15~2.5質量%、更優選為0.2~1.5質量%、特別優選為0.3~1質量%。
兩親性嵌段共聚物的含量相對于皮膚外用劑總量,例如為0.0001~50質量%左右、優選為0.001~30質量%、更優選為0.01~20質量%、特別優選為0.1~10質量%。
皮膚外用劑中的兩親性嵌段共聚物與藥物的含量的摩爾比〔(A-1):(B)〕優選為1:1000~1000:1、更優選為1:100~100:1、進一步優選為1:100~1:1、特別優選為1:50~1:1。
<分子聚集體>
本發明中使用的分子聚集體是通過上述兩親性嵌段共聚物的聚集、或者通過自組裝的取向締合而成立的構造體。上述分子聚集體的形狀為顆粒狀(膠束狀、泡囊狀等)、棒狀、其它分子的聚集形態均可,從皮膚刺激性降低、皮膚透過性和藥理效果的觀點出發,優選為顆粒狀、更優選為膠束狀、泡囊狀、特別優選為膠束狀。
從皮膚刺激性降低、皮膚透過性和藥理效果的觀點出發,本發明中使用的分子聚集體的平均粒徑優選為10~300nm、平均粒徑更優選為10~200nm、平均粒徑進一步優選為10~150nm、平均粒徑進一步優選為10~100nm、平均粒徑進一步優選為15~60nm、平均粒徑特別優選為20~45nm。
需要說明的是,平均粒徑是通過后述的實施例所述的方法測定的數值。
本發明的皮膚外用劑和皮膚刺激降低劑能夠根據常規方法通過對如下述那樣操作而得到的分子聚集體進行配混來制造。
使用能夠通過適當組合肽合成法、聚酯合成法、縮肽類合成法的公知的方法而合成的兩親性嵌段共聚物,以及根據需要使用疏水性聚合物,能夠通過薄膜法或注射法等來制作分子聚集體。在制作分子聚集體時,除了兩親性嵌段共聚物以及根據需要使用的疏水性聚合物以外,通過使用藥物而能夠得到含有藥物的分子聚集體。另外,也能夠將形成分子聚集體前的兩親性嵌段共聚物和根據需要使用的疏水性聚合物作為皮膚刺激降低劑來提供。在該形態中,通過使用作為皮膚刺激降低劑的兩親性嵌段共聚物和藥物來制作分子聚集體,從而能夠得到可以作為皮膚外用劑使用的分子聚集體。需要說明的是,對于得到的分子聚集體而言,也可以根據公知的方法進行表面修飾。
(薄膜法)
薄膜法通常是制備脂質體中所使用的方法,包括以下工序(1)~(3)。
工序(1):在容器(例如玻璃容器)內,使兩親性嵌段共聚物、藥物以及根據情況的疏水性聚合物溶解于有機溶劑中的工序;
工序(2):從前述溶液中除去前述有機溶劑,在前述容器的內壁得到含有兩親性嵌段共聚物、以及根據情況的疏水性聚合物和/或藥物的薄膜的工序;
工序(3):在前述容器中加入水或水溶液,使前述薄膜變換為顆粒狀的分子聚集體而得到分子聚集體的分散液的工序。
進而,薄膜法也可以包括將前述的分子聚集體的分散液供于冷凍干燥處理的工序。另外,工序(3)中根據情況也可以進行超聲波處理和水溶液的加熱處理。
另外,在有機溶劑中含有兩親性嵌段共聚物、以及根據情況的疏水性聚合物和/或藥物的溶液可由本領域技術人員適當制備。例如,可以通過將所有應該使用的聚合物和藥物進行一次性混合來制備,也可以將該應該使用的聚合物和藥物當中的一部分預先以薄膜的狀態準備,之后通過加入含有該應該使用的成分當中的其它成分的溶液來制備。預先準備的一部分的聚合物的薄膜的形成法能夠根據后述的方法來進行。
作為薄膜法中使用的有機溶劑,只要溶解使用的兩親性嵌段共聚物、藥物和疏水性聚合物就沒有特別限制,但出于溶解后進行蒸餾除去考慮而優選使用低沸點溶劑。本發明中的低沸點溶劑是指在1個大氣壓下的沸點為100℃以下、優選為90℃以下的溶劑。具體而言,可列舉出氯仿、乙醚、乙腈、甲醇、乙醇、丙醇、異丙醇、丙酮、二氯甲烷、四氫呋喃、己烷、乙酸乙酯等。
對于兩親性嵌段共聚物、以及根據情況的疏水性聚合物和/或藥物的溶解,通過使用這種低沸點溶劑而使溶劑的除去變得非常簡單。作為溶劑的除去方法沒有特別限定,根據使用的有機溶劑的沸點等,本領域技術人員進行適當確定即可。例如,可以在減壓下進行溶劑除去,也可以通過自然干燥除去溶劑。
有機溶劑被除去后,在容器內壁形成含有兩親性嵌段共聚物、以及根據情況的疏水性聚合物和/或藥物的薄膜。向粘附有該薄膜的容器中加入水或水溶液。作為水或水溶液沒有特別限定,本領域技術人員適當選擇在生化學、藥學上可接受的物質即可。例如,可列舉出注射用蒸餾水、生理鹽水、緩沖液等。
加入水或水溶液后,通過根據需要進行加熱處理和/或超聲波處理,從而從容器內壁上剝離薄膜,在該過程中形成分子聚集體。超聲波處理例如可以在1~60分鐘的條件下進行。加熱處理例如可以在20~95℃的條件下進行。與超聲波處理同時進行加熱處理時,例如在20~95℃、1~60分鐘的條件下進行超聲波處理即可。加熱處理和/或超聲波處理結束時,在容器中能制備分子聚集體被分散在前述水或水溶液中的分散液。
(注射法)
注射法是制備其它多種分子聚集體時使用的方法,不限定于本發明的分子聚集體。該方法中能夠通過如下方式制備分子聚集體,即,在有機溶劑、例如三氟乙醇、乙醇、六氟異丙醇、二甲基亞砜等中溶解兩親性嵌段共聚物、以及根據情況的疏水性聚合物和/或藥物,使得到的溶液分散于注射用蒸餾水、生理鹽水、緩沖液等水系溶劑中,進行純化處理、例如凝膠過濾層析、濾波、超離心等的處理后,除去有機溶劑。
在將分子聚集體作為泡囊進行制備時,制備包封型的分子聚集體時,在注射用蒸餾水、生理鹽水、緩沖液等水系溶劑中使應包封的物質溶解或懸浮,在通過此操作而得到的水溶液或懸浮液中,使兩親性嵌段共聚物、以及根據情況的疏水性聚合物和/或藥物溶解于上述有機溶劑而得到的溶液分散。
通過在制備分子聚集體時使用藥物,從而在形成含有藥物的分子聚集體時,出于藥物容易被包封或負載而皮膚刺激性降低方面的考慮,優選使用疏水性的藥物。例如,作為藥物使用脂溶性他汀類時,藥物變得容易被包封或負載在兩親性嵌段共聚物的疏水核心部分而進一步皮膚刺激性降低。
兩親性嵌段共聚物與藥物的含量的摩爾比〔(A-1):(B)〕從顆粒的粗大化、漏出藥物的聚集等的外觀穩定性的觀點出發,優選為1:1000~1000:1、更優選為1:100~100:1、進一步優選為1:100~1:1、特別優選為1:50~1:1。
<皮膚外用劑的附加的成分>
除了上述分子聚集體和藥物以外,本發明的皮膚外用劑也可含有保濕劑、柔軟劑、經皮吸收促進劑、無痛化劑、防腐劑、抗氧化劑、著色劑、增稠劑、香料、pH調整劑等。這些可以單獨含有1種或組合含有2種以上。
作為上述保濕劑,例如,可列舉出瓊脂、二甘油、二硬脂二甲銨鋰蒙脫石、丁二醇、聚乙二醇、丙二醇、己二醇、薏苡仁提取物、凡士林、尿素、透明質酸、氨甲環酸、神經酰胺、Lipidure(保濕因子)、異黃酮、氨基酸、膠原、粘多糖、褐藻糖膠、乳鐵蛋白、山梨醇、甲殼素·殼聚糖、蘋果酸、葡萄糖醛酸、胎盤提取物、海藻提取物、牡丹皮提取物、甜繡球(sweet hydrangea)提取物、小連翹提取物、彩葉草提取物、衛矛提取物、可可提取物、玫瑰花提取物、豬苓提取物、山楂提取物、迷迭香提取物、栽種色椰木提取物、春黃菊提取物、野芝麻提取物、荔支提取物、蓍提取物、蘆薈提取物、馬栗提取物、羅漢柏提取物、墨角藻提取物、歐絲磨(osmoin)提取物、燕麥提取物、晚香玉多糖、冬蟲夏草提取物、大麥提取物、柑桔提取物、地黃提取物、花椒提取物、薏苡仁提取物等。
作為上述柔軟劑,例如,可列舉出甘油、礦物油、潤膚成分(例如,異硬脂酸異丙酯、異硬脂酸聚甘油脂、異壬酸異十三烷酯、異壬酸辛酯、油酸、油酸甘油酯、可可脂、膽固醇、混合脂肪酸甘油三酯、琥珀酸二辛酯、蔗糖乙酸硬脂酸酯、環五硅氧烷、蔗糖二硬脂酸酯、棕櫚酸二辛酯、羥基硬脂酸辛酯、山萮酸二十烷醇酯、蔗糖多山萮酸酯、聚甲基倍半硅氧烷、肉豆蔻醇、肉豆蔻酸十六酯、肉豆蔻酸肉豆蔻脂、月桂酸己酯等)。
作為上述經皮吸收促進劑,例如,可列舉出乙醇、肉豆蔻酸異丙酯、檸檬酸、角鯊烷、油酸、薄荷腦、N-甲基-2-吡咯烷酮、己二酸二乙酯、己二酸二異丙酯、癸二酸二乙酯、癸二酸二異丙酯、棕櫚酸異丙酯、油酸異丙酯、油酸辛基十二烷酯、異硬脂醇、2-辛基十二烷醇、尿素、植物油、動物油。
作為上述無痛化劑,例如,可列舉出苯甲醇、鹽酸普魯卡因、鹽酸利多卡因、氯丁醇等。
作為上述防腐劑,例如,可列舉出苯甲酸、苯甲酸鈉、對羥基苯甲酸酯、對羥基苯甲酸酯乙酯、對羥基苯甲酸甲酯、對羥基苯甲酸丙酯、對羥基苯甲酸丁酯、山梨酸鉀、山梨酸鈉、山梨酸、脫氫乙酸鈉、過氧化氫、甲酸、甲酸乙酯、次氯酸鈉、丙酸、丙酸鈉、丙酸鈣、果膠分解物、聚賴氨酸、苯酚、異丙基甲基苯酚、鄰苯基苯酚、苯氧乙醇、間苯二酚、百里香酚、福美雙、茶樹油。
作為上述抗氧化劑,例如,可列舉出維生素A、維甲酸(Retinoic acid)、視黃醇、醋酸視黃酯、維生素A棕櫚酸酯、維生素A醋酸酯、視黃醇棕櫚酸酯、生育酚視黃酸酯、維生素C及其衍生物、激動素、β-胡蘿卜素、蝦青素、葉黃素、番茄紅素、維甲酸(Tretinoin)、維生素E、α-硫辛酸、輔酶Q10、聚苯酚、SOD、植酸等。
作為上述著色劑,例如,可列舉出氧化鐵、三氧化二鐵、氧化鐵黃、二氧化鈦、高嶺土、焦油系色素、葉綠素等。
作為上述增稠劑,例如,可列舉出榅桲、卡拉膠、阿拉伯膠、卡拉牙膠、黃原膠、結冷膠、羅望子膠、刺槐豆膠、黃蓍膠、果膠、淀粉、環糊精、甲基纖維素、乙基纖維素、羧甲基纖維素、海藻酸鈉、聚乙烯醇、聚乙烯吡咯烷酮、羧基乙烯聚合物、聚丙烯酸鈉等。
作為上述香料,例如,可列舉出麝香、阿拉伯膠油、茴香油、依蘭油、肉桂油、茉莉油、甜柑桔油、留蘭香油、天竺葵油、百里香油、橙花油、薄荷油、柏樹油、茴香油、薄荷油、佛手柑油、酸橙油、薰衣草油、檸檬油、檸檬草油、玫瑰油、玫瑰木油、茴香醛、香葉醇、檸檬醛、靈貓酮、麝香酮、苧烯、香草醛等。
作為上述pH調整劑,例如,可列舉出檸檬酸、檸檬酸鈉、乙酸、乙酸鈉、氫氧化鈉、氫氧化鉀、磷酸、磷酸氫鈉、磷酸二氫鈉、磷酸氫二鈉、琥珀酸、琥珀酸鈉、蘋果酸、蘋果酸鈉、鹽酸等。
<皮膚外用劑的用法>
本發明的皮膚外用劑只要是經皮給藥(包括經粘膜給藥)的物質即可,但由于不僅能夠期待局部作用也能夠期待全身作用,所以作為用于循環系統疾病、免疫疾病、精神疾病、神經系統疾病、內分泌疾病等全身性疾病的預防或治療的皮膚外用劑是有用的。
另外,本發明的皮膚外用劑的給藥量和給藥期間可以根據藥物的種類和用量、患者的體重、疾病的狀態等適當設定。
本發明的皮膚外用劑降低了藥物對皮膚的刺激,對人體的安全性高,容易透過皮膚移動至血中等體內,藥理效果也優異。另外,具有優異的生物降解性和生物適應性,進而即使少量也能夠在體內顯現藥效。
特別是,即使是在僅應用于皮膚時難以顯現所期望藥效的藥物,也能夠顯現優異的藥理效果,另外,即使是因皮膚刺激等副作用的風險高而不適合外用的藥物,也能夠兼顧顯現出優異的藥理效果和降低副作用的風險。
實施例
以下,列舉實施例對本發明進行詳細地說明,本發明不限定于實施例。
需要說明的是,實施例中的平均粒徑使用評價溶液中的分子聚集體濃度成為1mg/mL的方式分散于純化水的試樣,根據Zetasizer Nano S(馬爾文制)進行測定。另外,測定參數的Dispersant RI設為1.330、Material RI設為1.45(蛋白)和測定溫度設為25.0℃。另外,數據解析時使用Zetasizer Software(ver.6.32)。
[合成例1:聚肌氨酸-聚-L-乳酸(PSar-PLLA)的合成]
按照以下的步驟,基于肌氨酸-NCA(Sar-NCA)和氨基化聚L-乳酸(a-PLA)合成聚肌氨酸-聚乳酸兩親性嵌段聚合物(PSar65-PLLA30)(方案1)。
在氬氣氣氛下,向氨基化聚L-乳酸(383mg,0.17mmol)和肌氨酸-NCA(3.21g,27.9mmol)中加入二甲基甲酰胺(DMF)(140mL),在室溫下攪拌12小時。接著,將反應溶液冷卻至0℃,加入乙醇酸(72mg,0.95mmol)、O-(苯并三唑-1-基)-N,N,N’,N’-四甲基脲六氟磷酸鹽(HATU)(357mg,0.94mmol)和N,N-二異丙基乙胺(DIEA)(245μL,1.4mmol),在室溫下反應18小時。
之后,通過旋轉蒸發器減壓蒸餾除去DMF,利用LH20色譜柱進行純化。回收·濃縮在UV270nm下檢測到峰的組分。將得到的濃縮溶液在0℃下滴加至乙醚中,通過再沉淀而得到目標產物的PSar65-PLLA30(1.7g)。
[實施例1:匹伐他汀鈣的皮膚刺激性降低效果]
實施例1中,作為藥物使用匹伐他汀鈣,進行了有關使藥物含在兩親性聚合物膠束的皮膚外用劑的試驗。
[制備例1-1:含有匹伐他汀鈣的聚合物膠束的制備(35nm)]
使合成例1中得到的PSar65-PLLA30 100mg和匹伐他汀鈣20mg溶解于氯仿40mL中,利用旋轉蒸發器減壓蒸餾除去氯仿。減壓蒸餾除去后向在容器內形成的薄膜中添加純化水10mL,將容器在85℃熱水浴中浸漬20分鐘而形成膠束,使用0.2μm PTFE過濾器進行過濾,使濾液冷凍干燥,得到含有匹伐他汀鈣的聚合物膠束。
平均粒徑:35nm、藥物含量:20質量%、回收率:90%以上
[制備例1-2:含有匹伐他汀鈣的聚合物膠束的制備(60nm)]
合成例1中得到的PSar65-PLLA30 100mg、使對末端進行Z化(芐氧基羰基化)的聚-L-乳酸(PLLA30-Z)34mg和匹伐他汀鈣20mg溶解于氯仿10mL中,利用旋轉蒸發器減壓蒸餾除去氯仿。減壓蒸餾除去后向在容器內形成的薄膜中添加純化水10mL,將容器在85℃熱水浴中浸漬20分鐘而形成膠束,使用0.2μm PTFE過濾器進行過濾,使濾液冷凍干燥,得到含有匹伐他汀鈣的聚合物膠束。
平均粒徑:60nm、藥物含量:15質量%、回收率:90%以上
[制備例1-3:含有匹伐他汀鈣的聚合物膠束的制備(35nm)]
除了將匹伐他汀鈣的量設為10mg以外,通過與制備例1-1相同的步驟得到含有匹伐他汀鈣的聚合物膠束。
平均粒徑:35nm、藥物含量:10質量%、回收率:90%以上
[制備例1-4:含有匹伐他汀鈣的聚合物膠束的制備(35nm)]
除了將匹伐他汀鈣的量設為40mg以外,通過與制備例1-1相同的步驟得到含有匹伐他汀鈣的聚合物膠束。
平均粒徑:35nm、藥物含量:40質量%、回收率:90%以上
[試驗例1-1:皮膚刺激性試驗]
在給藥開始日的前一天,使用電動剪毛刀和剃須刀剪掉背部皮毛,考慮到皮膚狀態來選擇被檢動物(兔子)。使以下液<1-A>~<1-E>各500μL浸滲于切成2.5cm見方的絨布上作為被檢物質,用油紙保護(以下作為制劑)后,粘貼在背部皮膚上。給藥為封閉涂布,為了防止制劑涂布后絨布的偏離而用醫療用粘合片進行覆蓋,進一步纏繞醫用膠帶進行固定,給動物安裝伊麗莎白項圈(Elizabethan collar)。
涂布24小時后移除伊麗莎白項圈,用浸有生理鹽水(日本藥典生理鹽水、大冢生理鹽水注射液、Otsuka Pharmaceutical Co.,Ltd.制造)的脫脂棉除去(擦拭)制劑,結束給藥部位的觀察后,進行下面的涂布操作,實施了連續14天重復給藥并進行了觀察。
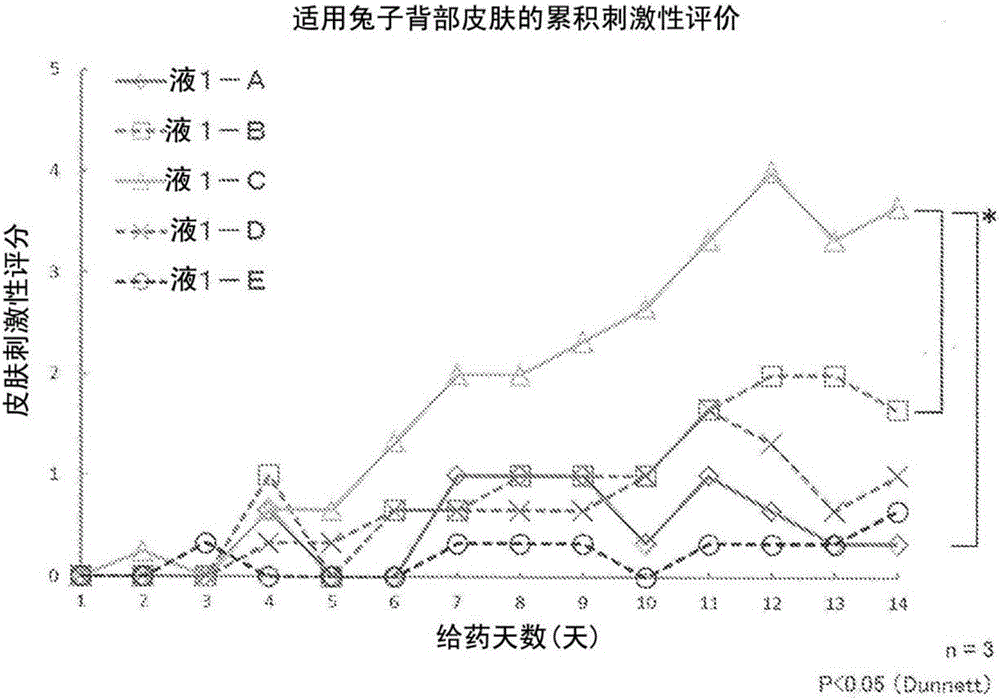
上述觀察通過對出現紅斑和焦痂以及浮腫進行肉眼觀察,按照根據Draize法的皮膚刺激性判定基準,基于紅斑和焦痂的評分和浮腫的評分的總值判斷了皮膚刺激的程度。表1示出紅斑和焦痂的評分標準和浮腫的評分標準,圖1示出根據Dunnett法進行統計分析的試驗結果。
<1-A>:制備例1-1中得到的含有匹伐他汀鈣的聚合物膠束的濃度以匹伐他汀鈣換算成為0.5質量%的方式制備的磷酸鹽緩沖液(pH7.4)懸浮液
<1-B>:含有匹伐他汀鈣(0.5質量%)和聚乙二醇400(9質量%)的磷酸鹽緩沖液(pH7.4)溶液
<1-C>:含有匹伐他汀鈣(0.5質量%)的磷酸鹽緩沖液(pH7.4)懸浮液
<1-D>:含有合成例1中得到的聚合物(2.5質量%)的磷酸鹽緩沖液(pH7.4)懸浮液
<1-E>:磷酸鹽緩沖液(pH7.4)
[表1]
試驗例1-1的結果證實了:使用含有匹伐他汀鈣的聚合物膠束懸浮液(液1-A)的情況與使用匹伐他汀鈣懸浮液(液1-C)的情況相比,皮膚刺激評分(Score)顯著降低。而且,含有匹伐他汀鈣的聚合物膠束懸浮液(液1-A)的皮膚刺激評分經過14天推移至1以下,意外的是幾乎推移了與不含匹伐他汀的聚合物膠束懸浮液(液1-D)相同程度。
另外,在使匹伐他汀鈣溶解于聚乙二醇400溶液的溶液(液1-B)中的皮膚刺激性評價的結果中,雖然累積刺激評分上未發現顯著的上升趨勢,但得到了比含有匹伐他汀鈣的聚合物膠束懸浮液(液1-A)高的皮膚刺激評分。
[試驗例1-2:皮膚透過試驗(1)]
對大鼠腹部皮膚進行脫毛處理后進行摘出,將其制成透過膜。在臥式透過池中將摘出皮膚的角質層一側作為供體側固定摘出皮膚。制備例1-1和1-2中得到的含有匹伐他汀鈣的聚合物膠束、以及將匹伐他汀鈣作為對照,以匹伐他汀鈣的濃度成為0.1質量%方式分別懸浮于磷酸鹽緩沖液(pH7.4)中,將這些作為供體溶液用于固定的大鼠摘出皮膚上。受體溶液為磷酸鹽緩沖液(pH7.4)2mL,實驗開始后從樣品采集口經時性地采集0.5mL,補充新的受體溶液0.5mL。用HPLC法測定采集的樣品溶液中的匹伐他汀含量,測定各自的制劑中的匹伐他汀鈣的大鼠皮膚透過量。圖2示出試驗結果。
[試驗例1-3:皮膚透過試驗(2)]
制備例1-1、1-3和1-4中得到的含有匹伐他汀鈣的聚合物膠束的匹伐他汀鈣的濃度分別成為0.1質量%、0.05質量%和0.2質量%的方式懸浮于磷酸鹽緩沖液(pH7.4)中,使用由此而制備的樣品,用與試驗例1-2相同的方法測定了皮膚透過性。圖3示出結果。
試驗例1-2和1-3的結果證實了含有匹伐他汀鈣的聚合物膠束的皮膚透過性高。
[試驗例1-4:藥效試驗]
在給藥開始日的前一天,使用電動剪毛刀和剃須刀剪掉被檢動物(雄性豚鼠、Slc:Hartley、7周齡)的背部皮毛,用除毛乳膏(Epilat、Kanebo制造)進行除毛。各被檢動物的除毛部位為了防止液體下垂而用帶膠帶的海綿包裝(3.5cm×3.5cm×0.5cm、Ashiya Packing Manufactory制造)覆蓋,在內側被掏空的2.5cm×2.5cm部分分別使用以下液<4-A>~<4-E>各500μL。使給藥液緊貼于涂布部位后,用切成2.5cm見方的絨布進行吸水(以下作為制劑)。給藥為封閉涂布,在吸水的絨布上疊加3張硅片并用醫療用醫用膠帶和伸縮性包帶進行固定。在涂布24小時后用浸漬于生理鹽水(日本藥典生理鹽水、大冢生理鹽水注射液、Otsuka Pharmaceutical Co.,Ltd.制造)的脫脂棉除去(擦拭)制劑。結束給藥部位的觀察后進行下面的涂布操作,連續涂布了10天。需要說明的是,在開始第5天時除了涂布部位以外,為了維持海綿框架型的粘接性而利用除毛乳膏進行了除毛。
在給藥開始第0天和第10天時采血約2.5mL,在3300rpm、4℃的條件進行15分鐘離心分離而得到血漿,對于得到的血漿而言,利用日立自動分析裝置(LABOSPECT003)測定總膽固醇量(TC)、HDL膽固醇量(HDL-C)、LDL膽固醇量(LDL-C)和磷脂量(PL)。圖4-1~4-4示出該結果。
<4-A>:在制備例1-1中得到的含有匹伐他汀鈣的聚合物膠束的濃度以匹伐他汀鈣換算成為0.1質量%的方式制備的磷酸鹽緩沖液(pH7.4)懸浮液
<4-B>:在制備例1-1中得到的含有匹伐他汀鈣的聚合物膠束的濃度以匹伐他汀鈣換算成為0.5質量%的方式制備的磷酸鹽緩沖液(pH7.4)懸浮液
<4-C>:含有匹伐他汀鈣(0.1質量%)的磷酸鹽緩沖液(pH7.4)懸浮液
<4-D>:含有匹伐他汀鈣(0.5質量%)的磷酸鹽緩沖液(pH7.4)懸浮液
<4-E>:磷酸鹽緩沖液(pH7.4)
基于圖4-1~4-4所示的試驗結果,可知的是:含有匹伐他汀鈣的聚合物膠束懸浮液(液4-A和4-B)的總膽固醇量、HDL膽固醇量、LDL膽固醇量和磷脂量均得以降低。
另外,如圖4-1和圖4-3所示,使用含有匹伐他汀鈣(0.1質量%)的聚合物膠束懸浮液(液4-A)的情況,與使用含有0.1質量%匹伐他汀鈣的磷酸鹽緩沖液(液4-C)的情況相比,相同程度地降低了總膽固醇量和LDL膽固醇量。另外,如圖4-1、圖4-3和圖4-4所示,使用含有匹伐他汀鈣(0.5質量%)的聚合物膠束(液4-B)的情況,與使用含有0.5質量%匹伐他汀鈣的磷酸鹽緩沖液(液4-D)的情況相比,降低了總膽固醇量、LDL膽固醇量和磷脂量。
[試驗例1-5:使用三維皮膚模型的刺激性試驗]
使用以下的<5-A>~<5-G>作為試驗物質,通過OECD承認的皮膚刺激性試驗專用試劑盒(KURABO公司制造產品編號:EPI-212SIT),按照OECD TG439(In Vitro(體外)皮膚刺激試驗),根據以下的步驟實施了試驗物質對表皮的暴露和刺激性評價。
在預先進行一夜預培養的試劑盒表皮的角質層一側添加試驗物質30μL,用鑷子放置尼龍網而對角質層進行試驗物質的暴露。試驗物質為固體時(下述<5-E>),向角質層中添加25μL的DPBS,之后立即向角質層中添加固體物質25mg,從而進行對角質層的試驗物質的暴露。60分鐘后進行清洗,完全除去試驗物質后進行42小時的過培養(post-incubation)。培養過程中,經過24小時后進行一次培養基更換。培養后使用MTT法試劑盒(KURABO公司制造產品編號:MTT-100-JP),用MTT溶液反應3小時,提取由線粒體代謝產生的甲月朁染料,測定OD值。基于測定結果,計算出相對于陰性對照(下述<5-G>)的相對存活率。圖5示出試驗結果。
<5-A>:制備例1-1中得到的含有匹伐他汀鈣的聚合物膠束的濃度以匹伐他汀鈣換算成為0.5質量%的方式制備的磷酸鹽緩沖液(pH7.4)懸浮液
<5-B>:制備例1-1中得到的含有匹伐他汀鈣的聚合物膠束的濃度以匹伐他汀鈣換算成為1.0質量%的方式制備的磷酸鹽緩沖液(pH7.4)懸浮液
<5-C>:含有匹伐他汀鈣(0.5質量%)的磷酸鹽緩沖液(pH7.4)懸浮液
<5-D>:含有匹伐他汀鈣(1.0質量%)的磷酸鹽緩沖液(pH7.4)懸浮液
<5-E>:匹伐他汀鈣原料藥(粉體)
<5-F>:5%SDS溶液;陽性對照
<5-G>:杜氏磷酸鹽緩沖生理鹽水(DPBS);陰性對照
基于圖5所示的試驗結果證實了:在使用三維皮膚模型的試驗中,使相對存活率依賴于匹伐他汀鈣的使用濃度地降低,通過使用含有匹伐他汀鈣的聚合物膠束,從而使相對存活率上升。這些結果與兔子累積刺激性評價(上述試驗例1-1)的結果相同,通過三維皮膚模型的刺激性評價試驗再現了動物實驗的結果,通過使藥物含在聚合物膠束中帶來的皮膚刺激性降低效果利用細胞系得到啟示。
[試驗例1-6:使用三維皮膚模型的皮膚透過試驗]
在帶自動取樣功能的經皮吸收試驗裝置(CosMED Pharmaceutical Co.Ltd制造TransView)的立式透過池中固定培養皮膚模型(KURABO公司制造產品編號:EPI-606X;屏障功能增強吸收試驗推薦產品)的角質層一側作為供體側。作為供體溶液,上述<5-A:以匹伐他汀鈣換算成為0.5質量%的方式制備的含有匹伐他汀鈣的聚合物膠束的磷酸鹽緩沖液(pH7.4)懸浮液>和<5-C:使用含有匹伐他汀鈣(0.5質量%)的磷酸鹽緩沖液(pH7.4)懸浮液>1.5mL,受體液使用磷酸鹽緩沖液(pH7.4)。在2、4、6、8、10、12小時后采集受體溶液0.8mL,補充新的受體溶液0.8mL。用HPLC法測定采集的受體溶液中的藥物含量。圖6示出測定試驗開始后至受體溶液采集為止的時間與藥物的累積透過量的關系進行繪圖表示的結果。
試驗例1-6的結果證實了:在三維皮膚模型中,與使用大鼠腹部皮膚的試驗(上述試驗例1-2和1-3)相同地,含有匹伐他汀鈣的聚合物膠束顯示出高的皮膚透過性。另外,基于圖6所示的結果,可知的是含有匹伐他汀的聚合物膠束在單獨使用匹伐他汀鈣時,對皮膚的透過性沒有差異。基于以上的結果,可認為在豚鼠藥效試驗(上述試驗例1-4)中,含有匹伐他汀的聚合物膠束顯示出與單獨使用匹伐他汀鈣時同等或者同等以上的藥效,是由于兩者具有同等的皮膚透過性所致。
[實施例2:卡巴拉汀的皮膚刺激性降低效果]
在實施例2中,作為藥物使用作為阿爾茨海默氏癡呆治療藥的卡巴拉汀,進行了有關混合了兩親性聚合物膠束和藥物的皮膚外用劑的試驗。
[制備例2-1:不含藥物的聚合物膠束的制備]
使在合成例1中得到的PSar65-PLLA30 100mg溶解于氯仿40mL中,利用旋轉蒸發器減壓蒸餾除去氯仿。減壓蒸餾除去后向在容器內形成的薄膜中添加純化水10mL,將容器在85℃熱水浴中浸漬20分鐘而形成膠束,使用0.2μm PTFE過濾器進行過濾,使濾液冷凍干燥,得到聚合物膠束。
平均粒徑:35nm、藥物含量:0、回收率:90%以上
[制備例2-2:聚合物膠束與藥物的混合液的制備(1)]
在肉豆蔻酸異丙酯(IPM)中添加卡巴拉汀,制備20質量%的溶液(下述1-A)。在該溶液中以濃度成為1質量%(下述1-B)或3質量%(下述1-C)的方式添加在上述制備例2-1中得到的聚合物膠束,制備了聚合物膠束分散在卡巴拉汀溶液中的懸浮液。
[制備例2-3:聚合物膠束與藥物的混合液的制備(2)]
在油狀的卡巴拉汀原液(下述2-A)中添加在上述制備例2-1中得到的聚合物膠束,對分散性進行確認,發現在相對于卡巴拉汀原液的聚合物膠束的添加量為10質量%以內時,得到了聚合物膠束均勻分散的懸浮液。在本制備例中,相對于卡巴拉汀原液以濃度成為1質量%(下述2-B)、3質量%(下述2-C)、或10質量%(下述2-D)的方式添加在制備例2-1中得到的聚合物膠束,制備了聚合物膠束分散于卡巴拉汀原液中的懸浮液。
[試驗例2-1:使用三維皮膚模型的刺激性試驗(1)]
作為試驗物質使用以下的<1-A>~<1-E>,用與前述的試驗例1-5相同的方法,實施了通過皮膚刺激性試驗專用試劑盒的對表皮的試驗物質的暴露和刺激性評價。圖7-1示出相對于陰性對照的相對存活率。
<1-A>:20%卡巴拉汀IPM溶液
<1-B>:制備例2-2中得到的、20%卡巴拉汀IPM溶液1%聚合物膠束懸浮液
<1-C>:制備例2-2中得到的、20%卡巴拉汀IPM溶液3%聚合物膠束懸浮液
<1-D>:5%SDS溶液;陽性對照
<1-E>:DPBS;陰性對照
[試驗例2-2:使用三維皮膚模型的刺激性試驗(2)]
作為試驗物質使用以下的<2-A>~<2-F>,用與前述的試驗例1-5相同的方法,實施了通過皮膚刺激性試驗專用試劑盒的對表皮的試驗物質的暴露和刺激性評價。圖7-2示出相對于陰性對照的相對存活率。
<2-A>:卡巴拉汀原液
<2-B>:制備例2-3中得到的、卡巴拉汀1%聚合物膠束懸浮液
<2-C>:制備例2-3中得到的、卡巴拉汀3%聚合物膠束懸浮液
<2-D>:制備例2-4中得到的、卡巴拉汀10%聚合物膠束懸浮液
<2-E>:5%SDS溶液;陽性對照
<2-F>:DPBS;陰性對照
試驗例2-1和2-2的結果,卡巴拉汀溶液和卡巴拉汀原液的任一者中,伴隨聚合物膠束的添加量增大相對存活率上升。基于這些結果證實了:與在聚合物膠束含有藥物的情況(上述實施例1)相同地,在聚合物膠束和藥物的混合體系中,降低藥物導致的皮膚刺激性。即,可知的是:未包封藥物的聚合物膠束通過與藥物的組合使用而作為皮膚刺激降低劑發揮作用,通過使聚合物膠束與藥物在混合狀態下同時存在,從而能夠得到降低了皮膚刺激性的皮膚外用劑。
[試驗例2-3:使用三維皮膚模型的皮膚透過試驗]
將添加了20質量%卡巴拉汀IPM懸浮和2質量%的聚合物膠束的20質量%卡巴拉汀IMP懸浮液作為供體溶液,用與上述試驗例1-6相同的方法,實施了皮膚透過試驗。作為對照,將卡巴拉汀作為藥效成分的市售的皮膚外用貼劑(Novartis Pharma制造Ixellon patch18mg;(面積:1.33cm2))粘貼在培養皮膚模型的角質層一側,實施了皮膚透過試驗。圖8示出對從試驗開始后至受體溶液采集為止的時間與藥物的累積透過量的關系進行繪圖表示的結果。
基于圖8所示的結果證實了:添加了聚合物膠束的卡巴拉汀溶液與未添加聚合物膠束的卡巴拉汀溶液相比,雖然發現皮膚透過性略有降低的傾向,但與市售的皮膚外用貼劑相比顯示出充分高的皮膚透過性,作為皮膚外用劑是有用的。
[實施例3:美金剛的皮膚刺激性降低效果]
實施例3中,作為藥物使用作為阿爾茨海默氏癡呆治療藥的美金剛鹽酸鹽,作為使兩親性聚合物膠束含有藥物的皮膚外用劑和皮膚刺激降低劑的兩親性聚合物膠束與皮膚接觸后,進行了有關使用藥物的形態的試驗。
[制備例3-1:含有美金剛的聚合物膠束的制備(52nm)]
使合成例1中得到的PSar65-PLLA30 100mg和美金剛鹽酸鹽100mg溶解于氯仿50mL中,利用旋轉蒸發器減壓蒸餾除去氯仿。減壓蒸餾除去后向在容器內形成的薄膜中添加純化水100mL,將容器在85℃熱水浴中中浸漬20分鐘而形成膠束,使其冷凍干燥,得到含有美金剛鹽酸鹽的聚合物膠束。
平均粒徑:52nm、藥物含量:100質量%、回收率:90%以上
[試驗例3-1:使用三維皮膚模型的皮膚刺激性試驗]
使用OECD承認的皮膚刺激性試驗專用試劑盒(KURABO公司制造產品編號:EPI-200SIT),用與前述的試驗例1-5相同的方法,對表皮以下述<A>~<E>的水準進行試驗物質的暴露,實施了刺激性評價。圖9示出相對于陰性對照的相對存活率。
<A>:向角質層中添加25μL的DPBS,之后立即向角質層中添加美金剛鹽酸鹽(固體)1mg
<B>:向角質層中添加25μL的DPBS,之后立即向角質層中添加在制備例3-1中得到的含有藥物的聚合物膠束2mg(相當于藥物1mg)
<C>:向角質層中添加25μL的DPBS,之后立即向角質層中添加在制備例2-1中得到的不含藥物的聚合物膠束5mg,之后進一步向角質層中添加美金剛鹽酸鹽(固體)1mg
<D>:向角質層中添加25μL的DPBS,之后立即向角質層中添加在制備例2-1中得到的不含藥物的聚合物膠束25mg,之后進一步向角質層中添加美金剛鹽酸鹽(固體)1mg
<E>:向角質層中添加5%SDS溶液;陽性對照
<F>:向角質層中添加DPBS;陰性對照
如圖9所示,<B>:含有美金剛的含有藥物的聚合物膠束與<A>:單獨使用美金剛的情況相比,相對存活率大幅上升。另外,<C>和<D>:使用聚合物膠束后使用美金剛的情況與<A>:單獨使用美金剛的情況相比,相對存活率也大幅上升,證實了皮膚刺激降低效果。基于這些結果,可知通過在使用藥物之前使用聚合物膠束,從而聚合物膠束作為皮膚刺激降低劑發揮作用。
[試驗例3-2:通過ELISA的IL-1α產生量的定量]
在上述試驗例3-1的水準A、B、D、E、F中,采集自過培養起24小時后的培養基上清液,通過市售的白細胞介素(IL)-1αELISA(酶聯免疫吸附測定:Enzyme-Linked Immuno Sorbent Assay)試劑盒,進行了培養基上清液中的IL-1α含量(產生量)的測定。需要說明的是,IL-1α是皮膚受到刺激時所產生的細胞因子中的1種。測定結果與相對存活率一同示于圖10。
如圖10所示,得到了:刺激性試驗中相對存活率越高的試樣,IL-1α的產生量越小結果。基于這些結果,從皮膚刺激機理的觀點出發,證實了通過使用聚合物膠束的皮膚刺激性降低效果。
- 還沒有人留言評論。精彩留言會獲得點贊!