調節雌激素受體突變體的方法和組合物與流程
本申請含有序列表,其已經作為呈ASCII格式的計算機可讀文本文件經由EFS-Web提交,并通過引用的方式整體并入本申請。該文本文件,創建于2014年3月13日,命名為45202-739-101seqlist.txt且大小為8KB。
技術領域
本申請描述了通過給予雌激素受體調節劑來治療婦女中特征在于一個或多個腫瘤細胞中ER基因突變的激素抗性-雌激素受體(ER)陽性乳腺癌的方法。
背景技術:
乳腺癌是最常見的癌癥形式并且是全世界婦女中癌癥死亡的首要原因。所有乳腺癌中約80%表達并且依賴于用于腫瘤生長和進展的雌激素受體(ER)。雌激素受體(“ER”)是一種通過其與內源性雌激素的相互作用而介導誘導多種生物效應的配體活化的轉錄調節蛋白。內源性雌激素包括17β-雌二醇和雌酮。已發現ER具有兩種亞型,ER-α和ER-β。雌激素和雌激素受體牽涉許多疾病或病癥,諸如乳腺癌、卵巢癌、結腸癌、肺癌、前列腺癌、子宮內膜癌、子宮癌,以及其它疾病或病癥。
大多數乳腺癌患者用藥物治療,該藥物阻斷雌激素合成(例如,芳香酶抑制劑;AIS)或通過競爭性ER結合拮抗雌二醇的作用(例如,他莫昔芬)(Puhalla S,et al Mol Oncol 2012;6(2):222-236)。盡管在疾病的不同階段,這些藥物具有充分記載的治療效用,但是許多ER+乳腺癌復發且患者最終死亡。最近,下一代全基因組和靶標測序在高達20%的來自已經對內分泌療法(主要是芳香酶抑制劑)進展的具有晚期乳腺癌的患者的腫瘤中已鑒定出ESR1(雌激素受體α基因)(Li S,et al.Cell Rep(2013);4(6):1116-1130;Merenbakh-Lamin K,et al.Cancer Res(2013);73(23):6856-6864;Robinson DR,et al.Nat Genet(2013);45(12):1446-1451;Toy W,et al.Nat Genet(2013);45(12):1439-1445;Jeselsohn R,et al.Clin Cancer Res(2014);20:1757-1767)。這些配體結合域(LBD)突變賦予apo受體高基底活性,這使得它們不依賴于配體且由此在低雌二醇環境(setting)中具有活性。在AI或他莫昔芬治療后進行性疾病的環境(包括具有ESR1突變腫瘤的患者的亞組)中,對于靶向具有強效活性的ER信號傳導的療法存在巨大的需求。
ARN-810(GDC-0810,Seragon Pharmaceuticals,Genentech Inc.)是一種拮抗雌激素作用且經蛋白酶體誘導ER降解的強效的小分子、非類固醇、選擇性ER調節劑。在臨床試驗中,ARN-810作為口服遞送的療法以治療晚期轉移性ER-α陽性(ER+)乳腺癌。
已經描述了非類固醇、選擇性雌激素受體降解劑(SERD)(WO 2011/156518;US 8703810;WO 2012/037411;WO 2012/037410;US 8299112;US 8455534;WO 2013/090829;WO 2013/142266;WO 2014/151899;WO 2013/090836;WO 2014/025138;WO 2014/205136)。
技術實現要素:
在某些實施方案中,本申請描述了用于治療特征在于具有ESR1基因突變的患者中激素抗性-雌激素受體(ER)陽性乳腺癌的方法,所述方法包括給予雌激素受體調節劑(ERM)。在一些實施方案中,所述雌激素受體調節劑為選擇性雌激素受體降解劑(SERD)。在一些實施方案中,所述雌激素受體調節劑為選擇性雌激素受體調節劑(SERM)。在一些實施方案中,所述雌激素受體調節劑為具有式(A)、(B)、(C)或(D)結構的化合物。在一些實施方案中,具有式(A)結構的化合物為具有式(A-1)結構的化合物。在一些實施方案中,具有式(C)結構的化合物為具有式(C-1)結構的化合物。在一些實施方案中,具有式(D)結構的化合物為具有式(D-1)、(D-2)、(D-3)、(D-4)、(D-5)或(D-6)結構的化合物。在一些實施方案中,ESR1基因中的突變導致形成在選自以下的位置具有氨基酸替換的ER多肽:SEQ ID NO:2的氨基酸位置6、118、269、311、341、350、380、392、394、433、463、503、534、535、536、537、538和555。在一些實施方案中,所述突變導致形成具有選自以下的氨基酸替換的ER多肽:H6Y、S118P、R269C、T311M、S341L、A350E、E380Q、V392I、R394H、S433P、S463P、R503W、V534E、P535H、L536R、L536P、L536Q、Y537N、Y537C、Y537S、D538G和R555C。在一些實施方案中,所述患者具有兩個或更多個ESR1基因中的突變。
在某些實施方案中,本申請描述了用于治療ER相關疾病或病癥的方法,其包括向具有ESR1基因突變的患者給予式(A)、(B)、(C)或(D)的雌激素受體調節劑(ERM)化合物。
式(A)化合物或其藥用鹽或溶劑化物,所述化合物具有以下結構:
其中,
Ra為-CO2H或選自以下的5元雜環:
Rb為C1-C6烷基或C3-C6環烷基;
Rc為H或F;
每個Rd獨立地選自H、鹵素、-CN、-ORe、-NHRe、-NReRf、-SRe、-S(=O)Rf、-S(=O)2Rf、C1-C6烷基和氟C1-C6烷基;
每個Re獨立地選自H、-C(=O)Rf、-C(=O)ORf、-C(=O)NHRf、C1-C6烷基、氟C1-C6烷基、C3-C6環烷基、經取代的或未經取代的單環C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;
每個Rf獨立地選自C1-C6烷基、氟C1-C6烷基、C3-C6環烷基、經取代的或未經取代的單環C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;
X為CH或N;且
n為0、1或2。
在一些實施方案中,所述雌激素受體調節劑為式(A-1)化合物或其藥用鹽或溶劑化物,所述化合物具有以下結構:
在一些實施方案中,所述雌激素受體調節劑選自化合物1-1、1-2、1-3、1-4、1-5、1-6、1-7、1-8、1-9、1-10、1-11和1-12。
在一些實施方案中,所述雌激素受體調節劑為化合物1-3。
式(B)化合物具有以下結構:
其中,
Ra為-CO2H或選自以下的5元雜環:
環C為
環D為苯基或噻吩基;
每個Rd獨立地選自H、鹵素、-CN、-ORe、-NHRe、-NReRf、-SRe、-S(=O)Rf、-S(=O)2Rf、C1-C6烷基和氟C1-C6烷基;
每個Re獨立地選自H、-C(=O)Rf、-C(=O)ORf、-C(=O)NHRf、C1-C6烷基、氟C1-C6烷基、C3-C6環烷基、經取代的或未經取代的單環C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;
每個Rf獨立地選自C1-C6烷基、氟C1-C6烷基、C3-C6環烷基、經取代的或未經取代的單環C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;
n為0、1或2,
或其藥用鹽或溶劑化物。
在一些實施方案中,所述雌激素受體調節劑選自化合物2-1、2-2、2-3、2-4和2-5。
式(C)化合物具有以下結構:
其中,
Ra為-CO2H或選自以下的5元雜環:
Rb為C1-C6烷基或C3-C6環烷基;
每個Rd獨立地選自H、鹵素、-CN、-ORe、-NHRe、-NReRf、-SRe、-S(=O)Rf、-S(=O)2Rf、C1-C6烷基和氟C1-C6烷基;
每個Re獨立地選自H、-C(=O)Rf、-C(=O)ORf、-C(=O)NHRf、C1-C6烷基、氟C1-C6烷基、C3-C6環烷基、經取代的或未經取代的單環C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;
每個Rf獨立地選自C1-C6烷基、氟C1-C6烷基、C3-C6環烷基、經取代的或未經取代的單環C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;且
n為0、1或2,
或其藥用鹽或溶劑化物。
在一些實施方案中,所述雌激素受體調節劑為式(C-1)化合物或其藥用鹽或溶劑化物,所述化合物具有以下結構:
在一些實施方案中,所述雌激素受體調節劑為化合物3-1、3-2、3-3、3-4。
式(D)化合物或其藥用鹽或溶劑化物,所述化合物具有以下結構:
其中,
R1為H、C1-C4烷基或氟C1-C4烷基;
R2為H、F、C1-C4烷基或氟C1-C4烷基;
R3為H、鹵素、-CN、-OR6、-NHR6、-NR6R7、-SR6、-S(=O)R7、-S(=O)2R7、C1-C4烷基或C1-C4氟烷基;
每個R4獨立地選自H、鹵素、-CN、-OH、C1-C6烷基、氟C1-C4烷基、氟C1-C4烷氧基和C1-C4烷氧基;每個R5為H、F、Cl、-OH、-CH3、-CF3或-OCH3;
每個R6獨立地選自H、-C(=O)R7、-C(=O)OR7、-C(=O)NHR7、C1-C6烷基、氟C1-C6烷基、C3-C6環烷基、經取代的或未經取代的C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;每個R7獨立地選自C1-C6烷基、氟C1-C6烷基、經取代的或未經取代的C3-C6環烷基、經取代的或未經取代的單環C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;
n為0、1或2;且t為1或2。
在一些實施方案中,所述雌激素受體調節劑為具有以下結構的式(D-1)化合物:
在一些實施方案中,所述雌激素受體調節劑為具有以下結構的式(D-2)化合物:
在一些實施方案中,所述雌激素受體調節劑為具有以下結構的式(D-3)化合物:
在一些實施方案中,所述雌激素受體調節劑為具有以下結構的式(D-4)化合物:
在一些實施方案中,所述雌激素受體調節劑選自化合物4-1、4-2、4-3、4-4、4-5、4-6、4-7、4-8、4-9、4-10、4-11、4-12、4-13、4-14、4-15、4-16、4-17、4-18、4-19、4-20、4-21、4-22、4-23、4-24、4-25、4-26、4-27、4-28、4-29、4-30、4-31、4-32、4-33、4-34、4-35、4-36、4-37、4-38、4-39、4-40、4-41、4-42、4-43、4-44和4-45。
在一些實施方案中,所述雌激素受體調節劑為化合物4-23。
在一些實施方案中,所述雌激素受體調節劑為化合物1-3或4-23。
在一些實施方案中,所述雌激素受體調節劑為(E)-3-(4-((E)-2-(2-氯-4-氟苯基)-1-(1H-吲唑-5-基)丁-1-烯-1-基)苯基)丙烯酸或(S)-2-(4-(2-(3-(氟甲基)氮雜環丁-1-基)乙氧基)苯基)-3-(3-羥基苯基)-4-甲基-2H-色烯-6-醇。
在一些實施方案中,所述雌激素受體調節劑為(E)-3-(4-((E)-2-(2-氯-4-氟苯基)-1-(1H-吲唑-5-基)丁-1-烯-1-基)苯基)丙烯酸。
在一些實施方案中,所述雌激素受體調節劑為(S)-2-(4-(2-(3-(氟甲基)氮雜環丁-1-基)乙氧基)苯基)-3-(3-羥基苯基)-4-甲基-2H-色烯-6-醇。
在一些實施方案中,所述ER相關的疾病或病癥為癌癥。在一些實施方案中,所述癌癥為乳腺癌。在一些實施方案中,所述乳腺癌為轉移性乳腺癌。在一些實施方案中,所述乳腺癌為激素抗性乳腺癌。在一些實施方案中,所述乳腺癌為雌激素受體陽性乳腺癌。在一些實施方案中,所述乳腺癌為HER2陽性乳腺癌。在一些實施方案中,所述乳腺癌為HER2陰性乳腺癌。在一些實施方案中,所述乳腺癌對用芳香酶抑制劑的治療具有抗性。在一些實施方案中,ESR1基因中的突變為體細胞突變。在一些實施方案中,所述患者表達野生型ER和突變型ER。在一些實施方案中,所述患者表達兩種突變型ER-α多肽的同二聚體。在一些實施方案中,所述患者表達一種野生型ER-α多肽和一種突變型ER-α多肽的異二聚體,或一種野生型ER-β多肽和一種突變型ER-α多肽的異二聚體。在一些實施方案中,所述患者具有腫瘤。在一些實施方案中,多數腫瘤細胞表達突變型ER。在一些實施方案中,所述患者處于絕經前或絕經后。在一些實施方案中,所述患者已經歷一種或多種抗癌療法失敗。在一些實施方案中,所述患者已接受化學治療劑、生物療法、癌癥疫苗、血管生成抑制劑、激素療法、放射療法、外科手術或它們的任意組合。在一些實施方案中,所述生物療法是肽、細胞因子、抗體、治療性病毒、治療性細菌、基因療法、siRNA、過繼性T細胞轉移或它們的任意組合。在一些實施方案中,所述患者已接受芳香酶抑制劑、選擇性雌激素受體調節劑(SERM)、選擇性雌激素降解劑(SERD)、磷酸肌醇3-激酶(PI3K)/mTOR途徑抑制劑、CDK4/6抑制劑、HER-2抑制劑、EGFR抑制劑、PD-1抑制劑、聚ADP-核糖聚合酶(PARP)抑制劑、組蛋白脫乙酰酶(HDAC)抑制劑、HSP90抑制劑、VEGFR抑制劑、AKT抑制劑、化學療法或它們的任意組合。在一些實施方案中,所述患者已接受氟維司群(fulvestrant)、他莫昔芬(tamoxifen)、阿那曲唑(anastrozole)、來曲唑(letrozole)、依西美坦(exemestane)、GDC0032、戈舍瑞林(goserelin)、亮丙瑞林(leuprolide)、雷洛昔芬(raloxifene)、托瑞米芬(toremifene)、乙酸甲地孕酮(megestrol acetate)、巴多昔芬(bazedoxifene)或它們的任意組合。在一些實施方案中,所述患者已接受蒽環類抗生素(anthracycline)、紫杉烷(taxane)、鉑劑、埃坡霉素(epothilone)或核苷類似物。在一些實施方案中,所述患者已接受順鉑(cisplatin)、卡鉑(carboplatin)、卡培他濱(capecitabine)、環磷酰胺(cyclophosphamide)、多西他賽(docetaxel)、多柔比星(doxorubicin)、表柔比星(epirubicin)、艾日布林(eribulin)、氟尿嘧啶(fluorouracil)、吉西他濱(gemcitabine)、伊沙匹隆(ixabepilone)、米托蒽醌(mitoxantrone)、甲氨蝶呤(methotrexate)、紫杉醇(paclitaxel)、帕米膦酸(pamidronate)、長春瑞濱(vinorelbine)或它們的任意組合。在一些實施方案中,所述患者已接受帕妥珠單抗(pertuzumab)、曲妥單抗(trastuzumab)、拉帕替尼(lapatinib)、依維莫司(everolimus)、貝伐單抗(bevacizumab)、坦西莫司(temsirolimus)或它們的任意組合。在一些實施方案中,所述ESR1突變導致替換、插入或缺失一個或多個ER多肽中的氨基酸。在一些實施方案中,所述ESR1突變導致雌激素受體的N末端結構域、DNA結合域、鉸鏈區或配體結合域中的氨基酸替換。在一些實施方案中,所述ESR1突變導致雌激素受體的配體結合域中的氨基酸替換。在一些實施方案中,所述氨基酸替換位于SEQ ID NO:2的6、118、269、311、341、350、380、392、394、433、463、503、534、535、536、537、538和555位氨基酸。在一些實施方案中,所述氨基酸替換選自H6Y、S118P、R269C、T311M、S341L、A350E、E380Q、V392I、R394H、S433P、S463P、R503W、V534E、P535H、L536R、L536P、L536Q、Y537N、Y537C、Y537S、D538G和R555C。在一些實施方案中,所述氨基酸替換選自Y537N、Y537C、Y537S和D538G。在一些實施方案中,所述方法還包括給予一種或多種用于治療ER相關疾病或病癥的治療劑。在一些實施方案中,所述方法還包括給予額外的抗癌劑。在一些實施方案中,所述方法還包括給予芳香酶抑制劑。
在某些實施方案中,本申請所述的是針對用式(A)、(B)、(C)或(D)化合物調節劑化合物的治療選擇患有ER相關疾病或病癥的患者的方法:其包括1)在包含來自患者的核酸的樣品中檢測ESR1基因中的突變;和2)若患者具有ESR1突變,則針對用所述化合物的治療選擇患者。
在一些實施方案中,所述核酸為RNA或DNA。在一些實施方案中,所述DNA為基因組DNA。在一些實施方案中,所述方法還包括從核酸樣品中分離mRNA。在一些實施方案中,所述方法還包括從核酸樣品中擴增包含所述突變的核酸分子。在一些實施方案中,通過聚合物酶鏈式反應(PCR)或數字PCR進行擴增。在一些實施方案中,PCR擴增包括使用一對側翼具有包含所述突變的區域的寡核苷酸引物。在一些實施方案中,所述方法包括使核酸與序列特異性核酸探針接觸,其中所述序列特異性核酸探針與具有所述突變的核酸結合且不與野生型核酸結合。在一些實施方案中,所述樣品包含來自一個或多個腫瘤細胞的核酸。在一些實施方案中,所述腫瘤細胞取自腫瘤活檢樣品、血液樣品、血清樣品、淋巴樣品或骨髓穿刺液。在一些實施方案中,所述腫瘤細胞是循環腫瘤細胞。在一些實施方案中,所述樣品包含循環腫瘤DNA(ctDNA)。
在某些實施方案中,本申請所述的是試劑盒,其包含一種或多種用于檢測ESR1突變的試劑以及式(A)、(B)、(C)或(D)的化合物。在一些實施方案中,所述試劑盒包含一種或多種引物或用于檢測ESR1中的突變的探針。在一些實施方案中,所述ESR1突變導致替換、插入或缺失一個或多個ER多肽中的氨基酸。在一些實施方案中,所述ESR1突變導致雌激素受體的N末端結構域、DNA結合域、鉸鏈區或配體結合域中的氨基酸替換。在一些實施方案中,所述ESR1突變導致雌激素受體的配體結合域中的氨基酸替換。在一些實施方案中,所述氨基酸替換位于SEQ ID NO:2的6、118、269、311、341、350、380、392、394、433、463、503、534、535、536、537、538和555位氨基酸。在一些實施方案中,所述氨基酸替換選自H6Y、S118P、R269C、T311M、S341L、A350E、E380Q、V392I、R394H、S433P、S463P、R503W、V534E、P535H、L536R、L536P、L536Q、Y537N、Y537C、Y537S、D538G和R555C。在一些實施方案中,所述氨基酸替換選自Y537N、Y537C、Y537S和D538G。
在一些實施方案中,式(A)、(B)、(C)、(D)的雌激素受體調節劑口服給予患者。在一些實施方案中,式(A)、(B)、(C)、(D)的雌激素受體調節劑每天給予。在一些實施方案中,式(A)、(B)、(C)、(D)的雌激素受體調節劑以連續每日給藥方案給予。
在一些實施方案中,式(A)、(B)、(C)、(D)的雌激素受體調節劑以約5mg/天至約1000mg/天給予。在一些實施方案中,式(A)、(B)、(C)、(D)的雌激素受體調節劑的治療有效量為約10mg/天至約100mg/天。
在一些實施方案中,式(A)、(B)、(C)、(D)的雌激素受體調節劑每日一次或每日多次給予。在一些實施方案中,式(A)、(B)、(C)、(D)的雌激素受體調節劑每日一次、每日兩次、每日三次或每日四次給予。
本申請所述的方法、用途和組合物的其它目的、特征和優點將從以下詳細描述中變得顯而易見。然而,應當理解的是,詳細描述和具體實施例,雖然指示具體實施方案,但僅以說明的方式給出,這是因為從該詳細描述中本公開的精神和范圍內的各種改變和修改對于本領域技術人員將變得顯而易見。
具體實施方式
乳腺癌是最常見的癌癥形式并且是全世界婦女中癌癥死亡的首要原因。所有乳腺癌中約80%表達并依賴于腫瘤生長和進展的雌激素受體(ER)。其它癌癥也被認為依賴于用于生長和存活的ER-α信號傳導,諸如卵巢癌和子宮內膜癌。
雌激素受體α(ER-α)和雌激素受體β(ER-β)是類固醇激素受體,其為大的核受體超家族成員。核受體共享共同的模塊結構,其最低限度包括DNA結合域(DBD)和配體結合域(LBD)。類固醇激素受體是作為配體調節的轉錄因子的可溶性細胞內蛋白質。脊椎動物含有五個密切相關的類固醇激素受體(雌激素受體、雄激素受體、孕激素受體、糖皮質激素受體、鹽皮質激素受體),其調節廣譜的生殖、代謝和發育活動。ER的活性受內源性雌激素,包括17β-雌二醇和雌酮的結合控制。
ER-α基因位于6q25.1且編碼595AA蛋白。ER-β基因位于染色體14q23.3上且產生530AA蛋白質。然而,由于選擇性剪接和翻譯起始位點,這些基因中的每一個可產生多種同工型。除了DNA結合域(稱為C結構域)和配體結合域(E結構域)之外,這些受體還包含N-末端(A/B)結構域,連接C和E結構域的鉸鏈(D)結構域,和C-末端延伸(F結構域)(Gronemeyer and Laudet;Protein Profile 2:1173-1308,1995)。雖然ER-α和ER-β的C和E結構域是相當保守的(分別為95%和55%氨基酸同一性),但是A/B、D和F結構域的保守性差(低于30%的氨基酸同一性)。兩種受體都參與雌性生殖道的調節和發育,但在中樞神經系統、心血管系統和骨代謝中也發揮多種作用。
類固醇激素受體的配體結合口袋深深地埋在配體結合域內。結合后,配體變成該結構域的疏水核心的一部分。因此,大多數類固醇激素受體在不存在激素的情況下是不穩定的,并且需要來自伴侶蛋白諸如Hsp90的輔助,以便維持激素結合能力(competency)。與Hsp90的相互作用也控制這些受體的核易位。配體結合穩定受體并啟動釋放伴侶蛋白的序列構象變化,改變各種受體結構域之間的相互作用并重塑蛋白相互作用表面,其允許這些受體易位至細胞核中,結合DNA并參與與染色質重塑復合物和轉錄器的相互作用。雖然ER可與Hsp90相互作用,但是這種相互作用不是激素結合所必需的,并且取決于細胞環境,apo-ER既可以是胞質的也可以是核的。生物物理研究表明有助于受體的穩定性的是DNA結合而不是配體結合(Greenfield et al.,Biochemistry 40:6646-6652,2001)。
ER可通過結合稱為雌激素響應元件(ERE)的特異性DNA序列基序(經典途徑)直接與DNA相互作用,或通過蛋白質-蛋白質相互作用(非經典途徑)間接與DNA相互作用(Welboren et al.,Endocrine-Related Cancer 16:1073-1089,2009)。在非經典途徑中,ER已顯示與其它轉錄因子包括SP-1、AP-1和NF-κB相連。這些相互作用似乎在ER調節細胞增殖和分化的能力中發揮關鍵作用。
兩種類型的ER DNA相互作用可導致依賴于由相應的ER-ERE復合物募集的轉錄輔助調節因子的基因激活或抑制(Klinge,Steroid 65:227-251,2000)。輔助調節因子的募集主要由兩個蛋白質相互作用表面AF2和AF1介導。AF2位于ER E結構域中并且其構象由配體直接調節(Brzozowski et al.,Nature 389:753-758,1997)。完全激動劑似乎促進輔助激活因子的募集,而弱激動劑和拮抗劑則有助于輔助抑制因子的結合。對用AF1調節蛋白質了解較少,但其可通過絲氨酸磷酸化來控制(Ward and Weigel,Biofactors 35:528-536,2009)。所涉及的磷酸化位點(S118)之一似乎在存在拮抗劑諸如他莫昔芬的情況下控制ER的轉錄活性,所述拮抗劑在乳腺癌的治療中發揮重要作用。盡管完全激動劑似乎以某些構象阻止ER,但弱激動劑傾向于使ER保持在不同構象之間的平衡中,這允許輔助調節因子所有組分中的細胞依賴性差異以細胞依賴性方式調節ER的活性(Tamrazi et al.,Mol.Endocrinol.17:2593-2602,2003)。ER與DNA的相互作用是動態的,并且通過包括但不限于通過蛋白酶體降解ER的方法來調節(Reid et al.,Mol Cell 11:695-707,2003)。用配體降解ER為對可用的抗激素治療具有雌激素敏感性和/或抗性的疾病或病癥提供有吸引力的治療策略。
ER信號傳導對于女性生殖器官(包括乳房)的發育和維持、排卵和子宮內膜的增厚是至關重要的。ER信號傳導還在骨量、脂質代謝、癌癥等中發揮作用。
雌激素活性和/或合成的調節是具有ER陽性(ER+)乳腺癌的女性的治療方法的主要內容。ER-α拮抗劑他莫昔芬已用于治療絕經前和絕經后婦女的早期和晚期ER-α陽性乳腺癌。氟維司群(FASLODEXTM,Astra Zeneca),即一種基于類固醇的ER拮抗劑,用于治療雖用他莫昔芬治療但仍有進展的婦女的乳腺癌。類固醇和非類固醇芳香酶抑制劑也用于治療人類的癌癥。在一些實施方案中,類固醇和非類固醇芳香酶抑制劑(例如阿那曲唑、來曲唑和依西美坦)阻斷絕經后婦女中由雄烯二酮和睪酮產生雌激素,從而阻斷癌癥中的ER依賴性生長。除了這些抗激素劑之外,在一些情況下用多種其它化療劑諸如蒽環類、鉑類、紫杉烷類治療進行性ER陽性乳腺癌。在一些情況下,用單克隆抗體曲妥單抗(HERCEPTINTM,Genentech Inc.)或小分子pan-ERB-B抑制劑拉帕替尼治療攜帶ERB-B/HER2酪氨酸激酶受體的基因擴增的ER陽性乳腺癌。盡管具有一系列抗激素、化學治療和小分子以及基于抗體的靶向療法,許多具有ER-α陽性乳腺癌的婦女發展進展性轉移性疾病,并需要新的療法。重要的是,在現有抗激素以及其它療法上進展的大多數ER陽性腫瘤被認為仍然依賴于用于生長和存活的ER-α。因此,需要在轉移性疾病和獲得性耐藥的情況下具有活性的新型ER-α靶向劑。
盡管對于芳香酶抑制劑或他莫昔芬而言變得具有難治性,抗性腫瘤細胞的生長和存活仍然依賴于ER信號傳導;因此,具有ER+乳腺癌患者在先前激素療法進展后仍然可進行第二/三線激素治療。在一些實施方案中,在內分泌耐藥狀態下,ER可以配體非依賴性方式發出信號。在一些實施方案中,具有雙重作用機制(諸如ER拮抗作用+降解)的藥物具有靶向配體依賴性和非依賴性ER信號傳導兩者的潛力,并因此改善晚期ER+乳腺癌的治療結果。
來自激素抗性乳腺癌患者的腫瘤樣品的基因組分析揭示了雌激素受體α基因ESR1中的突變,其有助于ER+乳腺癌中的激素抗性。在某些情況下,這種突變導致雌激素受體的配體非依賴性激活。如本申請所述,特定的ER調節劑化合物在ER突變體環境中有效抑制ER信號傳導。因此,這種ER調節劑化合物可用于治療具有突變型ER的ER+乳腺癌患者。
在某些情況下,所述ER突變為ESR1基因中的體細胞突變。在一些實施方案中,所述體細胞突變在癌癥治療過程中發生于癌細胞(例如,乳腺癌細胞)中。在一些實施方案中,所述患者具有野生型ESR1基因和突變的ESR1基因兩者(即,雜合子)。在一些實施方案中,癌細胞經歷體細胞突變以產生突變的ESR1基因。在一些實施方案中,所述突變的癌細胞復制產生許多突變的癌細胞(例如,歸因于體細胞突變的具有突變的ESR1基因的擴大種群的癌細胞)。在一些實施方案中,所述患者表達野生型ER-α和突變型ER-α(即,異源表達)。在一些實施方案中,所述突變型ER-α包含兩種突變型ER-α多肽(即,同二聚體)。在一些實施方案中,所述突變型ER-α包含野生型ER-α多肽和突變型ER-α(即,異二聚體)。在一些實施方案中,所述體細胞突變賦予癌細胞對癌癥治療的抗性。在一些實施方案中,許多癌細胞中的體細胞突變賦予患者對癌癥治療的抗性。在一些實施方案中,對于癌癥(例如,乳腺癌)的治療,所述突變賦予基于激素的療法的抗性。在一些實施方案中,所述癌癥為ER+乳腺癌。
在一些實施方案中,所述ER突變為遺傳的ESR1基因中的種系突變。在一些實施方案中,所述突變增加發展乳腺癌的風險。在一些實施方案中,所述種系突變賦予癌細胞對癌癥治療的抗性。在一些實施方案中,許多癌細胞(例如,乳腺癌細胞)中的種系突變賦予患者對癌癥治療的抗性。在一些實施方案中,對于癌癥(例如,乳腺癌)的治療,所述種系突變賦予基于激素的療法的抗性。在一些實施方案中,所述癌癥為ER+乳腺癌。
在一個方面,本申請描述用于治療具有一個或多個ESR1基因中的突變的患者的雌激素受體調節劑的化合物。在一些實施方案中,所述患者在一個或多個癌細胞,或多數癌細胞中具有一個或多個ESR1基因中的突變。在一些實施方案中,所述ER調節劑化合物為選擇性雌激素受體降解劑(SERD),其靶向用于降解的ER-α。在一些實施方案中,所述ER調節劑化合物為具有組織特異性ER性質的選擇性雌激素受體調節劑(SERM)。
在一些實施方案中,在基于細胞的測定中,本申請所述的化合物導致穩態ER-α水平的降低(例如,ER降解),并且可用于治療雌激素敏感性疾病或病癥和/或已經對抗激素療法發展出抗性的疾病或病癥。在一些實施方案中,本申請所公開的ER調節劑化合物使核中雌激素受體的水平最小化。在一些實施方案中,所述ER調節劑化合物與雌激素競爭結合至雌激素受體。在一些實施方案中,所述ER調節劑化合物為與雌激素競爭結合至雌激素受體的非類固醇ERα拮抗劑。在一些實施方案中,所述ER調節劑化合物完全拮抗野生型ER-α對雌激素的響應。在一些實施方案中,所述ER調節劑化合物完全拮抗突變型ER-α對雌激素的響應。在一些實施方案中,與野生型ER-α相比,所述突變型ER-α展現出增加的基底活性。在一些實施方案中,所述突變型ER-α展現出配體非依賴性活性(例如,組成性活性)。在一些實施方案中,所述突變型ER-α在不存在雌二醇的情況下展現出組成性活性。在一些實施方案中,所述ER調節劑抑制突變型ER-α的配體非依賴性活性(例如,組成性活性)。在一些實施方案中,所述ER調節劑誘導突變型ER-α中的構象改變。在一些實施方案中,所述ER調節劑誘導抑制突變型ER-α的活性的突變型ER-α中的構象改變。在一些實施方案中,所述ER調節劑誘導乳腺癌細胞中野生型ER-α的蛋白酶體降解。在一些實施方案中,所述ER調節劑誘導乳腺癌細胞中突變型ER-α的蛋白酶體降解。在一些實施方案中,所述ER調節劑不依賴蛋白酶體降解而抑制細乳腺癌胞中突變型ER-α。在一些實施方案中,所述ER調節劑化合物完全拮抗ER-α對雌激素的響應并誘導乳腺癌細胞中野生型ER-α的蛋白酶體降解。在一些實施方案中,所述ER調節劑化合物完全拮抗突變型ER-α對雌激素的響應并誘導乳腺癌細胞中突變型ER-α的蛋白酶體降解。在一些實施方案中,所述ER調節劑化合物完全拮抗突變型ER-α對雌激素的響應而不誘導乳腺癌細胞中突變型ER-α的蛋白酶體降解。在一些實施方案中,所述ER調節劑化合物抑制表達突變型ER-α的乳腺癌細胞的增殖。在一些實施方案中,所述ER調節劑化合物展現出良好的口服生物利用度。
本申請公開的ER調節劑化合物可單獨或與調節乳腺癌中其它關鍵途徑的其它藥物組合用于治療特征在于ESR1基因中的一個或多個突變的激素抗性ER陽性乳腺癌,所述其它途徑包括但不限于抑制IGF1R、EGFR、Erb-B2、Erb-B3、PI3K/AKT/mTOR途徑、HSP90、PARP、細胞周期蛋白依賴性激酶(即CDK4/6)、VEGF受體或組蛋白脫乙酰酶的那些途徑。在一些實施方案中,本申請公開的ER調節劑化合物可單獨或與用于治療乳腺癌的其它藥物組合用于治療特征在于ESR1基因中的一個或多個突變的激素抗性ER陽性乳腺癌,所述其它藥物包括但不限于,芳香酶抑制劑、蒽環類抗生素、鉑類、氮芥、烷化劑、紫杉烷、核苷類似物、磷酸肌醇3-激酶(PI3K)/mTOR途徑抑制劑、CDK 4/6抑制劑、HER-2抑制劑、EGFR抑制劑、聚ADP-核糖聚合酶(PARP)抑制劑、組蛋白脫乙酰酶(HDAC)抑制劑、HSP90抑制劑、VEGFR抑制劑、AKT抑制劑和化學療法。用于治療乳腺癌的示例性藥物包括但不限于,氟維司群、他莫昔芬、阿那曲唑、來曲唑、依西美坦、GDC-0032、GDC-0068、戈舍瑞林、亮丙瑞林、雷洛昔芬、托瑞米芬、乙酸甲地孕酮、巴多昔芬、順鉑、卡鉑、卡培他濱、環磷酰胺、多西他賽、多柔比星、表柔比星、艾日布林、非格司亭、氟尿嘧啶、吉西他濱、伊沙匹隆、LEE011、LY2835219、米托蒽醌、甲氨蝶呤、紫杉醇、帕米膦酸、長春瑞濱、非格司亭(pegfilgrastim)、帕妥珠單抗、曲妥單抗、拉帕替尼、依維莫司、貝伐單抗、坦西莫司及它們的組合,以及本申請所述的其它藥物。用于治療乳腺癌的其它非限制性示例性藥物在本申請他處提供。
在一些實施方案中,本發明涉及本申請所述的雌激素受體調節劑化合物,其用于治療本申請所述的ER相關疾病或病癥。
在一些實施方案中,本發明涉及藥物組合物,其包含用于治療本申請所述的ER相關疾病或病癥的本申請所述的雌激素受體調節劑化合物和一種或多種藥用賦形劑。
在一些實施方案中,本發明涉及本申請所述的雌激素受體調節劑化合物在制備用于治療本申請所述的ER相關疾病或病癥的藥物中的用途。
在一些實施方案中,本發明涉及本申請所述的雌激素受體調節劑化合物用于治療本申請所述的ER相關疾病或病癥的用途。
在一些實施方案中,本發明涉及治療患者的ER相關疾病或病癥的方法,其包括給予本申請所述的雌激素受體調節劑化合物。
附圖說明
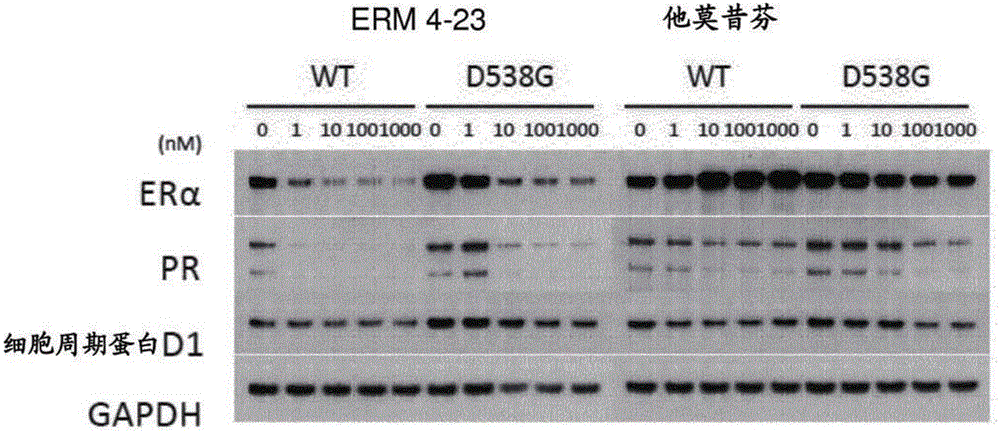
圖1和2示出不存在E2(炔雌醇)的情況下在誘導表達野生型(WT)和突變型ERα的MCF7中的ERα降解測定。在含有100ng/ml Dox(多柔比星)的缺乏雌激素(estrogen-depleted)的培養基中將細胞用增加劑量的氟維司群(圖1)處理24小時。用來自表1的雌激素受體調節劑(ERM)1-3(圖1)和ERM 4-23(圖2)而非他莫昔芬(圖2),觀察到突變的ERa降解。由PR和細胞周期蛋白D1水平證明功能輸出。
圖3示出一組7只攜帶MCF-7EF1:Y537S ESR1-突變體(Y537S)的免疫受損小鼠中歷時28天的擬合腫瘤體積變化:每日一次PO(口服)給予媒介物,以高劑量200mg/kg給予氟維司群;AUC約20-30x臨床暴露以上,以及100mg/kg/天來自表1的雌激素受體調節劑(ERM)1-3和100mg/kg/天來自表4的ERM 4-23。
圖4示出一組5只攜帶包含ESR1L536P突變體的HCI-005乳腺腫瘤(NOD.SCID OVX中的BC PDX模型)異種移植物(ER+,PR+,HER2+)的免疫受損小鼠中歷時40天的擬合腫瘤體積變化:每日一次PO(口服)給予媒介物(+)、媒介物(-),以60mg/kg/天給予他莫昔芬,以200mg/kg(QD 3x/wk)給予氟維司群,以100mg/kg/天給予ERM 1-3,以及以100mg/kg/天給予ERM4-23。媒介物(+)為含有炔雌醇(0.1mg/kg)的溶劑/緩沖液。媒介物(-)為不含有炔雌醇的溶劑/緩沖液。
圖5示出一組7只攜帶包含ESR1L536P突變體的HCI-005乳腺腫瘤(NOD.SCID OVX中的BC PDX模型)異種移植物(ER+,PR+,HER2+)的免疫受損小鼠中具有Fold Over Start的歷時56天的擬合腫瘤體積變化:每日一次PO(口服)給予媒介物(+E2)、媒介物(-E2),以60mg/kg/天給予他莫昔芬,以200mg/kg(QD 3x/wk)給予氟維司群,以100mg/kg/天給予ERM 1-3,以及以100mg/kg/天給予ERM 4-23。媒介物(+E2)為含有炔雌醇(0.1mg/kg)的溶劑/緩沖液。媒介物(-E2)為不含有炔雌醇的溶劑/緩沖液。
圖6示出一組7-8只攜帶WHIM 20Y537S ESR1-突變體(Y537S)、PIK3CA突變體(E542K)乳腺腫瘤(NOD.SCID OVX中的BC PDX模型)異種移植物的免疫受損小鼠中歷時35天的擬合腫瘤體積變化:每日一次PO(口服)給予媒介物(+E2)、媒介物(-E2),以60mg/kg/天給予枸櫞酸他莫昔芬,以50mg/kg給予氟維司群,以100mg/kg/天給予ERM 1-3,以及以100mg/kg/天給予ERM 4-23。
圖7示出一組7只攜帶WHIM 20Y537S ESR1-突變體(Y537S)、PIK3CA突變體(E542K)乳腺腫瘤(NSG OVX中的BC PDX模型)異種移植物的免疫受損小鼠中歷時28天的擬合腫瘤體積變化:每日一次PO(口服)給予媒介物(+E2)、媒介物(-E2),以200mg/kg每周三次皮下給予氟維司群,以100mg/kg/天給予ERM 1-3,以及以10和100mg/kg/天給予ERM 4-23。
圖8和9示出攜帶WHIM 20Y537S ESR1-突變體(Y537S)、PIK3CA突變體(E542K)乳腺腫瘤、患者衍生的(BC PDX模型)異種移植物模型的免疫受損小鼠中ERα(alpha)與肌動蛋白水平的比率(圖8)以及PR-A與肌動蛋白水平的比率(圖9)的條形圖:所述模型歷時4天每日一次PO(口服)給予100微升(μl)媒介物,以200mg/kg給予氟維司群,以100mg/kg給予ERM 1-3,以及以100mg/kg給予ERM 4-23。
圖10示出乳腺癌患者在基線、治療前(左側)和以600mg/天連續每日口服給予ERM 1-3(ARN-810)一個月后(右側)的[18F]FES-PET圖像,其中在給予后23小時采集圖像。確認患者具有含ESR1D538G突變的軟組織損害。
定義
除非另有定義,否則本申請使用的所有技術和科學術語具有與所要求保護的主題所屬領域的技術人員通常理解的相同的含義。除非另有說明,否則在本申請的整個公開內容中提及的所有專利、專利申請、公開的申請和出版物、GENBANK序列、網站和其它公開的材料通過引用整體并入。在本申請中存在術語的多個定義的情況下,以本部分中的定義為準。在參考URL或其它這樣的標識符或地址時,應當理解,這樣的標識符可以改變,并且互聯網上的特定信息可為不定的,但是等效信息是已知的并且可容易地訪問,諸如通過搜索互聯網和/或適當的數據庫。有關參考文獻證明這種信息的可用性和公開傳播。通常,細胞培養、細胞感染、抗體生產和分子生物學方法的操作是本領域常用的方法。這樣的標準技術可在例如參考手冊諸如Sambrook et al.(2000)和Ausubel et al.(1994)中找到。
除非上下文另有明確指示,否則本申請使用的單數形式“一個”、“一種”和“所述”包括復數指代。在本申請中,除非另有特別說明,單數的使用包括復數。如本申請所用,除非另有說明,否則“或”的使用意指“和/或”。此外,術語“包括”以及其它形式(例如,“包含”、“含有”和“涵蓋”)的使用是非限制性的。
本申請使用的范圍和量可表示為“約”特定值或范圍。約還包括確切量。因此,“約5μg”意指“約5μg”也指“5μg”。通常,術語“約”包括預期在實驗誤差內的量。
本申請使用的“雌激素受體多肽”或“ER多肽”是指任何雌激素受體蛋白或多肽,包括但不限于,重組產生的蛋白、合成產生的蛋白、天然雌激素受體蛋白質和從細胞或組織提取的雌激素受體蛋白。ER多肽包括來自不同物種的相關多肽,包括但不限于人源和非人源的動物。非人源的ER多肽包括但不限于,非人靈長類動物(例如黑猩猩和猿)、鼠科動物(例如,小鼠和大鼠)、犬科動物(狗)、貓科動物(貓)、兔屬動物(兔)、禽類(鳥)、牛科動物(牛)、綿羊類(綿羊)、豬類(豬)、馬科動物(馬)、魚類(魚)、蛙科動物(蛙)和其它哺乳動物或非哺乳動物ER多肽。示例性ER多肽包括例如SEQ ID NO:2。ER多肽包括野生型ER、等位基因變體同工型、體細胞突變(包括在腫瘤中發現的那些)、來自核酸的合成分子、從人組織和細胞分離的蛋白質以及它們的經修飾形式。本申請提供的ER多肽可通過缺失、添加或取代一個或多個氨基酸來修飾一級氨基酸序列,從而得到進一步修飾。本申請使用的ER蛋白包括ER多肽的單體和二聚體形式,包括ER-α和ER-β多肽的二聚體形式(例如,ER-α(αα)或ER-β(ββ)同二聚體或ERαβ(αβ)異二聚體)。
本申請使用的“突變的雌激素受體”或“突變型ER”是指與野生型ER相比通過缺失、添加或取代一個或多個氨基酸來修飾一級氨基酸序列從而得到修飾的任何雌激素受體蛋白或多肽。在一些實施方案中,突變型ER包括突變型ER多肽和野生型多肽的異二聚體。在一些實施方案中,突變雌激素受體(ER)包含兩種突變型ER多肽的同二聚體。
本申請使用的術語“調節”意指直接或間接與靶標相互作用從而改變靶標的活性,包括(僅舉例來說)增強靶標的活性、抑制靶標的活性、限制靶標的活性或者擴展靶標的活性。
本申請使用的術語“調節劑”是指直接或間接與靶標相互作用的分子。所述相互作用包括但不限于,激動劑、部分激動劑、反向激動劑、拮抗劑、降解劑或它們的組合的相互作用。在一些實施方案中,調節劑是拮抗劑。本申請使用的雌激素受體(ER)調節劑是與雌激素受體(例如,ER-α)相互作用的分子。在一些實施方案中,調節劑是降解劑。
本申請使用的“選擇性雌激素受體調節劑”或“SERM”是指差異性調節不同組織中的雌激素受體活性的分子。例如,在一些實施方案中,SERM在一些組織中展現ER拮抗劑活性,且在其它組織中展現ER激動劑活性。在一些實施方案中,SERM在一些組織中展現ER拮抗劑活性,在其它組織中展現最小ER激動劑活性或無該活性。在一些實施方案中,SERM在乳腺組織、卵巢組織、子宮內膜組織和/或子宮頸組織中展現ER拮抗劑活性,但在子宮組織中展現最小ER激動劑活性或無該活性。在一些實施方案中,SERM展現ER降解性質。在一些實施方案中,SERM在一些組織中展現ER降解性質,而在其它組織中沒有ER降解性質。在一些實施方案中,SERM展現ER降解和ER拮抗劑性質。在一些實施方案中,SERM在一些組織中展現ER降解和ER拮抗劑性質,但在其它組織中展現ER降解性質而無ER激動劑活性。在一些實施方案中,SERM在一些組織中展現ER降解和ER拮抗劑性質,但在其它組織中展現ER拮抗劑性質而無ER降解性質。在一些實施方案中,SERM在乳腺組織、卵巢組織、子宮內膜組織和/或子宮頸組織中展現ER降解和ER拮抗劑性質,但在子宮組織中展現最小或沒有ER降解和/或ER拮抗劑性質。
本申請使用的術語“拮抗劑”是指結合核激素受體并隨后降低激動劑誘導的核激素受體轉錄活性的小分子藥物。
本申請使用的術語“激動劑”是指不存在已知激動劑的情況下結合核激素受體并隨后提高核激素受體轉錄活性的小分子藥物。
本申請使用的術語“反相激動劑”是指不存在已知激動劑的情況下結合核激素受體并隨后降低核激素受體轉錄活性的基礎水平的小分子藥物。
本申請使用的術語“降解劑”是指結合核激素受體并隨后降低所述受體的穩態蛋白水平的小分子藥物。在一些實施方案中,本申請所述的降解劑降低穩態雌激素受體水平至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%。
本申請使用的術語“選擇性雌激素受體降解劑”或“SERD”是指優先結合雌激素受體而非其它受體并隨后降低穩態雌激素受體水平的小分子藥物。
本申請使用的術語“ER依賴性”是指不存在雌激素受體的情況下不會發生或不會以相同程度發生的疾病或病癥。
本申請使用的術語“ER介導的”是指不存在雌激素受體的情況下不會發生但可在存在雌激素受體時發生的疾病或病癥。
本申請使用的術語“ER敏感性”是指不存在雌激素的情況下不會發生或不會以相同程度發生的疾病或病癥。
本申請使用的術語“癌癥”是指傾向于以不受控制的方式增殖的細胞的異常生長,并且在一些情況下是指轉移(擴散)。癌癥的類型包括但不限于,處于有或無轉移的疾病的任何階段的實體瘤,諸如膀胱腫瘤、腸腫瘤、腦腫瘤、乳腺腫瘤、子宮內膜腫瘤、心臟腫瘤、腎腫瘤、肺腫瘤、子宮腫瘤、淋巴組織腫瘤(淋巴瘤)、卵巢腫瘤、胰腺或其它內分泌器官腫瘤(甲狀腺腫瘤)、前列腺腫瘤、皮膚腫瘤(黑色素瘤或基底細胞癌)或血液腫瘤(諸如白血病和淋巴瘤)。在一些實施方案中,所述癌癥是癌(例如,腺癌)或肉瘤。
癌癥的其它非限制性實例包括急性成淋巴細胞白血病、急性骨髓性白血病、腎上腺皮質癌、肛門癌、闌尾癌、星形細胞瘤、非典型畸胎瘤/橫紋肌瘤、基底細胞癌、膽管癌、膀胱癌、骨癌(骨肉瘤和惡性纖維組織細胞瘤)、腦干膠質瘤、腦腫瘤、腦和脊髓腫瘤、乳腺癌、支氣管腫瘤、伯基特淋巴瘤、子宮頸癌、慢性淋巴細胞性白血病、慢性骨髓性白血病、結腸癌、結腸直腸癌、顱咽管瘤、皮膚T細胞淋巴瘤、胚胎腫瘤、子宮內膜癌、成室管膜細胞瘤、室管膜瘤、食管癌、尤因肉瘤家族腫瘤、眼癌、成視網膜細胞瘤、膽囊癌、胃部(胃)癌、胃腸道類癌腫瘤、胃腸道間質瘤(GIST)、胃腸道間質細胞腫瘤、生殖細胞腫瘤、神經膠質瘤、毛細胞白血病、頭頸癌、肝細胞(肝)癌、霍奇金淋巴瘤、下咽癌、眼內黑素瘤、胰島細胞腫瘤(內分泌胰腺)、卡波西肉瘤、腎癌、朗格漢斯細胞組織細胞增多癥、喉癌、白血病、急性成淋巴細胞白血病、急性骨髓性白血病、慢性淋巴細胞白血病、慢性骨髓性白血病、毛細胞白血病、肝癌、肺癌、非小細胞肺癌、小細胞肺癌、伯基特淋巴瘤、皮膚T-細胞淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、淋巴瘤、瓦爾登斯特倫巨球蛋白血癥、成神經管細胞瘤、髓上皮瘤、黑素瘤、間皮瘤、口腔癌(mouth cancer)、慢性骨髓性白血病、骨髓性白血病、多發性骨髓瘤、鼻咽癌、成神經細胞瘤、非霍奇金淋巴瘤、非小細胞肺癌、口腔癌(oral cancer)、口咽癌、骨肉瘤、骨的惡性纖維組織細胞瘤、卵巢癌、卵巢上皮癌、卵巢生殖細胞腫瘤、卵巢低惡性潛在腫瘤、胰腺癌、乳頭狀瘤、甲狀旁腺癌、陰莖癌、咽癌、中間分化的松果體實質腫瘤、成松果體細胞瘤和幕上原始神經外胚層腫瘤(supratentorial primitive neuroectodermal tumor)、垂體瘤、漿細胞瘤/多發性骨髓瘤、成胸膜肺細胞瘤、原發性中樞神經系統淋巴瘤、前列腺癌、直腸癌、腎細胞(腎)癌、成視網膜細胞瘤、橫紋肌肉瘤、唾液腺癌癥、肉瘤、尤文肉瘤家族腫瘤、肉瘤、卡波西肉瘤、塞扎里綜合征、皮膚癌、小細胞肺癌、小腸癌、軟組織肉瘤、鱗狀細胞癌、胃部(胃)癌、幕上原始神經外胚層腫瘤、T細胞淋巴瘤、睪丸癌、喉癌(throat cancer)、胸腺瘤和胸腺癌、甲狀腺癌、尿道癌、子宮癌、子宮肉瘤、陰道癌、外陰癌、瓦爾登斯特倫巨球蛋白血癥、維爾姆斯瘤。
本申請使用的術語“乳腺癌”是指組織學或細胞學證實的乳腺癌。在一些實施方案中,所述乳腺癌為癌。在一些實施方案中,所述乳腺癌為腺癌。在一些實施方案中,所述乳腺癌為肉瘤。
術語“局部晚期乳腺癌”是指已經從在乳房開始的地方擴散到附近組織或淋巴結,而不是擴散到身體的其它部分的癌癥。
術語“轉移性乳腺癌”是指已經從乳房擴散到身體的其它部分的癌癥,諸如骨、肝、肺或腦。轉移性乳腺癌也稱為IV期乳腺癌。
本申請使用的術語“共同給予”等意在涵蓋向單個患者給予所選擇的治療劑,并且旨在包括其中通過相同或不同的給予途徑或在相同或不同的時間給予所述藥物的治療方案。
本申請使用的術語“有效量”或“治療有效量”是指待給予的藥物或化合物的足夠量,其將在一定程度上緩解待治療的疾病或病癥的一種或多種癥狀。所述結果包括減少和/或減輕疾病的體征、癥狀或原因,或生物系統的任何其它期望的改變。例如,用于治療用途的“有效量”是包含本申請公開的化合物的組合物的量,其需要提供疾病癥狀的臨床顯著降低。在任何個別情況下,任選地使用技術諸如劑量遞增研究來確定合適的“有效”量。
本申請使用的術語“治療”(“treat”、“treating”或“treatment”)包括緩解、減輕或改善疾病或病癥的至少一種癥狀,預防另外的癥狀,抑制疾病或病癥,例如預防性和/或治療性地阻止疾病或病癥的發展、緩解疾病或病癥、引起疾病或病癥的消退、延遲病癥的進展、緩解由疾病或病癥引起的病癥或停止疾病或病癥的癥狀。在一些實施方案中,治療包括延長無進展存活期。在一些實施方案中,治療包括與其它治療選擇相比降低疾病進展的相對風險。在一些實施方案中,其它治療選擇包括但不限于激素治療(例如,抗雌激素療法,諸如他莫昔芬和/或氟維司群或芳香酶療法)。
術語“無進展存活”是在疾病(諸如癌癥)的治療期間和之后患者帶病生活但其并未惡化的時間的量。在臨床試驗中,測量無進展存活期是一種查看治療產生效果好壞的方式。
術語“無轉移存活”或“MFS”是指研究中在沒有癌癥擴散持續確定的時間段或死亡的情況下存活的受試者的百分比。MFS通常以研究中由治療開始的時間報告。對于個體或研究群體報道MFS。在一些實施方案中,無轉移存活的增加為約1個月、約2個月、約2個月、約3個月、約4個月、約5個月、約6個月、約7個月、約8個月、約10個月、約11個月、約12個月、約13個月、約14個月、約15個月、約16個月、約17個月、約18個月、約19個月、約20個月或多于20個月。
本申請使用的術語“藥物組合”意指由多于一種活性成分混合或組合產生的產品且包括活性成分的固定和非固定組合。術語“固定組合”意指活性成分,例如式(A)、(B)、(C)或(D)的化合物和共藥物(co-agent),以單一實體或劑量的形式同時給予于患者。術語“非固定組合”意指活性成分,例如式(A)、(B)、(C)或(D)的化合物和共藥物,作為單獨的實體同時、共同或先后給予患者,而沒有特定的中間時間限制,其中所述給予在患者體內提供有效水平的兩種化合物。后者也適用于混合療法(cocktail therapy),例如三種或更多種活性成分的給予。
本申請公開的化合物的“代謝物”是當化合物被代謝時形成的該化合物的衍生物。術語“活性代謝物”是指化合物代謝時形成的化合物的生物活性衍生物。本申請使用的術語“代謝”是指特定物質被生物體改變的過程(包括但不限于水解反應和酶催化的反應)的總和。因此,酶可對化合物產生特定的結構改變。例如,細胞色素P450催化多種氧化和還原反應,而二磷酸尿苷葡糖醛酸轉移酶催化經活化的葡糖醛酸分子轉移至芳族醇、脂族醇、羧酸、胺和游離巰基。任選地通過以下方式鑒定本申請公開的化合物的代謝物:向宿主給予化合物并分析來自宿主的組織樣品,或使化合物與肝細胞在體外孵育并分析所得化合物。
本申請使用的術語“藥用的”是指不消除本申請所述的ER抑制劑化合物的生物活性或性質的物質(例如,載體或稀釋劑),并且相對無毒(即,將所述物質給予個體而不引起不期望的生物效應或以有害方式與包含它的組合物的任何組分相互作用)。
本申請使用的“對照”是指與測試樣品基本相同的樣品,除了其不用測試參數處理,或者如果其為血漿樣品,則其可來自未受所研究的病癥侵襲的正常志愿者。對照也可為內部對照。
本申請使用的術語“受試者”、“個體”和“患者”可互換使用。上述術語均不被解釋為需要醫療專業人員(例如,醫生、護士、醫生助理、護理員、臨終關懷工作者(hospice worker))的監督。本申請使用的受試者可為任何動物,包括哺乳動物(例如,人或非人動物,例如,黑猩猩、猿、猴、牛、馬、綿羊、山羊、豬、兔、犬、貓、大鼠、小鼠、豚鼠等)和非哺乳動物。在本申請提供的方法和組合物的一個實施方案中,所述哺乳動物是人。
術語“連續每日給藥方案”是指沒有任何休藥期的每天給予雌激素受體調節劑或其藥用鹽。在一些實施方案中,連續每日給藥方案包括在每天大致相同的時間每天給予雌激素受體調節劑或其藥用鹽。
“烷基”是指脂族烴基。烷基部分可為支鏈或直鏈。“烷基”基團可具有1至6個碳原子(每當在本申請出現時,數值范圍諸如“1至6”是指給定范圍內的每個整數;例如,“1至6個碳原子”意指烷基可由1個碳原子、2個碳原子、3個碳原子等,直至并包括6個碳原子組成,但是本定義也涵蓋沒有指定數值范圍的術語“烷基”的出現)。在一個方面,烷基選自甲基、乙基、丙基、異丙基、正丁基、異丁基、仲丁基和叔丁基。典型的烷基包括但絕不限于甲基、乙基、丙基、異丙基、丁基、異丁基、仲丁基、叔丁基、戊基、新戊基、己基等。在一些實施方案中,烷基的1個或更多個氫原子被1個或多個氘原子替代。
“烷氧基”是指(烷基)O-基團,其中烷基如本申請所定義。
術語“芳族”是指具有包含4n+2個π電子的離域π電子系統的平面環,其中n為整數。芳族為任選取代的。術語“芳族的”包括碳環芳基(“芳基”,例如,苯基)和雜環芳基(或“雜芳基”或“雜芳族”)基團(例如吡啶)。該術語包括單環或稠環多環(即,共享相鄰碳原子對的環)基團。
術語“碳環”是指其中形成環骨架的原子均為碳原子的環或環系。因此,該術語使碳環區別于其中環骨架含有至少一個不同于碳的原子的雜環。
本申請使用的術語“芳基”是指芳族環,其中形成環的每個原子為碳原子。在一個方面,芳基為苯基或萘基。在一個方面,芳基為苯基。在一個方面,芳基為C6-C10芳基。在一些實施方案中,芳基的1個或多個氫原子被1個或多個氘原子替代。
術語“環烷基”是指環狀脂族烴基。環烷基包括具有3至10個環原子的基團。在一些實施方案中,環烷基選自環丙基、環丁基、環戊基、環戊烯基、環己基、環己烯基、環庚基和環辛基。在一個方面,環烷基是C3-C6環烷基。
術語“鹵代”或“鹵素”或“鹵化物”是指氟(F)、氯(Cl)、溴(Br)或碘(I)。在一些實施方案中,鹵素是F或Cl。在一些實施方案中,鹵素為F。
術語“氟烷基”是指其中一個或多個氫原子被氟原子替代的烷基。在一些實施方案中,氟烷基為氟C1-C6烷基。在一些實施方案中,氟烷基為單氟烷基,其中烷基的一個氫原子被氟原子替代。在一些實施方案中,氟烷基為二氟烷基,其中烷基的兩個氫原子被氟原子替代。在一些實施方案中,氟烷基為三氟烷基,其中烷基的三個氫原子被氟原子替代。在一些實施方案中,氟烷基為單氟烷基,二氟烷基或三氟烷基。在一些實施方案中,單氟烷基為-CH2F、-CHF2、-CF3、-CHFCH3、-CH2CH2F、-CH2CHF2、-CH2CF3、-CH2CH2CF3、-CH2CH2CH2CF3、-CHCH3CF3、-CH(CF3)2或-CF(CH3)2。
術語“雜環”或“雜環的”是指在一個或多個環中含有一至四個雜原子的雜芳族環(也稱為雜芳基)和雜環烷基環(也稱為雜脂環基),其中在所述環中的每個雜原子選自O、S和N,其中在其環系中的每個雜環基團具有3至10個原子,并且條件是任何環不含有兩個相鄰的O或S原子。非芳族雜環基團(也稱為雜環烷基)包括在其環系中僅具有3個原子的基團,但芳族雜環基團在其環系中必須具有至少5個原子。雜環基團包括苯并稠合環系。3元雜環基團的實例是氮雜環丙基。4元雜環基團的實例是氮雜環丁基。5元雜環基團的實例是噻唑基。6元雜環基的實例是吡啶基,且10元雜環基的實例是喹啉基。非芳族雜環基團的實例為吡咯烷基、四氫呋喃基、二氫呋喃基、四氫噻吩基、噁唑烷酮基、四氫吡喃基、二氫吡喃基、四氫噻喃基、哌啶基、嗎啉基、硫嗎啉基、噻噁烷基、哌嗪基、氮雜環丙基、氮雜環丁基、氧雜環丁基、硫雜環丁基、高哌啶基、氧雜環庚基、硫雜環庚基、氧氮雜基、二氮雜基、硫氮雜基、1,2,3,6-四氫吡啶基、吡咯啉-2-基、吡咯啉-3-基、二氫吲哚基、2H-吡喃基、4H-吡喃基、二噁烷基、1,3-二氧雜環戊基、吡唑啉基、二噻烷基、二硫雜環戊基、二氫吡喃基、二氫噻吩基、二氫呋喃基、吡唑烷基、咪唑啉基、咪唑烷基、3-氮雜二環[3.1.0]己基、3-氮雜二環[4.1.0]庚基、3H-吲哚基和喹嗪基。芳族雜環基團的實例為吡啶基、咪唑基、嘧啶基、吡唑基、三唑基、吡嗪基、四唑基、呋喃基、噻吩基、異噁唑基、噻唑基、噁唑基、異噻唑基、吡咯基、喹啉基、異喹啉基、吲哚基、苯并咪唑基、苯并呋喃基、噌啉基、吲唑基、吲嗪基、酞嗪基、噠嗪基、三嗪基、異吲哚基、蝶啶基、嘌呤基、噁二唑基、噻二唑基、呋咱基、苯并呋咱基、苯并噻吩基、苯并噻唑基、苯并噁唑基、喹唑啉基、喹喔啉基、二氮雜萘基和呋喃并吡啶基。當可能時,前述基團可為C-附接的(或C-連接的)或N-附接的。例如,衍生自吡咯的基團可為吡咯-1-基(N-附接的)或吡咯-3-基(C-連接的)。此外,衍生自咪唑的基團可為咪唑-1-基或咪唑-3-基(均為N-附接的)或咪唑-2-基、咪唑-4-基或咪唑-5-基(均為C-附接的)。雜環基團包括苯并稠合環系。
術語“雜芳基”是指包括一個或多個選自氮、氧和硫的環雜原子的芳基。單環雜芳基包括吡啶基、咪唑基、嘧啶基、吡唑基、三唑基、吡嗪基、四唑基、呋喃基、噻吩基、異噁唑基、噻唑基、噁唑基、異噻唑基、吡咯基、噠嗪基、三嗪基、噁二唑基、噻二唑基和呋咱基。在一些實施方案中,雜芳基在環中含有0-3個N原子。在一些實施方案中,雜芳基在環中含有1-3個N原子。在一些實施方案中,雜芳基在環中含有0-3個N原子、0-1個O原子,和0-1個S原子。在一些實施方案中,單環雜芳基為5元或6元雜芳基。
“雜環烷基”或“雜脂環基”是指其中環烷基的至少一個碳原子被氮(未經取代或經取代的,例如,-NH-、-NRe-)、氧(-O-)或硫(例如-S-、-S(=O)-或-S(=O)2-)取代的環烷基。所述基團可與芳基或雜芳基稠合。在一些實施方案中,所述雜環烷基選自噁唑烷酮基、吡咯烷基、四氫呋喃基、四氫噻吩基、四氫吡喃基、四氫噻喃基、哌啶基、嗎啉基、硫嗎啉基、哌嗪基和二氫吲哚基。術語雜脂環還包括碳水化合物的所有環形式,包括但不限于單糖、二糖和寡糖。在一個方面,雜環烷基為C2-C10雜環烷基。在另一方面,雜環烷基為C4-C10雜環烷基。在一些實施方案中,雜環烷基在環中含有0-2個N原子。在一些實施方案中,雜環烷基在環中含有0-2個N原子、0-2個O原子和0-1個S原子。
術語“任選取代的”或“經取代的”意指所述基團可取代有一個或多個單獨和獨立地選自以下的額外基團:烷基、環烷基、芳基、雜芳基、雜脂環基、羥基、烷氧基、芳基氧基、烷基硫基、芳基硫基、烷基亞砜、芳基亞砜、烷基砜、芳基砜、氰基、鹵素、硝基、鹵代烷基、氟烷基、氟烷氧基和氨基(包括單取代和二取代的氨基)及其經保護的衍生物。在一些實施方案中,任選的取代基獨立地選自鹵素、-CN、-NH2、-NH(烷基)、-N(烷基)2、-OH、-CO2H、-CO2烷基、-C(=O)NH2、-C(=O)NH(烷基)、-C(=O)N(烷基)2、-S(=O)2NH2、-S(=O)2NH(烷基)、-S(=O)2N(烷基)2烷基、環烷基、氟烷基、雜烷基、烷氧基、氟烷氧基、雜環烷基、芳基、雜芳基、芳基氧基、烷基硫基、芳基硫基、烷基亞砜、芳基亞砜、烷基砜和芳基砜。在一些實施方案中,任選的取代基獨立地選自鹵素、-CN、-NH2、-OH、-NH(CH3)、-N(CH3)2、-CH3、-CH2CH3、-CF3、-OCH3和-OCF3。在一些實施方案中,取代基取代有一個或兩個前述基團。在一些實施方案中,脂族碳原子(非環狀或環狀、飽和或不飽和的碳原子,不包括芳族碳原子)上的任選取代基包括氧代(=O)。
用于診斷和治療的示例性雌激素受體突變體
在一些實施方案中,本申請提供的診斷方法包括檢測ESR1基因中的一個或多個突變。在一些實施方案中,本申請提供的方法包括治療具有ESR1基因中的一個或多個突變的患者。用于診斷和治療的示例性ESR1突變包括,但不限于核苷酸插入、缺失或取代。在一些實施方案中,所述突變為導致編碼的ER多肽中氨基酸的取代的核苷酸取代(即,錯義突變)。在一些實施方案中,所述突變為導致編碼的ER多肽中氨基酸的插入和/或一個或多個氨基酸的取代的核苷酸插入。在一些實施方案中,所述突變為導致編碼的ER中的氨基酸缺失和/或一個或多個氨基酸的取代的核苷酸缺失。在一些實施方案中,所述突變為導致雜合ER多肽的基因組易位,其中ER多肽的一個或多個結構域與另一蛋白或其部分融合。在一些實施方案中,所述突變為導致截短的ER多肽(即,無義突變)的核苷酸插入、缺失或取代。在一些實施方案中,ESR1突變導致編碼的突變ER-α多肽的活性增加。在一些實施方案中,所述突變賦予編碼的突變ER-α多肽的配體非依賴性激活。在一些實施方案中,所述突變導致組成性激活的突變ER-α多肽。在一些實施方案中,所述突變型ER-α在不存在雌二醇的情況下展現組成性活性。在一些實施方案中,所述ESR1突變增加了ESR1基因產物的表達(即,增加野生型ER-α多肽的表達)。
在一些實施方案中,所述突變導致在選自以下的位置具有氨基酸替換的ER多肽:SEQ ID NO:2的氨基酸位置6、118、269、311、341、350、380、392、394、433、463、503、534、535、536、537、538和555。在一些實施方案中,所述突變導致在選自以下的位置具有氨基酸替換的ER多肽:SEQ ID NO:2的氨基酸位置380、463、534、535、536、537和538。在一些實施方案中,所述突變導致具有選自以下的氨基酸替換的ER多肽:H6Y、S118P、R269C、T311M、S341L、A350E、E380Q、V392I、R394H、S433P、S463P、R503W、V534E、P535H、L536R、L536P、L536Q、Y537N、Y537C、Y537S、D538G和R555C。在一些實施方案中,所述患者具有兩個或更多個ESR1基因中的突變。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的6位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為H6Y取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的編碼H6的密碼子中的C16T取代(例如,CAC至TAC)。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的118位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為S118P取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的編碼S118的密碼子中的T352C取代(例如,TCG至CCG)。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的269位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為R269C取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的編碼R269的密碼子中的C805T取代(例如,CGC至TGC)。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的311位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為T311M取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的C932T取代。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的341位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為S341L取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的C1022T取代。
在一些實施方案中,所述ESR1突變包括引起在SEQ ID NO:2的氨基酸G344和L345之間的氨基酸插入的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸插入為C氨基酸。在一些實施方案中,所述錯義突變為SEQ ID NO:l的核苷酸1032和1033之間核苷酸GCT的插入。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的350位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為A350E取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的C1049A取代。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的380位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為E380Q取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的編碼E380的密碼子中的G1138C取代(例如,GAA至CAA)。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的392位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為V392I取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的編碼V392的密碼子中的G1174A取代(例如,GTC至ATC)。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的394位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為R394H取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的G1181A取代。
在一些實施方案中,所述ESR1突變包括引起在SEQ ID NO:2的413位結束的截短蛋白的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸截短為Q414*突變,歸因于引入終止密碼子的核苷酸序列中的突變。在一些實施方案中,所述突變為根據SEQ ID NO:l的核苷酸序列的C1240T取代。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的433位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為S433P取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的T1297C取代。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的463位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為S463P取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的編碼S463的密碼子中的T1387C取代(例如,TCC至CCC)。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的503位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為R503W取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的C1507T取代。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的534位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為V534E取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的編碼V534的密碼子中的T1601A取代(例如,GTG至GAG)。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的535位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為P535H取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的編碼P535的密碼子中的C1604A取代(例如,CCC至CAC)。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的536位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為L536R取代。在一些實施方案中,所述氨基酸替換為L536P取代。在一些實施方案中,所述氨基酸替換為L536Q取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的編碼L536的密碼子中的T1607A取代和C1608A取代(例如,CTC至CAA)。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的537位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為Y537N取代。在一些實施方案中,所述氨基酸替換為Y537C取代。在一些實施方案中,所述氨基酸替換為Y537S取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的T1609A取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的A1610G取代。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的538位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為D538G取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的A1613G取代。
在一些實施方案中,所述ESR1突變包括引起SEQ ID NO:2的555位氨基酸替換的ESRl基因中的錯義突變。在一些實施方案中,所述氨基酸替換為R555C取代。在一些實施方案中,所述錯義突變為根據SEQ ID NO:l的核苷酸序列的編碼R555的密碼子中的C1663T取代(例如,CGT至TGT)。
在一些實施方案中,所述ESRl突變為ESRl基因的配體結合域中的缺失。在一些實施方案中,所述ESRl突變為3個或更多個核苷酸的框內缺失(in frame deletion)。在一些實施方案中,所述突變為一個或多個ESR1外顯子中3個或更多個核苷酸的框內缺失。在一些實施方案中,所述突變為ESR1基因的外顯子8、9、10、11或12中3個或更多個核苷酸的框內缺失。在一些實施方案中,所述ESRl突變為根據SEQ ID NO:1的1046-1051核苷酸(TGGCAG)的6個核苷酸缺失,其導致349-351位氨基酸(LAD)的缺失和在SEQ ID NO:2的ER多肽的349位氨基酸處插入H。
在一些實施方案中,ESR1基因中的錯義突變導致SEQ ID NO:2的選自以下的一個或多個氨基酸替換:在6位組氨酸至酪氨酸取代(H6Y);在118位絲氨酸至脯氨酸取代(S118P);在269位精氨酸至半胱氨酸取代(R269C);在311位蘇氨酸至甲硫氨酸取代(T311M);在341位絲氨酸至亮氨酸取代(S341L);在350位丙氨酸至谷氨酰胺取代(A350E);在380位谷氨酸至谷氨酰胺取代(E380Q);在392位纈氨酸至異亮氨酸取代(V392I);在394位精氨酸至組氨酸取代(R394H);在414位谷氨酰胺取代,例如,插入至終止密碼子(Q414*);在433位絲氨酸至脯氨酸取代(S433P);在463位絲氨酸至脯氨酸取代(S463P);在503位精氨酸至色氨酸取代(R503W);在534位纈氨酸至谷氨酸取代(V534E);在535位脯氨酸至組氨酸取代(P535H);在536位亮氨酸至精氨酸取代536(L536R);在536位亮氨酸至脯氨酸取代(L536P);在536位亮氨酸至谷氨酰胺取代(L536Q);在537位酪氨酸至天冬酰胺取代(Y537N);在537位酪氨酸至半胱氨酸取代(Y537C);在537位酪氨酸至絲氨酸取代(Y537S);在538位天冬氨酸至甘氨酸取代(D538G);在555位精氨酸至半胱氨酸取代(R555C)。
在一些實施方案中,所述ESRl突變為導致ER-YAP1融合蛋白的ESR1基因與Yes激活蛋白1(YAP1)基因之間的基因組易位。
在一些實施方案中,所述ESRl基因包含兩個或更多個突變。在一些實施方案中,所述ESRl基因包含在鉸鏈結構域和/或配體結合域中的兩個或更多個突變。
雌激素受體調節劑化合物
本申請提供了用于治療具有ESR1基因突變的受試者的雌激素受體調節劑(ERM)化合物。在一些實施方案中,雌激素受體調節劑化合物為式(A)、(B)、(C)或(D)的化合物,其包括它們的藥用鹽、溶劑化物、N-氧化物、代謝物和前藥。
在一個方面,用于本申請所述方法和組合物的雌激素受體調節劑化合物為式(A)化合物或其藥用鹽或溶劑化物:
其中,
Ra為-CO2H或選自以下的5元雜環:
Rb為C1-C6烷基或C3-C6環烷基;
Rc為H或F;
每個Rd獨立地選自H、鹵素、-CN、-ORe、-NHRe、-NReRf、-SRe、-S(=O)Rf、-S(=O)2Rf、C1-C6烷基和氟C1-C6烷基;
每個Re獨立地選自H、-C(=O)Rf、-C(=O)ORf、-C(=O)NHRf、C1-C6烷基、氟C1-C6烷基、C3-C6環烷基、經取代的或未經取代的單環C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;
每個Rf獨立地選自C1-C6烷基、氟C1-C6烷基、C3-C6環烷基、經取代的或未經取代的單環C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;
X為CH或N;
n為0、1或2。
在一些實施方案中,Ra為-CO2H。在一些實施方案中,Ra為選自以下的5元雜環:
在一些實施方案中,Rc為H。在一些實施方案中,Rc為F。
在一些實施方案中,Rb為-CH3、-CH2CH3、環丙基或環丁基。在一些實施方案中,Rb為-CH2CH3。在一些實施方案中,Rb為環丁基。
在一些實施方案中,X為CH。在一些實施方案中,X為N。
在一些實施方案中,n為1或2。在一些實施方案中,n為1。在一些實施方案中,n為2。在一些實施方案中,n為0。
在一些實施方案中,每個Rd獨立地選自H、F、Cl、-CN、-OH、-OCH3、-OCH2CH3、-S(=O)2CH3、-CH3、-CH2H3和-CF3。在一些實施方案中,每個Rd獨立地選自H、F、Cl、-CN、-OH、-OCH3、-OCH2CH3、-CH3、-CH2H3和-CF3。
在一些實施方案中,所述雌激素受體調節劑為式(A)化合物或其藥用鹽或溶劑化物,其中Ra為-CO2H,Rb為C1-C6烷基,Rc為H,每個Rd獨立地選自鹵素,X為CH;且n為2。
在一些實施方案中,所述雌激素受體調節劑為式(A)化合物或其藥用鹽或溶劑化物,其中Ra為-CO2H,Rb為乙基,Rc為H,每個Rd獨立地選自F和Cl,X為CH;且n為2。
在一些實施方案中,式(A)的雌激素受體調節劑化合物或其藥用鹽或溶劑化物具有以下式(A-1)的結構:
在一些實施方案中,式(A)的雌激素受體調節劑化合物或其藥用鹽或溶劑化物為表1所述的化合物:
表1.
在另一方面,用于本申請所述方法和組合物的雌激素受體調節劑化合物為式(B)化合物或其藥用鹽或溶劑化物:
其中,
Ra為-CO2H或選自以下的5元雜環:
環C為
環D為苯基或噻吩基;
每個Rd獨立地選自H、鹵素、-CN、-ORe、-NHRe、-NReRf、-SRe、-S(=O)Rf、-S(=O)2Rf、C1-C6烷基和氟C1-C6烷基;
每個Re獨立地選自H、-C(=O)Rf、-C(=O)ORf、-C(=O)NHRf、C1-C6烷基、氟C1-C6烷基、C3-C6環烷基、經取代的或未經取代的單環C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;
每個Rf獨立地選自C1-C6烷基、氟C1-C6烷基、C3-C6環烷基、經取代的或未經取代的單環C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;
n為0、1或2。
在一些實施方案中,環C為
在一些實施方案中,環C為
在一些實施方案中,為
在一些實施方案中,為
在一些實施方案中,為
在一些實施方案中,Ra為-CO2H。
在一些實施方案中,n為1或2。
在一些實施方案中,n為1。
在一些實施方案中,n為2。在一些實施方案中,n為0。
在一些實施方案中,每個Rd獨立地選自H、F、Cl、-CN、-OH、-OCH3、-OCH2CH3、-S(=O)2CH3、-CH3、-CH2H3和-CF3。
在一些實施方案中,每個Rd獨立地選自H、F、Cl、-CN、-OH、-OCH3、-OCH2CH3、-CH3、-CH2H3和-CF3。
在一些實施方案中,式(B)的雌激素受體調節劑化合物或其藥用鹽或溶劑化物為表2所述的化合物:
表2.
在再一個方面,用于本申請所述方法和組合物的雌激素受體調節劑化合物為式(C)化合物或其藥用鹽或溶劑化物:
其中,
Ra為-CO2H或選自以下的5元雜環:
Rb為C1-C6烷基或C3-C6環烷基;
每個Rd獨立地選自H、鹵素、-CN、-ORe、-NHRe、-NReRf、-SRe、-S(=O)Rf、-S(=O)2Rf、C1-C6烷基和氟C1-C6烷基;
每個Re獨立地選自H、-C(=O)Rf、-C(=O)ORf、-C(=O)NHRf、C1-C6烷基、氟C1-C6烷基、C3-C6環烷基、經取代的或未經取代的單環C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;
每個Rf獨立地選自C1-C6烷基、氟C1-C6烷基、C3-C6環烷基、經取代的或未經取代的單環C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;
n為0、1或2。
在一些實施方案中,Ra為-CO2H。
在一些實施方案中,Rb為-CH3、-CH2CH3、環丙基或環丁基。
在一些實施方案中,Rb為-CH2CH3。
在一些實施方案中,Rb為環丁基。
在一些實施方案中,n為1或2。在一些實施方案中,n為1。在一些實施方案中,n為2。在一些實施方案中,n為0。
在一些實施方案中,每個Rd獨立地選自H、F、Cl、-CN、-OH、-OCH3、-OCH2CH3、-S(=O)2CH3、-CH3、-CH2H3和-CF3。
在一些實施方案中,每個Rd獨立地選自H、F、Cl、-CN、-OH、-OCH3、-OCH2CH3、-CH3、-CH2H3和-CF3。
在一些實施方案中,式(C)的雌激素受體調節劑化合物或其藥用鹽或溶劑化物具有式(C-1)的結構:
在一些實施方案中,式(C)的雌激素受體調節劑化合物或其藥用鹽或溶劑化物為表3所述的化合物:
表3.
在另一方面,用于本申請所述方法和組合物的雌激素受體調節劑化合物為式(D)化合物或其藥用鹽或溶劑化物:
其中,
R1為H、C1-C4烷基或氟C1-C4烷基;
R2為H、F、C1-C4烷基或氟C1-C4烷基;
R3為H、鹵素、-CN、-OR6、-NHR6、-NR6R7、-SR6、-S(=O)R7、-S(=O)2R7、C1-C4烷基或氟C1-C4烷基;
每個R4獨立地選自H、鹵素、-CN、-OH、C1-C6烷基、氟C1-C4烷基、氟C1-C4烷氧基和C1-C4烷氧基;
每個R5為H、F、Cl、-OH、-CH3、-CF3或-OCH3;
每個R6獨立地選自H、-C(=O)R7、-C(=O)OR7、-C(=O)NHR7、C1-C6烷基、氟C1-C6烷基、C3-C6環烷基、經取代的或未經取代的C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;
每個R7獨立地選自C1-C6烷基、氟C1-C6烷基、經取代的或未經取代的C3-C6環烷基、經取代的或未經取代的單環C2-C6雜環烷基、經取代的或未經取代的苯基和經取代的或未經取代的單環雜芳基;
n為0、1或2;且
t為1或2。
在一些實施方案中,R1為H、-CH3、-CH2F、-CHF2或-CF3。
在一些實施方案中,每個R2獨立地為F、-CH3、-CH2CH3、-CH2F、-CHF2、-CF3、-CHFCH3、-CH2CH2F、-CH2CHF2、-CH2CF3、-CH2CH2CF3、-CH2CH2CH2CF3、-CHCH3CF3、-CH(CF3)2或-CF(CH3)2。在一些實施方案中,每個R2獨立地為F、-CH3、-CH2F、-CHF2或-CF3。在一些實施方案中,每個R2獨立地為-CH3、-CH2F、-CHF2或-CF3。在一些實施方案中,每個R2獨立地為-CH2F。在一些實施方案中,每個R2獨立地為-CH3。
在一些實施方案中,t為1。在一些實施方案中,t為2。
在一些實施方案中,R3為-OR6。在一些實施方案中,R3為-OH。
在一些實施方案中,每個R4獨立地選自H、F、Cl、-OH、-CH3、-CF3或-OCH3。
在一些實施方案中,每個R5獨立地選自H和F。
在一些實施方案中,每個R6獨立地選自H、-C(=O)R7、-C(=O)OR7、-C(=O)NHR7、C1-C6烷基、氟C1-C6烷基和經取代的或未經取代的苯基。在一些實施方案中,每個R6為H。
在一些實施方案中,每個R7獨立地選自C1-C6烷基、氟C1-C6烷基和經取代的或未經取代的苯基。
在一些實施方案中,為
在一些實施方案中,為
在一些實施方案中,為
在一些實施方案中,為
在一些實施方案中,為
在一些實施方案中,為或
在一些實施方案中,為
在一些實施方案中,為
在一些實施方案中,為
在一些實施方案中,為
在一些實施方案中,為
在一些實施方案中,式(D)的雌激素受體調節劑化合物或其藥用鹽或溶劑化物具有以下式(D-1)的結構:
在一些實施方案中,式(D)的雌激素受體調節劑化合物或其藥用鹽或溶劑化物具有以下式(D-2)的結構:
在一些實施方案中,式(D)的雌激素受體調節劑化合物或其藥用鹽或溶劑化物具有以下式(D-3)的結構:
在一些實施方案中,式(D)的雌激素受體調節劑化合物或其藥用鹽或溶劑化物具有以下式(D-4)的結構:
在一些實施方案中,式(D)的雌激素受體調節劑化合物或其藥用鹽或溶劑化物具有以下式(D-5)的結構:
在一些實施方案中,式(D)的雌激素受體調節劑化合物或其藥用鹽或溶劑化物具有以下式(D-6)的結構:
在一些實施方案中,為
在一些實施方案中,所述雌激素受體調節劑為式(D)化合物、式(D-1)化合物或式(D-3)化合物或其藥用鹽或溶劑化物,其中R1為H,R2為氟C1-C4烷基,R3為H,R4為-OH,R5為H,R6為H,n為1,t為1。
在一些實施方案中,所述雌激素受體調節劑為式(D)化合物、式(D-1)化合物或式(D-3)化合物或其藥用鹽或溶劑化物,其中R1為H,R2為-CH2F,R3為H,R4為-OH,R5為H,R6為H,n為1,t為1。
在一些實施方案中,式(D)的雌激素受體調節劑化合物或其藥用鹽或溶劑化物為表4所述的化合物:
表4.
雌激素受體調節劑化合物的其它形式
在一些實施方案中,所述雌激素受體調節劑化合物用作藥用鹽。藥用鹽的類型包括但不限于:(1)酸加成鹽,其通過使化合物的游離堿形式與藥用無機酸反應形成鹽,諸如,例如,鹽酸鹽、氫溴酸鹽、硫酸鹽、磷酸鹽、偏磷酸鹽等;或與藥用有機酸反應形成鹽,諸如,例如乙酸鹽、丙酸鹽、己酸鹽、環戊烷丙酸鹽、乙醇酸鹽、丙酮酸鹽、乳酸鹽、丙二酸鹽、琥珀酸鹽、蘋果酸鹽、馬來酸鹽、富馬酸鹽、三氟乙酸鹽、酒石酸鹽、檸檬酸鹽、苯甲酸鹽、3-(4-羥基苯甲酰基)苯甲酸鹽、肉桂酸鹽、扁桃酸鹽、甲磺酸鹽、乙磺酸鹽、1,2-乙二磺酸鹽、2-羥基乙磺酸鹽、苯磺酸鹽、甲苯磺酸鹽、2-萘磺酸鹽、4-甲基二環-[2.2.2]辛-2-烯-1-羧酸鹽、葡庚糖酸鹽、4,4'-亞甲基二-(3-羥基-2-烯-1-羧酸)鹽、3-苯基丙酸鹽、三甲基乙酸鹽、叔丁基乙酸鹽、月桂基硫酸鹽、葡萄糖酸鹽、谷氨酸鹽、羥基萘甲酸鹽、水楊酸鹽、硬脂酸鹽、粘康酸鹽、丁酸鹽、苯乙酸鹽、苯丁酸鹽、丙戊酸鹽等;(2)當存在于母體化合物中的酸性質子被金屬離子代替時形成的鹽,所述金屬離子例如,堿金屬離子(例如鋰鹽、鈉鹽或鉀鹽),堿土金屬離子(例如鎂鹽或鈣鹽)或鋁離子(例如鋁鹽)。在一些情況下,本申請所述的化合物可與有機堿配位形成鹽,諸如但不限于乙醇胺鹽、二乙醇胺鹽、三乙醇胺鹽、氨基丁三醇鹽、N-甲基葡糖胺鹽、二環己胺鹽或三(羥基甲基)甲胺鹽。在其它情況下,本申請所述的化合物可與氨基酸形成鹽,諸如但不限于精氨酸鹽、賴氨酸鹽等。用于與包含酸性質子的化合物形成鹽的可接受的無機堿包括但不限于氫氧化鋁、氫氧化鈣、氫氧化鉀、碳酸鈉、氫氧化鈉等。
應當理解的是,提及藥用鹽包括溶劑加成形式。溶劑化物含有化學計量或非化學計量量的溶劑,并且可在與藥用溶劑諸如水、乙醇等的結晶過程中形成。當溶劑是水時形成水合物,或當溶劑是醇時形成醇化物。本申請所述的化合物的溶劑化物可方便地在本申請所述的操作中制備或形成。此外,本申請提供的化合物可以非溶劑化形式以及溶劑化形式存在。
在一些實施方案中,本申請所述的雌激素受體調節劑化合物可包含一個或多個立體中心。應當理解的是,當存在立體中心時,所述立體中心可以R構型或S構型畫出。除非畫出立體中心的具體構型,否則本申請所述的化合物意在包括所有這些可能的立體化學構型(即外消旋形式,R構型、S構型)。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低突變型ER的活性。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低野生型ER的活性。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低突變型ER-α的活性,所述突變型ER-α具有一種野生型ER-α多肽和一種突變型ER-α多肽(即,異二聚體)。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低突變型ER-α的活性,所述突變型ER-α具有兩種突變型ER-α多肽(即,同二聚體)。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低細胞中突變型ER-α的活性,所述細胞表達野生型和突變型ER-α兩者(即,異源表達)。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低細胞中野生型ER-α的活性,所述細胞表達野生型和突變型ER兩者。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低細胞中突變型ER-α的活性,所述細胞僅表達突變型ER-α(即,同源表達)。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低ER的活性,所述ER在選自以下的位置具有氨基酸替換:SEQ ID NO:2的氨基酸位置6、118、269、311、341、350、380、392、394、433、463、503、534、535、536、537、538和555位。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低ER的活性,所述ER具有選自以下的氨基酸替換:H6Y、S118P、R269C、T311M、S341L、A350E、E380Q、V392I、R394H、S433P、S463P、R503W、V534E、P535H、L536R、L536P、L536Q、Y537N、Y537C、Y537S、D538G和R555C。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物拮抗突變型ER。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物拮抗野生型ER。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物拮抗突變型ER-α,所述突變型ER-α具有一種野生型ER-α多肽和一種突變型ER-α多肽(即,異二聚體)。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物拮抗突變型ER-α,所述突變型ER-α具有兩種突變型ER-α多肽(即,同二聚體。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物拮抗細胞中突變型ER-α,所述細胞表達野生型和突變型ER-α兩者(即,異源表達)。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物拮抗細胞中的野生型ER-α,所述細胞表達野生型和突變型ER。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物拮抗細胞中突變型ER-α,所述細胞僅表達突變型ER-α(即,同源表達)。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物拮抗ER,所述ER在選自以下的位置具有氨基酸替換:SEQ ID NO:2的氨基酸位置6、118、269、311、341、350、380、392、394、433、463、503、534、535、536、537、538和555。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物拮抗ER,所述ER具有選自以下的氨基酸替換:H6Y、S118P、R269C、T311M、S341L、A350E、E380Q、V392I、R394H、S433P、S463P、R503W、V534E、P535H、L536R、L536P、L536Q、Y537N、Y537C、Y537S、D538G和R555C。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低突變型ER的細胞濃度。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低野生型ER的細胞濃度。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低突變型ER-α的細胞濃度,所述突變型ER-α具有一種野生型ER-α多肽和一種突變型ER-α多肽(即,異二聚體)。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低突變型ER-α的細胞濃度,所述突變型ER-α具有兩種突變型ER-α多肽(即,同二聚體)。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低細胞中突變型ER-α的細胞濃度,所述細胞表達野生型和突變型ER-α兩者(即,異源表達)。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低細胞中野生型ER-α的細胞濃度,所述細胞表達野生型和突變型ER兩者。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低細胞中突變型ER-α的細胞濃度,所述細胞僅表達突變型ER-α(即,同源表達)。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低ER的細胞濃度,所述ER在選自以下的位置具有氨基酸替換:SEQ ID NO:2的氨基酸位置6、118、269、311、341、350、380、392、394、433、463、503、534、535、536、537、538和555。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽或N-氧化物降低的細胞濃度ER,所述ER具有選自以下的氨基酸替換:H6Y、S118P、R269C、T311M、S341L、A350E、E380Q、V392I、R394H、S433P、S463P、R503W、V534E、P535H、L536R、L536P、L536Q、Y537N、Y537C、Y537S、D538G和R555C。
式(A)、(B)、(C)或(D)的化合物、其藥用鹽或N-氧化物用作治療或預防疾病或病癥的藥物,其中雌激素和/或雌激素受體的作用涉及疾病或病癥的病因或病理學或有助于疾病或病癥的至少一種癥狀,并且其中雌激素和/或雌激素受體的這種作用是不期望的。在一些實施方案中,所述式(A)、(B)、(C)或(D)的化合物為雌激素受體拮抗劑。在一些實施方案中,本申請公開的化合物為選擇性雌激素受體降解劑化合物(SERD)。在一些實施方案中,所述式(A)、(B)、(C)或(D)的化合物為雌激素受體拮抗劑以及雌激素受體降解劑。在一些實施方案中,所述式(A)、(B)、(C)或(D)的化合物展現最小的雌激素受體激動劑活性或沒有該活性。在一些實施方案中,在治療癌癥的背景下,所述式(A)、(B)、(C)或(D)的化合物提供改善的治療活性,其特征在于完全或持續較長時間的腫瘤消退、較低的發生率或對治療發展抗性的發生率和/或腫瘤侵襲力的減少。在一些實施方案中,本申請公開的化合物為雌激素受體降解劑,其展現完全的雌激素受體拮抗劑活性且具有可忽略的或最小的雌激素受體激動劑活性。在一些實施方案中,所述式(A)、(B)、(C)或(D)的化合物為具有組織特異性ER性質的選擇性雌激素受體調節劑(SERM)。
診斷性和治療性方法
在某些實施方案中,本申請描述的是針對使用雌激素受體調節劑的療法選擇患者的方法。在一些實施方案中,所述雌激素受體調節劑為式(A)、(B)、(C)或(D)的化合物。在一些實施方案中,所述方法包括確定患者是否具有ESR1基因中的突變。在一些實施方案中,所述患者具有ER介導的疾病或病癥。在一些實施方案中,所述患者具有癌癥。在一些實施方案中,所述患者具有乳腺癌。在一些實施方案中,所述患者具有ER+乳腺癌。在一些實施方案中,所述患者具有激素抗性乳腺癌。在一些實施方案中,所述患者具有激素抗性ER+乳腺癌。在一些實施方案中,所述患者在激素療法后展現疾病進展。在一些實施方案中,所述患者在抗雌激素療法后展現疾病進展。在一些實施方案中,所述乳腺癌不適合具有治愈意圖的切除或放射療法。在一些實施方案中,所述乳腺癌在針對雌激素受體陽性乳腺癌的至少6個月激素療法后進展。在一些實施方案中,所述乳腺癌先前在使用氟維司群的療法存在的情況下進展。在一些實施方案中,所述乳腺癌先前在使用芳香酶抑制劑的療法存在的情況下進展。在一些實施方案中,所述乳腺癌先前在使用阿那曲唑、來曲唑或依西美坦的療法存在的情況下進展。
在一些實施方案中,針對使用式(A)、(B)、(C)或(D)的雌激素受體調節劑的療法選擇具有激素抗性雌激素受體(ER)陽性乳腺癌的患者的方法包括:a)確定所述患者是否具有ESR1基因中的突;和b)若所述患者具有突變,則針對療法選擇患者。在一些實施方案中,所述式(A)、(B)、(C)或(D)的雌激素受體調節劑為選擇性雌激素受體降解劑(SERD)。在一些實施方案中,所述突變導致具有選自以下位置的氨基酸替換的ER多肽:SEQ ID NO:2的氨基酸位置6、118、269、311、341、350、380、392、394、433、463、503、534、535、536、537、538和555。在一些實施方案中,所述突變導致具有選自以下的氨基酸替換的ER多肽:H6Y、S118P、R269C、T311M、S341L、A350E、E380Q、V392I、R394H、S433P、S463P、R503W、V534E、P535H、L536R、L536P、L536Q、Y537N、Y537C、Y537S、D538G和R555C。在一些實施方案中,所述患者具有ESR1基因中的兩種或更多種突變。在一些實施方案中,所述突變為導致ER-YAP1融合多肽的易位。
在一些實施方案中,所述患者在激素療法后展現疾病進展。在一些實施方案中,所述患者在抗雌激素療法后展現疾病進展。在一些實施方案中,所述乳腺癌不適合具有治愈意圖的切除或放射療法。在一些實施方案中,所述乳腺癌在針對雌激素受體陽性乳腺癌的至少6個月激素療法后進展。在一些實施方案中,所述乳腺癌先前在使用氟維司群的療法存在的情況下進展。在一些實施方案中,所述乳腺癌先前在使用芳香酶抑制劑的療法存在的情況下進展。在一些實施方案中,所述乳腺癌先前在使用阿那曲唑、來曲唑或依西美坦的療法存在的情況下進展。
在一些實施方案中,確定所述患者是否具有ESR1基因中的突變的方法包括測試含有一種或多種腫瘤細胞的樣品。在一些實施方案中,所述樣品是腫瘤活檢樣品或流體樣品(例如血液或淋巴樣品)。在一些實施方案中,所述樣品包含一種或多種循環腫瘤細胞(CTC)。因此,在一些實施方案中,在含有一種或多種腫瘤細胞的樣品中評估ESR1的突變狀態。在一些實施方案中,在含有一種或多種CTC的樣品中評估ESR1基因的突變狀態。在一些實施方案中,含有一種或多種循環腫瘤細胞的樣品由患者分離。在一些實施方案中,所述患者具有乳腺癌。在一些實施方案中,所述患者具有ER陽性乳腺癌。在一些實施方案中,所述患者具有轉移性乳腺癌。在一些實施方案中,所述患者先前已用一種或多種抗癌劑治療。在一些實施方案中,所述患者先前已用一種或多種激素療法治療。在一些實施方案中,針對存在或不存在一種或多種ESR1突變測定所述CTC。在一些實施方案中,所述ESR1突變賦予編碼的ER多肽的配體非依賴性活性。在一些實施方案中,確定了導致在選自以下位置具有氨基酸替換的ER多肽的ESR1突變:SEQ ID NO:2的氨基酸位置6、118、269、311、341、350、380、392、394、433、463、503、534、535、536、537、538和555。在一些實施方案中,確定了導致具有選自以下的氨基酸替換的ER多肽的ESR1突變:H6Y、S118P、R269C、T311M、S341L、A350E、E380Q、V392I、R394H、S433P、S463P、R503W、V534E、P535H、L536R、L536P、L536Q、Y537N、Y537C、Y537S、D538G和R555C。在一些實施方案中,確定了作為導致ER-YAP1融合多肽的易位的突變。
在一些實施方案中,測定含有一種或多種腫瘤細胞的樣品存在或不存在一種或多種額外的基因突變。在一些實施方案中,測定含有一種或多種腫瘤細胞的樣品存在或不存在一種或多種選自以下基因中的突變的額外基因突變:BRCA1、BRCA2、CDH1、STK11、TP53、PIK3CA、PTEN、EGFR(ERBB1)、HER2(ERBB2)、AR、ATM、BARD1、BRIP1、CHEK2、DIRAS3、ERBB2、NBN、PALB2、RAD50和RAD51。
在一些實施方案中,編碼ER的核酸分離自含有一種或多種腫瘤細胞的樣品。在一些實施方案中,編碼ER的核酸分離自循環腫瘤細胞。
在一些實施方案中,確定樣品中具有一種或多種ESR1基因中突變的腫瘤細胞的百分比。在一些實施方案中,基于具有一種或多種ESR1基因中突變的腫瘤細胞的百分比確定治療性診斷。
在一些實施方案中,確定樣品中具有一種或多種ESR1基因中突變的CTC的百分比。在一些實施方案中,基于具有一種或多種ESR1基因中突變的CTC的百分比確定治療性診斷。
在一些實施方案中,從患者中分離后,將含有一種或多種腫瘤細胞的樣品體外培養。在一些實施方案中,在測定存在或不存在一種或多種ESR1突變之前,將含有一種或多種腫瘤細胞的樣品體外培養。
在一些實施方案中,從患者中分離后,將含有一種或多種循環腫瘤細胞(CTC)的樣品體外培養。在一些實施方案中,在測定存在或不存在一種或多種ESR1突變之前,將循環腫瘤細胞(CTC)體外培養。
在一些實施方案中,隨時間推移監測患者的ESR1突變狀態。在一些實施方案中,在癌癥治療的過程中監測患者的ESR1突變狀態。在一些實施方案中,在癌癥治療的過程中一次或多次評估患者的ESR1突變狀態。在一些實施方案中,每周、每兩周、每三周、每四周、每月、每2個月、每3個月、每4個月、每5個月、每6個月、每7個月、每8個月、每9個月、每10個月、每11個月、每年、每兩年、每三年、每四年、每五年或更長時間周期評估患者的ESR1突變狀態。
本申請提供的化合物的活性可使用本領域公知的標準方法測定,包括但不限于體外測定諸如報道分子測定、結合測定和細胞存活力測定,或體內測定包括異種移植物腫瘤動物模型。
在一些實施方案中,腫瘤樣品來自生物體的任何組織或流體。樣品包括但不限于全血、抽離的骨髓、骨髓穿刺液、胸膜液、腹膜液、中樞脊液、腹腔液、胰液、腦脊液、腦液、腹水、心包液、尿液、唾液、支氣管灌洗液、汗液、眼淚、耳流、痰、腦積液、精液、經液(vaginal flow)、乳、羊水以及呼吸道、腸道或泌尿生殖道的分泌物。在具體實施方案中,所述樣品為腫瘤活檢樣品。在具體實施方案中,所述樣品來自作為淋巴系統或循環系統的一部分或與淋巴系統或循環系統相關聯的流體或組織。在一些實施方案中,所述樣品為血液樣品,其為靜脈、動脈、周圍組織或臍帶血樣品。在具體實施方案中,所述樣品為血清樣品。在一些實施方案中,所述樣品含有一種或多種循環腫瘤細胞(CTC)。在一些實施方案中,所述樣品含有一種或多種播散性腫瘤細胞(DTC,例如在一個實施方案中為骨髓穿刺液樣品)。
分離來自包含在組織和流體樣品中的細胞的核酸和蛋白質的方法是本領域公知的。在具體實施方案中,從受試者獲得的核酸樣品分離自包含在來自受試者的腫瘤活檢中的細胞。在具體實施方案中,從受試者獲得的核酸樣品分離自骨髓穿刺液中的細胞。在具體實施方案中,從受試者獲得的核酸樣品分離自包含在血液樣品中的細胞。在具體實施方案中,從受試者獲得的核酸樣品分離自包含在淋巴液樣品中的細胞。在一些實施方案中,所述細胞為循環腫瘤細胞(CTC)。
在一些實施方案中,通過使用公知和常規臨床方法獲得樣品的任何合適方法從受試者獲得樣品。用于從受試者獲得流體樣品的操作是公知的。例如,用于抽取和處理全血和淋巴的操作是公知的,并且可用于獲得在所提供的方法中使用的樣品。通常,為了收集血液樣品,向樣品中添加抗凝血劑(例如EDTA或檸檬酸鹽和肝素或CPD(檸檬酸鹽、磷酸鹽、葡萄糖)或類似物質)以防止血液凝結。在一些實例中,將血液樣品收集在含有一定量EDTA的收集管中,以防止血液樣品的凝結。
在一些實施方案中,所述樣品為組織活檢并且例如通過針吸活檢、CT引導的針吸活檢、穿刺活檢、內窺鏡活檢、支氣管鏡活檢、支氣管灌洗、切口活檢、切除活檢、鉆取活檢、剃刮活檢、皮膚活檢、骨髓活檢和電套圈外科切除操作(Loop Electrosurgical Excision Procedure,LEEP)獲得。通常,獲得非壞死、無菌活檢或樣本,其大于100mg,但可更小,諸如小于100mg、50mg或更小,10mg或更小或5mg或更小;或更大,諸如大于100mg、200mg或更大,或500mg或更大,1g或更大,2g或更大,3g或更大,4g或更大或5g或更大。待提取用于測定的樣品大小取決于許多因素,包括但不限于待進行的測定數目、組織樣品的健康狀況、癌癥的類型和患者的狀況。在一些實施方案中,將組織置于無菌容器(諸如無菌管或培養板)中,并任選地浸沒在適當介質中。通常,通過本領域公知的機械方法和/或酶處理將細胞解離成細胞懸浮液。通常,收集細胞,然后進行標準操作以分離用于測定的核酸。
在一些實施方案中,在規律的間隔獲得樣品,諸如一天、兩天、三天、四天、五天、六天、一周、兩周、四周、一個月,兩個月、三個月、四個月、五個月、六個月、一年、每天、每周、每月、每季、每年兩次或每年。在一些實施方案中,樣品的收集在相對于用一種或多種抗癌劑治療的預定時間或規律的間隔進行。在一些實施方案中,樣品的收集在相對于用激素療法治療的預定時間或規律的間隔進行。例如,在治療之前、期間或之后或在連續治療之間以預定時間或以規律的間隔收集樣品。在具體的實例中,在給予抗癌療法之前從受試者獲得樣品,然后在實施治療之后在規律的間隔再次獲得樣品。在具體的實例中,在給予激素治療之前從受試者獲得樣品,然后在實施治療之后在規律的間隔再次獲得樣品。
流體樣品的體積可為適于在所提供的方法中檢測ER突變體的任何體積。在一些實例中,流體樣品的體積取決于所使用的特定測定方法。例如,特定的測定方法可需要更大或更小的流體樣品體積,這取決于以下因素,諸如但不限于所使用的裝置或方法的容量和測定方法的通量水平。在一些實例中,在應用測定方法之前,將流體樣品在適當的培養基中稀釋。在一些實例中,從受試者獲得流體樣品,并且在測定方法中使用樣品的一部分或等分試樣。在應用測定方法之前,可將所述部分或等分試樣在適當的培養基中稀釋。
在一些實施方案中,樣品獲自受試者,其為哺乳動物。示例性哺乳動物受試者包括但不限于靈長類動物,諸如人、猿和猴;嚙齒類動物,諸如小鼠、大鼠、兔和雪貂;反芻動物,諸如山羊、牛、鹿和綿羊;馬、豬、狗、貓和其它動物。在一些實施方案中,所述樣品獲自患者。在一些實施例中,所述患者為人類患者。
在一些實施方案中,獲自受試者的核酸樣品為基因組核酸樣品。在一些實施方案中,獲自受試者的核酸樣品為RNA樣品。在一些實施方案中,mRNA分離自RNA樣品中的全RNA。在一些實施方案中,所述RNA樣品逆轉錄至cDNA。在一些實施方案中,所述基因組核酸樣品通過核酸擴增方法擴增。在一些實施方案中,所述核酸擴增方法為聚合酶鏈式反應(PCR)。在一些實施方案中,所述基因組核酸樣品使用一組對ER基因具有特異性的核苷酸引物擴增。在一些實施方案中,該組核苷酸引物側面具有編碼ER多肽的突變的氨基酸位置的核酸序列。在一些實施方案中,所述擴增產物為編碼ER多肽的突變的氨基酸位置的核酸。在一些實施方案中,序列特異性引物與可檢測分子,諸如熒光標記、生物發光標記、化學發光標記、放射性標記、酶標記、可檢測底物或結合第二可檢測分子的肽或分子綴合。
在一些實施方案中,所述樣品為含有循環腫瘤DNA(ctDNA)、RNA(ctRNA)或微RNA的血漿或血清樣品(參見例如Chan et al.(2007)Br J Cancer 96(5):681-5)。在一些實施方案中,所述核酸在檢測之前由樣品分離。
檢測方法
在一些實施方案中,測定包括測序所述核酸樣品。在一些實施方案中,核酸樣品中編碼ER的核酸首先通過諸如聚合物酶鏈式反應(PCR)的方法使用序列特異性引物擴增,然后測序擴增后的PCR片段。用于本申請提供的方法的示例性測序方法是本領域公知的,并且包括但不限于雙脫氧或鏈終止方法、Maxam-Gilbert測序、大規模平行簽名測序(或MPSS)、Polony測序、焦磷酸測序、Illumina染料測序、SOLiD(或通過連接測序)測序、離子半導體測序、DNA納米球測序、Heliscope測序和單分子實時(SMRT)測序。
在一些實施方案中,編碼突變型ER-α的DNA通過BEAMing(珠子、擴增、乳液、磁性)PCR測序方法評估(參見,例如Li et al.(2006)Nat Methods 3(2):95-7;Li et al.(2006)Nat Methods 3(7):551-9;和Diehl et al.(2008)Nat Med.14(9):985–990)。BEAMing是這樣的技術,其中單個DNA分子附著至油包水型乳劑中的磁珠,然后進行區室化PCR擴增。然后通過與突變型或野生型ER的熒光等位基因特異性探針雜交來確定與珠子結合的DNA的突變狀態。然后使用流式細胞術來定量存在于血漿或血清中的突變型DNA的水平(參見例如Higgins et al.(2012)Clin Cancer Res 18:3462-3469)。
在一些實施方案中,編碼突變型ER-α的DNA通過核酸樣品的克隆擴增評估。在一些實施方案中,編碼突變型ER-α的DNA通過數字聚合酶鏈式反應評估。在一些實施方案中,編碼突變型ER-α的DNA通過液滴數字聚合酶鏈式反應(droplet digital polymerase chain reaction)評估。
在一些實施方案中,對用于檢測存在編碼突變型ER-α的DNA的樣品進行測定,其包括用序列特異性寡核苷酸探針檢測突變,所述序列特異性寡核苷酸探針對編碼突變型ER-α而非野生型ER的核酸具有特異性。在一些實施方案中,測定包括(a)使樣品與突變型ER-α核酸序列特異性寡核苷酸探針接觸,其中若樣品中存在突變性核酸序列,則形成探針-DNA復合物,和(b)檢測探針-DNA復合物。在一些實施方案中,將序列特異性探針與可檢測分子綴合,諸如熒光標記、生物發光標記、化學發光標記、放射性標記、酶標記、可檢測底物或結合第二可檢測分子的肽或分子。
在一些實施方案中,單核苷酸變化可通過以下方式檢測:使用基于PCR的切割擴增多態性序列(cleaved amplified polymorphic sequences,CAPS)標記物進行PCR,其在突變序列中產生限制性位點(Michaels et al(1998)Plant J.14(3):381-5)或附接至可檢測部分的序列特異性發卡探針,所述可檢測部分諸如但不限于熒光團(Mhlanga and Malmberg(2001)Methods 25:463-471)。在一些實施方案中,將序列特異性探針與可檢測分子綴合,諸如熒光標記、生物發光標記、化學發光標記、放射性標記、酶標記、可檢測底物或結合第二可檢測分子的肽或分子。
在一些實施方案中,對用于檢測存在編碼突變型ER-α的DNA的樣品進行測定,其使用寡核苷酸陣列進行(參見例如Hastia et al.(1999)J Med Genet.36(10):730-6)。在一些實施方案中,含有來自受試者的核酸的樣品直接雜交至芯片。在一些實施方案中,含有來自受試者的核酸的樣品使用擴增方法擴增,所述擴增方法諸如但不限于聚合酶鏈式反應(PCR),并且擴增后的核酸雜交至芯片。在一些實施方案中,所述寡核苷酸陣列包含在微芯片上。在一些實施方案中,單核苷酸變化可使用微芯片檢測。
在一些實施方案中,測定樣品包括用針對突變型ER-α多肽具有特異性的抗體檢測突變。在一些實施方案中,檢測突變型ER-α多肽的方法包括從受試者獲得樣品,其中所述樣品包含ER多肽,以及通過使樣品與抗體接觸來測試樣品是否存在突變型ER-α多肽,所述抗體對結合突變型ER-α多肽具有特異性,而不結合野生型ER-α多肽或以降低的親和力結合野生型ER-α多肽,其中突變型ER-α多肽的存在產生抗體-突變型ER-α多肽復合物。在一些實施方案中,所述方法還包括檢測抗體-突變型ER-α多肽復合物。在一些實施方案中,所述方法還包括用檢測試劑檢測抗體-突變型ER-α多肽復合物。在一些實施方案中,所述突變型ER-α特異性抗體與可檢測分子綴合,諸如熒光標記、生物發光標記、化學發光標記、放射性標記、酶標記、可檢測底物或結合第二可檢測分子的肽或分子(例如二級抗體)。在一些實施方案中,通過測定可檢測分子來檢測突變型ER-α特異性抗體的結合。在一些實施方案中,通過使用二級抗體(例如抗-IgG)檢測突變型ER-α特異性抗體的結合。在一些實施方案中,所述樣品是腫瘤活檢樣品、骨髓穿刺液、血液樣品、血清樣品或淋巴樣品。
雌激素受體調節劑體外活性
雌激素受體調節劑(ERM)化合物(其包括但不限于表1-4中的那些)的組合的細胞毒性和抑制細胞活性通過以下方式測量:在細胞培養基中建立增殖的哺乳動物腫瘤細胞系,添加測試化合物,將所述細胞培養約6小時至約5天的時間;并測量細胞存活力(實施例7)。使用基于細胞的體外測定法測量存活力,即增殖(IC50)、細胞毒性(EC50)和誘導凋亡(半胱天冬酶激活)。
ERM化合物的體外效力通過實施例7的細胞增殖測定(可從Promega Corp.,Madison,WI商購獲得的發光細胞存活力測定)來測量。該均相測定方法基于鞘翅目(Coleoptera)熒光素酶的重組表達(US 5583024;US 5674713;US 5700670),并基于存在的ATP(代謝活性細胞的指示劑)的定量來確定培養物中存活細胞的數量(Crouch et al(1993)J.Immunol.Meth.160:81-88;US 6602677)。以96或384孔格式進行測定,使其適合于自動化高通量篩選(HTS)(Cree et al(1995)AntiCancer Drugs 6:398-404)。均相測定操作包括將單一試劑(試劑)直接添加到在補充有血清的培養基中培養的細胞中。不需要細胞清洗、去除培養基和多次移液步驟。在添加試劑和混合后的10分鐘內,系統在384孔格式中檢測到少至15個細胞/孔。
通過針對腫瘤細胞系的測定(實施例7)測量ERM化合物的組合的抗增殖作用。建立測試化合物和組合的EC50值。體外細胞效能活性的范圍可為約100nM至約10μM。
雌激素受體調節劑體內腫瘤異種移植物活性
通過在嚙齒類動物中植入癌細胞的同種異體移植物或異種移植物并用藥物和對照(媒介物)制劑處理荷瘤動物,體內測量ERM化合物和各種化學治療劑的功效。結果取決于細胞系、腫瘤細胞中存在或不存在某些突變、ERM化合物和化療劑的給予順序、給予方案和其它因素。用藥物或對照(媒介物)處理受試小鼠,并監測數周或更長時間以測量腫瘤倍增時間、細胞殺滅對數值(log cell kill)和腫瘤抑制(實施例8)。圖1-13顯示根據實施例8的方案在對用ERM化合物和各種化療劑處理的荷瘤小鼠處理后,腫瘤體積隨時間變化的圖。
圖1和2示出不存在E2的情況下在誘導表達WT和突變型ERα的MCF7中的ERα降解測定。在含有100ng/ml Dox的缺乏雌激素的培養基中將細胞用增加劑量的氟維司群(圖1)處理24小時。用來自表1的雌激素受體調節劑(ERM)1-3(圖1)和ERM 4-23(圖2)而非他莫昔芬(圖2),觀察到突變的ERa降解。由PR和細胞周期蛋白D1水平證明功能輸出。
圖3示出一組7只攜帶MCF-7EF1:Y537S ESR1-突變體(Y537S)的免疫受損小鼠中歷時28天的擬合腫瘤體積變化:每日一次PO(口服)給予媒介物,以高劑量200mg/kg給予氟維司群;AUC約20-30x臨床暴露以上,以及100mg/kg/天來自表1的雌激素受體調節劑(ERM)1-3和100mg/kg/天來自表4的ERM 4-23。工程化MCF7突變型細胞表達相對于內源性野生型(WT)MCF7細胞而言4-5x以上的蛋白。氟維司群未顯示強效的體內效能,甚至在30x臨床暴露以上且不存在E2的情況下。
圖4示出一組5只攜帶包含ESR1L536P突變體的HCI-005乳腺腫瘤(NOD.SCID OVX中的BC PDX模型)異種移植物(ER+,PR+,HER2+)的免疫受損小鼠中歷時40天的擬合腫瘤體積變化:每日一次PO(口服)給予媒介物(+)、媒介物(-),以60mg/kg/天給予他莫昔芬,以200mg/kg(QD 3x/wk)給予氟維司群,以100mg/kg/天給予ERM 1-3,以及以100mg/kg/天給予ERM 4-23。在該ESR1L536P突變體模型中,ERM 4-23比ERM 1-3具有更大效能。
圖5示出一組7只攜帶包含ESR1L536P突變體的HCI-005乳腺腫瘤(NOD.SCID OVX中的BC PDX模型)異種移植物(ER+,PR+,HER2+)的免疫受損小鼠中具有Fold Over Start的歷時56天的擬合腫瘤體積變化:每日一次PO(口服)給予媒介物(+E2)、媒介物(-E2),以60mg/kg/天給予他莫昔芬,以200mg/kg(QD 3x/wk)給予氟維司群,以100mg/kg/天給予ERM 1-3,以及以100mg/kg/天給予ERM 4-23。
圖6示出一組7-8只攜帶WHIM 20Y537S ESR1-突變體(Y537S)、PIK3CA突變體(E542K)乳腺腫瘤(NOD.SCID OVX中的BC PDX模型)異種移植物的免疫受損小鼠中歷時35天的擬合腫瘤體積變化:每日一次PO(口服)給予媒介物(+E2)、媒介物(-E2),以60mg/kg/天給予枸櫞酸他莫昔芬,以50mg/kg給予氟維司群,以100mg/kg/天給予ERM 1-3,以及以100mg/kg/天給予ERM 4-23。
圖7示出一組7只攜帶WHIM 20Y537S ESR1-突變體(Y537S)、PIK3CA突變體(E542K)乳腺腫瘤(NSG OVX中的BC PDX模型)異種移植物的免疫受損小鼠中歷時28天的擬合腫瘤體積變化:每日一次PO(口服)給予媒介物(+E2)、媒介物(-E2),以200mg/kg每周三次皮下給予氟維司群,以100mg/kg/天給予ERM 1-3,以及以10和100mg/kg/天給予ERM 4-23。
圖8和9示出攜帶WHIM 20Y537S ESR1-突變體(Y537S)、PIK3CA突變體(E542K)乳腺腫瘤、患者衍生的(BC PDX模型)異種移植物模型的免疫受損小鼠中ERα(alpha)與肌動蛋白水平的比率(圖8)以及PR-A與肌動蛋白水平的比率(圖9)的條形圖:所述模型歷時4天每日一次PO(口服)給予100微升(μl)媒介物,以200mg/kg給予氟維司群,以100mg/kg給予ERM 1-3,以及以100mg/kg給予ERM 4-23。
圖10示出乳腺癌患者在基線、治療前(左側)和以600mg/天連續每日口服給予ERM 1-3(ARN-810)一個月后(右側)的[18F]FES-PET圖像,其中在給予后23小時采集圖像。確認患者具有含ESR1D538G突變的軟組織損害。
ERM 1-3和ERM 4-23證明在ER突變型乳腺癌異種移植模型中腫瘤退化至腫瘤生長延遲的抗腫瘤活性的范圍。此外,ERM 1-3和ERM 4-23在其中來自患者的原發性或轉移性腫瘤植入免疫受損小鼠的模型(也稱為患者衍生的異種移植物模型)中是有效的。在患者衍生的異種移植物模型中觀察到ERM 1-3和ERM 4-23的藥效學活性,其基于降低的ER蛋白水平和孕酮受體水平的降低:ER靶基因。此外,在一個模型中,ERM 1-3和ERM 4-23比護理藥物標準物(氟維司群或他莫昔芬)更有效,并且在其它模型中觀察到改善的功效的趨勢。
ER相關疾病或病癥的治療
在一些實施方案中,本申請提供了治療具有一種或多種ESR1基因中的突變的患者的方法。在一些實施方案中,治療包括對具有一種或多種ESR1基因中的突變的患者給予式(A)、(B)、(C)或(D)的化合物。在一些實施方案中,所述突變導致具有選自以下的氨基酸替換的ER多肽:H6Y、S118P、R269C、T311M、S341L、A350E、E380Q、V392I、R394H、S433P、S463P、R503W、V534E、P535H、L536R、L536P、L536Q、Y537N、Y537C、Y537S、D538G和R555C。在一些實施方案中,所述患者具有兩種或更多種ESR1基因中的突變。在一些實施方案中,所述突變為導致ER-YAP1融合多肽的易位。在一些實施方案中,所述患者具有癌癥。在一些實施方案中,所述患者具有實體瘤。在一些實施方案中,所述癌癥為乳腺癌、卵巢癌、子宮內膜癌、子宮癌、宮頸癌、前列腺癌、肝癌、肺癌或膀胱癌。在一些實施方案中,所述癌癥為乳腺癌。在一些實施方案中,所述癌癥為雌激素陽性乳腺癌。在一些實施方案中,所述癌癥為HER2陽性乳腺癌。在一些實施方案中,所述癌癥為HER2陰性乳腺癌。在一些實施方案中,所述癌癥轉移性癌癥。在一些實施方案中,所述癌癥為轉移性乳腺癌。
在一些實施方案中,所述癌癥為激素依賴性癌癥。在一些實施方案中,所述癌癥為雌激素受體依賴性癌癥。在一些實施方案中,所述癌癥為雌激素受體陽性癌癥。在一些實施方案中,所述癌癥為雌激素敏感性癌癥。在一些實施方案中,所述癌癥對抗激素治療具有抗性。在一些實施方案中,所述癌癥為對抗激素治療具有抗性的雌激素敏感性癌癥或雌激素受體依賴性癌癥。在一些實施方案中,抗激素治療包括用至少一種選自以下的藥物治療:他莫昔芬、氟維司群、類固醇芳香酶抑制劑和非類固醇芳香酶抑制劑。在一些實施方案中,抗激素治療包括用阿那曲唑、來曲唑或依西美坦治療。
在一些實施方案中,用式(A)、(B)、(C)或(D)的化合物治療的患者為在抗雌激素療法后具有疾病進展的婦女。在一些實施方案中,用式(A)、(B)、(C)或(D)的化合物治療的患者為在用芳香酶抑制劑的療法后具有疾病進展的婦女。在一些實施方案中,用式(A)、(B)、(C)或(D)的化合物治療的患者為在用阿那曲唑、來曲唑或依西美坦的療法后具有疾病進展的婦女。
在一些實施方案中,用式(A)、(B)、(C)或(D)的化合物治療的患者為絕經后婦女。在一些實施方案中,用式(A)、(B)、(C)或(D)的化合物治療的患者為在抗雌激素療法后具有疾病進展的絕經后婦女。在一些實施方案中,用式(A)、(B)、(C)或(D)的化合物治療的患者為在用芳香酶抑制劑的療法后具有疾病進展的絕經后婦女。在一些實施方案中,用式(A)、(B)、(C)或(D)的化合物治療的患者為在用阿那曲唑、來曲唑或依西美坦的療法后具有疾病進展的絕經后婦女。
在一些實施方案中,用式(A)、(B)、(C)或(D)的化合物治療的患者未經受化學療法(chemotherapy-)。
在一些實施方案中,用式(A)、(B)、(C)或(D)的化合物治療的患者正在用至少一種抗癌劑針對癌癥進行治療。在一個實施方案中,所述癌癥為激素難治性癌癥。
在一些實施方案中,所述式(A)、(B)、(C)或(D)的化合物用于治療具有一種或多種ESR1突變的患者的ER相關疾病或病癥。示例性ER相關疾病或病癥包括但不限于與癌癥(例如骨癌、乳腺癌、結腸直腸癌、肺癌、子宮內膜癌、前列腺癌、卵巢癌和子宮癌)相關的ER-α功能障礙、子宮內膜異位癥、子宮肌瘤、平滑肌瘤(例如子宮平滑肌瘤)、中樞神經系統(CNS)缺陷(例如酒精中毒、偏頭痛)、心血管系統缺陷(例如主動脈瘤、對心肌梗塞的易感性、主動脈瓣硬化、心血管疾病、冠狀動脈疾病、高血壓)、血液系統缺陷(例如深靜脈血栓形成)、免疫和炎癥疾病(例如格雷夫斯病、關節炎、多發性硬化、肝硬化)、感染易感性(例如乙型肝炎、慢性肝病)、代謝缺陷(例如骨密度、膽汁郁積、尿道下裂、肥胖、骨關節炎、骨質減少、骨質疏松)、神經缺陷(例如阿爾茨海默病、帕金森病、偏頭痛、眩暈)、精神缺陷(例如神經性厭食、注意缺陷多動障礙(ADHD)、癡呆、重度抑郁癥、精神病)和生殖缺陷(例如月經初潮年齡、子宮內膜異位癥、不育癥)。
本申請還提供了降低具有一種或多種ESR1突變的患者中ER激活的方法,包括向哺乳動物給予至少一種具有式(A)、(B)、(C)或(D)的結構的化合物或其藥用鹽或N-氧化物。在一些實施方案中,所述方法包括降低哺乳動物中乳腺細胞、卵巢細胞、結腸細胞、前列腺細胞、子宮內膜細胞或子宮細胞中的ER活化。在一些實施方案中,降低哺乳動物中ER激活的方法包括降低哺乳動物中雌激素與雌激素受體的結合。在一些實施方案中,降低哺乳動物中ER激活的方法包括降低哺乳動物中的ER濃度。
給藥途徑
本申請所述的雌激素受體調節劑化合物的合適的給藥途徑包括但不限于口服、腸胃外(例如、靜脈內、皮下、肌肉內)、鼻內、經頰、局部、經直腸、氣霧劑、眼部、肺部、透粘膜、透皮、陰道、耳部、經鼻和局部給予。此外,僅通過舉例的方式,腸胃外遞送包括肌內、皮下、靜脈內、髓內注射、以及鞘內、直接心室內、腹膜內、淋巴內和鼻內注射。在某些實施方案中,本申請所述的雌激素受體調節劑化合物以全身方式給予。在某些其它實施方案中,本申請所述的雌激素受體調節劑化合物以局部而非全身方式給予。在一些實施方案中,某些實施方案,本申請所述的雌激素受體調節劑化合物口服給予。
藥物組合物/制劑
在一些實施方案中,如本申請所述的雌激素受體調節劑化合物被配制成藥物組合物。藥物組合物以常規方式使用一種或多種藥用非活性成分配制,所述成分促進活性化合物加工成藥學上使用的制劑。適當的制劑取決于所選擇的給藥途徑。本申請所述藥物組合物的概述可見于例如Remington:The Science and Practice of Pharmacy,Nineteenth Ed(Easton,Pa.:Mack Publishing Company,1995);Hoover,John E.,Remington’s Pharmaceutical Sciences,Mack Publishing Co.,Easton,Pennsylvania 1975;Liberman,H.A.and Lachman,L.,Eds.,Pharmaceutical Dosage Forms,Marcel Decker,New York,N.Y.,1980;和Pharmaceutical Dosage Forms and Drug Delivery Systems,Seventh Ed.(Lippincott Williams&Wilkins1999),通過引用的方式將上述公開內容并入本申請。
本申請所用的藥物組合物是指式(A)、(B)、(C)或(D)的化合物與其它化學組分(即藥用無活性成分)的混合物,所述其它化學組分諸如載體、賦形劑、粘合劑、填充劑、助懸劑、矯味劑、增甜劑、崩解劑、分散劑、表面活性劑、潤滑劑、著色劑、稀釋劑、增溶劑、濕潤劑、增塑劑、穩定劑、滲透增強劑、潤濕劑、消泡劑、抗氧化劑、防腐劑或一種或多種它們的組合。藥物組合物有助于向哺乳動物給予化合物。
藥物組合物將包含至少一種式(A)、(B)、(C)或(D)的化合物或其藥用鹽,其作為呈游離酸或游離堿形式或呈藥用鹽形式的活性成分。此外,本申請所述的方法和藥物組合物包括使用N-氧化物(適當時)、結晶形式、無定形相以及具有相同類型活性的這些化合物的活性代謝物。在一些實施方案中,本申請所述的化合物以非溶劑化形式或以與藥用溶劑諸如水、乙醇等的溶劑化形式存在。
本申請所述的藥物制劑包括但不限于水性液體分散體、自乳化分散體、固體溶液、脂質體分散體、氣溶膠、固體劑型、粉劑、即時釋放制劑、控制釋放制劑、速溶制劑、片劑、膠囊劑、丸劑、延遲釋放制劑、延長釋放制劑、腸溶衣制劑、脈沖釋放制劑、多顆粒制劑和混合的即時釋放和控制釋放制劑。
在一些實施方案中,全身性給予所述式(A)、(B)、(C)或(D)的化合物或其藥用鹽。
在一些實施方案中,口服給予所述式(A)、(B)、(C)或(D)的化合物或其藥用鹽。所有用于口服給予的制劑都呈適于所述給藥的劑量。在一些實施方案中,本申請公開的固體劑型呈片劑、丸劑、粉劑、膠囊劑、固體分散體、固體溶液、生物可蝕性劑型、控制釋放制劑、脈沖釋放劑型、多顆粒劑型、珠粒、藥丸(pellets)、顆粒劑的形式。在其它實施方案中,藥物制劑呈粉末形式。在其它實施方案中,藥物制劑呈片劑形式。在其它實施方案中,藥物制劑呈懸浮片劑、速溶片劑、嚼崩(bite-disintegration)片劑、速崩片劑、泡騰片劑或囊片形式。在其它實施方案中,藥物制劑呈膠囊劑形式。
在一些實施方案中,配制藥物固體口服劑型以提供活性化合物的控制釋放。控制釋放特性包括例如持續釋放、延長釋放、脈沖釋放和延遲釋放性質。
在一個方面,用于口服給予的液體制劑劑型呈選自包括但不限于以下的水性混懸劑形式:藥用水性口服分散體、乳劑、溶液、酏劑、凝膠劑和糖漿劑。參見,例如,Singh et al.,Encyclopedia of Pharmaceutical Technology,2nd Ed.,pp.754-757(2002)。
對于經頰或舌下給予,組合物任選地采取以常規方式配制的片劑、錠劑或凝膠劑的形式。
在一個方面,將式(A)、(B)、(C)或(D)的化合物或其藥用鹽配制成適于肌內、皮下或靜脈內注射的藥物組合物。腸胃外注射涉及推注(bolus injection)和/或連續輸注。
在一些實施方案中,靜脈內給予所述式(A)、(B)、(C)或(D)的化合物或其藥用鹽。在一些實施方案中,皮下給予所述式(A)、(B)、(C)或(D)的化合物或其藥用鹽。
在一些實施方案中,局部給予所述式(A)、(B)、(C)或(D)的化合物或其藥用鹽。在所述實施方案中,將所述式(A)、(B)、(C)或(D)的化合物或其藥用鹽配制成各種可局部給予的組合物,諸如溶液劑、懸浮劑、洗劑、凝膠劑、糊劑、洗發劑、擦洗劑、擦拭劑、涂抹劑、藥棒、藥用繃帶、香膏劑、乳膏劑或軟膏劑。在一些實施方案中,向哺乳動物的皮膚局部給予所述式(A)、(B)、(C)或(D)的化合物或其藥用鹽。在一些實施方案中,將所述式(A)、(B)、(C)或(D)的化合物制備成經皮劑型。
在另一方面,其為式(A)、(B)、(C)或(D)的化合物或其藥用鹽在制備用于治療其中雌激素受體的活性有助于疾病或病癥的病理學和/或癥狀的疾病、障礙或病癥(例如,特征在于ESR1基因中的突變的激素抗性癌癥)的藥物中的用途。在一個方面,所述疾病或病癥為任何本申請所述的疾病或病癥。
治療有效量的雌激素受體調節劑或其藥用鹽可取決于疾病的嚴重度、受試者的年齡和相對健康以及其它因素而廣泛變化。
給藥和治療方案
在一個實施方案中,所述式(A)、(B)、(C)或(D)的化合物或其藥用鹽用于制備治療具有一種或多種ESR1突變包括從雌激素受體活性降低中獲益的疾病或病癥(例如,特征在于ESR1基因中的突變的激素抗性癌癥)的藥物。在需要所述治療的哺乳動物中治療本申請所述的任何疾病或病癥的方法包括以治療有效量向所述患者給予藥物組合物,所述藥物組合物包含至少一種式(A)、(B)、(C)或(D)的化合物或其藥用鹽、N-氧化物、活性代謝物、前藥或藥用溶劑化物。
治療有效量取決于疾病或病癥的嚴重度和病程、先前療法、患者的健康狀況、體重和對藥物的響應,以及治療醫師的判斷。治療有效量任選地通過包括但不限于劑量遞增臨床試驗的方法來確定。
在本申請所述的任何治療方法中,將所述式(A)、(B)、(C)或(D)的化合物的有效量:(a)全身性給予于哺乳動物;和/或(b)口服給予于哺乳動物;和/或(c)靜脈內給予于哺乳動物;和/或(d)通過注射給予于哺乳動物;和/或(e)局部給予于哺乳動物;和/或(f)非全身性或局部給予于哺乳動物。
在一些情況下,治療方法包括單次給予有效量的化合物,包括另外的實施方案,其中(i)給予化合物一次;(ii)在一天的時間內多次向哺乳動物給予化合物;(iii)持續(continually)給予;或(iv)連續(continuously)給予。
在任意上述方面中是包括多次給予有效量的化合物的另外的實施方案,包括另外的實施方案,其中(i)連續或間歇給予化合物:如單劑量;(ii)多次給予之間的時間為每6小時;(iii)每8小時向哺乳動物給予化合物;(iv)每12小時向哺乳動物給予化合物;(v)每24小時向哺乳動物給予化合物。在進一步或備選的實施方案中,所述方法包括休藥期,其中暫時中止所述化合物的給予或暫時減少所給予的化合物的劑量;在休藥期結束時,恢復化合物的給藥。在一個實施方案中,休藥期的長度從2天到1年不等。
在其中患者的狀況不改善的某些實施方案中,根據醫生的判斷,長期(即延長的時間)給予化合物。
在其中患者的狀態改善的某些實施方案中,所給予的藥物的劑量暫時減少或暫時中止一段時間(即,“休藥期”)。
在一些實施方案中,成人治療所采用的劑量范圍通常為每日0.01mg-5000mg的式(A)、(B)、(C)或(D)的化合物。在一個方面,成人治療所采用的劑量范圍通常為每日約1mg至約2000mg的式(A)、(B)、(C)或(D)的化合物。在一個實施方案中,期望的劑量方便地以同時或以適當的間隔給予的單劑量或分開劑量存在,例如每日兩次、三次、四次或更多次亞劑量。在一個實施方案中,適于本申請所述式(A)、(B)、(C)或(D)的化合物或其藥用鹽的每日劑量為約0.01至約50mg/kg體重。
在一些實施方案中,向絕經后婦女口服給予雌激素受體調節劑或其藥用鹽。
在一些實施方案中,每天向所述患者給予式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽。在一些實施方案中,每隔一天向所述患者給予式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽。在一些實施方案中,每天、每隔一天、每三天、每四天、每五天、每六天、每周一次、每兩周一次、每三周一次或每月一次向所述患者給予式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽。
在一些實施方案中,以連續每日給藥方案向所述患者口服給予式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽。
在一些實施方案中,向所述患者給予約5mg/天至約1000mg/天的式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽。在一些實施方案中,向所述患者給予約10mg/天至約100mg/天的式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽。
在一些實施方案中,向所述患者給予約10mg/天、約15mg/天、約20mg/天、約25mg/天、約30mg/天、約35mg/天、約35mg/天、約40mg/天、約45mg/天、約50mg/天、約55mg/天、約60mg/天、約65mg/天、約70mg/天、約75mg/天、約80mg/天、約85mg/天、約90mg/天、約100mg/天、約150mg/天、約200mg/天、約250mg/天、約300mg/天、約350mg/天、約400mg/天、約450mg/天、約500mg/天、約550mg/天、約600mg/天、約650mg/天、約700mg/天、約750mg/天、約800mg/天、850mg/天、約900mg/天、約950mg/天、約1000mg/天的式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽。
在一些實施方案中,向所述患者給予約600mg/天的式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽。
在一些實施方案中,向所述患者給予約1000mg/天的式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽。
在一個實施方案中,期望的每日劑量方便地以同時(或在短時間內)或以適當的間隔給予的單劑量或分開劑量存在,例如作為每日兩個、三個、四個或更多個亞劑量。在一些實施方案中,期望的每日劑量方便地以分開的劑量存在,所述劑量每日一次同時(或在短時間內)給予。在一些實施方案中,期望的日劑量方便地以分開的劑量提供,所述劑量以等份每日兩次、每日三次或每日多于三次給予。
在一些實施方案中,向患者給予的期望每日量的式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽每日給予一次。
在一些實施方案中,向患者給予的每日量的式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽以均分劑量每日給予兩次。
在一些實施方案中,向患者給予的每日量的式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽以均分劑量每日給予三次。
在一些實施方案中,向患者給予的每日量的式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽以均分劑量每日給予多于三次。
在其中未觀察到患者中乳腺癌的狀態改善的某些實施方案中,式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽的每日劑量增加。在一些實施方案中,每日一次給藥方案變為每日兩次給藥方案。在一些實施方案中,采用每日三次給藥方案增加給予的雌激素受體調節劑或其藥用鹽的量。
在一些實施方案中,向處于禁食狀態的患者給予式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽。在一些實施方案中,向處于進食狀態的患者給予式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽。
在一些實施方案中,向患者給予的式(A)、(B)、(C)或(D)的雌激素受體調節劑或其藥用鹽的量取決于以下因素而變化,諸如但不限于乳腺癌的情況和嚴重度及婦女的特征(identity)(例如,體重)。
18F-氟雌二醇(FES)是雌激素受體的特異性和選擇性放射性示蹤劑,其可通過對良好耐受劑量的新治療劑的充分靶標結合進行非侵入性監測來輔助臨床藥物開發。在患有晚期或轉移性ER+乳腺癌的婦女中,使用18F-FES的正電子發射斷層掃描(PET)在多中心、I期、劑量探尋、安全性和藥物動力學臨床試驗中用于驗證雌激素受體靶標與ERM1-3的結合。圖10顯示了在基線、治療前(左)和以600mg/日的連續口服每日給藥藥物制劑ERM 1-3一個月后(ARN-810)(右)的乳腺癌患者的[18F]FES-PET(氟雌二醇-正電子發射斷層掃描)圖像,其中在給藥后23小時收集圖像。患者被證實具有ESR1D538G突變的軟組織損害。患者狀態是部分響應。FES-PET/CT成功地證明了ERM1-3臨床試驗的靶標結合。臨床試驗中的其它患者與用ERM 1-3藥物制劑的治療顯示出相似的響應。
組合療法
在一些實施方案中,用于治療具有一種或多種ESR1突變的患者的藥物組合物還包含一種或多種選自以下的額外治療活性劑:皮質類固醇、止吐劑、鎮痛劑、抗癌劑、抗炎劑、激酶抑制劑、受體抑制劑、抗體、HSP90抑制劑、組蛋白脫乙酰酶(HDAC)抑制劑、免疫系統調節劑、PD-1抑制劑、聚ADP-核糖聚合酶(PARP)抑制劑和芳香酶抑制劑。
在某些情況下,適當地給予至少一種式(A)、(B)、(C)或(D)的化合物或其藥用鹽與一種或多種額外治療劑的組合。在某些實施方案中,藥物組合物還包含一種或多種抗癌劑。
在一個具體的實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與第二治療劑共同給予,其中式(A)、(B)、(C)或(D)的化合物或其藥用鹽和第二治療劑調節所治療的疾病、障礙或病癥的不同方面,從而提供比單獨給予任一治療劑更佳的總體益處。
在任何情況下,不考慮待治療的疾病、障礙或病癥,患者所經歷的總體益處是兩種治療劑的累加效應,或者患者可經歷協同益處。
在組合療法中,多種治療劑(其中之一是本申請所述的化合物之一)以任何順序或甚至同時給予。如果同時給予,僅通過舉例的方式,多種治療劑以單一形式、統一形式或以多種形式提供(例如,作為單一丸劑或作為兩種單獨的丸劑)。
在一些實施方案中,治療雌激素受體依賴性或雌激素受體介導的病癥或疾病(諸如增殖性病癥,包括癌癥)的方法包括向哺乳動物給予式(A)、(B)、(C)或(D)的化合物或其藥用鹽以及至少一種額外治療劑。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與激素阻斷治療、化學療法、放射療法、手術、癌癥疫苗、生物療法或它們的組合組合給予。在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與肽、細胞因子、治療性病毒、治療性細菌、基因療法、siRNA、過繼性T細胞轉移、抗體、單克隆抗體或它們的組合組合給予。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與芳香酶抑制劑、磷酸肌醇3-激酶(PI3K)/mTOR途徑抑制劑、CDK 4/6抑制劑、HER-2抑制劑、EGFR抑制劑、PD-1抑制劑、聚ADP-核糖聚合酶(PARP)抑制劑、組蛋白脫乙酰酶(HDAC)抑制劑、HSP90抑制劑、VEGFR抑制劑、AKT抑制劑、化學療法或它們的任何組合組合給予。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與芳香酶抑制劑組合給予。在一些實施方案中,所述芳香酶抑制劑為阿那曲唑、來曲唑或依西美坦。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與CDK 4/6抑制劑組合給予。在一些實施方案中,所述CDK 4/6抑制劑為LEE011或LY283519。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與磷酸肌醇3-激酶(PI3K)/mTOR途徑抑制劑組合給予。在一些實施方案中,所述磷酸肌醇3-激酶(PI3K)/mTOR途徑抑制劑為依維莫司、坦西莫司、BEZ235、BYL719、GDC0032、BKM120、BGT226、GDC0068、GDC-0980、GDC0941、INK128(MLN0128)、INK1117、MK-2206、OSI-027、CC-223、AZD8055、SAR245408、SAR245409、PF04691502、WYE125132、GSK2126458、GSK-2636771、BAY806946、PF-05212384、SF1126、PX866、AMG319、ZSTK474、Cal101、PWT33597、CU-906或CUDC-907。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與組蛋白脫乙酰酶(HDAC)抑制劑組合給予。在一些實施方案中,所述HDAC抑制劑為恩替司他(entinostat)或莫西司他(mocetinostat)。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與HER-2抑制劑組合給予。在一些實施方案中,所述HER-2抑制劑為曲妥單抗、帕妥珠單抗或TDM-1。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與表皮生長因子受體(EGFR)抑制劑組合給予。在一些實施方案中,所述EGFR抑制劑為拉帕替尼、吉非替尼、厄洛替尼、西妥昔單抗(cetuximab)、卡奈替尼(canertinib)、帕尼單抗(panitumumab)、尼妥珠單抗(nimotuzumab)、OSI-632、凡德他尼(vandetanib)、阿法替尼(afatinib)、MP-412、AEE-788、來那替尼(neratinib)、XL-647、達克替尼(dacomitinib)、AZD-8931、CUDC-101、AP-26113或CO-1686。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與抗血管生成劑組合給予。在一些實施方案中,所述抗血管生成劑為VEGFR抑制劑。在一些實施方案中,所述抗血管生成劑抑制多種激酶(例如,為多激酶靶向劑)。在一些實施方案中,所述抗血管生成劑為貝伐單抗、ABR-215050(他喹莫德(tasquinimod))、CHIR-258(多韋替尼(dovitinib))、EXEL-7647、OSI-930、BIBF-1120、BAY-73-4506、BMS-582664(布立尼布(brivanib))、RO-4929097、JNJ-26483327、AZD-2171(西地尼布(cediranib))、索拉非尼(sorafenib)、阿柏西普(aflibercept)、恩扎妥林(enzastaurin)、AG-013736(阿西替尼(axitinib))、GSK-786034(帕唑帕尼(pazopanib))、AP-23573或舒尼替尼(sunitinib)。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與抗-PD-1劑組合給予。在一些實施方案中,所述抗-PD-1劑為MK-3475、納武單抗(Nivolumab)、MPDL3280A或MEDI4736。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與AKT抑制劑組合給予。在一些實施方案中,所述AKT抑制劑為GDC0068、MK-2206、AT7867、GSK2110183、GSK2141795或GSK690693。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與多柔比星、環磷酰胺、卡培他濱、長春瑞濱、紫杉醇、多西他賽和順鉑組合給予。
在一些實施方案中,與式(A)、(B)、(C)或(D)的化合物或其藥用鹽組合使用的額外治療劑包括一種或多種以下治療劑:阿比特龍(abiraterone);阿巴瑞克(abarelix);阿霉素(adriamycin);放線菌素(actinomycin);阿維菌素(acivicin);阿柔比星(aclarubicin);鹽酸阿考達唑(acodazole hydrochloride);阿克羅寧(acronine);阿多來新(adozelesin);阿地白介素(aldesleukin);阿侖單抗(alemtuzumab);別嘌呤醇(allopurinol);阿利維甲酸(alitretinoin);六甲蜜胺(altretamine);安波霉素(ambomycin);乙酸阿美蒽醌(ametantrone acetate);氨魯米特(aminoglutethimide);氨基乙酰丙酸(aminolevulinic acid);氨磷汀(amifostine);安吖啶(amsacrine);阿那曲唑(anastrozole);氨曲霉素(anthramycin);阿瑞吡坦(aprepitant);三氧化二砷(arsenic trioxide);天冬酰胺酶(asparaginase);曲林菌素(asperlin);阿扎胞苷(azacitidine);阿扎替派(azetepa);阿佐霉素(azotomycin);巴馬司他(batimastat);鹽酸苯達莫司汀(bendamustine hydrochloride);苯佐替哌(benzodepa);貝伐單抗(bevacizumab);貝沙羅汀(bexarotene);比卡魯胺(bicalutamide);鹽酸比生群(bisantrene hydrochloride);二甲磺酸雙奈法德(bisnafide dimesylate);比折來新(bizelesin);博來霉素(bleomycin);硫酸博來霉素(bleomycin sulfate);硼替佐米(bortezomib);布喹那鈉(brequinar sodium);溴匹立明(bropirimine);白消安(busulfan);放線霉素C(cactinomycin);卡蘆睪酮(calusterone);卡拉酰胺(caracemide);卡貝替姆(carbetimer);卡鉑(carboplatin);卡莫司汀(carmustine);鹽酸卡柔比星(carubicin hydrochloride);卡折來新(carzelesin);卡培他濱(capecitabine);西地芬戈(cedefingol);西妥昔單抗(cetuximab);苯丁酸氮芥(chlorambucil);西羅霉素(cirolemycin);順鉑(cisplatin);克拉屈濱(cladribine);氯法拉濱(clofarabine);甲磺酸克立那托(crisnatol mesylate);環磷酰胺(cyclophosphamide);阿糖胞苷(cytarabine);達卡巴嗪(dacarbazine);達沙替尼(dasatinib);鹽酸柔紅霉素(daunorubicin hydrochloride);更生霉素(dactinomycin);達貝泊汀α(darbepoetin alfa);地西他濱(decitabine);地加瑞克(degarelix);地尼白介素毒素連接物(denileukin diftitox);右奧馬鉑(dexormaplatin);鹽酸右雷佐生(dexrazoxane hydrochloride);地扎呱寧(dezaguanine);甲磺酸地扎呱寧(dezaguanine mesylate);地吖醌(diaziquone);多烯紫杉醇(docetaxel);多柔比星(doxorubicin);鹽酸多柔比星(doxorubicinhydrochloride);屈洛昔芬(droloxifene);枸櫞酸屈洛昔芬(droloxifene citrate);丙酸倍他米松(dromostanolone propionate);達佐霉素(duazomycin);依達曲沙(edatrexate);鹽酸依氟鳥氨酸(eflornithine hydrochloride);伊沙蘆星(elsamitrucin);艾曲波帕(eltrombopag olamine);恩洛鉑(enloplatin);恩普氨酯(enpromate);依匹哌啶(epipropidine);鹽酸表柔比星(epirubicinhydrochloride);阿法依泊汀(epoetin alfa);厄布洛唑(erbulozole);鹽酸厄洛替尼(erlotinib hydrochloride);鹽酸依索比星(esorubicin hydrochloride);雌莫司汀(estramustine);雌莫司汀磷酸鈉(estramustine phosphate sodium);依他硝唑(etanidazole);依托泊苷(etoposide);磷酸依托泊苷(etoposide phosphate);氯苯乙嘧胺(etoprine);依維莫司(everolimus);依西美坦(exemestane);GDC0032;鹽酸法倔佐(fadrozole hydrochloride);法扎拉濱(fazarabine);芬維甲胺(fenretinide);非格司亭(filgrastim);氟尿苷(floxuridine);磷酸氟達拉濱(fludarabine phosphate);氟尿嘧啶(fluorouracil);氟西他濱(flurocitabine);磷喹酮(fosquidone);福司曲星鈉(fostriecin sodium);氟維司群;吉非替尼(gefitinib);吉西他濱(gemcitabine);鹽酸吉西他濱(gemcitabine hydrochloride);吉西他濱-順鉑(gemcitabine-cisplatin);吉妥珠單抗奧佐米星(gemtuzumab ozogamicin);乙酸戈舍瑞林(goserelin acetate);乙酸組胺瑞林(histrelin acetate);羥基脲(hydroxyurea);鹽酸伊達比星(idarubicin hydrochloride);異環磷酰胺(ifosfamide);iimofosine;替伊莫單抗(ibritumomab tiuxetan);伊達比星(idarubicin);異環磷酰胺(ifosfamide);甲磺酸伊馬替尼(imatinib mesylate);咪喹莫特(imiquimod);白介素Il(包括重組白介素II或rlL2);干擾素α-2a;干擾素α-2b;干擾素α-n1;干擾素α-n3;干擾素β-l a;干擾素γ-lb;異丙鉑(iproplatin);鹽酸伊立替康(irinotecan hydrochloride);伊沙匹隆(ixabepilone);乙酸蘭瑞肽(lanreotide acetate);拉帕替尼(lapatinib);來那度胺(lenalidomide);來曲唑(letrozole);乙酸亮丙瑞林(leuprolide acetate);亞葉酸鈣(leucovorin calcium);乙酸亮丙瑞林(leuprolide acetate);左旋咪唑(levamisole);阿糖胞苷脂質體(liposomal cytarabine);鹽酸利阿唑(liarozole hydrochloride);洛美曲索鈉(lometrexol sodium);洛莫司汀(lomustine);鹽酸洛索蒽醌(losoxantrone hydrochloride);馬索羅酚(masoprocol);美登素(maytansine);鹽酸氮芥(mechlorethamine hydrochloride);(megestrol acetate);(melengestrol acetate);美法侖(melphalan);美諾立爾(menogaril);巰嘌呤(mercaptopurine);甲氨蝶呤(methotrexate);甲氨蝶呤鈉(methotrexate sodium);甲氧沙林(methoxsalen);氯苯氨啶(metoprine);美烏替派(meturedepa);米丁度胺(mitindomide);米托克星(mitocarcin);絲裂紅素(mitocromin);米托菌素(mitogillin);米托馬星(mitomalcin);絲裂霉素C(mitomycin C);米托司培(mitosper);米托坦(mitotane);鹽酸米托蒽醌(mitoxantrone hydrochloride);霉酚酸(mycophenolic acid);苯丙酸諾龍(nandrolone phenpropionate);奈拉濱(nelarabine);尼洛替尼(nilotinib);諾考達唑(nocodazoie);若莫單抗(nofetumomab);諾加霉素(nogalamycin);奧法木單抗(ofatumumab);奧普瑞白介素(oprelvekin);奧馬鉑(ormaplatin);奧沙利鉑(oxaliplatin);奧西舒侖(oxisuran);多西他賽(paclitaxel);帕利夫明(palifermin);鹽酸帕諾洛司瓊(palonosetron hydrochloride);帕米磷酸鹽(pamidronate);培非格司亭(pegfilgrastim);培美曲塞二鈉(pemetrexed disodium);噴司他丁(pentostatin);帕尼單抗(panitumumab);鹽酸帕唑帕尼(pazopanib hydrochloride);培美曲塞二鈉(pemetrexed disodium);普樂沙福(plerixafor);普拉曲沙(pralatrexate);培加帕酶(pegaspargase);佩里霉素(peliomycin);戊氮芥(pentamustine);硫酸培洛霉素(peplomycin sulfate);過磷酰胺(perfosfamide);哌泊溴烷(pipobroman);哌泊舒凡(piposulfan);鹽酸吡羅蒽醌(piroxantrone hydrochloride);光神霉素(plicamycin);普洛美坦(plomestane);卟吩姆鈉(porfimer sodium);紫菜霉素(porfiromycin);潑尼莫司汀(prednimustine);鹽酸丙卡巴肼(procarbazine hydrochloride);嘌呤霉素(puromycin);鹽酸嘌呤霉素(puromycin hydrochloride);吡唑呋喃菌素(pyrazofurin);奎納克林(quinacrine);鹽酸雷洛昔芬(raloxifene hydrochloride);拉布立酶(rasburicase);重組HPV二價疫苗;重組HPV四價疫苗;利波腺苷(riboprine);洛太米特(rogletimide);利妥昔單抗(rituximab);羅米地辛(romidepsin);羅米司亭(romiplostim);沙芬戈(safingol);鹽酸沙芬戈(safingol hydrochloride);沙莫司亭(sargramostim);司莫司汀(semustine);辛曲秦(simtrazene);sipuleucel-T;索拉非尼(sorafenib);磷乙酰天冬氨酸鈉(sparfosate sodium);司帕索霉素(sparsomycin);鹽酸螺鍺(spirogermanium hydrochloride);螺莫司汀(spiromustine);螺鉑(spiroplatin);鏈黑菌素(streptonigrin);鏈佐星(streptozocin);磺氯苯脲(sulofenur);蘋果酸舒尼替尼(sunitinib malate);他利霉素(talisomycin);他莫昔芬;枸櫞酸他莫昔芬;替可加蘭鈉(tecogalan sodium);替加氟(tegafur);鹽酸替洛蒽醌(teloxantrone hydrochloride);替莫唑胺(temozolomide);替莫卟吩(temoporfin);坦西莫司(temsirolimus);替尼泊苷(teniposide);替羅昔隆(teroxirone);睪內酯(testolactone);沙利度胺(thalidomide);硫咪嘌呤(thiamiprine);硫鳥嘌呤(thioguanine);塞替派(thiotepa);噻唑扶林(tiazofurin);替拉扎明(tirapazamine);鹽酸托泊替康(topotecan hydrochloride);托瑞米芬(toremifene);托西莫單抗(tositumomab)和I131碘托西莫單抗;曲妥單抗(trastuzumab);乙酸曲托龍(trestolone acetate);維甲酸(tretinoin);磷酸曲西立濱(triciribine phosphate);三甲曲沙(trimetrexate);葡糖醛酸三甲曲沙(trimetrexate glucuronate);曲普瑞林(triptorelin);鹽酸妥布氯唑(tubulozole hydrochloride);尿嘧啶氮芥(uracil mustard);烏瑞替派(uredepa);戊柔比星(valrubicin);伐普肽(vapreotide);維替泊芬(verteporfin);長春堿(vinblastine);硫酸長春堿(vinblastine sulfate);硫酸長春新堿(vincristine sulfate);長春地辛(vindesine);硫酸長春地辛(vindesine sulfate);硫酸長春匹定(vinepidine sulfate);硫酸長春甘酯(vinglycinate sulfate);硫酸環氧長春堿(vinleurosine sulfate);酒石酸長春瑞濱(vinorelbine tartrate);硫酸異長春堿(vinrosidine sulfate);硫酸長春利定(vinzolidine sulfate);伏立諾地(vorinostat);伏氯唑(vorozole);折尼鉑(zeniplatin);凈司他丁(zinostatin);唑來膦酸(zoledronic acid);和鹽酸佐柔比星(zorubicin hydrochloride)。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與止吐劑組合使用以治療由使用式(A)、(B)、(C)或(D)的化合物、抗癌劑和/或放射療法引起的惡心或嘔吐。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與用于治療貧血和中性粒細胞減少的藥物組合使用。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與皮質類固醇給予。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與鎮痛藥共同給予。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與放射療法(或放療)組合使用。放射療法是用電離放射治療癌癥和其它疾病。任選地使用放射療法治療局部實體瘤,諸如皮膚、舌、喉、腦、乳腺、前列腺、結腸、子宮和/或子宮頸的癌癥。它還任選地用于治療白血病和淋巴瘤(分別為造血細胞和淋巴系統的癌癥)。
用于向癌細胞遞送放射的技術是將放射性植入物直接放置在腫瘤或體腔中。這稱為內部放射療法(近距離放射療法、間質輻照和腔內輻照是內部放射療法的類型)。使用內部放射療法、放射劑量集中在小區域,并且患者住院若干天。內部放射療法經常用于舌、子宮、前列腺、結腸和子宮頸的癌癥。術語“放射療法”或“電離放射”包括所有形式的放射,包括但不限于α、β和γ放射和紫外光。
在一些實施方案中,式(A)、(B)、(C)或(D)的化合物或其藥用鹽與至少一種額外用于乳腺癌的治療選擇組合用于治療乳腺癌。在一些實施方案中,所述額外治療選擇包括乳腺癌手術。在一些實施方案中,乳腺癌手術包括乳房切除術(lumpectomy)、乳頭切除術(mastectomy)、前哨淋巴結活檢(sentinel node biopsy)或腋窩淋巴結切除術(axillary node dissection)。在一些實施方案中,所述額外治療選擇包括放射療法。在一些實施方案中,放射包括外部束放射或近距離放射療法。在一些實施方案中,所述額外治療選項包括激素療法(即激素阻斷療法)。在一些實施方案中,激素療法包括使用選擇性雌激素受體調節劑(例如他莫昔芬)、芳香酶抑制劑或氟維司群。在一些實施方案中,所述額外治療選擇包括去除卵巢的手術或使卵巢終止產生雌激素的藥物。在一些實施方案中,所述額外治療選擇包括使用曲妥單抗、拉帕替尼或貝伐單抗。在一些實施方案中,所述額外治療選擇包括使用預防乳腺癌復發(例如唑來膦酸(Reclast,Zometa))的骨形成藥物。
試劑盒/制品
為了用于本申請所述的診斷和治療應用,本申請還描述了試劑盒和制品。這樣的試劑盒可包括被分隔以接收一個或多個容器諸如小瓶、管等的載體、包裝或容器,每個容器包括在本申請所述方法中使用的單獨元件之一。合適的容器包括例如瓶、小瓶、注射器和試管。容器由任何可接受的材料形成,包括例如玻璃或塑料。
在一些實施方案中,本申請提供的試劑盒用于在受試者中檢測編碼突變型ER-α多肽的核酸或用于檢測受試者中的突變型ER-α多肽(即診斷試劑盒)。在一些實施方案中,所述試劑盒用于選擇用式(A)、(B)、(C)或(D)的雌激素受體調節劑化合物治療的患者,用于鑒定對激素療法具有抗性或可能變得具有抗性的受試者,用于監測對激素療法的抗性的發展,或它們的組合。本申請提供的試劑盒含有一種或多種試劑,其用于檢測編碼突變型ER-α多肽的核酸,用于檢測突變型ER-α多肽,用于檢測來自受試者的細胞中ER活性,或它們的組合。示例性試劑包括但不限于緩沖液、PCR試劑、抗體、用于酶染色的底物、發色團或其它材料,諸如載玻片、容器、微量滴定板,以及任選地用于進行所述方法的說明書。本領域技術人員將認識到許多其它可能的可用于接觸各種材料的容器和板及試劑。試劑盒還可含有對照樣品,例如核酸或蛋白質,諸如本申請提供的突變型ER-α多肽或編碼本申請提供的突變型ER-α多肽的核酸。在一些實施方案中,試劑盒含有一組或多組用于檢測內源性ER基因表達的寡核苷酸引物。
在一些實施方案中,所述容器可包含一種或多種式(A)、(B)、(C)或(D)的雌激素受體調節劑化合物,任選地在組合物中或與本申請公開的另一種藥物組合。所述容器任選地具有無菌入口(例如,所述容器可為靜脈內溶液袋或具有可被皮下注射針頭刺穿的塞子的小瓶)。這樣的試劑盒任選地包含具有與其在本申請所述方法中的用途相關的識別描述或標記或說明書的化合物。
試劑盒通常包含一個或多個額外的容器,每個容器具有從商業和用戶角度考慮使用本申請所述的化合物所需的各種材料(諸如試劑,任選地呈濃縮形式和/或裝置)中的一種或多種。這種材料的非限制性實例包括但不限于緩沖液、稀釋劑、過濾器、針、注射器;列出內容和/或使用說明的載體、包裝、容器,小瓶和/或管標簽,以及具有使用說明的包裝插頁。通常還將包括一組說明書。
標簽可在容器上或與容器相關聯。當形成標簽的字母、數字或其它字符附接、模制或蝕刻到容器本身時,標簽可在容器上;當容器存在于同樣托住容器的容器(receptacle)或載體內時,標簽可與容器相關聯,例如作為包裝插頁。標記可用于指示內容物將用于特定的治療應用。標簽還可用于指示使用內容物的指導,諸如在本申請所述的方法中。
本申請提供了制品,其包括包裝材料、在包裝材料內的式(A)、(B)、(C)或(D)的雌激素受體調節劑化合物以及標簽,所述標簽指示化合物或組合物或其藥用鹽、互變異構體、藥用N-氧化物、藥學活性代謝物、藥用前藥或藥用溶劑化物,所述制品用于降低、減少或消除活化的雌激素受體的作用,或用于治療、預防或改善一種或多種將受益于雌激素受體活性降低或消除的疾病或病癥的癥狀。
實施例
提供這些實施例僅用于說明目的而非限制本申請提供的權利要求的范圍。
實施例1:MCF-7 3x ERE熒光素酶轉錄報道蛋白測定
在本實施例中,在MCF7乳腺癌細胞中,使用3x ERE-熒光素酶報道蛋白針對ER調節劑雌二醇、4-OH他莫昔芬、氟維司群和一組化合物,評估了對選擇的突變型雌激素受體和刺激的野生型雌激素受體活性的組成性轉錄活性的抑制的最大相對IC50。在該測定中使用的條件下,野生型和所有突變型雌激素受體展現可通過ER配體調節的可測量的組成性、序列依賴性和雌二醇非依賴性基礎活性。因此,所有數據都是在不存在雌二醇的情況下相對于野生型雌激素受體而言。
將MCF7細胞保持在補充有10%FCS的RPMI 1640中。轉錄測定通過如下進行:將100μL細胞以250,000個細胞/mL的密度接種到補充有10%活性炭處理的(charcoal stripped)血清的RPMI 1640的96孔細胞培養板中,并使其附著過夜。使用Lipofectin(Life Technologies)根據制造商的方案瞬時轉染細胞。使用150ng 3X ERE-TK-Luc(報道蛋白載體)、30ng CMVpRL(標準化載體)和300ng pCDNA ERα(或ERα突變體)進行一式三份轉染。將轉染的細胞孵育過夜,然后用配體處理。將化合物連續稀釋,向細胞中添加50μL化合物+補充有活性炭處理的血清的RPMI 1640。孵育24小時后,除去培養基,將細胞在40μL裂解緩沖液(25mM Tris磷酸鹽、2mM CDTA、10%甘油、0.5%Triton X-100、2mM DTT)中裂解。在添加40μL熒光素酶緩沖液(20mM Tricine、0.1mM EDTA、1.07mM(MgCO3)4Mg(OH)2·5H2O、2.67mM MgSO4、33.3mM DTT、270μM輔酶A、470μM熒光素酶、530μM ATP)后立即測量螢火蟲熒光素酶(firefly luciferase)活性。在添加40μL腔腸素(coelenterazine)緩沖液(1.1M NaCl、2.2mM Na2EDTA、0.22M KxPO4(pH 5.1)、0.44mg/mL BSA、1.3mM NaN3、1.43μM腔腸素,最終pH調節至5.0)后測量花蟲型熒光素酶(Renilla luciferase)。每種化合物的最大相對激動劑活性源自代表每個突變體受體的最大響應(劑量響應曲線的底部)的劑量響應曲線上的點,如以下圖表所示:RLU樣品/RLU wtER-αDMSO×100=相對活性。每種化合物的相對IC50如下確定:IC50ER-α突變體/IC50wt ER-α。
本申請公開的代表性化合物的示例性轉錄數據示于表5:
表5
:‘+’:>10nM;‘++’:1–10nM;‘+++’:<1nM
實施例2:ERM化合物1-3在具有局部晚期或轉移性ER+乳腺癌和局部確認的ESR1突變的絕經后婦女中的臨床試驗
這是一個開放標簽的臨床試驗,評價ERM化合物1-3、(E)-3-(4-((E)-2-(2-氯-4-氟苯基)-1-(1H-吲唑-5-基)丁-1-烯-1-基)苯基)丙烯酸或其藥用鹽在患有具有確認的ESR1突變的局部晚期或轉移性ER+(HER2-)乳腺癌的絕經后婦女中的療效和安全性。
目的:為了在局部晚期或轉移性ER+(HER2-)乳腺癌和確認的ESR1突變的絕經后婦女中評價ERM化合物1-3,即(E)-3-(4-((E)-2-(2-氯-4-氟苯基)-1-(1H-吲唑-5-基)丁-1-烯-1-基)苯基)丙烯酸或其藥用鹽的藥物動力學(PK)、安全性和耐受性并評估它們的抗腫瘤活性的初步證據。額外目的包括:用[18F]-氟雌二醇(FES)正電子發射斷層掃描(PET)[FES PET]進行藥效學(PD)響應的生物標志物的探索性評價;進行ER靶基因表達的探索性評價;在單次或多次劑量治療(例如Cmax、Tmax、AUC、T1/2)后,進行對(E)-3-(4-((E)-2-(2-氯-4-氟苯基)-1-(1H-吲唑-5-基)丁-1-烯-1-基)苯基)丙烯酸或其藥用鹽的抗性機制的探索性評價。
試驗設計:對本研究中的婦女給予推薦的第2階段劑量的(E)-3-(4-((E)-2-(2-氯-4-氟苯基)-1-(1H-吲唑-5-基)丁-1-烯-1-基)苯基)丙烯酸或其藥用鹽,或指定逐漸升高劑量的(E)-3-(4-((E)-2-(2-氯-4-氟苯基)-1-(1H-吲唑-5-基)丁-1-烯-1-基)苯基)丙烯酸或其藥用鹽,其中起始劑量為約400mg/天的(E)-3-(4-((E)-2-(2-氯-4-氟苯基)-1-(1H-吲唑-5-基)丁-1-烯-1-基)苯基)丙烯酸或其藥用鹽,接著此后以約200mg增量進行劑量遞增。在用芳香酶抑制劑治療之后,患者應具有可測量的疾病進展以及確認的ESR1突變。
所有患者將被治療直到疾病進展、不可接受的毒性或患者撤回同意。
患者選擇
納入標準:
1.具有以下證據的組織學或細胞學證明的乳腺腺癌的診斷:不適合具有治療意圖的切除或放射療法的局部復發性疾病,或轉移性疾病,兩者在ER+乳腺癌的激素療法至少6個月后進展
2.ER陽性腫瘤(通過免疫組織化學[IHC]按照實驗室測試在≥1%細胞中染色)
3.按照當地實驗室測試,HER2陰性乳腺癌(對于細胞膜蛋白表達的IHC結果為0或+1,或對于不含有內部對照探針的系統,顯示HER2/CEP17比例<1.8的FISH結果或每個細胞核平均少于4個HER2基因拷貝)
4.根據RECIST v1.1可評估的疾病進一步定義如下:
可測量的疾病或可評估的骨病,即,在沒有可測量的損害的情況下裂解或混合(裂解+硬化)的骨損害。注意:先前輻照的損害被認為是可測量的,只有在放射完成后當場記錄進展。具有不可測量的、不可評估的損害(諸如胸腔積液)的患者不適合于試驗的劑量擴大部分
5.根據實驗室測試的ESR1突變。用芳香酶抑制劑治療后的疾病進展。
6.從使用他莫昔芬已經經過至少2個月
7.從使用任何其它抗癌激素療法已經經過至少2個月
8.從使用化學療法已經經過至少3周
9.女性,18歲或更年長
10.絕經后狀態定義如下:
先前的雙側外科卵巢切除術
年齡≥56歲:自上次月經后≥1年的自然性閉經
年齡<56歲,自上次月經后閉經≥1年且血清雌二醇水平(<20pg/mL)和FSH水平(>40mIU/mL)在絕經后范圍內
年齡<56歲,其經歷子宮切除術,其中一個或兩個卵巢留在原位,或具有他莫昔芬誘導的閉經以及他莫昔芬停用≥1年且血清雌二醇水平(<20pg/mL)和FSH水平(>40mIU/mL)在絕經后范圍內
11.東部腫瘤協作組(Eastern Cooperative Oncology Group,ECOG)體力狀態≤2(對于A組)或≤1(對于B1組和B2組)。
12.先前療法或外科手術的所有急性毒性作用相對于基線的分辨率或等級≤1級(除非脫發或其它毒性不被認為是針對患者的安全性風險)
13.適當的器官功能如以下標準所定義:
絕對中性粒細胞計數(ANC)≥1500/μL
血小板≥100,000/μL
血清天冬氨酸轉氨酶(AST)和血清丙氨酸轉氨酶(ALT)≤3x正常上限(ULN),或如果肝功能異常是由于潛在的惡性腫瘤,則AST和ALT≤5xULN
總血清膽紅素≤1.5x ULN,不考慮繼發于腫瘤肝轉移。允許納入具有由于吉爾伯特綜合征而增加的血清間接膽紅素(≤3x ULN)的患者
血清肌酐≤1.5x ULN
QTc≤460毫秒
14.簽署并注明日期的知情同意文件,表明該受試者(或法律上可接受的代表)在入選前已被告知試驗的所有相關方面
15.遵守定期訪問、治療計劃、實驗室測試和其它試驗操作的意愿和能力
排除標準:
1.未治療或有癥狀的CNS轉移。注意:如果長期使用皮質類固醇在招錄前4周內已經中止,則允許在招錄前12周內具有放射學穩定的治療和無癥狀CNS轉移的患者
2.子宮內膜病癥
3.在晚期/轉移性環境中大于1的先前化學療法。
4.使用針對晚期疾病的任何系統性抗癌療法的當前治療或對另一臨床試驗的任何系統性實驗性治療
5.在招錄前2年內診斷任何繼發性惡性腫瘤,除了充分治療的基底細胞或鱗狀細胞皮膚癌或原位癌之外
6.在招錄前12個月內具有任何以下情況:心肌梗塞、嚴重/不穩定型心絞痛、≥2級的持續性心律失常、任何等級的心房纖維顫動、冠狀動脈/外周動脈旁路移植術、有癥狀的充血性心力衰竭,或腦血管意外(包括短暫性缺血發作)
7.活動性炎性腸病或慢性腹瀉、短腸綜合征或上胃腸外科手術(包括胃切除術)
8.已知的人類免疫缺陷病毒感染
9.招錄前4周內進行大手術或放射療法
10.其它嚴重急性或慢性醫學或精神病癥或實驗室異常,其可能增加與研究參與或研究產品管理相關的風險,或可能干擾研究結果的解釋,并且在研究者的判斷中,將使受試者不適合進入這項研究
腫瘤評估:將進行疾病評估。成像研究將包括胸部、腹部和骨盆的CT掃描,以及骨掃描。目標腫瘤響應或疾病進展的放射學確認將基于RECIST v1.1(Eisenhauer,2009)。對于在骨掃描上檢測到的新的骨損害,將需要第二成像模式(例如,CT或MRI)以確認進展。
在篩選和隨訪期間應使用相同的評估方法和相同的技術。當沒有醫學禁忌時,需要靜脈內(IV)造影(contrast)。對IV造影具有禁忌癥的患者可進行腹部和骨盆的MRI檢查來代替CT和胸部的非造影CT。通過正電子發射斷層掃描(PET)掃描或通過超聲的腫瘤評估可能不能代替CT。
相關研究
用18FES-PET靶標結合(Target Engagement)的藥效學:使用[18F]-氟雌二醇(FES)正電子發射斷層掃描(PET)進行成像以定量腫瘤中的ER表達,并評估對用(E)-3-(4-((E)-2-(2-氯-4-氟苯基)-1-(1H-吲唑-5-基)丁-1-烯-1-基)苯基)丙烯酸或其藥用鹽的療法的藥效學響應。雖然FES攝取可在患者之間變化,但是一般來說,在給定時間點的損害處的FES攝取是相當一致的,并且平均攝取提供了個體患者的ER表達的合理概括。將影響標準攝取值(SUV)的因素,諸如性激素結合球蛋白(SHBG),根據標準方案(Peterson,2011)進行調整。此外,由于每種藥物的半衰期長及它們可能干擾FES攝取,對于先前用他莫昔芬(至少2個月)或氟維司群(至少6個月)治療的患者可能需要清除期。FES-PET研究將作為混合PET/CT成像用于衰減校正和損害定位。
組織芯活檢(Core Biopsies):收集治療前和治療后的腫瘤活檢(軟組織或內臟損害),以評估:
-腫瘤組織學;腫瘤vs基質,vs纖維組織
-通過免疫組織化學與免疫熒光評估ERα和PR蛋白水平
-增殖指數(Ki67)
-ER靶基因調節:可監測的ER靶基因的實例包括但不限于:AGR2、AREG、C3、CCND1、CXCL12、ERBB2、GREB1、IL6、IRS1、PDZK1、PGR、SEMA3B、TFF1、TFF2、TFF3、TOP2A、WISP2。
循環腫瘤DNA(ctDNA):在所有患者中,在劑量遞增和劑量擴展期間,在篩選、治療和在研究終止時收集額外血液樣品用于分析循環腫瘤DNA(ctDNA)。
最近的臨床前和臨床數據表明ER-α和磷脂酰肌醇-4,5-二磷酸3-激酶催化的亞基α(PIK3CA)的突變與內分泌抗性乳腺癌相關。為了深入了解(E)-3-(4-((E)-2-(2-氯-4-氟苯基)-1-(1H-吲唑-5-基)丁-1-烯-1-基)苯基)丙烯酸或其藥用鹽和抗性機制之間潛在的因果關系,將會使用高級DNA分析技術在分離自血漿的ctDNA中監測這些基因的突變狀態:諸如敏感性、基于乳化PCR的BEAMing(Beads,Emulsions,Amplification,and Magnetics)方法(Dressman,2003)或下一代測序。
實施例3:ERM化合物1-3(ARN-810)對臨床相對ESR1突變的活性
本研究的目的是評估表1中的ERM 1-3即(E)-3-(4-((E)-2-(2-氯-4-氟苯基)-1-(1H-吲唑-5-基)丁-1-烯-1-基)苯基)丙烯酸對臨床相關雌激素受體突變的功效,已提出該突變賦予對抗激素療法諸如芳香酶抑制劑的抗性。在穩定表達ER-α突變體的MCF-7細胞的ER依賴性轉錄報道蛋白測定和活力測定中體外測量ERM 1-3的效力和功效。將ERM 1-3活性與臨床相關的ER-α靶向乳腺癌治療劑4-羥基他莫昔芬(他莫昔芬的活性代謝產物)和氟維司群比較。在基于細胞的轉錄報道蛋白測定中,ERM 1-3抑制所有ER-α突變(E380Q、L536R、L536P、Y537C、Y537N、Y537S和D538G)的活性,測試具有納摩爾濃度效力,并且功效接近或大于針對野生型受體所觀察到的。在穩定表達ER-α突變體的MCF-7細胞中,ERM 1-3使活細胞的數目減少44%-78%(在5天增殖性測定中與DMSO對照相比),這取決于突變和測定格式。在報道蛋白和增殖性測定兩者中,在ESR1突變組中,與野生型ER-α相比,ERM 1-3展現0.8至210倍降低的效力。然而,與轉錄報道蛋白測定相比,在活力測定中ERM 1-3通常比穩定表達野生型ER-α的細胞展現出降低的效能。
化合物和制劑:
如WO 2012/037410實施例36和WO 2012/037411實施例50中所述制備ERM 1-3。藥品樣品具有>95%純度(純度評估:核磁共振/液相色譜-質譜)且為灰白色粉末。采用該分子的鈉鹽或N-甲基-D-葡糖胺鹽形式。ARN-810以10mM溶于DMSO中的儲備溶液形式提供,其在-20℃儲存。
氟維司群(中性形式)購自Waterstone Technology(WS10032)并以10mM的終濃度再混懸于無水DMSO中,然后分配成等分試樣并在-80℃儲存。
4-羥基他莫昔芬購自Sigma Aldrich,以10mM的終濃度再混懸于無水DMSO中,然后分配成等分試樣并在-80℃儲存。
MCF-7細胞可獲自ATCC( HTB-22TM)。在培養中一次傳代后,將細胞擴增并儲存在液氮中。將一小瓶冷凍細胞解凍,并每兩個月進行培養,然后每周兩次分開。將解凍的細胞培養兩周以允許在任何測定中使用之前從冷凍過程中恢復。在本報告中詳述的測定中使用的細胞經歷了從初始解凍起5至22次傳代。
細胞培養生長介質
CorningTM cellgroTM RPMI 1640(Corning,Catalog No.15-040)
CorningTM cellgroTM RPMI 1640,不含酚紅(Corning,Catalog No.17-105)
Thermo ScientificTM HyCloneTM胎牛血清(U.S.),具有特征的-(FBS)(Thermo Scientific Catalog No.SH3007103)
Thermo ScientificTM HyCloneTM胎牛血清(U.S.),經炭/葡聚糖處理的-(Thermo Scientific,Catalog No.SH3006803)
其它試劑
試劑(Promega,Catalog No.G7572)
帶蓋、平底、低法蘭、經組織培養處理的、無菌、白色聚苯乙烯384孔測定板(Corning,Catalog No.3570)
無水二甲基亞砜(Sigma Aldrich,Catalog No.276855-100mL)
Matrix 12通道電子移液器,0.5-12.5μL,2-125μL,和Matrix 8通道電子移液器,15-1250μL
96-孔經TC-處理的無菌聚苯乙烯板(Corning Inc.,Catalog Nos.3903,3904或3917)
Lipofectin(Invitrogen,Catalog No.18292037)
D-熒光素鉀鹽(Gold Biotechnology,Catalog No.LUCK-500)
Perkin Elmer EnVision 2103TM多標簽閱讀器
Molecular Devices AnalystTM GT多模式閱讀器
Reichert 改良的Neubauer血細胞計數板(Hausser Scientific,Catalog No.1490)
統計學分析:以GraphPad 軟件使用log(抑制劑)對響應可變斜率(四參數)曲線擬合,使用GraphPad Prism Version 6.01和Microsoft Office Excel(2010)產生曲線擬合及IC50和Emax值。
實施例4:ER-α轉錄報道蛋白測定
將MCF7細胞保持在補充有10%FCS的RPMI 1640中。轉錄測定通過如下進行:將100μL細胞以250,000個細胞/mL的密度接種到補充有10%活性炭處理的血清的RPMI 1640的96孔細胞培養板中,并使其附著過夜。使用Lipofectin(Life Technologies)根據制造商的方案瞬時轉染細胞。使用180ng 3X ERE-TK-Luc(報道蛋白載體)、30ng pRL-CMV(標準化載體)和270ng pCDNA ERα(或ERα突變體)進行一式三份轉染。將轉染的細胞孵育過夜,然后用配體處理。針對ER激動劑測定,將化合物連續稀釋,向細胞中添加50μL化合物及補充有活性炭處理的血清的RPMI 1640。
對于ER拮抗劑測定,將化合物連續稀釋并向細胞中添加于補充有活性炭處理的血清的RPMI 1640中的50μL化合物及3nM 17β-雌二醇。孵育24小時后,除去培養基,將細胞在40μL裂解緩沖液(25mM Tris磷酸鹽、2mM CDTA、10%甘油、0.5%Triton X-100、2mM DTT)中裂解。
在添加40μL熒光素酶緩沖液(20mM Tricine、0.1mM EDTA、1.07mM(MgCO3)4Mg(OH)2·5H2O、2.67mM MgSO4、33.3mM DTT、270μM輔酶A、470μM熒光素、530μM ATP)后立即測量螢火蟲熒光素酶活性。在添加40μL腔腸素緩沖液(1.1M NaCl、2.2mM Na2EDTA、0.22M KxPO4(pH 5.1)、0.44mg/mL BSA、1.3mM NaN3、1.43μM腔腸素,最終pH調節至5.0)后測量花蟲型熒光素酶。每種化合物的最大相對激動劑活性源自代表每個突變體受體的劑量響應曲線的底部,如以下所示:RLU樣品/RLU wtER-αDMSO=相對活性。
MCF-7突變型ER-α穩定細胞系產生:通過將包含氨基末端血凝素標簽的ESR1野生型和突變型cDNA亞克隆到pCDH-EF1-MCS-(PGK-Puro)(稱為EF1HA-ER-α)和pCDH-UbC-MCS-EF1-Hygro(稱為UbC HA-ER-α)中,產生穩定表達野生型或ER-α突變體的MCF-7細胞。除了空載體陰性對照外,隨后根據制造商的方案用pPACKH1包裝質粒混合物(System Biosciences)將所得質粒共轉染到HEK293T細胞中。轉染后4天,從細胞培養基純化慢病毒顆粒,分層并儲存在-80℃。用純化的病毒顆粒轉導MCF-7細胞,并通過在含有10%FBS及分別用于pCDH-EF1-MCS-(PGK-Puro)和pCDH-UbC-MCS-EF1-Hygro的1μG/mL嘌呤霉素或200μG/mL潮霉素的RPMI中生長來選擇穩定的細胞系。選擇后,使用6E2小鼠單克隆HA抗體(Cell Signaling)通過蛋白免疫印跡法(western blot)證實野生型和突變型ER-α的表達。
MCF-7穩定細胞系存活率:在含有10%CSS及NEAA和丙酮酸鈉的不含苯酚的RPMI中,使用濃度調節至40,000個細胞/mL的血細胞計數器對MCF-7細胞計數。使用Matrix 16通道電子移液器將16微升細胞混懸液添加至384孔經組織培養處理的白色透明底聚苯乙烯板(Corning)的每個孔中。將細胞孵育過夜以允許細胞粘附。第二日,使用Matrix 16通道電子移液器將16微升含有10%CSS及NEAA和丙酮酸鈉的不含苯酚的RPMI添加至一個板的孔中,然后添加16μL CellTiter-Glo(Promega,Madison WI)發光細胞存活力試劑(luminescent cell viability reagent)。在室溫孵育20分鐘后,在Perkin Elmer Envision 2103多標簽閱讀器上測量發光,其中發光測量高度設定為6.5mm,且最大積分時間為1秒。孔的相對發光單位(RLU)的“平均值”被認為是時間=零時的基線值。此外,使用Matrix 12通道電子移液器在DMSO(Sigma-Aldrich)中進行10點、1:5連續稀釋(包括僅作為陽性對照的DMSO)。然后將4μL的各稀釋液添加至196μL含有10%CSS及NEAA和丙酮酸鈉的RPMI中。將16μL含有化合物的培養基以10μM至5pM的終濃度添加至細胞中。使用Matrix 12通道電子移液器在培養基中稀釋化合物并隨后添加至細胞中。化合物暴露5天后,使用Matrix 16通道電子移液器向細胞中添加16μL CellTiter-Glo(Promega,Madison WI)發光細胞存活力試劑。使用添加至32μL無細胞培養基中的CellTiter-Glo獲得背景值。在Perkin Elmer Envision 2103多標簽閱讀器上測量發光,其中發光測量高度設定為0mm,且最大積分時間為0.1秒。測量每個孔的相對發光單位(RLU),并如下確定每個樣品的相對增殖(倍數):(RLU樣品-RLU背景)/(T=0時的RLU)=相對增殖
實施例5化合物1-3(ARN-810)和ER轉錄報道蛋白測定
在瞬時表達野生型ER-α或ER-α突變體的MCF-7乳腺癌細胞中評價化合物1-3(ARN-810)、4-羥基他莫昔芬和氟維司群對臨床相關ESR1突變(E380Q、L536R、L536P、Y537C、Y537N、Y537S和D538G)的轉錄活性的作用。用ER應答轉錄報道蛋白及野生型或突變型ER-α表達質粒瞬時轉染MCF-7細胞,并用范圍為0.1pM至10μM的ARN-810、4-羥基他莫昔芬或氟維司群或范圍為0.1pM至1μM的17β-雌二醇處理。為了評估化合物的潛在激動劑活性,在不存在雌二醇的情況下處理細胞。在1nM雌二醇存在的情況下進行拮抗劑測定。如表6所示,在不存在雌二醇的情況下,所有分析的臨床突變表現出可檢測的配體非依賴性活性,其被ARN-810、4-羥基他莫昔芬和氟維司群抑制達到接近野生型的水平。所有拮抗劑對測試的突變保持納摩爾濃度效力(表7)。然而,除了少數例外(4-羥基他莫昔芬對E380Q和L536P的活性),在激動劑模式中,與野生型ER-α相比,所有拮抗劑表現出對突變型受體的效力的適度降低(1.1至61倍),其中對于在ARN-810對Y537S突變中觀察到最大61倍的降低。當在拮抗劑模式轉錄測定中分析ESR1突變(L536R、Y537C、Y537N、Y537S和D538G)的亞組時,觀察到對功效的類似效應。然而,在雌二醇存在的情況下,用ARN-810觀察到的效力變化不太明顯。具體來說,在臨床相關突變ARN-810上,IC50改變0.8至1.7倍,并且最大功效接近在野生型受體上觀察到的功效(表8和9)。
表6 ARN-810抑制臨床相關ER-α突變的轉錄活性(激動劑模式,-E2)
Emax是相對于媒介物處理的野生型ER-α而言的最大刺激活性。還展示了與媒介物相比的抑制百分比(%)。
數據是從n次獨立實驗得到的平均值和標準偏差。
表7 ARN-810為臨床相關ER-α突變的轉錄拮抗劑(激動劑模式,-E2)
數據是從n次獨立實驗得到的平均值和標準偏差。
表8 ARN-810拮抗臨床相關ER-α突變的轉錄活性(拮抗劑模式,+E2)
Emax是相對于媒介物處理的野生型ER-α而言的最大刺激活性。還展示了與媒介物相比的抑制百分比(%)。
數據是從n次獨立實驗得到的平均值和標準偏差。
表9 ARN-810為臨床相關ER-α突變的轉錄拮抗劑(拮抗劑模式,+E2)
數據是從n次獨立實驗得到的平均值和標準偏差。
存活力測定:為了評估ARN-810拮抗患者中鑒定的組成型活性ER-α突變的配體非依賴性增殖活性的能力,產生穩定表達野生型、E380Q、L536P、L536R、Y537N、Y537S、Y537C和D538G氨基末端血凝素標簽的ER-α(HA-ER-α)的MCF-7細胞系。因為ER-α過表達可誘導配體非依賴性生長并且還可使配體介導的降解途徑飽和,所以利用UbC和EF1啟動子驅動ER-α表達,針對每個受體產生獨立的穩定細胞系(Li S,,et al.Cell Rep(2013);4(6):1116-1130;Wardell SE,et al.Biochem Pharmacol(2011);82(2):122-130)。UbC啟動子由制造商(System Biosciences)報道以表達低至中等RNA水平,而EF1啟動子表達高水平(System Biosciences)。如通過定量蛋白免疫印跡分析所確定,基于UbC的細胞系以小于10%內源性ER-α的水平表達HA-ER-α蛋白。在另一方面,基于EF1啟動子的細胞系以比內源性蛋白高2至6倍的水平表達HA-ER-α和突變體。
與其在轉錄報道蛋白測定中的活性一致,臨床鑒定的ER-α突變體在MCF-7細胞中通過UbC或EF1啟動子的表達賦予細胞在不存在17β-雌二醇的情況下增殖的能力(表10和14)。然而,使用EF1啟動子獲得的高水平的野生型ER-α表達(約為內源性蛋白水平的2-3倍)也足以促進配體非依賴性生長。
在基于UbC啟動子的細胞系中,化合物1-3(ARN-810)、4-羥基他莫昔芬和氟維司群以激動劑和拮抗劑模式兩者拮抗穩定表達野生型、E380Q、L536P、L536R、Y537N、Y537S、Y537C和D538G HA-ER-α的細胞系的增殖(表10和12)。氟維司群和ARN-810表現出相似的功效(對于激動劑和拮抗劑模式分別為47%至67%和71%至78%抑制),而4-羥基他莫西芬在所測試的所有突變上展現出降低的功效。在激動劑和拮抗劑模式中,所有三種拮抗劑對UbC HA-ER-α突變型細胞系展現出高皮摩爾濃度至低納摩爾濃度IC50(表11和13)。在激動劑模式下,UbC野生型HA-ER-α細胞系沒有充分增殖以得到準確的IC50,然而,在拮抗劑模式中,與野生型ER-α相比,所有拮抗劑均展現出效力的適度降低(1.3-至5.4倍,表13)。
在EF1衍生的細胞系中,在激動劑模式中,與野生型相比,所有拮抗劑對突變型受體表現出降低的效力(對于4-羥基他莫昔芬、氟維司群和ARN-810分別為8至140倍、2-至47倍和2-至210倍)。此外,與氟維司群和4-羥基他莫昔芬兩者相比,ARN-810在Y537突變體上展現出降低的功能(表15和16)。當以拮抗劑模式進行增殖測定時,觀察到拮抗劑功效和效力的類似觀察(表16和17)。然而,在17β-雌二醇存在的情況下,在攜帶野生型和突變型HA-ER-α的細胞系之間拮抗劑效力的差異不如在EF-1激動劑測定中所觀察到的顯著(最大15倍)。
表10孵育5天后ARN-810減少穩定表達臨床相關ER-α突變體的MCF-7細胞的存活細胞數(UbC HA-ER-α;激動劑模式;-E2)
MCF-7細胞用作陰性對照。
Emax是相對于第0天而言的第5天的最大刺激增殖響應。還展示了與媒介物相比的抑制百分比(%)。數據是從4次獨立實驗得到的平均值和標準偏差。
表11 ARN-810為穩定表達臨床相關ER-α突變體的MCF-7細胞的強效增殖拮抗劑(UbC HA-ER-α;激動劑模式;-E2)
MCF-7細胞用作陰性對照。
數據是從4次獨立實驗得到的平均值和標準偏差。
表12孵育5天后ARN-810減少穩定表達臨床相關ER-α突變體的MCF-7細胞的存活細胞數(UbC HA-ER-α;拮抗劑模式;+E2)
MCF-7細胞用作陰性對照。
Emax是相對于第0天而言的第5天的最大刺激增殖響應。還展示了與媒介物相比的抑制百分比(%)。數據是從2次獨立實驗得到的平均值和標準偏差。
表13 ARN-810為穩定表達臨床相關ER-α突變體的MCF-7細胞的強效增殖拮抗劑(UbC HA-ER-α;拮抗劑模式;+E2)
MCF-7細胞用作陰性對照。
數據是從2次獨立實驗得到的平均值和標準偏差。
表14孵育5天后ARN-810減少穩定表達臨床相關ER-α突變體的MCF-7細胞的活細胞數(EF1HA-ER-α;激動劑模式;-E2)
將用空EF1慢病毒載體轉導的MCF-7細胞用作陰性對照。
Emax是相對于第0天而言的第5天的最大刺激增殖響應。還展示了與媒介物相比的抑制百分比(%)。數據是從2次獨立實驗得到的平均值和標準偏差。
表15 ARN-810為穩定表達臨床相關ER-α突變體的MCF-7細胞的增殖拮抗劑(EF1HA-ER-α;激動劑模式;-E2)
將用空EF1慢病毒載體轉導的MCF-7細胞用作陰性對照。
數據是從2次獨立實驗得到的平均值和標準偏差。ND=未確定。
表16孵育5天后ARN-810減少穩定表達臨床相關ER-α突變體的MCF-7細胞的存活細胞數(EF1HA-ER-α;拮抗劑模式;+E2)
將用空EF1慢病毒載體轉導的MCF-7細胞用作陰性對照。
Emax是相對于第0天而言的第5天的最大刺激增殖響應。還展示了與媒介物相比的抑制百分比(%)。數據是從2次獨立實驗得到的平均值和標準偏差。
表17 ARN-810為穩定表達臨床相關ER-α突變體的MCF-7細胞的增殖拮抗劑(EF1HA-ER-α;拮抗劑模式;+E2)
將用空EF1慢病毒載體轉導的MCF-7細胞用作陰性對照。
數據是從2次獨立實驗得到的平均值和標準偏差。
結論:化合物1-3(ARN-810)在基于細胞的轉錄報道蛋白和細胞存活力測定中抑制臨床相關ESR1突變E380Q、L536R、L536P、Y537C、Y537N、Y537S和D538G的活性。ARN-810將ER依賴性轉錄報道蛋白測定中所有ESR1突變的轉錄活性抑制為達到接近野生型受體所觀察到的水平。在通過UBC啟動子以低水平穩定表達ER-α突變體的MCF-7細胞中,與DMSO對照相比,ARN-810將存活細胞數減少了47%-78%。雖然ARN-810在此測定中展現出納摩爾濃度效力,但與野生型相比,ARN-810在突變型ER-α上表現出1.3至2.7倍的降低的效力。相反,當ER-α突變體通過EF1啟動子過表達時,與野生型受體相比,ARN-810展現出效力降低0.6至210倍,并且與4-羥基他莫昔芬和氟維司群相比,降低最大功效(Emax)響應。
實施例6:ERM化合物4-23對臨床相關ESR1突變的活性
本研究的目的是評估ERM 4-23,即(S)-2-(4-(2-(3-(氟甲基)氮雜環丁-1-基)乙氧基)苯基)-3-(3-羥基苯基)-4-甲基-2H-色烯-6-醇(表4)對臨床相關雌激素受體突變的功效,已提出該突變賦予對抗激素療法諸如芳香酶抑制劑的抗性。在穩定表達ER-α突變體的MCF-7細胞的ER依賴性轉錄報道蛋白測定和存活力測定中,體外測量ERM 4-23的效力和功效。將ERM 4-23活性與臨床相關的ER-α靶向乳腺癌治療劑4-羥基他莫昔芬(他莫昔芬的活性代謝產物)和氟維司群進行比較。在基于細胞的轉錄報道蛋白測定中,ERM 4-23抑制所有ER-α突變(E380Q、L536R、L536P、Y537C、Y537N、Y537S和D538G)的活性,測試具有納摩爾濃度效力,并且功效接近野生型受體所觀察到的。類似地,在穩定表達ER-α突變體的MCF-7細胞中,ERM 4-23使存活細胞的數目減少49%-90%(與DMSO對照相比),這取決于突變和測定格式。然而,在兩種測定中,在ESR1突變組中,與野生型ER-α相比,ERM 4-23展現0.7至23倍降低的效力。
如實施例3所示,本研究的目的是確定ERM 4-23對臨床相關ER-α突變的活性。在穩定表達野生型或突變型ER-α(alpha)的MCF-7細胞的ER-α轉錄報道蛋白和細胞存活力中監測ERM 4-23活性。
如WO 2014/025138中所述制備ERM 4-23。采用該分子的鹽酸鹽形式。藥品樣品具有>95%純度(純度評估:核磁共振/液相色譜-質譜)且為灰白色粉末。將ERM 4-23溶于二甲基亞砜(DMSO)中作為10mM儲備溶液并在-20℃儲存。采用如實施例3中所述的其它化合物和制劑。
在如實施例5所示的瞬時表達野生型ER-α或ER-α突變體的MCF-7乳腺癌細胞中,評價ERM化合物4-23、4-羥基他莫昔芬和氟維司群對臨床相關ESR1突變(E380Q、L536R、L536P、Y537C、Y537N、Y537S和D538G)的轉錄活性的作用。用ER應答轉錄報道蛋白及野生型或突變型ER-α表達質粒瞬時轉染MCF-7細胞,并用范圍為0.1pM至10μM的ERM 4-23、4-羥基他莫昔芬或氟維司群或范圍為0.1pM至1μM的17β-雌二醇處理。為了評估化合物的潛在激動劑活性,在不存在雌二醇的情況下處理細胞。在1nM雌二醇存在的情況下進行拮抗劑測定。如表18所示,在不存在雌二醇的情況下,所有分析的臨床突變表現出可檢測的配體非依賴性活性,其被ERM 4-23、4-羥基他莫昔芬和氟維司群抑制到接近野生型的水平。所有拮抗劑對測試的突變保持納摩爾濃度效力(表19)。然而,除了少數例外(4-羥基他莫昔芬對E380Q和L536P的活性),在激動劑模式中,與野生型ER-α相比,所有拮抗劑表現出對突變型受體的效力的適度降低(1.1至5.9倍),其中對于在ERM 4-23對Y537S突變中觀察到最大5.9倍的降低。當在拮抗劑模式轉錄測定中分析ESR1突變(L536R、Y537C、Y537N、Y537S和D538G)的亞組時,觀察到對功效和效力的類似效應。具體來說,在臨床相關突變ERM 4-23上,IC50增加0.8至1.7倍,但最大功效接近在野生型受體上所觀察到的功效(表20和21)。
表18 ERM 4-23抑制臨床相關ER-α突變的轉錄活性(激動劑模式,-E2)
Emax是相對于經媒介物處理的野生型ER-α而言的最大刺激活性。還展示了與媒介物相比的抑制百分比(%)。
數據是從n次獨立實驗得到的平均值和標準偏差。
表19 ERM 4-23為臨床相關ER-α突變的活性的強效轉錄抑制劑(激動劑模式,-E2)
數據是從n次獨立實驗得到的平均值和標準偏差。
表20 ERM 4-23拮抗臨床相關ER-α突變的轉錄活性(拮抗劑模式,+E2)
Emax是相對于經媒介物處理的野生型ER-α而言的最大刺激活性。還展示了與媒介物相比的抑制百分比(%)。
數據是從n次獨立實驗得到的平均值和標準偏差。
表21 ERM 4-23為臨床相關ER-α突變的活性的強效轉錄拮抗劑(拮抗劑模式,+E2)
數據是從n次獨立實驗得到的平均值和標準偏差。
存活力測定:為了評估ERM 4-23拮抗患者中鑒定的組成型活性ER-α突變的配體非依賴性增殖活性的能力,產生穩定表達野生型、E380Q、L536P、L536R、Y537N、Y537S、Y537C和D538G氨基末端血凝素標簽的ER-α(HA-ER-α)的MCF-7細胞系。因為ER-α過表達可誘導配體非依賴性生長并且還可使配體介導的降解途徑飽和,所以利用UbC和EF1啟動子驅動ER-α表達,針對每個受體產生獨立的穩定細胞系。UbC啟動子由制造商(System Biosciences)報道以表達低至中等RNA水平,而EF1啟動子表達高水平(System Biosciences)。如通過定量蛋白免疫印跡分析所確定的,基于UbC的細胞系以小于10%內源性ER-α的水平表達HA-ER-α蛋白。在另一方面,基于EF1啟動子的細胞系以比內源性蛋白高2至6倍的水平表達HA-ER-α和突變體。
與其在轉錄報道蛋白測定中的活性一致,臨床鑒定的ER-α突變體在MCF-7細胞中通過UbC或EF1啟動子的表達賦予細胞在不存在17β-雌二醇的情況下增殖的能力(表22和26 5)。然而,使用EF1啟動子獲得的高水平的野生型ER-α表達(約為內源性蛋白水平的2-3倍)也足以促進配體非依賴性生長。在激動劑模式中,ERM 4-23、4-羥基他莫昔芬和氟維司群通過任一啟動子拮抗穩定表達野生型、E380Q、L536P、L536R、Y537N、Y537S、Y537C和D538G HA-ER-α的細胞系的增殖(表22和26)。氟維司群和ERM 4-23表現出相似的功效(對于UbC和EF1-衍生的細胞系分別為47%至66%和42%至96%抑制),而4-羥基他莫西芬在所測試的所有突變上展現出降低的功效。在激動劑模式中,所有三種拮抗劑對UbC HA-ER-α突變型細胞系展現出高皮摩爾濃度至低納摩爾濃度IC50,且在EF1-衍生的細胞系中展現出低納摩爾濃度效力(表23和27)。在不存在E2的情況下,UbC野生型HA-ER-α細胞系沒有充分增殖以得到準確的IC50,然而,在EF1-衍生的細胞系中,與野生型相比,所有拮抗劑均展現出降低的效力(對于4-羥基他莫昔芬、氟維司群和ERM 4-23分別為8至140倍、2至47倍和0.7至24倍)。當以拮抗劑模式進行增殖測定時,觀察到拮抗劑功效和效力的類似觀察(表24、25、28、29)。然而,在17β-雌二醇存在的情況下,在攜帶野生型和突變型HA-ER-α的細胞系之間拮抗劑效力的差異不如在EF-1激動劑測定中所觀察到的顯著(最大13倍)。
表22孵育5天后ERM 4-23減少穩定表達臨床相關ER-α突變體的MCF-7細胞的存活細胞數(UbC HA-ER-α;激動劑模式;-E2)
MCF-7細胞用作陰性對照。
Emax是相對于第0天而言第5天的最大刺激增殖反應。還展示了與媒介物相比的抑制百分比(%)。
數據是從4次獨立實驗得到的平均值和標準偏差。
表23ERM 4-23為穩定表達臨床相關ER-α突變體的MCF-7細胞的強效增殖拮抗劑(UbC HA-ER-α;激動劑模式;-E2)
MCF-7細胞用作陰性對照。
數據是從4次獨立實驗得到的平均值和標準偏差。
表24孵育5天后ERM 4-23減少穩定表達臨床相關ER-α突變體的MCF-7細胞的存活細胞數(UbC HA-ER-α;拮抗劑模式;+E2)
MCF-7細胞用作陰性對照。
Emax是相對于第0天而言第5天的最大刺激增殖反應。還展示了與媒介物相比的抑制百分比(%)。
數據是從2次獨立實驗得到的平均值和標準偏差。
表25 ERM 4-23為穩定表達臨床相關ER-α突變體的MCF-7細胞的強效增殖拮抗劑(UbC HA-ER-α;拮抗劑模式;+E2)
MCF-7細胞用作陰性對照。
數據是從2次獨立實驗得到的平均值和標準偏差。
表26孵育5天后ERM 4-23減少穩定表達臨床相關ER-α突變體的MCF-7細胞的存活細胞數(EF1HA-ER-α;激動劑模式;-E2)
將用空EF1慢病毒載體轉導的MCF-7細胞用作陰性對照。
Emax是相對于第0天而言第5天的最大刺激增殖反應。還展示了與媒介物相比的抑制百分比(%)。
數據是從2次獨立實驗得到的平均值和標準偏差。
表27 ERM 4-23為穩定表達臨床相關ER-α突變體的MCF-7細胞的強效增殖拮抗劑(EF1HA-ER-α;拮抗劑模式;-E2)
將用空EF1慢病毒載體轉導的MCF-7細胞用作陰性對照。
數據是從2次獨立實驗得到的平均值和標準偏差。ND=未確定。
表28孵育5天后ERM 4-23減少穩定表達臨床相關ER-α突變體的MCF-7細胞的存活細胞數(EF1HA-ER-α;拮抗劑模式;+E2)
將用空EF1慢病毒載體轉導的MCF-7細胞用作陰性對照。
Emax是相對于第0天而言第5天的最大刺激增殖反應。還展示了與媒介物相比的抑制百分比(%)。
數據是從2次獨立實驗得到的平均值和標準偏差。
表29 ERM 4-23為穩定表達臨床相關ER-α突變體的MCF-7細胞的強效增殖拮抗劑(EF1HA-ER-α;拮抗劑模式;+E2)
將用空EF1慢病毒載體轉導的MCF-7細胞用作陰性對照。
數據是從2次獨立實驗得到的平均值和標準偏差。
結論:ERM 4-23在基于細胞的轉錄報道蛋白和細胞存活力測定中抑制臨床相關ESR1突變E380Q、L536R、L536P、Y537C、Y537N、Y537S和D538G的活性。ERM 4-23將ER依賴性轉錄報道蛋白測定中所有ESR1突變的轉錄活性抑制為達到接近野生型受體所觀察到的水平。在穩定表達ER-α突變體的MCF-7細胞中,與DMSO對照相比,ERM 4-23使存活細胞數減少了49%-90%。雖然ERM 4-23在這些測定中展現出納摩爾濃度效力,但與野生型相比,ERM 4-23在突變型ER-α上表現出0.7至24倍的降低的效力。ERM 4-23展現出與4-羥基他莫昔芬和氟維司群類似的IC50效力以及與氟維司群類似的最大功效(Emax)響應。
實施例7體外細胞增殖測定
雌激素受體調節劑化合物和化療化合物的功效通過采用以下方案的細胞增殖測定來測量(Mendoza et al(2002)Cancer Res.62:5485-5488)。
發光細胞存活力測定是一種基于對存在的ATP定量而用于確定培養物中存活細胞數量的均相方法,這表示代謝活性細胞的存在。測定設計用于多孔板格式,使其對于自動化高通量篩選(HTS)、細胞增殖和細胞毒性測定而言是理想的。均相測定操作涉及將單一試劑(試劑)直接添加至在補充有血清的培養基中培養的細胞中。不需要細胞清洗、去除培養基或多個移液步驟。Cell發光細胞存活力測定包括試劑和方案是可商購得到的(Promega Corp.,Madison,WI,Technical Bulletin TB288)。
該測定評估化合物進入細胞和抑制細胞增殖的能力。測定原理基于通過定量存在于均相測定中的ATP來確定存在的存活細胞的數目,其中添加Cell試劑導致細胞裂解并通過熒光素酶反應產生發光信號。發光信號與存在的ATP的量成比例。
操作:第1天-接種細胞板(來自Falcon#353962的384孔黑色、透明底部、微透明、有蓋TC板),收獲細胞,以1000個細胞/54μl/孔接種細胞至384孔細胞板中以用于3天測定。細胞培養基:RPMI或DMEM高葡萄糖、10%胎牛血清、2mM L-谷氨酰胺,P/S。在37℃,5%CO2孵育O/N(過夜)。
第2天-向細胞添加藥物,化合物稀釋,DMSO板(連續稀釋1:2,9個點)。在96孔板的第二列加入20μl 10mM的化合物。使用來自Nunc(cat.#249946)的Precision Media Plates 96孔圓底聚丙烯板,跨板(10μl+20μl 100%DMSO)進行連續稀釋1:2共9個點(1:50稀釋)。向所有孔中添加147μl培養基。使用(Caliper,a Perkin-Elmer Co.)將DMSO板中每個孔的3μlDMSO+化合物轉移至培養基板上每個相應的孔中。對于2種藥物組合研究,使用Rapidplate將DMSO板中每個孔的一種藥物1.5μl DMSO+化合物轉移至培養基板上每個相應的孔中。然后,轉移另一種藥物1.5μl至培養基板。
添加藥物至細胞,細胞板(1:10稀釋):直接添加6μl培養基+化合物至細胞(在細胞上已經有54μl培養基)。在不會經常打開的培養箱中在37℃,5%CO2孵育3天。
第5天-鋪板,在室溫解凍Cell Titer Glo緩沖液:從37℃移去細胞板并平衡至室溫約30分鐘。添加Cell緩沖液至Cell底物(瓶到瓶)。向每個孔的細胞中添加30μl CellReagent(Promega cat.#G7572)。在板振蕩器上放置約30分鐘。在Analyst HT板閱讀器上讀取發光(每孔半秒)。
細胞存活力測定和組合測定:歷經16小時將細胞以1000-2000個細胞/孔接種在384孔板中。在第二天,在96孔板中在DMSO中制備9個連續稀釋的1:2化合物稀釋液。使用自動化設備(Zymark Corp.,Hopkinton,MA)將化合物進一步稀釋至生長培養基中。然后將稀釋的化合物一式四份添加至384孔細胞板的孔中,并在37℃和5%CO2下孵育。4天后,根據制造商的說明書使用Cell(Promega)通過發光測量存活細胞的相對數目,并在Wallac Multilabel(PerkinElmer,Foster City)上讀取。使用4.0software(GraphPad,San Diego)計算EC50值。組合測定中的藥物以4X EC50濃度開始給藥。如果在藥物的EC50>2.5μM的情況下,使用的最高濃度為10μM。在所有測定中同時添加或分隔4小時添加(一個接一個)雌激素受體調節劑化合物和化學治療劑。
另外的示例性體外細胞增殖測定包括以下步驟:
1.將培養基中含有約104個細胞(對于細胞系和腫瘤類型參見表3)的100μl細胞培養物的等分試樣沉積在384孔不透明壁板的每個孔中。
2.準備含有培養基和無細胞的對照孔。
3.將化合物添加至實驗孔中并孵育3-5天。
4.將板平衡至室溫約30分鐘。
5.添加與每個孔中存在的細胞培養基的體積相等的體積的試劑。
6.將內容物在定軌振蕩器上混合2分鐘以誘導細胞裂解。
7.將板在室溫孵育10分鐘以穩定發光信號。
8.記錄發光并在圖中報告為RLU=相對發光單位。
9.使用Chou和Talalay聯合方法并使用軟件(Biosoft,Cambridge,UK)的劑量-效應分析進行分析,以獲得聯合指數(Combination Index)。
可選擇地,將細胞以最佳密度接種在96孔板中并在測試化合物存在的情況下孵育4天。隨后將Alamar BlueTM添加至測定培養基中,并將細胞孵育6小時,然后在544nm激發、590nm發射讀取。使用S形劑量響應曲線擬合計算EC50值。
可選擇地,使用Cell試劑(Promega Inc.,Madison,WI)在藥物治療48小時后分析增殖/存活力。在所有存活力測定中DMSO處理用作對照。使用XL擬合軟件(IDBS,Alameda,CA)計算IC50值。
細胞系獲自ATCC(American Type Culture Collection,Manassas,VA)或DSMZ(Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH,Braunschweig,DE)。將細胞在補充有10%胎牛血清、100單位/ml青霉素、2mM L-谷氨酰胺和100mg/ml鏈霉素(Life Technology,Grand Island,NY)的RPMI 1640培養基中在37℃在5%CO2培養。
實施例8體內小鼠腫瘤異種移植物功效
小鼠:雌性嚴重聯合免疫缺陷小鼠(Fox ChaseC.B-17/IcrHsd,Harlan)或裸鼠(Taconic Farms,Harlan)為8至9周齡,在研究的第0天的BW范圍為15.1至21.4克。對動物隨意飼喂水(反滲透,1ppm Cl)以及由18.0%粗蛋白、5.0%粗脂肪和5.0%粗纖維組成的NIH 31改良和輻照實驗室飲食(Modified and Irradiated Lab)。將小鼠安置在21-22℃(70-72°F)和40-60%濕度、以12小時光照循環的靜態微隔離器(static microisolator)中經輻照的實驗室動物墊料(Laboratory Animal Bedding)上。PRC特別遵守“實驗動物護理和使用指南(Guide for Care and Use of Laboratory Animals)”關于約束、飼養、手術操作、飼料和流體調節以及獸醫護理的建議。PRC的動物護理和使用計劃由實驗動物護理國際評估和認證協會(the Association for Assessment and Accreditation of Laboratory Animal Care International)(AAALAC)認證,確保遵守關于實驗動物護理和使用的公認標準。
腫瘤植入:用癌細胞啟動異種移植。將細胞在補充有10%胎牛血清、2mM谷氨酰胺、100單位/mL青霉素、100μg/mL硫酸鏈霉素和25μg/mL慶大霉素的RPMI 1640培養基中培養。在指數生長期間收集細胞,并根據細胞系的倍增時間以5x 106或10x 106個細胞/mL的濃度重新混懸于磷酸鹽緩沖鹽水(PBS)中。將腫瘤細胞皮下植入右脅腹,并且當平均大小接近100至150mm3的目標范圍時監測腫瘤生長。在腫瘤植入后21天(指定為研究的第0天),將小鼠置于四組中,每組由10只小鼠組成,所述小鼠具有75-172mm3的單個腫瘤體積和120-121mm3的組平均腫瘤體積(參見附錄A)。使用下式計算體積:
腫瘤體積(mm3)=(w2x l)/2,其中w=腫瘤的寬度且l=腫瘤的長度(以mm為單位)。假設1mg等于1mm3的腫瘤體積,可估計腫瘤重量。
治療劑:雌激素受體調節劑化合物和化學治療劑通常由干粉制備,在室溫儲存,并且免受光照。在去離子水(“媒介物”)中的0.5%甲基纖維素:0.2%吐溫80中每周制備藥物劑量并在4℃儲存。在給藥的每一天通過用無菌鹽水(0.9%NaCl)稀釋儲備液的等分試樣來制備化合物的劑量。配制所有劑量以每20克體重0.2mL的體積(10mL/kg)遞送所述mg/kg劑量。
治療:將所有劑量按比例調整至單個動物的體重并通過各圖中所示的途徑提供。
終末點:以2維(長度和寬度)使用Ultra Cal IV卡尺(Model 54 10 111;Fred V.Fowler Company)如下測量腫瘤體積:腫瘤體積(mm3)=(長度x寬度2)×0.5并使用Excel version 11.2(Microsoft Corporation)進行分析。使用線性混合效應(LME)建模方法分析來自同一動物的腫瘤體積隨時間的重復測量(Pinheiro J,et al.nlme:linear and nonlinear mixed effects models.R package version 3.1 92.2009;Tan N,et al.Clin.Cancer Res.2011;17(6):1394–1404)。該方法解決了由于在研究結束之前動物的任何非治療相關的死亡所導致的重復測量和適度退出(dropout)。使用三次回歸樣條(cubic regression spline)在每個劑量水平將非線性分布擬合為log2腫瘤體積的時程。然后,這些非線性分布與混合模型內的劑量相關。使用下式將作為媒介物對照的百分比的腫瘤生長抑制(%TGI)計算為針對相應劑量組/天相對于媒介物的擬合曲線下面積(AUC)的百分比:%TGI=100×(1-AUCdose/AUCveh)。使用該式,TGI值為100%表示腫瘤停滯,TGI值>1%但<100%表示腫瘤生長延遲,且TGI值>100%表示腫瘤消退。將動物的部分響應(PR)定義為腫瘤消退>50%的起始腫瘤體積但<100%的起始腫瘤體積。將完全響應(CR)定義為在研究過程的任一天100%腫瘤消退(即,無可測量的腫瘤)。
毒性:在研究的前五天每天稱重動物,然后每周兩次稱重。使用AdventurerAV812量表(Ohaus Corporation)測量動物體重。重量變化百分比計算如下:體重變化(%)=[(重量新的一天-重量第0天)/重量第0天]×100。頻繁觀察小鼠并在觀察時記錄任何不良的、治療相關的副作用的明顯體征和臨床毒性體征。將可接受的毒性定義為在研究期間小于20%的組平均體重(BW)減輕,并且在10只治療的動物中有不超過一只治療相關的(TR)死亡。導致更大毒性的任何給藥方案被認為高于最大耐受劑量(MTD)。若可歸因于由臨床體征和/或尸體剖檢所證明的治療副作用,則將死亡歸類為TR,或者若歸因于給藥期期間或最后一次給藥的10天內的未知原因,則也可將死亡歸類為TR。若沒有證據表明死亡與治療副作用相關,則將死亡歸類為NTR。
盡管為了清楚理解的目的通過說明和實施例的方式相當詳細地描述了前述發明,但是描述和實施例不應被解釋為限制本發明的范圍。通過引用的方式將本申請引用的所有專利和科學文獻的公開內容明確地整體并入本申請。本申請所述的實施例和實施方案僅用于說明目的,并且本領域技術人員所建議的各種修改或變化將被包括在本申請的精神和范圍以及所附權利要求的范圍內。
序列表
<110> 賽拉根醫藥股份有限公司(SERAGON PHARMACEUTICALS, INC.)
<120> 調節雌激素受體突變體的方法和組合物
<130> 45202-739.101
<140> 待確定
<141> 2014-03-13
<160> 2
<170> PatentIn版本3.5
<210> 1
<211> 1788
<212> DNA
<213> 人
<400> 1
atgaccatga ccctccacac caaagcatct gggatggccc tactgcatca gatccaaggg 60
aacgagctgg agcccctgaa ccgtccgcag ctcaagatcc ccctggagcg gcccctgggc 120
gaggtgtacc tggacagcag caagcccgcc gtgtacaact accccgaggg cgccgcctac 180
gagttcaacg ccgcggccgc cgccaacgcg caggtctacg gtcagaccgg cctcccctac 240
ggccccgggt ctgaggctgc ggcgttcggc tccaacggcc tggggggttt ccccccactc 300
aacagcgtgt ctccgagccc gctgatgcta ctgcacccgc cgccgcagct gtcgcctttc 360
ctgcagcccc acggccagca ggtgccctac tacctggaga acgagcccag cggctacacg 420
gtgcgcgagg ccggcccgcc ggcattctac aggccaaatt cagataatcg acgccagggt 480
ggcagagaaa gattggccag taccaatgac aagggaagta tggctatgga atctgccaag 540
gagactcgct actgtgcagt gtgcaatgac tatgcttcag gctaccatta tggagtctgg 600
tcctgtgagg gctgcaaggc cttcttcaag agaagtattc aaggacataa cgactatatg 660
tgtccagcca ccaaccagtg caccattgat aaaaacagga ggaagagctg ccaggcctgc 720
cggctccgta aatgctacga agtgggaatg atgaaaggtg ggatacgaaa agaccgaaga 780
ggagggagaa tgttgaaaca caagcgccag agagatgatg gggagggcag gggtgaagtg 840
gggtctgctg gagacatgag agctgccaac ctttggccaa gcccgctcat gatcaaacgc 900
tctaagaaga acagcctggc cttgtccctg acggccgacc agatggtcag tgccttgttg 960
gatgctgagc ccccgatact ctattccgag tatgatccta ccagaccctt cagtgaagct 1020
tcgatgatgg gcttactgac caacctggca gacagggagc tggttcacat gatcaactgg 1080
gcgaagaggg tgccaggctt tgtggatttg accctccatg atcaggtcca ccttctagaa 1140
tgtgcctggc tagagatcct gatgattggt ctcgtctggc gctccatgga gcacccaggg 1200
aagctactgt ttgctcctaa cttgctcttg gacaggaacc agggaaaatg tgtagagggc 1260
atggtggaga tcttcgacat gctgctggct acatcatctc ggttccgcat gatgaatctg 1320
cagggagagg agtttgtgtg cctcaaatct attattttgc ttaattctgg agtgtacaca 1380
tttctgtcca gcaccctgaa gtctctggaa gagaaggacc atatccaccg agtcctggac 1440
aagatcacag acactttgat ccacctgatg gccaaggcag gcctgaccct gcagcagcag 1500
caccagcggc tggcccagct cctcctcatc ctctcccaca tcaggcacat gagtaacaaa 1560
ggcatggagc atctgtacag catgaagtgc aagaacgtgg tgcccctcta tgacctgctg 1620
ctggagatgc tggacgccca ccgcctacat gcgcccacta gccgtggagg ggcatccgtg 1680
gaggagacgg accaaagcca cttggccact gcgggctcta cttcatcgca ttccttgcaa 1740
aagtattaca tcacggggga ggcagagggt ttccctgcca cggtctga 1788
<210> 2
<211> 595
<212> PRT
<213> 人
<400> 2
Met Thr Met Thr Leu His Thr Lys Ala Ser Gly Met Ala Leu Leu His
1 5 10 15
Gln Ile Gln Gly Asn Glu Leu Glu Pro Leu Asn Arg Pro Gln Leu Lys
20 25 30
Ile Pro Leu Glu Arg Pro Leu Gly Glu Val Tyr Leu Asp Ser Ser Lys
35 40 45
Pro Ala Val Tyr Asn Tyr Pro Glu Gly Ala Ala Tyr Glu Phe Asn Ala
50 55 60
Ala Ala Ala Ala Asn Ala Gln Val Tyr Gly Gln Thr Gly Leu Pro Tyr
65 70 75 80
Gly Pro Gly Ser Glu Ala Ala Ala Phe Gly Ser Asn Gly Leu Gly Gly
85 90 95
Phe Pro Pro Leu Asn Ser Val Ser Pro Ser Pro Leu Met Leu Leu His
100 105 110
Pro Pro Pro Gln Leu Ser Pro Phe Leu Gln Pro His Gly Gln Gln Val
115 120 125
Pro Tyr Tyr Leu Glu Asn Glu Pro Ser Gly Tyr Thr Val Arg Glu Ala
130 135 140
Gly Pro Pro Ala Phe Tyr Arg Pro Asn Ser Asp Asn Arg Arg Gln Gly
145 150 155 160
Gly Arg Glu Arg Leu Ala Ser Thr Asn Asp Lys Gly Ser Met Ala Met
165 170 175
Glu Ser Ala Lys Glu Thr Arg Tyr Cys Ala Val Cys Asn Asp Tyr Ala
180 185 190
Ser Gly Tyr His Tyr Gly Val Trp Ser Cys Glu Gly Cys Lys Ala Phe
195 200 205
Phe Lys Arg Ser Ile Gln Gly His Asn Asp Tyr Met Cys Pro Ala Thr
210 215 220
Asn Gln Cys Thr Ile Asp Lys Asn Arg Arg Lys Ser Cys Gln Ala Cys
225 230 235 240
Arg Leu Arg Lys Cys Tyr Glu Val Gly Met Met Lys Gly Gly Ile Arg
245 250 255
Lys Asp Arg Arg Gly Gly Arg Met Leu Lys His Lys Arg Gln Arg Asp
260 265 270
Asp Gly Glu Gly Arg Gly Glu Val Gly Ser Ala Gly Asp Met Arg Ala
275 280 285
Ala Asn Leu Trp Pro Ser Pro Leu Met Ile Lys Arg Ser Lys Lys Asn
290 295 300
Ser Leu Ala Leu Ser Leu Thr Ala Asp Gln Met Val Ser Ala Leu Leu
305 310 315 320
Asp Ala Glu Pro Pro Ile Leu Tyr Ser Glu Tyr Asp Pro Thr Arg Pro
325 330 335
Phe Ser Glu Ala Ser Met Met Gly Leu Leu Thr Asn Leu Ala Asp Arg
340 345 350
Glu Leu Val His Met Ile Asn Trp Ala Lys Arg Val Pro Gly Phe Val
355 360 365
Asp Leu Thr Leu His Asp Gln Val His Leu Leu Glu Cys Ala Trp Leu
370 375 380
Glu Ile Leu Met Ile Gly Leu Val Trp Arg Ser Met Glu His Pro Gly
385 390 395 400
Lys Leu Leu Phe Ala Pro Asn Leu Leu Leu Asp Arg Asn Gln Gly Lys
405 410 415
Cys Val Glu Gly Met Val Glu Ile Phe Asp Met Leu Leu Ala Thr Ser
420 425 430
Ser Arg Phe Arg Met Met Asn Leu Gln Gly Glu Glu Phe Val Cys Leu
435 440 445
Lys Ser Ile Ile Leu Leu Asn Ser Gly Val Tyr Thr Phe Leu Ser Ser
450 455 460
Thr Leu Lys Ser Leu Glu Glu Lys Asp His Ile His Arg Val Leu Asp
465 470 475 480
Lys Ile Thr Asp Thr Leu Ile His Leu Met Ala Lys Ala Gly Leu Thr
485 490 495
Leu Gln Gln Gln His Gln Arg Leu Ala Gln Leu Leu Leu Ile Leu Ser
500 505 510
His Ile Arg His Met Ser Asn Lys Gly Met Glu His Leu Tyr Ser Met
515 520 525
Lys Cys Lys Asn Val Val Pro Leu Tyr Asp Leu Leu Leu Glu Met Leu
530 535 540
Asp Ala His Arg Leu His Ala Pro Thr Ser Arg Gly Gly Ala Ser Val
545 550 555 560
Glu Glu Thr Asp Gln Ser His Leu Ala Thr Ala Gly Ser Thr Ser Ser
565 570 575
His Ser Leu Gln Lys Tyr Tyr Ile Thr Gly Glu Ala Glu Gly Phe Pro
580 585 590
Ala Thr Val
595
- 還沒有人留言評論。精彩留言會獲得點贊!
- Virosaine A的四氫吡咯基和嗎啉基衍生物的組合物在抗骨質疏松藥物中的應用
- 鑒定嗅覺受體調節劑的方法
- 用于治療局部晚期或轉移性雌激素受體陽性乳腺癌的雌激素受體調節劑的制作方法
- 作為mglu5受體的負性別構調節劑的6-氟-2-[4-(吡啶-2-基)丁-3-炔-1-基]咪唑并[1,2a ...的制作方法
- Virosaine A的哌嗪基和咪唑基衍生物的組合物在抗骨質疏松藥物中的應用
- 受體調節劑的環烷基氧基吡啶化合物和雜環烷基氧基吡啶化合物的制作方法
- 作為甲酰肽受體調節劑的苯基氨基甲酸酯衍生物的制作方法
- 雄激素受體調節劑的晶形的制作方法
- 受體調節劑的環烷基氧基吡啶化合物和雜環烷基氧基吡啶化合物的制作方法
- 作為甲酰肽受體調節劑的苯基氨基甲酸酯衍生物的制作方法
- 作為AXL抑制劑的雜環化合物的制作方法與工藝
- HPTP?β抑制劑的制作方法與工藝
- 作為LSD1抑制劑的環丙胺的制作方法與工藝
- KRAS G12C的抑制劑的制作方法與工藝
- 調節雌激素受體突變體的方法和組合物與流程
- 作為PI3K抑制劑的吡啶并[1,2?A]嘧啶酮類似物的制作方法與工藝
- 作為PI3K抑制劑的吡啶并[1,2?A]嘧啶酮類似物的制作方法與工藝
- 包含Ⅲ類受體酪氨酸激酶抑制劑和烷基化組蛋白?脫乙酰酶抑制劑融合分子EDO?S101的藥物組合及其在治療癌癥中的用途的制作方法與工藝
- 包含Ⅲ類受體酪氨酸激酶抑制劑和烷基化組蛋白?脫乙酰酶抑制劑融合分子EDO?S101的藥物組合及其在治療癌癥中的用途的制作方法與工藝
- 新型雌激素相關受體α抑制劑及其醫學用途的制作方法與工藝
- 一種二化螟Bt蛋白受體ALP4基因及其應用
- 一種二化螟Bt蛋白受體ALP5基因及其應用
- 水稻ABA受體OsPYL3基因、其編碼蛋白及其應用
- 檢測表皮生長因子受體基因位點突變的熒光定量pcr試劑盒的制作方法
- 抗人雌激素受體單克隆抗體及抗人孕激素受體單克隆抗體的制備及應用的制作方法
- 子宮癌遺傳檢測試劑盒的制作方法
- 一種利用雌激素受體α基因預測優秀冰雪運動員身高的細胞生物學方法
- T1r味覺受體及其編碼基因的制作方法
- 放射性配基N<sub>2</sub>S<sub>2</sub>-Memantine和腦受體顯像劑<sup>99m</sup>Tc-Memantine的油水分配系數測定方法
- 獼猴雌二醇受體β基因片段及其應用的制作方法