FGF?18化合物給藥方案的制作方法
本發明涉及軟骨治療,特別是軟骨/骨疾病、骨關節炎和軟骨損傷的治療。更具體地說,本發明涉及用于特定治療方案的FGF-18化合物。本發明具體地涉及治療方案,所述治療方案包括在每個治療周期中進行三或四次每2周一次的FGF-18化合物的給藥。所述給藥方案還可包括施用對癥狀(疼痛和功能)有效的抗炎藥,例如阿那白滯素或雙氯芬酸。
背景技術:
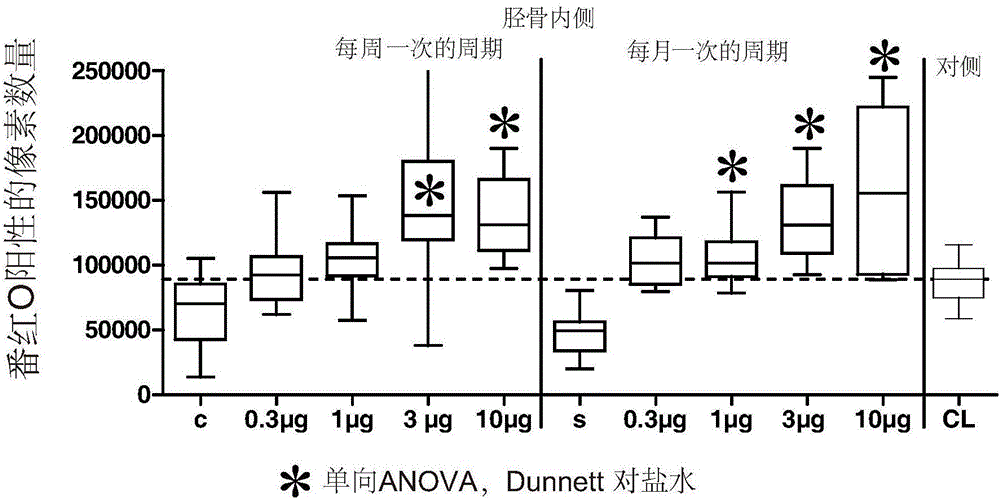
:軟骨由分散在基質(堅硬的凝膠狀的基質)中的軟骨細胞(源自間質細胞的細胞)組成。軟骨基質由這些細胞產生,并主要包含II型膠原纖維(纖維軟骨除外,纖維軟骨還包含I型膠原纖維)、蛋白多糖、和彈性蛋白纖維。軟骨存在于關節、胸廓、耳、鼻、喉、氣管和椎間盤等部位。主要有三種類型的軟骨:透明軟骨、彈性軟骨和纖維軟骨,根據它們的組織學形態提供顯著不同的功能特性。舉例來說,關節軟骨是一種透明軟骨,其具有粘彈性,覆蓋骨頭的關節表面。關節軟骨的主要功能是提供平滑的表面,以確保關節骨頭的幾乎無摩擦的運動。一般來說,軟骨疾病是指以軟骨的退化/解體和結締組織中的異常為特征的疾病,其表現為受影響身體部分的炎癥、疼痛、僵硬及活動受限。這些疾病可由病原體引起或者由創傷或損傷造成。成熟軟骨的自身修復能力非常有限,這主要是因為軟骨細胞中的營養供應有限,而且沒有血管,這使得成熟軟骨細胞幾乎沒有增殖的潛力。損傷或疾病引起的的受損軟骨、特別是關節軟骨的置換是醫生的一大挑戰,而現有的手術治療程序被認為是不可預測的,并且對沒有骨關節炎變化的年輕患者來說只在有限的時間內有效。因此,大多數患者不尋求治療,或者被建議盡量推遲治療。當必須進行治療時,標準程序是依年齡而定的,并且在全關節或部分關節置換術、軟骨塊或軟骨細胞移植或骨髓刺激技術(例如微裂手術)之間也有所不同。微裂手術是一種涉及穿刺軟骨下骨以通過骨髓干細胞刺激軟骨沉積的廉價及常見的程序。但是,這種技術已被證明不能充分修復軟骨缺陷,并且形成的新軟骨主要是纖維軟骨,這導致修復組織的壽命很短。事實上,纖維軟骨不具備與透明關節軟骨同樣的生物力學性質,并經常缺乏與周圍軟骨的適當的橫向整合。因此,新合成的纖維軟骨可能更容易損壞(預計期限:5-10年)。對于骨關節炎(OA)患者來說,上述軟骨修復技術都沒有用。其他非手術治療主要包括物理治療、生活方式改變(如減少體重)、支持裝置、口服藥物(如非類固醇抗炎藥)、注射藥物(如透明質酸和腎上腺皮質激素)和食品補充劑。所有這些治療都不能阻止OA病情的進展。如果疼痛療法也失效,患者的選擇就只剩下手術,例如關節置換術或膝關節脛骨高位截骨術。脛骨或股骨截骨術(切開骨骼以使關節磨損重建平衡)可減輕癥狀,有助于維持積極的生活方式,延緩對全關節置換的需求。全關節置換可改善晚期骨關節炎癥狀,但一般需顯著地改變患者的生活方式和/或活動水平。目前可用的藥物療法主要用于緩解疼痛。市場上目前還沒有能夠修復軟骨損傷的療法(見Lotz,2010)。白細胞介素-1α(IL-1α)和白細胞介素-1β(IL-1β)是天然存在的I型IL-1受體(IL-1RA)的激動劑。促炎細胞因子如IL-1的過度表達已被證明在諸如類風濕性關節炎(RA)(Bingham,2002)或骨關節炎(OA)(Lee等,2013)的免疫炎性疾病的發病機制中起主要作用。已用阿那白滯素(KineretTM)研究了拮抗IL-1α和IL-1β在RA中的臨床應用,阿那白滯素(KineretTM)是人IL-1ra的重組非糖基化形式。這種治療性蛋白質的使用降低了RA患者關節損傷的頻率和嚴重程度(Bresnihan,2002;St.Clair,2002),并且緩解了疼痛(Mertens等,2009)。該分子已于2001年獲得批準用于治療某些類型的RA。雖然OA也涉及IL-1,但與安慰劑相比,阿那白滯素療法與OA癥狀的改善并無顯著關聯,但有研究發現,與安慰劑相比,150mg的阿那白滯素往往可緩解疼痛(Chevalier等,2009)。成纖維細胞生長因子18(FGF-18)是成纖維細胞生長因子(FGF)蛋白家族的成員,其與FGF-8和FGF-17密切相關。FGF-18已被證明是軟骨細胞和成骨細胞的增殖劑(Ellsworth等,2002;Shimoaka等,2002)。FGF-18已被建議單獨(WO2008/023063)或與透明質酸結合(WO2004/032849)用于治療諸如骨關節炎和軟骨損傷的軟骨疾病。已有多種關于FGF18的給藥方案的建議。例如,Moore等(2005)公開了每周兩次、持續3周的給藥,而WO2008/023063教導了每周一次、持續3周的給藥。后一給藥方案已經過臨床試驗研究(詳情請參閱例如NCT01033994、NCT00911469及NCT01066871)。雖然WO2008023063中描述的給藥方案在關節軟骨修復中獲得了良好的效果,但仍有發生急性滑膜炎的風險。因此,需要一種用于降低與治療相關的發生急性滑膜炎的風險、并提高患者對關節內注射的耐受性、同時維持對軟骨疾病的療效的方法,所述療效主要是通過軟骨細胞增殖和隨后的軟骨修復來實現的。所述方法應當不僅能夠修復關節軟骨而盡可能不發生滑膜炎,而且能夠重新形成新的具有良好性能的軟骨(即,主要是透明軟骨)。實際上,所述透明軟骨的形成在作為治療劑以及作為生物基質的成分兩方面都是有價值的(Getgood等,2010)。還需要一種用于緩解疼痛/改善功能、同時維持對軟骨疾病的療效的方法。實際上,疼痛不僅經常與軟骨疾病有關,而且是這些疾病的臨床診斷的主要癥狀。技術實現要素:本發明的目的是提供一種用于治療患有軟骨疾病的患者的方法,所述方法包括施用FGF-18化合物,其中,所述FGF-18化合物在每個治療周期中至少給藥兩次,所述給藥相隔約2周,優選地相隔2周(每兩周給藥)。在一個優選實施例中,所述給藥相隔固定的間隔,每個間隔為約2周。優選地,所述FGF-18化合物以固定的間隔每兩周給藥一次。本發明還提供一種用于治療患有軟骨疾病的患者的FGF-18化合物,其中,所述FGF-18化合物在每個治療周期中至少給藥兩次,所述給藥相隔約2周,優選地相隔2周(每兩周給藥)。在一個優選實施例中,所述給藥相隔固定的間隔,每個間隔為約2周。優選地,所述FGF-18化合物以固定的間隔每兩周給藥一次。優選地,所述施用的FGF-18化合物是在本文中稱為trFGF-18(或sprifermin)的FGF-18片段,劑量學周期為每次關節內注射3至300微克、每2周一次、連續給藥3次(一個治療周期)。在作為一個整體的本發明的上下文中,任何使用FGF-18化合物的治療(或任何治療方法)還可包括施用對癥狀(疼痛和功能)有效的抗炎藥,例如阿那白滯素或雙氯芬酸。優選地,所述給藥與所述FGF-18化合物的給藥同時進行。如果需要抗炎藥,則所述抗炎藥在每個治療周期中至少與所述FGF-18化合物同時給藥兩次,所述給藥相隔約2周,優選地相隔2周(每兩周給藥)。優選的,所述抗炎藥是阿那白滯素或雙氯芬酸,劑量學周期為每次給藥0.01至500毫克、每2周一次、連續給藥3次(一個治療周期)。在一個優選實施例中,可在前一個治療周期的最后一次注射若干個月后重復該治療周期(單獨施用FGF-18化合物或結合對癥狀(疼痛和功能)有效的抗炎藥),例如在2、4或6個月后或甚至1年后。在本發明的優選實施例中,待治療的軟骨疾病是關節炎,例如骨關節炎,或者已經或未經手術干預(例如微裂手術)的軟骨損傷。發明人意外地發現,本發明的方法和用途顯著地改善軟骨修復并刺激軟骨細胞的增殖,同時提高患者對關節內注射的耐受性。發明人還意外地發現,當阿那白滯素或雙氯芬酸與FGF18一起使用時,能夠有效地恢復FGF-18化合物的增殖活性。與其他給藥方案相比,本發明的另一個優點是減少了滑膜炎。定義本說明書所用的術語“FGF-18化合物”或“FGF-18”,意指保持人FGF-18蛋白的至少一種生物活性的蛋白質。FGF-18可以是天然的、以其成熟形式、重組形式或截短形式存在。人FGF-18蛋白的生物活性特別包括軟骨細胞或成骨細胞增殖的增加(見W098/16644)或軟骨形成的增加(見W02008/023063)。天然的即野生型人FGF-18是由關節軟骨的軟骨細胞表達的蛋白質。W098/16644將人FGF-18首次指定為zFGF-5并加以充分描述。SEQIDNO:1對應于天然人FGF-18的氨基酸序列,其信號肽由氨基酸殘基1(Met)-27(Ala)組成。成熟形式的人FGF-18對應于SEQIDNO:1的殘基28(Glu)-殘基207(Ala)的氨基酸序列(180個氨基酸)。在本發明中,FGF-18可由重組方法產生,例如專利申請W02006/063362所教導的方法。根據表達系統和條件,在本發明中FGF-18在重組宿主細胞中表達并具有起始甲硫氨酸(Met)殘基或具有分泌信號序列。當在原核宿主(如大腸桿菌)中表達時,FGF-18在其序列的N-末端包含一個額外的Met殘基。例如,在大腸桿菌中表達時,人FGF-18的氨基酸序列以N端(位置1)的Met殘基開始,接著是SEQIDNO:1的殘基28(Glu)-殘基207(Ala)。本說明書所用的術語“截短形式”的FGF-18,指的是包含或由SEQIDNO:1的殘基28(Glu)-196(Lys)組成的蛋白質。優選地,FGF-18蛋白的截短形式是命名為“trFGF-18”的多肽(170個氨基酸;又稱為rhFGF18或sprifermin),它以Met殘基開始(N-末端),接著是野生型人FGF-18的氨基酸殘基28(Glu)-196(Lys)。trFGF-18的氨基酸序列見于SEQIDNO:2(SEQIDNO:2的氨基酸殘基2-170對應于SEQIDNO:1的氨基酸殘基28-196)。trFGF-18是一種在大腸桿菌中產生的截短形式的重組人FGF-18(見W02006/063362)。已證明FGF-18顯示與成熟人FGF-18類似的活性,例如,它增加軟骨細胞的增殖和軟骨的沉積,導致多種軟骨組織的修復和重建(見W02008/023063)。本說明書中所用的術語“對癥狀(疼痛和功能)有效的抗炎藥”或“抗炎藥”,指的是對與待治療的軟骨疾病相關的癥狀(例如疼痛和功能)有效的抗炎藥。根據本發明使用的優選“抗炎藥”是阿那白滯素和雙氯芬酸。阿那白滯素是人白細胞介素-1受體拮抗劑(IL-1Ra)的重組非糖基化形式。其商品名為其序列對應于SEQIDNO.3。雙氯芬酸(2-(2,6-二氯苯胺)苯乙酸)是一種公知的藥物,其用于減少炎癥和在某些情況下作為緩解疼痛的鎮痛劑。其有多個商品名。“約2周”或“約每2周”中的“約”包括相隔2周(14天)的給藥,以及相隔2周+/-數天(例如,+/-1、2、3天)的給藥。實際上,應當理解的是,從實際的角度來看,FGF-18化合物(例如trFGF-18)的給藥不可能總是按準確的間隔進行,例如,在上一次給藥的正好2周(14天)后進行。因此,在本發明的上下文中,2周的意思可以是14天,但也可以是上一次給藥的11、12、13、15、16或17天后,以方便患者。在本發明的上下文中,“2周”的意思與“每2周”、“每隔一周”或“每兩周”類似,這些詞可互換使用(圖1)。當提及“星期幾”(例如,第一次注射在星期一進行,下一次注射在2周后的星期一進行)或提及“日期”(例如,第一次注射在8月1日進行,下一次注射在8月15日進行)時,均可使用“2周”。“治療周期”或“周期”指一段時間,在這段時間中每2周施用FGF-18化合物(連續給藥)。例如,一個治療周期可包括3次間隔2周的注射。這種“治療周期”可以重復進行。例如,可在上一個周期的最后一次注射的2、3、4、5或6個月后進行第二個“治療周期”。或者,可在第一個周期的第一次注射的1年或2年后進行第二個周期。例如,第一個治療周期可包括3次間隔2周的注射,在該周期的最后一次注射的3個月后,進行包括3次間隔2周的注射的第二個治療周期。本說明書所用的“軟骨疾病”,包括由于諸如外傷的損傷、軟骨病或關節炎造成的損害而引起的病癥。可以通過施用本說明書所描述的FGF-18制劑來治療的軟骨疾病的例子包括(但不限于)關節炎(如骨關節炎)和軟骨損傷。該術語也包括軟骨或關節的退化性疾病/病癥,例如軟骨鈣質沉著病、多軟骨炎、復發性多軟骨炎、強直性脊柱炎或肋軟骨炎。國際軟骨修復學會提議了一種評估軟骨缺陷的嚴重程度的關節鏡評級系統:0級:(正常)健康軟骨,1級:軟骨有軟點或水皰,2級:軟骨中可見微小裂口,3級:損傷有深裂縫(超過軟骨層的50%),以及4級:軟骨裂口暴露下層(軟骨下)骨頭(見http://www.cartilage.org/_files/contentmanagement/ICRS_evaluation.pdf第13頁)。本說明書所用的術語“關節炎”包括諸如以下的疾病:骨關節炎,類風濕性關節炎,幼年型類風濕關節炎,感染性關節炎,牛皮癬關節炎,斯蒂爾病(幼年型類風濕關節炎的發病)或剝脫性骨軟骨炎,優選地包括軟骨受損的疾病或病癥。所用的術語“骨關節炎”或“OA”意指關節炎的最常見形式。術語“骨關節炎”包括原發性骨關節炎和次發性骨關節炎(例如,見TheMerckManual,第17版,第449頁)。骨關節炎可由軟骨斷裂而引起。軟骨的小片可能折斷并導致骨頭之間的關節疼痛和腫脹。隨著時間的推移,軟骨可以完全磨損,骨頭會相互摩擦。骨關節炎可累及任何關節,但通常涉及手、肩及負重關節,如髖、膝、腳和脊柱。在一個優選的實施例中,骨關節炎可以是膝骨關節炎或髖骨關節炎。該術語主要包括根據OARSI分類系統可分類為第1期至第4期或第1級至第6級的骨關節炎形式。本領域技術人員熟知本領域中使用的骨關節炎分類,特別是所述OARSI評估系統(又稱OOCHAS;例如,參閱Custers等,2007)。骨關節炎是可通過施用本發明的FGF-18化合物進行治療的優選的軟骨疾病之一。本說明書所用的術語“軟骨損傷”主要是指由創傷引起的軟骨疾病或軟骨受損。軟骨損傷主要可在創傷性機械破壞、特別是事故或手術(例如微裂手術)后發生。該術語“軟骨損傷”還包括軟骨或骨軟骨骨折和半月板損傷。該定義還包括與運動有關的損傷或與運動有關的關節組織的磨損。該術語還包括微損傷或鈍傷、軟骨斷裂、骨軟骨斷裂或半月板損傷。在本發明的上下文中,治療的“療效”可基于軟骨厚度的變化來測量,例如關節的關節軟骨的厚度。例如,可以通過X射線計算機斷層掃描、磁共振成像(MRI)或超聲波測量來測量該厚度。發明的詳細說明本發明提供使用FGF-18化合物治療諸如骨關節炎和軟骨損傷的各種軟骨疾病的給藥方案。優選地,所述FGF-18化合物是如上述定義的trFGF-18。在本發明的上下文中已證明,當根據本發明的方法和用途給藥時,FGF-18化合物對軟骨疾病的病情或癥狀的改善具有最佳的效果。發明人意外地發現,本發明的給藥方案(即:給藥頻率低于每個治療周期三周、每周一次)能夠減少下一次注射期間的炎癥(例如,急性滑膜炎),因此能夠發揮FGF-18化合物的全部活性。這一發現是出人意料的,因為FGF-18在關節中的半衰期是很短的(小于24小時)。在作為一個整體的本發明的上下文中,任何使用FGF-18化合物的治療(或任何治療方法)還可包括施用對癥狀(疼痛和功能)有效的抗炎藥,例如阿那白滯素或雙氯芬酸。優選地,所述給藥(或聯合給藥)與所述FGF-18化合物的給藥同時(即同步)進行。在一個實施例中,本發明提供一種用于治療患有軟骨疾病的患者的方法,所述方法包括施用FGF-18化合物,其中,所述FGF-18化合物在每個治療周期中至少給藥兩次,所述給藥相隔約2周,優選地相隔2周(即每2周、每隔一周或每兩周)。所述FGF-18化合物優選為trFGF-18。在一個優選實施例中,FGF-18化合物可在每個治療周期中以2周或約2周的固定間隔給藥3次(即:每個治療周期3次,固定間隔為2周或每2周一次)。所述治療可包括每年進行1、2或3個治療周期。可在施用所述FGF-18化合物的同時施用抗炎藥,例如阿那白滯素或雙氯芬酸。本發明的另一個方面提供一種用于治療患有軟骨疾病的患者的FGF-18化合物,其中,所述FGF-18化合物在每個治療周期中至少給藥兩次,所述給藥相隔約2周,優選地相隔2周。所述FGF-18化合物優選為trFGF-18。在一個優選實施例中,所述FGF-18化合物在每個治療周期中以2周或約2周的固定間隔給藥3次(即:每個治療周期3次,固定間隔為2周或每2周一次)。所述治療可包括每年進行1、2或3個治療周期。可在施用所述FGF-18化合物的同時施用對癥狀(疼痛和功能)有效的抗炎藥,例如阿那白滯素或雙氯芬酸。根據本發明,所述FGF-18化合物的給藥(單獨給藥或結合諸如阿那白滯素或雙氯芬酸的抗炎藥)以固定間隔進行,但+/-數天的微小變動是允許的(優選地不超過3天)。例如,在給藥相隔約2周的情況下,如果治療周期的第一次給藥在星期二進行,則第二次給藥可在第一次給藥的2周后的星期二進行(固定間隔),或者在其前幾天或后幾天進行(例如,之前的星期一或之后的星期四)。類似地,例如,如果第一次給藥在8月1日(例如,星期一)進行,則第二次給藥可在8月15日(星期一)、即第一次給藥的2周后進行(固定間隔),或者在其前幾天或后幾天進行(例如,8月15日之前的星期五或星期六,或8月15日之后的星期二或星期三)。這種靈活性使得給藥方案的限制更少、更方便患者。優選地,以固定的間隔進行給藥,例如,每2周給藥。在一個優選實施例中,所述給藥相隔2周(即每兩周給藥)。在作為一個整體的本發明的上下文中,所述FGF-18化合物在每個治療周期中至少給藥兩次。也可在每個周期中例如至少給藥3次或至少給藥4次。優選地,在每個治療周期中給藥3次或4次。在一個優選實施例中,所述FGF-18化合物(單獨給藥或結合諸如阿那白滯素或雙氯芬酸的抗炎藥)在每個治療周期中連續給藥至少2次、至少3次或至少4次。在一個更優選的實施例中,所述FGF-18化合物(單獨給藥或結合諸如阿那白滯素或雙氯芬酸的抗炎藥)在每個治療周期中連續給藥2次、3次或4次。在一個更優選的實施例中,連續給藥3次。在作為一個整體的本發明的上下文中,所述治療可包括每年進行數個治療周期,例如每年進行1、2或3個治療周期。在一個優選實施例中,所述治療包括每年進行2個治療周期。或者,所述治療包括每年進行1個治療周期,并在第一個治療周期開始的1年或2年后重復。例如,如果治療包括1個周期,所述治療可包括以2周的間隔進行3次注射。又例如,如果治療包括至少2個周期,第一個治療周期可包括以2周的間隔進行3次注射,并在該周期的最后一次注射的數個月后進行包括以2周的間隔進行3次注射的第二個治療周期。優選地,本發明的FGF-18化合物選自由以下組成的組:a)包括人FGF-18成熟形式或由人FGF-18成熟形式組成的多肽,所述人FGF-18成熟形式包括SEQIDNO:1的殘基28-207,或者b)包括FGF-18(170個氨基酸)(SEQIDNO:2)或由FGF-18(170個氨基酸)(SEQIDNO:2)組成的多肽。具體地說,所述化合物選自人野生型成熟FGF-18或trFGF-18。所述化合物增加軟骨沉積并允許軟骨修復。在另一個優選實施例中,所述治療包括在每次關節內給藥中以3-600微克(μg或mcg)、優選為3-300μg、或優選為10-200μg、或更優選為30-150μg、或更優選為30-120μg的劑量施用所述FGF-18化合物。在一個優選實施例中,所述治療包括在所述FGF-18化合物的每次關節內給藥中,以約3、10、20、30、40、50、60、90、100、120、150、180、200、240或300μg的劑量給藥。所述FGF-18化合物的每次關節內給藥優選的劑量包括10、20、30、60、90、120、180、240或300μg。應理解的是,取決于待治療的患者是人還是非人類哺乳動物,FGF-18化合物的給藥劑量會有所不同。例如,狗的劑量優選地比人的劑量低5倍。例如,如果人的劑量為每次關節內給藥30至120μg,則狗的劑量可為每次關節內給藥5至20μg。在實施例部分中給出了鼠和兔的劑量的例子。在作為一個整體的本發明的上下文中,所述FGF-18化合物可結合對癥狀(疼痛及功能)有效的抗炎藥使用。優選的抗炎藥是阿那白滯素(見SEQIDNO.3)或雙氯芬酸。當施用阿那白滯素或雙氯芬酸中的任一個時,所述治療包括在每次給藥中以0.01-500毫克(mg)、優選為0.1-250mg、或更優選為0.5-150mg的劑量通過關節內注射(施用例如阿那白滯素的優選方式)或通過口服(施用例如雙氯芬酸的優選方式)施用所述抗炎藥。在一個優選實施例中,所述治療包括在每次所述抗炎藥的給藥中以約0.03、0.1、0.25、0.3、0.5、1、1.5、2、5、10、15、20、30、40、50、60、70、80、90、100、150、200、250或300mg的劑量給藥。每次給藥優選的劑量包括0.5、1、5、1.5、10、50、100及150mg。應理解的是,取決于待治療的患者是人還是非人類哺乳動物,FGF-18化合物的給藥劑量會有所不同。例如,狗的劑量優選地比人的劑量低6倍。例如,如果人的劑量為每次關節內給藥150mg阿那白滯素,則狗的劑量可為每次關節內給藥25mg。醫生會根據患者的情況以及施用的抗炎藥來具體地調整抗炎藥的給藥方案。例如,口服雙氯芬酸的給藥方案可為50或75mg、每天兩次或三次。FGF-18化合物可配制成藥物組合物,即與藥學上可接受的載體、賦形劑或類似物一起。“藥學上可接受的”的定義是指包括任何不干擾活性成分的生物活性的有效性、并且對給藥的患者無毒性的載體、賦形劑或類似物。例如,對于腸胃外給藥,活性蛋白可以例如鹽水、葡萄糖溶液、血清白蛋白和Ringer溶液為載體配制成注射用單位劑量的形式。用于關節內注射的制劑將符合大部分也適用于其他注射制劑的要求,即必須是無菌的,并且必須與應用部位(例如,膝關節,滑液)的生理條件相容。用于關節內注射的賦形劑也可存在于其它注射制劑中,例如用于肌肉內注射或皮下注射的制劑。這種包括至少一種藥學上可接受的載體、賦形劑或類似物的FGF-18化合物的制劑在此也稱為“FGF-18組合物”或“FGF-18制劑”。所述“FGF-18組合物”或“FGF-18制劑”也在本發明的上下文中使用。如果抗炎藥(例如阿那白滯素或雙氯芬酸)與FGF-18化合物一起使用,可在給藥前將所述抗炎藥加入到FGF-18化合物制劑中,或者使用2個不同的注射器/針頭進行聯合給藥,或使用2個不同的注射器但優選地使用同一個針頭進行聯合給藥以方便患者。或者,可通過口服或任何其他給藥方式施用所述抗炎藥。FGF-18化合物,例如trFGF-18,以及包括FGF-18化合物的組合物(“FGF-18組合物”)可用于治療軟骨疾病。具體來說,可用于治療例如由表淺纖毛化(早期骨關節炎)引起的滑膜關節中的關節軟骨缺損、由骨關節炎引起的軟骨退化、以及由損傷或疾病引起的軟骨或骨軟骨缺損。FGF-18化合物和組合物還可用于治療由剝脫性骨軟骨炎引起的關節疾病和退行性關節病。在重建和整容手術領域中,FGF-18化合物和組合物可用于為大范圍組織缺損的重建而進行的自體或同種異體軟骨擴張和轉移。FGF-18組合物可與關節灌洗、骨髓刺激、磨損關節造形術、軟骨下鉆孔、或軟骨下骨的微裂手術結合,用于修復軟骨損傷。可選的與對癥狀(疼痛和功能)有效的抗炎藥(例如阿那白滯素或雙氯芬酸)結合的聯合給藥,可減輕與待治療的軟骨疾病相關的疼痛。在一個優選實施例中,根據本發明的待治療的軟骨疾病是骨關節炎,例如膝關節骨關節炎或髖關節骨關節炎。待治療的骨關節炎例如但不限于原發性骨關節炎或繼發性骨關節炎,以及按照OARSI分類系統分類為第1期至第4期或第1級至第6級的骨關節炎。在另一個優選實施例中,根據本發明的待治療的軟骨疾病是已經或未經手術干預(例如微裂手術)的軟骨損傷。此外,在施用FGF-18組合物(單獨施用或與諸如阿那白滯素或雙氯芬酸的抗炎藥一起施用)而引起的軟骨生長之后,可能需要進行手術治療,以適當地調整新形成的軟骨表面的輪廓。在一個優選實施例中,所述治療包括FGF-18化合物或FGF-18組合物的關節內給藥,所述給藥單獨進行或者與諸如阿那白滯素或雙氯芬酸的對癥狀(疼痛和功能)有效的抗炎藥一起進行。FGF-18化合物或FGF-18組合物可單獨或與諸如阿那白滯素或雙氯芬酸的抗炎藥一起,直接注射到關節的滑膜液中或缺損處,所述注射可單獨進行,或者與合適的載體混合,以實現蛋白質的延長釋放(例如緩釋制劑)或限制性局部釋放。優選地,本發明所述的單獨進行或者與諸如阿那白滯素或雙氯芬酸的抗炎藥一起進行的FGF-18化合物的給藥方式選自由以下組成的組:滑膜周圍給藥,滑膜內給藥,關節周圍給藥,關節內給藥。在一個優選實施例中,本發明所述的FGF-18化合物的給藥通過關節內給藥單獨進行或者與諸如阿那白滯素或雙氯芬酸的抗炎藥一起進行。優選地,所述抗炎藥通過關節內給藥(阿那白滯素的優選方式)或通過口服給藥(雙氯芬酸的優選方式)。所述關節內給藥在選自以下的關節中進行:髖,膝,肘,腕,踝關節,脊柱,腳,手指,腳趾,手,肩,肋骨,肩胛骨,大腿,小腿,腳跟以及沿脊柱骨點的關節。在另一個優選實施例中,所述關節內給藥在髖或膝關節中進行。附圖說明圖1:治療時間表略圖。圖1a:每周一次的給藥方案;圖1b:每月(或每4周)一次的給藥方案;圖1c:每月(或每4周)一次的給藥方案,允許+/-數天的變動以方便患者。圖2:FGF-18化合物引起大鼠OA模型中的劑量依賴的關節基質沉積,通過番紅O染色定量。圖3:不包括股骨的總關節分數圖4:總關節分數圖5:實質性脛骨軟骨變性寬度圖6:以IL1α刺激或不刺激并立即施用(A)或延后6小時后施用(B)100ng/mLrhFGF-18和/或100ng/mL阿那白滯素的豬軟骨細胞培養8天后的細胞濃度。(A)中N=4,(B)中N=6。圖7:血清α2MG水平隨時間的變化圖8:目標膝蓋(OA關節)與對側關節(健康膝蓋)之間的關節直徑的AUC(曲線下的面積)的差別隨時間的變化圖9:脛骨內側的軟骨體積(mm3)序列描述:SEQIDNO.1:天然人FGF-18的氨基酸序列。SEQIDNO.2:重組截短FGF-18(trFGF-18)的氨基酸序列。SEQIDNO.3:重組人iIL-1受體拮抗劑(阿那白滯素)的氨基酸序列。實施例材料以下實施例中的重組截短FGF-18(trFGF-18)根據專利申請WO2006/063362中所描述的技術通過大腸桿菌中的表達來制備。在以下實施例中,trFGF-18和FGF-18可互換使用。重組人白細胞介素-1受體拮抗劑(阿那白滯素)購買自Phartmacia。關節的評分處死后,將右膝移除并在5%甲酸中脫鈣4-6天,然后在冠狀面中對切并以石蠟包埋。以200微米的間隔切出三個截面,以甲苯胺藍染色,并使用ImageProPlusTM軟件(MediaCybernetics)進行分析。在對關節的三個截面評分時,每個載玻片上的兩個半體的最差的狀況被確定為軟骨病變的軟骨變形寬度(μm)。這反映了脛骨軟骨病變的面積,其中軟骨細胞和蛋白聚糖的損失延伸軟骨厚度的≥50%。在脛骨表面的三個區域中的每一個中具有最嚴重的病變的區域中進行所述測量。確定每個評分和測量的治療組平均值±SE。使用單向方差分析(單向ANOVA)或Kruskal-Wallis檢驗(非參數)以及合適的測試后多重比較對數據進行分析。使用學生t檢驗比較右膝與左膝的卡尺測量結果。除非特別說明,BolderBioPATH,Inc.只對原始數據(未經轉換)進行統計學分析。統計檢驗對數據的正態性和方差齊性做出某些假設,如果測試結果與這些假設相矛盾,則可能需要進一步的分析。所有檢驗的顯著性設定為p≤0.05。在每一組與賦形劑對照組之間、以及對之間進行比較。實施例1方法:在10-15周齡的雄性Lewis大鼠中進行不穩定誘導OA的前交叉韌帶切斷與內側半月板切除(ACLT+TMX)模型。簡要地說,在異氟醚麻醉下,打開每只大鼠的右膝的關節囊,快速切斷前交叉和半月板固定韌帶,除去半月板,通過縫合封閉關節囊、肌肉和皮膚。將動物隨機分為10組,每組n=10。研究了以下劑量:每次關節內注射0、0.3、1、3和10μg。第1-5組接受一個治療周期,包括每周一次的三次注射,第6-10組接受每月一次的三次注射。手術的三周后開始關節內治療。這時已可見諸如軟骨基質損失的病理生理變化。手術的17周后對動物施行安樂死并對關節進行研究。結果:1μg/關節的trFGF-18誘導了軟骨組織的劑量依賴性新形成(在側部脛骨中可見),并與注射方案無關(見圖2a)。根據每周一次的給藥方案1μg/關節的trFGF-18誘導了軟骨組織的劑量依賴性新形成(在脛骨內側可見),而根據每月一次的給藥方案0.3μg/關節的trFGF-18誘導了軟骨組織的劑量依賴性新形成(在脛骨內側可見)。實施例2方法:雄性Lewis大鼠接受手術(在異氟醚麻醉下)以在右膝關節中誘導內側半月板撕裂。按照兩個不同給藥方案(見下表)之一對動物關節內施用賦形劑或FGF-18,然后在第105天處死動物。在基線及第21、42、56、84和105天對膝蓋進行卡尺測量。在基線、第21和105天以及最后一次給藥(第42或84天)一周后評估血清的α2巨球蛋白水平。收集右膝以進行組織病理學評估。表1:治療組組別大鼠數量治療(每50μl10μg)110正常+賦形劑d21,35,49210手術+賦形劑d21,35,49310手術+FGF-18d21,28,35(每周治療)410手術+FGF-18d21,35,49(雙周)510手術+FGF-18d21,49,77(每月治療)610手術+FGF18d21,35710手術+FGF18d21,77結果和結論:所有動物術后從麻醉中蘇醒后都立即恢復負重。所有動物在研究過程中都獲得體重增加,體重的變化在組別之間沒有顯著差別。在注射FGF-18后,由卡尺測量的膝蓋直徑以及血清的α2巨球蛋白水平增加,但在本研究中使用這些參數未觀察到某個特定治療方案與其他方案相比具有明顯的優勢。相比之下,每月注射的方案帶來的結構上的優勢是最大的(圖3、4、5)。每兩周一次的注射也是有前景的,其也取得了令人感興趣的結構上的改善。整體來說,本研究的結果顯示,使用FGF-18的治療顯著地增加了第一次注射后被治療的膝蓋中的腫脹而與給藥方案無關。組織病理學評估顯示,治療大體上增大了脛骨表面上的損傷的范圍,特別是膠原質損傷的范圍,但減小了其嚴重程度。這種效果在接受了三次而不是兩次給藥的治療組中、以及在最遲時點(第77天)接受最后一次給藥的治療組中最為明顯。治療還有若干其他副作用,包括軟骨肥大、滑膜炎、和滑膜纖維化。這些變化在快速地連續接受了三次給藥的動物(第3和4組)中最為明顯和嚴重,而在只接受了兩次給藥(第6和7組)或者在較長的時間范圍內接受給藥(第5組)的動物中變化稍微不那么嚴重。結果具有最好的整體形態的治療方案是三次每月一次的注射(第4組;在第21、49、和77天注射),這表明給藥之間留有一定的恢復時間是有益的。此外,三次每2周一次的注射(第5組;在第21、35、和49天注射)的結果也具有良好的整體形態。實施例3方法:本研究使用60只雄性空白新西蘭白兔。動物的年齡約3-4個月。對兔子進行手術,以構建軟骨缺損的右膝。在滑車溝的關節軟骨中構建2mm乘6mm全厚度缺損。使用18號針頭構建微裂。穿過缺損的基部處的軟骨下骨構建了兩個3mm深的微裂,一個在近端,一個在遠端。每個微裂的直徑約為1.5mm,孔洞之間相隔2mm。實驗包括以下六個治療組,每組10只動物,共60只兔子(表2)。第3、4、5和6組中的兔子通過關節內施用rhFGF-18治療,給藥方案為一個周期包括三次每周一次的注射,每次注射100μg的rhFGF-18(第3和5組),或者一個周期包括三次每月一次的注射,每次注射100μg的rhFGF-18(第4和6組)。所有動物在手術的6個月后處以安樂死并進行尸檢。表2:治療組結果:尸檢結果(表3):第5組動物和第6組動物的ICRS總軟骨分數分別為1.9+/-0.3SE和2.4+/-0.2SE,說明每月注射的方案與每周注射的方案相比具有優勢。在第6組動物中,有3/10的動物的髁間溝被填滿細顆粒狀至顆粒狀的軟骨,其余7/10的動物的髁間溝被填充50%至完全填滿顆粒狀至粗顆粒狀的軟骨。總結而言,通過每周一次或每月一次的單獨給藥或結合微裂手術,注射rhFGF-18導致股骨髁區域和增厚或擴大,以及髁間溝病灶中的粗糙或粗顆粒狀軟骨的增殖,內側和外側滑車脊上的骨贅的刺激、偶爾的脛骨平臺骨贅形成、或滑膜脂肪墊中的髕骨上或髕骨附近的異常軟骨生長。不進行微裂手術時的病理形態學:進行了三個月每月一次的rhFGF18治療的動物的右股骨病灶部位具有顯著增加的缺損填充百分比(48%),這導致缺損填充分數顯著提高了49%。其他分數非顯著性地提高了20-23%。溝病灶的總寬度非顯著性地增加了36%,而不具有活軟骨的病灶的寬度顯著減小了94%。所有部位均有從輕微至嚴重的、大體上為局灶性的、并且通常伴有纖維軟骨的退化。中央MFC厚度顯著增加了120%。進行微裂手術時的病理形態學:進行了微裂手術但未經治療的對照組中的軟骨病灶區部位具有整體上輕度重建的骨軟骨交界、輕度減少的基質染色、以及50%的缺損填充。細胞形態主要是纖維軟骨。進行了三周每周一次的rhFGF18治療的動物的病灶區部位在所有評分參數以及缺損填充百分比中都有44-69%的顯著提高(趨向正常)。總分數顯著提高了53%。溝病灶的總寬度輕微增加了5%,而不具有活軟骨的病灶的寬度(非顯著性地)減小了59%。所有部位具有軟骨肥大。這些部位的中央MFC厚度顯著增加了112%。進行了三個月每月一次的rhFGF18治療的動物的病灶區部位在所有評分參數以及缺損填充百分比中都有61-97%的顯著提高(趨向正常)。總分數顯著提高了76%。溝病灶的總寬度和不具有活軟骨的病灶的寬度分別非顯著性地減小了19%和69%。所有部位具有軟骨肥大。這些部位的中央MFC厚度顯著增加了106%。結論:異常臨床體征輕微,并與膝蓋手術之后和/或重復的樣本收集(從側耳脈收集血樣或從膝關節收集滑液)導致的兔子的常見異常臨床體征一致。第1組和第2組動物的髁間溝愈合的比較顯示髁間溝中良好而自發地填充了總體上看似軟骨的物質。有跡象表明微裂手術可能促進髁間溝中的軟骨再生長,因為第2組中9/10的動物的髁間溝填充了軟骨,而第1組中只有7/10的動物的髁間溝填充了軟骨,但這個差別是輕微的。同樣,兩組之間的ICRS或骨贅分數沒有差別,因此軟骨愈合的質量是好的,兩組中都幾乎沒有刺激骨贅形成。在其余的使用rhFGF18治療的組中,第4組(髁間溝,三個月每月一次關節內注射100μgrhFGF18)的反應似乎是最好的,有6/9的動物的髁間溝填充了總體上看接近正常至輕微粗糙或顆粒狀的軟骨。此外,第4組的ICRS軟骨分數(2.1+/-0.3)是使用rhFGF18治療的四個組中第二低的,并且該組具有所有rhFGF18組中最低的骨贅分數(3.8+/-0.8)。相比之下,第6組(髁間溝,微裂手術,三個月每月一次關節內注射100μgrhFGF18)中只有3/10的動物具有髁間溝填充,其ICRS分數是所有組中最高的(2.4+/-0.2),其骨贅分數是所有rhFGF18治療組中第二高的(5.1+/-0.7)。此外,第5組(髁間溝,微裂手術,三周每周一次關節內注射100μgrhFGF18)的骨贅分數是所有組中最高的(5.7+/-0.7)。當以延長的時間長度進行治療時,可取得較大的有益效果,且所述效果在進行了微裂手術的兔子中比在未進行微裂手術的兔子中更為明顯。實施例4方法:從豬臀部的股骨頭軟骨分離豬軟骨細胞(豬約一歲)。關節解剖后,收集軟骨并在室溫下的膠原酶0.25%(將膠原酶NGB42.5%用HAM’sF12稀釋10倍)中消化45分鐘。將松弛的細胞丟棄,并將軟骨在37℃的膠原酶0.1%(將膠原酶NGB42.5%用HAM’sF12稀釋25倍)中消化過夜以提取軟骨細胞。在本研究中,軟骨細胞以單層培養。用10ng/mLIL1α刺激原生關節豬軟骨細胞,或不進行刺激,并立即或在6個小時后施用100ng/ml阿那白滯素和/或100ng/mltrFGF-18。每種條件進行4或6個重復實驗。作為對照,單獨用阿那白滯素、單獨用trFGF-18或不用任何藥物(培養基)培養細胞。預培養:在細胞分離之后,以20000細胞/cm2接種豬軟骨細胞,并在完整HAM’sF12中培養一周。然后用accutase收集細胞,計數并按以下描述的方式使用。直接施用阿那白滯素的細胞:在24孔板上以15000細胞/孔在0.5mL完整HAM’sF12中接種軟骨細胞。然后,向細胞添加0.25mL400ng/mL的trFGF-18和/或0.25mL400ng/mL的阿那白滯素。在處理樣本中,還向細胞添加10μL1000ng/mL的IL1α。trFGF-18、阿那白滯素和IL1α均以完整HAM’sF12稀釋。培養孔中的最終體積用完整HAM’sF12調整至1mL。最終濃度為10ng/mLIL1α,100ng/mLtrFGF-18及100ng/mL阿那白滯素,總培養時間為八天。在4天后進行培養基完全更換。N=4。在IL1α處理后6小時施用阿那白滯素和trFGF-18的細胞:在24孔板上以15000細胞/孔在包含或不包含10ng/mLIL1α的1mL完整HAM’sF12中接種軟骨細胞。6小時候,移除培養基,并替換為0.25mL400ng/mL的trFGF-18和/或0.25mL400ng/mL的阿那白滯素。在處理樣本中,還向細胞添加0.25mL40ng/mL的IL1α。trFGF-18、阿那白滯素和IL1α均以完整HAM’sF12稀釋。培養孔中的最終體積用完整HAM’sF12調整至1mL。最終濃度為10ng/mLIL1α,100ng/mLtrFGF-18及100ng/mL阿那白滯素,總培養時間為八天。在4天后進行培養基完全更換。N=6。培養八天后,用accutase收集細胞,所得細胞懸浮液用ViCellTM細胞分析儀(購自BeckmanCoulter)分析細胞濃度和細胞活力。統計分析以單向ANOVA進行,并隨后進行Dunnett事后分析。結果和結論:與預計相同,在沒有IL1α的情況下,rhFGF18增加了豬軟骨細胞的增殖。與對照組(培養基,無IL1α)相比,在存在100ng/mLrhFGF18的情況下,在培養8天后,兩組實驗中的細胞數量均有11.25和7.75倍的增加(圖6)。但是,在存在10ng/mLIL1α的情況下,與對照組(培養基,IL1α,10ng/mL)相比,兩組實驗中由rhFGF18刺激的增殖僅分別為2.38和2.44倍。不管是直接施用還是延后施用,100ng/mL的阿那白滯素都能完全恢復rhFGF18的活性。用不含IL1α的rhFGF18培養的細胞的細胞密度與用IL1α處理但施用了阿那白滯素的細胞的細胞密度并無顯著差別。最后,單獨使用阿那白滯素對軟骨細胞的增殖沒有效果。本研究證實,100ng/mL的阿那白滯素完全阻斷了IL1α對rhFGF18的增殖活性的抑制。這與以下事實一致:阿那白滯素是IL1受體拮抗劑,其阻斷由IL1引發的炎癥信號。本研究證實了阿那白滯素能夠恢復用IL1α處理的豬軟骨細胞中的rhFGF18的增殖效果。實施例5方法:雄性Lewis大鼠接受手術以在右膝關節中誘導內側半月板撕裂。在第21、28、和35天對動物關節內施用FGF-18(10μg/每個關節),并在第21-23、28-30、和35-37天口服施用雙氯芬酸(1mg/kg或3mg/kg)或賦形劑,然后在第42天或第63天處死動物。收集血清并在第-3、21、42、和63天評估血清的α2巨球蛋白(α2MG)水平。α2MG是一種炎癥血清生物標記物。α2MG與炎癥之間的關聯已被證實(Kuribayashi等,2013)。結果:FGF-18+賦形劑對照組在第24天發生輕微至溫和腫脹,并在第36天之前增大為嚴重腫脹,但未見跛行。膝部腫脹從第44天開始輕微減小至相當嚴重。卡尺測量支持上述結果,在第21天及其后的時間點,右膝與左膝之間有顯著的差別,但在基線則沒有顯著差別。與賦形劑對照組相比,施用了3mg/kg雙氯芬酸的動物在第24-29、31、和36-43天的腫脹分數明顯較低。膝部卡尺測量結果在第42天明顯較低,但在其他時間點則不受顯著影響。與賦形劑對照組相比,施用了1mg/kg雙氯芬酸的動物在第24-29、31、和36-43天的腫脹分數明顯較低。膝部卡尺測量結果在第42天明顯較低,但在其他時間點則不受顯著影響(數據未示出)。第-3天(手術前)的α2MG水平高于手術后的第21天。在手術前的時間點,與賦形劑對照組相比,施用3mg/kg雙氯芬酸的動物中的水平輕微但顯著地較低。在治療前的第21天,所有組中的水平基本相同。在第42天,疾病對照組中的α2MG水平明顯升高(約為第21天的水平的四倍),這明顯有別于兩個雙氯芬酸組。在第63天,所有組的水平又變得接近。(圖7)結論:總的來說,基于臨床觀測和卡尺測量的結果,本研究的結果顯示,在具有內側半月板撕裂并施用了FGF-18的大鼠中施用1或3mg/kg的雙氯芬酸顯著地減少了膝部腫脹。上述效果在最后一次施用雙氯芬酸后可持續約一周。在第-3、21、和63天,血清的α2MG水平與賦形劑對照組接近,但在第42天由于對照組的水平急劇上升而顯著較低。實施例6方法:本研究的目的是評估在相同的sprifermin總劑量下(3x1μg),不同的周期內給藥頻率對大鼠OA模型中的軟骨體積的影響。以實施例1中所述的方法進行前交叉韌帶切斷(ACLT)與內側半月板切除(tMx)。本研究施用來自ListerHooded大鼠(200–260g,CharlesRiver)的關節。動物在手術后18周處以安樂死。研究了關節中的變化與OA臨床評估(軟骨損失、骨贅、軟骨下硬化)的相關性。每周、每2周、每3周、每4周或每5周注射鹽水中的1μgsprifermin,共注射三次,并與適當的賦形劑組比較。每周研究體重、關節直徑和臨床健康分數。結果結果顯示,關節內注射對體重增加無影響:藥物或治療方案對生前(in-life)參數未見影響。但是,每兩周注射鹽水的組(n=4)具有最高的體重增加趨勢(數據未示出)。在第3、4和5周進行注射的組的關節直徑顯著大于在第3、8和13周進行注射的組(見圖8)。在每2周、每3周或每4周進行注射的組之間則未見顯著差別。在每5周進行注射的組中,關節直徑的AUC與鹽水注射相同。因此,就趨勢而言,關節直徑AUC隨著注射頻率降低而減小。體視學定量組織學分析揭示受影響的關節中有嚴重的類似OA的變化。rhFGF18基本上阻止了軟骨的完全脫落。1μg/每個關節以及每3周一次的注射(共三次注射)導致與鹽水相比在藥學上有意義及統計上顯著的差別(終點:脛骨內側的軟骨體積,見圖9)。結論:低于每周一次連續三周的注射頻率似乎使得注射后的關節腫脹能更好地恢復。所有施用了rhFGF18的組都顯示了結構上的改善,表現為與安慰劑相比較大的軟骨體積值。但是,在研究時間固定(所有動物的研究時間相同)和劑量固定的情況下,每3周一次的注射頻率取得的結構上的改善是最大的。可以推測,rhFGF18的注射之間較長的間隔是更為有益的,因為與每周一次連續三周的注射方案相比,軟骨細胞的增殖可更好地轉化成細胞外基質的生成。所得的鐘形曲線是生長因子的的療效測試結果中常見的。參考文獻1.Ellsworth等,2002,OsteoarthritisandCartilage,10:308-3202.Shimoaka等,2002,JBC277(9):7493-75003.WO20080230634.WO20040328495.WO98166446.WO20060633627.Custers等,2007,OsteoarthritisandCartilage,15:1241-12488.Lotz,2010,Arthritisresearchtherapy,12:2119.Moore等,2005,OsteoarthritisandCartilage,13:623-631.10.Arnaud-Dabernat等,2008,JournalofCellularPhysiology,216:261-268.11.TheMerckmanual,第17版,199912.Getgood等,2010,P116,ICRSMeeting2010,Barcelona.13.ICRS出版物:http://www.cartilage.org/_files/contentmanagement/ICRS_evaluation.pdf,第13頁14.Bingham,2002,J.Rheumatol.29:3-9.15.Lee等,2013,Gene,527:440-447.16.Bresnihan,2002,Ann.Rheum.61:ii74-ii7717.St.Clair,2002,J.Rheumatol.29:22-26,18.Mertens等,2009,,J.Rheumatol.,36(6):1118-112519.Chevalier等,2009,Arthritis&Rheumatism,61(3):344-35220.Kuribayashi等,2013,Inflammation,36(6):1448-52當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1