用于治療和預防肺部炎癥的包含環糊精和布地奈德衍生物的組合物的制作方法
本申請案之有關專利案有:美國臨時申請號61/972209案,申請日為2014年3月28日,名稱為“具有布地奈德衍生物的環糊精的組合物和方法”,其整體被并入本文中作為參考,如同完全在此之所述,且本申請案也有關專利案:歐洲申請號EP14132158 BE 28.03 2014,名稱為“用于治療和預防肺部炎癥性疾病的具有布地奈德衍生物的環糊精的組合物”,由列日大學(Université de Liège)所交付且被分配給公開號EP14162158.1。
本發明涉及新穎的和有用的藥物組合物,其以環糊精化合物和布地奈德衍生物來配制,用于治療和/或預防肺部炎癥性疾病。本發明還涉及一種新穎的和有用的分析技術,用來檢測和定量HP-β-CD在溶液中的量。更具體地,本發明涉及驗證的1H NMR分析的使用,其用于直接在藥物制劑中檢測和定量環糊精的量,而不需任何用于液體制劑的萃取或分離的步驟。
背景技術:
肺部炎性疾病(PID)的疾病狀態特征是不完全可逆的氣流限制。氣流限制與肺部的異常的炎癥反應有關,例如,有害粒子(細粒子,如在煙霧和霾中之所見,其直徑為2.5微米或更小)。
肺部炎性疾病包括炎癥性哮喘,即嚴重階段的哮喘、慢性阻塞性肺病(COPD)、如慢性支氣管炎、阻塞性細支氣管炎、肺氣腫、肺纖維化、囊性纖維化等。
PID患者的支氣管壁有顯著的嗜中性粒細胞炎癥,其系因蛋白酶和氧化劑(氧反應性物質)的重復產生而導致氣道結構產生進行性的破壞。迄今為止,市售的治療劑不能適當減少或防止PID患者的這種嗜中性粒細胞炎癥。尤其是,眾所周知,吸入或口服類固醇顯示出對嗜中性粒細胞炎癥并沒有效率。例如,S.Culpitt等人對COPD患者所進行的研究:Am J Respir Crit Care Med.160:1635-1639(1999),其顯示出高劑量的吸入類固醇對于COPD相關的嗜中性粒細胞炎癥及對嗜中性粒細胞的趨化劑(主要為人類的IL-8)并沒有效率。
鑒于PID患者當前的類固醇治療的無效性,故可以適當減少或防止PID患者的嗜中性粒細胞炎癥的有效的類固醇治療劑是有必要的。
技術實現要素:
簡言之,本發明利用新穎的和有用的藥物組合物來克服上述的與目前的PID患者使用類固醇治療的有關的不足與缺點,本發明可以有效地治療性地治療和/或預防對于需要這種治療的哺乳動物宿主的肺部炎癥性疾病。
一般而言,本發明涉及新穎的和有用的藥物組合物,其以環糊精化合物和布地奈德衍生物來配制,用于治療和/或預防肺部炎癥性疾病。本發明還涉及一種新潁的和有用的分析技術,用來檢測和定量HP-β-CD在溶液中的量。更具體地,本發明涉及驗證的1H NMR分析的使用,用于直接在藥物制劑中檢測和定量環糊精的量,而不需任何用于液體制劑的萃取或分離的步驟。本發明還涉及一種新穎的和有用的分析技術來檢測和定量溶液中的HP-β-CD。
本發明的新穎的組合物和方法,其包括以環糊精化合物和式(I)的布地奈德衍生物來配制的組合物,并使用它們來治療和/或預防需要這種治療的哺乳動物宿主的PID:
其中,R1和R2各自獨立地表示氫原子,鹵素、C1-5-烷基、C3-8-環烷基、羥基、C1-5-烷氧基、C1-5烷氧基-C1-5-烷基,選擇性地以單個或多個鹵原子置換的C1-5-烷基,C1-5-烷氧羰基或C1-5烷氧羰基-C1-6-烷基;R3、R4、R5和R6分別獨立地表示氫、羥基基團、C1-5-烷氧基、C1-5-烷氧羰基、羥羰基,選擇性地以單個或多個鹵原子置換的C1-5-烷羰基、C1-5-烷羰氧基、C3-8-環烷羰氧基、C1-5烷硫基、C1-5烷磺酰基、C1-5-烷亞磺酰基、呋喃、呋喃羰氧基,選擇性地以單個或多個鹵原子置換的C1-5-烷硫代羰基或丙氧甲基羰基;“R4”和“R5”選擇性地一起形成3至5個原子的烴環,2個碳原子選擇性地被替換為氧原子,且該環選擇性地被C1-5烷基所取代。例如,3至5個原子的雙-氧烴環,具有兩個碳原子被替換為氧原子,且選擇性地被烷基所取代,如丙基;或其具有藥學上可接受的酸或堿的鹽,或任何光學異構體或光學異構體的混合物,包括消旋混合物或其任何的互變異構形式,其用于治療和/或預防需要這種治療的哺乳動物宿主的肺部炎癥性疾病。
“C1-5-烷基”,如本文使用的,系指具有1-5個碳原子的直鏈或支鏈的飽和或未飽和的烴基,例如甲基、丙基、丁基、異戊基、1-甲丁基、1,2-二甲丁基、2-乙丁基等。
“C3-8-環烷基”,如本文使用的,系指具有3個或更多碳原子的飽和或部分不飽和的烴基環,較佳地為3至8個碳原子。環烷基的例子是環丙基、環丁基、環戊基、環己基等。
“C1-5-烷氧基”,也表示為C1-5-烷基氧基,如本文所使用的,系指包含經由醚氧連接的C1-5-烷基的直鏈或支鏈的單價取代基,其具有來自醚氧的游離價鍵且具有1至5個碳原子,如甲氧基、乙氧基、丙氧基、異丙氧基、丁氧基、仲-丁氧基、叔-丁氧基、2-甲基丁氧基、戊氧基等。
“C1-5-烷氧基-C1-5烷基”,如本文使用的,系指被氧原子中斷的2-10個的碳原子,例如-CH2-O-CH3、-CH2CH2O-CH3、-CH2-O-CH2CH3、-CH2-O-CH(CH3)2、-CH2CH2-O-CH(CH3)2、-CH(CH3)CH2-OCH3等。
“C1-5-烷硫基”,無論是單獨或結合,如本文中所使用的,系指包含經由二價硫原子連接的C1-5-烷基的直鏈或支鏈的單價取代基,其具有來自硫原子的游離價鍵且具有1至5個碳原子,如甲硫基、乙硫基、丙硫基、異丙硫基、丁硫基、戊硫基、3-甲戊硫基等。
“C1-5-烷基磺酰基”,如本文使用的,系指包含經由磺酰基(-S(=O)-)連接的C1-5-烷基的單價取代基,例如甲基磺酰基、乙基磺酰基、丙基磺酰基、異丙基磺酰基、丁基磺酰基、戊基磺酰基、2-甲基戊基磺酰基等。
“C1-5-烷基亞磺酰基”,如本文使用的,系指包含經由亞磺酰基(-S(=O))連接的C1-5-烷基的單價取代基,例如甲基亞磺酰基、乙基亞磺酰基、丙基亞磺酰基、異丙基亞磺酰基、叔-丁基亞磺酰基、戊基亞磺酰基、2-乙基丁基亞磺酰基等。
“呋喃”,如本文所使用的,系指:
“呋喃呋喃羰基氧基”,如本文所使用的,系指:
“鹵素”,如本文所使用的,系指氟、氯、溴或碘。
“R4”和“R5”,它們可選擇性地一起形成3至5個原子的烴環,其中兩個碳原子可選擇性地被氧原子所取代,且環可選擇性地被C1-5烷基取代,包括例如,3至5個原子的雙氧烴環,其中兩個碳原子可選擇性地被氧原子所取代,且可選擇性地被烷基取代,如1,3-二氧戊環-2-基)丙基,或
根據本發明的較佳的布地奈德衍生物是由通式(I)所表示的糠酸莫米松或糠酸氟替卡松,其分別在R3或R4具有呋喃羰基氧基,如下圖之所示:
糠酸莫米松可購自輝瑞和默克(Pfizer and Merck),而糠酸氟替卡松可購自GSK。
根據本發明的其他較佳的布地奈德衍生物是由通式(I)所表示的丙酸氟替卡松或二丙酸倍氯米松,其在R4中具有至少丙羰氧基或丙酸基,如下圖之所示:
丙酸氟替卡松可購自GSK,其商品名為輔舒酮(Flixotide),而二丙酸倍氯米松可購自UCB,SANDOZ,TEVA和CHIESI,其商品名為QVAR,Ecobec和Beclophar。
依據本發明,最佳的布地奈德衍生物是布地奈德。布地奈德是皮質類固醇,由通式(I)所表示:
布地奈德,也稱為(R,S)-11(3,16a,17,21-四羥基孕甾-1,4-二烯-3,20-二酮環16,17-乙縮醛丁醛或16,17-(亞丁基雙(氧))-11,21-二羥基-,(11-β3,16-a)-孕甾-1,4-二烯-3,20-二酮,布地奈德的化學式,分子量和CAS編號分別是C25H34O6,MW:430.5和51333-22-3。
布地奈德是消旋物,包括兩個非對映體22R和22S的混合物,且商業上以兩種異構體(22R和22S)的混合物被提供。
布地奈德溶液的商業制劑由AstraZeneca LP(Wilmington,Del.)提供。其商標為PulmicortAqua,而粉末形式的布地奈德的商標為Nasal Inhaler及Turbuhaler,且其為通用名稱。粉末形式的布地奈德(原料)由Indis(比利時)所提供。
倍他米松也被本發明所構想。如布地奈德,倍他米松也是皮質類固醇,由下面通式所表示:
倍他米松的IUPAC名稱是(8S,9R,10S,11S,13S,14S,16S,17R)-9-氟代-11,17-二羥基-17-(2-羥乙酰基)-10,13,16-三甲基-6,7,8,11,12,14,15,16-8氫環戊[a]菲-3-酮。布地奈德的化學式,分子量和CAS ID編號分別為C22H29FO5,392.461063克/莫耳和378-44-9。
倍他米松的不同的名稱包括Celestone,Rinderon Betadexamethasone及Flubenisolone。
氟替卡松是本發明所設想的另一種皮質類固醇,由下面通式所表示:
氟替卡松的IUPAC名稱是(6α,11β,16α,17α)-6,9-二氟-17-{[(氟甲基)硫代]羰基}-11-羥基-16-甲基-3-氧代雄甾-1,4-二烯-17-基-2-呋喃羧基。氟替卡松的化學式,分子量和CAS ID編號分別為C27H29F3O6S,538.576克/莫耳和80474-14-2。
環糊精已知是淀粉被細菌降解而產生的環狀寡糖。環糊精包括6個、7個或8個α-D-吡喃葡萄糖苷單位,并相應地被命名為α、β或γ環糊精。
根據本發明的環糊精化合物包括環糊精本身,烷基-環糊精(R-CD),其中“R”是甲基、乙基、丙基或丁基;羧烷基-環糊精(CR-CD)、醚化-環糊精(RO-CD)、羥基烷基-環糊精(HR-CD)、葡糖基-環糊精、二和三甘油酯-環糊精或它們的組合和它們的藥學上可接受的鹽,約25℃時其在水中溶解的量至少約0.5克/100毫升。
本發明所使用的較佳的水溶性環糊精化合物,其水溶解度至少是β-環糊精的水溶解度(約1.85克/100毫升)。這種水溶性環糊精化合物的例子包括羥丙基環糊精,麥芽糖環糊精及其鹽。特別是,羥丙基-β-環糊精、麥芽糖基-β-環糊精,和它們的衍生物是較佳的。
根據本發明的其它的較佳的環糊精化合物包括甲基環糊精(環糊精甲基化的產品),如2-O-甲基β環糊精;二甲基環糊精(DIMEB)(較佳地在2和6中被取代)、三甲基環糊精(較佳地在2、3和6中被取代)、“隨機甲基化的”環糊精(RAMEB或RM)(較佳地在2,3和6中隨機地被取代,但每單位的吡喃葡萄糖具有的甲基),羥丙基環糊精(HPCD),較佳地在2,和3位置隨機地被取代的羥丙基化環糊精(HP-βCD,HP-γCD),羥乙基-環糊精,羧甲基乙基環糊精,乙基環糊精,其利用在羥基的氫碳化鏈接枝所得到的兩性環糊精且能夠形成納米顆粒,利用單胺化環糊精(具有間隔臂)接枝所得到的膽固醇環糊精和甘油三酯環糊精,如治療藥物載體系統中的述評,Stephen D.Bruck Ed,環糊精-啟用輔料;它們目前和將來的藥物的用途,D.Thomson,Volume 14,Issue 1p1-114(1997)中之所述,其全部被引入本文中作為參考。
根據本發明最佳的環糊精化合物包括具有選擇性地接枝在吡喃葡萄糖單位的化學功能的β環糊精,如羥丙基β環糊精(HPβCD)、-β-環糊精(SBEβCD)、隨機甲基化-β-環糊精(RMβCD)、二甲基-β環糊精(DIMEβCD)、三甲基-β-環糊精(TRIMEβCD)、羥丁基-β-環糊精(HBβCD)、葡糖基-β-環糊精、麥芽糖基-β-環糊精、2-O-甲基-β-環糊精(Crysmeb)和它們的藥學上可接受的鹽,以及它們的任意組合。
根據本發明的最佳的環糊精化合物是羥丙基-β-環糊精(上文或下文也稱為HP-β-CD或HP-β-CD)。
根據本發明的環糊精化合物是經由公知的淀粉的酶降解,如J Szejtli,Kluwer學術出版社1998年,第1-78頁的環糊精技術之所述,其全部被引入本文中作為參考,隨后經由適當的化學基的接枝所產生。它們可購自Roquette(法國)。
最佳的藥物組合物包含約1-1至約1-100摩爾比,較佳地約1∶75,且最佳地約1∶50的布地奈德衍生物及環糊精化合物。布地奈德/羥丙基β環糊精的比較佳地為約1∶50的摩爾比。
根據本發明的包含環糊精化合物和布地奈德衍生物的藥物組合物,可以經由將粉末形式的過量的布地奈德衍生物加入到足夠量的環糊精的液體溶液中來制備。液體環糊精溶液是水基或水-醇基或例如乙醇的醇溶液。布地奈德衍生物和環糊精化合物于室溫下連續攪拌混合。過量的布地奈德衍生物可經由過濾除去。
兩種成分被秤重,以得到介于約1∶1500至約1∶2的重量濃度比,較佳為約1∶60的重量濃度比的布地奈德衍生物和環糊精混合物。
隨后,液體混合物以本領域的適當的公知技術在霧化期間被干燥,以產生微粒化干燥粉末。在此情況,藥物組合物還可以包括藥學上可接受的賦形劑,例如,如乳糖、硬脂酸鎂、甘露糖醇、多元醇、亮氨酸衍生物等的載體。
液體混合物也可以如混合步驟的液體溶液中的環糊精的相同的濃度,被加入等滲緩沖劑中的環糊精中,以產生液體溶液的藥物組合物。
在液體溶液中的藥物組合物也可以含有公知的藥學上可接受的賦形劑,如等滲緩沖劑,防腐劑,溶劑或粘度調節劑和輔助物質。合適的等滲緩沖系統系基于磷酸鈉(PBS),醋酸鈉或硼酸鈉,如下面資料之所述:
http://bio.lonza.com/uploads/tx_mwaxmarketingmaterial/Lonza_BenchGuides_Phosphate_Buffered_Saline_PBS.pdf.
防腐劑可以被加入,以防止藥物組合物在使用過程中的微生物污染。合適的防腐劑是,例如,苯扎氯銨、氯丁醇,對羥基苯甲酸甲酯,對羥基苯甲酸丙酯、苯乙醇、山梨酸。此類防腐劑通常以從約0.01至約1%重量/體積的量被使用。
合適的輔助物質和藥學上可接受的鹽被描述于Remington的醫藥科學,第16版,1980,Mack出版公司,由Oslo等人編輯,其全部被引入本文以作為參考。
一般,合適量的藥學上可接受的鹽被用于本發明的藥物組合物中,以使組合物具有等滲性。藥學上可接受的物質的例子包括生理鹽水、林格氏液(Ringer′s solution)和葡萄糖溶液。
依據本發明,溶液的pH值較佳地為由約5至約8,而更佳地為由約7至約7.5。
根據本發明的藥物組合物可用于治療和/或預防需要這種治療的哺乳動物宿主的肺部炎癥性疾病,較佳地是對于慢性阻塞性肺疾病,如慢性支氣管炎、阻塞性細支氣管炎、肺氣腫、肺纖維化、囊性纖維化,而最佳地是對于煙草誘導的慢性阻塞性肺疾病和囊性纖維化疾病。
本發明的藥物組合物可以被配制成口服,胃腸道用或局部用的劑型,特別是氣霧或經鼻吸入給藥的劑型,給藥的局部用形式。本發明的藥物組合物之遞送可經由溶液,懸浮液,如微粉化的粉末混合物等。另外,本發明的藥物組合物之施用可以經由例如,噴霧器,計量劑量吸入器或干粉吸入器,或設計用于這類局部施用的任何其他設備。
根據本發明的藥物組合物其可以施用的劑量范圍為由每天約0.05至約1000微克,較佳地是由每天約0.1至約500微克,尤其是在由每天約50至約200微克的范圍。
本發明所設想的較佳的藥物組合物是包含在液體溶液中的布地奈德和環糊精,最佳地是布地奈德和HP-β-環糊精。
本發明所設想的最佳的藥物組合物是包含在液體溶液中的布地奈德和環糊精,其中布地奈德的濃度大約為100微克/毫升而在等滲緩沖液中的HP-β-環糊精約20毫莫耳/升。
根據本發明的藥物組合物是環糊精化合物與布地奈德衍生物的組合,最佳地是化學計量比為約1∶1或約2∶1的布地奈德衍生物-環糊精化合物的復合物。尤其是化學計量比為約1∶1的布地奈德與HP-β-環糊精的復合物。
本發明進一步針對以下的內容:
(1)一種藥物組合物,其包含環糊精化合物和式(I)的布地奈德衍生物:
其中,“R1”和“R2”各自獨立地表示氫原子、鹵素、C1-5-烷基、C3-8-環烷基、羥基、C1-5-烷氧基、C1-5烷氧基-C1-5-烷基,選擇性地以單個或多個鹵原子置換的C1-5-烷基、C1-5-烷氧羰基、C1-5烷氧羰基-C1-6-烷基;
“R3”,“R4”,“R5”和“R6”分別獨立地表示氫、羥基、C1-5-烷氧基、C1-5-烷氧羰基、羥羰基,選擇性地以單個或多個鹵原子置換的C1-5-烷羰基、C1-5-烷羰氧基、C3-8-環烷羰氧基、C1-5烷硫基、C1-5烷磺酰基、C1-5-烷亞磺酰基、呋喃、呋喃羰氧基,選擇性地以單個或多個鹵原子置換的C1-5-烷硫代羰基;及
“R4”和“R5”選擇性地一起形成3至5個原子的烴環,2個碳原子選擇性地被氧原子替換,且該環選擇性地被C1-5烷基所替換或其具有藥學上可接受的酸或堿的鹽,或任何光學異構體或光學異構體的混合物,包括消旋混合物或其任何的互變異構形式,其用于治療和/或預防需要這種治療的哺乳動物宿主的肺部炎癥性疾病。
(2)依據項目1的藥物組合物,其中,布地奈德衍生物/環糊精化合物的重量濃度比為約1∶1500至約1∶2。
(3)依據項目1的藥物組合物,其中所述的布地奈德衍生物/環糊精化合物的重量濃度比為約1∶60。
(4)依據項目1-3任一項的藥物組合物,其中,布地奈德衍生物選自下列化合物組成之群組:糠酸莫米松、氟替卡松、糠酸氟替卡松、丙酸氟替卡松、倍他米松、丙酸倍他米松、倍氯米松、布地奈德或它們的組合和它們的藥學上可接受的鹽或酯。
(5)依據項目1-4任一項的包括布地奈德衍生物的藥物組合物,其中,R1,R2,R6是氫;R3是羥基乙酮基而R4與R5形成1,3-二氧戊環-2-基)丙基或
(6)依據項目1-4任一項的包括布地奈德衍生物的藥物組合物,其中,R1是氫,R2是Cl,R3是呋喃羧基,R4是氯甲基羧基而R5和R6是氫(糠酸莫米松)。
(7)依據項目1-4任一項的包括布地奈德衍生物的藥物組合物,其中,R1和R2是氟,R3是氟甲基硫羰基,R4是呋喃羧基而R5和R6是氫(糠酸氟替卡松)。
(8)依據項目1-4任一項的包括布地奈德衍生物的藥物組合物,其中,R1和R2是氟,R3是氟甲基硫羰基,R4是丙基羧基而R5和R6是氫(丙酸氟替卡松)。
(9)依據項目1-4任一項的包括布地奈德衍生物的藥物組合物,其中,R2是氯,R1,R5和R6是氫,R3是丙酰基氧甲基羰基而R4是丙基羰基氧基
(10)依據項目1-9任一項的藥物組合物,其中,布地奈德衍生物與環糊精化合物以約1∶1的化學計量比形成復合物。
(11)依據項目1-10任一項的藥物組合物,其中,環糊精化合物具有至少約1.85克/100毫升的水溶解度。
(12)依據項目1-11任一項的藥物組合物,其中,環糊精化合物選自下列化合物組成的群組:
β-環糊精、羥丙基-β環糊精、無規甲基化-β環糊精、二甲基-β環糊精、三甲基-β環糊精、羥丙基-β環糊精、羥丁基-β環糊精、葡糖基-β環糊精、麥芽糖基-β環糊精、2-O-甲基-β環糊精或它們的組合,及它們的藥學上可接受的鹽。
(13)依據項目1-12任一項的藥物組合物,其中,環糊精化合物是羥丙基-β環糊精。
(14)依據項目1-13任一項的藥物組合物,其中,肺炎性疾病是慢性阻塞性疾病。
(15)用于預防性治療肺部炎性疾病的方法,其包括給予需要這種治療的患者有效劑量的依據項目1-14任一項的藥物組合物。
(16)用于治療性治療肺部炎性疾病的方法,其包括給予需要這種治療的患者有效劑量的依據項目1-14任一項的藥物組合物。
(17)依據項目15或16的治療方法,其中,環糊精化合物和布地奈德衍生物分別以約0.1毫克及約25毫克/劑量的標稱劑量被施用。
(18)用于治療肺部炎性疾病的患者需要的吸入系統,其包括依據項目1-14任一項的藥物組合物。
(19)一種藥物組合物,其包含約250微克/毫升的布地奈德和約20毫莫耳/升的HP-β-CD。
(20)一種藥物組合物,其包含約100微克/毫升的布地奈德和約20毫莫耳/升的HP-β-CD。
(21)一種藥物組合物,其包含約250微克/毫升的布地奈德和約10毫莫耳/升的HP-β-CD。
(22)一種藥物組合物,其包含約100微克/毫升的布地奈德和約10毫莫耳/升的HP-β-CD。
(23)一種藥物組合物,其包含約100微克/毫升的氟替卡松和約10毫莫耳/升的HP-β-CD。
(24)一種藥物組合物,其包含約40微克/毫升的氟替卡松和約10毫莫耳/升的HP-β-CD。
(25)一種藥物組合物,其包含約40微克/毫升的倍氯米松和約10毫莫耳/升的HP-β-CD。
(26)依據項目19-25任一項的藥物組合物,其中,藥物組合物是溶液。
(27)依據項目26的藥物組合物,其中,溶液具有由約5至約8的pH值。
(28)依據項目26的藥物組合物,其中,溶液具有由約7至約7.5的pH值。
(29)依據項目26的藥物組合物,其中,藥物組合物是溶液且溶液被進行噴霧干燥以生成粉末。
(30)依據項目29的藥物組合物,其中,粉末包含約3微米的顆粒。
(31)一種藥物組合物,其包含布地奈德衍生物和輸送布地奈德衍生物的環糊精,其分子劑量的范圍由約0.05至約1000微克。
(32)一種藥物組合物,其包含布地奈德衍生物和輸送布地奈德衍生物的環糊精,其分子劑量的范圍由約0.1至約500微克。
(33)一種藥物組合物,其包含布地奈德衍生物和輸送布地奈德衍生物的環糊精,其分子劑量的范圍每日由約50至約200微克。
(34)依據項目31-33任一項的藥物組合物,其中,布地奈德衍生物是布地奈德而環糊精化合物是HP-β-CD。
(35)依據項目31-33任一項的藥物組合物,其中,布地奈德衍生物是倍他米松而環糊精化合物是HP-β-CD。
(36)依據項目31-33任一項的藥物組合物,其中,布地奈德衍生物是氟替卡松而環糊精化合物是HP-β-CD。
(37)依據項目31-33任一項的藥物組合物,其中,布地奈德衍生物是倍氯米松而環糊精化合物是HP-β-CD。
(38)一種藥物組合物,其包含化學計量比為約1∶1至約2∶1的布地奈德衍生物和環糊精化合物的復合物。
(39)一種藥物組合物,其包含化學計量比為約1∶1的布地奈德衍生物和環糊精化合物的復合物。
(40)依據項目38-39任一項的藥物組合物,其中,布地奈德衍生物是布地奈德而環糊精化合物是HP-β-CD。
(41)依據項目38-39任一項的藥物組合物,其中,布地奈德衍生物是氟替卡松而環糊精化合物是HP-β-CD。
(42)依據項目38-39任一項的藥物組合物,其中,布地奈德衍生物是倍氯米松而環糊精化合物是HP-β-CD。
(43)用于治療需要這種治療的哺乳動物宿主的肺部炎性疾病的方法,該方法包括
將依據項目1-14、19-42和58任一項的藥物組合物給予該哺乳動物宿主。
(44)用于減少需要這種治療的哺乳動物宿主的肺組織中的炎性細胞的方法,該方法包括
將依據項目1-14、19-42和58任一項的藥物組合物給予該哺乳動物宿主。
(45)用于減少需要這種治療的哺乳動物宿主的肺組織中的臭氧誘導的KC的產生的方法,該方法包括
將依據項目1-14、19-42和58任一項的藥物組合物給予該哺乳動物宿主。
(46)用于減少需要這種治療的哺乳動物宿主的肺組織中的IL-13的方法,該方法包括
將依據項目1-14、19-42和58任一項的藥物組合物給予該哺乳動物宿主。
(47)用于減少需要這種治療的哺乳動物宿主的支氣管高反應性的方法,該方法包括
將依據項目1-14、19-42和58任一項的藥物組合物給予該哺乳動物宿主。
(48)用于減少需要這種治療的哺乳動物宿主的IL-17水平的方法,該方法包括
將依據項目1-14、19-42和58任一項的藥物組合物給予該哺乳動物宿主。
(49)用于減少需要這種治療的哺乳動物宿主的CXCL-1水平的方法,該方法包括
將依據項目1-14、19-42和58任一項的藥物組合物給予該哺乳動物宿主。
(50)用于減少哺乳動物宿主的肺組織中嗜中性粒細胞的方法,該哺乳動物宿主在暴露香煙煙霧后需要這種治療,該方法包括
將依據項目1-14、19-42和58任一項的藥物組合物給予該哺乳動物宿主。
(51)用于檢測和定量含有活性成分和HP-β-CD的組合物中的HP-β-CD,而組合物不需任何的分離或萃取的步驟,其中,HP-β-CD包含在其上的羥基基團,該方法包括:
使用HP-β-CD上的羥基基團的1H NMR的分析,來檢測和量化組合物中的HP-β-CD。
(52)依據項目51的方法,其中,組合物是溶液。
(53)依據項目51或52的方法,其中,活性成分是布地奈德。
(54)依據項目51或52的方法,其中,布地奈德衍生物是布地奈德。
(55)依據項目51或52的方法,其中,布地奈德衍生物是氟替卡松。
(56)依據項目51或52的方法,其中,布地奈德衍生物是倍氯米松。
(57)依據項目51或52的方法,其中,布地奈德衍生物是倍他米松。
(58)如權利要求38-39中任一項所述的藥物組合物,其中,該布地奈德衍生物是倍他米松且該環糊精化合物為HP-β-CD。
下列例子,參考文獻,和圖式被提供以幫助本發明的理解。可以理解到,所述之程序可以被修改而不背離本發明。
附圖說明
本發明的上述和其它目的,優點和特征,及完成這些的方式,考慮以下附圖和例子將變得更加明顯,其中:
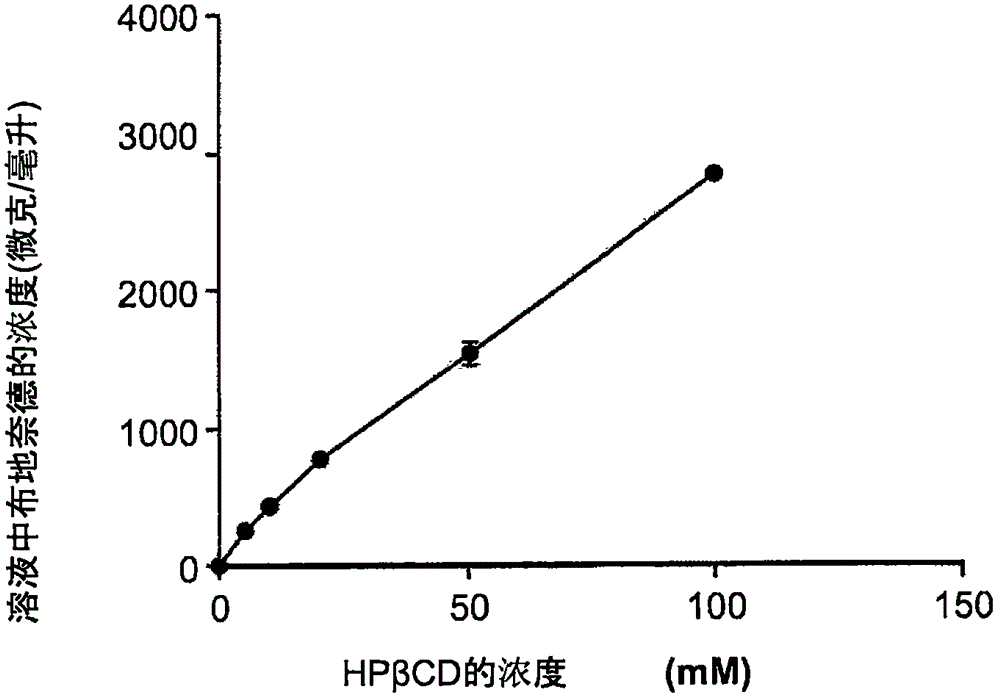
圖1顯示布地奈德在HP-β-環糊精(HP-β-CD)的濃度增加的水溶液中的溶解度;
圖2顯示氣道阻塞和炎癥的模型:組織學檢查所測的支氣管周圍炎癥的評分;
圖3顯示在肺的蛋白萃取物中所測定的IL-13的水平;
圖4顯示COPD模型:組織學檢查所測的支氣管周圍炎癥的評分;
圖5顯示氣道反應性的測量:對接受安慰劑或治療后的小鼠所測量的增強暫停(Penh)
圖6顯示暴露臭氧的小鼠的肺蛋白萃取物中利用ELISA(酶聯免疫吸附)所測定的IL-17;
圖7顯示暴露臭氧的小鼠的肺蛋白萃取物中利用ELISA(酶聯免疫吸附)所測定的IL-13;
圖8顯示暴露臭氧的小鼠的肺蛋白萃取物中利用ELISA(酶聯免疫吸附)所測定的KC(CXL1)
圖9顯示布地奈德-環糊精對BALF的嗜中性粒細胞百分比的影響;
圖10顯示含有布地奈德衍生物和環糊精的復合物中的布地奈德-羥丙基-β-環糊精復合物的1H-NMR譜(圖10a),相比于只有羥丙基-β-環糊精的基準的1H--NMR譜(圖10b);
圖11顯示含有布地奈德衍生物和環糊精的復合物中的布地奈德-羥丙基-β-環糊精復合物的1D-COSY-NMR譜。
圖12顯示HP-β-CD中的化學結構;
圖13顯示水中的HP-β-CD(δ0.6-1.5)的1H-NMR譜;
圖14顯示考慮加權(1/X)的二次回歸所得到的精確度曲線;
圖15顯示暴露于LPS的動物的在BALF中的嗜中性粒細胞的計數,該動物經安慰劑,布地奈德懸浮液和羥丙基-β-環糊精-布地奈德復合物的處理;
圖16顯示暴露于LPS的小鼠的炎癥評分;;
圖17顯示暴露于LPS的小鼠的炎癥評分;
圖18顯示暴露于LPS的動物的在BALF中的嗜中性粒細胞的計數的%,該動物經安慰劑,Crysmeb-二丙酸倍他米松復合物和100微克/毫升的倍他米松懸浮液的處理;
圖19顯示暴露于LPS的動物的在BALF中的嗜中性粒細胞的計數,該動物經安慰劑,Crysmeb-二丙酸倍他米松復合物和100微克/毫升的倍他米松懸浮液的處理;
圖20顯示暴露于LPS的小鼠的炎癥評分,該小鼠經安慰劑,2倍濃度的二丙酸倍他米松或二丙酸倍他米松-Crysmeb復合物的處理;及
圖21顯示暴露于LPS的動物的在BALF中的嗜中性粒細胞的計數,該動物經安慰劑,
丙酸氟替卡松懸浮液和羥丙基-β-環糊精-丙酸氟替卡松復合物的處理。
具體實施方式
現在將提供本發明各種實施例的例子來說明本發明,但它們并非用來限制本發明。其中的份數和百分比均以重量計,除非另有規定。
例1
布地奈德與HP-β-環糊精的溶液的藥物組合物
布地奈德購自Indis(比利時)而羥丙基-β-環糊精購自Roquette(法國)。約250微克/毫升的商用布地奈德懸浮液購自AstraZeneca(瑞典)。
圖1中,溶液的藥物組合物的制備系將過量的粉末狀的布地奈德加入至約5、約10、約25、約50、及約100毫莫耳/升(mM)的環糊精水溶液(使用Karl-Fischer滴定儀將水加入所計算的,準確稱取適量的環糊精以得到所要的體積莫耳濃度)。混合過程需要在室溫下以約350rpm(轉/分)的轉速連續攪拌約24小時來完成。利用0.22μm(微米)的過濾器過濾所得混合物以除去過量的布地奈德。溶液中的布地奈德的濃度以驗證過的高效液相色譜法(HPLC)來證實,然后混合物用PBS-環糊精溶液(約5、約10、約25、約50及約100毫莫耳/升(mM)的以前相同的精確濃度)來稀釋,以達到體內測試所要求的布地奈德的濃度。在這樣的濃度,例如,約100微克/毫升或約250微克/毫升,布地奈德可溶于水/PBS中,藥物組合物是呈現澄清且透明的吸入性溶液。
例1a:具有約100微克/毫升(μg/ml)的布地奈德和約10毫莫耳/升(mM)的HP-β-CD
較佳的吸入性溶液的藥物制劑包含約100微克/毫升的布地奈德和約10毫莫耳/升的羥丙基β-環糊精。溶液的制備系將約0.6979克的5%水(校正的含水量)的HP-β-CD溶解在約50毫升的純化的,無熱原的水(或無菌PBS)中,加入過量的布地奈德且在室溫下以約350rpm(轉/分)的轉速攪拌約24小時。利用0.22μm(微米)的過濾器除去過量的布地奈德。利用驗證過的高效液相色譜法(HPLC)來證實所得的溶液。然后以約10mM的HP-β-CD溶液(在PBS或水中)來稀釋所得的溶液,以達到約100微克/毫升的濃度的布地奈德。添加氯化鈉以達到等滲性。較佳地,最終的溶液利用0.22微米的聚丙烯膜或蒸汽滅菌過程來過濾滅菌。
例1b:具有約100微克/毫升(μg/ml)的布地奈德和約20毫莫耳/升(mM)的HP-β-CD
第二個較佳的吸入性溶液的藥物制劑包含約100微克/毫升的布地奈德和約20毫莫耳/升的羥丙基β-環糊精。溶液的制備系將約1.3958克的5%水(校正的含水量)的HP-β-CD溶解在約50毫升的純化的,無熱原的水(或無菌PBS)中,加入過量的布地奈德且以約350rpm(轉/分)的轉速攪拌約24小時。利用0.22μm(微米)的過濾器除去過量的布地奈德。利用驗證過的高效液相色譜法(HPLC)來證實所得的溶液。然后以約20mM的HP-β-CD溶液(在PBS或水中)來稀釋所得的溶液,以達到約100微克/毫升的濃度的布地奈德。添加氯化鈉以達到等滲性。較佳地,最終的溶液利用0.22微米的聚丙烯膜或蒸汽滅菌過程來過濾滅菌。
例1c:具有約250微克/毫升(μg/ml)的布地奈德和約20毫莫耳/升(mM)的HP-β-CD
第三個較佳的吸入性溶液的藥物制劑包含約250微克/毫升的布地奈德和約20毫莫耳/升的羥丙基β-環糊精。溶液的制備系將約1.3958克的5%水(校正的含水量)的HP-β-CD溶解在約50毫升的純化的,無熱原的水(或無菌PBS)中,加入過量的布地奈德且以約350rpm(轉/分)的轉速攪拌約24小時。利用0.22μm(微米)的過濾器除去過量的布地奈德。利用驗證過的高效液相色譜法(HPLC)來證實所得的溶液。然后以約20mM的HP-β-CD溶液(在PBS或水中)來稀釋所得的溶液,以達到約250微克/毫升的濃度的布地奈德。添加氯化鈉以達到等滲性。較佳地,最終的溶液利用0.22微米的聚丙烯膜或蒸汽滅菌過程來過濾滅菌。
例1d:具有約100微克/毫升(μg/ml)的氟替卡松和約10毫莫耳/升(mM)的HP-β-CD
第四個較佳的吸入性溶液的藥物制劑包含約100微克/毫升的氟替卡松和約10毫莫耳/升的羥丙基β-環糊精。溶液的制備系將約0.6979克的5%水(校正的含水量)的HP-β-CD溶解在約50毫升的純化的,無熱原的水(或無菌PBS)中,加入過量的氟替卡松且在室溫下以約350rpm(轉/分)的轉速攪拌約24小時。利用0.22μm(微米)的過濾器除去過量的氟替卡松。利用驗證過的高效液相色譜法(HPLC)來證實所得的溶液。然后以約10mM的HP-β-CD溶液(在PBS或水中)來稀釋所得的溶液,以達到約100微克/毫升的濃度的氟替卡松。添加氯化鈉以達到等滲性。較佳地,最終的溶液利用0.22微米的聚丙烯膜或蒸汽滅菌過程來過濾滅菌。
例1e:具有約40微克/毫升(μg/ml)的氟替卡松和約10毫莫耳/升(mM)的HP-β-CD
第五個較佳的吸入性溶液的藥物制劑包含約40微克/毫升的氟替卡松和約10毫莫耳/升的羥丙基β-環糊精。溶液的制備系將約0.6979克的5%水(校正的含水量)的HP-β-CD溶解在約50毫升的純化的,無熱原的水(或無菌PBS)中,加入過量的布地奈德且在室溫下以約350rpm(轉/分)的轉速攪拌約24小時。利用0.22μm(微米)的過濾器除去過量的氟替卡松。利用驗證過的高效液相色譜法(HPLC)來劑量所得的溶液。然后以約10mM的HP-β-CD溶液(在PBS或水中)來稀釋所得的溶液,以達到約40微克/毫升的濃度的氟替卡松。添加氯化鈉以達到等滲性。較佳地,最終的溶液利用0.22微米的聚丙烯膜或蒸汽滅菌過程來過濾滅菌。
例1f:具有約40微克/毫升(μg/ml)的倍氯米松和約10毫莫耳/升(mM)的HP-β-CD
第六個較佳的吸入性溶液的藥物制劑包含約40微克/毫升的倍氯米松和約10毫莫耳/升的羥丙基β-環糊精。溶液的制備系將約0.6979克的5%水(校正的含水量)的HP-β-CD溶解在約50毫升的純化的,無熱原的水(或無菌PBS)中,加入過量的倍氯米松且在室溫下以約350rpm(轉/分)的轉速攪拌約24小時。利用0.22μm(微米)的過濾器除去過量的倍氯米松。利用驗證過的高效液相色譜法(HPLC)來劑量所得的溶液。然后以約10mM的HP-β-CD溶液(在PBS或水中)來稀釋所得的溶液,以達到約40微克/毫升的濃度的倍氯米松。添加氯化鈉以達到等滲性。較佳地,最終的溶液利用0.22微米的聚丙烯膜或蒸汽滅菌過程來過濾滅菌。
例2
氟替卡松與HP-β-環糊精的粉末狀的藥物組合物
較佳的吸入性溶液的藥物組合物包含約40微克/毫升(μg/ml)的來自ECIC的氟替卡松和約10毫莫耳/升(mM)的羥丙基β-環糊精。溶液的制備系將約0.6979克的5%水(校正的含水量)的HP-β-CD溶解在約50毫升的純化的,無熱原的水中,加入過量的氟替卡松且以約350rpm(轉/分)的轉速攪拌約24小時。利用0.22μm(微米)的過濾器除去過量的氟替卡松。利用驗證過的高效液相色譜法(HPLC)來劑量所得的溶液。然后以約10mM的HP-β-CD溶液(在PBS或水中)來稀釋所得的溶液,以達到約40微克/毫升的濃度的氟替卡松。最終的溶液在最佳條件下以ProCept噴霧干燥器-冷卻器進行噴霧干燥,以獲得合理的粉末產率(約>90%),其顆粒約3微米的大小。噴霧干燥的工藝系本領域技術人員所熟知。噴霧干燥器-冷卻器和其干燥過程述于Procept數據表或下面數據源:(http://www.procept.be/spray-dryer-chiller),其全部被并入本文以作為參考。
例3
例1的藥物組合物在氣道阻塞和炎癥的模型中的評估
3a:致敏性,過敏原的暴露和治療方案。
其中,IP系指腹腔內注射而BHR系指支氣管高反應性。
為了研究氣道炎癥的調節,約6至約8周齡的BALB/c小鼠在第0天(D0)和第7天(D7)經腹膜內注射約10微克的乳化在氫氧化鋁(Alumlnject;Perbio,Erembodegem,比利時)的卵白蛋白(OVA)(Sigma Aldrich,Schnelldorf,德國)。隨后,小鼠從第21天至第25天被暴露于過敏原,其系每日吸入超聲霧化器(Devilbiss 2000)所產生約1%的卵白蛋白(OVA)氣溶膠約30分鐘。從第18天至第24天小鼠接受約50微升的鼻內滴注,并于第26天被處死,如先前Cataldo等人所報導的:Am.J.Pathol.161(2):491-498(2002),其全部被并入本文作為參考。安慰劑組的小鼠被鼻內注射PBS。
材料和方法
6到8周齡的雄性小鼠C57BL/6購自Charles River(Koln,德國)并飼養在我們的設施。所有的動物實驗過程都經列日大學(University of Liège)的倫理委員會批準過。食物和水隨意供給。
材料
磷酸鹽緩沖鹽水(PBS)購自Lonza(Verviers,比利時),羥丙基-β-環糊精(羥丙基基團的取代度:0.62)購自Roquette(法國),布地奈德購自Indis(比利時)而250微克/毫升的商用布地奈德懸浮液購自AstraZeneca(瑞典)。乙酰甲膽堿購自Sigma-Aldrich(德國)。給小鼠施用的藥物為,根據上述例1a,將羥丙基-β-環糊精(約20毫摩爾/升)與布地奈德(約250微克/毫升)和布地奈德的懸浮液(約250微克/毫升)相混合而成。所有其它材料都是分析級的。無菌的,無熱原的,和等滲的環糊精衍生物-皮質類固醇溶液以不同的濃度被制備。利用鱟變形細胞溶解物(LAL)依FDA 35 2012的細菌內毒素檢測指南來檢測吸入性無菌水的溶液(<約0.5USP單位的內毒素/毫升)。
支氣管肺泡灌洗液(BALF)
在評估氣道反應性之后即刻,并在最后的過敏原暴露后約24小時,處死小鼠并進行支氣管肺泡灌洗,其系使用4次約1毫升的約0.05毫莫耳/升的PBS-EDTA(Calbiochem,Darmstadt,德國),如先前CataldoDD,Tournoy KG,VermaelenK等人所描述的:Am J Pathol.161(2):491-498(2002),其全部被并入本文作為參考。
BALF的上清液被收集用于蛋白質的評估,而細胞被用來計數不同的細胞。離心制備的細胞用蘇木精-伊紅((Diff-Quick,Dade,比利時)染色后依形態學標準來進行不同細胞的計數。用溫和的人工抽吸來收集細胞。支氣管肺泡灌洗液(BALF)經離心(在約4℃下以約1200轉/分的轉速進行離心約10分鐘)后,上清液備冷凍在約-80℃下,用來作蛋白質的評估,而細胞沉淀物則重新懸浮于約1毫升的約0.05毫莫耳/升的PBS-EDTA中。離心制備(細胞離心涂片器)的細胞用Diff-Quick(Dade,比利時)染色,之后進行不同細胞的計數。
肺組織學檢查和組織的處理
在BAL之后,胸腔被打開且左主支氣管被夾緊,左肺被切下并立即被冷凍在約-80℃下以進行蛋白提取。右肺被輸入4毫升的約4%的多聚甲醛,并包埋在石蠟中而用于組織的檢查。從石蠟切取約5微米厚的切片,并用蘇木精-依紅染色。支氣管周圍炎癥的程度以分數來評估,其系以支氣管周圍炎癥細胞的量化來計算,如先前CataldoDD,Tournoy KG,VermaelenK等人所描述的:Am J Pathol.161(2):491-498(2002)。當檢測不到炎癥細胞時,其值為0,當偶然有炎癥細胞時,其值為1,當大部分支氣管被薄層的炎癥細胞包圍(約1至約5個細胞)時,其值為2,而當大部分支氣管被厚層的炎癥細胞包圍(>約5個細胞)時,其值為3。因每只小鼠有6-8片的隨機選擇的組織切片被評分,炎癥分數可被表示為其平均值,且可以在群組之間進行比較。
如上所述,左肺被切下且立即被冷凍在約-80℃下,然后在液氮中使用Mikro-Dismembrator(Braun Biotech International,Gmbh Melsungen,德國)將其破碎,以形成一均質的粉末。此粉碎的肺組織于約4℃下在含有約2莫耳/升的尿素,約1莫耳/升的NaCl,和約50毫莫耳/升的Tris(pH值約7.5)的溶液中培育過夜,隨后在約16 000×g下離心約15分鐘以得到蛋白提取。
利用ELISA(duoset kit,R&D Systems,Abingdon,英國)并依制造商的說明來測定非匯集的肺蛋白樣品的IL-13的水平。
支氣管反應性的測定
小鼠經由腹膜內注射氯胺酮(約10毫克/毫升,Merial,Brussels,比利時)和甲苯噻嗪(約1毫克/毫升,VMD,Arendonk,比利時)的混合物(約200微升)而被麻醉。氣管切開術之進行系將20規格的聚乙烯導管插入氣管并圍繞其周圍將其綁扎,以避免泄漏和斷開。使用小動物呼吸機(SCIREQ,Montreal,加拿大)以每分鐘約250次呼吸的頻率及約10毫升/千克的潮氣量使小鼠換氣。呼氣末正壓設定在約2百帕。測量開始于機械通氣后約2分鐘。然后約1赫茲的振蕩的正弦曲線被施加到氣管套管,并可利用多重線性回歸來計算氣道的動態電阻,彈性度,和順從性。包含約0.5至約19.6赫茲之間的頻率范圍的約8-s的強迫振蕩信號的第二種操作可以作阻抗的測定,以評估組織的阻尼,組織的順應性,和組織的粘彈性。以下是基線肺功能的測量:將小鼠暴露于鹽水氣溶膠(PBS)中,之后,暴露于含有增加劑量(約3、約6、約9、約12克/升)的乙酰甲膽堿(ICN Biomedicals,Asse Relegem,比利時)的氣霧劑中。氣溶膠系利用超聲霧化器(SYST’AM,LS 2000,Dupont Medical,Rhode-Saint-Genèse,比利時)產生,且依照制造商的說明使用醫用空氣的偏流輸送到的吸氣線。各氣溶膠輸送約2分鐘,各氣溶膠輸送后,如上所述的測量周期是1分鐘的時間間隔。鋪露乙酰甲膽堿后的平均氣道阻力是挑戰期間所測量的主要參數。
統計分析
肺組織學檢查的水平的結果被表示為平均值+/-SEM,且利用變異的單向分析進行組與組之間的比較,其后進行Tukey后測。測試之執行系使用GraphPad Prism 5.顯著性水平:α=約0.05(95%信賴區間)。
藥理結果
圖2顯示組織學測定的支氣管周圍炎癥的評分,其系以安慰劑,約100微克/毫升的布地奈德,根據例1a的藥物組合物,和約250微克/毫升的布地奈德做檢查。
暴露于卵清蛋白的小鼠(安慰劑組)顯示其肺組織的炎性細胞數目有顯著的增加。相比于安慰劑組,暴露于約100微克/毫升的布地奈德和約10毫莫耳/升的HP-β-CD的復合物的小鼠顯示,其炎性細胞數目顯著減少。布地奈德(約100微克/毫升)-HP-β-CD(約10毫莫耳/升)復合物誘導出相同的炎癥,其低于較高濃度(約250微克/毫升)的單獨的布地奈德誘導出的炎癥,并且比相同濃度(100微克/毫升)的單獨的布地奈德更有顯著的效果。
圖3說明:在肺蛋白萃取物中所測的IL-13的水平。
使用Mikro-Dismembrator(Braun Biotech International,Gmbh Melsungen,德國)將肺粉碎。粉碎的肺組織于約4℃下在含約1莫耳/升的尿素溶液中培育過夜,用于蛋白萃取。上清液被貯存在約-80℃下,用于ELISA之檢測。
比起經約250微克/毫升的布地奈德-約10莫耳/升的環糊精處理過的小鼠,經約250微克/毫升的布地奈德處理過的小鼠,顯示其肺組織中有更高水平的IL-13。依類似方式,比起經約100微克/毫升的布地奈德-約10莫耳/升的環糊精處理過的小鼠,經約100微克/毫升的布地奈德處理過的小鼠,顯示有更高水平的IL-13。
例4
例1a、例1b和例1c的藥物組合物在COPD模型中的評估
兩種不同的小鼠模型被用來仿真慢性阻塞性肺疾病(COPD)。在第一個模型中,C57BL/6的小鼠暴露于高濃度的臭氧(O3)中,臭氧是高反應性氧化劑的空氣污染物。在動物模型中,吸入的臭氧會引起氣道炎癥(嗜中性粒細胞)和高反應性。第二個模型使用如香煙的煙草煙霧,其被認為是慢性阻塞性肺病的主要驅動物。暴露于香煙煙霧也會導致嗜中性粒細胞介導的氣道炎癥。臭氧和香煙是氧化壓力的強誘導劑,而這種壓力,如長期研究中所觀察到的,可能會導致慢性炎癥。
4.A臭氧模式
暴露于臭氧和治療方案
暴露于臭氧的經歷的示意性的說明報導如下:
在示意性的說明中,C57BL/6的小鼠在高濃度的臭氧(約2ppm)中暴露約3小時之前,首先接受約50毫升的鼻內注射作為前處理(第0天與第1天之間),(第2天和第4天之間)再接受約50毫升的鼻內注射,約3小時。小鼠在第5天被處死。安慰劑組的小鼠被注射PBS。
支氣管肺泡灌洗液(BALF)的分析,肺組織學的分析,支氣管反應性的測量,和統計的分析如先前例1(氣道炎癥和高反應性)之所述。非匯集的肺蛋白樣品的IL-17和KC(CXCL1)的水平,利用ELISA(duoset kit,R&D Systems,Abingdon,英國)并依照制造商的說明來測量。
藥理結果
圖4顯示經安慰劑,依據例1a的組合物和約250微克/毫升的布地奈德的組織學所測定的支氣管周圍炎癥的評分。相比其它組群,暴露于臭氧的小鼠(安慰劑組)顯示在其肺組織中的炎性細胞數目顯著增加。暴露于含有約100微克/毫升的布地奈德和約10毫莫耳/升的HP-β-CD的復合物所誘導出的相同炎性的細胞數目,少于暴露于只有較高濃度(約250微克/毫升)的布地奈德。
圖5顯示氣道反應性的測量:小鼠接受安慰劑或根據例1a制備的藥物組合物治療后,測量其增強暫停(Penh)。
相比于其它群組,接受乙酰甲膽堿挑戰的小鼠,其暴露于臭氧所誘導出的支氣管高反應性預期地顯著增加。相比于安慰劑組,含約100微克/毫升的布地奈德-約10毫莫耳/升的HP-β-CD的復合物誘導出的48克/升的乙酰甲膽堿的支氣管高反應性顯著減少。布地奈德(約100微克/毫升)-HP-β-CD(10毫莫耳/升)的復合物誘導出的相同的支氣管高反應性少于單獨使用較高濃度(約250微克/毫升)的布地奈德。
圖6顯示暴露于臭氧的小鼠的肺蛋白提取物經ELISA所測量的IL-17。
比較經HP-β-CD和單獨或組合的地奈德的不同的治療。藥物組合物系依照例1a來制備,其或是組合混合物(布地奈德-HP-β-CD)或是單獨的各活性化合物(約250微克/毫升的布地奈德或約10毫莫耳/升的HP-β-CD)在相同的PBS緩沖液溶液中。
相比于布地奈德(約250微克/毫升)治療的群組,含有約250微克/毫升或約100微克/毫升或約10微克/毫升的布地奈德和10毫莫耳/升的HP-β-CD的復合物誘導出的IL-17的水平有顯著下降。
IL-17的水平在暴露于臭氧后增加,且其可能參與臭氧引起的嗜中性粒細胞炎癥的發病機理。這是首次證明了經由吸入布地奈德-環糊精的復合物能夠減少臭氧誘導的IL-17的水平。
圖7顯示暴露于臭氧的小鼠的肺蛋白提取物的經由ELISA所測量的IL-13。
比較經HP-β-CD和單獨或組合的地奈德的不同的治療。藥物組合物系按照例1a來制備,其或是組合混合物(布地奈德-HP-β-CD)或是單獨的各活性化合物(約250微克/毫升的布地奈德或約10毫莫耳/升的HP-β-CD)在相同的PBS緩沖液溶液中。
相比于布地奈德治療的群組(約250微克/毫升),含有約250微克/毫升或約100微克/毫升或約10微克/毫升的布地奈德和10毫莫耳/升的HP-β-CD的復合物誘導出的IL-13的水平有顯著下降
先前已顯示IL-13可以經臭氧的暴露來調節,且其可以參與暴露于臭氧后的氣道功能障礙。請參見,例如,Williams S.,Nath P,Leung S,等人:Eur Respir J.32(3):571-8(2008年9月),其全部內容被并入本文作為參考。這是第一次顯示經由吸入含有布地奈德的化合物可以顯著降低臭氧誘導的IL-13的水平。相比于布地奈德治療的群組(約250微克/毫升),含有約250微克/毫升或約100微克/毫升或約10微克/毫升的布地奈德和10毫莫耳/升的HP-β-CD的復合物誘導出的IL-13的水平有顯著下降。因此,相比于吸入約250微克/毫升的布地奈德,吸入布地奈德-環糊精的復合物可以降低IL-13的水平。
圖8顯示暴露于臭氧的小鼠的肺蛋白提取物的經由ELISA所測量的KC(CXCL1)。
比較經HPβCD和單獨或組合的地奈德的不同的治療。藥物組合物系依照例1a來制備,其或是組合混合物(布地奈德-HP-β-CD)或是單獨的各活性化合物(約250微克/毫升的布地奈德或約10毫莫耳/升的HP-β-CD)在相同的PBS緩沖液溶液中。比較經HPβCD和單獨或組合的地奈德的不同的治療。藥物組合物系依照例1a來制備,其或是組合混合物(布地奈德-HP-β-CD)或是單獨的各活性化合物(約250微克/毫升的布地奈德或約10毫莫耳/升的HP-B-CD)在相同的PBS緩沖液溶液中。
相比于布地奈德的治療的群組(約250微克/毫升),含有約250微克/毫升或約100微克/毫升或約10微克/毫升的布地奈德和10毫莫耳/升的HP-β-CD的復合物誘導出的KC的水平有下降。
這是首次證明了CXCL-1可以經由吸入布地奈德的衍生物來減少,CXCL-1是細胞因子,其在暴露于刺激物或氧化劑后嗜中性粒細胞在支氣管壁起著關鍵性作用。減少臭氧誘導的KC的產生的僅是布地奈德-環糊精的復合物。
4.B香煙煙霧暴露的模型
暴露于香煙和治療方案
使用系統(Scireq,Montreal,加拿大)使C57BL/6的小鼠每周5天被暴露于10支香煙,期間共6周。小鼠每周5天接受約50微升的鼻內注射,期間共6周。小鼠在第43天被處死。安慰劑組小鼠,也被稱為假暴露的小鼠,被注射PBS。
支氣管肺泡灌洗液(BALF)的分析如先前例3(氣道阻塞和炎癥模型)之所述。
統計分析
支氣管肺泡灌洗液中的炎癥細胞的數目的結果被表示為平均值+/-SEM,且使用Mann-Whitney檢驗來執行組間的比較。使用GraphPad Prism 5.來執行測試。P值<0.05被認為是顯著的。
藥理結果
在本實驗中,依照例1b和1c的藥物組合物被用作特定的吸入溶液,其包括:
·約100微克/毫升的布地奈德和約20毫莫耳/升的羥丙基-β-環糊精(例1b)
·約250微克/毫升的布地奈德和約20毫莫耳/升的羥丙基-β-環糊精(例1c)
將它們用來與單獨的約500微克/毫升的布地奈德的溶液做比較。
圖9顯示布地奈德-環糊精的混合物對于在BALF中的嗜中性粒細胞百分比的影響。
表1:在肺泡灌洗液中的嗜中性粒細胞百分比(+/-SEM)表1:在肺泡灌洗液中的嗜中性粒細胞百分比(+/-SEM)
假暴露的小鼠(Sham-Exposed mice)
安慰劑(PBS)處理(Placebo(PBS)treated)
約500微克/毫升的布地奈德(Budesonde about 500μg/ml)
約100微克/毫升的布地奈德+約20毫莫耳/升的CD(Budesonde about 100μg/ml+CD about 20mM)
約250微克/毫升的布地奈德+約20毫莫耳/升的CD(Budesonde about 250μg/ml+CD about 20mM)
毫莫耳/升(mM)
嗜中性粒細胞(%)(Neutrophils(%))
約(about)
相比于假暴露的小鼠,暴露于香煙煙霧的小鼠顯示在他們的支氣管肺泡灌洗液(BALF)中的嗜中性粒細胞數目有顯著的增加。相比于暴露于香煙煙霧的小鼠,暴露于所有測試濃度的布地奈德-HP-β-CD(約20毫莫耳/升)的復合物的小鼠所誘導的嗜中性粒細胞的數目有顯著的減少。相比于單獨使用較高濃度(約500微克/毫升)的布地奈德,所有的布地奈德-HP-β-CD(約20毫莫耳/升)的復合物所誘導出的減少更多。只有布地奈德明顯無效降低治療的小鼠的肺泡灌洗液中的炎癥的水平。
例5
復合的布地奈德衍生物-環糊精
因為HP-β-CD碳水化合物不含發色團,故UV檢測是不可行的。到現在為止,沒有技術被描述用于水溶液藥物中的HP-β-CD的定量。因為NMR譜儀被廣泛用來了解CD和藥物之間的相互作用,并評估取代的吡喃葡萄糖單元的數目(摩爾取代度),1H核磁共振光譜法被應用于水溶液中的HP-β-CD的檢測和定量。
材料
HP-β-CD(摩爾取代度=0.64)是由Roquette(法國)善意捐贈。
三甲基硅烷基-3-丙酸-d4(TMSP)和氧化氘(約99.96%D)購自Eurisotop(Gif-sur-Yvette,法國)。
馬來酸得自Sigma-Aldrich。
樣品的制備
在驗證過程中,HP-β-CD的標準溶液被稀釋在水中,以獲得介于約0.05毫克/毫升至約5毫克/毫升的范圍內的6種濃度的校準標準液。在約500微升的這些溶液中,加入約100微升的D2O緩沖劑,約100微升的馬來酸(約5毫莫耳/升),及約10微升的TMSP,用于NMR的分析。
較佳的布地奈德-HP-β-CD的藥物組合物系根據例1a來制備,但其等滲緩沖液以D2O取代。
NMR的測量
利用運作于約298°K下約500.13兆赫的Bruker Avance光譜儀,D2O中的布地奈德-HP-β-CD被記錄用來作質子信號的采集。該儀器配備具有Z梯度的5毫米的TCI冷凍探針。1D NOESY-presat序列(64次掃描)被用來盡量減少水的信號。馬來酸被用作量化的內部標準和零點校準的TMSP。
為了特別檢測HP-β-CD,其重點在于羥丙基基團。因此,來自甲基的雙峰的峰面積于約1.1ppm被測量,其是羥丙基基團(圖10b)的一部分。當HP-β-CD與布地奈德共存時,此特定峰值也可以被定量。在約1.1ppm的高峰仍然可以被量化,并保持沒有布地奈德時的相同的面積(圖10a)。其他峰也可被用于HP-β-CD的量化,包括在約5.2ppm的峰。
方法的驗證
方法的驗證以三個系列的實驗進行。以下的標準被測試:選擇性、特異性(相比于β-環糊精)、響應函數(校正曲線)、線性、精確度(重復性和中間精密度)、正確度、檢出限(LOD)、定量限(LOQ)、基質效應及精度。總誤差被用作驗證過程的決定標準。可接受的限度被設定為約+/-7.5%,而獲得在這些限制范圍內的未來的結果的最低的概率被設定于β=約95%(β-期望限制)。因此,該技術在上述范圍內是有效的。
圖11顯示HP-β-CD-布地奈德的復合物的1D-COSY譜。
依據K.A.Connors:Chem.Rev.97:1325-1357(1997),其全部被并入本文作為參考,眾所周知,HP-β-CD的H-3和H-5質子位于環糊精空腔內部,與這些質子相關的論文均建議布地奈德或布地奈德的一部分被包含在HP-β-CD的內部。
事實上,兩個相關點(約7.4-7.5ppm及約5.8-6.1ppm)表示布地奈德芳環之間的相互作用,其H-5HP-β-CD質子建議導致水溶性復合物的包容。
例6
使用作為質量控制的工具的1H NMR光譜儀來檢測和量化溶液中的2-羥丙基-β-環糊精
環糊精(CDs)是由連接-1,4-吡喃葡萄糖單元所形成的環狀寡聚糖,其形成包括疏水空腔的截頭的圓錐狀的結構。最常用的天然環糊精由6個、7個或8個吡喃葡萄糖單元所構成,通常分別被命名為α-、β-和γ-環糊精。為了降低毒性,并提高水溶解度,一些衍生物被開發。其中,2-羥基丙基-β-環糊精(HP-β-CD)(圖12)被廣泛地應用于藥物制劑中,經由水溶性包合復合物的形成,以提高疏水性藥物的水溶解性,穩定性和生物利用度。
根據USP和EP準則,藥物賦形劑的特性和量化方法應加以界定。由于HP-β-CD的碳水化合物不含發色團,UV檢測是不可行的。因此,雖然用于CDs的量化的一些技術已被說明,但其中沒有一個被開發用于藥物水溶液中的HP-β-CD的量化。
因為NMR光譜儀被廣泛用來了解CD和藥物之間的相互作用,并評估取代的吡喃葡萄糖單元的數目(摩爾取代度),1H核磁共振光譜法被應用于在本研究中,以執行水溶液中HP-β-CD的檢測和定量。
實驗方法
材料
HP-β-CD(摩爾取代度=0.64)由Roquette(法國)善意捐贈。
三甲基硅烷基-3-丙酸-d4(TMSP)和氧化氘(約99.96%D)購自Eurisotop(Gif-sur-Yvette,法國)。
統計分析以e-新軟件(Arlenda,Liege,比利時)進行。
樣品的制備
為驗證過程,HP-β-CD的標準溶液被稀釋在水中,以獲得介于約0.05毫克/毫升至約5毫克/毫升的范圍內的6種濃度的校準標準。在約500微升的這些溶液中,加入約100微升的D2O緩沖劑、約100微升的馬來酸(約5毫莫耳/升)及約10微升的TMSP、用于NMR的分析。
NMR的測量
利用運作于約298°K下約500.13兆赫的Bruker Avance光譜儀,所有樣品被記錄用來作為質子信號的采集。該儀器配備具有Z梯度的5毫米的TCI冷凍探針。1D NOESY-presat序列(64次掃描)被用來盡量減少水的信號。馬來酸被用來作為量化的內部標準和零點校準的TMSP。
結果與討論
水中HP-β-CD的檢測和定量(1H-NMR)
特別為了檢測HP-β-CD,其關鍵點在于羥丙基基團。因此,來自甲基的雙峰的峰面積于約1.1ppm被測量,其是羥丙基基團(圖13)的一部分。當HP-β-CD不是單獨在水中時,此特定峰值也可以被定量。實際上,包含HP-β-CD和皮質類固醇的溶液可以被實現,其被包含于環糊精,并于約1.1ppm的峰仍然可被量化且一直保持與沒有皮質類固醇時相同的面積。
方法的驗證
方法的驗證以三個系列的實驗進行。以下的標準被測試:選擇性、特異性(相對于β-環糊精)、響應函數(校正曲線)、線性、精確度(重復性和中間精密度)、正確度、檢出限(LOD)、定量限(LOQ)、基質效應及精度(圖3)。總誤差被用作驗證過程的決定標準。可接受的限度被設定為約+/-7.5%,而獲得在這些限制范圍內的未來的結果的最低的概率被設定于β=約95%(β-期望限制)。
如圖14之所示,由綠色點表示的逆算濃度的相對誤差散布于相對偏差(紅線)的周圍,且被包含在由虛線表示的β-期望公差極限之間。因此,該技術在上述范圍內是有效的。
在本研究中,首次發展出新穎且有用的分析技術,用來檢測和量化溶液中的HP-β-CD。此技術可用于如腸胃溶液的藥物溶液的劑量。此方法顯示至少有兩個主要的優點:快速和便利。事實上,NMR測定只需約8分鐘,而樣品的制備只需要簡單添加可抑制水的信號和量化羥丙基的峰面積的分子即可。因此,測量可以直接地被實現于藥物溶液(含活性成分),而不需任何的分離或萃取的步驟。
例7
布地奈德對LPS/COPD動物模型的影響
材料與方法
小鼠
6至8周齡的雄性的C57BL/6的小鼠購自Charles River(Koln,德國),并飼養在我們的設施。所有的動物實驗和程序都經列日大學的倫理委員會的批準。食物和水隨意供給。
材料
磷酸鹽緩沖鹽水(PBS),如下面數據源之報告:http://bio.lonza.com/uploads/tx_mwaxmarketingmaterial/Lonza_BenchGuides_Phosphate_Buffered_Saline_PBS.pdf,其購自Lonza(Verviers,比利時),羥基丙基-β-環糊精購自Roquette(法國),布地奈德購自Indis(比利時)而約250微克/毫升的商用的布地奈德的懸浮液購自AstraZeneca(瑞典)。羥丙基-β-環糊精(約20毫莫耳/升)與布地奈德(約250微克/毫升)及作為商業制劑的布地奈德的懸浮液(約250微克/毫升)相復合,以用作小鼠的給藥,。
暴露于脂多醣(LPS)的測定和環糊精-布地奈德的治療
小鼠(n=7/組)在每日滴注之前用約2.5%的異氟烷/氧混合物來麻醉。小鼠在第0,1,2,3天被滴注約50微升的磷酸鹽緩沖鹽水(PBS)(安慰劑組)或約50微升的羥丙基-β-環糊精-布地奈德的復合物,或約50微升的約250微克/毫升的商業布地奈德的懸浮液小鼠在第4天被處死,在治療給藥后6小時,小鼠氣管內被滴注LPS(約1微克/100微升的PBS,來自E.Coli,InvivoGen,San Diego,CA,美國的超純的脂多醣),于第1和3天為2次。
肺的細胞學和組織學
在實驗方案結束時,動物被處死,且執行支氣管肺泡灌洗液(BALF)的步驟,其系經由4X1毫升的約0.05毫莫耳/升的PBS-EDTA溶液(Calbiochem,Darmstadt,德國)的氣管內滴注。BALF的上清液被收集,用于蛋白質的評估,而細胞被用于不同細胞的計數。經蘇木精-伊紅(Diff-Quick,Dade,比利時)染色后,細胞計數基于形態學標準執行于細胞離心的樣品。
執行支氣管肺泡灌洗液的步驟后,左主支氣管被夾住且左肺被切除,并保持于約80℃下。右肺在約25厘米的壓力下輸注約4%的多聚甲醛,并被包埋在石蠟中。6個約5微米的切片被隨機采集,并用蘇木精和伊紅(HE)染色。每個后續的切片與前一個相隔開約50微米。載玻片用Hamamatsu nanozoomer(奈米伸縮鏡頭)HT 2.0掃描,并利用前面所述的炎癥評分系統在數字化載玻片上將炎癥量化。請參見,例如Cataldo等人:Am J Pathol(2002),其全部被并入本文作為參考。
結果
支氣管-肺泡灌洗的細胞學檢查
相比于安慰劑處理的動物,經布地奈德的懸浮液和羥丙基-β-環糊精-布地奈德的復合物處理的實驗動物,在其BALF中所測得的中性粒細胞的數目有顯著降低。請參見圖15。
肺薄壁的炎癥的測量
令人驚奇地,比起用安慰劑和布地奈德的懸浮液處理的動物,經暴露于LPS且經羥丙基-β-環糊精-布地奈德的復合物處理過的動物,顯示出LPS誘導的發炎有顯著降低。請參見圖16。
例8
二丙酸倍他米松(微粉化的起始材料)
溶液被制備于PBS緩沖液的約20毫莫耳/升的Crysmeb溶液中。約5.08克的Crysmeb被溶解在磷酸鹽緩沖鹽水(PBS)的緩沖液中。PBS購自Lonza(Verviers,,比利時),如下面資料源之報告:http://bio.lonza.com/uploads/tx_mwaxmarketingmaterial/Lonza_BenchGuides_Phosphate_Buffered_Saline_PBS.pdf,其全部被并入本文作為參考。
將約25至約30毫克的二丙酸倍他米松(過量)添加入飽和的溶液中,并在約25℃下輕輕混合約48小時。
飽和溶液通過0.22微米的過濾,并利用驗證過的高效液相色譜法(HPLC)測定在濾液中的二丙酸倍他米松的含量。
制備的二丙酸倍他米松的溶液的濃度為約147克/毫升。
例8a:100微克/毫升的二丙酸倍他米松溶液
用約20毫莫耳/升的Crysmeb PBS溶液將約34毫升的147微克/毫升的溶液,如上述制備,稀釋至約50毫升(高效液相色譜(HPLC)檢測=約99.00微克/毫升)。
在層流條件下使溶液通過0.22微米加以過濾,以使稀釋溶液滅菌。無菌的二丙酸倍他米松的溶液的濃度為約100微克/毫升。
例8b:50微克/毫升的二丙酸倍他米松溶液
用約20毫莫耳/升的Crysmeb PBS溶液將約17毫升的147微克/毫升的溶液,如上述制備,稀釋至約50毫升(高效液相色譜(HPLC)檢測=約49.64微克/毫升)。
在層流條件下使溶液通過0.22微米加以過濾,以使稀釋溶液滅菌。無菌的二丙酸倍他米松的溶液的濃度為約50微克/毫升。
例8C:參考懸浮液
因為沒有商業用二丙酸倍他米松的溶液;因此,參考二丙酸倍他米松的溶液需根據以下配方來制備:
二丙酸倍他米松 10.0毫克
Tween 80(聚山梨醇酯80) 00.1毫克
PBS緩沖液q.s.ad 100.0毫升
在層流條件下制備懸浮液
注:在反應釜中,二丙酸倍他米松會劣化;因此,其應在使用前才制備。
例9
丙酸氟替卡松(微粉化的起始材料)
根據以下的制備方法,HPβCD和Crysmeb二者都能夠溶解丙酸氟替卡松(FP)。
例9a:共蒸發的中間產物
將約1.5克的HPβCD溶解于100毫克的純乙醇中。隨后將約25毫克的丙酸氟替卡松溶解于50毫克的純乙醇中。一旦溶解了,將溶液合并,并在真空下蒸發至干。
例9b:250微克/毫升的丙酸氟替卡松的溶液
將共蒸發物,如上面例8a的制備,分散于約100毫升的PBS緩沖液中,以制得懸浮液。懸浮液經高壓釜滅菌,以產生具有約250微克/毫升的FP和約10毫莫耳/升的HPβCD的濃度的FP溶液(以HPLC測定FP,其約238微克/毫升)。
例9c:100微克/毫升的丙酸氟替卡松的溶液
用約10毫莫耳/升的HPβCD溶液來稀釋250微克/毫升的溶液,如上面例8b之制備,(約8.4毫升的238微克/毫升+約11.6毫升的PBS中的HPβCD)。懸浮液經由高壓釜滅菌,以產生具有約100微克/毫升的FP和約10毫莫耳/升的HPβCD的濃度的FP溶液。
例9d:50微克/毫升的丙酸氟替卡松的溶液
用約10毫莫耳/升的HPβCD溶液稀釋250微克/毫升的溶液,如上面例8b之制備,(約4.2毫升的約238微克/毫升+約15.6毫升的PBS中的HPβCD)。懸浮液經由高壓釜滅菌,以產生具有約50微克/毫升的FP和約10毫莫耳/升的HPβCD的濃度的FP溶液。
例9的參考產品是輔舒酮的懸浮液。
例10
二丙酸倍他米松對LPS/COPD動物模型的影響
材料與方法
小鼠
6至8周齡的雄性的C57BL/6小鼠購自Charles River(Koln,德國),并飼養在我們的設施。所有的動物實驗和程序都經列日大學倫理委員會的批準。食物和水隨意供給。
材料
磷酸鹽緩沖鹽水(PBS),如下面數據源之報告:http://bio.lonza.com/uploads/tx_mwaxmarketingmaterial/Lonza_BenchGuides_Phosphate_Buffered_Saline_PBS.pdf,其購自Lonza(Verviers,比利時),crysmeb購自Roquette(法國),二丙酸倍他米松購自ACIC(加拿大)而tween80經由Sigma Aldrich購自ICI。對于小鼠的給藥,例8所生產的產品被測試。
暴露于脂多醣(LPS)的測定和環糊精-二丙酸倍他米松之治療
小鼠(n=10/組)在每日滴注之前用約2.5%的異氟烷/氧混合物來麻醉。在第0,1,2,3天,小鼠被輸注約50微升的磷酸鹽緩沖鹽水(PBS)(安慰劑組),或約50微升的Crysmeb-二丙酸倍他米松的復合物,或約50微升的倍他米松的懸浮液,如根據例8所制備的。在第4天,小鼠被處死。在治療給藥后6小時,小鼠氣管內被滴注LPS(約1微克/100微升的PBS,來自E.Coli,InvivoGen,San Diego,CA,美國的超純的脂多醣),在第1和3天為2次。
肺細胞學和組織學
在實驗方案結束時,動物被處死且進行支氣管肺泡灌洗液(BALF)的步驟,其系經由4X1毫升的PBS-EDTA 0.05毫莫耳/升的溶液(Calbiochem,Darmstadt,德國)的氣管內滴注。收集BALF的上清液用于蛋白質的評估,而細胞用于不同細胞的計數。經蘇木精-伊紅(Diff-Quick,Dade,比利時)染色后,細胞離心制備的樣品依據形態學標準進行不同細胞的計數。
在支氣管肺泡灌洗液的步驟進行之后,左主支氣管被夾住且左肺被切除,并保存在-80℃下。右肺在約25厘米的壓力下被輸注約4%的多聚甲醛,并包埋在石蠟中。6片約5微米的切片被隨機采集,并用蘇木精和伊紅(H.E)染色。每個后續的切片與前一個相隔開約50微米。載玻片用Hamamatsu nanozoomer(奈米伸縮鏡頭)HT 2.0掃描,且利用前面所述的炎癥評分系統對數字化載玻片進行炎癥的定量。請參見,例如,Cataldo等人:Am J Pathol(2002),其全部被并入本文作為參考。
結果
支氣管肺泡沖洗液的細胞學檢查
相比于安慰劑處理的動物,經二丙酸倍他米松懸浮液和Crysmeb-二丙酸倍他米松的復合物治療后的實驗動物,其在BALF中的嗜中性粒細胞的數目被降低并不顯著。請參見圖18和圖19。
肺薄壁炎癥的測量
令人[驚奇地,比起用安慰劑和布地奈德(約100微克/毫米)的懸浮液處理的動物,經暴露于LPS且經約100微克/毫升的Crysmeb-二丙酸倍他米松的復合物處理過的動物,顯示出LPS誘導的發炎有顯著降低。請參見圖17。
并且,比起用安慰劑處理過的動物,暴露于LPS且經約50與約100微克/毫升的Crysmeb-二丙酸倍他米松的復合物及約50微克/毫升的倍他米松的懸浮液處理過的動物,顯示出LPS誘導的發炎有顯著降低。比起安慰劑組,約100微克/毫升的氟替卡松參考組也顯示有降低的效果但不顯著。
此外,比起約100微克/毫升的氟替卡松參考組,約100微克/毫升的Crysmeb-二丙酸倍他米松的復合物也顯著降低炎癥。請參見圖20。
例11
丙酸氟替卡松對LPS/COPD動物模型的影響
材料與方法
小鼠
6至8周齡的雄性的C57BL/6小鼠,購自Charles River(Koln,德國),并飼養在我們的設施。所有的動物實驗和程序都經列日大學的倫理委員會的批準。食物和水隨意供給。
材料
磷酸鹽緩沖鹽水(PBS),如下面來源之報告:http://bio.1onza.com/uploads/tx_mwaxmarketingmaterial/Lonza_BenchGuides_Phosphate_Buffered_Saline_PBS.pdf,其購自Lonza(Verviers,比利時),羥基丙基-β-環糊精購自Roquette(法國),丙酸氟替卡松購自ACIC(加拿大)而約250微克/毫升的商業的丙酸氟替卡松懸浮液購自Glaxo SmithKline(英國)。羥丙基-β-環糊精(約10毫莫耳/升)與根據例9的丙酸氟替卡松(約250微克/毫升)及作為商業制劑的丙酸氟替卡松懸浮液(約250微克/毫升)相復合,以作為小鼠的用藥,。
暴露于脂多醣(LPS)的測定和環糊精-丙酸氟替卡松的治療
小鼠(n=10/組)在每日滴注之前用約2.5%的異氟烷/氧混合物來麻醉。在第0、1、2、3天,小鼠被灌輸約50微升的磷酸鹽緩沖鹽水(PBS)(安慰劑組),或約50微升的羥丙基-β-環糊精-丙酸氟替卡松的復合物,或約50微升的市售的約250微克/毫升的丙酸氟替卡松的懸浮液在第4天,小鼠被處死。在治療給藥后6小時,小鼠氣管內被滴注LPS(約1微克/100微升的PBS,來自E.Coli,InvivoGen,San Diego,CA,美國的超純的脂多醣),于第1和3天2次。
肺細胞學和組織學
在實驗方案結束時,動物被處死且進行支氣管肺泡灌洗液(BALF)的步驟,其系經由4X1毫升的0.05毫莫耳/升的PBS-EDTA溶液(Calbiochem,Darmstadt,德國)的氣管內滴注。收集BALF的上清液用于蛋白質的評估,而細胞用于不同細胞的計數。經蘇木精-伊紅(Diff-Quick,Dade,比利時)染色后,細胞離心制備的樣品依據形態學標準進行不同細胞的計數。
在支氣管肺泡灌洗液的步驟進行之后,左主支氣管被夾住,左肺被切除,并保存在-80℃下。右肺在約25厘米的壓力下被輸注約4%的多聚甲醛,并包埋在石蠟中。6片約5微米的切片被隨機采集,并用蘇木精和伊紅(H.E)染色。每個后續的切片與前一個相隔開約50微米。載玻片用Hamamatsu nanozoomer(奈米伸縮鏡頭)HT 2.0掃描,且利用前面所述的炎癥評分系統對數字化載玻片進行炎癥的定量。請參見,例如,Cataldo等人:Am J Pathol(2002),其全部被并入本文作為參考。
結果
支氣管-肺泡沖洗液細胞學檢查
相比于安慰劑治療的動物,用約250微克/毫升的羥丙基-β-環糊精-丙酸氟替卡松的復合物治療的動物,其BALF中測得的嗜中性粒細胞的數量有令人驚訝的降低。相比于安慰劑,約250微克/毫升的丙酸氟替卡松懸浮液,其嗜中性粒細胞的數量有降低,但并不顯著。請參見圖21。
刊物
Frederick G.Vogt及Mark Strohmeier:“藥物-環糊精復合物的夾雜物的二維固態核磁共振的分析”,Molecular Pharmaceutics.9:3357-3374(2012).
Agüeros,M.,Campanero,M.A.,Irache,J.M.:“以高效液相色譜-蒸發光散射檢測對不同的環糊精和Gantrez的同時定量”,J.Pharm.Biomed.Anal.39:495-502(2005).
Thorsteinn Loftsson and Marcus E.Brewster:“環糊精的制藥應用:基礎科學和產品開發”,J.Pharm.Pharmacol.62:1607-1621(2010).
Szeman,J.,Gerloczy,A.,Csabai,K.,Szejtli,J.,Kis,G.L.,Su,P.,Chau,R.Y.,Jacober,A.:“基于環糊精增強熒光對不同生物體液中的2-羥丙基-γ-環糊精的高效液相色譜法的測定”.J.Chromatogr.B.774:157-164(2002).
此處所引用的所有刊物的完整的公開內容全部被并入本文作為參考,如同各單獨地整個被闡述并被并入在本說明書。
對于本領域的技術人員而言,本發明的各種修改和變更將變得明顯而不脫離本發明的范圍和精神。說明性的實施例和例子僅是被提供用作示例性,并非用來限制本發明的范圍。本發明的范圍僅由闡述如下的權利要求所限定。
- 還沒有人留言評論。精彩留言會獲得點贊!